Ingrid Chitiva M.D. 1 , Carlos Quintero M.D. 1 , Sebastian Amaya M.D. 2 *, Tatiana Bernal Salazar 2 , Evelyn Aguilar Mendieta 2 , Gabrielle Amaya 3
Recibido: 07-09-2021
Aceptado: 12-12-2021
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 3 pp. 339-349|https://doi.org/10.25237/revchilanestv5122031412
PDF|ePub|RIS
Abstract
The preoperative management of patients with hypothyroidism has an impact on the clinical outcomes in the postoperative period, however, it has been found that there is a lack of evidence regarding management recommendations in this scenario. Therefore, we conducted a review of the literature for articles in English and Spanish from the years 2000 to 2020 in the databases PubMed, ProQuest, Scopus and Embase, that highlight the physiology, pathophysiology and current recommendations for preoperative management in this patient population. It is of great importance to understand the physiological changes and implications in the anesthetic management of these patients, in order to assure an adequate approach both preoperatively and in possible serious postoperative complications, as well the common perioperative complications, which tend to be cardiovascular, pulmonary and of the upper airway, especially in patients with a higher degree of thyroid dysfunction (moderate, severe). Additionally, based on this non-systematic review of the literature, we propose a management algorithm for this patient population.
Resumen
El manejo preoperatorio de los pacientes con hipotiroidismo marca la diferencia en los desenlaces clínicos del posoperatorio, sin embargo, se ha encontrado que hay falta de evidencia en cuanto a recomendaciones en el manejo en este escenario, por lo que realizamos una búsqueda de la literatura en inglés y español de los años 2000 al 2020 en las bases de datos PubMed, ProQuest, Scopus y Embase sobre fisiología, fisiopatología y recomendaciones actuales del manejo preoperatorio en estos pacientes. Es de gran importancia conocer los cambios fisiológicos e implicaciones en el manejo anestésico de estos pacientes, para un adecuado abordaje tanto en el preoperatorio como en posibles complicaciones graves en el posoperatorio, así como las complicaciones más frecuentes, los cuales son cardiovasculares, pulmonares y de la vía aérea superior, esto en pacientes con mayor grado de disfunción tiroidea (moderado, severo). Adicionalmente, basado en esta revisión no sistemática de la literatura, proponemos un algoritmo de manejo en esta población de pacientes.
-
Introducción
El hipotiroidismo es un desorden endocrino secundario a la deficiencia de hormona tiroidea capaz de producir diversos efectos sistémicos como la depresión miocárdica, disminución de la respuesta ventilatoria, función anormal de los baro- rreceptores, disminución del volumen plasmático y disminución de la capacidad para metabolizar agentes anestésicos[1],[2],[3]. Por lo cual, los efectos de la disfunción tiroidea, especialmente en pacientes no diagnosticados o no tratados, pueden generar complicaciones a nivel cardiovascular, pulmonar, de la vía aérea superior, entre otros, durante la intervención quirúrgica de pacientes hipotiroideos. Entre las complicaciones se ha evidenciado la precipitación de insuficiencia cardiaca, falla respiratoria y el coma mixedematoso[4]. En este artículo se abordarán las cuestiones relativas al manejo perioperatorio en pacientes con hipotiroidismo que se someten a cirugía no tiroidea, con el fin de optimizar el abordaje preoperatorio y disminuir las complicaciones graves en el postoperatorio.
-
Epidemiología
El hipotiroidismo ocurre con mayor frecuencia en personas mayores de 65 años, de raza blanca y es 10 veces más común en mujeres que en hombres[5],[6]. Asimismo, su incidencia es mayor en pacientes con enfermedades autoinmunes tales como diabetes tipo 1, atrofia gástrica autoinmune y enfermedad celíaca[7]. La prevalencia del hipotiroidismo varía demográficamente, por ejemplo, en Estados Unidos fue del 3,7%[5], mientras que en otros países como India y Brasil, se ubicó en 10,95% y 12,3% respectivamente[8],[9]. Además, en Brasil se determinó la prevalencia dependiendo de la raza y se evidenció que en individuos blancos (16,7%) era mayor que en personas de ascendencia negra (6,9%) o mixta (8,8%)[9]. En la siguiente tabla se resume la prevalencia del hipotiroidismo en distintos países (Tabla 1).
-
Fisiología
Para comprender adecuadamente las implicaciones del hi- potiroidismo en la anestesia, es importante revisar la fisiología tiroidea humana normal y sus efectos en los principales sistemas orgánicos que entran en juego durante la realización de procedimientos quirúrgicos en pacientes hipotiroideos, como los sistemas cardiovascular y respiratorio. La producción de hormona tiroidea es el resultado de un cuidadoso equilibrio del sistema de retroalimentación entre el hipotálamo, la hipófisis anterior y la glándula tiroides[6]. La hormona liberadora de ti- rotropina es secretada por el hipotálamo y estimula la secreción de hormona estimulante de la tiroides (TSH) en la glándula pituitaria anterior, la cual luego activa la cascada de señalización de adenosina monofosfato cíclico (cAMP), fosfolipasa C y proteína quinasa A, las cuales juegan diferentes roles en la regulación de la función de la hormona tiroidea[6],[15].
La formación de cAMP y la activación de la proteína quinasa A ayudan a regular la captación de yoduro y la actividad del simportador de yoduro de sodio, mientras que la señalización de la fosfolipasa C regula la salida de yoduro y la producción de peróxido de hidrógeno, entre otras funciones. El transportador de yoduro de sodio transporta dos iones de sodio al interior de la célula folicular de la tiroides, junto con una molécula de yoduro, mientras que una ATPasa de sodio y potasio bombea activamente iones de sodio fuera del citoplasma del folículo tiroideo para crear un gradiente de concentración de sodio. El yoduro dentro de la célula folicular se oxida por la peroxidasa tiroidea y se usa en la yodación de la tiroglobulina, que posteriormente se degrada para liberar tetrayodotironina (T4) y triyo- dotironina (T3)[15],[16].
Estas hormonas tienen un metabolismo periférico que implica la eliminación de una molécula de yodo y la conversión de T4 en T3 a través de la yodotironina desyodasa tipo I en el hígado, riñón y tiroides, tipo II en el cerebro, hipófisis y tiroides, y tipo III en la placenta y tejidos fetales. La triyodotironina (T3) es la forma más activa de hormona tiroidea, sin embargo, tiene una vida media más corta (1 día frente a 7 días para T4), considerando que T4 se une con más afinidad a las proteínas plasmáticas. Los receptores sobre los que actúan estas hormonas se encuentran en casi todos los tejidos del cuerpo, y la unión de T3 a los receptores de hormonas tiroideas puede provocar una disminución o un aumento de las tasas de transcripción del gen diana. Estas hormonas ingresan a la célula y se unen a sus receptores nucleares, que unen elementos potenciadores en el ADN para regular la transcripción de genes, lo que finalmente conduce a una mayor síntesis de proteínas enzimáticas, estructurales y transportadoras[15],[16].
El resultado neto de las hormonas tiroideas es un aumento de la actividad funcional, que se observa en los diversos sistemas de órganos con un aumento evidente de la actividad me- tabólica entre 60% y 100% por encima de los valores normales cuando hay grandes cantidades de hormona tiroidea presente[17]. La hormona tiroidea influye en varios aspectos del metabolismo de los hidratos de carbono, con una rápida captación de glucosa por parte de las células, un aumento de la glucólisis y la gluconeogénesis y una mayor secreción de insulina. A la inversa, un aumento de esta hormona disminuye la concentración de colesterol, fosfolípidos y triglicéridos, mientras que una disminución de la hormona aumenta la concentración de éstos, lo que lleva a una asociación positiva entre el hipotiroidis- mo prolongado y la aterosclerosis grave[17]. Desde el punto de vista cardiovascular, hay muchos cambios asociados a la acción
Tabla 1. Prevalencia de hipotiroidismo
| Autores de estudio | País | Fecha del estudio | Tamaño de población | Porcentaje de hipotiridismo (%) |
| J. Wang et al.[10] | China | NA | 4.256 | 79 (1,8%) |
| K. Kasagi et al.[11] | Japón | 2005 – 2006 | 1.818 | 12 (0,7%) |
| A. Saritas et al.[12] | Turquía | 2011 – 2013 | 10.600 | 198 (1,86%) |
| Y. Aoki et al.[5] | USA | 1999 – 2002 | 4.392 | 162 (3,7%) |
| E.H Hoogendoorn et al.[13] | Países Bajos | 2002 – 2003 | 6.434 | 24 (0,4%) |
| U. Menon et al.[14] | India | 2009 | 986 | 38 (3,9%) |
| A. Unnikrishnan et al.[8] | India | 2013 | 5.360 | 587 (10,95%) |
| R. Sichieri et al.[9] | Brasil | 2004 – 2005 | 1.220 | 150 (12,3%) |
Tabla que demuestra la prevalencia de hipotiroidismo encontrado en varios estudios de diferentes países J. Wang, que fue en el 2013.
de las hormonas tiroideas. En primer lugar, el aumento del metabolismo estimulado por la hormona tiroidea conduce a una utilización más rápida del oxígeno y, en última instancia, a un aumento de los productos finales metabólicos, que provocan una vasodilatación en la mayoría de los tejidos corporales. Esta vasodilatación, junto con un aumento del flujo sanguíneo para la eliminación del calor, conduce a una disminución de la resistencia vascular periférica[17].
En segundo lugar, la hormona tiroidea puede aumentar la inotropía debido al estado hipermetabólico, similar a la respuesta observada en los síndromes febriles. Asimismo, el gasto cardíaco, el volumen sistólico y la frecuencia cardíaca en reposo también pueden verse incrementados debido a los efectos cro- notrópicos e inotrópicos positivos. Esto puede explicarse por el hecho de que esta hormona aumenta el calcio intracelular mio- cárdico y, por tanto, aumenta la fuerza y la velocidad de con- tracción[1],[13]. Por último, esta hormona aumenta los efectos de las catecolaminas a través de un aumento del número y la sensibilidad de los receptores beta adrenérgicos. En conjunto, estos cambios fisiológicos conducen a un aumento del gasto cardíaco que puede alcanzar hasta 60% por encima de lo normal, lo que juega un papel clave en la sala de operaciones cuando se trata de pacientes hipotiroideos, sin embargo, esto se discutirá más adelante[6].
Se ha demostrado que la T3 estimula directamente la síntesis de renina en el hígado, así como que aumenta la expresión de renina dentro del corazón, lo que conduce a un aumento de la producción local de Angiotensina II, la cual que induce a hipertrofia, inflamación y fibrosis[19]. La mecánica de la ventilación también se ve modificada por la hormona tiroidea debido al aumento de la utilización de oxígeno y la formación de dióxido de carbono que se observa en el estado metabólico acelerado causado por la hormona tiroidea, lo que provoca un ajuste de la frecuencia respiratoria y la ventilación minuto para satisfacer el aumento de la demanda de oxígeno en los distintos órganos y tejidos. Además, debido a la elevación de la hormona tiroidea, aumentó del impulso ventilatorio central, lo que provoca una hiperventilación y un aumento de la respuesta ventilatoria a la hipoxia y la hipercapnia[17],[18],[20].
La T3 también promueve la entrega de oxígeno a los tejidos mediante la simulación de la eritropoyetina y la producción de hemoglobina, mientras que también promueve la absorción de folato y cobalamina a través del tracto digestivo[18]. Además, se ha evidenciado un aumento del tiempo de hemorragia, del tiempo de protrombina (TP) y del tiempo de tromboplastina parcial activada (TTPA), con una disminución de la actividad del FVIII, así como de la actividad del factor de von Willebrand (FV) en estados de disminución de la hormona tiroidea[21]. Dentro del sistema nervioso, la hormona tiroidea aumenta la rapidez de la cerebración, aunque los procesos de pensamiento pueden estar disociados; mientras que la falta de hormona tiroidea disminuye la rapidez de la cerebración[18]. Como se puede observar, las hormonas tiroideas tienen una plétora de efectos en todo el cuerpo, sin embargo, revisar estos efectos en detalle preciso escapa al alcance y objetivo de nuestra revisión.
-
Fisiopatología
El hipotiroidismo es un desorden endocrino secundario a la deficiencia de hormona tiroidea[6 ]. Se caracteriza por un esta
do hipometabólico asociado a síntomas como intolerancia al frío, ganancia de peso, depresión, fatiga y estreñimiento[22]. La presentación clínica es variable e inespecífica, por tanto, el diagnóstico de la enfermedad se basa predominantemente en la confirmación bioquímica[7].
Las causas del hipotiroidismo se clasifican en primario, secundario y terciario. Los dos últimos también denominados hi- potiroidismo central, debido a que su fisiopatología, se asocia a defectos en el eje tiroideo hipotalámico-pituitario[23]. El primario, es producto del defecto en la síntesis y liberación de la hormona tiroidea, y se relaciona a niveles bajos de hormona tiroidea y niveles elevados de TSH. En el hipotiroidismo secundario existe una deficiencia en la secreción de TSH por la glándula pituitaria, originando niveles TSH y de hormona tiroidea bajos. Por último, el terciario se caracteriza por la carencia de hormona liberadora de hormona tiroidea (THRH), producida por el hipotálamo[24].
Además, existe también la presentación de hipotiroidismo subclínico, transitorio y periférico. El hipotiroidismo subclínico se define por concentraciones séricas de TSH aumentadas y, de tiroxina libre (T4) y triyodotironina (T3) normales[25]. Se clasifica dependiendo de los niveles de TSH en grado 1, valores entre 4 mUI/L a 10 mUI//L, y grado 2, valores por encima de 10 mUI/L[26]. Sin embargo, aproximadamente el 90% de estos pacientes tienen valores de TSH menores a 10 mUI/L. Estudios han demostrado elevación leve de TSH en pacientes ancianos sin comorbilidades, con ausencia de enfermedad tiroidea sin evidencia de incremento en el riesgo de morbilidad y mortalidad, se considera una elevación normal con la edad[26],[27].
Por último, para la confirmación del diagnóstico se requieren análisis repetidos de sangre, debido a las variaciones biológicas de los niveles de TSH, específicamente, su elevación con la edad y en respuesta al estrés o a una enfermedad transitoria[26],[28]. El hipotirodismo transitorio se caracteriza por concentraciones bajas de tiroxina (T4) y concentraciones elevadas de tirotropina (TSH) durante semanas o meses hasta regresar a valores eutiroideos. Es causada por tiroiditis subaguda, silente o posparto y, en algunos casos, por deficiencia de hormona tiroidea al nacer (hipotirodismo congénito)[29],[30]. Finalmente, el hipotirodismo periférico hace referencia a las causas extratiroideas que conducen al descenso de las hormonas tiroideas, como la presencia de tumores y síndromes genéticos. En cuanto a los tumores, el tejido tumoral puede aumentar la expresión de la enzima desyodasa 3 y por ende, intensificar la inactivación de las hormonas tiroideas. Por otro lado, los síndromes genéticos raros inducen la aparición de sensibilidad reducida a la hormona tiroidea en tejidos específicos, conduciendo a hipotiroidismo independiente de concentraciones normales de TSH[22].
El hipotiroidismo primario es la causa más frecuente, representando el 95% de los casos[6]. Entre las causas de hipotiroi- dismo primario se encuentran la deficiencia de yodo, la tiroiditis de Hashimoto, causas iatrogénicas (cirugía, radioterapia, amio- darona, litio y rifampicina), infiltrativas (amiloidosis, sarcoidosis) y congénitas, como defectos anatómicos en la glándula, deficiencia de yodo o un error del metabolismo de la tiroide[6]. Específicamente, la tiroiditis de Hashimoto es la principal causa de hipotiroidismo en las áreas del mundo con suplencia de yodo adecuado[31], con una incidencia de aproximadamente 350 casos por cada 100.000 habitantes al año para mujeres y 60 casos por cada 100.000 habitantes al año para hombre[32].
La tiroiditis de Hashimoto es el trastorno tiroideo autoinmu- nitario más frecuente[31] y se asocia principalmente a mujeres de mediana edad[33]. En general, se caracteriza por la producción de anticuerpos, como el anticuerpo anti-tiroglobulina (an- ti-Tg) y anticuerpo anti-peroxidasa tiroidea (anti-TPO), capaces de dañar la glándula tiroides al causar inflamación y, la consecuente incapacidad de producir hormonas tiroideas[34].
En cuanto a las consecuencias del hipotiroidismo en los diferentes sistemas del organismo, se ha evidenciado a nivel cardiovascular disminución del inotropismo y cronotropismo por reducción de la expresión de receptores p-adrenérgicos y concentraciones citoplasmáticas de calcio, lo que conduce a un gasto cardiaco disminuido, y finalmente pueden terminar en la presentación de insuficiencia cardiaca[35],[36]. Además, se ha visto en el ciclo cardiaco cambios relacionados con la prolongación del período de llenado ventricular y la reducción del tiempo de eyección del ventrículo izquierdo con la gravedad del hipotiroidismo, de manera que se considera un cuadro clínico severo cuando hay una prolongación del 40% y una disminución del 60% respectivamente[37].
Adicionalmente, los pacientes hipotiroideos presentan un incremento de la resistencia vascular periférica lo cual se cree está asociado con una alteración del músculo liso vascular y disfunción de la célula endotelial secundaria a una disminución de la disponibilidad de óxido nítrico endotelial, lo cual también está relacionado con la disminución de la distensibilidad arterial, secundario a una disminución de la demanda de oxígeno periférico y la subsecuente disminución del volumen sanguíneo total efectivo[1],[38]. Situaciones que junto a la reducción del gasto cardíaco provocan un tiempo de circulación prolongado y una presión de pulso reducida[37],[38]. En definitiva, la deficiencia de hormonas tiroideas puede provocar inicialmente hipertensión por disminución del efecto vasodilatador de T3 y disminución del factor de relajación derivado del end telio[39],[40], pero de manera prolongada la función cardíaca reducida puede llevar a la hipotensión y presentación de un choque cardiogénico[24],[41].
Por otra parte, la disminución de la función tiroidea puede llevar a cambios electrocardiográficos como bradicardia, alargamiento del intervalo QT y complejos QRS de bajo voltaje que aumentan el riesgo de mortalidad debido a arritmias mortales, como la taquicardia tipo torsades de pointes[37],[43]. Tales cambios son consecuencia de la disminución de la expresión de triyodotironina en las células cardíacas, puesto que conduce a la disminución de la contractilidad cardíaca, de la frecuencia cardíaca y de la conducción de los estímulos eléctricos en el músculo cardíaco (Tabla 2)[42].
Desde el punto de vista respiratorio, se observa una disminución de la capacidad vital y la capacidad pulmonar total, así como de la respuesta ventilatoria a la hipercapnia y la hipoxe- mia en el centro respiratorio[1],[38]. Asimismo, la función respiratoria alterada también puede deberse a una disfunción dia- fragmática secundario a la disminución de la síntesis de miosina y a una relajación inadecuada por disminución de la ATPasa muscular que lleva finalmente a una hipoventilación alveolar e hipoxemia por la falta de hormonas tiroideas[44],[45]. La debilidad muscular junto con la predisposición a la obesidad en estos pacientes puede resultar en síndrome de apnea/hipopnea obstructiva del sueño (SAHOS), atelectasia, y reducción de los volúmenes pulmonares[1]. De igual forma, es posible el desa
rrollo de disnea espiratoria y trastornos del habla por cambios obstructivos en la vía aérea superior como edema e infiltración de mucopolisacárido[46]. Otras causas asociadas a la obstrucción directa de la vía aérea son la obesidad y la macroglosia[1]. Por último, se ha observado que el 25% de los pacientes tienen evidencia radiográfica de derrame pleural[47], el cual se relaciona principalmente con un hipotiroidismo crónico severo.
Por otra parte, dado que las hormonas tiroideas afectan diversos componentes del sistema hemostático, estudios han indicado que en pacientes hipotiroideos se presenta un estado hipocoagulable e hiperfibrinolítico y por ende, un mayor riesgo de hemorragia[48]. Las condiciones anteriores se deben a la disminución de la actividad del factor VIII y del factor von Wille- brand (VWF)[21],[48] y a una reducción en plasma del inhibidor de la fibrinólisis activable por trombina activada (TAFIa), que conduce a un menor tiempo de lisis del coágulo[49]. Además, se ha asociado los trastornos de la homeostasis con el aumento en la incidencia de síndrome de von Willebrand adquirido (aVWS), condición que conlleva a hemorragias leves como hemorragia nasal, gingival y menorragia, o severas en situaciones como traumatismos y cirugías[48],[50].
A nivel metabólico, se ha observado un empeoramiento, a la par, del perfil lipídico y función tiroidea[37]. Específicamente, el hipotiroidismo se asocia a hipercolesterolemia por alteraciones en las lipoproteínas sanguíneas, como la apolipoproteína B, y elevación de los niveles de colesterol LDL, favoreciendo la aparición de arteriosclerosis, infarto agudo al miocardio y accidentes cerebrovasculares[35],[37]. Asimismo, la deficiencia de hormonas tiroideas puede conducir a la supresión de la tasa metabólica basal y disminución de la termogénesis, lo cual se relaciona con síntomas y signos como la ganancia de peso y la sensibilidad al frío[24]. Finalmente, dado que las hormonas tiroideas regulan los niveles circulantes de insulina, la expresión de transportadores de glucosa sensibles a insulina, la producción hepática y, absorción de glucosa por el músculo y el tejido graso, en los estados hipotiroideos es factible la aparición de insulinorresistencia e insulinemia y disminución de glucosa en- dógeno[51],[52].
De igual manera, pueden existir complicaciones renales y electrolíticas secundarias a la falta de hormona tiroidea. Tales como disminución de la perfusión renal, aumento de la hormona antidiurética (ADH) que puede resultar en hiponatremia, disminución del factor natriurético auricular (ANF) y disminución de la actividad del sistema renina-angiotensina-aldosterona[1]. Cabe resaltar que las implicaciones cardiovasculares como la distensibilidad arterial, la presión arterial diastólica y la hiper- lipidemia se pueden observar tanto en el hipotiroidismo clínico como en el hipotiroidismo subclínico[25]. Específicamente, se ha relacionado el hipotiroidismo subclínico con una mayor prevalencia de enfermedad isquémica del corazón[53],[54] y en pacientes con valores mayores a 10 mIU/L se asocia a mayor riesgo de eventos de enfermedad coronaria y mortalidad[27].
Por último, debido a los cambios en los diferentes sistemas del organismo por la deficiencia de hormona tiroidea, como el aumento en la aparición de anomalías electrocardiográficas, anemia e hipotensión, los pacientes hipotiroideos presentan complicaciones perioperatorias que pueden precipitar la insuficiencia cardiaca[4]. Además, los cambios electrolíticos y debilidad de los músculos respiratorios, secundarios a la afectación del sistema renal y respiratorio, puede conllevar también
Tabla 2. Efectos hemodinámicos en el hipotiroidismo
| Parámetro | Efecto hemodinámico | Mecanismo |
| Resistencia Vascular Sistémica y Periférica | Aumentada | • Disfunción endotelial
• Disminución ON* |
| Distensibilidad arterial | Disminuida | • Disfunción endotelial
• Engrosamiento de la intima |
| Inotropismo y cronotropismo | Disminuido | • Disminución receptores p-adrenérgicos
• Disminución calcio intracelular |
| Gasto e índice cardiaco | Disminuido | • Aumento RVS**
• Aumento de poscarga • Disminución inotropia y cronotropia |
| Presión arterial diastólica | Aumentada | • Disminución síntesis sustratos de renina
• Aumento RVS • Alteración musculo liso vascular • Engrosamiento de la intima |
| Presión de pulso | Disminuido | • Hipertensión arterial diastólica |
| Respuesta a las catecolaminas | Disminuida | • Disminución número y sensibilidad de receptores p-adrenérgicos |
| Flujo coronario | Disminuido | • Aterosclerosis acelerada
• Aumento LDL • Disminución HDL |
*Oxido Nítrico; **Resistencia Vascular Sistémica.
a falla respiratoria y, a la vez, la aparición de SAHOS complica el manejo perioperatorio en estos pacientes[4],[37]. Finalmente, situaciones como cirugías y administración de anestésicos desencadenan en los pacientes hipotiroideos la aparición de coma mixedematoso, el cual se puede manifestar en hipotermia, bradicardia, hiponatremia, insuficiencia cardíaca e hipop- nea[4],[55].
-
Implicaciones en anestesia
El hipotiroidismo no diagnosticado ni tratado en el entorno intraoperatorio puede dar lugar a complicaciones por los diversos efectos sistémicos de la disminución de la hormona tiroidea, como son la depresión miocárdica, la disminución de la respuesta ventilatoria, una función barorreceptora anormal, la disminución del volumen plasmático y la disminución de la capacidad para metabolizar agentes anestésicos[1],[2],[3]. Idealmente, los pacientes deben estar eutiroideos para poder ser intervenidos, y aunque el hipotiroidismo leve o moderado no es una contraindicación definitiva para la cirugía, es preferible posponer la cirugía electiva hasta que se pueda alcanzar ese estado, especialmente en el escenario de hipotiroidismo severo[38],[56] (Figura 1).
Se puede hacer una excepción en el marco de procedimientos de emergencia en donde hay que avanzar con extrema precaución, teniendo en cuenta que el estrés físico de la cirugía y los agentes anestésicos pueden desencadenar un coma mixe- dematoso[6]. En los pacientes con hipotiroidismo crónico grave o coma mixedematoso, existe un mayor riesgo de complicaciones perioperatorias debido al alto riesgo de colapso cardiovascular por depresión cardíaca resistente a las catecolaminas[57]. Se cree que esta resistencia a las catecolaminas está causada por una regulación decreciente del receptor beta adrenérgico en el tejido muscular cardíaco, por lo que, aunque los niveles de
catecolaminas puedan aumentar en estos pacientes, existe una importante posibilidad de que desarrollen hipotensión intraoperatoria[4]. Además, los estados hipotiroideos pueden causar un aumento de la resistencia vascular periférica y provocar un aumento de la poscarga cardíaca, disminución de la presión del pulso por un aumento de la presión diastólica y una disminución de la presión arterial sistólica[37].
Del mismo modo, la depresión cardíaca puede empeorar con los anestésicos volátiles, y puede producir vasodilatación debido a la alteración del reflejo barorreceptor en estos pacientes, así como hipovolemia por el aumento de la permeabilidad capilar y desplazamientos de líquido hacia el espacio extravas- cular[38],[58]. La disminución del gasto cardíaco observada en esta población de pacientes, no modifica la concentración alveolar mínima de los anestésicos volátiles, pero disminuye la recaptación en el tejido pulmonar y, por tanto, conduce a una mayor presión alveolar (Fa/Fi ratio) y a una inducción más rápida con anestésicos inhalados. Sin embargo, al final de la anestesia ocurre lo contrario, ya que el estado de bajo gasto cardíaco disminuye la recaptación en el sistema nervioso central y conduce a un aumento de la presión parcial tisular en el lugar de efecto de los agentes anestésicos y a un retraso en el despertar[59]. Además, el estado hipometabólico característico de los pacientes hipotiroideos potencia el efecto de los agentes anestésicos, sedantes y opioides debido a la disminución del flujo sanguíneo hepático y del metabolismo farmacológico, lo que puede retrasar aún más el despertar y aumentar el riesgo de efectos secundarios, como la depresión respiratoria, por lo que se recomienda reducir las dosis de estos medicamentos[37]. En esta población de pacientes, la presencia de macroglosia, tejido orofaríngeo débil, bocio, edema generalizado y/u obesidad puede crear un escenario difícil cuando se trata de un manejo adecuado de las vías respiratorias[57]. Además, la mecánica respiratoria en estos pacientes está alterada debido al derrame
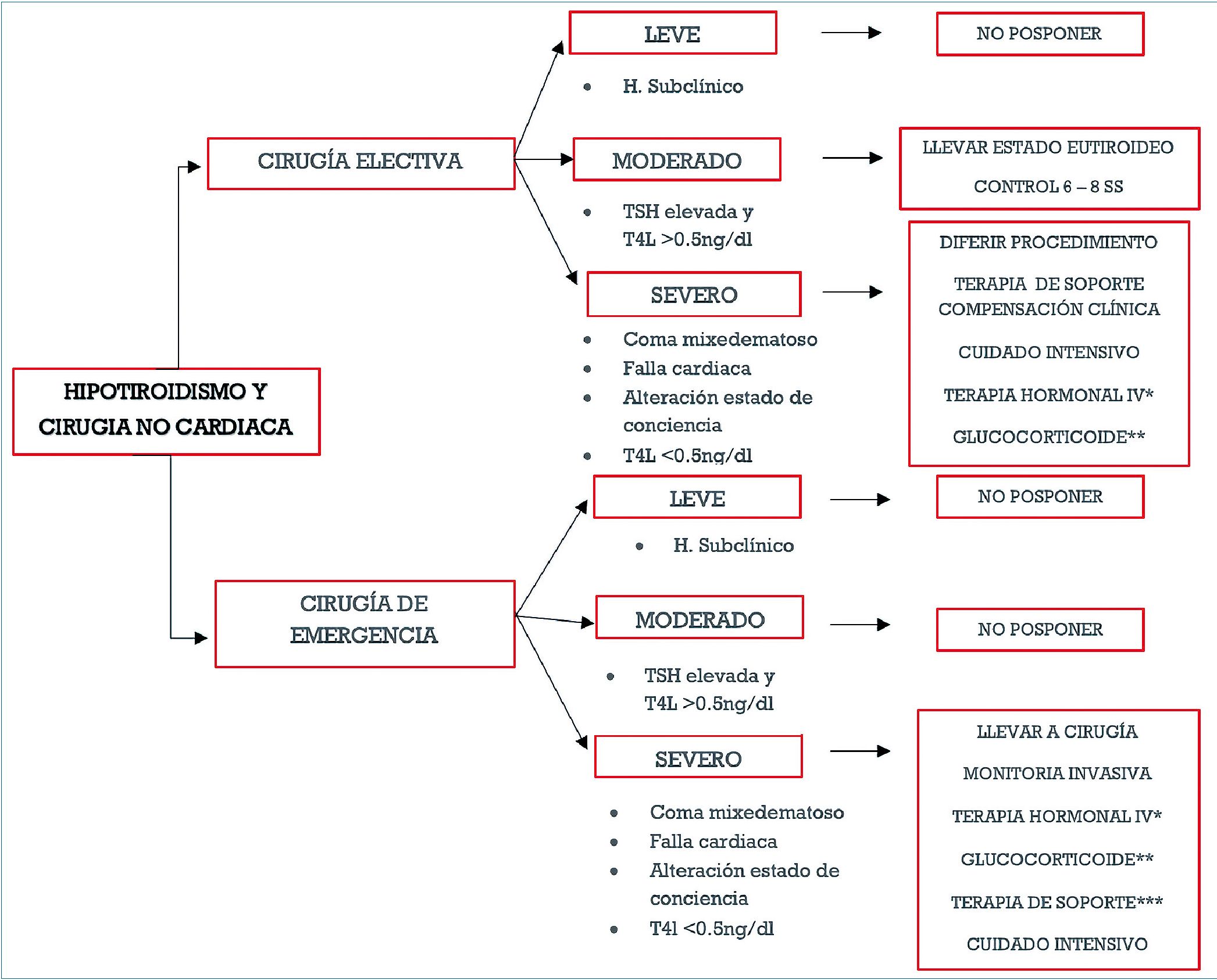
Figura 1. Algoritmo de manejo preoperatorio en pacientes con hipotiroidismo. *T4 200 a 300 mcg IV seguida de 50 mcg/día + T3 5 a 20 mcv IV seguida de 2,5 a 10 mcg cada ocho horas, según la edad del paciente y los factores de riesgo cardiaco coexistente; **Hidrocortisona 200 mg por día; ***Soporte inotrópica, vasopresor y ventilatoria.
pleural, la debilidad de los músculos respiratorios y la alteración del impulso respiratorio hipóxico e hipercápnico, lo que puede dificultar el manejo postoperatorio debido al mayor riesgo de hipoxemia, neumonía y atelectasia[37].
Existen otras implicaciones en el período perioperatorio en el paciente hipotiroideo, como el aumento del riesgo de aspiración por retraso en el vaciado gástrico, el aumento del riesgo de íleo por disminución de la motilidad gastrointestinal y la hiponatremia por aumento de la hormona antidiurética, entre otras[4],[57]. Como se mencionó anteriormente en esta sección, es posible llevar a los pacientes hipotiroideos a cirugía en situaciones de emergencia, sin embargo, se debe tener en cuenta el alto riesgo de un coma mixedematoso, que conlleva una tasa de mortalidad tan alta como el 80%. Este estado se define por una alteración del estado mental (coma o convulsiones), hipotermia, bradicardia, hiponatremia, insuficiencia cardíaca e hipoxemia por hipoventilación alveolar[4],[55],[60]. Si no se trata, esta condición puede conducir a una insuficiencia
cardíaca congestiva y a un derrame pericárdico, por lo que se requiere una terapia de apoyo rápida para optimizar la condición del paciente y, en algunos casos puede requerir la administración de hormonas tiroideas, aunque todavía no existe una recomendación concreta[60]. Asimismo, estos pacientes tienen un mayor riesgo de presentar eventos coronarios perio- peratorios, probablemente debido al aumento de los niveles de colesterol, la prolongación de la vida media de los factores de coagulación y la anemia[4]. Además, en estos pacientes puede observarse una disminución de la actividad del factor VIII, un tiempo de tromboplastina parcial prolongado y una enfermedad de von Willebrand adquirida, lo que hace que se observe el perfil coagulativo de los pacientes[4].
-
Recomendaciones actuales
La prueba de medición de los niveles de TSH para el escenario donde sospechamos que un paciente cursa con hipotiroi-
dismo es la más sensible. Es el ítem principal para el diagnóstico de hipotiroidismo primario con una sensibilidad del 89% y una especificidad del 95%, mientras que la T4 libre puede ir como paraclínico acompañante luego de solicitar una TSH por que tiene menor sensibilidad (82%) y menor especificidad (94%) [61],[62],[63]. El diagnóstico bioquímico de hipotiroidismo se realiza cuando se encuentran niveles elevados de la hormona TSH dependiendo de la edad del paciente, el rango para adultos corresponde a 0,4 a 3,4 mU/L[64], asociado a niveles de hormona T4 libre disminuida, es decir menos al rango de normalidad de 0,8 a 2,7 mU/L[65].
Aunque no hay consenso en la definición de la severidad del hipotiroidismo, teniendo en cuenta que varía en diferentes estudios, usamos el descrito en el estudio de Himes et al. La clasificación en leve, moderado y severo permite un abordaje más específico en el preoperatorio según la severidad así; leve: hipotiroidismo subclínico, moderado: niveles elevados de tirotropina (TSH) y niveles de T4L levemente disminuidos (> 0,5 ng/dL), y severo: con niveles de T3 y T4 muy bajos (< 0,5 ng/dL), coma mixedematoso, síntomas severos, hipotiroidismo crónico[66].
Se debe contemplar la existencia del hipotiroidismo subclínico, es decir cuando la TSH se encuentra en niveles de 4,5 a 10 mU/L, en el cual vamos a encontrar un paciente asintomático, pero con niveles elevados o con tendencia a la elevación de la TSH y la T4 Libre dentro de rangos normales. Estos pacientes solo se deben tratar cuando son mujeres y además tienen un estudio de anticuerpos antiperoxidasa (anti TPO) positivos, también debe tratarse si son mujeres que desean quedar en embarazo; cuando son pacientes con enfermedad cardiocere- brovascular; si comienzan a tener manifestaciones clínicas de hipotiroidismo; y cuando el nivel sérico de TSH es mayor de 10 mU/L[65],[67],[68].
La diferenciación entre los subgrupos de hipotiroidismo (leve, moderado, grave y subclínico) se basa en biomarcadores que permiten categorizar la enfermedad según los niveles de hormonas tiroideas, estos de TSH niveles se elevan progresivamente con la edad, en pacientes menores de 49 años se espera un nivel en 0,45 a 4,5 mU/L, mientras que a la edad de 80 años o más es normal un nivel en 6,3 mU/L. Por su parte, hipotiroi- dismo grave se presenta con niveles de TSH séricos superiores al rango de referencia clínico y concentraciones de T4 libre inferiores al rango de referencia, es decir, cuando la TSH supera el valor de 20 mU/L igual que cuando el paciente cursa con complicaciones del hipotiroidismo como el mixedema[57].
Diferentes organizaciones a nivel mundial han hablado sobre las recomendaciones para la realización del tamizaje de función tiroidea en pacientes con y sin antecedente de hipoti- roidismo, sin embargo, entre sí difieren mucho. Por parte de la Asociación Americana de Tiroides recomiendan la toma de perfil tiroideo en mujeres mayores de 35 años y a partir de esta edad debe tomar cada 5 años; por parte de la Asociación Americana de Endocrinología clínica recomiendan la toma de TSH en población geriátrica, especialmente mujeres; la Asociación Americana de Médicos familiaristas sugieren realizarlo en mayores de 60 años y el Colegio Americano de médico recomienda hacerlo en mujeres mayores de 50 años con hallazgos incidentales o sugestivos de enfermedad tiroidea asintomática. No obstante, en Colombia, se solicita la toma de perfil tiroideo en pacientes que superen los 60 años de edad, en mujeres que desean quedar en embarazo, en gestantes y en paciente con
enfermedad cardiocerebrovascular, en pacientes con enfermedad autoinmune, o con familiar en primer grado de consanguinidad con enfermedad autoinmune tiroidea, más frecuentemente[65].
Identificar a los pacientes con hipotiroidismo antes de que reciban una intervención quirúrgica tiene gran relevancia clínica y quirúrgica por lo que, el período preoperatorio es tan importante, ya que permite identificar riesgos durante la intervención quirúrgica y facilita establecer si es seguro o no proceder a la cirugía. Por medio de la valoración y los hallazgos durante la valoración prequirúrgica podemos establecer si es recomendable posponer la intervención electiva hasta que el paciente sea considerado como eutiroideo o sin manifestaciones sintomáticas relevantes, con el fin de evitar la descompensación aguda previo, durante o posterior a la cirugía[4]. Según Palace et al, en el caso de tener un paciente asintomático sin antecedentes de enfermedad tiroidea no es necesario hacer un cribado preoperatorio rutinario de función tiroidea, sin embargo, los paraclínicos preoperatorios deben comprobar niveles de TSH[4].
A pesar de que actualmente no existe un consenso acerca de cuándo aplazar la cirugía de manera programada a un paciente hipotiroideo leve o subclínico, entiéndase por hipo- tiroidismo leve en contexto de nivel sérico de TSH en rango de 5,5 a 10 mU/L, algunos autores muestran que no hay suficientes justificaciones clínicas que indiquen detener la intervención[38],[69],[70]. No obstante, se considera que quien cursa con hipotiroidismo grave (TSH en valores de > 20 mU/L) en sustitución hormonal o con sustitución inefectiva, definitivamente no debe entrar a quirófano a menos que el no hacerlo comprometa en mayor grado la vida del paciente[38],[66],[69],[70]. Las recomendaciones para lograr que el paciente hipotiroideo pueda ser candidato óptimo para una cirugía de elección, es el estado eutiroideo, para lo cual se requiere la administración de levotiroxina, el tratamiento debe iniciarse de 7 a 14 días antes de la cirugía para lograr el eutiroidismo[69]. Pero en el caso de tener un paciente que deba ser llevado a cirugía de emergencia, debe realizarse con todo el manejo de soporte hemodinámico y ventilatorio necesario, debe llevarse a cuidado intensivo postoperatorio, y manejo en conjunto con endocrinología[66]. Adicionalmente, debe iniciarse de forma inmediata la terapia con levotiroxina 200 a 500 microgramos endovenosos en 30 min, seguido de una dosis de mantenimiento postoperatorio de 50 a 100 microgramos endovenosos dependiendo de la edad del paciente y su riesgo cardiovascular preexistente[66],[71].
En el escenario clínico en el cual el paciente desarrolle mi- xedema posquirúrgico, se recomienda administrar corticoides endovenosos, como hidrocortisona en dosis de 100 mg cada 8 h y reanimación hídrica adecuada con cristaloides, ya que a pesar de que el mixedema es muy poco frecuente, tienen una tasa de mortalidad del 80%, comúnmente es desencadenado por infecciones, hipotermia, uso de sedantes y narcóticos, analgésicos y/u otros fármacos; condiciones frecuentemente presentes después de un procedimiento quirúrgico. Además, deben solicitarse glicemia y electrolitos plasmáticos, y controlar la temperatura corporal. Los síntomas debieran resolverse en las primeras 24 h de tratamiento[71].
El día de la cirugía programada, el paciente no debe suspender sus medicamentos antitiroideos, es aconsejable administrar la dosis matutina habitual de T3 del paciente[72]. Sin embargo, en el caso de haber sido omitida, no existe inconveniente ya que la vida media de la levotiroxina es de aproximadamente 7 días. Si ha sido suspendido por más de 7 días se debe reiniciar y se sugiere nuevo control de TSH. Si en el postoperatorio no se puede administrar la dosis vía oral después de 5 días es necesaria la administración endovenosa, debe realizarse de forma titulada entre el 60%-80% de la dosis oral[4], para evitar que la elevación de hormonas exógenas en el preoperatorio tenga implicación en complicaciones cardíacas como isquemia e infarto, debido al desequilibrio entre la demanda y el suministro de oxígeno[4],[73].
Los riesgos perioperatorios en pacientes con hipotiroidismo no tratado varían según el grado de disfunción tiroidea, estos pacientes tienen un mayor riesgo de sufrir complicaciones cardiovasculares, pulmonares y de vías respiratorias[66]. Las complicaciones más frecuentes en este caso corresponden a: bajo gasto cardíaco (hasta 30%-50%), hipotensión intraoperatoria, eventos coronarios, bradicardia, arritmias y prolongación del intervalo QT y por lo tanto, taquicardia ventricular y torsades de pointes[66]. Como se mencionó anteriormente, las complicaciones respiratorias también están asociadas en pacientes hipo- tiroideos graves, incluyen el deterioro del impulso respiratorio hipóxico e hipercápnico, debilidad en músculos respiratorios, aumento de la prevalencia de la apnea obstructiva del sueño, mixedema laríngeo, la macroglosia y la sensibilidad extrema a opioides o anestésicos[66].
El estudio prospectivo de Park et al, y el estudio de Leal et al, muestran resultados similares con respecto al desenlace quirúrgico en pacientes con intervención coronaria, ambos revelaron que es menos favorable en pacientes hipotiroideos graves (T4 total menor de 1,0 p/dl o T4 libre menor de 0,5 ng/dl) con respecto a los eutiroideos. Los pacientes fueron sometidos a un injerto de derivación coronaria, para quienes ingresaron como eutiroideos no se observó un aumento en los eventos cardiovasculares mayores (MACE), problemas en heridas, mediastinitis, infecciones, complicaciones respiratorias, delirio o reintervención durante la misma hospitalización, mientras que sí hubo un aumento de la tasa de fibrilación auricular posoperatoria en el grupo de quienes cursaron con hipotiroidismo subclínico, como también mostró el estudio de Worku et al, en 2015[70],[74],[75]. No se recomienda la terapia de reemplazo hormonal en quienes van a revascularización cardiaca de urgencia, ya que puede empeorar la isquemia cardíaca[66]. Un metaanálisis que incluyo 11 estudios de cohortes prospectivos en 5 continentes encontró una asociación del incremento de riesgo de eventos coronarios en pacientes con hipotiroidismo subclínico, especialmente en pacientes con niveles serios de TSH mayor a 10 mlU/L[27]. En cuanto a los pacientes no cardíacos, el estudio de cohorte retrospectivo de Komatsu et al, del 2015 muestra que el hipotiroidismo no se asoció con una peor mortalidad posoperatoria, heridas o resultados cardiovasculares[76].
Con respecto a las consideraciones anestésicas en el paciente hipotiroideo se aconseja administrar antihistamínicos H2 y metoclopramida, ya que los pacientes hipotiroideos suelen tener tránsito intestinal lento, por lo que quienes ya se encuentran eutiroideos para el día antes de la cirugía, deben tomarlos en la mañana de la intervención. Por otro lado, son más susceptibles a los efectos hipotensivos de los agentes anestésicos, por lo que la ketamina es el fármaco recomendado, el uso del halotano debe descartarse en el paciente con cuadro endocrino ya
que incrementa la secreción de TSH y T3 logrando sensibilizar el miocardio a la acción de las catecolaminas[77]. En la etapa postoperatoria inmediata, es decir, durante la recuperación de la anestesia general, puede tardar más secundario a hipotermia, depresión respiratoria, o biotransformación farmacológica lenta. Los pacientes deben mantenerse intubados hasta que estén totalmente despiertos y normotérmicos. En estos pacientes es aconsejable no administrar fármacos opioides por la posibilidad de depresión respiratoria, es mejor administrar fármacos como el ketorolaco para la analgesia postoperatoria[66].
Por su parte, la fenilefrina ha generado en algunos pacientes inestabilidad hemodinámica debida a hipotensión persistente. Existen estudios que han demostrado una disminución de la capacidad de respuesta vascular a la fenilefrina y otros agonistas adrenérgicos a-1 en hipotiroideos[78]. Para la analgesia posoperatoria no se recomienda el uso de opiáceos, por ejemplo la dosis inicial de morfina debe reducirse en 30%-40% en los pacientes con hipotiroidismo, también en contexto de insuficiencia hepática o renal grave o insuficiencia suprarrenal[79].
-
Algoritmo
Es de gran importancia conocer los cambios fisiológicos e implicaciones en el manejo anestésico de estos pacientes, para un adecuado abordaje, tanto en el preoperatorio como en posibles complicaciones graves en el postoperatorio. Por ende, basados en esta revisión no sistemática de la literatura, proponemos una discusión alrededor del algoritmo (Figura 1) de manejo presentado. Este algoritmo destaca que hasta ahora no se recomienda realizar tamizaje de los niveles séricos de TSH en el preoperatorio para todos los pacientes que van a cirugía electiva, sin embargo, sí se recomienda para los pacientes con diagnóstico previo o sintomáticos que han venido recibiendo tratamiento para definir la severidad de la enfermedad. Además, se considera que lo ideal es llevar al paciente con enfermedad ya conocida a cirugía electiva cuando ya se encuentra en estado eutiroideo.
Referencias
1. Hussain Z, Sc B, Elahi S. Undetected hypothyroidism and its anesthetic implications. Anaesth Pain Intensive Care. 1 de mayo de 2012;16:205-10.
2. Ishizuka S, Tsubokawa T, Yamamoto K, Kobayashi T. [Propofol pharmacokinetics in a patient with TSH producing pituitary adenoma]. Masui. febrero de 2001;50(2):199-202.
3. Rosato L, Avenia N, Bernante P, De Palma M, Gulino G, Nasi PG, et al. Complications of thyroid surgery: analysis of a multicentric study on 14,934 patients operated on in Italy over 5 years. World J Surg. marzo de 2004;28(3):271-6.
4. Palace MR. Perioperative Management of Thyroid Dysfunction. Health Serv Insights. 20 de febrero de 2017;10:1178632916689677. https://doi.org/10.1177/1178632916689677.
5. Aoki Y, Belin RM, Clickner R, Jeffries R, Phillips L, Mahaffey KR. Serum TSH and total T4 in the United States population and their association with participant characteristics: National Health and Nutrition Examination Survey (NHANES 1999-2002). Thyroid Off J Am Thyroid Assoc. diciembre de 2007;17(12):1211-23.
6. Sharma M-P, Cetera B. Thyroid disease and surgery. Anaesth Intensive Care Med. 1 de noviembre de 2020;21(11):558-71. https://doi.org/10.1016/j.mpaic.2020.09.001.
7. Taylor PN, Albrecht D, Scholz A, Gutierrez-Buey G, Lazarus JH, Dayan CM, et al. Global epidemiology of hyperthyroidism and hypothyroidism. Nat Rev Endocrinol. mayo de 2018;14(5):301-16. https://doi.org/10.1038/nrendo.2018.18.
8. Unnikrishnan AG, Kalra S, Sahay RK, Bantwal G, John M, Tewari N. Prevalence of hypothyroidism in adults: an epidemiological study in eight cities of India. Indian J Endocrinol Metab. 2013 Jul;17(4):647–52. https://doi.org/10.4103/2230-8210.113755 PMID:23961480
9. Sichieri R, Baima J, Marante T, de Vasconcellos MTL, Moura AS, Vaisman M. Low prevalence of hypothyroidism among black and Mulatto people in a population-based study of Brazilian women. Clin Endocrinol (Oxf). junio de 2007;66(6):803-7. https://doi.org/10.1111/j.1365-2265.2007.02816.x.
10. Wang J, Ma X, Qu S, Li Y, Han L, Sun X, et al. High prevalence of subclinical thyroid dysfunction and the relationship between thyrotropin levels and cardiovascular risk factors in residents of the coastal area of China. Exp Clin Cardiol. 2013;18(1):e16–20. PMID:24294042
11. s Kasagi K, Takahashi N, Inoue G, Honda T, Kawachi Y, Izumi Y. Thyroid function in Japanese adults as assessed by a general health checkup system in relation with thyroid-related antibodies and other clinical parameters. Thyroid Off J Am Thyroid Assoc. septiembre de 2009;19(9):937-44.
12. Sarıtas A, Sarıtas PU, Kurnaz MM, Çelik A. Spectrum and Prevalence of Thyroid Disorders in Patients Admitted to the Anaesthesiology Outpatient Clinic for Surgery. Turk J Anaesthesiol Reanim. agosto de 2015;43(4):240-5. https://doi.org/10.5152/TJAR.2015.03206.
13. Hoogendoorn EH, Hermus AR, de Vegt F, Ross HA, Verbeek AL, Kiemeney LA, et al. Thyroid function and prevalence of anti-thyroperoxidase antibodies in a population with borderline sufficient iodine intake: influences of age and sex. Clin Chem. 2006 Jan;52(1):104–11. https://doi.org/10.1373/clinchem.2005.055194 PMID:16254196
14. Usha Menon V, Sundaram KR, Unnikrishnan AG, Jayakumar RV, Nair V, Kumar H. High prevalence of undetected thyroid disorders in an iodine sufficient adult south Indian population. J Indian Med Assoc. febrero de 2009;107(2):72-7.
15. Molina PE. Thyroid Gland. En: Endocrine Physiology [Internet]. 5.a ed. New York, NY: McGraw-Hill Education; 2018 [citado 12 de agosto de 2021]. Disponible en: accessmedicine.mhmedical.com/content.aspx?aid=1160649708
16. Oetting A, Yen PM. New insights into thyroid hormone action. Best Pract Res Clin Endocrinol Metab. 1 de junio de 2007;21(2):193-208. https://doi.org/10.1016/j.beem.2007.04.004.
17. Hall J. Guyton And Hall Textbook Of Medical Physiology. Elsevier; 2016.Disponible en: https://www.elsevier.com/books/guyton-and-hall-textbook-of-medical-physiology/hall/978-1-4557-7005-2
18. Armstrong M, Asuka E, Fingeret A. Physiology, Thyroid Function. En: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 [citado 12 de agosto de 2021]. Disponible en: http://www.ncbi.nlm.nih.gov/books/NBK537039/
19. Mazza A, Beltramello G, Armigliato M, Montemurro D, Zorzan S, Zuin M, et al. Arterial hypertension and thyroid disorders: What is important to know in clinical practice? Ann Endocrinol. 1 de septiembre de 2011;72(4):296-303.
20. Milla CE, Zirbes J. Pulmonary Complications of Endocrine and Metabolic Disorders. Paediatr Respir Rev. 1 de marzo de 2012;13(1):23-8. https://doi.org/10.1016/j.prrv.2011.01.004.
21. Gullu S, Sav H, Kamel N. Effects of levothyroxine treatment on biochemical and hemostasis parameters in patients with hypothyroidism. Eur J Endocrinol. marzo de 2005;152(3):355-61. https://doi.org/10.1530/eje.1.01857.
22. Chaker L, Bianco AC, Jonklaas J, Peeters RP. Hypothyroidism. Lancet Lond Engl. 23 de septiembre de 2017;390(10101):1550-62.
23. Almandoz JP, Gharib H. Hypothyroidism: Etiology, Diagnosis, and Management. Med Clin North Am. 1 de marzo de 2012;96(2):203-21.
24. Christianson AG. 182 – Hypothyroidism. En: Pizzorno JE, Murray MT, editores. Textbook of Natural Medicine (Fifth Edition) [Internet]. St. Louis (MO): Churchill Livingstone; 2020 [citado 12 de agosto de 2021]. p. 1414-1421.e2. Disponible en: https://www.sciencedirect.com/science/article/pii/B9780323430449001825
25. Cooper DS, Biondi B. Subclinical thyroid disease. The Lancet. 24 de marzo de 2012;379(9821):1142-54. https://doi.org/10.1016/S0140-6736(11)60276-6.
26. Pearce SHS, Brabant G, Duntas LH, Monzani F, Peeters RP, Razvi S, et al. 2013 ETA Guideline: Management of Subclinical Hypothyroidism. Eur Thyroid J. diciembre de 2013;2(4):215-28.
27. Rodondi N, den Elzen WPJ, Bauer DC, Cappola AR, Razvi S, Walsh JP, et al. Subclinical hypothyroidism and the risk of coronary heart disease and mortality. JAMA. 22 de septiembre de 2010;304(12):1365-74. https://doi.org/10.1001/jama.2010.1361.
28. Surks MI, Boucai L. Age- and race-based serum thyrotropin reference limits. J Clin Endocrinol Metab. febrero de 2010;95(2):496-502.
29. González Martínez J, Rey J, Cedillo Pérez M, Espinosa Rey I, García L. Guía Nacional para el examen de Residencias Médicas, 2e.AccessMedicina.McGraw Hill Medical. Accessmedicina.mhmedical.com. https://accessmedicina.mhmedical.com/book.aspx?bookid=1469. Published 2021. Accessed August 16, 2021.
30. Kanike N, Davis A, Shekhawat PS. Transient hypothyroidism in the newborn: to treat or not to treat. Transl Pediatr. octubre de 2017;6(4):349-58. https://doi.org/10.21037/tp.2017.09.07.
31. Ragusa F, Fallahi P, Elia G, Gonnella D, Paparo SR, Giusti C, et al. Hashimotos’ thyroiditis: Epidemiology, pathogenesis, clinic and therapy. Best Pract Res Clin Endocrinol Metab. 1 de diciembre de 2019;33(6):101367.
32. Wiersinga WM. Hashimoto’s Thyroiditis. En: Vitti P, Hegedüs L, editores. Thyroid Diseases: Pathogenesis, Diagnosis, and Treatment [Internet]. Cham: Springer International Publishing; 2018 [citado 12 de agosto de 2021]. p. 205-47. (Endocrinology). Disponible en: https://doi.org/10.1007/978-3-319-45013-1_7.
33. Kollur SM, El Sayed S, El Hag IA. Follicular thyroid lesions coexisting with Hashimoto’s thyroiditis: incidence and possible sources of diagnostic errors. Diagn Cytopathol. 2003 Jan;28(1):35–8. https://doi.org/10.1002/dc.10206 PMID:12508180
34. Hou W, Xu G, Wang H, Gould J. Treating autoimmune disease with Chinese medicine. Edinburgh, New York: Churchill Livingstone; 2011. 303 pp.
35. Castillo A, Alfaro J, Boza A. Abordaje del hipotiroidismo subclínico en el adulto. Rev Medica Sinerg. 1 de febrero de 2020;5:e358.
36. Modesti PA, Marchetta M, Gamberi T, Lucchese G, Maccherini M, Chiavarelli M, et al. Reduced expression of thyroid hormone receptors and beta-adrenergic receptors in human failing cardiomyocytes. Biochem Pharmacol. febrero de 2008;75(4):900-6. https://doi.org/10.1016/j.bcp.2007.10.011.
37. Stathatos N, Wartofsky L. Perioperative management of patients with hypothyroidism. Endocrinol Metab Clin North Am. 1 de junio de 2003;32(2):503-18. https://doi.org/10.1016/S0889-8529(03)00007-0.
38. Graham GW, Unger BP, Coursin DB. Perioperative Management of Selected Endocrine Disorders. Int Anesthesiol Clin. Fall de 2000;38(4):31-67. https://doi.org/10.1097/00004311-200010000-00004.
39. Berta E, Lengyel I, Halmi S, Zrínyi M, Erdei A, Harangi M, et al. Hypertension in Thyroid Disorders. Front Endocrinol. 17 de julio de 2019;10:482. https://doi.org/10.3389/fendo.2019.00482.
40. Juárez-Allen. Lea L, Gómez R. Fisiopatología de la Hipertension Arterial en Patologia Endocrina. In: Sociedad Argentino De Hipertensión Arterial.; 2021.
41. Dharmasena S, Burzyantseva O, Jayawardana S, Rupanagudy V, Pathmanathan K. Cardiogenic shock in a patient with hypothyroid myopathy responsive only to thyroxin replacement: A case report. Cases J. 1 de febrero de 2010;3:66. https://doi.org/10.1186/1757-1626-3-66.
42. Shojaie M, Eshraghian A. Primary hypothyroidism presenting with Torsades de pointes type tachycardia: a case report. Cases J. 6 de noviembre de 2008;1(1):298. https://doi.org/10.1186/1757-1626-1-298.
43. Lee YS, Choi JW, Bae EJ, Park WI, Lee HJ, Oh PS. The corrected QT (QTc) prolongation in hyperthyroidism and the association of thyroid hormone with the QTc interval. Korean J Pediatr. 22 de julio de 2015;58(7):263-6.
44. Geiger PC, Cody MJ, Han YS, Hunter LW, Zhan WZ, Sieck GC. Effects of hypothyroidism on maximum specific force in rat diaphragm muscle fibers. J Appl Physiol. 2002 Apr;92(4):1506–14. https://doi.org/10.1152/japplphysiol.00095.2001 PMID:11896017
45. Novik AV, Pérez O ME, Anwandter Z G. Insuficiencia respiratoria global como forma de presentación de un hipotiroidismo: Comunicación de un caso. Rev Médica Chile. enero de 2004;132(1):81-4.
46. Lencu C, Alexescu T, Petrulea M, Lencu M. Respiratory manifestations in endocrine diseases. Clujul Med. 2016;89(4):459–63. PMID:27857512
47. Zimmerman L. Pulmonary Complications of Endocrine Diseases. Murray Nadels Textb Respir Med. 2016;1671-1678.e4. https://doi.org/10.1016/B978-1-4557-3383-5.00095-6.
48. Elbers LP, Fliers E, Cannegieter SC. The influence of thyroid function on the coagulation system and its clinical consequences. J Thromb Haemost. 2018 Apr;16(4):634–45. https://doi.org/10.1111/jth.13970 PMID:29573126
49. Verkleij CJ, Stuijver DJ, van Zaane B, Squizzato A, Brandjes DP, Büller HR, et al. Thrombin-activatable fibrinolysis inhibitor in hypothyroidism and hyperthyroxinaemia. Thromb Haemost. 2013 Feb;109(2):214–20. https://doi.org/10.1160/TH12-07-0525 PMID:23197299
50. Federici AB. Acquired von Willebrand Syndrome Associated with Hypothyroidism: A Mild Bleeding Disorder to Be Further Investigated. Semin Thromb Hemost. febrero de 2011;37(1):35-40. https://doi.org/10.1055/s-0030-1270069.
51. Brenta G. Diabetes and thyroid disorders. Br J Diabetes Vasc Dis. 2010;10(4):172–7. https://doi.org/10.1177/1474651410371321.
52. Rochon C, Tauveron I, Dejax C, Benoit P, Capitan P, Fabricio A, et al. Response of glucose disposal to hyperinsulinemia in human hypothyroidism and hyperthyroidism. Clin Sci Lond Engl 1979. enero de 2003;104(1):7-15.
53. Imaizumi M, Akahoshi M, Ichimaru S, Nakashima E, Hida A, Soda M, et al. Risk for ischemic heart disease and all-cause mortality in subclinical hypothyroidism. J Clin Endocrinol Metab. julio de 2004;89(7):3365-70.
54. Razvi S, Weaver JU, Vanderpump MP, Pearce SHS. The incidence of ischemic heart disease and mortality in people with subclinical hypothyroidism: reanalysis of the Whickham Survey cohort. J Clin Endocrinol Metab. abril de 2010;95(4):1734-40.
55. Mathew V, Misgar RA, Ghosh S, Mukhopadhyay P, Roychowdhury P, Pandit K, et al. Myxedema coma: a new look into an old crisis. J Thyroid Res. 2011;2011:493462. https://doi.org/10.4061/2011/493462 PMID:21941682
56. Hines R, Marschall K. Stoelting’s Anesthesia and Co-Existing Disease – 6th Edition [Internet]. [citado 29 de junio de 2020]. Disponible en: https://www.elsevier.com/books/stoeltings-anesthesia-and-co-existing-disease/hines/978-1-4557-0082-0
57. Peramunage D, Nikravan S. Anesthesia for Endocrine Emergencies. Anesthesiol Clin. 1 de marzo de 2020;38(1):149-63. https://doi.org/10.1016/j.anclin.2019.10.006.
58. Park CW, Shin YS, Ahn SJ, Kim SY, Choi EJ, Chang YS, et al. Thyroxine treatment induces upregulation of renin‐angiotensin‐aldosterone system due to decreasing effective plasma volume in patients with primary myxoedema. Nephrol Dial Transplant. 1 de septiembre de 2001;16(9):1799-806. https://doi.org/10.1093/ndt/16.9.1799.
59. Khan KS, Hayes I, Buggy DJ. Pharmacology of anaesthetic agents II: inhalation anaesthetic agents. Contin Educ Anaesth Crit Care Pain. 1 de junio de 2014;14(3):106-11. https://doi.org/10.1093/bjaceaccp/mkt038.
60. Bajwa SJ, Sehgal V. Anesthesia and thyroid surgery: the never ending challenges. Indian J Endocrinol Metab. 2013 Mar;17(2):228–34. https://doi.org/10.4103/2230-8210.109671 PMID:23776893
61. Olloqui Mundet J, Ochoa Prieto J. Medicina de familia en el seguimiento del hipotiroidismo. Aten Primaria. 1 de enero de 2002;29(1):36-8.
62. García Sáez J, Carvajal Martínez F, González Fernández P, Navarro Despaigne D. Hipotiroidismo subclínico: Actualización. Rev Cuba Endocrinol. diciembre de 2005;16(3):0-0.
63. Tekce B, Dikbas O, Tekçe H, Tosun M. Evaluation of the requests for thyroid function test according algorithms and cost effectivity. Abant Med J. 1 de enero de 2013;2:114-8.
64. Langén VL, Niiranen TJ, Mäki J, Sundvall J, Jula AM. Thyroid-stimulating hormone reference range and factors affecting it in a nationwide random sample. Clin Chem Lab Med CCLM. 1 de diciembre de 2014;52(12):1807-13. https://doi.org/10.1515/cclm-2014-0287.
65. Garber JR, Cobin RH, Gharib H, Hennessey JV, Klein I, Mechanick JI, et al. Clinical Practice Guidelines for Hypothyroidism in Adults: Cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. Endocr Pract. 1 de noviembre de 2012;18(6):988-1028.
66. Himes CP, Ganesh R, Wight EC, Simha V, Liebow M. Perioperative Evaluation and Management of Endocrine Disorders. Mayo Clin Proc. diciembre de 2020;95(12):2760-74. https://doi.org/10.1016/j.mayocp.2020.05.004.
67. Claudio Liberman G. Enfermedad tiroidea subclínica: revisión y enfoque clínico. Rev Médica Clínica Las Condes. 1 de septiembre de 2013;24(5):748-53. https://doi.org/10.1016/S0716-8640(13)70219-0.
68. Moon S, Kim MJ, Yu JM, Yoo HJ, Park YJ. Subclinical Hypothyroidism and the Risk of Cardiovascular Disease and All-Cause Mortality: A Meta-Analysis of Prospective Cohort Studies. Thyroid. 1 de septiembre de 2018;28(9):1101-10. https://doi.org/10.1089/thy.2017.0414.
69. Longbottom J, Macnab R. Thyroid disease and thyroid surgery. Anaesth Intensive Care Med. 2014;15(10):458–64. https://doi.org/10.1016/j.mpaic.2014.07.006.
70. Park YJ, Yoon JW, Kim KI, Lee YJ, Kim KW, Choi SH, et al. Subclinical Hypothyroidism Might Increase the Risk of Transient Atrial Fibrillation After Coronary Artery Bypass Grafting. Ann Thorac Surg. 1 de junio de 2009;87(6):1846-52. https://doi.org/10.1016/j.athoracsur.2009.03.032.
71. Nazar J C, Bastidas E J, Zamora H M, Coloma D R, Fuentes H R. Manejo Perioperatorio de Pacientes con Patología Tiroidea y Tratamiento Crónico con Corticoides . Rev Chil Cir. febrero de 2016;68(1):87-93.
72. Bacuzzi A, Dionigi G, Del Bosco A, Cantone G, Sansone T, Di Losa E, et al. Anaesthesia for thyroid surgery: Perioperative management. Int J Surg. 1 de enero de 2008;6:S82-5.
73. Pantos C, Mourouzis I, Xinaris C, Cokkinos DV. Thyroid hormone and myocardial ischaemia. J Steroid Biochem Mol Biol. 1 de abril de 2008;109(3):314-22.
74. Leal Ruiz D, Álvarez Dueñas E. Guía de evaluación preoperatoria del paciente con hipotiridosmo. Revista Médica – Clínica del Country. 2018. https://revistamedicaclcountry.com/app/default/files-module/local/documents/Guia-de-evaluacion-preoperatoria-DEL-PACIENTE-CON-HIPOTIROIDISMO.pdf. Accessed August 16, 2021.
75. Worku B, Tortolani AJ, Gulkarov I, Isom OW, Klein I. Preoperative hypothyroidism is a risk factor for postoperative atrial fibrillation in cardiac surgical patients. J Card Surg. 2015 Apr;30(4):307–12. https://doi.org/10.1111/jocs.12513 PMID:25640607
76. Komatsu R, You J, Mascha EJ, Sessler DI, Kasuya Y, Turan A. The Effect of Hypothyroidism on a Composite of Mortality, Cardiovascular and Wound Complications After Noncardiac Surgery: A Retrospective Cohort Analysis. Anesth Analg. septiembre de 2015;121(3):716-26.
77. Velásquez-Bravo S. Manejo perioperatorio del paciente para cirugía de tiroides. Rev Mex Anest. 2007;30(Suppl: 1):185-192.
78. Mohta M, Harisinghani P, Agarwal D, Sethi AK. Vasopressor for hypothyroid patients–is phenylephrine the right choice? Anaesth Intensive Care. septiembre de 2013;41(5):683-4.
79. Valiente Millán ML, Salinas Ruiz F, Verdejo González MA. los fármacos opioides en atención primaria. Med Integral. 30 de julio de 2001;38(3):116-26.

 ORCID
ORCID



 Creative Commons Attribution
Creative Commons Attribution