Mario A. Zamudio Burbano1,*, Jacobo Corrales Gómez1
Recibido: 12-05-2022
Aceptado: 20-06-2022
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 1 pp. 37-44|https://doi.org/10.25237/revchilanestv5203111405
PDF|ePub|RIS
Adjuvants in spinal anesthesia
Abstract
To Synthesize the most used adjuvants in spinal anesthesia, summarize the mechanisms of action, indication, dose, adverse events, and safety outcomes described. Non-systematic review in the medline, embase, central and Scielo databases without time or language limits, focused on adjuvants in spinal anesthesia, systematic reviews and meta-analyses were selected in order of priority in case they did not have them. Controlled clinical trials were chosen and finally observational studies. 36 original and secondary studies met the inclusión criteria; a narrative review was carried out with the main findings of the same according to the authors. Adjuvants for spinal anesthesia are drugs that are intended to take advantage of a synergistic effect with local anesthetics that can improve the latency of action onset, duration of neuraxial blockade and reduce adverse effects, they stand out for their effects and better safety profile opioid adjuvants.
Resumen
Sintetizar los coadyuvantes en anestesia espinal más usados, resumir los mecanismos de acción, indicaciones, dosis, eventos adversos y desenlaces de seguridad descritos. Revisión no sistemática en las bases de datos medline, embase, central y Scielo sin limite de tiempo ni de idioma, enfocados en coadyuvantes en anestesia espinal, se seleccionaron en orden de prioridad revisiones sistemáticas y meta análisis, en caso de no contar con los mismos se eligieron ensayos clínicos controlados y por último estudios observacionales. 36 estudios entre originales y secundarios cumplieron los criterios de inclusión, una revisión narrativa se realizó con los principales hallazgos de los mismos según los autores. Los coadyuvantes para la anestesia espinal son medicamentos que tienen como intención aprovechar un efecto sinérgico con los anestésicos locales que puede mejorar la latencia de inicio de acción, duración del bloqueo neuroaxial y reducir los efectos adversos, se destacan por sus efectos y mejor perfil de seguridad los coadyuvantes opioides en especial la morfina y el fentanil.
-
Introducción
La anestesia espinal se define como la administración de anestésicos locales cerca de la médula espinal para abolir la percepción del estímulo doloroso es de amplio uso, para prolongar su duración y disminuir eventos adversos se han descrito el uso de múltiples coadyuvantes, se presenta una revisión narrativa sobre dicho tema.
-
Metodología
Revisión no sistemática en las bases de datos medline, embase, central y Scielo sin limite de tiempo ni de idioma, enfocados en coadyuvantes en anestesia espinal, se seleccionaron en orden de prioridad revisiones sistemáticas y meta análisis, en caso de no contar con los mismos se eligieron ensayos clínicos controlados y por último estudios observacionales.
-
Estrategia de búsqueda
La búsqueda realizada en medline a través de pubmed fue: (spinal anesthesia AND (meta-analysis[Filter] OR systematicreview[Filter])) AND ((((((morphine) OR (Fentanyl)) OR (dexmedetomidine)) OR (midazolam)) OR (clonidine)) OR (ke- tamine) AND (meta-analysis[Filter] OR systematicreview[Filter])) Filters: Meta-Analysis, Randomized Controlled Trial, Systematic
Review, estrategias similares se usaron en las demás bases de datos, también se buscó por listado de referencias y búsqueda libre.
-
Criterios de inclusión y exclusión
Se realizó la búsqueda sin limite de tiempo ni de idioma, seleccionando artículos originales enfocados en coadyuvantes en anestesia espinal, se seleccionaron en orden de prioridad revisiones sistemáticas y meta análisis, en caso de no contar con los mismos se eligieron ensayos clínicos controlados y por último estudios observacionales.
-
Resultados
Luego de eliminar duplicados y seleccionar los artículos enfocados al objetivo de describir los coadyuvantes con mejor soporte en anestesia espinal se seleccionaron 36 artículos que se sintetizan en forma de revisión narrativa.
-
Desarrollo del tema
Breve aproximación a la fisiología de transmisión de dolor
El proceso de sensación de dolor está compuesto por cuatro procesos elementales: transducción, transmisión, percepción y modulación. Desde la periferia al sistema integrativo cerebral,
la señal dolorosa es facilitada por un complejo sistema de estructuras neuronales que sirven para modular la experiencia de percepción del dolor. Los procesos clave en la nocicepción involucran la transducción a través de elementos receptores especializados y el ganglio de la raíz dorsal, la transmisión por medio de tractos ascendentes de la médula espinal, tallo cerebral y la modulación en el tálamo y corteza cerebral[1].
La médula espinal es el primer sitio de relevo en la transmisión de la información nociceptiva. Las señales sensitivas son emitidas desde la periferia por fibras aferentes hacia el asta dorsal de la médula espinal donde hacen sinapsis con las neuronas propias del asta. La materia gris espinal contiene los cuerpos celulares de las neuronas espinales y la materia blanca contiene los axones que ascienden hacia o descienden desde el cerebro. La materia gris ha sido subdividida en 10 láminas; desde la I a la IV corresponde al asta dorsal. Las fibras C y A delta terminan, en su mayoría, en las láminas I y II, aunque algunas A delta hacen sinapsis en la lámina V[2],[3] (Figura 1). Esto es de suma importancia ya que brinda el sustrato anatómico en el que ejercen efecto los anestésicos locales y los coadyuvantes en la anestesia espinal.
Opioides: receptores opioides en láminas I y II del asta dorsal.
Clonidina: receptores a2 en fibras C pre-sinápticas y a las neuronas post-sinápticas del asta dorsal de la médula espinal.
Dexmedetomidina: receptores a2 en fibras C pre-sinápticas
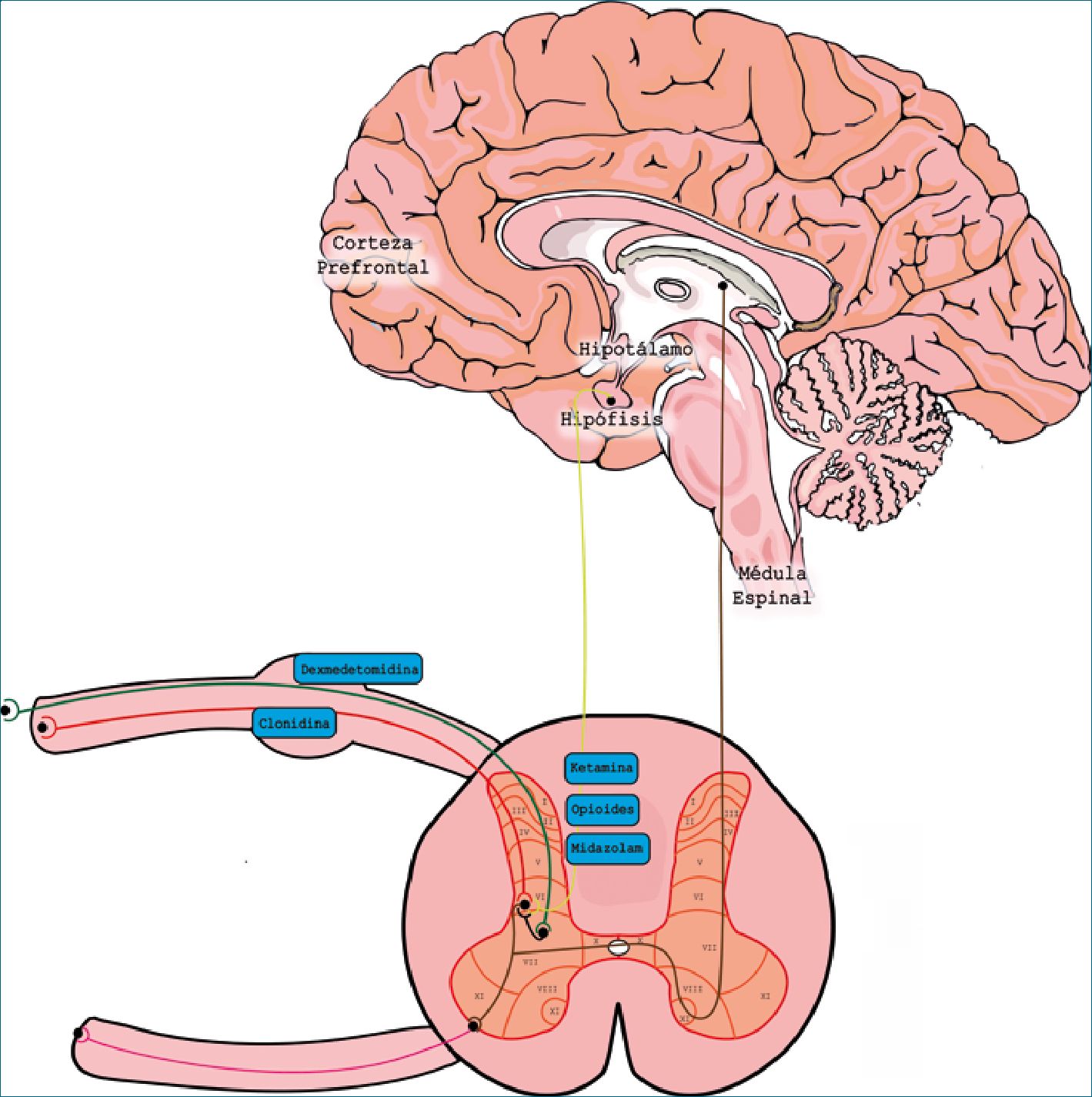
Figura 1. Sitios de acción de los coadyuvantes.
y a las neuronas post-sinápticas del asta dorsal de la médula espinal + bloqueo de las corrientes catiónicas que reversan las neuronas del estado hiperpolarizado al potencial de reposo en fibras C y A delta.
Ketamina: receptor NMDA: inhibición competitiva; también se ha propuesto que actúa sobre canales de calcio sensibles al voltaje, receptores monoaminérgicos y opioides.
Midazolam: acción mediada por el receptor GABA ya que este está altamente concentrado en la lámina II del asta dorsal de la médula espinal.
-
Anestesia espinal
La anestesia espinal se define como la administración de anestésicos locales cerca de la médula espinal para abolir la percepción del estímulo doloroso. Las moléculas no ionizadas del anestésico local cruzan las membranas celulares neuronales. Dentro de las células se disocian y alcanzan un nuevo estado de equilibrio entre moléculas ionizadas y no ionizadas dependiendo del pH celular y el pKa del anestésico. La forma ionizada se une al canal de sodio en conformación abierta y lo estabiliza en la forma inactivada, lo que previene la transmisión neuronal[4],[5].
Esta técnica anestésica es de suma importancia en la práctica del anestesiólogo. De acuerdo con datos del NAP 3, se usan técnicas neuroaxiales en 8%-10% de todas las cirugías realizadas en Reino Unido y se calcula que se realizan 700.000 bloqueos neuroaxiales cada año en esta región del mundo. Según la base de datos de anestesia obstétrica de este país, los bloqueos neuroaxiales se usaron en casi 90% de las cesáreas y hasta en 25% de los trabajos de parto no quirúrgicos. Además, según el registro británico de cirugías articulares, se usó anestesia neuroaxial en 60% de las artroplastias de cadera y 50% en artroplastia de rodilla. En una encuesta realizada a anestesiólogos de esta región, se encontró que el 75% de los anestesiólogos prefería usar técnicas neuroaxiales para cirugías de fractura de cuello femoral[6].
La anestesia espinal ha sido evaluada en diversas poblaciones quirúrgicas en comparación a la anestesia general. A pesar de que los resultados son poco consistentes, en algunos modelos quirúrgicos, principalmente en cirugía ortopédica mayor, se ha encontrado beneficio de la anestesia espinal en términos de mortalidad y complicaciones pulmonares posoperatorias[7]. De hecho, en un metaanálisis de varias revisiones Cochrane en diferentes modelos quirúrgicos, se encontró una posible reducción en mortalidad a 30 días y neumonía en los pacientes que tuvieron como técnica anestésica la anestesia espinal, con una calidad de la evidencia calificada como moderada[8].
La duración del efecto de los anestésicos locales en la anestesia espinal está determinada por diversos factores como el medicamento elegido, la dosis, densidad de la solución y la dispersión en los niveles de la médula espinal (Tabla 1)[9].
-
Coadyuvantes en anestesia neuroaxial
La justificación para el uso de coadyuvantes en la anestesia espinal es que los anestésicos locales pueden estar limitados por la duración de acción para procedimientos quirúrgicos prolongados y por los efectos adversos que se generan con el aumento de la dosis como la inestabilidad hemodinámica. Los coadyuvantes son medicamentos que se administran de forma concomitante para aprovechar un efecto sinérgico que puede mejorar la latencia de inicio de acción, duración del bloqueo neuroaxial y reducir los efectos adversos. En este escrito se clasificarán estos medicamentos en opioides, como la morfina y el fentanil, y no opioides como los alfa 2 agonistas, ketamina y midazolam[10] se resumen sus características en la Tabla 2.
-
Coadyuvantes opioides
Como se describió previamente, la información nociceptiva es transmitida a través de fibras C y A delta. Cuando estas son activadas se liberan neurotransmisores excitatorios como la sustancia P que contribuyen a la percepción del dolor. Existen receptores opioides en las láminas I y II, precisamente donde hacen sinapsis las fibras mencionadas, donde bloquean la liberación de sustancia P a través del GABA en la neurona presináptica y de la glicina en la postsináptica[11].
Las propiedades farmacológicas de los opioides determinan la velocidad de inicio de acción, duración del efecto y perfil de efectos adversos cuando se administran en el espacio subaracnoideo.
La liposolubilidad es una de las características más importantes. Los opioides lipofílicos, como el fentanil, tienen un inicio de acción más rápido y una duración del efecto más corta; rápidamente luego de la inyección, los niveles en el LCR no son detectables porque el medicamento se distribuye en la médula y grasa epidural. Esto puede resultar en una dispersión más segmentaria de la analgesia, con poco medicamento alcanzando el cerebro, por lo que teóricamente debería tener menor riesgo de depresión respiratoria.
Por otra parte, los opioides hidrofílicos, como la morfina, tienen un inicio de acción más lento, mayor duración del efecto y son detectables en el LCR por largo tiempo luego de la inyección; esto permite que el medicamento circule hacia cefálico y mayores concentraciones alcancen el cerebro, produciendo mayor riesgo de depresión respiratoria[11],[12].
Tabla 1. Duración de diferentes anestésicos locales espinales
| Agente y concentración | Baricidad y volumen usual (ml) | Dosis total (mg) | Duración usual (min) |
| Lidocaína 2% | Isobárica 2 – 4 ml | 40 – 80 | 90 – 180 |
| Bupivacaína 0,5% | Isobárica 2 – 4 ml | 10 – 20 | 90 – 180 |
| Bupivacaína 0,5% + dextrosa | Hiperbárica 2 – 4 ml | 10 – 20 | 90 – 180 |
| Levobupivacaína 0,75% | Isobárica 1,5 – 2 ml | 10 – 15 | 135 – 170 |
| Fuente: Veering BT[9]. |
Tabla 2. Resumen de principales coadyuvantes en anestesia espinal
| Coadyuvante y dosis | Población quirúrgica Beneficios | Riesgos |
| Morfina 100-200 ug | Cirugía ortopédica, gineco- Analgesia prolongada (hasta 24 h) obstétrica, abdominal | Náuseas, vómito, prurito Sin diferencia en depresión respiratoria con dosis < 300 ug |
| Fentanil 10-25 ug | Cirugía ortopédica, ginecológica, Suplementa anestesia. No aumenta el urológica, vascular bloqueo motor y reduce hipotensión
intraoperatoria |
Náuseas, vómito, prurito |
| Clonidina 15-40 ug | Cirugía ortopédica, urológica, Prolonga tiempo de anestesia espinal y ginecológica y abdominal hasta 1er requerimiento analgésico | Hipotensión, bradicardia y sedación |
| Dexmedetomidina 5-10 ug | Cirugía ortopédica, abdominal, Prolonga tiempo de anestesia espinal urológica y hasta 1er requerimiento analgésico. | Hipotensión, bradicardia. |
| Ketamina 0,05-0,1 mg/kg | Cirugía ortopédica, abdominal y Prolonga tiempo de bloqueo sensitivo y cesárea hasta 1er requerimiento analgésico | Efectos adversos neurológicos (dosis altas). Poca evidencia disponible |
| Midazolam 1-2,5 mg | Cirugía ortopédica, abdominal y Prolongación hasta el 1er requerimiento ginecológica analgésico. Reducción de náuseas y
vómito posoperatorio |
Sedación. Poca evidencia disponible |
| Fuente: Autores. |
-
Morfina
El uso de morfina libre de preservativos ha demostrado buen efecto analgésico a dosis de 100-200 ug intratecal, especialmente en población llevada a cesárea y cirugía ortopédica. Por su naturaleza hidrofílica resulta en dispersión cefálica y aumento del área de analgesia, pero se debe tener en cuenta que se asocia con efectos adversos como náuseas y vómito, prurito, retención urinaria y depresión respiratoria[10].
En cirugía ortopédica como artroplastia total de cadera, la morfina intratecal ha sido comparada con infiltración periarti- cular por parte del cirujano con anestésico local y antiinflamatorio no esteroideo, donde se encontró mejores puntajes de dolor iniciales, pero el dolor con la movilización fue peor y hubo más efectos adversos[13]. También hay un ensayo clínico alea- torizado que la compara con bloqueo de la fascia iliaca en el que obtuvo mejores puntajes de dolor en las primeras 24 h, sin aumento de los efectos adversos[14]. En cuanto a la dosis, hay evidencia que sugiere que 50 ug provee peor analgesia en las primeras 24 h en comparación con 100 y 200 ugs. Entre 100 y 200 ug no parece haber diferencia en eficacia analgésica, pero la dosis más alta se asocia con mayor incidencia de prurito[15].
La morfina espinal también se usa de forma frecuente para analgesia en el posoperatorio de cesárea. En el año 2016 se publicó un metaanálisis sobre el efecto de la dosis de morfina intratecal en los desenlaces luego de cesárea electiva; se compararon dosis bajas (50-100 ug) y dosis altas (> 100 ug). Se encontró que las dosis altas pueden proveer analgesia de mayor duración, pero se asocia a mayor incidencia de efectos adversos como prurito y vómito[16].
En cirugía abdominal, en el año 2020 se publicó un metaanálisis que tenía como objetivo cuantificar los riesgos y beneficios de los opioides hidrofílicos intratecales. Treinta y siete de los 40 ensayos clínicos aleatorizados incluidos se realizaron con morfina y se usaron dosis desde 100 ug hasta 800 ug. En los resultados se evidenció una reducción en el consumo de equivalentes de morfina IV en las primeras 24 y 48 h, menores puntajes de dolor en reposo y movimiento y mayor tiempo hasta el primer requerimiento analgésico. La incidencia de prurito
fue mayor en los pacientes que recibieron morfina intratecal. En cuanto a la depresión respiratoria, esta fue más frecuente en el grupo de morfina; sin embargo, cuando se excluyeron los estudios que usaron dosis mayores a 500 ug, no hubo diferencias estadísticamente significativas[17].
En la trayectoria del uso de la morfina espinal se ha usado un rango de dosis desde 50 ug hasta 2,5 mg, pero recientemente se ha favorecido el uso de dosis bajas (100-200 ug) para reducir efectos adversos y complicaciones. Hay series descritas, como la de Gwirtz et al., que reportó una incidencia de depresión respiratoria de 3% en sus pacientes[18]. En el año 2009 se publicó una revisión sistemática de ensayos clínicos que compararan la morfina intratecal con el placebo para observar las diferencias en efectos adversos como náuseas, vómito, prurito y depresión respiratoria. La morfina resultó en un aumento de la incidencia de náuseas, vómito y prurito; sin embargo, en el desenlace de depresión respiratoria no hubo diferencias con las dosis menores de 300 ug.
La morfina espinal es un coadyuvante sumamente valioso, ya que en comparación con los demás, es el único que provee analgesia duradera en el posoperatorio. La dosis de 100 ug es la que se ha encontrado en la literatura que mejor balancea la efectividad y los efectos adversos.
-
Fentanil
Como coadyuvante para anestesia espinal se ha recomendado a dosis de 10-25 ug. Este medicamento causa prolongación y extensión significativa de la analgesia sin aumentar el tiempo de bloqueo motor. Tiene un inicio de acción de 10 a 15 minutos y una duración del efecto de 2 a 4 h[19].
Se ha mostrado que el fentanil suplementa la anestesia espinal, pero esto no demuestra que el sitio de acción principal resida en la médula espinal ya que hay estudios que muestran que un gran porcentaje de este medicamento se distribuye al espacio y grasa epidural y luego al plasma, lo que puede sugerir que la analgesia se induzca a través de una acción sistémica en lugar de la acción espinal. Por esto, se diseñó un ensayo clínico en pacientes llevadas a cesárea a quienes se les administró bupivacaína hiperbárica junto con 12,5 ug de fentanil intravenoso o intratecal. Se evidenció que ninguna paciente del grupo de fentanil espinal requirió suplementación analgésica en el intraoperatorio en comparación con 32% de las que lo recibieron intravenoso. Además, hubo menor incidencia de hipotensión y necesidad de uso de vasopresor en el grupo de fentanil intratecal. Se concluyó entonces que la administración de fentanil intratecal suplementa de mejor manera la anestesia espinal y que se asocia con menor incidencia de efectos adversos en comparación con la administración intravenosa[20].
La evidencia en cesárea para el fentanil ha sido condensada en un meta análisis en el que se investigó la seguridad y la eficacia, esta última en términos de éxito de la anestesia espinal y necesidad de suplementar la analgesia en el intraoperatorio. Se incluyeron ensayos clínicos que compararan la administración de bupivacaína con bupivacaína y fentanil intratecal. Se encontró que solo 4,6% de las pacientes del grupo de fentanil requirió suplementación de la analgesia en comparación con casi el 30% del grupo control. En otros desenlaces, el fentanil se asoció con menor riesgo de náuseas y vómito intraoperato- rio, mayor incidencia de prurito, pero no hubo diferencia en la- tencia de la anestesia, duración del bloqueo motor y depresión respiratoria[21]. Adicional a esto, se realizó otro meta análisis en el que se incluyó población quirúrgica diversa (ortopedia, ginecología, urología, cirugía vascular) que tuvo como objetivo evaluar si la adición de un opioide a una dosis baja de anestésico local se asociaba con reducción de efectos adversos sin reducir el éxito de la anestesia espinal. Se incluyeron ensayos clínicos que compararan anestésico local a dosis estándar contra una dosis reducida de este medicamento (en promedio una reducción del 40% de la dosis) y opioide, que en la mayoría de los casos fue fentanil. No se encontraron diferencias en la necesidad de suplementar la analgesia con opioide IV o conversión a anestesia general, hubo menor incidencia de hipotensión y escalofríos, pero más riesgo de prurito. Además, el tiempo de duración de la analgesia fue similar, pero el tiempo de bloqueo motor y estancia en la unidad de cuidados postanestésicos fue menor, por lo que este régimen puede ser atractivo en cirugía ambulatoria[22].
A la luz de la evidencia, el fentanil es un adyuvante muy útil en varios contextos quirúrgicos, ya que permite reducir la dosis del anestésico local, y en consecuencia sus efectos adversos relacionados como la hipotensión, sin disminuir la efectividad de la anestesia espinal. Además, usado a dosis bajas su perfil de riesgo/beneficio es adecuado, sin aumentar el tiempo de que pasan los pacientes en la unidad de cuidados postanestésicos.
Uso conjunto de morfina y fentanil: como se ha expresado previamente, estos opioides tienen cinéticas diferentes cuando se administran en el espacio subaracnoideo. Estas diferencias en el perfil farmacocinético abren la puerta a la administración conjunta. El fentanil suplementaría el efecto del anestésico local para tener una analgesia segmentaria más densa durante la cirugía, mientras que la morfina proveería analgesia postoperatoria de larga duración. Sin embargo, hay 3 ensayos clínicos en los que se evaluó esta combinación y no se encontró diferencia en puntajes de dolor posoperatorio ni en la satisfacción de los pacientes, pero sí hubo más riesgo de náuseas y vómito, prurito e incluso se encontró mayor consumo de opioides en las primeras 12 h luego del procedimiento[23],[24],[25]. Teniendo en cuenta lo anterior, el perfil de riesgo y beneficio de esta combinación por vía intratecal es incierto y se debería estudiar más a profundidad en estudios clínicos de alta calidad.
Coadyuvantes no opioides
-
Clonidina
Este medicamento pertenece a la familia de los alfa 2 agonistas; se ha descrito que este tipo de medicamentos se unen a las fibras C pre-sinápticas y a las neuronas post-sinápticas del asta dorsal de la médula espinal. Producen la analgesia al reducir la liberación de neurotransmisores pre-sinápticos e hiperpo- larizar las neuronas post-sinápticas. Actualmente, se recomienda a dosis entre 15 y 40 ug intratecal con el fin de reducir el impacto hemodinámico que puede generar[19].
En el año 2008 se publicó una revisión sistemática que tenía como fin cuantificar los posibles beneficios y riesgos de la clonidina como adyuvante intratecal de los anestésicos locales. Se incluyeron 22 ensayos clínicos con 1.445 pacientes programados para cirugía ortopédica, urológica, ginecológica y abdominal, y se usaron dosis entre 15 y 150 ug. Se evidenció que la clonidina prolonga el bloqueo sensitivo, motor y el tiempo hasta el primer requerimiento analgésico. Sin embargo, en los pacientes que recibieron la clonidina hubo mayor riesgo de hipotensión y tendencia a mayor incidencia de bradicardia[26].
La evidencia frente al fentanil es escasa. Hay un ensayo clínico aleatorizado en el que se comparó la administración de 50 ug de fentanil con 50 ug de clonidina para anestesia espinal con 12,5 mg de bupivacaína en pacientes sometidos a cirugía ortopédica de miembro inferior. La clonidina se asoció con mayor tiempo de bloqueo sensitivo, motor y hasta el primer requerimiento analgésico de forma significativa. No hubo diferencias en variables hemodinámicas, pero la sedación fue más frecuente en el grupo de clonidina[27].
-
Dexmedetomidina
Al igual que la clonidina es un alfa 2 agonista, pero es 7 veces más selectivo por este receptor. Se ha usado a dosis de 5-10 ug intratecal. Además del efecto descrito anteriormente para la clonidina, parece que tiene un efecto periférico perineural en el que bloquea las corrientes catiónicas que normalmente reversan las neuronas del estado hiperpolarizado al potencial de reposo. Este efecto es más pronunciado en las fibras C y A delta que en las fibras motoras; por esto, en teoría, este medicamento confiere analgesia mientras preserva la actividad motora[19],[28].
Los estudios preclínicos y clínicos sugieren que la administración de dexmedetomidina vía intratecal es bien tolerada y no genera neurotoxicidad. Incluso hay estudios con dosis altas (2040 ug/kg) en los que no se encontraron signos de daño axonal o de la mielina[28].
En un primer meta análisis publicado en el año 2013 en el que se incluyeron 4 estudios con dexmedetomidina intratecal en pacientes llevados a cirugía bajo anestesia espinal se demostró que este medicamento puede prolongar el bloqueo sensitivo y motor hasta en 90 minutos. No hubo diferencia en efectos adversos como náuseas y vómito postoperatorio, escalofríos o hipotensión; sin embargo, hubo un aumento del riesgo de 7 veces en la necesidad de requerimiento de atropina para corrección de bradicardia[29]. Posteriormente, en el 2020, se publicó otro metaanálisis con 25 ensayos clínicos y 1.478 pacientes, en
el que se observó nuevamente que la dexmedetomidina prolonga el tiempo de bloqueo sensitivo, motor y hasta el primer requerimiento analgésico; no obstante, hubo mayor riesgo de bradicardia transitoria y de hipotensión[30]. Por otra parte, en un metaanálisis publicado este mismo año con 24 ensayos clínicos y 1.460 pacientes, se encontró que la dexmedetomidina intratecal prolongó el tiempo hasta el primer requerimiento analgésico casi 200 minutos en comparación con el anestésico local sin adyuvante y no se asoció con efectos adversos hemodinámicos e incluso redujo la incidencia de escalofrío en el postoperatorio[31].
Por tanto, a pesar de que este medicamento es efectivo como un coadyuvante para la anestesia espinal, parece que sus efectos en el sistema cardiovascular son importantes y hace falta evidencia que lo compare de forma directa con otros coadyuvantes más sedimentados en la práctica como el fentanil.
-
Ketamina
Su mecanismo de acción intratecal no está completamente entendido. Se ha reportado que por su alta liposolubilidad tiene una rápida difusión al sistema venoso y ejerce su efecto a nivel sistémico. Por otra parte, otros estudios sugieren que la ketamina intratecal se une al sitio de la fenciclidina en el receptor NMDA y lo inhibe de forma competitiva; también se ha propuesto que actúa sobre canales de calcio sensibles al voltaje, receptores monoaminérgicos y opioides[32]. Se debe tener en cuenta que se recomienda el uso de ketamina libre de preservativos y que las dosis espinales mayores de 0,75 mg/kg se asociaron con la incidencia de efectos adversos neurológicos como nistagmo, alteraciones psicomiméticas y alucinaciones[33].
La evidencia del uso de ketamina intratecal se reunió en un metaanálisis publicado en el año 2021 en el que se incluyeron 11 ensayos clínicos y se analizaron desenlaces de efectividad, pero no de efectos adversos. Los resultados indican que la ketamina espinal genera un aumento estadísticamente significativo en el tiempo de bloqueo sensitivo y hasta el primer requerimiento de analgesia, sin diferencias en el inicio del bloqueo ni en la duración del bloqueo motor[34]. En comparación con fentanil, no parece que la ketamina prolongue el tiempo hasta el primer requerimiento analgésico y tampoco hay diferencia en el tiempo para inicio del bloqueo sensitivo ni motor[35].
-
Midazolam
Ejerce su efecto al ocupar el receptor del GABA, el mayor neurotransmisor inhibitorio cerebral. Estos receptores se encuentran en el bulbo olfativo, corteza cerebral, cerebelo, hipocampo, tallo cerebral y médula espinal. Cuando se da la activación de este receptor se abren los canales de cloro y se hiperpolariza la célula, por lo que se hace resistente a la excitación neuronal. El midazolam intratecal puede producir analgesia probablemente debido a su acción mediada por el receptor GABA ya que este está altamente concentrado en la lámina II del asta dorsal de la médula espinal, una región importante la transmisión de información dolorosa y de la temperatura; también se han propuesto otros mecanismos, como actividad en los receptores opioides[36]. El midazolam intratecal ha sido evaluado en diversos modelos quirúrgicos como ortopedia, obstetricia y cirugía general. Ha demostrado prolongar el tiempo hasta el primer requerimiento analgésico hasta en casi 100 minutos y reducir la incidencia de náuseas y vómito posoperatorio[37]. Se publicó recientemente un ensayo clínico en pacientes pediátricos de entre 6 y 8 años programados para cirugía abdominal infraumbilical en el que se comparó la administración de midazolam (0,5 mg) y fentanil (0,2 ug/kg) intratecales en conjunto con bupivacaína al 0,5% (0,3 mg/kg). Se encontró que el grupo de pacientes a quienes se les administró midazolam tuvo un mayor tiempo hasta el primer requerimiento analgésico (80 minutos), mayor satisfacción de la familia y menor consumo total de analgésicos en comparación con el grupo de fentanil, sin diferencias en efectos adversos importantes[38]. Sin embargo, hace falta más evidencia de alta calidad que compare este medicamento con otros coadyuvantes para esclarecer su dosis apropiada, beneficios y efectos adversos con mayor certeza.
Conclusiones
Los coadyuvantes para la anestesia espinal son medicamentos que tienen como intención aprovechar un efecto sinérgico con los anestésicos locales que puede mejorar la latencia de inicio de acción, duración del bloqueo neuroaxial y reducir los efectos adversos. Los opioides intratecales son los que tienen evidencia más sedimentada; la morfina espinal a dosis bajas puede mejorar la analgesia para el posoperatorio con bajo riesgo de depresión respiratoria y el fentanil permite reducir la dosis de anestésico local sin aumentar el riesgo de falla de la técnica raquídea. Por otra parte, los alfa 2 agonistas no parecen aportar algún beneficio clínicamente importante en comparación con el fentanil y pueden aumentar el riesgo de efectos adversos hemodinámicos. Por último, la ketamina y el midazolam parecen ser seguros por vía intratecal, pero se requieren estudios adicionales para esclarecer si tienen alguna ventaja en comparación con los demás coadyuvantes.
Referencias
1. Grubb S, Pasvankas GW. Anatomy and Physiology: Mechanisms of Nociceptive Transmission. Academic Pain Medicine. Springer International Publishing; 2019. pp. 1–7. https://doi.org/10.1007/978-3-030-18005-8_1.
2. D’Mello R, Dickenson AH. Spinal cord mechanisms of pain. Vol. 101, British Journal of Anaesthesia. Oxford University Press; 2008. p. 8–16. https://doi.org/10.1093/bja/aen088.
3. Bridgestock C, Rae CP. Anatomy, physiology and pharmacology of pain. Vol. 14, Anaesthesia and Intensive Care Medicine. Elsevier Ltd; 2013. p. 480–3. https://doi.org/10.1016/j.mpaic.2013.08.004.
4. Chin A, Van Zundert A. Spinal anesthesia. En: HADZIC’S TEXTBOOK OF REGIONAL ANESTHESIA AND ACUTE PAIN MANAGEMENT. 2nd editio. 2017. p. 328369.
5. Taylor A, McLeod G. Basic pharmacology of local anaesthetics. Vol. 20, BJA Education. Elsevier Ltd; 2020. p. 34–41. https://doi.org/10.1016/j.bjae.2019.10.002.
6. Cook TM, Counsell D, Wildsmith JA; Royal College of Anaesthetists Third National Audit Project. Major complications of central neuraxial block: report on the Third National Audit Project of the Royal College of Anaesthetists. Br J Anaesth. 2009 Feb;102(2):179–90. https://doi.org/10.1093/bja/aen360 PMID:19139027
7. Memtsoudis SG, Cozowicz C, Bekeris J, Bekere D, Liu J, Soffin EM, et al. Anaesthetic care of patients undergoing primary hip and knee arthroplasty: consensus recommendations from the International Consensus on Anaesthesia-Related Outcomes after Surgery group (ICAROS) based on a systematic review and meta-analysis. Vol. 123, British Journal of Anaesthesia. Elsevier Ltd; 2019. p. 269–87.
8. Guay J, Choi P, Suresh S, Albert N, Kopp S, Pace NL. Neuraxial blockade for the prevention of postoperative mortality and major morbidity: An overview of Cochrane systematic reviews. Vol. 2014, Cochrane Database of Systematic Reviews. John Wiley and Sons Ltd; 2014.
9. Veering BT, Stienstra R. Duration of Block: Drug, Dose, and Additives. Vol. 23. Reg Anesth Pain Med. 1998;23(4):352–6. https://doi.org/10.1016/S1098-7339(98)90005-0.
10. Prabhakar A, Lambert T, Kaye RJ, Gaignard SM, Ragusa J, Wheat S, et al. Adjuvants in clinical regional anesthesia practice: A comprehensive review. Vol. 33, Best Practice and Research: Clinical Anaesthesiology. Bailliere Tindall Ltd; 2019. p. 415–23.
11. Conlin N, Grant MC, Wu CL. Intrathecal Opioids for Postoperative Pain. Essentials of Pain Medicine. Elsevier; 2018. pp. 123–128.e1. https://doi.org/10.1016/B978-0-323-40196-8.00014-0.
12. Ummenhofer WC, Arends RH, Shen DD, Bernards CM. Comparative Spinal Distribution and Clearance Kinetics of Intrathecally Administered Morphine, Fentanyl, Alfentanil, and Sufentanil [Internet]. Vol. 92, LABORATORY INVESTIGATIONS Anesthesiology. 2000. Disponible en: http://pubs.asahq.org/anesthesiology/article-pdf/92/3/739/400139/0000542-200003000-00018.pdf
13. Kuchálik J, Granath B, Ljunggren A, Magnuson A, Lundin A, Gupta A. Postoperative pain relief after total hip arthroplasty: a randomized, double-blind comparison between intrathecal morphine and local infiltration analgesia. Br J Anaesth. 2013 Nov;111(5):793–9. https://doi.org/10.1093/bja/aet248 PMID:23872462
14. Kearns R, Macfarlane A, Grant A, Puxty K, Harrison P, Shaw M, et al. A randomised, controlled, double blind, non-inferiority trial of ultrasound-guided fascia iliaca block vs. spinal morphine for analgesia after primary hip arthroplasty. Anaesthesia. el 1 de diciembre de 2016;71(12):1431–40.
15. Murphy PM, Stack D, Kinirons B, Laffey JG. Optimizing the dose of intrathecal morphine in older patients undergoing hip arthroplasty. Anesth Analg. 2003 Dec;97(6):1709–15. https://doi.org/10.1213/01.ANE.0000089965.75585.0D PMID:14633547
16. Sultan P, Halpern SH, Pushpanathan E, Patel S, Carvalho B. The Effect of Intrathecal Morphine Dose on Outcomes after Elective Cesarean Delivery: A Meta-Analysis. Anesth Analg. el 1 de julio de 2016;123(1):154–64. https://doi.org/10.1213/ANE.0000000000001255.
17. Koning M V., Klimek M, Rijs K, Stolker RJ, Heesen MA. Intrathecal hydrophilic opioids for abdominal surgery: a meta-analysis, meta-regression, and trial sequential analysis. Vol. 125, British Journal of Anaesthesia. Elsevier Ltd; 2020. p. 358–72. https://doi.org/10.1016/j.bja.2020.05.061.
18. Gwirtz KH, Young JV, Byers RS, Alley C, Levin K, Walker SG, et al. The Safety And Efficacy of Intrathecal Opioid Analgesia for Acute Postoperative Pain: Seven Years’ Experience with 5969 Surgical Patients at Indiana University Hospital [Internet]. Disponible en: http://journals.lww.com/anesthesia-analgesia
19. Swain A, Nag DS, Sahu S, Samaddar DP. Adjuvants to local anesthetics: current understanding and future trends. World J Clin Cases. 2017 Aug;5(8):307–23. https://doi.org/10.12998/wjcc.v5.i8.307 PMID:28868303
20. Siddik-Sayyid SM, Aouad MT, Jalbout MI, Zalaket MI, Berzina CE, Baraka AS. Intrathecal versus intravenous fentanyl for supplementation of subarachnoid block during cesarean delivery. Anesth Analg. 2002 Jul;95(1):209–13. https://doi.org/10.1097/00000539-200207000-00037 PMID:12088970
21. Uppal V, Retter S, Casey M, Sancheti S, Matheson K, McKeen DM. Efficacy of Intrathecal Fentanyl for Cesarean Delivery: A Systematic Review and Meta-analysis of Randomized Controlled Trials With Trial Sequential Analysis. Anesth Analg. el 1 de enero de 2020;130(1):111–25. https://doi.org/10.1213/ANE.0000000000003975.
22. Pöpping DM, Elia N, Wenk M, Tramèr MR. Combination of a reduced dose of an intrathecal local anesthetic with a small dose of an opioid: a meta-analysis of randomized trials. Pain. 2013 Aug;154(8):1383–90. https://doi.org/10.1016/j.pain.2013.04.023 PMID:23731835
23. Carvalho B, Drover DR, Ginosar Y, Cohen SE, Riley ET. Intrathecal fentanyl added to bupivacaine and morphine for cesarean delivery may induce a subtle acute opioid tolerance. Int J Obstet Anesth. enero de 2012;21(1):29–34. https://doi.org/10.1016/j.ijoa.2011.09.002.
24. Karaman S, Günüsen I, Uyar M, Biricik E, Firat V. The effects of morphine and fentanyl alone or in combination added to intrathecal bupivacaine in spinal anesthesia for cesarean section. Agri. abril de 2011;23(2):57–63.
25. Weigl W, Bieryło A, Wielgus M, Krzemiel-Wiczyńska Ś, Kołacz M, Dabrowski MJ. Perioperative analgesia after intrathecal fentanyl and morphine or morphine alone for cesarean section. Med (United States). el 1 de diciembre de 2017;96(48). https://doi.org/10.1097/MD.0000000000008892.
26. Elia N, Culebras X, Mazza C, Schiffer E, Tramèr MR. Clonidine as an Adjuvant to Intrathecal Local Anesthetics for Surgery: Systematic Review of Randomized Trials. Reg Anesth Pain Med. marzo de 2008;33(2):159–67.
27. Routray SS, Raut K, Pradhan A, Dash A, Soren M. Comparison of intrathecal clonidine and fentanyl as adjuvant to hyperbaric bupivacaine in subarachnoid block for lower limb orthopedic surgery. Anesth Essays Res. 2017;11(3):589–93. https://doi.org/10.4103/aer.AER_91_17 PMID:28928553
28. Marhofer P, Brummett CM. Safety and efficiency of dexmedetomidine as adjuvant to local anesthetics. Vol. 29, Current Opinion in Anaesthesiology. Lippincott Williams and Wilkins; 2016. p. 632–7. https://doi.org/10.1097/ACO.0000000000000364.
29. Niu XY, Ding XB, Guo T, Chen MH, Fu SK, Li Q. Effects of intravenous and intrathecal dexmedetomidine in spinal anesthesia: A meta-analysis. CNS Neurosci Ther. noviembre de 2013;19(11):897–904. https://doi.org/10.1111/cns.12172.
30. Liu S, Zhao P, Cui Y, Lu C, Ji M, Liu W, et al. Effect of 5-µg Dose of Dexmedetomidine in Combination With Intrathecal Bupivacaine on Spinal Anesthesia: A Systematic Review and Meta-analysis. Vol. 42, Clinical Therapeutics. Excerpta Medica Inc.; 2020. p. 676-690.e5.
31. Paramasivan A, Lopez-Olivo MA, Foong TW, Tan YW, Yap AP. European Journal of Pain. Intrathecal dexmedetomidine and postoperative pain: A systematic review and meta-analysis of randomized controlled trials. Volume 24. United Kingdom: Blackwell Publishing Ltd; 2020. pp. 1215–27.
32. Hirota K, Lambert DG. Ketamine: Its mechanism(s) of action and unusual clinical uses. Vol. 77, British Journal of Anaesthesia. Oxford University Press; 1996. p. 441–4.
33. Hawksworth C, Serpell M. Intrathecal Anesthesia With Ketamine. Vol. 23. Reg Anesth Pain Med. 1998.
34. Sohnen S, Dowling O, Shore-Lesserson L. Single dose perioperative intrathecal ketamine as an adjuvant to intrathecal bupivacaine: A systematic review and meta-analysis of adult human randomized controlled trials. J Clin Anesth. el 1 de octubre de 2021;73.
35. Unlugenc H, Ozalevli M, Gunes Y, Olguner S, Evrüke C, Ozcengiz D, et al. A double-blind comparison of intrathecal S(+) ketamine and fentanyl combined with bupivacaine 0.5% for Caesarean delivery. Eur J Anaesthesiol. diciembre de 2006;23(12):1018–24.
36. Goodchild CS, Guo Z, Musgreave A, Gent JP. Antinociception by intrathecal midazolam involves endogenous neurotransmitters acting at spinal cord delta opioid receptors. Br J Anaesth. 1996 Dec;77(6):758–63. https://doi.org/10.1093/bja/77.6.758 PMID:9014630
37. Ho KM, Ismail H; K. M. HO. Use of intrathecal midazolam to improve perioperative analgesia: a meta-analysis. Anaesth Intensive Care. 2008 May;36(3):365–73. https://doi.org/10.1177/0310057X0803600307 PMID:18564797
38. AbdelRady MM, Abdelrahman KA, Ali WN, Ali AM, AboElfadl GM. Fentanyl versus midazolam added to bupivacaine for spinal analgesia in children undergoing infraumbilical abdominal surgery: A randomized clinical trial. Egypt J Anaesth. 2022;38(1):116–23. https://doi.org/10.1080/11101849.2022.2031810.

 ORCID
ORCID