Adrián Gallardo1,*, Adrián Pablo Dévoli2, Santiago Saavedra3, Patrick Sepúlveda Barisich4, Alberto Gómez-González5, Robert Jones Baro5, María Carolina Cabrera Schulmeyer6
Recibido: 12-08-2022
Aceptado: 08-09-2022
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 1 pp. 95-105|https://doi.org/10.25237/revchilanestv5210111052
PDF|ePub|RIS
Ultrasound in critical care
Abstract
Ultrasound is a pluripotential tool that has been shown to be useful in the diagnostic study and evolutionary control of different pathologies. The use of protocols (BLUE, FALLS, PINK) has shown high diagnostic precision in entities such as pneumonía, pulmonary embolism, pneumothorax, heart failure, diaphragmatic or musculoskeletal evaluation. Its exponential growth has positioned the technique as the preferred option for non-invasive and bedside evaluation. This article proposes a simplified and non-systematic review, of quick and easy reading, of the reasons why ultrasound has become, in recent years, a standard of care for critically ill patients.
Resumen
La ecografía es una herramienta pluripotencial que ha mostrado ser útil en el estudio diagnóstico y control evolutivo de distintas patologías. El empleo de protocolos (BLUE, FALLS, PINK) ha mostrado una alta precisión diagnóstica en entidades como neumonía, embolismo pulmonar, neumotórax, insuficiencia cardíaca, evaluación diafragmática o músculo-esquelética. Su crecimiento exponencial ha posicionado a la técnica como la opción de preferencia para la evaluación no invasiva y a pie de cama. Este artículo propone una revisión simplificada y no sistemática, de lectura rápida y sencilla, de las razones por las cuales la ecografía se ha convertido, en los últimos años, en un estándar de cuidado para los pacientes críticamente enfermos.
-
Introducción
-
Thirteen Reasons Why…
Parafraseando a la popular serie televisiva de 2017, emitida por Netflix, compartimos (en texto, no en cassettes) las razones por las cuales consideramos indispensable el empleo de la ultrasonografía, y el concepto point of care ultrasound (por su traducción en inglés POCUS), en la unidad de cuidados críticos. El curioso estudiante podrá complementar la información que considere relevante en los reconocidos repositorios de información científica: los estudios evaluando y avalando la utilidad de la técnica. Los aportes que brinda el ultrasonido (US) han sido numerosos durante los últimos años y en la actualidad ya se encuentra establecido como parte del examen físico en las unidades de pacientes críticos. Existen distintos protocolos descritos en la literatura: el protocolo FALLS (Fluid Administration Limited by Lung Sonography)[1] es una herramienta para la evaluación hemodinámica de la falla circulatoria utilizando la ultrasonografía pulmonar; el protocolo PINK[2], que está diseñado para evaluar las causas de deterioro del paciente en ventilación mecánica; el protocolo BLUE (Bedside Lung Ultrasound in Emergency)[3] que determina de forma rápida, dicotómica y organizada la etiología de la disnea en el departamento de emergencias.
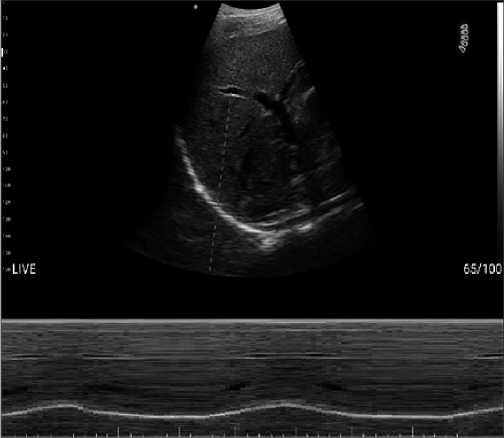
Figura 1. Excursión diafragma derecho. (Equipo pocket Pockus®). Se observa excursión hemidiafragma derecho con sonda sectorial en ventana subcostal y modo M (motion).
Resumimos aquí sólo algunas de sus utilidades y conceptos
-
1. No invasivo. Reproducible. Confiable. Al lado de la cama del paciente (Bedside)
En el año 1957, se publicó el primer trabajo de valoración ecográfica por Doppler de las válvulas cardíacas (Satomura, 1957) y, desde entonces, el uso de la ecografía ha crecido sustancialmente debido a sus numerosas ventajas: es un método no invasivo, inocuo y sin radiación ionizante, por tanto, se pueden realizar repetidas valoraciones sin riesgo para el paciente, como sucedería con una radiografía o tomografía computarizada.
Adicionalmente, se realiza al lado de la cama del paciente, evitando las posibles complicaciones de un traslado a un servicio de imágenes, ofrece factibilidad y repetibilidad las veces que sea necesario. También es de una alta importancia permitir la interpretación diagnóstica inmediata al realizar valoraciones anatómicas y funcionales de diferentes parénquimas. Y una razón fundamental de su alta utilidad es que el mismo operador que realiza el US es el tratante del paciente, es decir, que no se requiere de retransmisión de la información y el médico intentará responder las preguntas respecto al grado de compromiso de los órganos en su paciente crítico.
Distintas compañías han desarrollado equipos portátiles de tamaños muy pequeños, pero con una excelente calidad de imágenes (algunos pueden ser conectados al teléfono celular) con la posibilidad de realizar la valoración a pie de cama.
A través de POCUS no sólo podemos realizar diagnósticos, sino también realizar distintos procedimientos de manera guiada y segura, como punciones lumbares, colocación de accesos venosos o toracocentésis (Abraham, 2019; Smit, 2018; Helgeson, 2019). En el caso de una toracocentesis por ejemplo es posible evaluar la cantidad de líquido que ocupa los espacios pleurales, se puede guiar la aguja para la punción y finalmente evaluar si el derrame quedó bien drenado. En el caso de patología propiamente pulmonar su precisión diagnóstica es muy alta al ser comparado el US con otras tecnicas de imágenes, por ejemplo para detectar neumotórax tiene una una sensibilidad del 81% y especificidad del 100%; para neumonías, 88% y 93%, respectivamente. Para la evaluación del corazón el POCUS es extremadamente útil, permitiendo la evaluación de las cavidades cardíacas y de sus grandes vasos. Así puede conocerse si existe disfunción derecha o ventricular izquierda (69% y 94%; 88% y 96%, sensibilidad y especificidad, respectivamente) (Díaz-Gómez, 2021).
Esta herramienta de tan alta utilidad tiene también una rápida curva de aprendizaje: se requieren 40 a 50 exámenes para garantizar la competencia básica en la mayoría de las técnicas diagnósticas de los diferentes parénquimas a evaluar y a las patologías a diagnosticar (Frankel, 2015).
-
2. Destete del ventilador mecánico (weaning) ecoguiado
Poco más de la mitad del tiempo empleado en ventilación mecánica invasiva (VM) se destina al destete. Reconocer el momento oportuno y preciso para retirar el soporte ventilatorio es difícil y se requiere de experiencia y de un importante conocimiento de la fisiología pulmonar, respiratoria y ventilatoria.
Entre las causas de la falla en la extubación se ha demostrado que la disfunción diafragmática (Theerawit, 2018) cumple un rol fundamental. La evaluación ecográfica permite conocer la estructura y función del diafragma y, al mismo tiempo, evaluar su excursión (Figura 1), fracción de acortamiento o velocidad de contracción. Se han definido valores para cada uno de estos parámetros que permitirán garantizar un proceso exitoso de salida de VM. Durante la prueba de ventilación espontánea, sin presión positiva, el valor de corte para excursión diafragmática es de 1,1 cm siendo un valor menor indicativo de disfunción muscular y probabilidad de fracaso de extubación. Respecto a la fracción de engrosamiento (Figura 2), ha mostrado tener mejor performance como índice predictivo de éxito en extubación siendo su valor de corte > 30%-36% durante la prueba de ventilación espontánea (mayo, 2016).
La fracción de engrosamiento y la excursión del diafragma, conjuntamente, han mostrado ser buenos indicadores del éxito en el proceso de destete en pacientes añosos y en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) (Li, 2021; Zhang, 2020).
Una revisión reciente ha mostrado la utilidad de esta técnica de evaluación con US durante el proceso de weaning no sólo para el diafragma sino también para el conjunto corazón-pulmón (Santangelo, 2022). En donde se ha visto que el adecuado balance de los fluidos encontrados en el parénquima pulmonar, expresados como líneas B y la función del VI será un excelente predictor para un weaning exitoso.
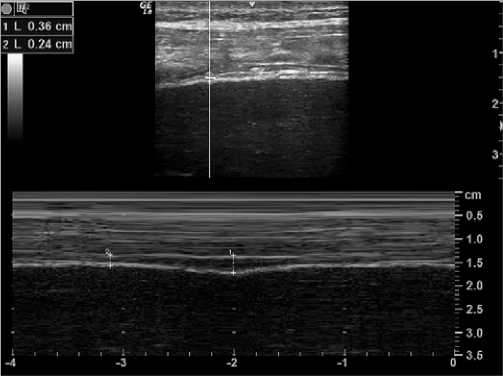
Figura 2. Fracción de engrosamiento diafragmático en prueba de ventilación espontanea. Se observa mediante sonda lineal en zona de aposición en modo M (motion) medición de grosor del diafragma en inspiración (1) 0,36 cm y espiración (2) 0,24 cm. Fracción de engrosamiento: 50%.
-
3. Titulación de PEEP
La titulación de presión positiva al final de la espiración (PEEP) ha sido tema de debate recurrente. Se han descripto variadas técnicas y procedimientos utilizando la presión esofágica, la presión meseta, el índice de stress o la tomografía por impedancia eléctrica, entre otras. La propuesta de la ultrasonografía como método de titulación de PEEP, en tiempo real y a pie de cama, ha cobrado relevancia en los últimos años apareciendo como una alternativa eficaz y con muy buena correlación con las técnicas previamente descriptas. Se ha reportado correlación significativa entre el cambio de volumen pulmonar inducido por PEEP, medido por curva presión-volumen y variación del puntaje LUS, conjuntamente con una correlación estadísticamente significativa entre el cambio del puntaje LUS y el aumento en la PaO2 inducido por PEEP (Shen, 2014; Bouhemad, 2010).
Si bien no ha mostrado superioridad por sobre el resto de los métodos, ni reducción en los días de ventilación mecánica o la mortalidad, la ecografía ha mostrado ser de utilidad para detectar el punto final del reclutamiento pulmonar y la mejor PEEP (Figura 3), con efectos sobre la distensibilidad pulmonar y mejoría de la oxigenación (Tang, 2017).
-
4. Ultrasonido pulmonar
Durante muchos años el ultrasonido estuvo proscrito para la evaluación del parénquima pulmonar aduciendo a que el aire presente en los pulmones normales es un pésimo conductor del US. Siendo esto completamente verdadero se comenzó a estudiar y a trabajar con los artefactos que se generan con el US al ir atravesando los músculos intercostales, la pleura y la reverberación de ésta en el parénquima pulmonar, llamadas líneas A (Figura 4). Estas líneas se caracterizan por ser equidistantes una de otra y están presentes hasta el borde de la pantalla.
Así cuando existe patología pulmonar desaparecen las líneas A y estas son reemplazadas por líneas B, que corresponde a pérdida de aireación; ya sea por líquido a nivel alveolo-intersticial, engrasamiento septal o atelectasia/condensación.
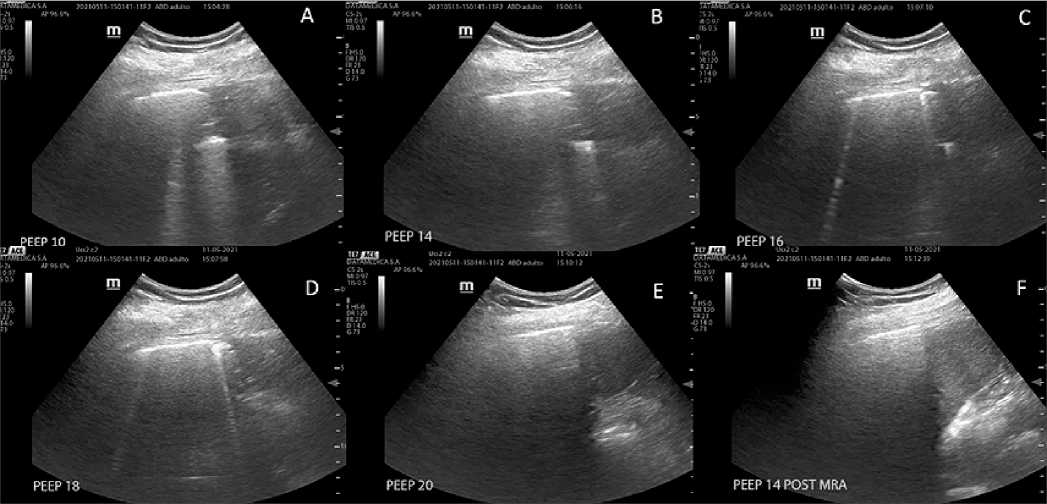
Figura 3. Titulación de PEEP ecoguiado. A: Nivel basal de PEEP. Visualización de patrón de condensación subpleural; B, C, D y E: Aumento gradual de PEEP observándose mejoría en la aireación, desaparece patrón de condensación subpleural y se visualizan líneas B y luego A; F: Titulación decreciente con PEEP 14; se observa adecuada aireación pulmonar.
Las líneas B, antes llamadas colas de cometa (Figura 5), se inician en la línea pleural y van hasta el final de la pantalla. Su número es proporcional al grado de compromiso del parénquima pulmonar y es posible dependiendo de su ubicación (en parches) o generalizada sospechar un cuadro intersticial infeccioso en el primer caso o en una falla del VI en el segundo caso.
Neumonía. Neumotórax. Derrame pleural
La ultrasonografía es incapaz de diferenciar los tipos de consolidación (neumonía, contusión, atelectasia, tumor) pero mostrará una zona de característica similar al hígado en lugar de pulmón correctamente aireado llamado signo del “like tissue ” (Figura 6). También podrá observarse la irregularidad de los bordes pleurales, ausencia de líneas A o B (por ausencia de interfaz aire/fluido) y la presencia de broncograma aéreo (Yang, 1992; Targhetta, 1992, William, 2006).
En los casos de neumotórax pequeños, muchas veces difíciles de diagnosticar mediante radiografía, el estudio ecográfico es de suma utilidad. Así, su diagnóstico podrá realizarse precozmente, a pie de cama, de modo no invasivo y sin radiación ionizante. Podremos observar ausencia de deslizamiento pleural y el conocido “código de barras” (en modo M) (Lichtenstein, 1995). Se puede establecer con 100% de precisión diagnostica encontrando el “punto pulmonar” donde se visualiza zona de pulmón aireada y zona colapsada.
Una imagen anecoica (negra) entre ambas pleuras es indicativo de la presencia de derrame pleural (Figuras 7 y 8). En los casos de derrame pleural complejo, con elementos de desecho por el exudado, podemos observar el “signo del plankton” (Figura 9) (Bhoil, 2021). El agregado del “signo sinusoidal” (variación del espacio intrapleural, en modo M, con las fases del ciclo respiratorio) refuerza el diagnóstico. Es de utilidad la fórmula propuesta para cuantificar el derrame, multiplicando los milímetros de distancia interpleural por 20 (Balik, 2006).

Figura 4. Líneas A. Con sonda convexa se puede observar la reverberación de línea pleural, artefacto de líneas A.
-
5. TEP
Aunque la angiografía pulmonar por tomografía no puede
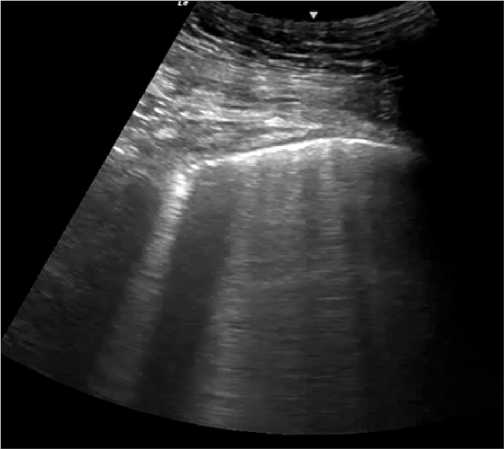
Figura 5. Líneas B. Con sonda convexa puede observarse la presencia de artefactos verticales, que nacen desde línea pleural y atraviesan la pantalla.
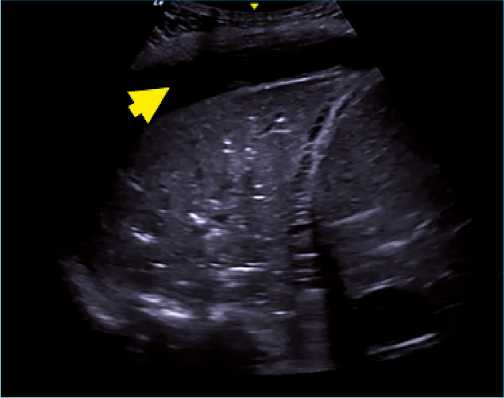
Figura 6. Condensación basal y derrame pleural subyacente. Se observa, con sonda convexa, el signo de “like tissue”, donde el pulmón tiene la misma densidad que el higado. Además, se observa el broncograma fluido (material hiperecogénico o blanco dentro de condensación). Flecha: imagen anecoica que corresponde a derrame pleural.
reemplazarse con la ecografía en el diagnóstico de la embolia pulmonar (EP) en pacientes sin shock o insuficiencia respiratoria, ésta última puede ser de preferencia en aquellos pacientes en quienes no se desea practicar una angiografía pulmonar computarizada, ya que se ha reportado que su valor predictivo negativo no es lo suficientemente alto (Bowra, 2011).
The American Heart Association categoriza EP masiva (riesgo alto), submasiva (riesgo intermedio) y EP de bajo riesgo, en parte, sobre la base de hallazgos ecocardiográficos (Jaff, 2011). Se ha reportado mayor mortalidad y morbilidad en pacientes con signos ecocardiográficos de insuficiencia cardíaca derecha y EP aguda (Cho, 2014).
Koenig y col.[49] Basado en los resultados del examen de ultrasonido, la opinión de los investigadores fue que 56 de los 100 sujetos (58%) no necesitó una angio TC (es decir, el ultrasonido reveló una anomalía que estableció una alternativa diagnóstica al EP) .En ninguno de estos 56 casos la angio TC identificó EP. Otros 40 pacientes (42%) necesitó una angio TC (es decir, el examen de ultrasonido fue normal y no reveló ninguna anormalidad que estableciera un diagnóstico alternativo a la EP). En 12 de estos casos (30%), la angio TC identificó una EP. Al comparar los resultados de la ecografía con los de la angio TC, en las 56 pacientes donde el examen de ultrasonido mostró un diagnóstico alternativo, la anormalidad fue correlacionada con el resultado en la tomografía computarizada en 56 casos (100%). Los resultados indican que un examen ecográfico (que incluye ecografía torácica, ECG y doppler bilateral en las extremidades inferiores), podría ser útil para reducir el número de angio TC.
En trombosis venosa profunda (TVP) sintomática la ecografía se ha convertido en la modalidad diagnóstica de elección. La ecografía de compresión de tres puntos (ingle, muslo medio y fosa poplítea) es una simplificación de la ecografía de compresión estándar, fácil de aprender y rápida de realizar. Ha demostrado una gran exactitud en el diagnóstico de la TVP proximal, donde alcanza una sensibilidad del 93-100% y una especificidad del 97%-100% (Collum, 2022).

Figura 7. Derrame pleural.

Figura 8. Derrame pleural simple. Signo de la medusa donde el pulmón condensado/atelectasiado “flota” en el líquido (anecoico).

Figura 9. Derrame pleural complejo: Signo del plankton. Derrame pleural extenso que muestra imagen anecoica entre parénquima pulmonar y diafragma. Además existen elementos puntiformes hiperecogénicos (blancos) que se arremolinan con la respiración denominado “signo del plankton”, lo cual corresponde a desechos en derrames por exudado (empiema) o coágulos en hemotórax.
-
6. Ecocardiografía
La ecocardiografía en la unidad de cuidados intensivos es de muy alta utilidad. Con esta técnica de imagenes se puede evaluar en tiempo real y latido a latido qué es lo que va sucediendo con el corazón al instaurar diferentes terapias como la indicación de fluidos, inótropos y vasopresores. Así se puede reconocer el efecto beneficioso o no de la administración de fluidos. Se puede titular la dosis precisa de un inótropo observando y midiendo parámetros como volumen de fin de diástole (VFD), gasto cardíacao (GC) puede aportar un valor agregado para la evaluación conjunta del binomio corazón-pulmón. Tal es el caso del diagnóstico de la hipertensión pulmonar, que puede producir una sobrecarga del ventrículo derecho e insuficiencia cardíaca. Considerando que sus signos y síntomas suelen ser inespecíficos al comienzo de la enfermedad, la evaluación eco- gráfica cumple un papel importante en su detección precoz y es menos invasiva, más barata y disponible que el cateterismo derecho. Aunque existen controversias sobre el diagnóstico preciso con este método, estudios han mostrado una correlación significativa entre la ecografía y el cateterismo o la resonancia magnética (Hammerstingl, 2012; Evaldsson, 2020). Adicionalmente, la ecografía permite estudiar la fracción de eyección del ventrículo derecho, la función valvular, el llenado diastólico y la contractilidad, entre otros parámetros de relevancia para la evaluación de la función cardíaca.
Lo anteriormente descripto, sumado a las características del método, transforman al estudio ecográfico en una herramienta indispensable dentro de la evaluación del paciente crítico.
-
7. Respuesta a la infusión de volumen
La reanimación con el uso de cristaloides solo ha mostrado ser efectiva, aproximadamente, en la mitad de los pacientes. Aquellos que no responden a la terapia pueden desarrollar resultados adversos, como el aumento del volumen intersticial con la consecuente disrupción del endotelio y la gran cantidad de consecuencias que esto puede producir. El ultrasonido es una herramienta que permite predecir qué pacientes podrían beneficiarse de la reanimación por volumen evitando la sobrecarga hídrica (Ansari, 2016).
La variación en la sección de la vena cava inferior (VCI) durante el ciclo respiratorio y el índice de colapsabilidad venosa (IC) (Finnerty, 2017), son alternativas al estudio de la presión venosa central o la presión de enclavamiento. La presión venosa central es proporcional al diámetro de la VCI, pero inversamente proporcional al IC (Ilyas, 2017). Aunque no se ha demostrado que la presión venosa central y el IC estén linealmente relacionados, cuanto más cerca está el IC de cualquiera de los dos extremos (0%-100%), tanto más probable serán la hipo o hipervolemia, respectivamente. Esto último objetivable por la presencia de líneas B (Agricola, 2005), siendo más sensible que la radiografía de tórax o la auscultación y aumentando proporcionalmente al grado de edema pulmonar (Pourmand, 2019).
-
8. Focused assessment with sonography in trauma (EcoFAST)
El protocolo FAST se ha desarrollado como una exploración en la atención al paciente traumatizado, siendo parte del protocolo Advanced Trauma Life Support (ATLS), desarrollado por el Colegio Americano de Cirujanos (Calea, 1999), y se centra inicialmente en el abdomen (Figura 10). Se basa en el principio de que el líquido libre (LL) como la sangre se acumula en determinados lugares anatómicos en el paciente en decúbito supino. En el tórax, puede hallarse LL en uno de dos posibles espacios: el pericardio y el espacio pleural. Si añadimos el tórax anterior superior para detectar la presencia de neumotórax, la denominamos FAST ampliada (EFAST). En el abdomen los posibles espacios más declives son la fosa de Morrison (encuentra entre el hígado y el riñón derecho), la interfaz esplenorrenal (entre el bazo y el riñón izquierdo), encima del bazo (líquido subfrénico), y en la pelvis, el LL se acumulará en el fondo de saco de Douglas (fondo saco rectovesical). El ultrasonido permite identificar fácilmente la presencia de líquido intraabdominal, y si bien no siempre puede especificar la etiología, es muy útil para el reconocimiento y sospechar un sangrado intraperitoneal en pacientes hipotensos que necesitan una laparotomía urgente (Ayuela Azcáratea, 2014). El protocolo FAST es equivalente o incluso mejor (en manos experimentadas) que la radiografía de tórax para identificar neumotórax o hemotórax en los pacientes críticos politraumatizados. Los objetivos del FAST son: identificar líquido libre (intraperitoneal, pericárdico), y guiar la toma de decisiones en la resucitación del paciente traumático en base a los hallazgos del estudio ecográfico y la situación hemodinámi- ca del paciente. Sus virtudes se pueden resumir en su capacidad de diagnosticar taponamiento cardíaco traumático, el neumotórax a tensión y el hemotórax masivo que pueden provocar la muerte con rapidez si no se detectan y tratan a tiempo; La FAST es incruenta, rápida y repetible, y puede realizarse en el lecho del enfermo; La EFAST es más fiable que la radiografía de tórax en decúbito supino para la detección de neumotórax y puede además utilizarse como herramienta para guiar el procedimiento terapéutico (pericardiocentesis o drenaje intercostal) (Bowra, 2011; Catán, 2011).
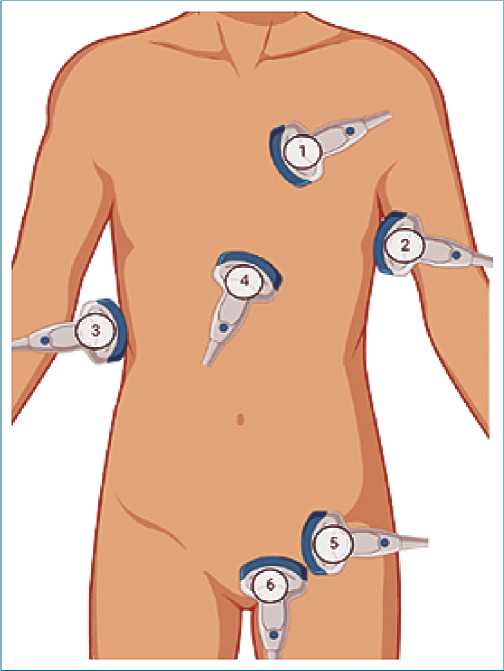
Figura 10. Ventanas utilizadas para la exploración ecográfica con FAST. 1. Paraesternal longitudinal izquierda; 2. Esplenorrenal; 3. Fosa de Morrison; 4. Subxifoidea; 5. Pélvica sagital; 6. Pélvica transversal.
-
9. Monitoreo en pacientes neurocríticos
La ecografía doppler también puede ser utilizada para el monitoreo y seguimiento clínico de los pacientes neurocríticos permitiendo la visualización de estructuras anatómicas y el flujo sanguíneo. Se ha reportado un excelente correlación entre la ecografía transcraneal y la tomografía para la evaluación del desvío de la línea media cerebral (Motuel, 2014; Blanco, 2018) y en la evaluación del volumen del hematoma, el cual ha mostrado ser un predictor independiente de pronóstico desfavorable (Camps-Renom, 2017). Además, se ha descripto su utilidad para detectar la oclusión de vasos cerebrales (Krejza, 2001). Para evaluar el grado de obstrucción se utiliza el Doppler pulsado que permite detectar la velocidad del flujo sanguíneo en un punto determinado. Se ha determinado que los valores altos o un cambio brusco de estos predicen con una alta probabilidad la obstrucción de un vaso.
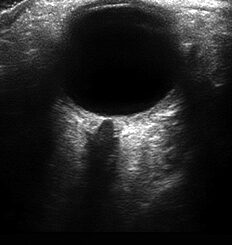
Adicionalmente, la medición del diámetro de la vaina del nervio óptico (Figura 11) ha mostrado utilidad en el neuromonitoreo de pacientes con sospecha de hipertensión intracraneana debido a su continuidad con la duramadre. Una elevación de la presión intracraneana (PIC) causa distensión de la vaina del nervio óptico. A medida que la PIC se eleva, el líquido cefalorraquídeo se redistribuye por la duramadre hacia la vaina de este nervio, lo que aumenta su diámetro. Mediante la ultrasonografía, utilizando una sonda lineal sobre el párpado, es posible obtener una medición confiable. Este procedimiento ha mostrado ser de fácil aprendizaje y reproducible. Midiendo desde la unión de la retina y el nervio óptico 0,3 cm se traza una línea perpendicular y se realiza medición de la vaina. Esta evaluación tiene una sensibilidad y especificidad de 88 y 93%, respectivamente, con un punto de corte mayor o igual a 0,5cm traduciendo una PIC > 20 mmHg (Ohle, 2015, Rajajee, 2012, Kalantari, 2013).
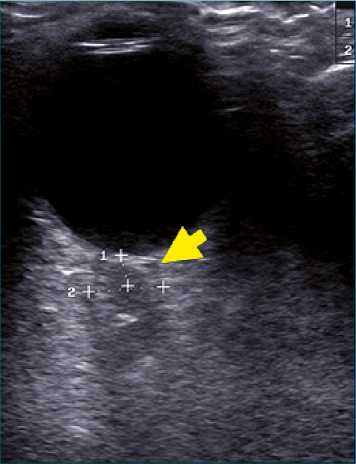
Figura 11. Medición diámetro vaina nervio óptico. Mediante sonda lineal se visualiza el globo ocular y, posteriormente, la vaina del nervio óptico cuyo diámetro a 0,3 cm es de 0,8 cm lo que indica una PIC > 20 mmhg.
-
10. Evaluación de sonda nasogástrica
La inserción de sonda nasogástrica en el entorno de cuidados intensivos es un procedimiento común. Se suele verificar su posicionamiento para evitar complicaciones relacionadas con la infusión endobronquial. El estándar de oro de la práctica es la radiografía de tórax. No obstante, el ultrasonido es una modalidad en crecimiento, fácilmente disponible en la mayoría de las unidades de cuidados intensivos que incluso realizado por no radiólogos con una capacitación mínima se asocia con la precisión diagnóstica aceptable (McMullen, 2022). Si bien tiene un buen valor predictivo positivo y puede confirmar la correcta colocación de la sonda nasogástrica en comparación con la radiografía de tórax, teniendo en cuenta su especificidad subóptima, es necesario tener precaución antes de implementar esta técnica en la práctica clínica diaria (Mumoli, 2021).
-
11. Evaluación de la vía aérea
La implementación de ventilación mecánica invasiva requiere la colocación de un tubo endotraqueal. Una vez realizado el procedimiento es habitual corroborar su ubicación mediante auscultación, utilización de capnografía, elevación simétrica de ambos hemitórax, condensación espiratoria o la ausencia de ruidos en el epigastrio (Grmec, 2002). La evaluación ecográfica para descartar la intubación del esófago o la intubación selectiva (Figura 12) es una herramienta de relevancia al haber mostrado resultados similares a la capnografía, la auscultación o la radiografía (Chou, 2011; Lichtenstein, 2015).
-
12. Evaluación músculo-esquelética
La debilidad adquirida en la UCI (DAUCI) es un síndrome de debilidad muscular difusa y simétrica, causada por la enfermedad crítica, con una prevalencia del 43% de los pacientes admitidos en UCI (Fan, 2014).
La disfunción del músculo esquelético, se asocia a peores resultados en el corto y largo plazo. Los pacientes que desarrollan DAUCI, tienen mayor mortalidad, mayor número de días de ventilación mecánica y mayor estadía hospitalaria (Vanhorebeek, 2020). Debido a estas consecuencias, el sistema muscular ha ganado protagonismo en las nuevas publicaciones científicas, desde su fisiología e impacto en la enfermedad crítica hasta opciones de tratamiento y aporte nutricional.
La ultrasonografía otorga ventajas para su evaluación: es un método no invasivo, de menor costo, no requiere traslados ni colaboración del paciente, permite medir el músculo con el paciente sedado y detectar cambios estructurales de manera temprana. Un trabajo reciente evaluó la variabilidad del grosor del cuádriceps (Quadriceps muscle layer thickness – QMLT) dentro de las 48 h de admisión, al día 7 y 14; los autores encontraron que cada 1% de pérdida de QMLT durante la primera semana de enfermedad crítica se asoció con 5% más de probabilidades de mortalidad a 60 días (Lee, 2020).
-
13. Colocación de catéteres
Recientemente se ha promovido la guía ecográfica como un método para reducir el riesgo de complicaciones durante la colocación de catéteres. El uso de ultrasonografía es de gran utilidad para identificar la anatomía y determinar localización y permeabilidad de los vasos a canalizar, permitiendo planificar la vía de abordaje (Figura 13). El cateterismo guiado por ultrasonido requiere capacitación. En los centros donde el equipamiento esté disponible y los profesionales tengan la formación adecuada, la guía ecográfica debería ser rutinariamente considerada para colocar accesos vasculares.
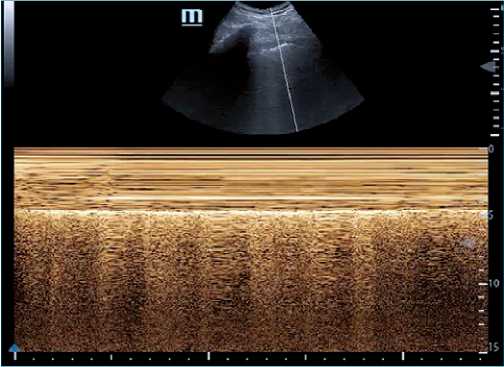
Figura 12. Pulso pulmonar. Intubación selectiva (monobronquial). Se observa mediante sonda línea en zona inferior tórax izquierdo en modo M (motion) la transmisión del latido cardiaco observándose interrupciones periódicas en parte inferior de imagen. Esto indica atelectasia completa pulmón izquierdo que luego de intubación corresponde a intubación monobronquial.
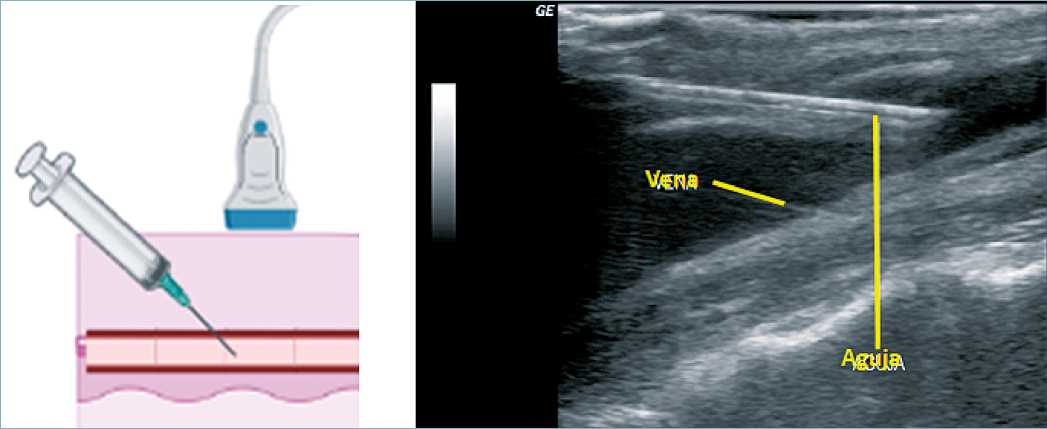
Figura 13. Canalización venosa bajo guía ecográfica.
Figura 14. A. Esquema que muestra la posición del transductor y el ángulo superficial de la aguja para técnica en plano. B. Aguja en la vena yugular interna, técnica en plano, imagen ecográfica.
Metaanálisis de ensayos controlados aleatorizados sobre la venopunción guiada por ultrasonido, mostraron tasas de éxito cercanas al 86% en el primer intento de inserción (Timsit, 2020). Sin embargo, su utilización en el acceso subclavio ha tenido resultados mixtos en ensayos clínicos, probablemente por razones anatómicas entre la vena subclavia y la clavícula, donde la ecografía es más difícil, menos confiable y donde no se observó diferencia estadísticamente significativa en la incidencia de infecciones asociadas a catéter (Imataki, 2019).
La evaluación ecográfica también permite verificar la colocación de la aguja, el alambre y la punta del catéter. Se recomienda también no prescindir del color de la sangre o ausencia de flujo pulsátil para confirmar la correcta inserción del catéter (McGee and Gould, 2003).
Fundings: None.
Conflict of interest: None.
Referencias
1. Lichtenstein D. FALLS-protocol: lung ultrasound in hemodynamic assessment of shock. Heart Lung Vessel. 2013;5(3):142–7. PMID:24364005
2. Lichtenstein DA. Lung Ultrasound in ARDS: The Pink-Protocol. The Place of Some Other Applications in the Intensive Care Unit (CLOT-Protocol, Fever-Protocol). Lung Ultrasound in the Critically Ill. Cham: Springer; 2016. https://doi.org/10.1007/978-3-319-15371-1_28.
3. Lichtenstein DA, Mezière GA. Relevance of lung ultrasound in the diagnosis of acute respiratory failure: the BLUE protocol. Chest. 2008 Jul;134(1):117–25. https://doi.org/10.1378/chest.07-2800 PMID:18403664
4. Bouhemad B, Brisson H, Le-Guen M, Arbelot C, Lu Q, Rouby JJ. Bedside ultrasound assessment of positive end-expiratory pressure-induced lung recruitment. Am J Respir Crit Care Med. 2011 Feb;183(3):341–7. https://doi.org/10.1164/rccm.201003-0369OC PMID:20851923
5. Tang KQ, Yang SL, Zhang B, Liu HX, Ye DY, Zhang HZ, et al. Ultrasonic monitoring in the assessment of pulmonary recruitment and the best positive end-expiratory pressure. Medicine (Baltimore). 2017 Sep;96(39):e8168. https://doi.org/10.1097/MD.0000000000008168 PMID:28953669
6. Satomura S. Ultrasonic Doppler method for the inspection of cardiac functions. J Acoust Soc Am. 1957;29(11):1181–5. https://doi.org/10.1121/1.1908737.
7. Abraham A, Breiner A, Katzberg HD, Lovblom LE, Bril V. Ultrasound-assisted lumbar puncture in a neuromuscular clinic has a high success rate and less pain. Can J Neurol Sci. 2019 Jan;46(1):79–82. https://doi.org/10.1017/cjn.2018.351 PMID:30419981
8. Smit JM, Raadsen R, Blans MJ, Petjak M, Van de Ven PM, Tuinman PR. Bedside ultrasound to detect central venous catheter misplacement and associated iatrogenic complications: a systematic review and meta-analysis. Crit Care. 2018 Mar;22(1):65. https://doi.org/10.1186/s13054-018-1989-x PMID:29534732
9. Helgeson SA, Fritz AV, Tatari MM, Daniels CE, Diaz-Gomez JL. Reducing iatrogenic pneumothoraces: using real-time ultrasound guidance for pleural procedures. Crit Care Med. 2019 Jul;47(7):903–9. https://doi.org/10.1097/CCM.0000000000003761 PMID:30985389
10. Díaz-Gómez JL, Mayo PH, Koenig SJ. Point-of-Care Ultrasonography. N Engl J Med. 2021 Oct;385(17):1593–602. https://doi.org/10.1056/NEJMra1916062 PMID:34670045
11. Frankel HL, Kirkpatrick AW, Elbarbary M, Blaivas M, Desai H, Evans D, et al. Guidelines for the appropriate use of bedside general and cardiac ultrasonography in the evaluation of critically ill patients. I. General ultrasonography. Crit Care Med. 2015 Nov;43(11):2479–502. https://doi.org/10.1097/CCM.0000000000001216 PMID:26468699
12. Theerawit P, Eksombatchai D, Sutherasan Y, Suwatanapongched T, Kiatboonsri C, Kiatboonsri S. Diaphragmatic parameters by ultrasonography for predicting weaning outcomes. BMC Pulm Med. 2018 Nov;18(1):175. https://doi.org/10.1186/s12890-018-0739-9 PMID:30470204
13. Mayo P, Volpicelli G, Lerolle N, Schreiber A, Doelken P, Vieillard-Baron A. Ultrasonography evaluation during the weaning process: the heart, the diaphragm, the pleura and the lung. Intensive Care Med. 2016 Jul;42(7):1107–17. https://doi.org/10.1007/s00134-016-4245-3 PMID:26951426
14. Santangelo E, Mongodi S, Bouhemad B, Mojoli F. The weaning from mechanical ventilation: a comprehensive ultrasound approach. Curr Opin Crit Care. 2022 Jun;28(3):322–30. https://doi.org/10.1097/MCC.0000000000000941 PMID:35653254
15. Li S, Chen Z, Yan W. Application of bedside ultrasound in predicting the outcome of weaning from mechanical ventilation in elderly patients. BMC Pulm Med. 2021 Jul;21(1):217. https://doi.org/10.1186/s12890-021-01605-4 PMID:34243739
16. Zhang X, Yuan J, Zhan Y, Wu J, Liu B, Zhang P, et al. Evaluation of diaphragm ultrasound in predicting extubation outcome in mechanically ventilated patients with COPD. Ir J Med Sci. 2020 May;189(2):661–8. https://doi.org/10.1007/s11845-019-02117-1 PMID:31691888
17. Xu X, Wu R, Zhang YJ, Li HW, He XH, Wang SM. Value of Combination of Heart, Lung, and Diaphragm Ultrasound in Predicting Weaning Outcome of Mechanical Ventilation. Med Sci Monit. 2020 Aug;26:e924885. Available from: https://www.medscimonit.com/abstract/index/idArt/924885 https://doi.org/10.12659/MSM.924885 PMID:32769960
18. Motuel J, Biette I, Srairi M, Mrozek S, Kurrek MM, Chaynes P, et al. Assessment of brain midline shift using sonography in neurosurgical ICU patients. Crit Care. 2014 Dec;18(6):676. https://doi.org/10.1186/s13054-014-0676-9 PMID:25488604
19. Blanco P, Abdo-Cuza A. Transcranial Doppler ultrasound in neurocritical care. J Ultrasound. 2018 Mar;21(1):1–16. https://doi.org/10.1007/s40477-018-0282-9 PMID:29429015
20. Camps-Renom P, Méndez J, Granell E, Casoni F, Prats-Sánchez L, Martínez-Domeño A, et al. Transcranial Duplex Sonography Predicts Outcome following an Intracerebral Hemorrhage. AJNR Am J Neuroradiol. 2017 Aug;38(8):1543–9. https://doi.org/10.3174/ajnr.A5248 PMID:28619839
21. Krejza J, Fryc J, Owlasiuk M, Huba M, Bert RJ, Mariak Z. Transcranial color Doppler sonography in the emergency diagnosis of middle cerebral artery occlusion in a patient after head injury. Clin Imaging. 2001;25(2):90–4. https://doi.org/10.1016/S0899-7071(01)00255-8 PMID:11483416
22. Ohle R, McIsaac SM, Woo MY, Perry JJ. Sonography of the optic nerve sheath diameter for detection of raised intracranial pressure compared to computed tomography. J Ultrasound Med. 2015 Jul;34(7):1285–94. https://doi.org/10.7863/ultra.34.7.1285 PMID:26112632
23. Rajajee V, Fletcher JJ, Rochlen LR, Jacobs TL. Comparison of accuracy of optic nerve ultrasound for the detection of intracranial hypertension in the setting of acutely fluctuating vs stable intracranial pressure: post-hoc analysis of data from a prospective, blinded single center study. Crit Care. 2012 May;16(3):R79. https://doi.org/10.1186/CC11336 PMID:22578001
24. Kalantari H, Jaiswal R, Bruck I, Matari H, Ghobadi F, Weedon J, et al. Correlation of optic nerve sheath diameter measurements by computed tomography and magnetic resonance imaging. Am J Emerg Med. 2013 Nov;31(11):1595–7. https://doi.org/10.1016/j.ajem.2013.07.028 PMID:24054852
25. Hammerstingl C, Schueler R, Bors L, Momcilovic D, Pabst S, Nickenig G, et al. Diagnostic value of echocardiography in the diagnosis of pulmonary hypertension. PLoS One. 2012;7(6):e38519. https://doi.org/10.1371/journal.pone.0038519 PMID:22685577
26. Evaldsson AW, Lindholm A, Jumatate R, Ingvarsson A, Smith GJ, Waktare J, et al. Right ventricular function parameters in pulmonary hypertension: echocardiography vs. cardiac magnetic resonance. BMC Cardiovasc Disord. 2020 Jun;20(1):259. https://doi.org/10.1186/s12872-020-01548-4 PMID:32487063
27. Calea TM, Rodriguez A, Chiu WC, Brenneman FD, Fallon Jr WF, Kato K, et al. Focused Assessment with Sonography for Trauma (FAST): Results from an international consensus conference. J Trauma. 1999;46:466—72.
28. Ayuela Azcáratea JM, Clau-Terré F, Vicho Pereira R, et al. Documento de consenso para la formación en ecografía en Medicina Intensiva. Proceso asistencial, uso de la técnica y adquisición de competencias profesionales. Med Intensiva. 2014;38(1):33—40
29. Bowra J, MacLaughlin RE. Ecografia para medicina de urgencias. Ed. Elsevier. 2011. 2da Ed. Cap 4. Pag 29-42.
30. Catán GF, Villado DM, Astudillo CD. Ecografía FAST en la evaluación de pacientes traumatizados. Rev Med Clin Las Condes. 2011;22(5):633–9. https://doi.org/10.1016/S0716-8640(11)70475-8.
31. McMullen CD, Anstey C, Garrett P, Moore J. Nasogastric tube placement under sonographic observation: A comparison study of ultrasound and chest radiography in mechanically ventilated patients. Aust Crit Care. 2022 Mar;35(2):181–5. https://doi.org/10.1016/j.aucc.2021.03.006 PMID:34120804
32. Mumoli N, Vitale J, Pagnamenta A, Mastroiacovo D, Cei M, Pomero F, et al. Bedside Abdominal Ultrasound in Evaluating Nasogastric Tube Placement: A Multicenter, Prospective, Cohort Study. Chest. 2021 Jun;159(6):2366–72. https://doi.org/10.1016/j.chest.2021.01.058 PMID:33545162
33. Yang PC, Luh KT, Chang DB, Yu CJ, Kuo SH, Wu HD. Ultrasonographic evaluation of pulmonary consolidation. Am Rev Respir Dis. 1992 Sep;146(3):757–62. https://doi.org/10.1164/ajrccm/146.3.757 PMID:1519859
34. Targhetta R, Chavagneux R, Bourgeois JM, Dauzat M, Balmes P, Pourcelot L. Sonographic approach to diagnosing pulmonary consolidation. J Ultrasound Med. 1992 Dec;11(12):667–72. https://doi.org/10.7863/jum.1992.11.12.667 PMID:1494199
35. William E, Brant MD. Tórax. Rumack CM, Wilson SR, Charboneau JW, Johnson JAM, editores. Diagno’stico por ecografı’a. 3rd ed. Madrid: Mosby; 2006. pp. 575–97.
36. Lichtenstein DA, Menu Y. A bedside ultrasound sign ruling out pneumothorax in the critically ill. Lung sliding. Chest. 1995 Nov;108(5):1345–8. https://doi.org/10.1378/chest.108.5.1345 PMID:7587439
37. Bhoil R, Ahluwalia A, Chopra R, Surya M, Bhoil S. Signs and lines in lung ultrasound. J Ultrason. 2021 Aug;21(86):e225–33. https://doi.org/10.15557/JoU.2021.0036 PMID:34540277
38. Balik M, Plasil P, Waldauf P, Pazout J, Fric M, Otahal M, et al. Ultrasound estimation of volume of pleural fluid in mechanically ventilated patients. Intensive Care Med. 2006 Feb;32(2):318–21. https://doi.org/10.1007/s00134-005-0024-2 PMID:16432674
39. Grmec S. Comparison of three different methods to confirm tracheal tube placement in emergency intubation. Intensive Care Med. 2002 Jun;28(6):701–4. https://doi.org/10.1007/s00134-002-1290-x PMID:12107674
40. Chou HC, Tseng WP, Wang CH, Ma MH, Wang HP, Huang PC, et al. Tracheal rapid ultrasound exam (T.R.U.E.) for confirming endotracheal tube placement during emergency intubation. Resuscitation. 2011 Oct;82(10):1279–84. https://doi.org/10.1016/j.resuscitation.2011.05.016 PMID:21684668
41. Lichtenstein DA. BLUE-protocol and FALLS-protocol: two applications of lung ultrasound in the critically ill. Chest. 2015 Jun;147(6):1659–70. https://doi.org/10.1378/chest.14-1313 PMID:26033127
42. Ansari BM, Zochios V, Falter F, Klein AA. Physiological controversies and methods used to determine fluid responsiveness: a qualitative systematic review. Anaesthesia. 2016 Jan;71(1):94–105. https://doi.org/10.1111/anae.13246 PMID:26459299
43. Finnerty NM, Panchal AR, Boulger C, Vira A, Bischof JJ, Amick C, et al. Inferior vena cava measurement with ultrasound: what is the best view and best mode? West J Emerg Med. 2017 Apr;18(3):496–501. https://doi.org/10.5811/westjem.2016.12.32489 PMID:28435502
44. Ilyas A, Ishtiaq W, Assad S, Ghazanfar H, Mansoor S, Haris M, et al. Correlation of IVC diameter and collapsibility index with central venous pressure in the assessment of intravascular volume in critically ill patients. Cureus. 2017 Feb;9(2):e1025. https://doi.org/10.7759/cureus.1025 PMID:28348943
45. Agricola E, Bove T, Oppizzi M, Marino G, Zangrillo A, Margonato A, et al. “Ultrasound comet-tail images”: a marker of pulmonary edema: a comparative study with wedge pressure and extravascular lung water. Chest. 2005 May;127(5):1690–5. https://doi.org/10.1378/chest.127.5.1690 PMID:15888847
46. Pourmand A, Pyle M, Yamane D, Sumon K, Frasure SE. The utility of point-of-care ultrasound in the assessment of volume status in acute and critically ill patients. World J Emerg Med. 2019;10(4):232–8. https://doi.org/10.5847/wjem.j.1920-8642.2019.04.007 PMID:31534598
47. Bowra J, MacLaughlin RE. Ecografia para medicina de urgencias. Ed. Elsevier. 2011. 2da Ed. Cap 5. Pag 43-56
48. Jaff MR, McMurtry MS, Archer SL, Cushman M, Goldenberg N, Goldhaber SZ, et al.; American Heart Association Council on Cardiopulmonary, Critical Care, Perioperative and Resuscitation; American Heart Association Council on Peripheral Vascular Disease; American Heart Association Council on Arteriosclerosis, Thrombosis and Vascular Biology. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association. Circulation. 2011 Apr;123(16):1788–830. https://doi.org/10.1161/CIR.0b013e318214914f PMID:21422387
49. Cho JH, Kutti Sridharan G, Kim SH, Kaw R, Abburi T, Irfan A, et al. Right ventricular dysfunction as an echocardiographic prognostic factor in hemodynamically stable patients with acute pulmonary embolism: a meta-analysis. BMC Cardiovasc Disord. 2014 May;14(1):64. https://doi.org/10.1186/1471-2261-14-64 PMID:24884693
50. Collum N, McLaughlin R, Murray A, Bowra J, Mc Laughling RE, Atkinson P, et al. Ecografia para medicina de urgencias. Ed. Elsevier. 2022. Cap 12. Pag 153-163.
51. Timsit JF, Baleine J, Bernard L, Calvino-Gunther S, Darmon M, Dellamonica J, et al. Expert consensus-based clinical practice guidelines management of intravascular catheters in the intensive care unit. Ann Intensive Care. 2020 Sep;10(1):118. https://doi.org/10.1186/s13613-020-00713-4 PMID:32894389
52. Imataki O, Shimatani M, Ohue Y, Uemura M. Effect of ultrasound-guided central venous catheter insertion on the incidence of catheter-related bloodstream infections and mechanical complications. BMC Infect Dis. 2019 Oct;19(1):857. https://doi.org/10.1186/s12879-019-4487-0 PMID:31619174
53. McGee DC, Gould MK. Preventing complications of central venous catheterization. N Engl J Med. 2003 Mar;348(12):1123–33. https://doi.org/10.1056/NEJMra011883 PMID:12646670
54. Fan E, Cheek F, Chlan L, Gosselink R, Hart N, Herridge MS, et al.; ATS Committee on ICU-acquired Weakness in Adults; American Thoracic Society. An official American Thoracic Society Clinical Practice guideline: the diagnosis of intensive care unit-acquired weakness in adults. Am J Respir Crit Care Med. 2014 Dec;190(12):1437–46. https://doi.org/10.1164/rccm.201411-2011ST PMID:25496103
55. Vanhorebeek I, Latronico N, Van den Berghe G. ICU-acquired weakness. Intensive Care Med. 2020 Apr;46(4):637–53. https://doi.org/10.1007/s00134-020-05944-4 PMID:32076765
56. Lee, Z. Y., Ong, S. P., Ng, C. C., Yap, C. S. L., Engkasan, J. P., Barakatun-Nisak, M. Y., Hasan, M. S. (2020). Association between ultrasound quadriceps muscle status with premorbid functional status and 60-day mortality in mechanically ventilated critically ill patient: A single-center prospective observational study. Clinical Nutrition.
57. Koenig S, Chandra S, Alaverdian A, Dibello C, Mayo PH, Narasimhan M. Ultrasound assessment of pulmonary embolism in patients receiving CT pulmonary angiography. Chest. 2014 Apr;145(4):818–23. https://doi.org/10.1378/chest.13-0797 PMID:24178672

 ORCID
ORCID