Anamaría Correa Bustillos MD.1,*,2, Verónica Maureira Moreno MD., MSc.1,2. Nathalie López Jaque MD, MSc.1,2
Recibido: 10-08-2022
Aceptado: 01-11-2022
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 1 pp. 113-118|https://doi.org/10.25237/revchilanestv5210111615
PDF|ePub|RIS
Kawasaki-like disease related to COVID-19. Perioperative management of a pediatric case
Abstract
The recently identified COVID-19-related Kawasaki-like disease has been considerad one of the phenotypes of the cardiovascular manifesta- tions of the Pediatric Multisystem Inflammatory Syndrome associated with SARS-CoV-2 (PIMS-TS), which stands out for few respiratory symptoms and múltiple manifestations cardiovascular, the most important being dilation and eventual coronary aneurysms associated or not with cardio- genic shock. The literature is scarce, so perioperative management is challenging for the anesthesiology team. We present the case of an infant with severe cardiovascular manifestations as a result of this disease that required anesthetic interventions to perform a plethysmography and amputation of his lower extremity. The article describes the most relevant considerations in the perioperative management of patients with this pathology.
Resumen
La enfermedad tipo Kawasaki relacionada a COVID-19 recientemente identificada ha sido considerada como uno de los fenotipos de las manifestaciones cardiovasculares del Síndrome Inflamatorio Multisistémico Pediátrico asociado a SARS-CoV-2 (PIMS-TS), que destaca por escasos síntomas respiratorios y múltiples manifestaciones cardiovasculares, siendo la más importante, la dilatación y eventuales aneurismas coronarios asociados o no a shock cardiogénico. La bibliografía es escasa, por lo que, el manejo perioperatorio es desafiante para el equipo anestesiológico. Presentamos el caso de un lactante con manifestaciones cardiovasculares severas producto de esta enfermedad que requirió intervenciones anestésicas para la realización de una pletismografía y la amputación de su extremidad inferior. El artículo describe las consideraciones más relevantes en el manejo perioperatorio de los pacientes con esta patología.
-
Introducción
La infección por SARS-CoV-2, en general, ha tenido un menor impacto en los pacientes pediátricos en comparación con los adultos[1]. Sin embargo, en abril de 2020 aparecieron los primeros reportes en Europa sobre una respuesta inflamatoria con afectación multiorgánica producida por SARS- CoV-2 en la población pediátrica, presentándose con PCR negativa para el virus, pero con anticuerpos positivos, sugiriendo una infección previa y una respuesta inflamatoria exagerada[2] que se denominó Síndrome Inflamatorio Multisistémico Pediátrico asociado a SARS-CoV-2 (PIMS-TS) en mayo de 2020[3]. Del mismo modo, en abril de 2020 se reporta un incremento de los casos de enfermedad tipo Kawasaki (EK) con afectación cardíaca y dilatación coronaria, asociado a COVID-19 en población pediátrica[4],[5].
Dada la emergencia de esta asociación, es posible que los equipos anestésico-quirúrgicos se vean enfrentados a estos pacientes para procedimientos o cirugías.
Reportamos el caso de un paciente de 2 meses que desarrolló una enfermedad tipo Kawasaki con afectación cardiaca grave en el contexto post infeccioso de COVID-19 y que requirió del manejo anestésico para procedimientos diagnósticos y terapéuticos.
-
Caso clínico
Lactante masculino, 2 meses, 7 kg, consultó a la Unidad de Emergencia Pediátrica por progresivo compromiso del estado general, rechazo alimentario y aparición de eritema macular en tronco y extremidades, con el antecedente de haber cursado una diarrea febril 15 días previos, con PCR SARS-CoV-2 (-) tratada ambulatoriamente.
Ingresó grave, taquicárdico (188 lpm), hipotenso, con signos de mala perfusión, febril de 38,9 °C rectal, sin compromiso respiratorio. En el laboratorio inicial destacó leucocitosis 26.700/mL y acidosis metabólica con lactato de 4,6 mmol/L.
Se diagnosticó probable shock séptico, requiriendo estabilización inicial con cristaloides intravenoso [IV] y traslado a UPCP, donde evolucionó hemodinámicamente inestable, requiriendo drogas vasoactivas, ventilación mecánica e inicio de tratamiento antibiótico empírico. El laboratorio mostró elevación de bio- marcadores inflamatorios y cardíacos (Figura 1 y 2).
En los antecedentes maternos destacó infección por CO- VID-19 oligosintomática, a las 21 semanas de embarazo, documentada con PCR SARS-CoV-2 (+).
Nueva PCR COVID-19 (-) y Test rápido COVID-19 (-). Los Anticuerpos Anti SARS-CoV-2 SPIKE 1, principalmente IgG fueron positivos: 2,88 U/ml y 1,5 U/ml a los 10 y 33 días del ingreso respectivamente. Los Ac Anticápside (-) (Método ECLIA Cobas – Roche). El estudio bacteriano y viral resultó negativo.
En la ecocardiografía inicial se diagnosticó insuficiencia mi- tral y aórtica leves con disfunción sisto-diastólica del ventrículo izquierdo (VI), derrame pericárdico no obstructivo y volemia adecuada. Desde las 48 h evolucionó con dilatación aneurismática moderada de todas las coronarias proximales (Z-score entre +7,24 y +9,11) y disfunción diastólica del ventrículo derecho (VD), sin derrame pericárdico. Entonces, se diagnosticó probable EK relacionado a COVID-19, comenzando tratamiento según protocolo[6].
Concomitantemente, a las 48 h se pesquisó lesión isquémica del tercio distal de la extremidad inferior izquierda (EII), atribuida a intento de acceso venoso femoral difícil durante la reanimación. El Eco Doppler color fue compatible con trombosis de arteria femoral común e ilíaca externa izquierda.
Evoluciona muy grave hasta el quinto día, con apoyo de adrenalina y luego milrinona. En adelante, se observa más estable y afebril, con disminución de parámetros inflamatorios, sin aumento de requerimientos ventilatorios y tendencia a la normalización de la función cardíaca. La curva de troponinas alcanzó su valor máximo al 5° día y tendió a normalizarse a las 2 semanas. La dilatación de las arterias coronarias circunfleja y coronaria derecha presentan una regresión importante (Z-score +2,43 y +2,29 respectivamente), mientras la arteria coronaria izquierda y descendente anterior se mantienen con dilataciones aneurismáticas moderadas (Z-score > +6).
Se extubó al día 11, se trasladó con captopril a sala el día 26.
La lesión isquémica de la EII evolucionó a gangrena seca. Se decidió realizar amputación previa pletismografía bajo anestesia. El examen se realizó a los 37 días de hospitalización, con monitoreo estándar no invasivo, (ECG 5 derivadas con análisis de ST) y oximetría cerebral. Se administró sevoflurano en O2/ aire 50%, remifentanilo 0,1 mcg ug/kg/min IV; manteniendo ventilación espontánea con mascarilla facial. El procedimiento transcurrió sin incidentes. En la emergencia anestésica presentó taquicardia sinusal (190 lpm). Durante la vigilancia postanestésica en la UTI, se objetivó hipertensión arterial leve y extrasisto- lía ventricular monomorfa frecuente, bigeminismo autolimita- do, sin inestabilidad hemodinámica, asociado a alza transitoria de troponinas, con NTproBNP hasta 1.450 pg/ml. Holter de 24 h confirmó arritmias, que se controlaron con carvedilol.
Previo a la amputación infracondílea, se realizó traslape de Enoxaparina a Heparina sódica en infusión IV, control de exámenes y ecocardiograma. Se indicó dexmedetomidina a 0,3 mcg/kg/h IV perioperatoria bajo monitorización en UTI.
La cirugía se realizó a los 4 meses de edad (7,8 kg) , bajo anestesia general balanceada con sevoflurano (O2/Aire) fentanilo 4 mcg/kg IV, lidocaína 1 mg/kg IV; rocuronio 1 mg/kg IV, dexametasona 0,1 mg/kg IV. Intubación OT e instalación de dos vías venosas periféricas. Monitoreo no invasivo estándar, ECG 5 derivadas, análisis de ST más oximetría cerebral y diuresis horaria.
Analgesia multimodal con anestesia caudal continua eco- guiada con bolo preoperatorio de bupivacaina 0,2% y mantención con bupivacaina 0,1% + fentanyl 1 mcg/ml por 48 h, más paracetamol IV por horario.
El tiempo anestésico fue 3 h, sin pérdidas sanguíneas significativas y hemodinamia estable. Se trasladó extubado y tranquilo a UPCP para vigilancia postoperatoria que cursó sin complicaciones.
Previo al retiro del catéter peridural se realizó bloqueo ciático poplíteo + canal aductor izquierdo ecoguiado con Bupivacaina 0,2% 6 ml, logrando buena analgesia sin requerimientos farmacológicos adicionales. Posteriormente, se reanudó la enoxaparina, la cual se mantuvo después del alta hasta repermeabilización de arteria ilíaca (8 meses).
El paciente se dio de alta a los 69 días de hospitalización, con control multidisciplinario y rehabilitación.
-
Discusión
Al igual que en la literatura internacional, en Chile los casos de PIMS – TS en niños han sido poco frecuentes y con escasa mortalidad. El compromiso cardiovascular es muy frecuente y la EK es uno de los fenotipos clínicos posibles, caracterizado por una presentación clínica más severa que el Kawasaki clásico, con una mayor proporción de miocarditis, alteraciones ecocar- diográficas y shock como presentación inicial[7], refrendado en los hallazgos de laboratorio que incluyen linfopenia, tromboci- topenia, troponina elevada, NTproBNP elevado, dímero D elevado y ferritina elevada.
La asociación fisiopatológica subyacente entre SARS-CoV-2 y Kawasaki es aún desconocida, probablemente sea un proceso post infeccioso con activación inmunitaria retardada que conduce a un estallido de citoquinas, responsables de la fiebre, erupción cutánea, manifestaciones gastrointestinales, insuficiencia cardiaca y síndrome inflamatorio similar a la respuesta fisiopatológica del Kawasaki clásico[7] y que se manifiesta al igual que el PIMS, luego de 2-6 semanas del cuadro agudo, con PCR SARS-CoV-2 negativa y con test de anticuerpos tipo IgG positivos, como en el caso reportado.
Los criterios diagnósticos de Kawasaki clásico e incompleto[8], no se logran identificar habitualmente, sin embargo, es posible considerar el diagnóstico de EK como confirmado, ante la presencia de dilatación coronaria en el contexto de CO- VID-19. Resulta perentorio un estudio cardiovascular precoz con ecocardiografía, electrocardiografía y biomarcadores cardíacos (troponinas I/T, BNP o NT Pro-BNP); además de solicitar exámenes para la detección de SARS-CoV-2 y estudio de anticuerpos, como en este caso.

Figura 1. Evolución de los niveles plasmáticos de biomarcadores inflamatorios en la primera semana de hospitalización. a. Dímero D, valor de referencia < 0,5 ug/ml FEU; b. Ácido láctico, valor de referencia 0,5 – 2,2 mmol/L; c. Ferritina, valor de referencia 21,81 – 274,66 ng/ml. Ácido láctico, valor de referencia 0,5 – 2,2 mmol/L; d. Proteína C Reactiva, valor de referencia < 5,0 mg/L; e. Plaquetas, valor de referencia 140 – 400 xA3/uL; f. Leucocitos, valor de referencia 6.0 – 15.0 xA3/uL.
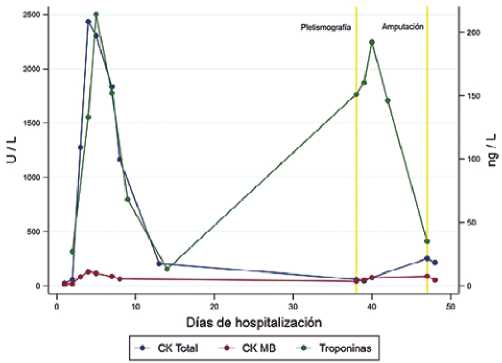
Figura 2. Evolución de los niveles plasmáticos de CK total, CK MB y Troponinas en relación a los días de hospitalización, destacando en líneas amarillas intervenciones bajo anestesia: pletismografía y amputa- ción.Eje de la Y a izquierda valores plasmáticos de CK total y CK MB en U/L; CK total representada en línea azul; valor de referencia 30 – 200 U/L; CK MB representada en línea roja, valor referencia < 24 U/L. Eje de la Y a derecha valores plasmáticos de Troponina I ultrasensible en ng/L representada en línea verde, valores de referencia 0 – 15,6 ng/L
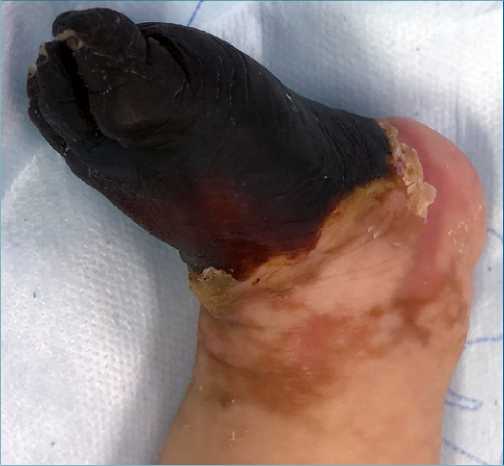
Figura 3. Imagen de la pierna izquierda mostrando el nivel de compromiso isquémico previo a la amputación.
En la EK ligada a COVID-19 los hallazgos más frecuentes se encuentran detallados en la Tabla 1. Es destacable que superado el shock inicial, la dilatación coronaria y la miocarditis constituyen los hallazgos más relevantes a largo plazo[7]. Nuestro paciente presentó eritema, fiebre, diarrea y a nivel cardiovascular: arritmias, disfunción de VD, compromiso valvular, derrame pericárdico, dilatación coronaria, elevación de troponinas y pro- Bnp, además de la presencia de shock.
Las anomalías coronarias se clasifican según Z-score, en dilatación coronaria, aneurismas pequeños, medianos y gigantes[6]. En el caso reportado, destacó la dilatación aneuris- mática proximal moderada de todas las coronarias. Este es un elemento muy importante para el diagnóstico, tratamiento y seguimiento, considerando que no existen grandes series que reporten las consecuencias a largo plazo de estas lesiones en el contexto de esta pandemia por COVID-19.
Esta patología cursa con distintas fases, asociadas a riesgos particulares, los cuales deben ser reconocidos por el anestesiólogo. Primero una fase febril aguda (7 a 14 días), luego una fase subaguda de 4 semanas de duración donde se pueden desarrollar los aneurismas de las arterias coronarias; que en el caso de nuestro paciente, se diagnosticaron durante las primeras 48 h desde su ingreso, luego de dos semanas de fiebre. La tercera fase (convalecencia), suele ser asintomática[9] y se recomienda que los pacientes que han presentado compromiso cardiovascular sean controlados al menos por un año.
La lesión isquémica trombótica de la EII del paciente, (Figura 3) fue atribuida al difícil intento para conseguir una vía venosa central a nivel femoral, en un contexto inflamatorio procoagulante en presencia de shock.
Es importante recordar que la EK es una vasculitis de vasos pequeños y medianos, que además de comprometer las coronarias puede afectar las arterias axilar, braquial, femoral, ilíaca, entre otras y ocasionalmente se ha descrito gangrena periférica, incluso con pérdida de dedos[10]. Por tanto, es recomendable que la instalación de los accesos vasculares centrales sean procedimientos planificados, ecoguiados y realizados por especialistas con experiencia.
Dada la similitud de la EK asociado a COVID con el Kawasaki clásico, se han extrapolado las terapias habituales, descritas en la Tabla 1.
Las manifestaciones clínicas, contexto epidemiológico e interacciones farmacológicas suponen un desafío al enfrentarnos a estos casos. Las principales consideraciones anestésicas se enumeran en la Tabla 1.
Se debe planificar cuidadosamente el manejo de la ansiedad y el dolor perioperatorio en los pacientes con injuria miocárdica y vascular con el objetivo de reducir la descarga adrenérgica y el aumento del consumo de oxígeno. Para este efecto, se utilizó una infusión perioperatoria de dexmedetomidina intravenosa en la cirugía de amputación. Esta decisión fue tomada posterior a la Pletismografía, un examen aparentemente no doloroso, que desencadenó una nueva alza de troponinas y arritmias post procedimiento.
La analgesia multimodal y la prevención del dolor crónico incluyendo técnicas de anestesia regional, son desafiantes en pacientes con tratamiento anticoagulante y antiagregante. En este caso, se realizó una técnica neuroaxial continua, y un bloqueo de nervio periférico al retirar el catéter caudal, con el respectivo manejo de la terapia anticoagulante. Un bloqueo regional periférico continuo es una buena alternativa en centros con vasta experiencia y protocolos en dicha técnica.
Asimismo, el monitoreo anestésico debe considerar el riesgo de arritmias e isquemia coronaria en estos pacientes. La estabilidad hemodinámica intraoperatoria, la normotermia, y control metabólico e hidroelectrolítico deben ser manejados en forma estricta.
Tabla 1. Características clínicas y consideraciones anestésicas perioperatorias de Enfermedad tipo Kawasaki relacionado a COVID-19 en pacientes pediátricos

-
Conclusiones
El abordaje perioperatorio de los pacientes con EK relacionada a COVID-19 en sus distintas fases, impone un gran desafío para el equipo multidisciplinario, ya que el diagnóstico y tratamiento precoz de esta patología y sus complicaciones, pueden tener impacto a mediano-largo plazo en estos pacientes.
El caso que reportamos es sin duda un ejemplo de la manifestación más severa de Kawasaki ligado a COVID-19, con graves consecuencias permanentes como la amputación de una extremidad y un compromiso coronario severo de lenta regresión, pero con evolución favorable hasta su último control cardiológico, en el cual la colaboración y el trabajo multidisciplinario han resultado claves.
Agradecimientos
Queremos mostrar nuestro agradecimiento al Dr. Ricardo Eltit, Cardiólogo Infantil del Hospital Carlos Van Buren de Valparaíso, por su contribución en el análisis del estudio cardiológico; y a la Cátedra de Medicina Basada en Evidencia de la Escuela de Medicina de la Universidad de Valparaíso Chile, por su colaboración en los aspectos metodológicos del caso y representaciones gráficas.
Referencias
1. Radia T, Williams N, Agrawal P, Harman K, Weale J, Cook J, et al. Multi-system inflammatory syndrome in children & adolescents (MIS-C): A systematic review of clinical features and presentation. Vol. 38, Paediatric Respiratory Reviews. W.B. Saunders Ltd; 2021. p. 51–7.
2. Abrams JY, Oster ME, Godfred-Cato SE, Bryant B, Datta SD, Campbell AP, et al. Factors linked to severe outcomes in multisystem inflammatory syndrome in children (MIS-C) in the USA: a retrospective surveillance study. Lancet Child Adolesc Health. 2021 May;5(5):323–31. https://doi.org/10.1016/S2352-4642(21)00050-X PMID:33711293
3. Multisystem inflammatory syndrome in children and adolescents with COVID-19 Scientific brief 15 May 2020 Background [Internet]. 2020. Available from: https://www.who.int/news-
4. Jones VG, Mills M, Suarez D, Hogan CA, Yeh D, Segal JB, et al. COVID-19 and Kawasaki Disease: Novel Virus and Novel Case. Hosp Pediatr. 2020 Jun;10(6):537–40. https://doi.org/10.1542/hpeds.2020-0123 PMID:32265235
5. Verdoni L, Mazza A, Gervasoni A, Martelli L, Ruggeri M, Ciuffreda M, et al. An outbreak of severe Kawasaki-like disease at the Italian epicentre of the SARS-CoV-2 epidemic: an observational cohort study. Lancet. 2020 Jun;395(10239):1771–8. https://doi.org/10.1016/S0140-6736(20)31103-X PMID:32410760
6. Álvarez Z P, Larios G G, Toro R L, Acevedo A V, Arancibia G F, Cárdenas M L, et al. Recomendación para la sospecha, manejo y seguimiento del compromiso cardiovascular en pacientes con Síndrome Inflamatorio Multisistémico en Pediatría asociado a COVID-19 (PIMS-TC). Declaración de Posición de la Sociedad Chilena de Pediatría (SOCHIPE) y Sociedad Chilena de Cardiología y Cirugía Cardiovascular (SOCHICAR). Rev Chil Pediatr. 2020 Dec;91(6):982–90. https://doi.org/10.32641/rchped.v91i6.3215 PMID:33861837
7. Pouletty M, Borocco C, Ouldali N, Caseris M, Basmaci R, Lachaume N, et al. Paediatric multisystem inflammatory syndrome temporally associated with SARS-CoV-2 mimicking Kawasaki disease (Kawa-COVID-19): a multicentre cohort. Ann Rheum Dis. 2020 Aug;79(8):999–1006. https://doi.org/10.1136/annrheumdis-2020-217960 PMID:32527868
8. McCrindle BW, Rowley AH, Newburger JW, Burns JC, Bolger AF, Gewitz M, et al.; American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee of the Council on Cardiovascular Disease in the Young; Council on Cardiovascular and Stroke Nursing; Council on Cardiovascular Surgery and Anesthesia; and Council on Epidemiology and Prevention. Diagnosis, treatment, and long-term management of Kawasaki disease: A scientific statement for health professionals from the American Heart Association. Circulation. 2017 Apr;135(17):e927–99. https://doi.org/10.1161/CIR.0000000000000484 PMID:28356445
9. Rife E, Gedalia A. Kawasaki Disease: an Update. Vol. 22, Current Rheumatology Reports. Springer; 2020.
10. Elouardi Y, Rebahi H, Zarrouki Y, Ziadi A, Younous S, Samkaoui MA. [COVID-19 associated Kawasaki-like multisystem inflammatory syndrome in an adult]. Rev Esp Anestesiol Reanim. 2022 Jan;69(1):43–7. https://doi.org/10.1016/j.redar.2020.11.013 PMID:33994586

 ORCID
ORCID