Germán W. Rangel J.1,2, Karina Ortega A.1,2, Julian González M.3, Ximena J. Cediel C.1,3,*
Recibido: 11-01-2022
Aceptado: 23-05-2022
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 1 pp. 119-122|https://doi.org/10.25237/revchilanestv5211111513
PDF|ePub|RIS
Lumbar sympathetic blockade for the management of complex regional pain syndrome, apropos of a case with complete resolution
Abstract
Phantom limb syndrome (PLS) is a condition that occurs in amputee patients that has a wide array of different treatment approaches. We present the case of a patient diagnosed with complex regional pain syndrome (CRPS) of the right upper limb secondary to polytrauma with complete brachial plexus injury, who, after being subjected to múltiple successful therapies, was finally taken to amputation. Later, he developed a painful PLS that was difficult to manage, which was treated with a stellate ganglion block (SGB), achieving a significant decrease in pain. This article aims to present a case in which a SGB was used as an adjunct to control acute postoperative PLS in a patient with previous sensitization due to CRPS. The SGB, in this case, performed with local anesthetic plus corticosteroid, constitutes a useful therapeutic alternative for intense postoperative pain in PLS, achieving adequate pain relief without adverse effects. However, its routine use as in acute postoperative pain still lacks sufficient evidence for complete support, therefore we urge the scientific community to undertake more in depth research concerning this topic in order to create clear guidelines and recommendations.
Resumen
El síndrome doloroso regional complejo (SDRC) es una patología crónica dolorosa, con una prevalencia aproximada de 5,4 a 26,2 por 100.000 personas al año, y se caracteriza por ser un dolor regional espontáneo que empeora progresivamente sin seguir una distribución dermatómica. El dolor experimentado, es desproporcionado en tiempo y gravedad al evento desencadenante, acompañándose de síntomas sensoriales (alodinia, hiperalgesia), vasomotores (cambios de la temperatura cutánea) y tróficos (hipertricosis, descamación). A continuación, se describirá un caso clínico en donde se evidencia una respuesta positiva y prolongada luego de la realización de un bloqueo simpático lumbar, resaltándose la importancia de un diagnóstico oportuno y temprano.
Introducción
El síndrome doloroso regional complejo (SDRC) fue definido por la Asociación Internacional para el Estudio del Dolor (IASP) como una alteración que se caracteriza por dolor espontáneo o inducido, desproporcionado con relación al evento inicial, y que se acompaña de una gran variedad de alteraciones autonómicas y motoras, dando lugar a una gran diversidad de presentaciones clínicas[1]. A través de los años ha sido foco de interés de múltiples estudios y tomó alrededor de 100 años determinar la denominación apropiada para referirse a este grupo de pacientes bajo el nombre SDRC[2].
Se han descrito dos tipos de SDRC según la ausencia o presencia de lesión de nervio periférico, siendo el tipo I (previamente llamado distrofia simpático refleja) en el cual no se presenta una lesión nerviosa, y el tipo II (causalgia), en donde se evidencia una lesión nerviosa de importancia[3],[4], su diagnóstico se basa en la sospecha clínica mediante la presencia de signos y síntomas que son evaluados por medio de los criterios de Budapest[1],[5].
En la literatura se ha reportado una prevalencia aproximada de 5,4 a 26,2 por cada 100.000 personas al año, existiendo algunos factores de riesgo definidos como lo son: género femenino, tener una lesión en la extremidad superior, y sufrir un trauma de alta energía[6]. Se han descrito múltiples esquemas de tratamiento que comprenden desde terapia psicológica, terapia ocupacional y medicamentos, hasta la realización de procedimientos intervencionistas que incluyen bloqueos, radiofrecuencia e incluso neuroestimulación[7],[8].
A continuación, describiremos un caso clínico en el cual se evidencia cómo un diagnóstico temprano y un tratamiento intervencionista oportuno, en este caso con un bloqueo simpático lumbar, puede generar una mejoría clínica del paciente, y por consiguiente impactar positivamente en la calidad de vida.
-
Caso clínico

Figura 1. Radiografía pie izquierdo. cambios quirúrgicos en el primero y segundo metatarsianos, con desviación en valgo de la articulación metatarso falángica del primer dedo y aumento en el volumen de los tejidos blandos adyacentes.
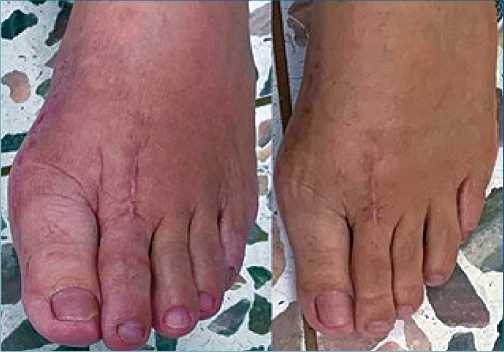
Figura 2. Fotografía de pie izquierdo de la paciente, en la imagen A se observan cambios tróficos y vasomotores en la extremidad, en la imagen B se observa el control posterior a la realización de intervencionismo analgésico.
Se trata de una paciente femenina de 55 años, con antecedente de fibromialgia quien se encontraba en seguimiento de forma regular por el servicio de clínica del dolor, venía recibiendo manejo analgésico multimodal con acetaminofén, pregabalina y tizanidina. Fue llevada a la realización de una cirugía programada de corrección de hallux valgus más osteosíntesis de metatarso 1 y 2 del pie izquierdo.
La paciente asistió al control por clínica del dolor 2 meses después de su procedimiento quirúrgico, manifestaba además de sus síntomas usuales de fibromialgia, dolor de alta intensidad en el pie izquierdo de características neuropáticas (calor, ardor, quemazón), VAS 8/10 en reposo y 10/10 al movimiento, el cual le impedía realizar las terapias posoperatorias, adicionalmente presentaba incapacidad para el apoyo e intolerancia al uso de calzado, alodinia e hiperalgesia. Así mismo, presentaba cambios en el calibre de los vellos y coloración rojo-violácea de dicha extremidad. Al examen físico, se evidenciaban cambios tróficos y vasomotores en la extremidad (edema, aumento de crecimiento de vello y de su grosor, cambios de temperatura y en la coloración) (Figura 2), mediante la aplicación de los criterios de Budapest se dió la impresión diagnóstica de síndrome doloroso regional complejo tipo I.
Se realizó una radiografía que mostró cambios quirúrgicos y edema de tejidos blandos (Figura 1); la paciente fue valorada por el servicio de ortopedia, el cual descartó la presencia de alguna complicación que requiriera una nueva intervención quirúrgica. Ante la sospecha clínica de SDRC tipo I, se realizó un ajuste farmacológico iniciando con acetaminofén/tramadol, nimesulina, vitamina C y gabapentina, sin embargo, la paciente no presentó mejoría clínica, por lo cual se programó para la realización de intervencionismo analgésico por medio de un bloqueo simpático lumbar izquierdo guiado por fluoroscopio. Se realizó un acceso lateral bajo fluoroscopia con enfoque oblicuo hasta lograr que el cuerpo vertebral cubriera la apófisis transversa, y se orientó la punta de la aguja hasta el borde anterior del cuerpo vertebral de L2 posicionando la aguja cinco milímetros dorsales a la porción más ventral del cuerpo vertebral (Figura 3).
Una vez comprobada la adecuada dispersión del medio de contraste, se procedió a la aplicación de una mezcla de 10 cc de bupivacaina al 0,5%, 40 mg de metilprednisolona, 50 mg de ketamina y 2 mg de morfina, obteniéndose una respuesta positiva en el posoperatorio inmediato. Posteriormente, se citó a control a los 7 días, en donde la paciente refirió resolución completa de la anodinia, toleraba la colocación de calzado, realizaba la marcha sin apoyo y presentaba parcial resolución de cambios vasomotores y tróficos. En el seguimiento realizado 1 mes después, se constató la resolución completa de cambios vasomotores, dolorosos y tróficos, presentando un VAS de 0/10. Seis meses después la paciente permanece asintomática y continua sus actividades laborales con éxito.
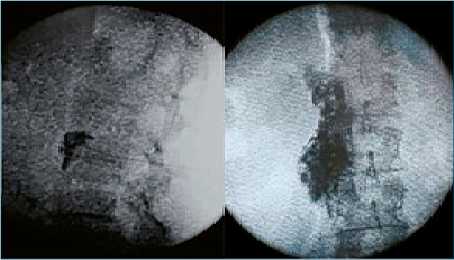
Figura 3. Imagen de Fluoroscopio de realización de bloqueo simpático lumbar, en la imagen A se observa imagen fluoroscopica lateral mostrando distribución del contraste, en la imagen C se observa fluoroscopica anteroposterior mostrando ubicación de la aguja y la distribución del contraste.
-
Discusión
La fisiopatología del SDRC es compleja y sigue siendo un tema de interés en múltiples estudios a nivel mundial, la evidencia actual sugiere que es una entidad multifactorial que requiere de un detonante inicial para desencadenar la presentación de la misma, se caracteriza por tener una respuesta aberrante a estímulos nocivos que sobrepasan en intensidad lo esperable para la lesión inicial[7], se ha visto que está determinada por tres componentes principales: los cambios inflamatorios, el proceso de sensibilización central y la disfunción vasomotora[1].
Inicialmente, se observan alteraciones a nivel periférico terminal en las fibras C y A-8, esto genera una sensibilización noci- ceptiva inicial que se mantiene por la liberación de mediadores pro inflamatorios. La afección periférica compromete el sistema autónomo, así como los sistemas motores y de transmisión de dolor[2],[9],[10].
Adicionalmente, se ha observado que el acoplamiento entre las neuronas adrenérgicas y las nociceptivas generan un aumento de dolor luego de la estimulación simpática[3],[9],[10]. Así mismo, se ha identificado una mayor expresión de receptores a1-adrenergicos en las extremidades afectadas y presencia de alteraciones en las catecolaminas circulantes que pueden explicar los cambios térmicos presentados[4],[11],[12].
A pesar de que el SDRC se ha convertido en foco de interés para múltiples estudios, no se ha determinado un gold stardard para su diagnóstico, el cual sigue siendo clínico[13],[14]. En el caso descrito previamente podemos encontrar la presencia de cambios vasomotores y tróficos, compatibles con los hallazgos realizados por Sang-Wook Oh en su estudio en el año 2019, en donde se demostró que la suma de la sensibilidad y especificidad para el diagnóstico de la enfermedad era más alta en la categoría sudomotor/edema, lo que aumentaba la tasa de precisión en la detección de la enfermedad[14].
Se identificó de forma muy temprana un SDRC tipo I el cual no se asocia a una noxa nerviosa concreta y el cual corresponde a cerca del 90% de todos los SDRC. El diagnóstico precoz y la realización de un abordaje y tratamiento multimodal temprano ha mostrado tener mejores resultados en el desenlace de los pacientes. El caso de esta paciente es afortunado ya que la misma venía en seguimiento bimensual por nuestra especialidad por otra patología (fibromialgia) y esto generó que fuera identificado rápidamente el diagnóstico de SDRC, lo que permitió una evolución satisfactoria, pudiéndose revertir el proceso de cronicidad que se venía iniciando al disminuirse la actividad nociceptiva perpetuada por los cambios autonómicos, evitando una reorganización de la corteza somatosensorial de forma permanente[15].
El manejo farmacológico de esta patología ha sido ampliamente estudiado, describiéndose la utilidad de diferentes grupos farmacológicos, desde bifosfonatos en las etapas iniciales de la enfermedad hasta calcitonina en las etapas más avanzadas. Los antidepresivos y los anticonvulsivantes como la gabapentina han mostrado mejoría en la percepción de síntomas dolorosos, pero no existen grandes estudios que los respalden[16]. En un metaanálisis realizado en el año 2018 se concluyó que la infusión de ketamina en comparación con el placebo disminuía la percepción de dolor, sin embargo, la evidencia aún requiere la realización de estudios aleatorizados y multicéntricos para determinar la utilidad de la misma[17].
En aquellos casos en los que el tratamiento farmacológico y la terapia de rehabilitación no generan mejoría, se considera la realización de un bloqueo simpático. El bloqueo simpático para el manejo de SDRC de miembros inferiores y el bloqueo de ganglio estrellado para el SDRC de miembros superiores fueron estudiados por Shim et al., por medio de la realización de un metaanálisis, en donde se comprobó la utilidad de la realización de los mismos, sin embargo mostró la necesidad de estudios a profundidad[12]. A pesar del reducido número de investigaciones sobre la eficacia del bloqueo simpático lumbar el procedimiento se utiliza ampliamente para el tratamiento del SDRC[18], en ocasiones se suele realizar neurolisis con fenol o alcohol para buscar efectos más duraderos, sin embargo, estos pueden asociarse a complicaciones tales como la neuralgia genitofemoral, que tiene una prevalencia de alrededor del 4%- 10%[17]. En el presente caso, se prefirió realizar el bloqueo sin neurólisis pensando en más adelante llevar a la paciente a radiofrecuencia, lo cual no ha sido necesaria hasta el momento dada la completa resolución de sus síntomas.
La importancia del caso expuesto anteriormente es precisamente la respuesta total al manejo intervencionista oportuno, llama la atención la respuesta completa únicamente al bloqueo simpático sin necesidad de una técnica que conlleve mayor durabilidad, por lo tanto, podría deducirse que el manejo temprano, en definitiva, mejora los desenlaces de este grupo de pacientes.
Referencias
1. Hernández-Porras BC, Plancarte-Sánchez R, Alarcón-Barrios S, Sámano-García M. Síndrome doloroso regional complejo: revisión. Cir y Cir (English Ed. 2017;85(4):366–74.
2. Héctor E, González H. Síndrome doloroso regional complejo Regional complex pain syndrome [Internet]. Arch Méd Camagüey. 2020;24(2):205–93. Available from: https://orcid.org/0000-0002-2765-1669
3. Pendón G, Salas A, García M, Pereira D. Síndrome doloroso regional complejo tipo 1. Análisis de 108 pacientes [Internet]. Reumatol Clín. 2017;13(2):73–7. https://doi.org/10.1016/j.reuma.2016.03.015 PMID:27132482
4. Knudsen LF, Terkelsen AJ, Drummond PD, Birklein F. Complex regional pain syndrome: a focus on the autonomic nervous system [Internet]. Clin Auton Res. 2019 Aug;29(4):457–67. https://doi.org/10.1007/s10286-019-00612-0 PMID:31104164
5. Urits I, Shen AH, Jones MR, Viswanath O, Kaye AD. Complex Regional Pain Syndrome. Current Concepts and Treatment Options; 2018.
6. Neumeister MW, Romanelli MR. C o m p l e x Re g i o n a l P a i n S y n d ro m e [Internet]. Clin Plast Surg. 2020 Apr;47(2):305–10. https://doi.org/10.1016/j.cps.2019.12.009 PMID:32115056
7. Cutts S, Gangoo S, Srinivasan SH, Pasapula C, Power D, Modi N. Complex regional pain syndrome : an evolving perspective. 2020;1–6. https://doi.org/10.1136/postgradmedj-2020-137808.
8. Halicka M, Vittersø AD, Proulx MJ, Bultitude JH. Pain reduction by inducing sensory-motor adaptation in Complex Regional Pain Syndrome (CRPS PRISMA) : protocol for a double-blind randomized controlled trial. 2020;1–24.
9. Kingery WS. Role of neuropeptide, cytokine, and growth factor signaling in complex regional pain syndrome. Pain Med. 2010 Aug;11(8):1239–50. https://doi.org/10.1111/j.1526-4637.2010.00913.x PMID:20704672
10. Halicka M, Vittersø AD, Proulx MJ, Bultitude JH. Review Article Neuropsychological Changes in Complex Regional Pain Syndrome. CRPS; 2020.
11. Finch PM, Drummond ES, Dawson LF, Phillips JK, Drummond PD. Up-regulation of cutaneous α1 -adrenoceptors in complex regional pain syndrome type I. Pain Med. 2014 Nov;15(11):1945–56. https://doi.org/10.1111/pme.12548 PMID:25220453
12. Kessler A, Yoo M, Calisoff R. Complex regional pain syndrome: An updated comprehensive review. 2020;
13. Harden NR, Bruehl S, Perez RS, Birklein F, Marinus J, Maihofner C, et al. Validation of proposed diagnostic criteria (the “budapest Criteria”) for Complex Regional Pain Syndrome. Pain. 2010 Aug;150(2):268–74. https://doi.org/10.1016/j.pain.2010.04.030 PMID:20493633
14. Oh SW, Choi SU, Park M, Shin JH. Validity of the Budapest criteria for poststroke complex regional pain syndrome. Clin J Pain. 2019 Oct;35(10):831–5. https://doi.org/10.1097/AJP.0000000000000741 PMID:31478951
15. Yang Y, Zhao Q, Zhang Y, Wu Q, Jiang X, Cheng G. Effect of Mirror Therapy on Recovery of Stroke Survivors: A Systematic Review and Network Meta-analysis [Internet]. Neuroscience. 2018 Oct;390:318–36. https://doi.org/10.1016/j.neuroscience.2018.06.044 PMID:29981364
16. Bruehl S. Complex regional pain syndrome. BMJ. 2015 Jul;351:h2730. https://doi.org/10.1136/bmj.h2730 PMID:26224572
17. Zhao J, Wang Y, Wang D. The Effect of Ketamine Infusion in the Treatment of Complex Regional Pain Syndrome : a Systemic Review and Meta-analysis. 2018;2–9. https://doi.org/10.1007/s11916-018-0664-x.
18. Lee Y, Lee CJ, Choi E, Lee PB, Lee HJ, Nahm FS. Lumbar Sympathetic Block with Botulinum Toxin Type A and Type B for the Complex Regional Pain Syndrome. Toxins (Basel). 2018 Apr;10(4):164. https://doi.org/10.3390/toxins10040164 PMID:29671801

 ORCID
ORCID
 Creative Commons Attribution
Creative Commons Attribution