Manuel A. Guerrero-Gutiérrez MD1,*, Orlando R. Pérez-Nieto MD.2, Diego Escarraman-Martínez MD. MSc.3, Antonio Ojeda Niño MD. FIPP.4, Eder I. Zamarron-López5, Ricardo Olivares-Reséndiz MD.6, Manuel A. Díaz-Martínez MD.7, Ernesto Deloya-Tomás MD.8, Jesús S. Sánchez-Díaz MD MSc.9, Maikel Silva-Llorente10, Karla S. Chora-Pérez11, Laura C. Mosqueda-Aguilera11, Susana Carbajo-Martínez MD.7, Dora E. Torres-Prado MD.12, Carlos Ferrando MD, PhD, DESA.13
Recibido: 12-09-2022
Aceptado: 22-11-2022
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 2 pp. 177-192|https://doi.org/10.25237/revchilanestv5223121124
PDF|ePub|RIS
Multimodal analgesia in critical care
Abstract
Pain management is r one of the greatest challenges in critical care. It is necessary to carry out a timely and optimal treatment with the least possible adverse effects, which is why multimodal analgesia is at the core of the critically ill patient. For this article, we did a search on PubMed based on an analysis of 7,109 indexed articles, from which we chose the most relevant ones for the writing of this article. Herein we present an updated review and an algorithm for pain management in critically ill patients. We highly recommend early pain recognition and treatment with the use of multimodal analgesia, so this will impact on patient’s evolution, inpatient stay, and their life quality.
Resumen
El manejo del dolor representa uno de los grandes retos en el cuidado del paciente crítico, por lo que es necesario realizar un tratamiento oportuno y óptimo con los menores efectos adversos posibles, es por ello que la analgesia multimodal simboliza un pilar fundamental en el paciente críticamente enfermo. Para este artículo, se realizó una búsqueda en PubMed en la que nos basamos en un análisis de 7.109 artículos indexados, de los cuales se tomaron los de mayor relevancia para la formación del presente. De tal manera que presentamos una revisión actualizada y un algoritmo de manejo del dolor en el paciente crítico. Recomendamos ampliamente reconocer y tratar el dolor de manera temprana con el uso de analgesia multimodal, lo que impactará en la evolución del paciente, los días de estancia intrahospitalaria y la calidad de vida.
-
Introducción
Casi todos los pacientes experimentan dolor en algún momento de su estancia en la unidad de cuidados intensivos (UCI) y al menos la mitad de estos presentan dolor de intensidad moderada a severa tanto en las UCI médicas como en las quirúrgicas[1]. Se trata de un síntoma común que presentan los pacientes en áreas críticas como urgencias, unidad de terapia intensiva y posquirúrgicos, por lo que es la causa de búsqueda de atención en 80% de los pacientes. Los pacientes en cuidados intensivos experimentan un estado de estrés debido a una multitud de factores y una proporción significativa es atribuible al dolor. El dolor puede ser causado o provocado por muchas condiciones preexistentes como aspectos médicos agudos, quirúrgicos o rutinarios (colocación de sondas o catéteres) y, en caso de no manejarse de manera adecuada, induce una gran cantidad de cambios fisiológicos deletéreos en la mayoría de los órganos y sistemas. Todos estos efectos perjudiciales pueden conducir a un aumento de la duración en estancia hospitalaria, en la unidad de cuidados intensivos y un incremento en la mortalidad[2].
Los protocolos de manejo en la unidad de cuidados intensivos se deben centrar sobre todo en la analgesia más que en una sedación profunda. El objetivo también debe ser evitar las infusiones continúas prolongadas y fomentar la titulación dirigida a objetivos específicos individualizados. Una manera de tener un control analgésico óptimo es mediante la combinación de diferentes fármacos con mecanismo de acción variable que se dirigen a diferentes receptores para controlar y mejorar el dolor. Este esquema de manejo analgésico multimodal permite un efecto sinérgico y reduce la cantidad de opioide necesario para controlar el dolor. Entre los medicamentos que se han estudiado como componentes del abordaje multimodal se encuentran el paracetamol, gabapentina/pregabalina, ketamina, magnesio, antiinflamatorios no esteroideos (AINE), duloxetina, dexmedetomidina y lidocaína. La combinación de fármacos de diferentes clases y diferentes mecanismos de acción ofrece una mejor oportunidad para una analgesia eficaz en dosis reducidas de los agentes individuales[3],[4].
La analgesia multimodal se define como aquella que engloba la combinación de dos o más fármacos y/o métodos anestésicos, respaldados por la farmacocinética y la farmacodinamia de los agentes empleados mediante sus interacciones (sinergia y aditividad) con el objetivo principal de brindar seguridad, disminuir los efectos colaterales y favorecer una recuperación temprana[5]. El objetivo de esta revisión es la actualización del manejo del dolor y de la analgesia multimodal en el paciente crítico.
Para la redacción de esta revisión se realizó una búsqueda en PubMed de las siguientes palabras clave: “multimodal analgesia” (3.038 artículos), “critical care, multimodal analgesia” (289 artículos) y “critical care, analgesia” (3.782 artículos).
-
Dolor en el paciente crítico
El dolor es una experiencia sensorial y emocional desagradable asociada o similar a la asociada a una lesión tisular real o potencial[6]. El dolor agudo se define como dolor de aparición reciente y, probablemente, de limitada duración. Su control adecuado influye en la disminución de la morbimortalidad y la estancia intrahospitalaria y, por lo tanto, en los costos de esta.
El dolor induce una respuesta de estrés y estimulación simpática adrenérgica que causan taquicardia, hipertensión, aumento del consumo de oxígeno del miocardio y pueden inducir isquemia miocárdica en pacientes susceptibles. Las causas de dolor del paciente de la UCI son diversas; primero está la propia enfermedad que ocasiona el ingreso a cuidados intensivos (politraumatismo, cirugía), después los distintos procedimientos invasivos necesarios para dar soporte intensivo al paciente, las técnicas rutinarias de higiene, o las diversas complicaciones que se puedan presentar durante la estancia en la UCI tales como la atrofia muscular, escaras, pie equino adquirido, procesos infecciosos, etc.
A la fecha, no se han establecido cuales son los factores de riesgo para un control del dolor difícil durante la estancia en la UCI. Sin embargo, a partir del estudio de otras poblaciones (dolor posquirúrgico), se puede extrapolar que los pacientes con síndromes dolorosos crónicos, consumo de opioides crónicos, alteraciones del estado de ánimo (ansiedad, depresión) y pensamientos catastróficos en torno al dolor, probablemente tengan mayor dificultad para el control del dolor adecuado durante su estancia en la UCI. Por lo tanto, es necesario investigar la historia previa de cada paciente e individualizar el abordaje del dolor.
-
Dolor procedimental
El dolor durante procedimientos (dolor procedimental) es extremadamente común[7] y puede condicionar la aparición de complicaciones agudas graves, además es probable que se siga tratando de manera inadecuada en un gran número de pacientes[8]. Es importante mencionar que este puede condicionar complicaciones agudas a graves que son evitables si se tratan de manera adecuada. Existen múltiples procedimientos realizados en la UCI que pueden causar dolor intenso. Los más dolorosos son la retirada del tubo torácico, la inserción del catéter arterial y la retirada de drenajes quirúrgicos. En la Tabla 1 se presentan una lista de otros procedimientos dolorosos.
El dolor de las incisiones abdominales mal manejado reduce la función diafragmática y causa hiperventilación y atelectasia. El dolor, especialmente en pacientes sedados, puede presentarse como agitación o delirio y cuando se maneja mal puede tener secuelas psicológicas como trastorno de estrés postraumático, depresión y ansiedad, o puede progresar a dolor crónico. Los efectos deletéreos sistémicos del dolor incluyen el síndrome de respuesta inflamatoria sistémica, hiperglucemia, inmunosupresión, cicatrización deteriorada de heridas, hipercoagulabilidad y aumento del catabolismo[9].
El manejo del dolor en el paciente crítico resulta desafiante puesto que, en primer lugar, la capacidad del enfermo para comunicar el dolor se encuentra disminuida, sin olvidar que existen otros trastornos agregados (trastornos del sueño y de ansiedad); además de que por la naturaleza compleja del cúmulo de morbilidades y su necesidad de tratamiento, nos enfrentamos a la interacción que dichos fármacos puedan generar entre sí.
Siempre que sea posible hay que tratar la causa del dolor y cuando existe dolor intenso que no mejora tras tratamiento inicial o hay empeoramiento súbito del mismo, se deben investigar las causas potencialmente tratables o considerar alguna complicación de la patología de base.
Tabla 1. Listado de procedimientos dolorosos realizados en la unidad de cuidados intensivos
| Colocación de catéter arterial |
| Colocación de catéter venoso periférico |
| Colocación de catéter venoso central |
| Colocación de tubo endotraqueal |
| Colocación de tubo torácico |
| Colocación de sonda nasogástrica |
| Extracción de sangre periférica |
| Retiro de acceso femoral |
| Retiro de tubo endotraqueal |
| Retiro de tubo torácico |
| Retiro de drenajes quirúrgicos |
| Retiro de sonda nasogástrica |
| Aspiración traqueal |
| Movilización |
| Higiene ocular y bucal |
| Cuidados de enfermería (baño, cambio de sábanas, reposicionamiento) |
| Ejercicios respiratorios |
¿Por qué es importante el tratamiento prematuro del dolor en el paciente críticamente enfermo?
El dolor es uno de los síntomas más experimentados en el enfermo de las unidades de cuidados intensivos posquirúrgicos y su tratamiento es un derecho fundamental de todos los pacientes; asimismo, es un indicador de buena práctica clínica y de calidad asistencial. En el paciente críticamente enfermo un tratamiento del dolor inadecuado tiene consecuencias que pueden empeorar el pronóstico a corto plazo y ocasionar complicaciones crónicas a largo plazo. Algunas complicaciones a largo plazo son el dolor crónico, trastorno de estrés postraumático, ansiedad, depresión, deterioro cognitivo y estrés postraumático. Se destaca la importancia del trastorno de estrés postraumático (TEPT), pues distintas series han observado que hasta 20% de los pacientes presenta TEPT al año, tras su estancia en la UCI. El dolor es un predictor de síntomas de estrés postraumático a los 6 meses, se cree que mientras más severo sea el dolor, existe mayor probabilidad de presentar TEPT[10].
La prevalencia del dolor en pacientes hospitalizados es de 84% con dolor moderado y 24,8% con dolor intenso[11]. El dolor experimentado en la UCI tiene el potencial de transición a dolor crónico y se ha demostrado que persiste en 12% a 44% de los pacientes 6 meses después del alta hospitalaria[12]. En este microambiente se tiende a tomar medidas sobre las condiciones que ponen en peligro inminente la vida y en muchas ocasiones se deja en segundo plano el manejo preventivo del dolor. Asimismo, se ha demostrado que debido al estrés que genera encontrarse en estado crítico y el causado por los procedimientos propios de la unidad, el enfermo puede desarrollar complicaciones provocadas por la secreción endocrina, retraso en la cicatrización de heridas, aumento en las infecciones nosocomiales, en el número de días de ventilación mecánica y estancia en la UCI.
-
Consideraciones fisiopatológicas del dolor en el paciente crítico
La percepción del dolor es igual en todos los pacientes; pero, lo que cambia es el contexto clínico. Las vías del dolor pertenecen a las vías aferentes con una secuencia de liberación de mediadores inflamatorios secundarios a la lesión tisular, que posteriormente se deriva en la estimulación nociceptiva y la transmisión del impulso doloroso a través del tracto espino- talámico y de este al sistema de activación reticular, el tálamo y la corteza somatosensorial, donde se interpreta y se da significado al dolor. En el enfermo crítico es aconsejable diferenciar la nocicepción del dolor. En los pacientes inconscientes (BIS < 60) se evalúa la nocicepción (ya que el dolor es una experiencia y requiere de la función de la corteza cerebral), para tal fin se disponen de diversos dispositivos o herramientas que valoran la reacción del sistema nervioso simpático a diversos estímulos. Es necesario recordar que en los enfermos de las unidades críticas esta suele utilizar agentes farmacológicos como los relajantes musculares que pueden alterar la capacidad de comunicación del paciente siendo este un motivo de analgesia ineficiente[13] (Figura 1).
-
Evaluación del dolor
El reconocimiento del dolor en los pacientes de la UCI es el primer paso importante en su tratamiento. Sin embargo, la comunicación verbal no siempre es posible debido a las dificultades en las formas de comunicación (por ejemplo, sedación, delirio, intubación traqueal, bloqueo neuromuscular y debilidad). Es necesario realizar una evaluación diaria con base en el paquete de medidas ABCDE. En este paquete, a la letra “A” corresponde el evaluar, prevenir y manejar el dolor (Assess, prevent, and manage pain) para el abordaje integral de los síntomas durante una enfermedad crítica. La implementación de estas acciones ha demostrado mejoras clínicamente significativas en los resultados, entre ellos la supervivencia, uso de ventilación mecánica, coma y delirio, reingresos a la UCI, etc. La autoevaluación del dolor se considera un patrón de oro y, siempre que sea posible, se debe intentar calificar el dolor autoinformado por el paciente utilizando escalas validadas-mínimo cada turno de enfermería (idealmente cada 4 h), cuando el paciente se queje de dolor, antes, durante y después de cada procedimiento potencialmente doloroso.
Las escalas de dolor pueden ser continuas o discretas, unidimensionales o multidimensionales, subjetivas u objetivas. Estas escalas de uso común en la UCI son unidimensionales y bastante útiles para evaluar el dolor y medir la respuesta al tratamiento (Tabla 2)[14].
¿Cómo evaluamos el dolor en el paciente critico?
En el entorno clínico se utiliza la escala de calificación numérica; sin embargo, resulta complicado por la comunicación con el paciente crítico. Asimismo, la evaluación de los signos vitales no está validada para la medición del dolor. Actualmente, se están desarrollando herramientas que sean menos complejas en la interacción con el enfermo, que se basen en datos fisiológicos y del comportamiento. Estos datos se refieren a acciones concretas que la persona pueda comunicar (voluntaria o involuntariamente), que sean observables ante el evaluador y que puedan indicar la presencia o ausencia de dolor. Por otro lado, la escala de dolor conductual (BPS, Behavioral Pain Scale) se centra en tres dominios: la expresión facial, el movimiento de las extremidades superiores y el cumplimiento con el ventilador. La BPS ha demostrado ser una escala de dolor válida y confiable; sin embargo, tiene una alta variabilidad entre evalua- dores[15]. Finalmente, la herramienta de observación del dolor en cuidados críticos (CPOT, Critical-Care Pain Observation Tool) se basa en cuatro dominios: la expresión facial, el acoplamiento a ventilador, la tensión muscular y los movimientos.
Tabla 2. Escalas para la evaluación del dolor
| Escalas de dolor para pacientes capaces de comunicarse
Escala visual analógica (EVA) |
Los pacientes marcan la intensidad de su dolor en una línea de 100 mm, con descriptores verbales en cada extremo 0: sin dolor, 100: dolor muy severo
La puntuación se obtiene midiendo la distancia en milímetros desde el extremo izquierdo de la línea |
| Escala de calificación numérica (NRS) | Los pacientes califican el dolor en una escala de 10 puntos 0: sin dolor, 10: dolor severo |
| Escala de calificación verbal (VRS) | Escala de 4 puntos, en la que se puede clasificar el dolor de la siguiente manera:
1: ausente, 2: leve, 3: moderado y 4: severo |
| Escalas de dolor para pacientes incapaces de comunicarse Escala de dolor conductual (BPS) | Esta escala utiliza observaciones clínicas de la expresión facial, los movimientos de las extremidades superiores y la sincronía con la ventilación mecánica
Varía de 3 a 12 puntuaciones. Las puntuaciones de > 6 requieren manejo del dolor |
| Herramienta de observación del dolor en cuidados críticos (CPOT) | La escala utiliza una observación clínica de cuatro componentes: expresión facial, movimientos corporales, tensión muscular y acoplamiento al ventilador para pacientes intubados o vocalización para pacientes extubados
Cada componente tiene una puntuación de 0 a 2 y la puntuación total varía de 0 a 8 Una puntuación de > 2 tiene una alta sensibilidad y especificidad para predecir dolor |
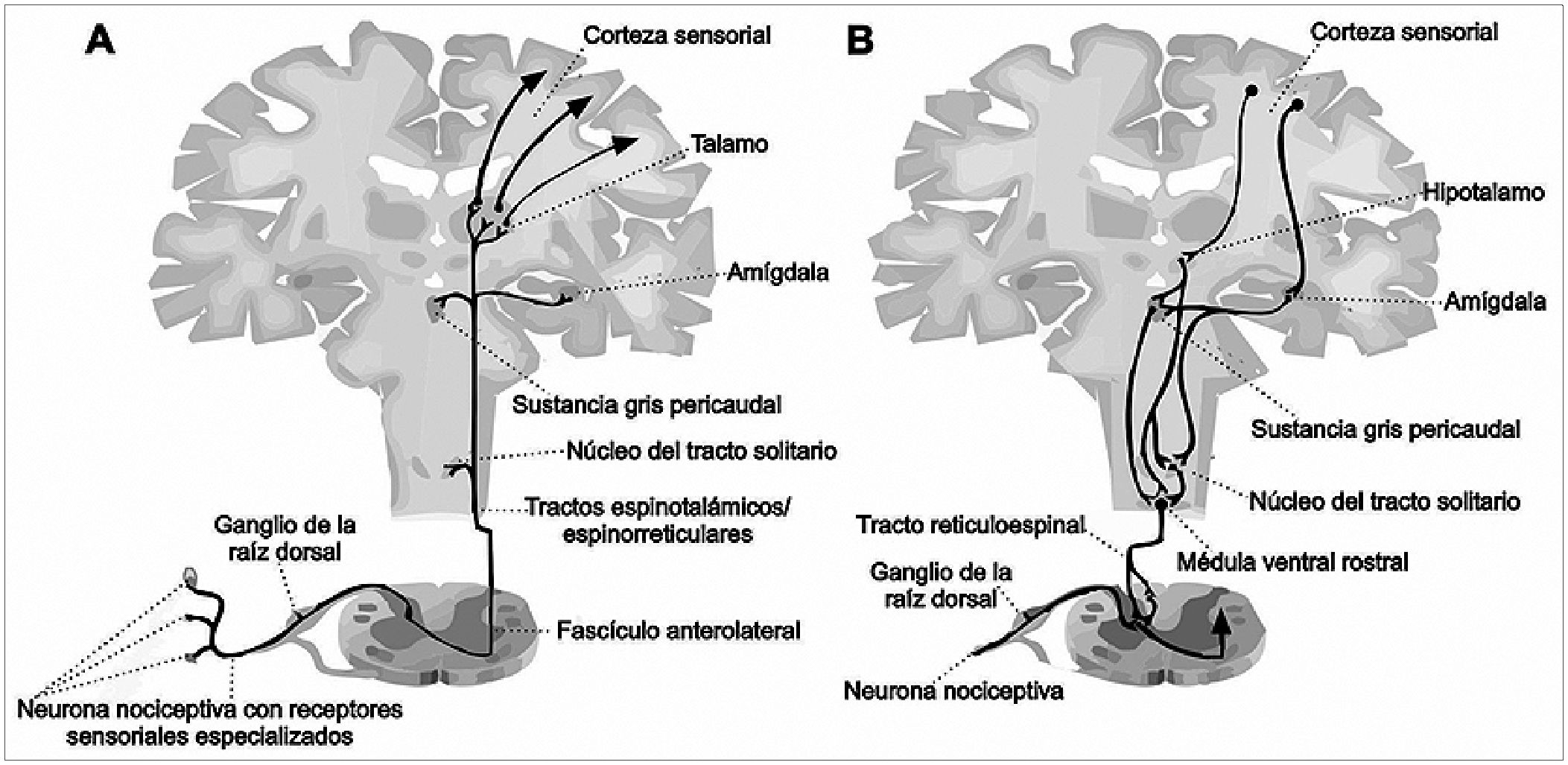
Figura 1. Vía de nocicepción ascendente y descendente. A: las señales nociceptivas ingresan a la médula espinal, a través de las neuronas que tienen receptores especializados alojadas en tejido y cuerpos celulares, localizados en los ganglios de la raíz dorsal. Luego, hay una sinapsis en la asta dorsal de la medula espinal, en las neuronas de proyección primaria que viajan en el fascículo anterolateral a través del tracto reticular y el tracto talámico espinal. Posteriormente, las proyecciones del tálamo se van hacia la corteza cerebral primaria; B: las vías descendentes comienzan en la corteza sensorial y se proyectan al hipotálamo y a la amígdala (núcleo del tracto solitario, NTS), médula ventral rostral (RVM) y sustancia gris pericaudal (PAG).
-
Manejo analgésico multimodal en la UCI
El abordaje multimodal del dolor consiste en involucrar técnicas farmacológicas y no farmacológicas. La analgesia multimodal farmacológica involucra el utilizar distintos medicamentos con diversos mecanismos de acción para potenciar su acción (sinergia) y disminuir los efectos secundarios. Los opioides siguen siendo la piedra angular en el tratamiento del dolor agudo en la UCI. De no haber contraindicación siempre hay que favorecer la vía oral; durante el soporte vasopresor se debe evitar la vía subcutánea o la enteral. Durante la hemodiálisis, se debe ajustar la dosis de los fármacos y metabolitos muy lipofílicos, o los que se unen fácilmente con proteínas, no se depuran y se pueden acumular. Asimismo, se deben disminuir la dosis y los intervalos de administración. El tratamiento no farmacológico es fundamental en el abordaje actual del dolor en cuidados intensivos, el cual incluye la terapia física, el soporte psicológico, el empleo de técnicas de relajación, la musicoterapia, la terapia eléctrica transcutánea (TENS) y otras técnicas de reciente aplicación, como la realidad virtual. Por lo tanto, el realizar una descripción de estos tratamientos potenciaría su revisión.
Dentro del abordaje multimodal del dolor, las técnicas de analgesia regional son otro de los pilares del tratamiento. Los principios básicos en el manejo del dolor en la UCI son muy similares al contexto perioperatorio. Las modificaciones importantes son: mayor uso de sedantes (sedoanalgesia) se asocia con depresión cardiovascular, mayor duración de la ventilación mecánica y estancia en cuidados intensivos, delirio y disfunción cognitiva. Los algoritmos que enfatizan la analgesia adecuada antes de la sedación (analgosedación o analgesia primero) reducen los requisitos de sedantes y la duración de la ventilación mecánica sin aumentar la incidencia de extubaciones accidentales o trastorno de estrés postraumático. Siempre que sea posible, se debe evitar el dolor e iniciar el tratamiento antes de los procedimientos potencialmente dolorosos[16]. La evidencia muestra que un enfoque basado en algoritmos para la sedación y el manejo del dolor mejora los resultados y, cualquiera que sea el algoritmo utilizado, la analgesia debe estar dirigida a objetivos y ajustarse al efecto (Figura 2).
Estos pacientes suelen tener múltiples alteraciones fisiológicas, lo que influye en el perfil farmacocinético y farmacodinámico. Algunos de estos factores son:
• Disfunción orgánica: la disfunción hepática y renal reduce el metabolismo y la excreción de fármacos y sus metabolitos activos.
• Empeoramiento de la disfunción orgánica inducido por fármacos: los AINE pueden empeorar la función renal.
• Íleo: absorción impredecible de fármacos administrados por vía oral
• Alteración de la unión a proteínas: aumento de las fracciones libres del fármaco en la hipoalbuminemia.
• Equilibrio ácido-base alterado: afecta las fracciones ionizadas y unidas de los fármacos.
• Flujo sanguíneo esplácnico alterado: reduce el metabolismo dependiente de las fases 1 y 2 (es decir, en pacientes con shock, inotrópicos o ambos).
• Interacciones medicamentosas: influyen tanto en el metabolismo como en la eficacia (sinergismo o antagonismo) de los medicamentos administrados de manera concomitante.
• Efectos farmacodinámicos: las alteraciones en la barrera hematoencefálica pueden provocar una mayor sensibilidad a los efectos de los fármacos (opioides y depresión respiratoria; toxicidad del SNC por anestésicos locales).
Es posible lograr una analgesia “ideal” mediante la combinación de técnicas o fármacos que actúen en la transducción, transmisión, modulación y percepción del dolor; por lo tanto, el método para el alivio del dolor debe ser equilibrado y combinarse con diferentes vías de administración, así como con fármacos analgésicos o anestésicos. Este es el objetivo de la analgesia multimodal.
Tipos de analgesia multimodal: utilización de los AINE, técnicas de analgesia regional, opioides endovenosos, infiltración de campo con anestésicos locales. El modelo ideal de analgesia multimodal es aquel que utiliza dosis bajas de fármacos de forma individualizada para lograr un efecto sinérgico, lo cual ahorra medicamento y disminuye los efectos adversos (Figura 3).
A continuación, se describirán los fármacos que se utilizan para el abordaje del dolor en el paciente crítico: opioides, dexmedetomedina, ketamina, sulfato de magnesio, paracetamol, antiinflamatorios no esteroideos (AINE), lidocaína, gabapentinoides, técnicas de analgesia regional y medidas no farmacológicas.
-
Opioides para el control del dolor en el paciente crítico
El término opioide se refiere a los compuestos con relación estructural a productos encontrados en el opio, que a su vez se deriva de la palabra griega opos, que significa “jugo”, ya que los opioides naturales se extraen de la resina de la amapola, Papaver somniferum. Los opioides incluyen los alcaloides naturales de la planta como morfina, codeína, tebaína y muchos derivados semisintéticos. Un opioide es una sustancia, que, sin importar su estructura, tiene propiedades funcionales y farmacológicas de un opioide. Los tres receptores opioides (3, p y k) pertenecen a la familia de rodopsina. Se han aislado cuatro subtipos distintos de receptores opioides en humanos: mu (p, OP3, MOR), delta (3, OP1, DOR), kappa (k, OP2, KOR) y nociceptina (nociceptina/orfanina FQ, OP4, NOR). Debe destacarse que se han definido al menos dos subclases de receptores mu y delta y tres subclases de receptores kappa; en la actualidad, no se considera al receptor sigma como opioide. Aunque todos ellos presentan una gran similitud estructural, se trata de receptores de membrana acoplados a proteína G que poseen distintos ligandos endógenos y producen algunas acciones similares y otras distintas.
Los receptores opioides 3, p y k tienen distribución amplia en encéfalo, médula espinal, tejido vascular y cardíaco, vías respiratorias, pulmones, intestino y varias células inmunitarias o inflamatorias. La selección del opioide ideal en cada paciente dependerá de sus comorbilidades, estado hemodinámico y de la severidad del dolor; por lo general, el dolor en el paciente crítico va de moderado a severo, por lo que es necesario conocer las potencias analgésicas de los opioides (Figura 4) (Tabla 3).
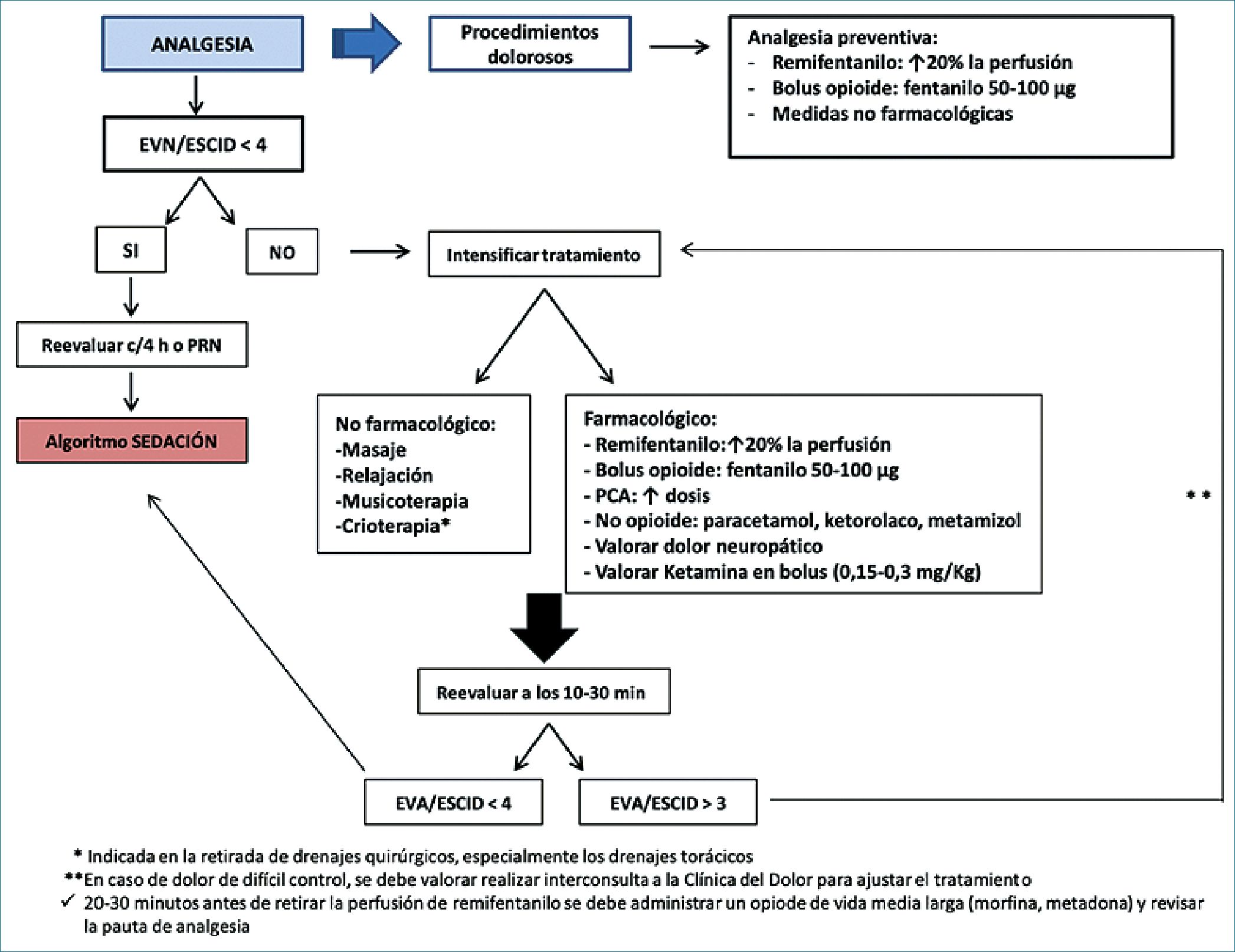
Figura 2. Algoritmo propuesto para el manejo de analgesia en la unidad de cuidados intensivos.
-
Efectos adversos de los opioides
El uso clínico primario de los opioides se debe a sus propiedades analgésicas, aunque producen otros efectos en el paciente. Esto no es de sorprender en virtud de la amplia distribución de receptores opioides en el encéfalo y la periferia. En el sistema nervioso tales efectos varían desde analgesia hasta efectos en la motivación y alteración del estado afectivo (euforia), excitación y varios procesos autonómicos, hormonales y motores. En la periferia, los opioides pueden influir en diversos sistemas visceromotores como náuseas o vómitos, que incluye aquellos relacionados con la motilidad gastrointestinal, y el tono del músculo liso como retención urinaria[31].
-
Morfina
La morfina tiene una absorción adecuada por vía oral y una vida media de 2 a 3 h, con una duración de 3 a 6 h debido a su alto grado de extracción hepática (90%). También tiene una biodisponibilidad baja (15% – 64%) y es variable de persona a persona. Asimismo, cuenta con un volumen de distribución de entre 1,5 – 1,7 L/kg y 36% está unido a proteínas, principalmente a la albumina. Se detectan concentraciones elevadas de morfina en distintos tejidos, principalmente hepático y renal; el paso al sistema nervioso central es escaso por ser uno de los opioides más hidrofílicos que alcanza concentraciones bajas en líquido cefalorraquídeo. Estas concentraciones son suficientes para producir el efecto analgésico.
-
Fentanilo
El fentanilo es un opioide sintético relacionado con las fenil- piperidinas y es un agonista puro. Las acciones del fentanilo y de sus fármacos relacionados como sufentanilo, remifentanilo y alfentanilo son similares a los de otros agonistas MOR. El fen- tanilo en un fármaco muy importante en la práctica anestésica por el poco tiempo que le toma alcanzar el efecto analgésico máximo (por ser altamente lipofílico), la rápida terminación del efecto después de la administración de dosis pequeñas, mínimos efectos depresores directos al miocardio y su capacidad para reducir las dosis necesarias de anestésicos inhalados (“efecto ahorrador de anestésicos inhalados”). Además de su utilidad en la anestesia, el fentanilo también puede utilizarse en el tratamiento del dolor intenso. Los efectos adversos son analgesia potente, náuseas, vómitos, prurito, rigidez muscular, depresión respiratoria dependiente de la dosis. Tiene una biodisponibilidad por vía oral de 90%, una vida media de 2 a 7 h y unión a proteínas plasmáticas al 83%.
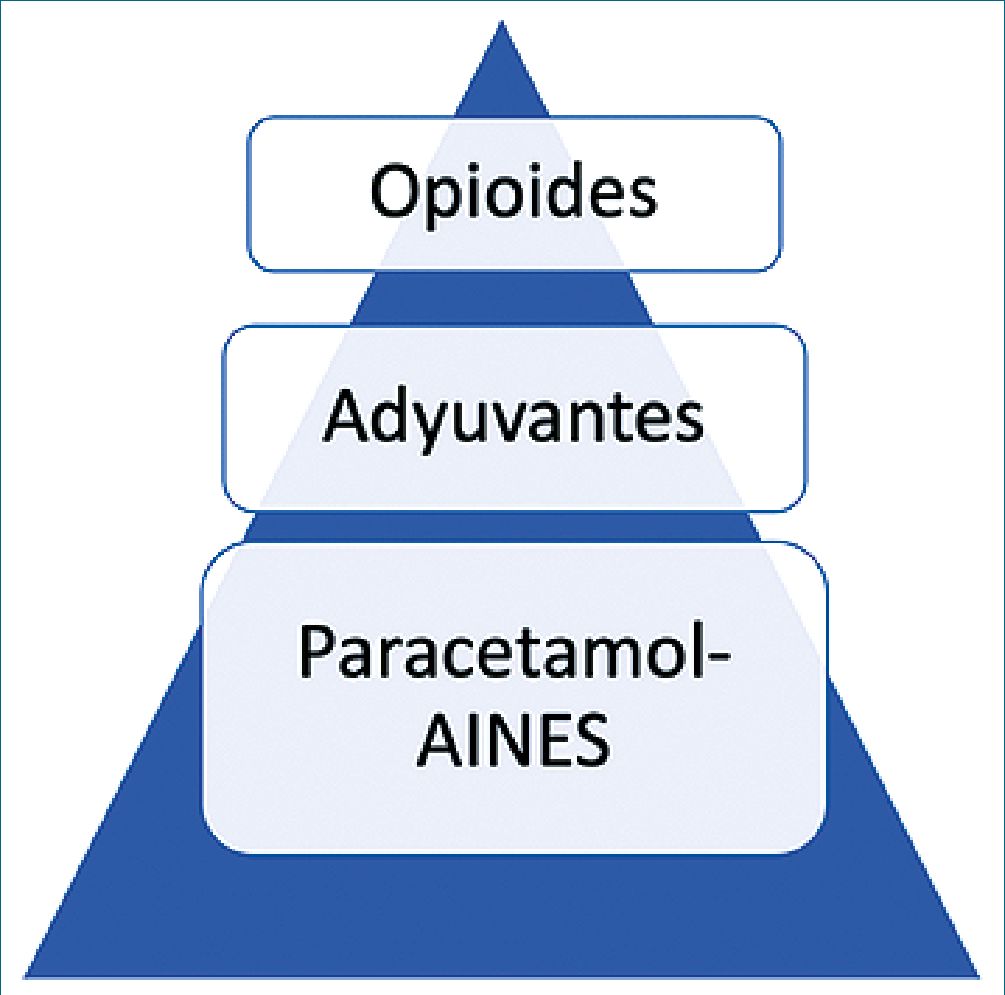
Figura 3. Nueva pirámide en el manejo del dolor.
Tabla 3. Potencias analgésicas de medicamentos opioides
| Opioide | Potencia analgésica opioide |
| Sufentanilo | 700 – 1.000 (17) |
| Fentanilo | 80 – 100 (18) |
| Remifentanilo | 80 – 100 (19) |
| Alfentanilo | 70 (20) |
| Buprenorfina | 30 – 50 (21) |
| Hidromorfona | 5 – 8 (22) |
| Oxicodona | 2 (23) |
| Metadona | 1.5 – 2, crónico 20 (24) |
| Hidrocodona | 1 (25) |
| Nalbufina | 1 (26) |
| Morfina | 1 (25) |
| Tramadol | 0,1 – 0,5 (27) |
| tTapentadol | 0,5 (28) |
| Dextropropoxifeno | 0,2 (29) |
| Codeína | 0,1 – 0,6 (30) |
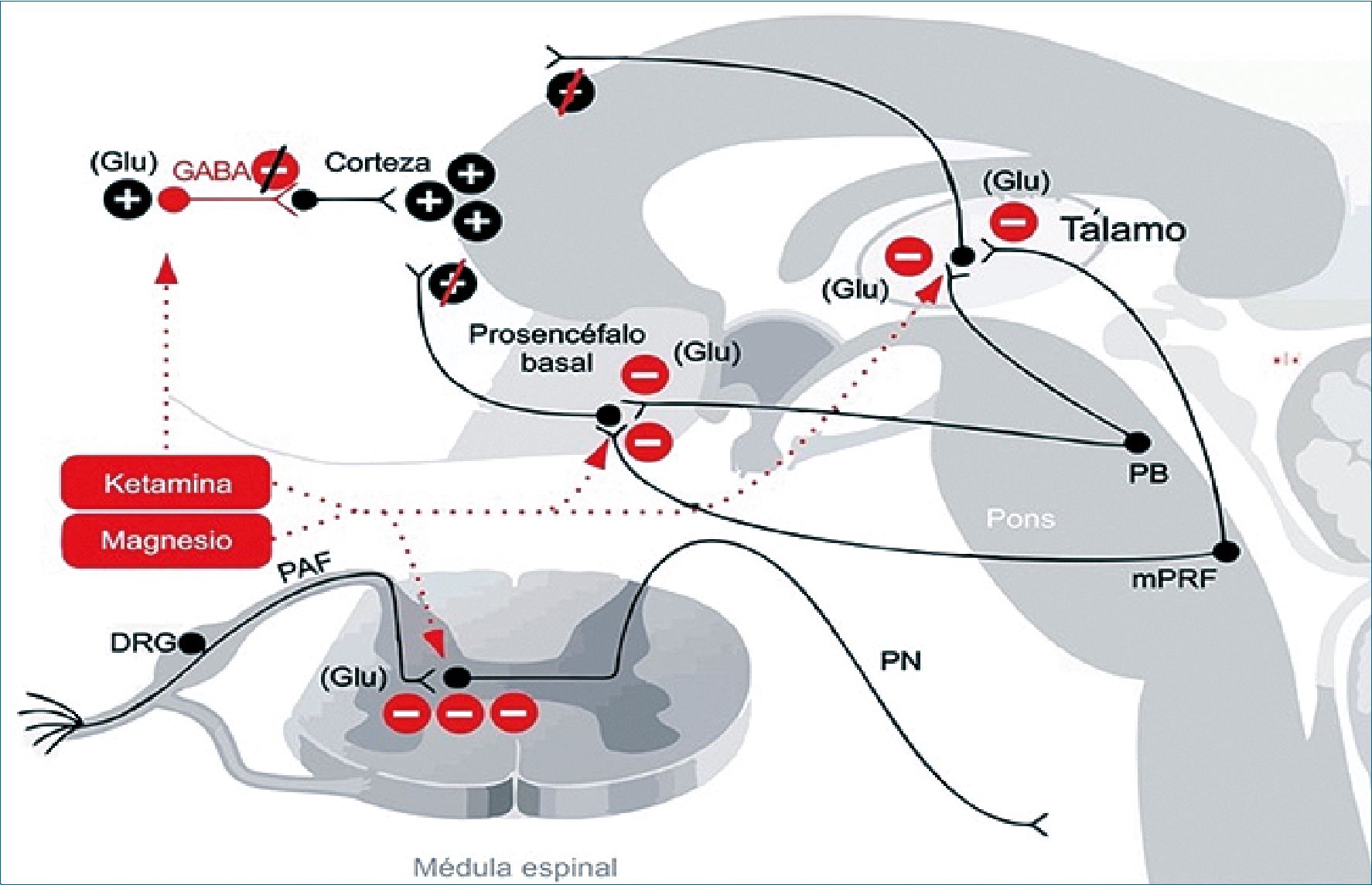
Figura 4. Opioides. El mecanismo de acción se lleva a cabo en receptores de opioides en el tronco encefálico de la médula espinal. Se genera una disminución de la excitación, producida por el bloqueo de las proyecciones colinérgicas de excitación desde el tronco del encéfalo al tálamo y la corteza. En la imagen se representan el efecto excitatorio y el inhibitorio con la simbología +. ACh: acetilcolina; DRG: ganglios de la raíz dorsal; Glu; glutamato; LDT: área tegmental latero dorsal; mPRF: formación reticular pontina medial; NE: norepinefrina; PAF: fibra aferente periférica; PAG: sustancia gris pericaudal; PN: neurona de proyección; PPT: área tegmental pedúnculo pontina; RVM: médula ventral dorsal.
-
Remifentanilo
Se trata de un opioide sintético anilidopiperidina, potente agonista mu (p), con un perfil farmacocinético único debido al rápido metabolismo por esterasas tisulares inespecíficas, con acción ultracorta (por lo que no se acumula), de fácil titulación, con recuperación rápida después de infusiones prolongadas, un metabolismo independiente de la función hepática o renal y que brinda estabilidad hemodinámica. Todas las características antes mencionadas lo hacen un fármaco ideal para el manejo del paciente crítico. Dentro de sus efectos adversos, y al igual que otros opioides, están la depresión respiratoria, náuseas y vómito; a concentraciones plasmáticas altas, genera bradicardia e hipotensión. Por último, una consideración importante en el trato postoperatorio inmediato es que tiene una analgesia evanescente debido a su perfil farmacocinético y su recuperación tan rápida.
-
Tramadol
Es un opioide ciclohexano agonista que se fija a receptores mu p, kappa k y delta 3. Inhibe la receptación de serotonina y noradrenalina en terminaciones nerviosas presinápticas. Tiene una biodisponibilidad por vía oral de 68%, con dosis repetidas aumenta a 90% a 100%. Tiene un metabolismo hepático del 80% con una excreción renal del 90% y una semivida de eliminación de 5 h. Es efectivo como monoterapia al igual que asociado a paracetamol u otros AINE en el dolor moderado o de moderado a severo. Los efectos adversos más comunes son somnolencia, hipotensión, taquicardia, mareos, confusión mental, sequedad de boca, cansancio, náuseas, vómitos y estreñimiento. Las nuevas propuestas de su mecanismo de acción suponen que su efecto opioide corresponde únicamente al 5%.
-
Buprenorfina
Fármaco agonista parcial opioide con una potencia 30 a 50 veces mayor a la de la morfina. Su empleo en la presentación en parche está limitado para el dolor crónico y existen presentaciones para administración por vía oral, sublingual y parenteral (intramuscular e intravenosa). Tiene una unión a proteínas plasmáticas del 96% y se metaboliza en el hígado. Su eliminación es de 2/3 del fármaco inalterado por heces y el otro tercio se elimina por vía urinaria. La administración vía sublingual produce un aumento significativo en la biodisponibilidad respecto a la vía oral y mantiene su efecto analgésico por 8 h, por lo que se administra a una dosis de 0,4 mg/8 h. Por vía transdérmica se mantienen los niveles terapéuticos durante 3 días[32].
-
Dexmedetomidina
Es un fármaco alfa 2 agonista selectivo de metabolismo hepático con una vida media de eliminación de 2 a 3 h, sigue un modelo de tipo tricompartimental con unión a proteínas del 94% y una eliminación predominantemente renal. Actúa directamente en los receptores ubicados en el SNC y en la médula espinal, específicamente en el locus cerúleo y en las astas dorsales, respectivamente. Una característica importante es que no modifica la mecánica ventilatoria ni los valores de SAO2 y ETCO2. Se ha demostrado que la infusión de dexmedetomidina reduce la prevalencia y la duración de confusión y delirio[33]. Se ha utilizado para tratar la abstinencia de opioides, benzodiacepinas y alcohol y se utiliza para mejorar la calidad de la analgesia y ayudar a la rotación de opioides en personas tolerantes a estos (p.ej., quemaduras o abuso de sustancias).
Tiene propiedades sedantes, ansiolíticas, analgésicas y un efecto importante sobre la respuesta simpática ante el estrés ya que disminuye la liberación de norepinefrina. El perfil de efectos secundarios incluye bradicardia e hipotensión, que llegan a limitar la dosis que se puede administrar de manera segura. La interrupción brusca de los agonistas a2 puede causar hipertensión de rebote y rara vez causa un síndrome de abstinencia (Figura 5).
-
Ketamina
Es un anestésico general disociativo, no barbitúrico y no narcótico. Su mecanismo de acción tiene varias vías, en las cuales se incluyen la interacción con los canales de calcio, la unión débil a receptores opioides, el bloqueo de los canales de sodio a altas dosis, los efectos anticolinérgicos por inhibición de receptores nicotínicos y muscarínicos, antagonismo no competitivo del receptor N- metil-D-aspártico (NMDA) e inhibición de la recaptación de noradrenalina y serotonina, lo que requiere de vías descendentes inhibitorias intactas para producir analgesia.
Los efectos analgésicos de la ketamina están mediados a través de los receptores NMDA y de manera parcial a través de los receptores opioides. Las dosis efectivas en bolo oscilan entre 0,15 mg/kg a 0,5 mg/kg y, por lo general, las infusiones se establecen en el rango de 0,1 a 0,2 mg/kg/h; también se considera útil a 2 mcg/kg/min. Los efectos psicosensoriales aumentan con dosificaciones superiores a 0,3 mg/kg, que se tienen que tomar en cuenta si se quiere utilizar como analgésico.
-
Sulfato de magnesio
El sulfato de magnesio es el cuarto catión más importante y muchos de sus efectos terapéuticos están mediados por el bloqueo de los canales de calcio, además de que el magnesio bloquea a los receptores de NMDA. El rango normal de magnesio en plasma es de 0,7 a 1,1 mmol/L (1,4 a 2,2 mEq/L). Las dosis usuales de sulfato de magnesio son de 30 a 50 mg/kg/h seguidas de una dosis de mantenimiento de 6 a 20 mg/kg/h en infusión continua. La dosis de mantenimiento, sin dosis de bolo inicial, también ha resultado efectiva para el tratamiento del dolor (Figura 6).
-
Paracetamol
El mecanismo de acción del paracetamol no se conoce bien, pero tiene efectos analgésicos y antipiréticos bien conocidos. El paracetamol se puede administrar a través de muchas vías, incluidas la oral, la intravenosa y la rectal. El paracetamol reduce las necesidades de opioides, por lo que, a menos que esté contraindicado, debe considerarse como un fármaco de primera línea en el tratamiento del dolor leve a moderado y debe incluirse como parte del régimen multimodal en el tratamiento del dolor intenso. La dosificación de paracetamol en pacientes con bajo peso corporal, reservas reducidas de glutatión (es decir, desnutrición o comorbilidad) debe realizarse con precaución, ya que el paracetamol puede potencialmente causar daño hepático incluso dentro de las dosis normales recomendadas.
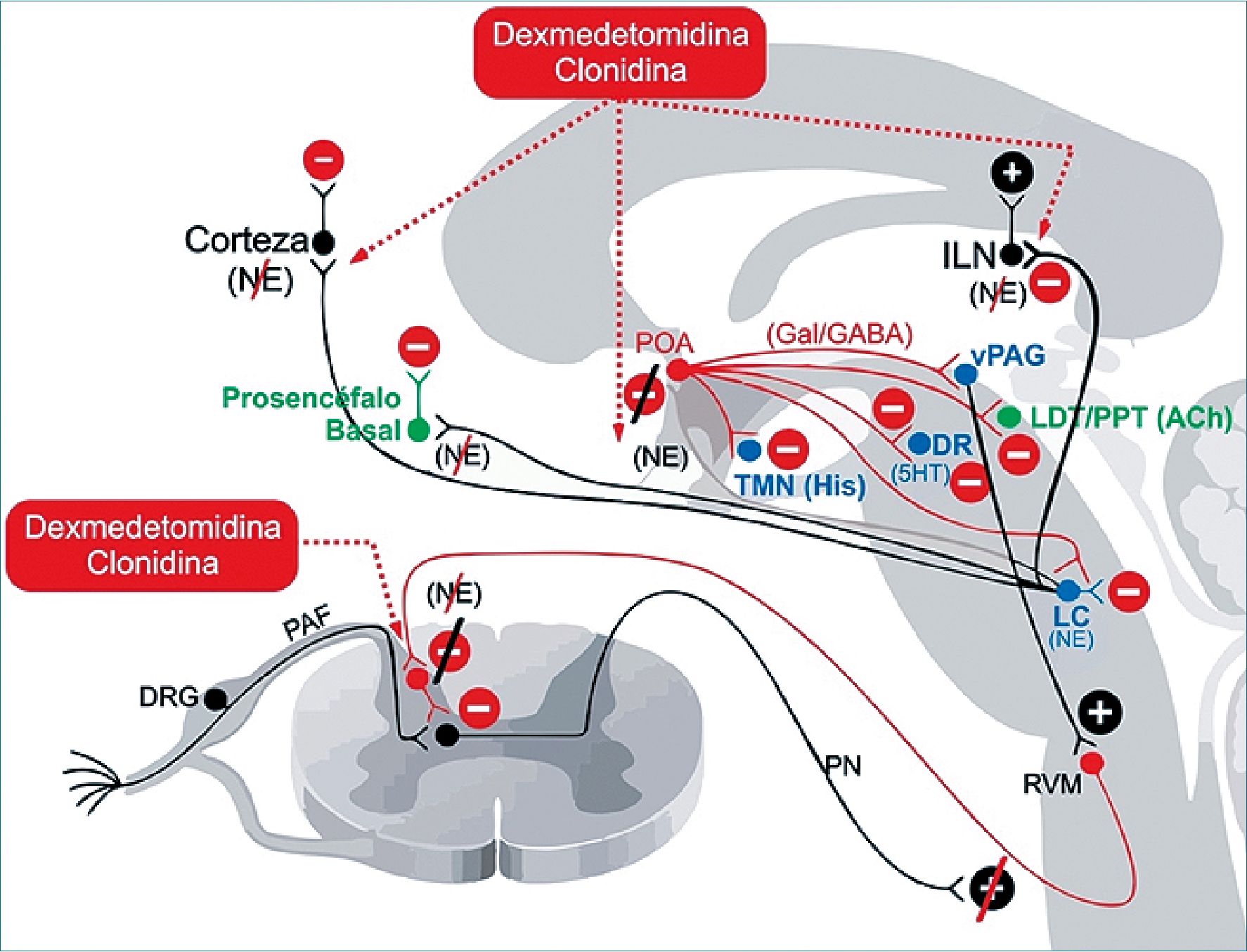
Figura 5. Dexmedetomidina y clonidina. La antinocicepción se produce principalmente a través de una actividad inhibitoria aumentada en las vías nociceptivas descendentes. La pérdida de conciencia se produce por la desinhibición mediada por NE del POA del hipotálamo, así como por la disminución de la señalización noradrenérgica en el tálamo y la corteza. 5HT: serotonina; ACh: acetilcolina; PA: dopamina; DR: nervio del rafe; DRG: ganglios de la raíz dorsal; GABAA: subtipo A del receptor ácido gamma aminobutírico; Gal: galanina; His: histamina; ILN: núcleo interlaminal del tálamo; LC: locus cerúleo; NE: norepinefrina; PAF: fibra aferente periférica; PN: neurona de proyección; POA: área preóptica; PPT: área tegmental pedúnculo pontina; RVM: médula ventral, TMN: núcleo tuberomamilar; vPAG: sustancia gris pericaudal.
El paracetamol ha sido la causa principal de insuficiencia hepática aguda en los Estados Unidos desde 1998 y requiere una advertencia sobre los riesgos hepatotóxicos. Aunque el paracetamol todavía se considera el analgésico más seguro, no hay estudios de alta calidad que hayan evaluado efectos adversos crónicos y la Administración de Alimentos y Medicamentos de Estados Unidos de América (FDA) supervisa la seguridad de su uso durante el embarazo.
-
Analgésicos no esteroideos (AINE)
Los AINE actúan mediante la inhibición de las enzimas ciclooxigenasa (COX) COX-1 y COX2. Regulan la producción de prostaglandinas y tromboxano a partir del ácido araquidónico con una proporción variable de COX-1 en comparación con la inhibición de COX-2. Los AINE tienen propiedades analgésicas, antipiréticas y antiinflamatorias. La propiedad analgésica de los AINE no se ha estudiado bien en pacientes críticamente enfermos, por lo que no está claro si los beneficios potenciales (p.ej., el tiempo reducido de ventilación mecánica o duración disminuida del íleo) superan los riesgos potenciales (es decir, disfunción renal o hemorragia gastrointestinal). En un estudio de cohorte retrospectivo de pacientes ingresados a la UCI después de fracturas costales, el uso de ketorolaco se asoció con una disminución de la neumonía, aumento del ventilador y días sin UCI. Las tasas de lesión renal aguda, hemorragia gastrointestinal y pseudoartrosis de fracturas no variaron[34] (Figura 7).
Los AINE deben evitarse en pacientes con riesgo de disfunción renal (hipovolemia y choque dependiente de inotrópicos), hemorragia gastrointestinal (ventilación mecánica, quemaduras y enfermedad hepática alcohólica) y en pacientes con anomalías plaquetarias, coagulopatía, terapia concomitante con inhibidores de la enzima convertidora de angiotensina, congestión, insuficiencia cardíaca, cirrosis o asma sensible a la aspirina. Incluso los inhibidores selectivos de la COX-2 tienen un efecto similar al de los AINE no selectivos en la reducción del flujo sanguíneo renal. Aparte de su administración a pacientes posoperatorios estables, los AINE tienen un uso limitado en la UCI y, en general, se evitan.
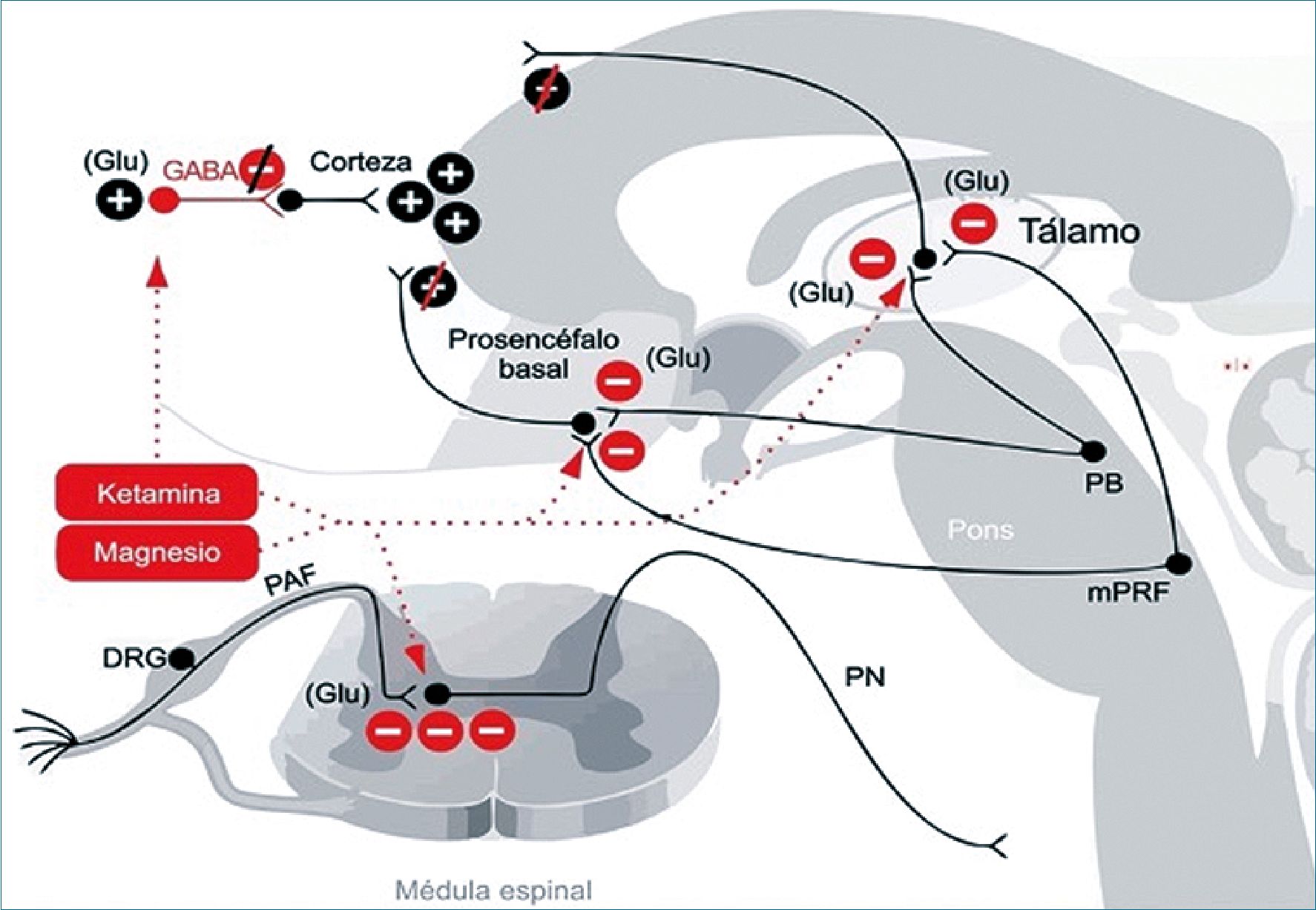
Figura 6. Ketamina y magnesio: Los mecanismos de antinocicepción se producen principalmente por el bloqueo de los receptores glutaminérgicos en médula espinal y en las proyecciones de activación que emanan del tronco cerebral. La ketamina en dosis bajas bloquea las interneuronas GABAérgicas. DRG: ganglios de la raíz dorsal; GABA: ácido gamma aminobutírico; Glu: glutamato; mPRF: formación reticular pontina medial; PAF: fibra aferente periférica; PB: núcleo parabraquial; PN: neurona de proyección.
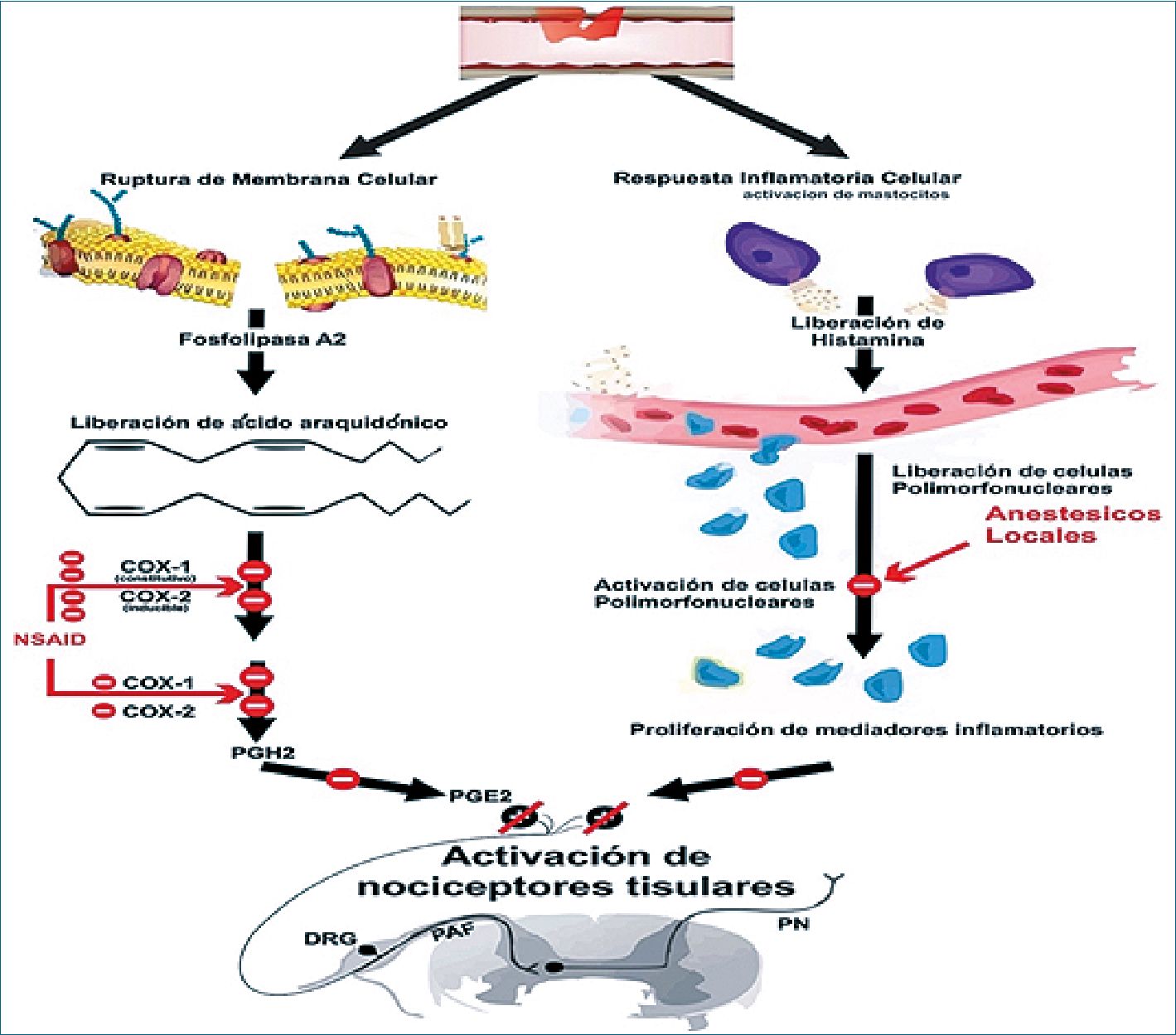
Figura 7. AINE y lidocaína. Los insultos quirúrgicos inducen la ruptura de membranas celulares, lo que lleva a la liberación de ácido araquidónico que, a través de los receptores COX-1 y COX-2, se convierte en prostaglandinas que son mediadores inflamatorios y nociceptivos potentes. Los AINE modulan la respuesta nociceptiva al bloquear las acciones de la COX-1 y la COX-2. La lidocaína ejerce sus efectos antinociceptivos al inactivar los canales de sodio e inhibe así la excitación de las terminaciones nerviosas y bloquea la conducción de los potenciales de acción en los nervios periféricos. También impide la desgranulación de los neutrófilos lo que impide la amplificación de la respuesta infamatoria. COX: ciclooxigenasa; DRG: ganglio de la raíz dorsal; AINE: antiinflamatorio no esteroideo; PAF: fibra aferente periférica; PGE2: prostaglandina E2; PGH2: prostaglandina H2; PGG2: prostaglandina G2; PN: neurona de proyección.
-
Lidocaína
La lidocaína es un anestésico local de tipo amida que ejerce su acción farmacológica mediante el bloqueo de los canales de sodio en los tejidos neurales, con lo que se interrumpe la transmisión neuronal. Esta acción se demuestra mejor cuando el fármaco entra en contacto directo con o en las proximidades de los tejidos neurales. Los efectos sistémicos de la lidocaína también están probablemente, o al menos parcialmente, relacionados con este mecanismo. Aún se desconoce el mecanismo exacto por el cual la lidocaína intravenosa proporciona analgesia sistémica.
Los estudios de ciencia básica y el trabajo adicional en modelos animales sugieren que el efecto sistémico de la lidocaína ocurre de manera predominante en los nervios dañados y disfuncionales, donde previene la despolarización de las membranas neuronales. Asimismo, se sugiere que la lidocaína sistémica también puede reducir y/o prevenir la neoproliferación de los canales de sodio activos y bloquear su disparo espontáneo, en especial en tejidos traumatizados y con cicatrices. En el dolor agudo, la lidocaína intravenosa muestra importantes propiedades analgésicas, antihiperalgésicas y antiinflamatorias. También reduce la sensibilidad y la actividad de las neuronas de la médula espinal (sensibilización central) y disminuye la despolarización posináptica mediada por el receptor de N–metil-D-aspartato. Otros estudios han demostrado además una disminución clínicamente relevante de los marcadores inflamatorios sistémicos en pacientes que reciben lidocaína de manera perioperatoria.
La dosis de lidocaína intravenosa necesaria para la analgesia en el período perioperatorio es de 1 a 2 mg/kg como bolo inicial seguido de una infusión continua de 0,5 a 3 mg/kg/h. El rango de dosis mayormente reportado y clínicamente efectivo parece ser de 1 a 2 mg/kg/h. La lidocaína tiene una alta tasa de extracción hepática y su metabolismo no solo depende de la capacidad metabólica hepática, sino también del flujo sanguíneo hepático. Una infusión continua (sin bolo) tardará entre 4 y 8 h en alcanzar una concentración plasmática en estado estable. En la interrupción después de la infusión prolongada, los niveles en plasma disminuyen con rapidez. El tiempo medio sensible al contexto después de una infusión de lidocaína de 3 días es de aproximadamente 20 a 40 min y no hay acumulación con el tiempo en individuos sanos.
A pesar del perfil de seguridad bien descrito en numerosos ensayos clínicos, debe reiterarse que la lidocaína sistémica tiene un índice terapéutico muy estrecho. Se produce toxicidad en el sistema nervioso central (SNC) (> 5 pg/ml) ligeramente por encima del nivel plasmático terapéutico (2,5 – 3,5 pg/ml). Los factores que influyen en la concentración plasmática de lidocaína libre incluyen la dosis y velocidad de inyección, estado ácido-base, hipercapnia e hipoxia, niveles bajos de proteínas plasmáticas y función hepática o renal disminuida[35].
-
Gabapentina y pregabalina
Los gabapentinoides (gabapentina y pregabalina), son vistos estructuralmente como análogos del neurotransmisor ácido gamma-aminobutírico (GABA), pero realmente no se unen a él. El mecanismo de acción más aceptado hasta el momento es la interacción con subunidades presinápticas a-2-3 de los canales de calcio, que favorecen la disminución en el influjo de calcio a este nivel y reducen la presencia de glutamato, sustancia P y norepinefrina en la sinapsis, lo que genera una disminución de la hiperexcitabilidad neuronal.
En el manejo multimodal del dolor, su uso se enfoca en mejorar los síntomas de dolor de tipo neuropático, disminuir el consumo de opioides y la evolución del dolor de agudo a crónico[36].
Los gabapentinoides solo están disponibles en la formulación enteral. La biodisponibilidad de gabapentina está inversamente relacionada con la dosis. La gabapentina se absorbe en una parte relativamente pequeña del duodeno y tiene una biodisponibilidad menor en comparación con la pregabalina, que se absorbe en todo el intestino delgado. Por lo tanto, la gabapentina será ineficaz en pacientes con alimentación yeyunal. Los efectos secundarios de los gabapentinoides incluyen somnolencia, mareos, confusión, convulsiones y ataxia. No se ha demostrado que su uso disminuya el dolor crónico postquirúrgico y pueden potenciar los efectos adversos de los opioides, requieren titulación y sus efectos analgésicos pueden requerir de días de administración.
Actualmente, se utilizan las guías de manejo del dolor neu- ropático crónico para el abordaje del dolor neuropático agudo, ya que se carece de evidencia científica para el manejo del dolor neuropático agudo. Recomendaciones actuales. Fármacos de primera línea: Gabapentinoides (gabapentina o pregabalina), antidepresivos tricíclicos (amitrptilina), antidepresivos duales (duloxetina, venlafaxina), anticonvulsivantes, carbamazepina[37].
En la Tabla 4 se mencionan los fármacos más utilizados para la analgesia multimodal en la UCI y sus características.
-
Analgesia regional
La analgesia regional en las unidades de terapia intensiva como parte de la analgesia multimodal, en sinergia con otros bloqueos de las vías nociceptivas, mejora considerablemente el dolor, reduce la respuesta al estrés y la probabilidad de presentar efectos secundarios, así como las complicaciones asociadas al uso de un solo medicamento para controlar el dolor.
A pesar de los beneficios que el uso de analgesia regional otorga, es también un método con consideraciones especiales para su práctica en la UCI, tales como la dificultad para posicionar al paciente, edema de tejidos, múltiples catéteres colocados, inestabilidad hemodinámica, ventilación mecánica, defectos en la coagulación, entre otros. Se ha extendido y valido de manera amplia la analgesia regional en el manejo del dolor posoperatorio; sin embargo, su papel en la UCI no está establecido, ya que la bibliografía es escasa y se utilizan estudios en pacientes no críticos.
Ventajas: disminuye la respuesta fisiológica al estrés quirúrgico o trauma y disminuye el consumo de opioides. Lo anterior puede facilitar el destete de la ventilación mecánica, la rehabilitación, el inicio de los movimientos intestinales y la disminución de la estancia hospitalaria.
Hay que tener consideraciones en el paciente críticamente enfermo, por lo que es importante conocerlas.
Tabla 4. Fármacos utilizados en la analgesia multimodal
| Fármaco | Dosificación | Vida media | Características |
| Fentanilo | Dosis de carga: 1-2 mcg/kg
Infusión de mantenimiento: 0.7-10 mcg/ kg/h |
45 min | Metabolizado en el hígado sin metabolitos activos
Acumulación en insuficiencia hepática Altamente soluble en lípidos La duración de la acción aumenta significativamente cuando se utilizan infusiones continuas durante períodos prolongados |
| Tramadol | Dosis en bolo: 1 – 1,5 mg/kg administrada en 20 minutos
Dosis subsecuentes en 24 h: 150 a 400 mg/ día, aplicar cada 8 h o en infusión continua |
6 h | Dosis máxima 300 mg por día
Alta biodisponibilidad oral, solo antagonismo parcial de la naloxona, causa menos depresión respiratoria Se acumula en caso de insuficiencia renal y hepática Precaución en pacientes con epilepsia Contraindicado con el uso concomitante de inhibidores de monoaminooxidasa |
| Morfina | Dosis en bolo: 0.05 mg/kg administrada en 5 a 15 minutos
Infusión: 2 – 6 mg/h |
2 – 4 h | Para infusión continua se debe calcular por 4 vidas medias Metabolizada por glucuronidación, metabolitos activos: M6G y M3G
La biodisponibilidad oral es deficiente 15% a 65% La M6G es más potente que la morfina y se acumula en la insuficiencia renal y la M3G puede causar delirio |
| Buprenorfina | Dosis en bolo: 1 mcg/kg administrada en 10 minutos
Dosis subsecuente: 0.2 – 0.7 mcg/kg (preferible mantenimiento en infusión) |
4 – 6 h | Su administración puede ser intravenosa o subcutánea |
| Remifentanilo | Infusión de mantenimiento: 0,025 – 0,1 mcg/kg/min | 3 – 10 min | |
| Lidocaína | Dosis en bolo: 1,5 – 2 mg/kg administrada en 5 minutos
Dosis subsecuente: en infusión de 1 – 1,3 mg/kg/h |
2 h | Evitar en pacientes con arritmias, falla cardiaca o coronaria |
| Sulfato de magnesio | Dosis en bolo: 40 mg/kg Infusión: 10 mcg/kg/h | Potencializa opioides y BNM | |
| Paracetamol | 1 g cada 6 a 8 h | 6 – 8 h | Dosis máxima 4 g/día |
| Metamizol | 1 g cada 6 a 8 h | 6 – 8 h | Riesgo de anemia aplacida |
| Gabapentina | Dosis inicial, 100 – 300 mg/día; ajustar hasta 1.800 – 3.600 mg/día | 5 – 7 h | |
| Pregabalina | Pregabalina: dosis inicial, 75 – 150 mg/día; ajustar hasta 450 – 600 mg/día | ||
| Dexmedetomidina | Dosis de impregnación 0,5 – 1 mcg/kg en 20 minutos
Infusión de mantenimiento 0,1 – 0.4 mcg/kg/h |
1,8 – 3,1 h | Provoca hipotensión y bradicardia |
| Ketamina | Dosis en bolo: 0,25 – 0,5 mg/kg
Infusión de mantenimiento transquirúrgico: 2 – 10 mcg/kg/min Infusión para manejo de dolor pos quirúrgico: 0,1 – 0,4 mg/kg/h |
2,5 – 5 h | Provoca efectos disociativos, alucinaciones, sueños vívidos, hipertensión y taquicardia
Precaución en pacientes con PIC elevada, cardiopatía isquémica, hipertensión significativa y estados psicóticos |
-
Consideraciones especiales para realizar técnicas locorregionales en la UCI:
– Movilización dificultosa del paciente.
– Edema de tejidos que puede dificultar el procedimiento: alteración de la anatomía, aumento de la distancia piel-aguja y distorsión de la imagen ecográfica.
– Etiquetar de manera apropiada los catéteres neuroaxiales o regionales para evitar errores de administración. En la UCI los pacientes por lo general presentan múltiples catéteres.
– Fijar con apósitos transparentes: valorar posible infección.
– Tunelización subcutánea (disminuye la colonización bacteriana).
-
Características particulares de los pacientes críticos:
– Inestabilidad hemodinámica, dificultad para técnicas neuroaxiales.
– Alteraciones de la coagulación.
– Procesos infecciosos: pacientes inmunodeprimidos, alta
prevalencia de infecciones nosocomiales.
– Ventilación mecánica: los cambios en la presión intratoráci- ca pueden afectar la distribución del anestésico local en el espacio peridural (PS > 7,5 cmH2O). Aumento de la extensión del bloqueo en Pd torácica[38].
-
Técnicas de analgesia regional
-
Analgesia peridural
La analgesia peridural puede reducir la morbilidad y la mortalidad en los pacientes posoperados de cirugía mayor abdominal y torácica al presentar efectos antiisquémicos, mejorar la oxigenación intestinal intraoperatoria y promover la motilidad intestinal posquirúrgica[39]-[41]. Smith y colaboradores también demostraron la reducción de complicaciones pulmonares tales como hipoxia, neumonía, atelectasias y falla respiratoria, así como la asociación a una reducción de hasta 60% en la necesidad de ventilación mecánica; de igual manera, se encontró una disminución de infección del sitio quirúrgico y de eventos tromboembólicos. No obstante, en esta revisión no se encontró una reducción en la mortalidad a 30 días, pero sí un aumento del riesgo de cursar con un infarto agudo al miocardio, que se sospecha tiene asociación con la tendencia a la hipotensión por bloqueo simpático[37]. Se mostró también que el uso de analgesia peridural hasta por 11 días puede ser seguro, siempre y cuando se monitoree al paciente de manera sistemática para identificar a tiempo alguna de las posibles complicaciones serias, aunque poco frecuentes, como infección, hematoma epidural y daño nervioso. Son más comunes otros efectos adversos en el paciente como hipotensión, prurito, bloqueo motor y retención urinaria[42].
-
Epidural torácica
Está indicada para trauma torácico, toracotomía, esterno- tomía, laparotomía supraumbilical, pancreatitis aguda. El dolor torácico no controlado favorece la inmovilidad, la respiración ineficaz y la incapacidad para una tos efectiva. Su uso puede prevenir atelectasias, neumonía, insuficiencia respiratoria, tromboembolismo pulmonar, retraso en la extubación[43].
-
Epidural lumbar
Está indicada en cirugía ortopédica mayor de extremidades inferiores, traumatismos en extremidades inferiores y enfermedad vascular de extremidades inferiores.
-
Bloqueo paravertebral en comparación con la epidural torácica
El bloqueo paravertebral redujo los riesgos de desarrollar complicaciones menores en comparación con el bloqueo epidural torácico. Este bloqueo fue tan eficaz como el bloqueo epidural torácico en el control del dolor agudo, aunque hubo una falta de evidencia en otros resultados. No hubo diferencias en la mortalidad a 30 días, en las complicaciones mayores ni en la duración de la estancia hospitalaria. No se encontraron datos suficientes sobre dolor crónico y costos[44],[45].
-
Contraindicaciones absolutas de analgesia peridural en la UCI
Algunas de las contraindicaciones son la infección y úlceras en el área de punción, alteraciones en la coagulación, anticoagulantes a dosis plenas en la colocación o retiro de catéter, hipovolemia severa, inestabilidad hemodinámica, íleo obstructivo, hipertensión intracraneal estenosis aortica o mitral severa, bacteriemia activa y sepsis.
-
Bloqueo de los nervios intercostales
Este bloqueo es útil para el dolor del tubo torácico, tiene pocos efectos adversos, posibilidad de neumotórax o absorción sistémica de anestésicos locales.
-
Bloqueos de los planos interfasciales
Consiste en la inyección anestésica local en planos anatómicos donde discurren los nervios que dan la sensibilidad de la pared torácica y abdominal. Requieren de gran cantidad de volumen de anestésicos locales y probablemente tienen menos efectos adversos y complejidad en comparación con otras técnicas “clásicas” (epidural, paravertebral).
Ejemplos de bloqueos interfasciales:
TAP: transversus abdominis plane, ESP: erector spinae plane, SAP: serratus anterior plane, QL: quadratum lumborun, BRILMA: bloqueo de las ramas intercostales en línea media axilar.
-
Otros bloqueos
La analgesia con métodos de bloqueo regional no se remite únicamente al bloqueo peridural, puesto que hay pacientes que no se beneficiarían del uso de analgesia peridural o tienen alguna contraindicación que no permite hacer uso de la misma. Existen otros bloqueos útiles en la UCI, como el bloqueo paravertebral, el bloqueo del plano transverso abdominal, bloqueo de la fascia de los rectos abdominales, bloqueos intercostales, bloqueos interpleurales, bloqueo del plano serrato, bloqueo del plano del erector espinal, bloqueos de las extremidades superiores e inferiores, bloqueo del plexo cervical superficial. Todos estos se realizan de manera guiada por ecografía.
De entre ellos se destaca el bloqueo del ganglio estrellado, que se ha popularizado en las UCI en los últimos años y se usa en numerosos escenarios como en el manejo de dolor regional complejo, para la recuperación de extremidades isquémicas causadas por extravasación de vasopresores, para reducir el vaso espasmo posterior a una hemorragia subaracnoidea, en arritmias ventriculares o para la estabilización del ritmo cardíaco después de la colocación de dispositivos de asistencia ventricular[46],[47].
-
Indicaciones de analgesia regional
Cirugía abdominal mayor. El manejo de dolor de estos pacientes posquirúrgicos se puede realizar con analgesia peridural torácica, indicada para cualquier laparotomía supraumbilical, que demuestra beneficios como la recuperación más rápida de la función intestinal, el incremento de flujo sanguíneo a las anastomosis, así como la reducción de falla de anastomosis.
Pancreatitis aguda. El uso de analgesia torácica por bloqueo peridural es una de las indicaciones mejor estudiadas de analgesia regional en la UCI. El catéter peridural se debe situar en la zona torácica inferior para producir el bloqueo de la inervación simpática del páncreas (T6-L2 con lo que se ha reportado una mejora en el flujo sanguíneo renal e intestinal, en la microcirculación pancreática, así como de la función hepática y pulmonar, lo que reduce la extensión de la necrosis pancreática[48],[49].
Cirugía torácica. Se puede utilizar analgesia torácica por medio de bloqueo peridural o con bloqueo paravertebral; con este último se disminuyen los efectos adversos del primero como retención urinaria, prurito, vómito e hipotensión[50].
Cirugía cardíaca. El manejo del dolor posquirúrgico en la UCI se puede realizar con analgesia torácica peridural ya que se demuestra una disminución del riesgo de infarto agudo al miocardio, los días de ventilación mecánica y de complicaciones pulmonares. Tiene como ventajas el ocasionar vasodilatación coronaria, mejorar la presión parcial de oxígeno coronaria, reducir la taquicardia supraventricular, reducir la respuesta inflamatoria posquirúrgica y una mayor cooperación para la realización de la fisioterapia, lo que da como resultado la disminución de la estancia intrahospitalaria[51].
Fractura de costillas. El manejo inadecuado del dolor en estos pacientes está asociado a atelectasias, disminución de la movilidad del paciente y del aclaramiento de secreciones, lo cual genera un aumento de desarrollo de neumonía, intubación y mortalidad. Se pueden utilizar bloqueo epidural torácico, bloqueo paravertebral, bloqueo intercostal o bloqueo del plano serrato[52].
Paciente politraumatizado. En estos pacientes se deberá individualizar el manejo ya que, tanto en ellos como en los pacientes con quemaduras, la valoración de la necesidad de analgesia regional dependerá del sitio, o sitios, afectado.
-
Manejo no farmacológico
-
Estimulación nerviosa eléctrica transcutánea (TENS)
Se trata de una terapia no invasiva, usada para el manejo del dolor que implica la aplicación de corriente eléctrica mediante electrodos que se colocan en la piel a una intensidad de < 10 a > 50 Hz. Su mecanismo de acción se basa en la activación de receptores centrales y periféricos. Activa receptores opioides y receptores agonistas alfa 2 de manera periférica, mientras que de manera central activa a los receptores opioides, muscarínicos y serotoninérgicos, en el cordón espinal y en el tronco encefálico. Existe la modulación del dolor al SNC y la producción de opioides endógenos[53]. Disminuye la producción de citoquinas inflamatorias[54]. Comparado con placebo, la TENS más terapia farmacológica disminuyen el dolor y mejoran la capacidad vital funcional[55]. Es efectiva de manera global como técnica complementaria; asimismo es segura y no tiene efectos secundarios.
-
Conclusión
El dolor es un problema común en cuidados intensivos y se siguen evaluando y manejando mal. Al controlar el dolor se debe hacer hincapié en la evaluación periódica y en el uso de un régimen analgésico multimodal basado en un protocolo. La decisión sobre la elección de los fármacos analgésicos debe tener en cuenta los diversos trastornos fisiológicos que también pueden ocurrir en la UCI, así como la posibilidad de que estos fármacos causen daño orgánico.
Los opioides siguen siendo el pilar del tratamiento de la analgesia; sin embargo, siempre que sea posible, se debe considerar un enfoque multimodal. La analgesia multimodal en el paciente grave es un área de oportunidad para la mejora de su pronóstico global. El aprovechamiento de los diferentes medios de control del dolor nos permite una disminución del uso de opioides y con esto las complicaciones asociadas a ellos. Asimismo, con la administración continua a dosis altas, se tienen que valorar de manera meticulosa el manejo individualizado y los requerimientos de cada paciente, así como el escalar o desescalar las terapias convergentes día con día.
Conflictos de interés: Todos los autores declaran no tener conflicto de interés.
Referencias
1. Chanques G, Sebbane M, Barbotte E, Viel E, Eledjam JJ, Jaber S. A prospective study of pain at rest: incidence and characteristics of an unrecognized symptom in surgical and trauma versus medical intensive care unit patients. Anesthesiology. 2007 Nov;107(5):858–60. https://doi.org/10.1097/01.anes.0000287211.98642.51 PMID:18073576
2. Narayanan M, Venkataraju A, Jennings J. Analgesia in intensive care: part 1. BJA Educ. 2016 Feb;2(2):72–8. https://doi.org/10.1093/bjaceaccp/mkv018.
3. Brown EN, Lydic R, Schiff ND. General anesthesia, sleep, and coma. N Engl J Med. 2010 Dec;363(27):2638–50. https://doi.org/10.1056/NEJMra0808281 PMID:21190458
4. Goldberg DS, McGee SJ. Pain as a global public health priority. BMC Public Health. 2011 Oct;11(1):770. https://doi.org/10.1186/1471-2458-11-770 PMID:21978149
5. Miranda-Rangel A. Anestesia multimodal: una visión de la anestesia moderna. Anestesiología. 2015;38:300–1.
6. Raja SN, Carr DB, Cohen M, Finnerup NB, Flor H, Gibson S, et al. The revised International Association for the Study of Pain definition of pain: concepts, challenges, and compromises. Pain. 2020 Sep;161(9):1976–82. https://doi.org/10.1097/j.pain.0000000000001939 PMID:32694387
7. Puntillo KA, Max A, Timsit JF, Vignoud L, Chanques G, Robleda G, et al. Determinants of procedural pain intensity in the intensive care unit. The Europain® study. Am J Respir Crit Care Med. 2014 Jan;189(1):39–47. https://doi.org/10.1164/rccm.201306-1174OC PMID:24262016
8. Payen JF, Bosson JL, Chanques G, Mantz J, Labarere J; DOLOREA Investigators. Pain assessment is associated with decreased duration of mechanical ventilation in the intensive care unit: a post Hoc analysis of the DOLOREA study. Anesthesiology. 2009 Dec;111(6):1308–16. https://doi.org/10.1097/ALN.0b013e3181c0d4f0 PMID:19934877
9. Ehieli E, Yalamuri S, Brudney CS, Pyati S. Analgesia in the surgical intensive care unit. Postgrad Med J. 2017 Jan;93(1095):38–45. https://doi.org/10.1136/postgradmedj-2016-134047 PMID:27777355
10. Fishbain DA, Pulikal A, Lewis JE, Gao J. Chronic Pain Types Differ in Their Reported Prevalence of Post -Traumatic Stress Disorder (PTSD) and There Is Consistent Evidence That Chronic Pain Is Associated with PTSD: An Evidence-Based Structured Systematic Review. Pain Med. 2017 Apr;18(4):711–35. https://doi.org/10.1093/pm/pnw065 PMID:27188666
11. Sawyer J, Haslam L, Daines P, Stilos K. Pain prevalence study in a large Canadian teaching hospital. Round 2: lessons learned? Pain Manag Nurs. 2010 Mar;11(1):45–55. https://doi.org/10.1016/j.pmn.2009.01.002 PMID:20207327
12. Wampole CR, Smith KE. Beyond Opioids for Pain Management in Adult Critically Ill Patients. J Pharm Pract. 2019 Jun;32(3):256–70. https://doi.org/10.1177/0897190019834479 PMID:30845871
13. McGuire DB, Kaiser KS, Haisfield-Wolfe ME, Iyamu F. Pain Assessment in Noncommunicative Adult Palliative Care Patients. Nurs Clin North Am. 2016 Sep;51(3):397–431. https://doi.org/10.1016/j.cnur.2016.05.009 PMID:27497016
14. Sessler CN, Grap MJ, Ramsay MA. Evaluating and monitoring analgesia and sedation in the intensive care unit. Crit Care. 2008;12 Suppl 3(Suppl 3):S2. https://doi.org/10.1186/cc6148.
15. Karcioglu O, Topacoglu H, Dikme O, Dikme O. A systematic review of the pain scales in adults: which to use? Am J Emerg Med. 2018 Apr;36(4):707–14. https://doi.org/10.1016/j.ajem.2018.01.008 PMID:29321111
16. Devlin JW, Skrobik Y, Gélinas C, Needham DM, Slooter AJ, Pandharipande PP, et al. Clinical Practice Guidelines for the Prevention and Management of Pain, Agitation/Sedation, Delirium, Immobility, and Sleep Disruption in Adult Patients in the ICU. Crit Care Med. 2018 Sep;46(9):e825–73. https://doi.org/10.1097/CCM.0000000000003299 PMID:30113379
17. Philbin DM, Rosow CE, Schneider RC, Koski G, D’Ambra MN. Fentanyl and sufentanil anesthesia revisited: how much is enough? Anesthesiology. 1990 Jul;73(1):5–11. https://doi.org/10.1097/00000542-199007000-00002 PMID:2141773
18. Peng PW, Sandler AN. A review of the use of fentanyl analgesia in the management of acute pain in adults. Anesthesiology. 1999 Feb;90(2):576–99. https://doi.org/10.1097/00000542-199902000-00034 PMID:9952166
19. Knotkova H, Fine PG, Portenoy RK. Opioid rotation: the science and the limitations of the equianalgesic dose table. J Pain Symptom Manage. 2009 Sep;38(3):426–39. https://doi.org/10.1016/j.jpainsymman.2009.06.001 PMID:19735903
20. Ortiz JR, Lora-Tamayo J. Opiáceos. Fentanilo, alfentanilo, sufentanilo, remifentanilo. Anestesia total intravenosa. Principios básicos. Aguilar Luciano. Bbraun Medical SA. Impreso S.A. de Litografía; 2009.
21. Pergolizzi J, Aloisi AM, Dahan A, Filitz J, Langford R, Likar R, et al. Current knowledge of buprenorphine and its unique pharmacological profile. Pain Pract. 2010;10(5):428–50. https://doi.org/10.1111/j.1533-2500.2010.00378.x PMID:20492579
22. Vadalouca A, Moka E, Argyra E, Sikioti P, Siafaka I. Opioid rotation in patients with cancer: a review of the current literature. J Opioid Manag. 2008;4(4):213–50. https://doi.org/10.5055/jom.2008.0027 PMID:18837204
23. Hernández-Ortiz A. Construction of a nomogram to facilitate the calculation of equianalgesic doses for opioid rotation. Rev Mex Anest. 2016;39(4):251–60.
24. Ripamonti C, Groff L, Brunelli C, Polastri D, Stavrakis A, De Conno F. Switching from morphine to oral methadone in treating cancer pain: what is the equianalgesic dose ratio? J Clin Oncol. 1998 Oct;16(10):3216–21. https://doi.org/10.1200/JCO.1998.16.10.3216 PMID:9779694
25. McPherson ML. Demystifying opioid conversion calculations. Bethesda (MD): American Society of Health System Pharmacists; 2010.
26. Vissers KC, Besse K, Hans G, Devulder J, Morlion B. Opioid rotation in the management of chronic pain: where is the evidence? Pain Pract. 2010;10(2):85–93. https://doi.org/10.1111/j.1533-2500.2009.00335.x PMID:20070552
27. Grond S, Sablotzki A. Clinical pharmacology of tramadol. Clin Pharmacokinet. 2004;43(13):879–923. https://doi.org/10.2165/00003088-200443130-00004 PMID:15509185
28. Gálvez R, Schäfer M, Hans G, Falke D, Steigerwald I. Tapentadol prolonged release versus strong opioids for severe, chronic low back pain: results of an open-label, phase 3b study. Adv Ther. 2013 Mar;30(3):229–59. https://doi.org/10.1007/s12325-013-0015-6 PMID:23475406
29. Gruber CM Jr. Codeine phosphate, propoxyphene hydrochloride, and placebo. J Am Med Assoc. 1957 Jun;164(9):966–9. https://doi.org/10.1001/jama.1957.02980090020006 PMID:13428571
30. Vissers KC, Besse K, Hans G, Devulder J, Morlion B. Opioid rotation in the management of chronic pain: where is the evidence? Pain Pract. 2010;10(2):85–93. https://doi.org/10.1111/j.1533-2500.2009.00335.x PMID:20070552
31. Brunton L, Chabner BA, Knollmann BC. Goodman y Gilman. Las bases farmacológicas de la terapéutica. 12 edición. DF, México: McGraw-Hill; 2012.
32. Alvarez Y, Farré M. Farmacología de los opioides. Revista Adicciones,2005;17(2):21-40.) https://www.redalyc.org/pdf/2891/289122022016.pdf
33. Shehabi Y, Howe BD, Bellomo R, Arabi YM, Bailey M, Bass FE, et al.; ANZICS Clinical Trials Group and the SPICE III Investigators. Early Sedation with Dexmedetomidine in Critically Ill Patients. N Engl J Med. 2019 Jun;380(26):2506–17. https://doi.org/10.1056/NEJMoa1904710 PMID:31112380
34. Yang Y, Young JB, Schermer CR, Utter GH. Use of ketorolac is associated with decreased pneumonia following rib fractures. Am J Surg. 2014 Apr;207(4):566–72. https://doi.org/10.1016/j.amjsurg.2013.05.011 PMID:24112670
35. Eipe N, Gupta S, Penning J. Intravenous lidocaine for acute pain: an evidence-based clinical update. BJA Educ. 2016 Sep;16(9):292–8. https://doi.org/10.1093/bjaed/mkw008.
36. Zakkar M, Frazer S, Hunt I. Is there a role for gabapentin in preventing or treating pain following thoracic surgery? Interact Cardiovasc Thorac Surg. 2013 Oct;17(4):716–9. https://doi.org/10.1093/icvts/ivt301 PMID:23832920
37. Neuropathic pain in adults: pharmacological management in non-specialist settings. London: National Institute for Health and Care Excellence (UK); 2020 Sep 22. (NICE Clinical Guidelines, No. 173.) Available from: https://www.ncbi.nlm.nih.gov/books/NBK552848/
38. Visser WA, Lee RA, Gielen MJ. Factors affecting the distribution of neural blockade by local anesthetics in epidural anesthesia and a comparison of lumbar versus thoracic epidural anesthesia. Anesth Analg. 2008 Aug;107(2):708–21. https://doi.org/10.1213/ane.0b013e31817e7065 PMID:18633056
39. Kozian A, Schilling T, Hachenberg T. Non-analgetic effects of thoracic epidural anaesthesia. Curr Opin Anaesthesiol. 2005 Feb;18(1):29–34. https://doi.org/10.1097/00001503-200502000-00006 PMID:16534314
40. Liu SS, Wu CL. Effect of postoperative analgesia on major postoperative complications: a systematic update of the evidence. Anesth Analg. 2007 Mar;104(3):689–702. https://doi.org/10.1213/01.ane.0000255040.71600.41 PMID:17312231
41. Freise H, Van Aken HK. Risks and benefits of thoracic epidural anaesthesia. Br J Anaesth. 2011 Dec;107(6):859–68. https://doi.org/10.1093/bja/aer339 PMID:22058144
42. Smith LM, Cozowicz C, Uda Y, Memtsoudis SG, Barrington MJ. Neuraxial and Combined Neuraxial/General Anesthesia Compared to General Anesthesia for Major Truncal and Lower Limb Surgery: A Systematic Review and Meta-analysis. Anesth Analg. 2017 Dec;125(6):1931–45. https://doi.org/10.1213/ANE.0000000000002069 PMID:28537970
43. Cywinski JB, Xu M, Sessler DI, Mason D, Koch CG. Predictors of prolonged postoperative endotracheal intubation in patients undergoing thoracotomy for lung resection. J Cardiothorac Vasc Anesth. 2009 Dec;23(6):766–9. https://doi.org/10.1053/j.jvca.2009.03.022 PMID:19525128
44. Yeung JH, Gates S, Naidu BV, Wilson MJ, Gao Smith F. Paravertebral block versus thoracic epidural for patients undergoing thoracotomy. Cochrane Database Syst Rev. 2016 Feb;2(2):CD009121. https://doi.org/10.1002/14651858.CD009121.pub2 PMID:26897642
45. Jabaudon M, Chabanne R, Sossou A, Bertrand PM, Kauffmann S, Chartier C, et al. Epidural analgesia in the intensive care unit: an observational series of 121 patients. Anaesth Crit Care Pain Med. 2015 Aug;34(4):217–23. https://doi.org/10.1016/j.accpm.2014.12.002 PMID:26004880
46. Tran DQ, Finlayson RJ. Use of stellate ganglion block to salvage an ischemic hand caused by the extravasation of vasopressors. Reg Anesth Pain Med. 2005;30(4):405–8. https://doi.org/10.1016/j.rapm.2005.04.007 PMID:16032594
47. Loyalka P, Hariharan R, Gholkar G, Gregoric ID, Tamerisa R, Nathan S, et al. Left stellate ganglion block for continuous ventricular arrhythmias during percutaneous left ventricular assist device support. Tex Heart Inst J. 2011;38(4):409–11. PMID:21841870
48. Windisch O, Heidegger CP, Giraud R, Morel P, Bühler L. Thoracic epidural analgesia: a new approach for the treatment of acute pancreatitis? Crit Care. 2016 May;20(1):116. https://doi.org/10.1186/s13054-016-1292-7 PMID:27141977
49. Jabaudon M, Belhadj-Tahar N, Rimmelé T, Joannes-Boyau O, Bulyez S, Lefrant JY, et al.; Azurea Network. Thoracic Epidural Analgesia and Mortality in Acute Pancreatitis: A Multicenter Propensity Analysis. Crit Care Med. 2018 Mar;46(3):e198–205. https://doi.org/10.1097/CCM.0000000000002874 PMID:29194144
50. Yeung JH, Gates S, Naidu BV, Wilson MJ, Gao Smith F. Paravertebral block versus thoracic epidural for patients undergoing thoracotomy. Cochrane Database Syst Rev. 2016 Feb;2(2):CD009121. https://doi.org/10.1002/14651858.CD009121.pub2 PMID:26897642
51. Landoni G, Isella F, Greco M, Zangrillo A, Royse CF. Benefits and risks of epidural analgesia in cardiac surgery. Br J Anaesth. 2015 Jul;115(1):25–32. https://doi.org/10.1093/bja/aev201 PMID:26089444
52. Britt T, Sturm R, Ricardi R, Labond V. Comparative evaluation of continuous intercostal nerve block or epidural analgesia on the rate of respiratory complications, intensive care unit, and hospital stay following traumatic rib fractures: a retrospective review. Local Reg Anesth. 2015 Oct;8:79–84. https://doi.org/10.2147/LRA.S80498 PMID:26604819
53. Cipriano G Jr, de Camargo Carvalho AC, Bernardelli GF, Tayar Peres PA. Short-term transcutaneous electrical nerve stimulation after cardiac surgery: effect on pain, pulmonary function and electrical muscle activity. Interact Cardiovasc Thorac Surg. 2008 Aug;7(4):539–43. https://doi.org/10.1510/icvts.2007.168542 PMID:18417519
54. Fiorelli A, Morgillo F, Milione R, Pace MC, Passavanti MB, Laperuta P, et al. Control of post-thoracotomy pain by transcutaneous electrical nerve stimulation: effect on serum cytokine levels, visual analogue scale, pulmonary function and medication. Eur J Cardiothorac Surg. 2012 Apr;41(4):861–8. https://doi.org/10.1093/ejcts/ezr108 PMID:22219414
55. Freynet A, Falcoz PE. Is transcutaneous electrical nerve stimulation effective in relieving postoperative pain after thoracotomy? Interact Cardiovasc Thorac Surg. 2010 Feb;10(2):283–8. https://doi.org/10.1510/icvts.2009.219576 PMID:19910359

 ORCID
ORCID