Adrián Gallardo RT.1,5,*, Patrick Sepúlveda Barisich RT.2,5, Adrián Pablo Dévoli3, Santiago Nicolás Saavedra4,5
Recibido: 23-01-2023
Aceptado: 15-03-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 4 pp. 360-364|https://doi.org/10.25237/revchilanestv52n04-05
PDF|ePub|RIS
Permissive atelectasis in mechanical ventilation
Abstract
There are many strategies for mechanical ventilation to optimize outcomes in patients with acute respiratory distress syndrome. In this sense, much has been written about “protective ventilation” or about the open lung concept. This is more complex to apply in patients with healthy lungs, interstitial or fibrotic pathologies. Recent studies showed that the lung areas that remain closed during mechanical ventilation suffer less mechanical stress and less release of proinflammatory cytokines. This approach, which could be considered as “permissive atelectasis” strategy, could be used in a specific population of patients, and achieve better outcomes than those obtained through the “open lung” strategy. This text shows the advantages of a different approach that could be useful in a specific subgroup of patients.
Resumen
Existen diferentes estrategias de asistencia ventilatoria mecánica a fin de optimizar los resultados en pacientes con distrés respiratorio agudo. En este sentido, mucho se ha escrito sobre la “ventilación protectora” o el concepto del pulmón abierto. Lo anterior es de aplicación más compleja en pacientes con pulmones sanos, patologías intersticiales o fibróticas. Estudios recientes muestran que las zonas pulmonares que permanecen cerradas durante la ventilación mecánica sufren menor estrés mecánico y menor liberación de citoquinas proinflamatorias. Este abordaje, que podría considerarse como estrategia con “atelectasias permisivas”, podría ser utilizado en una población específica de pacientes y alcanzar mejores resultados que los obtenidos mediante la estrategia del “open lung”. El presente texto muestra las ventajas de un enfoque diferente que podría ser de utilidad en un subgrupo específio de pacientes.
-
Introducción
A lo largo de los años se han acuñado diferentes estrategias para aplicar la asistencia ventilatoria invasiva a fin de optimizar los resultados de aquellos pacientes que la requieran, sobre todo en presencia de distrés respiratorio agudo y un pulmón afectado y reducido funcionalmente (“baby lung”). Esto se ha hecho evidente con mayor énfasis en las
variables devenidas de los parámetros ventilatorios (volumen tidal, PEEP, gradientes de presión y/o frecuencia respiratoria), en busca de evitar la lesión inducida por la ventilación. En este sentido, mucho se ha escrito sobre la “ventilación protectora” y el empleo de bajos volúmenes corrientes, la “hipercapnia permisiva”, el driving pressure o el concepto del pulmón abierto (conocido como “open the lung and keep it open”), el cual demanda valores de PEEP moderados a altos. Lo anterior es
particularmente de aplicación más compleja en pacientes con pulmones sanos, patologías intersticiales o fibróticas en quienes aún no se conoce con precisión el manejo ideal. Actualmente, el avance de la tecnología ha permitido el desarrollo de estudios para evidenciar y cuantificar la inflamación pulmonar sufrida con una ventilación injuriante durante los sucesivos ciclos respiratorios. Existe suficiente evidencia para sostener que las zonas pulmonares que permanecen cerradas durante la ventilación mecánica sufren menor estrés mecánico y, en consecuencia, menor liberación de citoquinas proinflamatorias. Este abordaje, que podría considerarse como “pulmón cerrado” o estrategia con “atelectasias permisivas”, podría ser utilizado en una población específica de pacientes y alcanzar mejores resultados que los obtenidos mediante la estrategia del “open lung”.
-
Injuria pulmonar asociada a la ventilación (VILI)
La ventilación mecánica invasiva (VMI) es una herramienta utilizada en la unidad de cuidados intensivos (UCI) para el tratamiento de la insuficiencia respiratoria aguda. Se ha reportado una incidencia cercana al 39%, mostrando que su aplicación es frecuente[1]. Sin embargo, su empleo no está exento de complicaciones y contratiempos que pueden entorpecer la evolución clínica, y paradójicamente, contribuir a generar mayor daño pulmonar[2],[3]. Esta situación es claramente visible en aquellas estrategias ventilatorias que no consideran los efectos secundarios de esta terapia. La VMI debe procurar reducir el stress mecánico, estático y dinámico, en ambas fases del ciclo respiratorio, al tiempo que se minimizan los trastornos hemodinámicos productos de la presión positiva intratorácica aplicada. Conceptos como volutrauma, barotrauma, atelectrauma, biotrauma o ergotrauma han sido ampliamente difundidos y considerados para evitar la lesión pulmonar asociada a la VMI (VILI). Esto es particularmente aplicable a los pacientes con síndrome de distrés respiratorio agudo (SDRA). Se han identificado varios mecanismos responsables, siendo los más sobresalientes la sobredistensión alveolar y la apertura y cierre continuos de unidades pulmonares con atelectasias[4]. Así, el empleo de un volumen tidal (VT) más bajo (calculado en 6-8 ml/kg de peso teórico) brinda una reducción de la relación presión/unidad de superficie durante la fase inspiratoria. Estos VT bajos combinados con niveles más altos de presión positiva al final de la espiración (PEEP), que buscan evitar el colapso espiratorio y, en consecuencia, el cierre y reapertura cíclicas de unidades respiratorias, se han sugerido como una estrategia ventilatoria protectora[5],[6]. No obstante, es de mencionar que VT bajos, si bien pueden evitar el volutrauma, también incrementan el espacio muerto y la hipercapnia. Los mecanismos por los cuales se puede producir VILI son variados y numerosos: la sobredistensión alveolar estática o dinámica, producto de un exceso de VT o exceso de PEEP; el “reclutamiento tidal”, que no es más que la apertura y cierre cíclicos de los alvéolos, secundarias al incremento del VT y una PEEP escasa (atelectrauma) o parámetros de mecánica ventilatoria (presión plateau, presión pico, driving pressure, presión transpulmonar), son algunos de estos mecanismos. Los beneficios de la ventilación protectora son principalmente atribuidos a la disminución del stress y strain secundarios al uso de VT bajo con la consecuente disminución del driving pressure,
y por tanto, al strain cíclico en un pulmón heterogéneo. Esta estrategia es la piedra angular de la protección pulmonar ya que ha demostrado disminuir todos los determinantes de VILI[21].
-
Concepto “Open lung”
A comienzos de la década de los 90’s se propuso una idea interesante: “open the lung and keep it open”[7] y, más tarde, se popularizó la “ventilación protectora”. La idea proponía alcanzar la máxima superficie de intercambio gaseoso sin distender el tejido pulmonar ni permitir su colapso durante la fase espiratoria. La ventilación con bajos volúmenes tidal mostró menor concentración de mediadores inflamatorios[8],[9]. Desde una perspectiva fisiopatológica el “enfoque de pulmón abierto” combinado con volumen tidal bajo, se considera la estrategia de ventilación óptima para minimizar el VILI en el SDRA. Sin embargo, los datos clínicos al respecto son contradictorios. Por ejemplo, estudios experimentales han reportado un incremento del edema pulmonar ante la aplicación de niveles crecientes de PEEP[10],[11], y al mismo tiempo, beneficios secundarios a la reducción del líquido intrapulmonar[12]. La estrategia de pulmón abierto y el efecto de niveles de PEEP moderados a altos permanece en debate. Por un lado ha demostrado ser efectiva en mejorar la oxigenación en SDRA moderado – severo por su rol en la disminución del VILI evitando el reclutamiento tidal (apertura y cierre); y por el otro, homogeneizando las presiones a través del parénquima. Uno de los estudios más grandes en pacientes con SDRA moderado a severo que comparó el uso de VT bajo, maniobras de reclutamiento y PEEP alto versus VT bajo y PEEP según tabla ARDSNet, demostró que la estrategia de PEEP alto aumentó la mortalidad a 28 días[22]. Si bien las estrategias de máximo reclutamiento pueden aumentar la oxigenación, también generan aumento de la presión intratorácica, sobredistensión del parénquima y disminución del gasto cardiaco. El grupo experimental tuvo mayor presión meseta, PaCO2 más elevada y mayor uso de fluidos lo que corrobora lo antes expuesto[22]. Además, altos valores de PEEP generarán mayor presión por unidad de superficie y deformación (estática y dinámica), llevando a las unidades alveolares a las zonas de deformación plástica o ruptura (Figura 1).
-
Concepto “Closed lung”
Los investigadores que defienden este enfoque, demostraron que el metabolismo pulmonar no muestra relación directa con las zonas de atelectasia, sino más bien con aquellas zonas donde se encuentran unidades respiratorias intermedias entre la atelectasia y la aireación[13]. Además, un estudio experimental, realizado en ratas, mostró que el daño producido por una ventilación mecánica injuriante (VT 25 ml/kg y PEEP 14 cmH2O) se origina en las zonas no dependientes (posiblemente por sobredistensión), mientras que las zonas dependientes parecían estar protegidas por la atelectasia y presencia de edema alveolar[14]. Estos, y otros estudios adicionales[15],[16], ponen de manifiesto que la sobredistensión alveolar (estática o dinámica) es un factor predeterminante del grado de inflamación pulmonar. De esta manera, las zonas de atelectasia se encontrarían “protegidas” en comparación a las zonas donde predomina la sobredistensión. Lo anterior supone el empleo de cantidades adecuadas de PEEP
a fin de abolir procesos cíclicos de apertura y cierre constantes, secundarios al “reclutamiento tidal”[15]. Al mismo tiempo, una PEEP adecuada evita la sobredistensión de los alveolos sanos (mayormente predispuestos a este tipo de daño), los que recibirían la presión de base más el VT programado. Distintos estudios han mostrado que tanto la deformación, en relación a su volumen de reposo (strain) o el stress generado de modo estático (PEEP) o dinámico (VT) pueden provocar daños e incrementar la liberación de mediadores inflamatorios o inactivar el surfactante[17],[18].
Adicionalmente, las presiones elevadas dentro del sistema respiratorio ejercen acción sobre el corazón derecho. Por ello, la evaluación ecocardiográfica a pie de cama, se ha constituido en una herramienta de gran importancia para optimizar los parámetros ventilatorios. Los incrementos desmedidos de PEEP, en busca del “open lung” podrían generar un cor pulmonale agudo secundario a las presiones elevadas y permanentes sumadas a una reducción del retorno venoso y, en consecuencia, del gasto cardíaco. Evitar, por tanto, los incrementos de PEEP, driving pressure y presión meseta, preservará la función hemodinámica del ventrículo derecho. Por lo anterior, se ha propuesto el empleo de bajos VT ya que se ha relacionado con mejores resultados clínicos[19]. Si bien se han obtenido ventajas sobre la oxigenación, al mismo tiempo se ha reportado que altos valores de PEEP, asociados con presión meseta conservada y VT más bajos afectan la función de las cavidades derechas[20].
Uno de los escenarios donde la PEEP alta se destaca como factor de injuria pulmonar y en donde el concepto de pulmón cerrado puede ser mejor entendido es el de las neumonías intersticiales o las exacerbaciones de las neumopatías intersticiales difusas[23]. En estos pacientes la hipoxemia no se beneficia de PEEP moderados ni altos y por tanto, la estrategia de pulmón abierto no juega un rol en ningún aspecto. Por el contrario,
puede agravar los determinantes del VILI al ser manejados equivocadamente como un SDRA convencional.
Es aquí donde la evaluación del potencial de reclutamiento ayuda a determinar la estrategia que obtendrá los mejores beneficios, teniendo en cuenta que mejorar la oxigenación (a cualquier costo) puede llevar a provocar daño pulmonar. Está demostrado que en SDRA el potencial de reclutamiento es muy variable y que los efectos de la PEEP estarán dados por la cantidad de tejido pulmonar predispuesto a ganar aireación, es decir, reclutar. Pudiendo ser este porcentaje de tejido reclutable muy marginal o incluso llegar hasta el 50% del peso total. Asimismo, los pacientes que presentan mayor potencial de reclutamiento poseen mayor severidad de daño pulmonar y por consiguiente están más predispuestos a VILI. Los pacientes que tienen mayor potencial de reclutamiento tienen marcadamente peor intercambio gaseoso, mecánica respiratoria y una tasa de mortalidad significativamente más alta que los pacientes no reclutables[24].
Es por lo anterior que estos pacientes no se benefician de la aplicación de PEEP alto ya que no otorga reclutamiento de las zonas hipoventiladas sino que conducen a sobredistensión con deterioro de la mecánica respiratoria. En este escenario es que se debe mantener un volumen corriente bajo como medida permanente y programar niveles de PEEP bajos < 5 cmH2O tomando en cuenta el muy bajo potencial de reclutamiento y el alto riesgo de sobredistensión. En un estudio de cohorte retrospectiva de pacientes en VMI con enfermedad pulmonar intersticial demostró que los pacientes que tenían PEEP > 10 cmH2O se asoció como un factor independiente de mortalidad a corto plazo sin efecto positivo en la oxigenación. Además, los pacientes que tuvieron un PEEP < 5 cmH2O tuvieron significativamente mejor sobrevida (mediana de tiempo sobrevida > 350 días) en comparación con los de PEEP > 10 cmH20 (mediana de tiempo de sobrevida 5,8 días)[25].
Asimismo, en pacientes con exacerbación aguda de enfermedad intersticial difusa se ha propuesto el modelo de “squishy ball”. Al aumentar la PEEP se produciría una protrusión de las zonas pulmonares más distensibles a través de los círculos de tejido fibrótico anelástico causando incremento de rigidez y facilitando la rotura del tejido subyacente[26]. Ante esto, cuando las áreas más reclutables que son sometidas al aumento de presión transpulmonar, la subsecuente hiperinflación se exacerba por la geometría del pulmón fibrótico actuando como amplificador del stress. En vista de lo anteriormente expuesto es que el rol fundamental del strain estático en estos pacientes determina VILI y por tanto, deben limitarse las presiones de vía aérea, manteniendo el VT bajo y disminuyendo el PEEP.
Por tanto, en este tipo de escenarios y ante la evidencia disponible es que la estrategia de pulmón abierto debe ser evitada dando paso a la estrategia de pulmón cerrado. Manteniendo el VT bajo y permitiendo zonas de pulmón atelectasiado con el fin de evitar la VILI, procurando un pH mayor a 7,25 y una oxigenación aceptable, es decir una PaO2 50 – 60 mmHg o SpO2 > 88%. La Figura 2 muestra la diferencia entre las estrategias de ventilación y las patologías donde pueden aplicarse.

Figura 1. Gráfica representativa de la deformación de materiales de acuerdo al módulo de Young, también aplicable al parénquima pulmonar. Utilizar cantidades crecientes de presión positiva al final de la espiración (PEEP) puede llevar a las unidades alveolares a la deformación plástica; B) o la ruptura; C). La estrategia de “atelectasias permisivas” supone utilizar cantidades de PEEP y volúmenes tidales para no sobrepasar el segmento A-B. El punto A indica el momento desde el cual una determinada cantidad de PEEP genera mayor cantidad de deformación en comparación con el stress.
-
Conclusión
Aunque existe evidencia sólida que sustenta la estrategia de
“atelectasias permisivas”, bajo el concepto de “closed lung”, el cambio de paradigma parece no tener la adherencia que requiere el manejo específico de algunos pacientes que se benefician de ella, observándose, de manera frecuente, valores de PEEP moderados a altos ante la existencia de hipoxemia severa, sea cual sea la etiología de ésta. Intentar maximizar los valores de presión parcial de oxígeno arterial mediante el empleo de valores altos de PEEP, o con maniobras de reclutamiento alveolar, puede mostrar resultados favorables en el corto plazo, sin embargo, lo anterior expuesto conducirá a una evolución clínica de un pulmón sobredistendido con consecuente injuria asociada a la ventilación y peores desenlaces a mediano plazo.
Esta estrategia de pulmón abierto suele utilizarse incluso en pacientes con pulmones sanos, en quienes valores de PEEP y presión meseta bajos podrían evitar la sobredistensión e inflamación alveolar sin deteriorar el intercambio de gases. Debe considerarse, no obstante, que bajos valores de PEEP y de presión meseta pueden predisponer a atelectasias y, en consecuencia, a la apertura y cierre cíclicos secundarios al reclutamiento tidal. Por lo anterior, la estrategia debe implementarse de forma personalizada tomando en cuenta la patología subyacente y sus características imagenológicas con estrecho monitoreo y control de las curvas del respirador, gases en sangre y signos vitales.
Aún queda mucho por investigar sobre la estrategia de “atelectasias permisivas” y sus beneficios, sin embargo, los estudios experimentales han mostrado resultados suficientes, sobre todo en patologías intersticiales como la fibrosis pulmonar o las exacerbaciones de enfermedades intersticiales difusas, las cuales, se benefician de mantener el PEEP en valores mínimos con un manejo estricto de la protección pulmonar, permitiendo regiones pulmonares mantenerse cerradas con el fin de evitar mayor inflamación. Asimismo, sostener niveles de oxemia
“aceptables” y permitiendo la hipercapnia consecuente a este manejo, convirtiéndose en la mejor opción terapéutica factible bajo la evidencia científica actual.
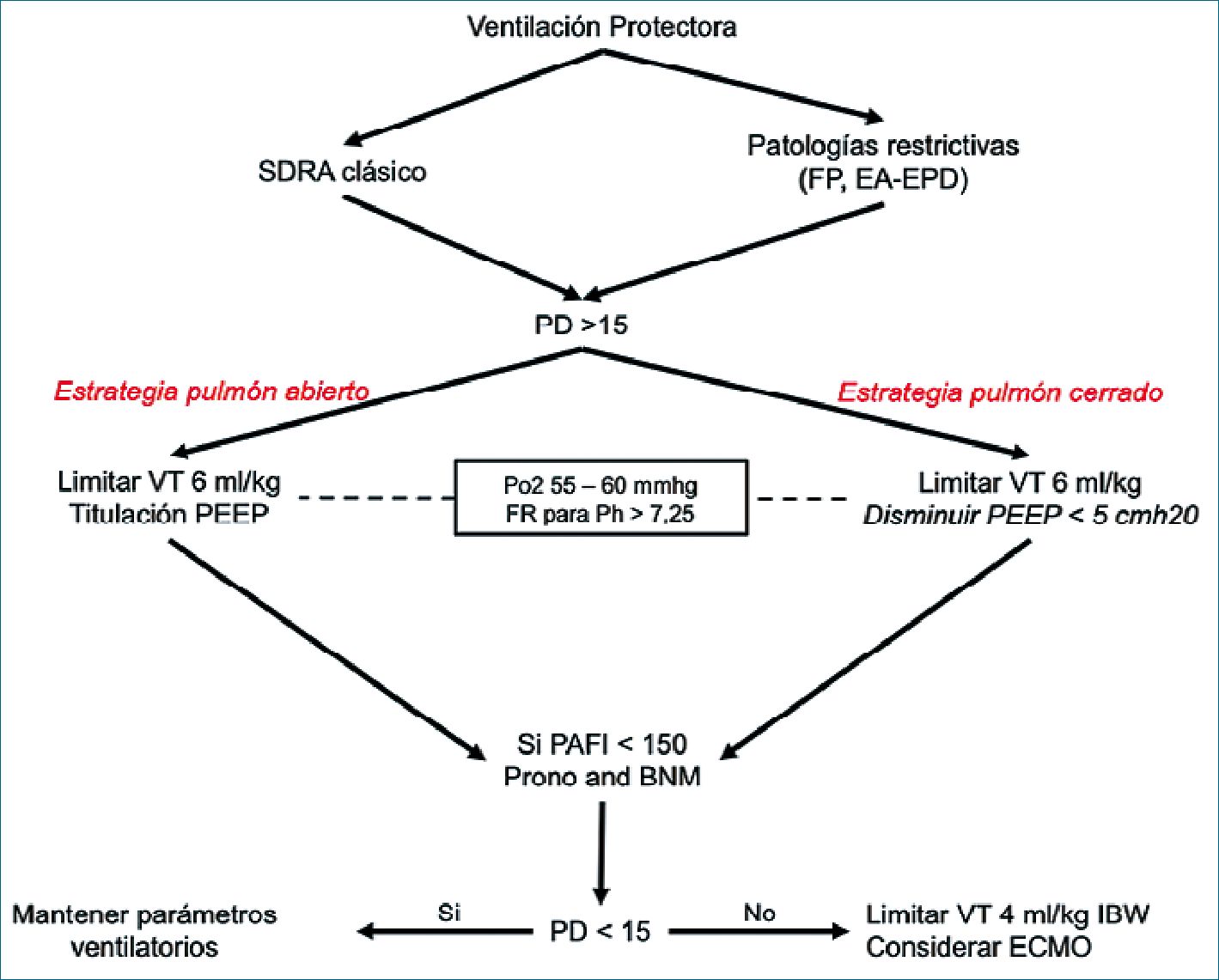
Figura 2. Algoritmo para ajustar parámetros en estrategia de pulmón cerrado. FP Fibrosis pulmonar, EA-EPD Exacerbación aguda de enfermedad pulmonar difusa, VT Volumen tidal, PD Presión de distensión, BNM Bloqueo neuromuscular, PAFI Razón de presión arterial de oxígeno y fracción inspirada de oxígeno, Po2 Presión parcial de oxígeno, FR Frecuencia respiratoria.
Conflictos de intereses: Ninguno.
Referencias
1. Esteban A, Anzueto A, Alía I, Gordo F, Apezteguía C, Pálizas F, et al. How is mechanical ventilation employed in the intensive care unit? An international utilization review. Am J Respir Crit Care Med. 2000 May;161(5):1450–8. https://doi.org/10.1164/ajrccm.161.5.9902018 PMID:10806138
2. Phua J, Badia JR, Adhikari NK, Friedrich JO, Fowler RA, Singh JM, et al. Has mortality from acute respiratory distress syndrome decreased over time?: A systematic review [Review]. Am J Respir Crit Care Med. 2009 Feb;179(3):220–7. https://doi.org/10.1164/rccm.200805-722OC PMID:19011152
3. Slutsky AS, Tremblay LN. Multiple system organ failure. Is mechanical ventilation a contributing factor? Am J Respir Crit Care Med. 1998 Jun;157(6 Pt 1):1721–5. https://doi.org/10.1164/ajrccm.157.6.9709092 PMID:9620897
4. Rocco PR, Dos Santos C, Pelosi P. Pathophysiology of ventilator-associated lung injury. Curr Opin Anaesthesiol. 2012 Apr;25(2):123–30. https://doi.org/10.1097/ACO.0b013e32834f8c7f PMID:22395439
5. Bellani G, Laffey JG, Pham T, Fan E, Brochard L, Esteban A, et al.; LUNG SAFE Investigators; ESICM Trials Group. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 2016 Feb;315(8):788–800. https://doi.org/10.1001/jama.2016.0291 PMID:26903337
6. Esteban A, Frutos-Vivar F, Muriel A, Ferguson ND, Peñuelas O, Abraira V, et al. Evolution of mortality over time in patients receiving mechanical ventilation. Am J Respir Crit Care Med. 2013 Jul;188(2):220–30. https://doi.org/10.1164/rccm.201212-2169OC PMID:23631814
7. Lachmann B. Open up the lung and keep the lung open. Intensive Care Med. 1992;18(6):319–21. https://doi.org/10.1007/BF01694358 PMID:1469157
8. Ranieri VM, Suter PM, Tortorella C, De Tullio R, Dayer JM, Brienza A, et al. Effect of mechanical ventilation on inflammatory mediators in patients with acute respiratory distress syndrome: a randomized controlled trial. JAMA. 1999 Jul;282(1):54–61. https://doi.org/10.1001/jama.282.1.54 PMID:10404912
9. Ranieri VM, Giunta F, Suter PM, Slutsky AS. Mechanical ventilation as a mediator of multisystem organ failure in acute respiratory distress syndrome. JAMA. 2000 Jul;284(1):43–4. https://doi.org/10.1001/jama.284.1.43 PMID:10872010
10. Caldini P, Leith JD, Brennan MJ. Effect of continuous postive-pressure ventilation (CPPV) on edema formation in dog lung. J Appl Physiol. 1975 Oct;39(4):672–9. https://doi.org/10.1152/jappl.1975.39.4.672 PMID:1104563
11. Demling RH, Staub NC, Edmunds LH Jr. Effect of end-expiratory airway pressure on accumulation of extravascular lung water. J Appl Physiol. 1975 May;38(5):907–12. https://doi.org/10.1152/jappl.1975.38.5.907 PMID:1126901
12. Colmenero-Ruiz M, Fernández-Mondéjar E, Fernández-Sacristán MA, Rivera-Fernández R, Vázquez-Mata G. PEEP and low tidal volume ventilation reduce lung water in porcine pulmonary edema. Am J Respir Crit Care Med. 1997 Mar;155(3):964–70. https://doi.org/10.1164/ajrccm.155.3.9117033 PMID:9117033
13. Bellani G, Messa C, Guerra L, Spagnolli E, Foti G, Patroniti N, et al. Lungs of patients with acute respiratory distress syndrome show diffuse inflammation in normally aerated regions: a [18F]-fluoro-2-deoxy-D-glucose PET/CT study. Crit Care Med. 2009 Jul;37(7):2216–22. https://doi.org/10.1097/CCM.0b013e3181aab31f PMID:19487931
14. Tsuchida S, Engelberts D, Peltekova V, Hopkins N, Frndova H, Babyn P, et al. Atelectasis causes alveolar injury in nonatelectatic lung regions. Am J Respir Crit Care Med. 2006 Aug;174(3):279–89. https://doi.org/10.1164/rccm.200506-1006OC PMID:16675780
15. Chu EK, Whitehead T, Slutsky AS. Effects of cyclic opening and closing at low- and high-volume ventilation on bronchoalveolar lavage cytokines. Crit Care Med. 2004 Jan;32(1):168–74. https://doi.org/10.1097/01.CCM.0000104203.20830.AE PMID:14707576
16. Wakabayashi K, Wilson MR, Tatham KC, O’Dea KP, Takata M. Volutrauma, but not atelectrauma, induces systemic cytokine production by lung-marginated monocytes. Crit Care Med. 2014 Jan;42(1):e49–57. https://doi.org/10.1097/CCM.0b013e31829a822a PMID:23963135
17. Marini JJ, Gattinoni L. Ventilatory management of acute respiratory distress syndrome: a consensus of two. Crit Care Med. 2004 Jan;32(1):250–5. https://doi.org/10.1097/01.CCM.0000104946.66723.A8 PMID:14707588
18. Gattinoni L, Carlesso E, Cadringher P, Valenza F, Vagginelli F, Chiumello D. Physical and biological triggers of ventilator-induced lung injury and its prevention. Eur Respir J Suppl. 2003 Nov;47 Supplement 47:15s–25s. https://doi.org/10.1183/09031936.03.00021303 PMID:14621113
19. Mekontso Dessap A, Boissier F, Charron C, Bégot E, Repessé X, Legras A, et al. Acute cor pulmonale during protective ventilation for acute respiratory distress syndrome: prevalence, predictors, and clinical impact. Intensive Care Med. 2016 May;42(5):862–70. https://doi.org/10.1007/s00134-015-4141-2 PMID:26650055
20. Mekontso Dessap A, Charron C, Devaquet J, Aboab J, Jardin F, Brochard L, et al. Impact of acute hypercapnia and augmented positive end-expiratory pressure on right ventricle function in severe acute respiratory distress syndrome. Intensive Care Med. 2009 Nov;35(11):1850–8. https://doi.org/10.1007/s00134-009-1569-2 PMID:19652953
21. Brower RG, Matthay MA, Morris A, Schoenfeld D, Thompson BT, Wheeler A; Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med. 2000 May;342(18):1301–8. https://doi.org/10.1056/NEJM200005043421801 PMID:10793162
22. Cavalcanti AB, Suzumura ÉA, Laranjeira LN, Paisani DM, Damiani LP, Guimarães HP, et al.; Writing Group for the Alveolar Recruitment for Acute Respiratory Distress Syndrome Trial (ART) Investigators. Effect of Lung Recruitment and Titrated Positive End-Expiratory Pressure (PEEP) vs Low PEEP on Mortality in Patients With Acute Respiratory Distress Syndrome: A Randomized Clinical Trial. JAMA. 2017 Oct;318(14):1335–45. https://doi.org/10.1001/jama.2017.14171 PMID:28973363
23. Travis WD, Costabel U, Hansell DM, King TE Jr, Lynch DA, Nicholson AG, et al.; ATS/ERS Committee on Idiopathic Interstitial Pneumonias. An official American Thoracic Society/European Respiratory Society statement: update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med. 2013 Sep;188(6):733–48. https://doi.org/10.1164/rccm.201308-1483ST PMID:24032382
24. Gattinoni L, Caironi P, Cressoni M, Chiumello D, Ranieri VM, Quintel M, et al. Lung recruitment in patients with the acute respiratory distress syndrome. N Engl J Med. 2006 Apr;354(17):1775–86. https://doi.org/10.1056/NEJMoa052052 PMID:16641394
25. Fernández-Pérez ER, Yilmaz M, Jenad H, Daniels CE, Ryu JH, Hubmayr RD, et al. Ventilator settings and outcome of respiratory failure in chronic interstitial lung disease. Chest. 2008 May;133(5):1113–9. https://doi.org/10.1378/chest.07-1481 PMID:17989156
26. Marchioni A, Tonelli R, Rossi G, Spagnolo P, Luppi F, Cerri S, et al. Ventilatory support and mechanical properties of the fibrotic lung acting as a “squishy ball”. Ann Intensive Care. 2020 Feb;10(1):13. https://doi.org/10.1186/s13613-020-0632-6 PMID:32020548

 ORCID
ORCID