Santiago Sánchez Freytes1,*
Recibido: 27-02-2023
Aceptado: 05-06-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 5 pp. 451-458|https://doi.org/10.25237/revchilanestv52n5-03
PDF|ePub|RIS
Fascial blocks anatomy and mechanisms: a review
Abstract
The introduction of ultrasound to anesthesiological practice has redefined the role of the fasciae and has expanded the arsenal of regional anesthesia techniques. The dizzying development of fascial blocks has generated great controversy around them. To review the recent developments around fascial blocks in anatomical aspects and mechanisms of action, as well as current controversies and potential lines of investigation. A bibliographic search related to fascial blocks was carried out in medical databases (Cochrane, PubMed) and specialized journals (Regional Anesthesia and Pain Medicine, Anesthesiology Journal, British Journal of Anesthesiology, among others). The keywords that have been used are: fascial blocks, anatomy, mechanism of action, review. The advent of ultrasound to regional anesthesia was accompanied by a myriad of new blocks, particularly those called fascial blocks. Their relative ease of implementation as well as their beneficial safety profile have led to their rapid introduction into medical practice. However, the anatomical foundations as well as the mechanisms of action that justify its action are not entirely clear. The arrival of ultrasound in regional anesthesia has redefined our understanding of this field of anesthesia. It is necessary to know these new concepts around fascial blocks to make this technique a safe and effective practice for our patients.
Resumen
La introducción del ultrasonido a la práctica anestesiológica ha redefinido el rol de las fascias y ha ampliado el arsenal de técnicas de anestesia regional. El vertiginoso desarrollo de los bloqueos fasciales ha generado gran controversia en torno a los mismos. Revisar los recientes desarrollos en torno a los bloqueos fasciales en aspectos anatómicos y mecanismos de su funcionamiento, así como actuales controversias y potenciales líneas de investigación. Se ha realizado una búsqueda bibliográfica vinculada a bloqueos fasciales en bases de datos médicas (Cochrane, PubMed) y revistas especializadas (Regional Anesthesia and Pain Medicine, Anesthesiology Journal, British Journal of Anesthesiology, entre otras). Las palabras claves que se han utilizado son: bloqueos fasciales, anatomía, mecanismo de acción, revisión. El advenimiento de la ecografía a la anestesia regional se acompañó de una miríada de nuevos bloqueos en particular de aquellos llamados fasciales. Su relativa facilidad de realización, asi como beneficioso perfil de seguridad ha llevado a una rápida introducción de los mismos a la práctica médica. Sin embargo, los fundamentos anatómicos, así como los mecanismos de acción que justifican su funcionamiento no están del todo claros. La llegada del ultrasonido a la anestesia regional ha redefinido nuestro entendimiento hacia este campo de la anestesia. Resulta necesario conocer estos nuevos conceptos en torno a los bloqueos fasciales para hacer de esta técnica una práctica segura y efectiva para nuestros pacientes.
-
Introducción
El advenimiento de la ecografía ha ampliado enormemente el campo de la anestesia regional, ya que desde su llegada se ha visto la proliferación de gran cantidad de bloqueos, particularmente aquellos denominados bloqueos fasciales[1]. Si bien el concepto de estos bloqueos no es nuevo, (Dalens[2] publica el bloqueo del compartimento de la fascia iliaca en 1989). El ecógrafo ha permitido ampliar nuestro entendimiento respecto a la fascia como órgano y, consecuentemente, han aparecido nuevos conceptos que han permitido tener un mayor entendimiento de la dinámica de los bloqueos regionales periféricos. La particularidad de estos bloqueos radica en que el objetivo no es la deposición del anestésico local en relación a un nervio periférico específico, sino que el fármaco es colocado en un compartimento delimitado por dos capas de tejido conectivo y el efecto analgésico se logra a partir del bloqueo de fibras aferentes nociceptivas[3].
A lo largo de la siguiente revisión, haremos un breve repaso de la anatomía, histología y fisiología de las fascias, para luego desglosar el mecanismo de acción de las mismas. Haremos un breve paso por la evolución de la anestesia regional en torno a los bloqueos fasciales y, finalmente, se discutirán temas controversiales en torno a los bloqueos fasciales, así como potenciales líneas de investigación.
-
Breve reseña anatomohistológica de las fascias y su funcionalidad
La fascia es un órgano compuesto esencialmente por tejidos blandos ricos en colágeno, que interconecta todo el cuerpo[4]. Tienen como función, la movilidad propia independiente de la musculatura subyacente, son reservorios de energía en movimiento, distribuyen fuerza y sostén y tiene una inervación e irrigación propia.
Desde un punto de vista anatómico, existen 3 capas de tejido fascial (Figura 1):
• Fascia superficial
– Se encuentra vinculada a la piel y divide al celular subcutáneo en un tejido superficial y uno más profundo conectado por fibras conectivas reticulares. De consistencia laxa, da la apariencia loculada al tejido graso del celular subcutáneo[5].
• Fascia profunda
– Se trata de un tejido multilaminar y es el sitio donde depositamos el anestésico local al hacer los bloqueos fasciales[6]. Se extiende a lo largo de todo el cuerpo y cuenta con anclajes al sistema muscular que la mantiene bajo tensión. Carece de grasa y forma compartimentos para vasos, nervios y diferentes órganos. Histológicamente consiste en una red de fibras colágenas mezcladas con fibras de elastina “flotando” junto con células como fibroblastos y adipocitos en una matriz de ácido hialurónico y proteoglicanos. De esta forma las fascias son permeables a soluciones acuosas[5]. La fascia profunda es independiente del tejido muscular adyacente y está separado del mismo por el epimisio y tejido celular laxo[7]. Dado que no todas las fascias son iguales y tanto su adhesión a planos profundos como su grosor puede alterar la difusión del anestésico local hacia el sitio objetivo, algunos autores la subdividen en[8]:
• Fascia epimisial: es más delgada (150-200 pm), es propia de cada músculo, por lo que tiene mayor adhesión a los mismos a través de septos fibrosos. Ej. Fascia pectoral (PEC block), Fascia del serrato (Bloqueo del serrato).
• Fascia aponeurótica: es más gruesa (600-1.400 pm), transmite fuerzas de contracción muscular siendo capaz de envolver varios grupos musculares y es más fácil de separar de los mismos. Ej. fascia toracolumbar (Bloqueo cuadrado lumbar), fascia de los rectos (bloqueo de la fascia de los rectos).
• Fascia visceral
– Envuelve a los diferentes órganos. Algunos autores, distinguen en este punto a las meninges como un sistema fascial separado.
Con la excepción de algunas fascias troncales (Ej. nervio ilioinguinal y el iliohipogástrico), en general no existen grandes componentes nerviosos entre las láminas de la fascia profunda. Sin embargo, es posible encontrar fibras A delta y fibras C nociceptivas en su espesor, así como neuronas de amplio rango dinámico (WDR) capaces de percibir y transmitir una amplia gama de estimulos[9]. Se han encontrado también variedades de mecanoreceptores como los corpúsculos de Vater – Pachini y de Ruffini vinculados a la sensación de estiramiento y presión, elementos útiles para la propiocepcion[10]. El rol de estas estructuras en los efectos analgésicos de los bloqueos interfasciales es un ítem a definir en futuras investigaciones[6].
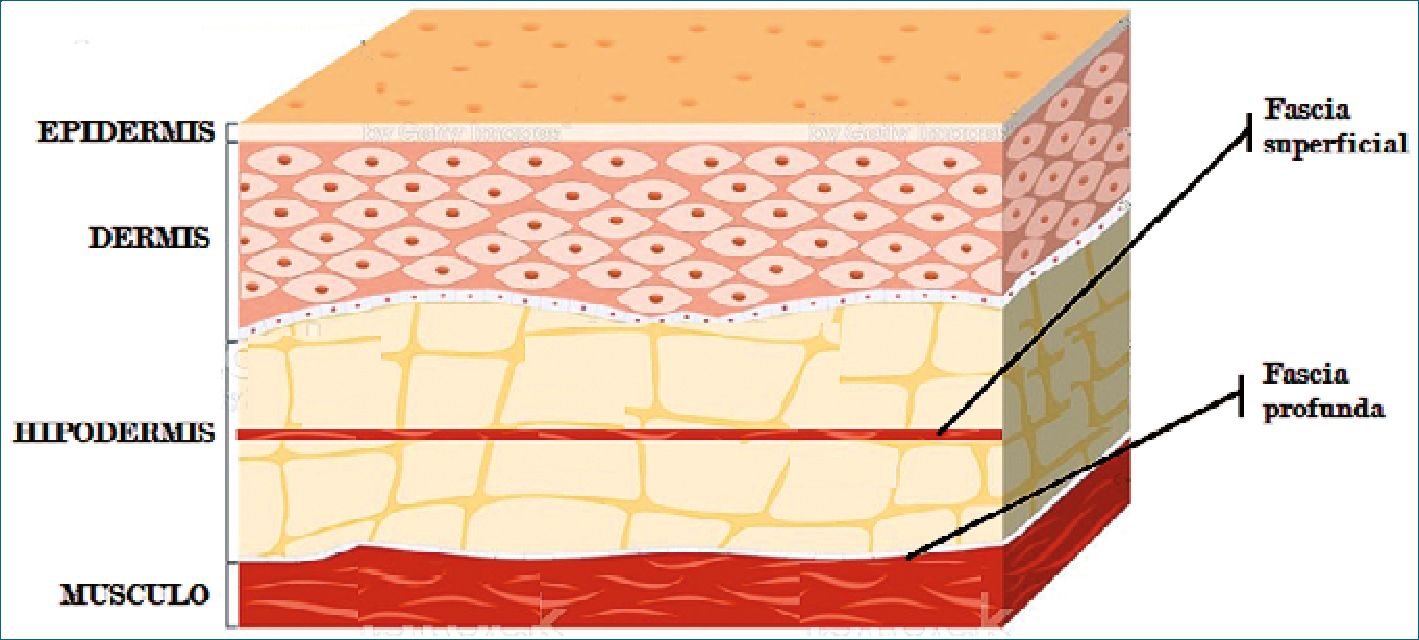
Figura 1.
El plano fascial donde se depositan los anestésicos locales, no es más que la aposición de tejidos fasciales que, usualmente, suele corresponder al epimisio de dos músculos adyacentes (como lo son el plano del TAP block el cual surge de las fascias que cubren el músculo oblicuo interno y el del músculo transverso del abdomen)[5]. Ambas fascias se encuentran conectadas entre sí por laxas fibras de colágeno, las cuales son separadas tras la administración del anestésico local (lo cual da lugar al fenómeno de “hidrodisección” observado en la práctica clínica). A su vez, estas fibras afectan la distribución del fármaco en dicho plano y son las responsables de los diferentes patrones de bloqueo aun entre planos fasciales[5].
Finalmente, es necesario señalar que, si bien el compartimento fascial se encuentra interrelacionado a lo largo de todo el cuerpo, las fascias no son iguales entre si ya que algunas no solo muestran una composición diferente sino también diferentes cantidades de capas (Ej. vaina de los rectos tiene una capa y la fascia lata 2 a 3 capas) como así también cumplen diferentes funciones siendo algunas más móviles y laxas que otras, esto podría influir en la difusión de los anestésicos locales[7].
-
Las fascias y la anestesia regional
Si bien es cierto que el auge de los bloqueos fasciales ha sido recientemente tras el advenimiento de la ecografía[7], la anestesia regional se vale de las fascias desde sus inicios. Como se señaló previamente, Dalens describe en 1986 el bloqueo de la fascia iliaca y para ello se vale de referencias hápticas para el éxito del mismo, describe así los “pops” como elementos a encontrar para la realización de esta técnica siendo estos el ruido que hace la aguja al atravesar la fascia lata y la fascia iliaca. En 1958, Preston Burnham señala que llenar la “membrana neuromuscular” con anestésico local podría simplificar el bloqueo axilar. Referencias más cercanas pueden ser encontradas en las publicaciones de Vloka[11] (1997), que describe la fascia que envuelve al nervio ciático y las posibles implicancias de esta en la dinámica del bloqueo de dicho nervio a nivel poplíteo (Figura 2).
Sin embargo, como se dijo previamente, no es hasta la introducción del ecógrafo[6], que surge el gran auge de los bloqueos fasciales. A continuación, cabe mencionar algunos de los bloqueos fasciales descritos en los últimos años tras la imple- mentación del mismo a la anestesia regional:
Figura 2.
1. Bloqueo de plano de la fascia transversalis – Hebbar (2009). 2. Bloqueo del serrato y PECs – Rafael Blanco (2011).
3. Bloqueo de las cutáneas laterales de los nervios intercostales (BRILMA) – Mario Fajardo (2012).
4. Bloqueo del espacio entre la arteria poplitea y la capsula posterior de la rodilla (IPACK block) – Sanjay Sinha (2012).
5. Bloqueo del cuadrado lumbar con todas sus variantes – Rafael Blanco y McDonell (2013).
6. Bloqueo del erector espinal – Mauricio Forero (2016).
7. Bloqueo de la fascia clavipectoral – Valdés -Vilches (2017).
8. Bloqueo del grupo de nervios pericapsulares (PENG block) – Phillip Peng (2018).
Las causas que justifican el gran desarrollo de este tipo de bloqueos tienen que ver no solo con la aparición del ecógrafo, sino que este tipo de técnica cuenta con varias ventajas, a sa- ber[12]:
• Existe una “distancia segura” entre las agujas de bloqueo y las estructuras vásculo nerviosas.
• Menor riesgo de bloqueo motor y autonómico (con una incidencia menor de alteración hemodinámica).
• Al tener puntos de acceso alejados del neuroeje, las complicaciones producto de hematomas y/o infecciosas son menos nocivas.
Lo cierto es que los seres humanos somos animales, esencialmente, visuales (90% de la información que recibe nuestro cerebro es de tipo visual), y que nuestra forma de interpretar el mundo se basa en aquello que percibimos por medio de la vista[13]. Teniendo esto en cuenta, es lógico pensar que esta característica, inherente al ser humano, haya promovido el cambio de paradigma desde la anestesia regional guiada por parestesias hacia la guiada por imagen ecográfica. Y a partir de la introducción de la ecografía, ésta ha logrado redefinir el rol de las fascias, tal como podemos apreciar en los siguientes ejemplos:
1. La existencia del espacio paraneural en el nervio ciatico[14]: espacio virtual comprendido entre el epimisio muscular y el epineurio del nervio ciático que de ser rellenado con anestésico local acorta la latencia del bloqueo y asegura mayor efectividad al mismo[15],[16].
2. La inyección de anestésico local por debajo de la fascia cervical profunda reduce la latencia del bloqueo supraclavicular y prolonga sus efectos analgesicos[17].
3. Las fascias profundas del miembro inferior a nivel subglúteo justificarían la incidencia del fallo en la dispersión del anestésico local hacia el nervio cutáneo femoral posterior del muslo en el 32% de los abordajes subglúteos del nervio ciático[18].
4. La difusión de los anestésicos locales por el canal aponeurótico de los aductores depende de lugar de abordaje de dicho canal. Esto es de vital importancia en cirugía de reemplazo total de rodilla donde la migración del fármaco hacia el triángulo femoral puede verse asociado a bloqueo motor de la extremidad, con el consecuente mayor riesgo de caídas. Se han hecho numerosos estudios ecográficos con el fin de definir el mejor sitio de abordaje del canal[19],[20],[21] para cirugía de reemplazo de rodilla.
5. En el bloqueo infraclavicular, Brenner et al[22], describe la presencia de tabiques fasciales que condicionarían la co
rrecta dispersión del anestésico local en torno a la arteria axilar por lo que recomienda la inyección multipunto y el uso de volúmenes mayores de anestésicos locales.
-
Mecanismos de acción de los anestésicos locales[3]
Si bien es posible decir que no está del todo claro cómo intervienen las fascias en las dinámicas de los bloqueos[6], existen varios mecanismos propuestos que explicarían como es que actúan los anestésicos locales al ser infiltrados en un plano fascial:
1) Movimiento en masa (“bulk Flow”) del anestésico local dentro del mismo plano fascial
Una vez inyectado el anestésico local en el plano fascial, el fármaco hidrodiseca el mismo mediante un movimiento en masa siguiendo un gradiente de presión (mecanismo de “movimiento en masa” o “bulk flow”). Este mecanismo de distensión hidráulica estaría influenciado por múltiples factores físicos como el sentido en el que se inyecta, la fuerza con que se lo hace como así también las propiedades elásticas de la fascia en cuestión. Por otro lado, los tendones muchas veces se encuentran fijados a los planos fasciales profundos generando movimiento de los mismos siendo que 30% de la fuerza muscular generada es transmitida a los tejidos conectivos que rodean a los músculos[23]. Estos movimientos y estiramientos de las fascias podrían funcionar como un bombeo activo[24] de los anestésicos locales a lo largo de los sectores de baja resistencia por donde los fármacos hidrodisecarían los planos de los diferentes tejidos, ejerciendo su función analgésica. Finalmente, los movimientos respiratorios (en bloqueos como el plano del erector espinal[25],[26]), la presión negativa intratorácica y los movimientos de los miembros pueden ser factores que faciliten la dispersión interfascial del anestésico local[11]. Es así como los fármacos alcanzan las estructuras nerviosas que discurren por el plano fascial en cuestión y el bloqueo ejerce sus efectos analgésicos. Ejemplos de este mecanismo de acción son el PEC 1 – 2 y el del plano del serrato que actúan sobre los ramos pectorales del plexo braquial y los ramos laterales de los nervios intercostales respectivamente.
Sin embargo, si bien este mecanismo de acción es el de mayor aceptación, adolece de incongruencias tales como la ausencia de un área de bloqueo cutáneo sensitivo predecible tras la inyección de los anestésicos locales en dichos planos fasciales. Tal es el caso del bloqueo del plano TAP que, a pesar de gozar de buen nivel de evidencia en sus efectos analgésicos, existen trabajos (Kion et al [27]) que señalan la variabilidad que puede observarse en las áreas carentes de respuesta al prick test.
Posibles explicaciones a estos hallazgos es el hecho de que los efectos analgésicos de este mecanismo de acción sean susceptibles a otras variables tales como:
• Factores anatómicos, técnicos, farmacocinéticos y/o fisiológicos que favorecen la variabilidad interindividual: desde un punto de vista anatómico, los dermatomas sensitivos son los que presentan la mayor variabilidad interindividual, siendo común no solo el solapamiento entre dermatomas ipsilaterales y contiguos sino también con los contralaterales[28]. Por otro lado, la edad, la elasticidad de los tejidos (y por ende los diferentes sitios de punción en diferentes y en un mismo plano fascial), el tono muscular, los movimien
tos, el posicionamiento, el volumen/fuerza de inyección, la dirección, la temperatura son solo algunas de las variables técnicas que podrían tener influencia en al menos la dispersión en masa del anestésico local dentro del plano fascial[3].
• Factores no cutáneos que intervienen en la nocicepción: es importante aclarar que la ausencia de sensibilidad cutánea como variable para evaluar el efecto analgésico de un bloqueo fascial es imperfecto, sobre todo si se tiene en cuenta que el dolor se genera no solo tras la incisión en piel sino también desde tejidos profundos a partir de mecanismos propiciados por la inflamación e injuria tisular[3]. La nocicepción de tejidos profundos es a partir de nociceptores presentes en fascias, ligamentos y capsulas articulares[6] que podrían ser alcanzados tras la difusión de los anestésicos locales en planos aledaños. Esto se evidencia en los efectos analgésicos provistos por bloqueos como el PEC1 o TAP, en el que los nervios objetivos (nervios pectorales y nervios toracoabdominales respectivamente) son esencialmente motores[5]. Sin embargo, cabe aclarar que, hasta un tercio de las fibras presentes en un nervio motor son en realidad sensitivas (nociceptivas) y que muchas veces el bloqueo motor y la consiguiente disminución del tono muscular puede a veces aliviar el dolor experimentado en algunas cirugías (ejemplo cirugía reconstructiva de mama con implantes retromusculares)[28].
• Bloqueo diferencial. Es bien sabido que las diferentes fibras nerviosas expresan diferentes niveles de susceptibilidad a los anestésicos locales. Más allá de las características farmacológicas de los fármacos en si (pka) y la afinidad de los mismos por los canales abiertos de sodio, es posible alcanzar cierto nivel de analgesia sin necesidad de que el paciente refiera cierto nivel de ausencia total de sensibilidad en el territorio cutáneo evaluado (anestesia)[3]. Mas aún, las rápidas A- delta (responsables de la sensibilidad valorada mediante el prick test) son mielínicas y son más susceptibles a la acción de los anestésicos locales, mientras que las fibras C (responsable de la sensibilidad térmica – otra forma de evaluar los bloqueos sensitivos) son amielínicas y más “resistentes” a los mismos[29]. Finalmente, la lidocaína tiene un mayor tropismo por las fibras A, mientras que la ropivacaína o la bupivacaina (los cuales son los agentes más comúnmente utilizados en bloqueos fasciales) muestran una mayor preferencia por las fibras C[30].
• Inervación simpática y dolor visceral. Es posible que los efectos analgésicos de algunos bloqueos provengan no solo de su acción sobre las fibras somáticas del nervio sino también a partir del bloqueo de fibras autonómicas aferentes de las vísceras[3]. Sin embargo, es conveniente recordar que las fibras autonómicas responsables del tono simpático o parasimpático comparten anatómicamente un trayecto con las fibras autonómicas responsable del dolor visceral, pero son funcionalmente independientes[5]. Bloqueos como el PEC1 y 2 o el TAP son susceptibles de proveer analgesia visceral solo a expensas de un mecanismo de acción sistémico de los anestésicos locales, ya que la deposición de dichos fármacos no entra en contacto con las fibras autonómicas aferentes que intervienen en el dolor visceral torácico o abdominal (estas fibras son intratorácicas e intraabdominales respectivamente). Sin embargo, bloqueos como el ESP (y eventualmente el QLB) son susceptibles de proveer simultáneamente
analgesia visceral y somática, ya que el plano anatómico donde se deposita el anestésico local alcanza a través del espacio paravertebral y/o peridural, el recorrido de nervios somáticos y autonómicos por igual (viscerales, simpáticos y parasimpáticos).
2) Acción mediante difusión loco regional del anestésico en planos fasciales adyacentes
Este mecanismo supone que, a un nivel microscópico, una vez que el anestésico avanza en masa sobre los tejidos, existe la difusión de las partículas del fármaco siguiendo un gradiente de concentración a través de microporos entre las fibras de tejido conectivo que conforman las fascias.
Este tipo de mecanismo justifica el accionar de bloqueos tales como del cuadrado lumbar, el retrolaminar o el del erector espinal (en éste caso, este sería uno de sus mecanismos de acción), ya que, anatómicamente los únicos nervios que discurren en dicho plano fascial son las ramas dorsales de los nervios espinales. Estos ramos inervan, esencialmente, la masa de músculos paraespinales, sin embargo, son numerosos los estudios que confirman los efectos analgésicos de estos bloqueos para procedimientos toracoabdominales. Es mediante cuestionados estudios de disección[31],[32] y de imágenes en voluntarios sanos[33], que estos bloqueos prueban que sus efectos analgésicos son a expensas de migraciones del anestésico local al espacio paravertebral y/o intercostal a través de la difusión del anestésico local a espacios adyacentes. Sin embargo, en el caso del bloqueo del cuadrado lumbar la evidencia acerca de la migración del fármaco es aún equivoca y carece de común aceptación. Esta afirmación radica en la inexistencia de un espacio paravertebral lumbar definido, ya que el mismo se encuentra ocupado por el músculo psoas y el cuadrado lumbar y los nervios espinales tienen un corto recorrido hasta el psoas donde forman el plexo lumbar. El mecanismo de acción sería a través de una comunicación anatómica entre la fascia toracolumbar y los espacios paravertebrales torácicos[34].
3) Analgesia mediada por efectos sistémicos de los anestésicos locales
Si bien los efectos analgésicos de la administración endovenosa de anestésicos locales (siendo la lidocaína el más utilizado) es un tema controversial, este mecanismo podría justificar la acción calmante de los bloqueos fasciales[3]. Existe evidencia de que el dolor visceral responde a este tipo de terapéuticas (no tanto así el dolor de tipo somático) y se han comprobado múltiples vías por las cuales los anestésicos locales pueden proveer de analgesia por vía endovenosa (exponerlos van más allá de los propósitos de esta revisión). Por otro lado, es importante tener en cuenta la patogénesis del dolor, ya que los efectos analgésicos son más marcados en procedimientos quirúrgicos y síndromes dolorosos donde predomina el dolor visceral[35]. Si bien, mediante la deposición interfascial, es posible alcanzar concentraciones terapéuticas en sangre de anestésicos locales (lidocaína 1 a 5 mcg/ml[36]), es conveniente señalar que dicha concentración no siempre se mantiene en el tiempo lo suficiente como para compararse con infusiones endovenosas ya que depende de dosis, volúmenes, sitios de inyección, coadyuvantes, etc. Mas aún, es importante señalar que, si bien los anestésicos locales más comúnmente utilizados en los bloqueos de planos fasciales son la bupivacaina y la ropivacaína, comparten
la estructura amida y sitio de acción con la lidocaína, por lo cual es razonable esperar que sean equivalentes en su mecanismo de acción sistémico[3].
-
Controversias y potenciales líneas de investigación
Como se explicó previamente, los bloqueos fasciales son, desde sus comienzos, víctimas de criticas y generadores de controversias ya que desde su introducción plantean un cambio de paradigma en la anestesia regional: no hay necesidad de ver el nervio a bloquear, ni es necesario depositar el anestésico local en su cercanía.
En la práctica clínica, si bien han demostrado efectos analgésicos en múltiples estudios, existen inconsistencias en su estudio, así como también en sus efectos, eficacia, indicaciones y modos de evaluarlos y llevarlos a cabo[8]. A continuación, se enumerarán una serie de factores que podrían justificar las deficiencias de estas deficiencias:
• La estructura de las fascias
La estructura de las fascias del organismo humano no es consistente e igual en toda su extensión. Existen fascias de diverso grosor en el organismo y es factible que este factor se determinante en la difusión del anestésico local. Tal como se describió previamente, las fascias epimisiales suelen tener un espesor menor al de las fascias aponeuróticas. Sería lógico pensar que los diferentes espesores de las fascias podrían actuar como limitantes al movimiento en masa de los fármacos y, por qué no, a la difusión de las mismos a través de los diferentes compartimentos[8]. Mas aún, es interesante pensar, qué ocurre con el espesor de las fascias en contextos de: cicatrices posquirúrgicas, los cambios productos de la edad, hábitos constitucionales o enfermedades como la diabetes o las colagenopatías.
Por otro lado, existen diferentes puntos de fusión entre las hojas de una fascia (Ej. línea alba). Esto genera la compartimentalización de diferentes estructuras, lo cual puede tener una incidencia en la dispersión del anestésico local. Tal es el caso del bloqueo de la vaina de los rectos, donde es necesario realizar el bloqueo en forma bilateral, ya que ésta previene la difusión del fármaco al lado contralateral. Una vez más, traumatismos, cirugías y puntos de adherencia patológicos pueden ser causantes de patrones de difusión impredecibles en estos bloqueos.
Finalmente, es posible hallar puntos de interconectividad entre diferentes planos fasciales, siendo algunos lejanos y de difícil correlación anatómica (ejemplo: existen conexiones entre la fascia toracolumbar y la fascia endotorácica a través de los ligamentos arcuatos y el hiato aórtico a nivel del diafragma[5], lo cual explicaría el mecanismo de acción del bloqueo del cuadrado lumbar vía transmuscular). Esto genera cierta incertidumbre en torno a los mecanismos de acción, volúmenes a utilizar y posibles reacciones adversas a describir en las diferentes técnicas fasciales, tras la difusión de los mismos a lugares no definidos anatómicamente.
• La función de las fascias
Como se describió previamente, una de las funciones de las fascias es facilitar el deslizamiento entre las estructuras osteomusculares. Esta capacidad, está dada por el contenido de glicosaminoglicanos en su espesor (ácido hialurónico), la
cual funciona como una suerte de lubricante entre las diferentes hojas de las fascias. La viscosidad de los mismos, está influenciada por la temperatura corporal, el pH y las fuerzas subyacentes en los tejidos aledaños[8]. Potenciales líneas de trabajo podrían elaborarse en torno a como influyen diferentes condiciones fisiopatológicas (edad, sexo, embarazo, colagenopatías) en torno a la difusión del anestésico local y la efectividad de los bloqueos fasciales. Por otro lado, es posible evaluar qué efecto tiene sobre los mismos la inyección de fármacos con efecto hialuronidasa como coadyuvante.
• Factores técnicos
Existen factores relativos a la forma de llevar a cabo las diferentes técnicas de bloqueos fasciales que pueden influenciar en la distribución de los anestésicos locales y por ende afectar su predictibilidad, a saber:
1. Sitio de punción.
2. Posición del paciente.
3. Ventilación: espontánea o con presión positiva.
4. Orientación de la aguja.
5. Fuerza al inyectar.
6. Volúmenes.
7. Dosis y concentraciones.
8. Coadyuvantes.
Su influencia en la dinámica de los diferentes bloqueos son potenciales líneas de investigación a definir.
• Variaciones en la distribución de los nervios
El recorrido intrafascial de los nervios es variable e impredecible[8], mas aún, muchos de ellos no son posible de visualizar por vía ultrasonográfica razón por lo cual el patrón de acción analgésica de los bloqueos suele ser inconstante. Por otro lado, la fascia es un órgano ricamente inervado, lo cual ha llevado a algunos autores a hablar de posibles “fasciotomas”, los cuales tendrían un patrón de distribución más similar a los miotomas que los dermatomas cutáneos[37]. Sin embargo, no existe a la fecha un “mapa” de la inervación fascial corporal que pueda guiar al anestesiólogo en la práctica de los bloqueos fasciales.
Otros puntos posibles de investigación son el potencial rol de las fascias en la generación de dolor (dolor miofascial) y su correlación con el efecto antiálgicos de los bloqueos faciales, así como los efectos analgésicos producto del bloqueo de fibras fasciales autonómicas (con su influencia en el dolor visceral) que es posible alcanzar con determinadas técnicas de anestesia regional (Véase: “Inervación simpática y dolor visceral” en el apartado de “Mecanismos de acción de los bloqueos fasciales”).
• Evidencia clínica
Existen múltiples estudios cadavéricos[26],[31] y otros tantos en pacientes vivos[32],[33] que buscan explicar los mecanismos de acción de los diferentes bloqueos fasciales. Sin embargo, a la hora de interpretar los resultados es necesario tener presente las limitaciones de diseño que tienen estos estudios. En cuanto a los estudios cadavéricos[6],[8], hay que reconocer que las características de los cadáveres están lejos de parecerse a un paciente vivo; la consistencia del ácido hialuronico que interviene en el deslizamiento y consistencia de las fascias, así como los movimientos activos de los miembros y aquellos producto de la respiración se encuentran ausentes, siendo éstos algunos ejemplos de las diferencias entre los dos escenarios. Por otro lado, en el
caso de los estudios en pacientes[8], la evaluación image- nológica de la difusión del fármaco tiene sus limitaciones, ya que si bien es posible apreciar la extensión de la misma muchas veces no es posible definir la intensidad con que el fármaco alcanza el sitio diana. Mas aún, tal como hemos visto en apartados anteriores, la evaluación clínica de la acción del anestésico local no es un buen marcador de éxito en los bloqueos fasciales[3]. (Véase: “Mecanismos de acción de los bloqueos fasciales” – “Movimiento en masa del anestésico local en el mismo plano fascial”).
-
Conclusión
El advenimiento de la ecografía redefinió a la anestesia regional y con ella los bloqueos fasciales han surgido como una alternativa analgésica de gran difusión y aceptación. Sin embargo, existen muchas interrogantes alrededor de los mismos, y si bien sus efectos analgésicos no son puestos en duda, es necesario un mayor entendimiento en torno al mecanismo de acción de los mismos. Para ello, el diseño de estudios que permitan aclarar su funcionamiento, así como la interpretación de la evidencia publicada debe ser hecha a la luz de sus limitaciones. Finalmente, los conocimientos en torno a sus fundamentos anatómicos son primordiales a la hora de llevarlos a cabo de una manera efectiva y segura.
Referencias
1. Chin KJ, McDonnell JG, Carvalho B, Sharkey A, Pawa A, Gadsden J. Essentials of our current understanding: abdominalwall blocks. Reg Anesth Pain Med. 2017;42(2):133–83. https://doi.org/10.1097/AAP.0000000000000545 PMID:28085788
2. Dalens B, Vanneuville G, Tanguy A. Comparison of the fascia iliaca compartment block with the 3-in-1 block in children. Anesth Analg. 1989 Dec;69(6):705–13. https://doi.org/10.1213/00000539-198912000-00003 PMID:2589650
3. Chin KJ, Lirk P, Hollmann MW, Schwarz SK. Mechanisms of action of fascial plane blocks: a narrative review. Reg Anesth Pain Med. 2021 Jul;46(7):618–28. https://doi.org/10.1136/rapm-2020-102305 PMID:34145073
4. Adstrum S, Hedley G, Schleip R, Stecco C, Yucesoy CA. Defining the fascial system. J Bodyw Mov Ther. 2017 Jan;21(1):173–7. https://doi.org/10.1016/j.jbmt.2016.11.003 PMID:28167173
5. Chin KJ, Versyck B, Elsharkawy H, Rojas Gomez MF, Sala-Blanch X, Reina MA. Anatomical basis of fascial plane blocks. Reg Anesth Pain Med. 2021 Jul;46(7):581–99. https://doi.org/10.1136/rapm-2021-102506 PMID:34145071
6. Hesham Elsharkawy Amit Pawa and Edward R. Mariano. Interfascial Plane Blocks – Back to Basics. Reg Anesth Pain Med 2018;43: 00–00.
7. Bednar DA, Orr FW, Simon GT. Observations on the pathomorphology of the thoracolumbar fascia in chronic mechanical back pain. A microscopic study. Spine. 1995 May;20(10):1161–4. https://doi.org/10.1097/00007632-199505150-00010 PMID:7638659
8. Black ND, Stecco C, Chan VW. Fascial Plane Blocks: More Questions Than Answers? Anesth Analg. 2021 Mar;132(3):899–905. https://doi.org/10.1213/ANE.0000000000005321 PMID:33346985
9. Benetazzo L, Bizzego A, De Caro R, Frigo G, Guidolin D, Stecco C. 3D reconstruction of the crural and thoracolumbar fasciae. Surg Radiol Anat. 2011 Dec;33(10):855–62. https://doi.org/10.1007/s00276-010-0757-7 PMID:21203765
10. Burnham PJ. Regional block of the great nerves of the upper arm. Anesthesiology. 1958;19(2):281–4. https://doi.org/10.1097/00000542-195803000-00017 PMID:13521382
11. Vloka JD, Hadzić A, Lesser JB, Kitain E, Geatz H, April EW, et al. A common epineural sheath for the nerves in the popliteal fossa and its possible implications for sciatic nerve block. Anesth Analg. 1997 Feb;84(2):387–90. https://doi.org/10.1213/00000539-199702000-00028 PMID:9024035
12. David H Kim, Sang Jo Kim, Jiabin Liu, Jonathan Beathe, Stavros G Memtsoudis. Fascial plane blocks: a narrative review of the literature. Kim DH, et al. Reg Anesth Pain Med. 2021;46:600–17. https://doi.org/10.1136/rapm-2020-101909 PMID:34145072
13. El pensamiento visual. Ruldolph Arnheim. Ediciones Paidós Ibérica S.A. 1986
14. Karmakar MK, Shariat AN, Pangthipampai P, Chen J. High-definition ultrasound imaging defines the paraneural sheath and the fascial compartments surrounding the sciatic nerve at the popliteal fossa. Reg Anesth Pain Med. 2013;38(5):447–51. https://doi.org/10.1097/AAP.0b013e31829ffcb4 PMID:23897425
15. Sala-Blanch X, de Riva N, Carrera A, López AM, Prats A, Hadzic A. Ultrasound-guided popliteal sciatic block with a single injection at the sciatic division results in faster block onset than the classical nerve stimulator technique. Anesth Analg. 2012 May;114(5):1121–7. https://doi.org/10.1213/ANE.0b013e318248e1b3 PMID:22366843
16. Perlas A, Wong P, Abdallah F, Hazrati LN, Tse C, Chan V. Ultrasound-guided popliteal block through a common paraneural sheath versus conventional injection: a prospective, randomized, double-blind study. Reg Anesth Pain Med. 2013;38(3):218–25. https://doi.org/10.1097/AAP.0b013e31828db12f PMID:23558372
17. Sivashanmugam T, Ray S, Ravishankar M, Jaya V, Selvam E, Karmakar MK. Randomized Comparison of Extrafascial Versus Subfascial Injection of Local Anesthetic During Ultrasound-Guided Supraclavicular Brachial Plexus Block. Reg Anesth Pain Med. 2015;40(4):337–43. https://doi.org/10.1097/AAP.0000000000000264 PMID:26066385
18. Johnson CS, Johnson RL, Niesen AD, Stoike DE, Pawlina W. Ultrasound-Guided Posterior Femoral Cutaneous Nerve Block: A Cadaveric Study. J Ultrasound Med. 2018 Apr;37(4):897–903. https://doi.org/10.1002/jum.14429 PMID:29027690
19. Meier AW, Auyong DB, Yuan SC, et alComparison of Continuous Proximal Versus Distal Adductor Canal Blocks for Total Knee Arthroplasty: Meier AW, Auyong DB, Yuan SC, Lin SE, Flaherty JM, Hanson NA. Double-Blind. Reg Anesth Pain Med. 2018 Jan;43(1):36–42. https://doi.org/10.1097/AAP.0000000000000692 PMID:29140959
20. Sztain JF, Khatibi B, Monahan AM, Said ET, Abramson WB, Gabriel RA, et al. Proximal Versus Distal Continuous Adductor Canal Blocks: Does Varying Perineural Catheter Location Influence Analgesia? A Randomized, Subject-Masked, Controlled Clinical Trial. Anesth Analg. 2018 Jul;127(1):240–6. https://doi.org/10.1213/ANE.0000000000003422 PMID:29750695
21. Wong WY, Bjørn S, Strid JM, Børglum J, Bendtsen TF. Defining the Location of the Adductor Canal Using Ultrasound. Reg Anesth Pain Med. 2017;42(2):241–5. https://doi.org/10.1097/AAP.0000000000000539 PMID:28002228
22. Brenner D, Mahon P, Iohom G, Cronin M, O’Flynn C, Shorten G. Fascial layers influence the spread of injectate during ultrasound-guided infraclavicular brachial plexus block: a cadaver study. Br J Anaesth. 2018 Oct;121(4):876–82. https://doi.org/10.1016/j.bja.2018.04.043 PMID:30236249
23. Stecco C, Macchi V, Porzionato A, Duparc F, De Caro R. The fascia: the forgotten structure. Ital J Anat Embryol. 2011;116(3):127–38. PMID:22852442
24. Lelean P. The migratory fascia hypothesis. J Bodyw Mov Ther. 2009 Oct;13(4):304–10. https://doi.org/10.1016/j.jbmt.2008.06.009 PMID:19761952
25. Condino S, Turini G, Parrini S, Stecco A, Busoni F, Ferrari V, et al. A semiautomatic method for in vivo three-dimensional quantitative analysis of fascial layers mobility based on 3D ultrasound scans. Int J CARS. 2015 Nov;10(11):1721–35. https://doi.org/10.1007/s11548-015-1167-4 PMID:25740204
26. Jason Ivanusic, Yasutaka Konishi and Michael J. Barrington. A Cadaveric Study Investigating the Mechanism of Action of Erector Spinae Blockade. Reg Anesth Pain Med 2018;43: 00–00) https://doi.org/10.1097/AAP.0000000000000789.
27. Støving K, Rothe C, Rosenstock CV, Aasvang EK, Lundstrøm LH, Lange KH. Cutaneous Sensory Block Area, Muscle-Relaxing Effect, and Block Duration of the Transversus Abdominis Plane Block: A Randomized, Blinded, and Placebo-Controlled Study in Healthy Volunteers. Reg Anesth Pain Med. 2015;40(4):355–62. https://doi.org/10.1097/AAP.0000000000000252 PMID:25923818
28. Glenn E. Woodworth, Ryan M.J. Ivie, Sylvia M. Nelson. Cameron M. Walker and Robert B. Maniker. Perioperative Breast Analgesia: A Qualitative Review of Anatomy and Regional Techniques. Reg Anesth Pain Med. 2017;42(5):609–31. https://doi.org/10.1097/AAP.0000000000000641.
29. Gokin AP, Philip B, Strichartz GR. Preferential block of small myelinated sensory and motor fibers by lidocaine: in vivo electrophysiology in the rat sciatic nerve. Anesthesiology. 2001 Dec;95(6):1441–54. https://doi.org/10.1097/00000542-200112000-00025 PMID:11748404
30. Ford DJ, Raj PP, Singh P, Regan KM, Ohlweiler D. Differential peripheral nerve block by local anesthetics in the cat. Anesthesiology. 1984 Jan;60(1):28–33. https://doi.org/10.1097/00000542-198401000-00007 PMID:6691593
31. Ivanusic J, Konishi Y, Barrington MJ. A cadaveric study investigating the mechanism of action of erector spinae blockade. Reg Anesth Pain Med. 2018 Aug;43(6):567–71. https://doi.org/10.1097/AAP.0000000000000789 PMID:29746445
32. Aponte A, Sala-Blanch X, Prats-Galino A, Masdeu J, Moreno LA, Sermeus LA. Anatomical evaluation of the extent of spread in the erector spinae plane block: a cadaveric study. Can J Anaesth. 2019 Aug;66(8):886–93. https://doi.org/10.1007/s12630-019-01399-4 PMID:31119551
33. Schwartzmann A, Peng P, Maciel MA, et al. A magnetic resonance imaging study of local anesthetic spread in patients receiving an erector spinae plane block. Can J Anesth/J Can Anesth 2020;67:942–8. https://doi.org/10.1007/s12630-020-01613-8.
34. Elsharkawy H, El-Boghdadly K, Barrington M. Quadratus lumborum block: anatomical concepts, mechanisms, and techniques. Anesthesiology. 2019 Feb;130(2):322–35. https://doi.org/10.1097/ALN.0000000000002524 PMID:30688787
35. Brinkrolf P, Hahnenkamp K. Systemic lidocaine in surgical procedures: effects beyond sodium channel blockade. Curr Opin Anaesthesiol. 2014 Aug;27(4):420–5. https://doi.org/10.1097/ACO.0000000000000094 PMID:24874023
36. Hermanns H, Hollmann MW, Stevens MF, Lirk P, Brandenburger T, Piegeler T, et al. Molecular mechanisms of action of systemic lidocaine in acute and chronic pain: a narrative review. Br J Anaesth. 2019 Sep;123(3):335–49. https://doi.org/10.1016/j.bja.2019.06.014 PMID:31303268
37. Stecco C, Pirri C, Fede C, Fan C, Giordani F, Stecco L, et al. Dermatome and fasciatome. Clin Anat. 2019 Oct;32(7):896–902. https://doi.org/10.1002/ca.23408 PMID:31087420

 ORCID
ORCID