Maximiliano Soto1,*, Fridda P. Hernández1
Recibido: 06-03-2023
Aceptado: 16-04-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 5 pp. 542-544|https://doi.org/10.25237/revchilanestv52n5-15
PDF|ePub|RIS
Abstract
Toxic epidermal necrolysis (TEN) and Steven Johnson Syndrome (SJS) are entities that are theorized to have an immunological principle where the main role of antigen is given mainly by drugs, causing a cascade of immune reactions with the formation of substances that promote cell damage and death of keratinocytes, with subsequent detachment of the epidermis. This case is about a patient who was diagnosed with TEN where early pharmacological and general measures were established, and despite this the patient had a torpid evolution with superinfection by Acinetobacter baumannii
Resumen
La necrólisis epidérmica tóxica (NET) y el Síndrome de Steven Johnson (SSJ) son entidades que se teorizan tienen un principio inmunológico en donde el papel principal de antígeno es dado principalmente por fármacos, causando una cascada de reacciones inmunitarias con la formación de sustancias que promueven el daño y muerte celular de los queratinocitos, con posterior desprendimiento de la epidermis. Este caso se trata de un paciente que curso con diagnóstico de NET donde se instauraron medidas farmacológicas y generales tempranas, y a pesar de esto el paciente tuvo evolución tórpida con sobreinfección por Acinetobacter baumannii .
-
Introducción
-
Presentación del caso
La NET y el SSJ son entidades que ya habían sido descritas desde la época antigua de los egipcios, sin embargo, los términos fueron acuñados respectivamente por Stevens y Johnson (1922) y por Lyell (1956). Son solo distintos espectros de la misma enfermedad, dependiendo del área de superficie corporal afectada. Ambas representan urgencias dermatológicas con complicaciones multisistémicas y potencialmente letales. La etiología más frecuente está relacionada a la utilización de fármacos y en menor proporción a infecciones, factores in- munológicos, ambientales y hematooncológicos. El manejo de esta enfermedad está basado, principalmente, en medidas de soporte vital.
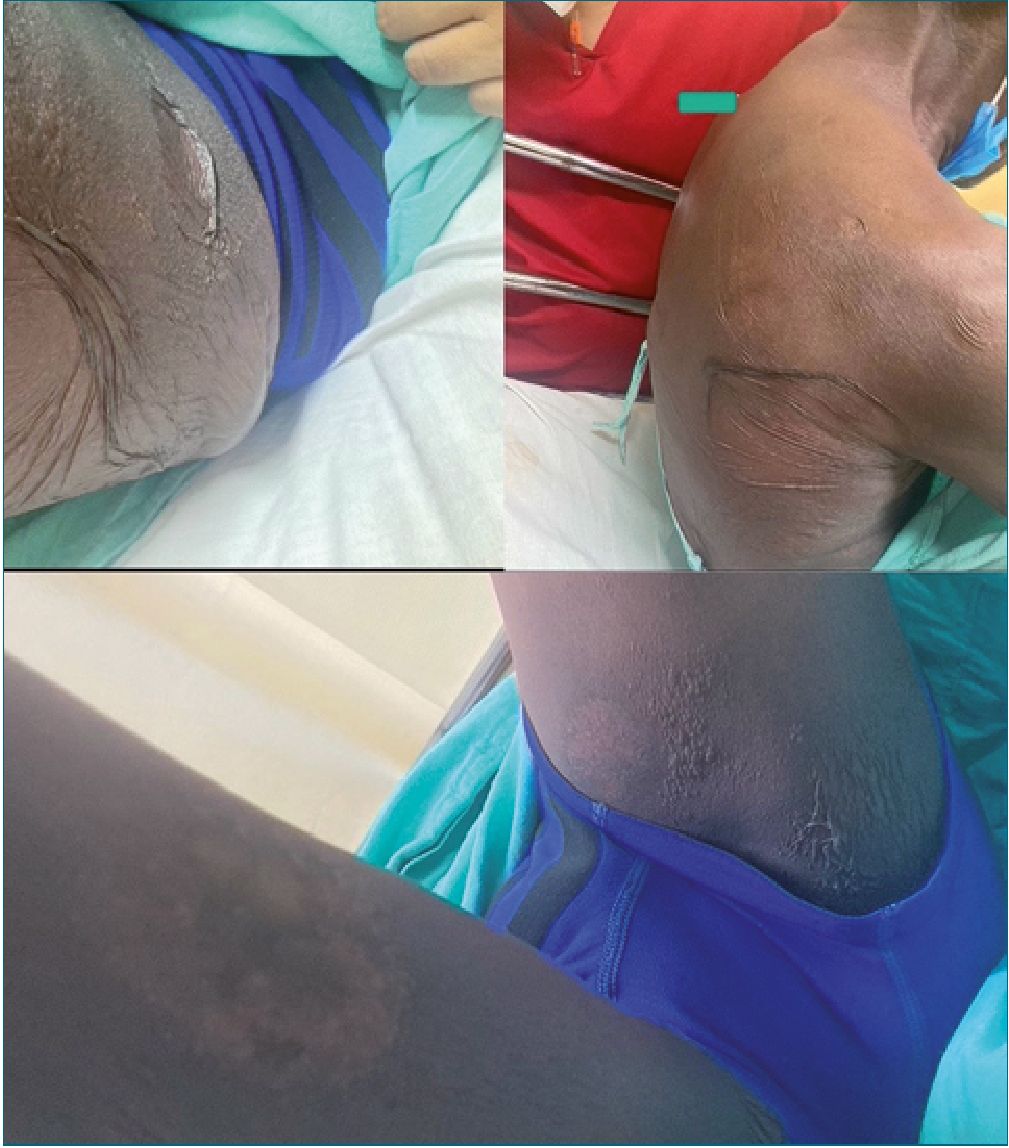
Figura 1. Paciente dentro de las primeras 48 horas después de la aplicación de fenitoina.
Se trata de un hombre de 64 años, quien acude al servicio de urgencias por presentar crisis convulsivas. Al momento de admisión se encuentra en estado postictal, sin familiares. Se decide impregnación con difenilhidantoína 15 mg/kg así como dosis de mantenimiento 7 mg/kg. Trascurridas, aproximadamente, 12 h con recuperación del estado de conciencia, reinterroga, donde se obtiene información de antecedentes de importancia: epilepsia desde hace 20 años tratado con valproato de magnesio 600 mg c/12 h y levetiracetam 1 gr c/12 h, mal apego al tratamiento, menciona el antecedente de reacción “alergica” a difenilhidantoína, por lo cual se suspende la administración iniciada previamente. Ocho horas despues, paciente refiere dolor de carácter urente en tórax y cuello, artralgias, mialgias y prurito generalizado; alzas térmicas de 38 °C y cambios de coloración tegumentaria, sospechando de pródromo de NET, se suspenden anticomiciales y AINES. Se decide manejo con corticoesteroides (metilprednisolona) y antihistaminicos, manejo tópico con emolientes y petrolato. Doce horas después surgen lesiones vesiculo- ampollosas en más del 50% de la superficie corporal con signo de Nikolsky positivo. Se inicia analgesia con opioide como fen- tanil y ansiolisis con dexmedetomidina. Se solicita valoración por dermatología e ingreso a unidad de cuidados intensivos. En paraclínicos cuenta con una biometría hemática con los siguientes parámetros: Hb 11,1 g/dL, leucocitos 5,34 x103/pL, neutrófilos# 4,66 x103/pL, plaquetas 89 x103/pL y clínicamente cuenta con disminución de sus cifras tensionales con una TA 80/40 mmHg. Al tercer día de estancia ingresa a la unidad de cuidados intensivos, donde se decide agregar inmunoglobulina y fluidoterapia agresiva. Trascurridos 4 días, se observa exudado en zonas con desprendimiento de epidermis (Figuras 1, 2 y 3), se reporta edema en miembros pélvicos, así como llenado capilar retardado 4 seg. Se inician aminas vasoactivas y continúan con hidroterapia agresiva. En su quinto día se reportan datos de SRIS; oliguria (0,3 ml/kg/h) exudados purulentos de heridas en dorso y cara interna de ambos muslos, leucopenia persistente y disminución de hematíes. Respiratorio con campos pulmonares hipoventila- dos en ambos hemitorax, PaO2/FiO2: 122. Presenta alteraciones neurológicas con datos de delirium hipoactivo. En radiografía de tórax con infiltrado intersticial bilateral de focos múltiples. Se añade antibioticoterapia de amplio espectro (Linezolid), con poca respuesta. Presenta falla respiratoria aguda, con necesidad de manejo avanzado de la vía aérea. Se toman cultivos centrales, periféricos y de heridas, reportándose Acinetobacter baumannii multirresistente, iniciando antibioticoterapia dirigida. Al día 14 de estancia intrahospitalaria, se inicia sospecha de CID con evolución torpida y aumento de hemorragia por tubo endotraqueal. Al día 25 de estancia intrahospitalaria presenta parocardíaco sin retorno de la circulación espontánea a pesar de maniobras de reanimación.
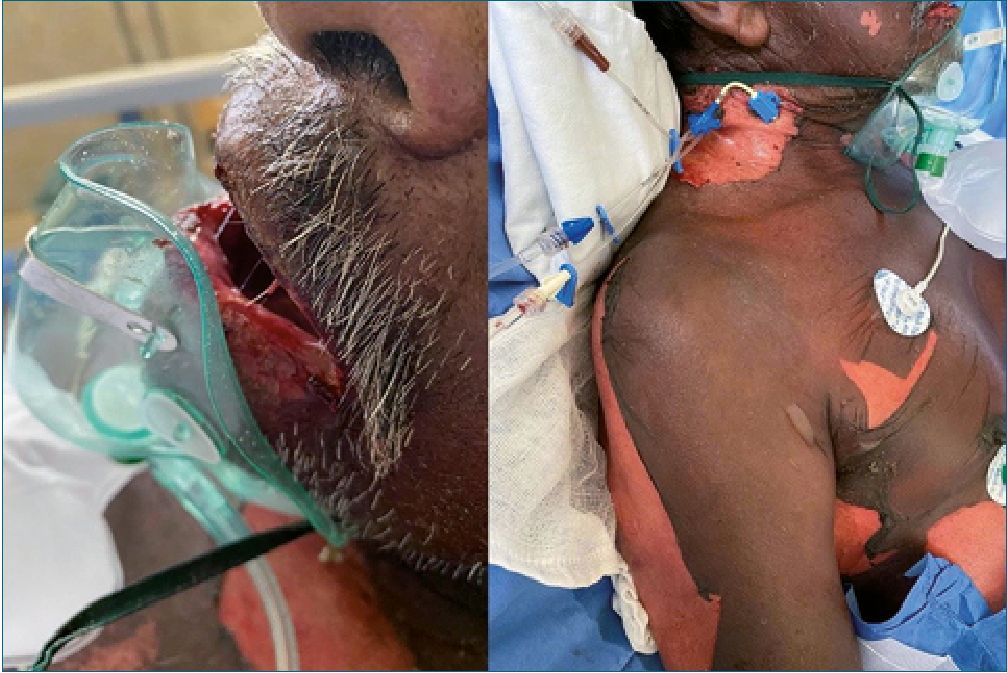
Figura 2. Paciente dentro de las primeras 72 horas posterior a la aplicación de fenitoina, podemos observar donde la afeccion a mucosas empieza a hacerse presente.
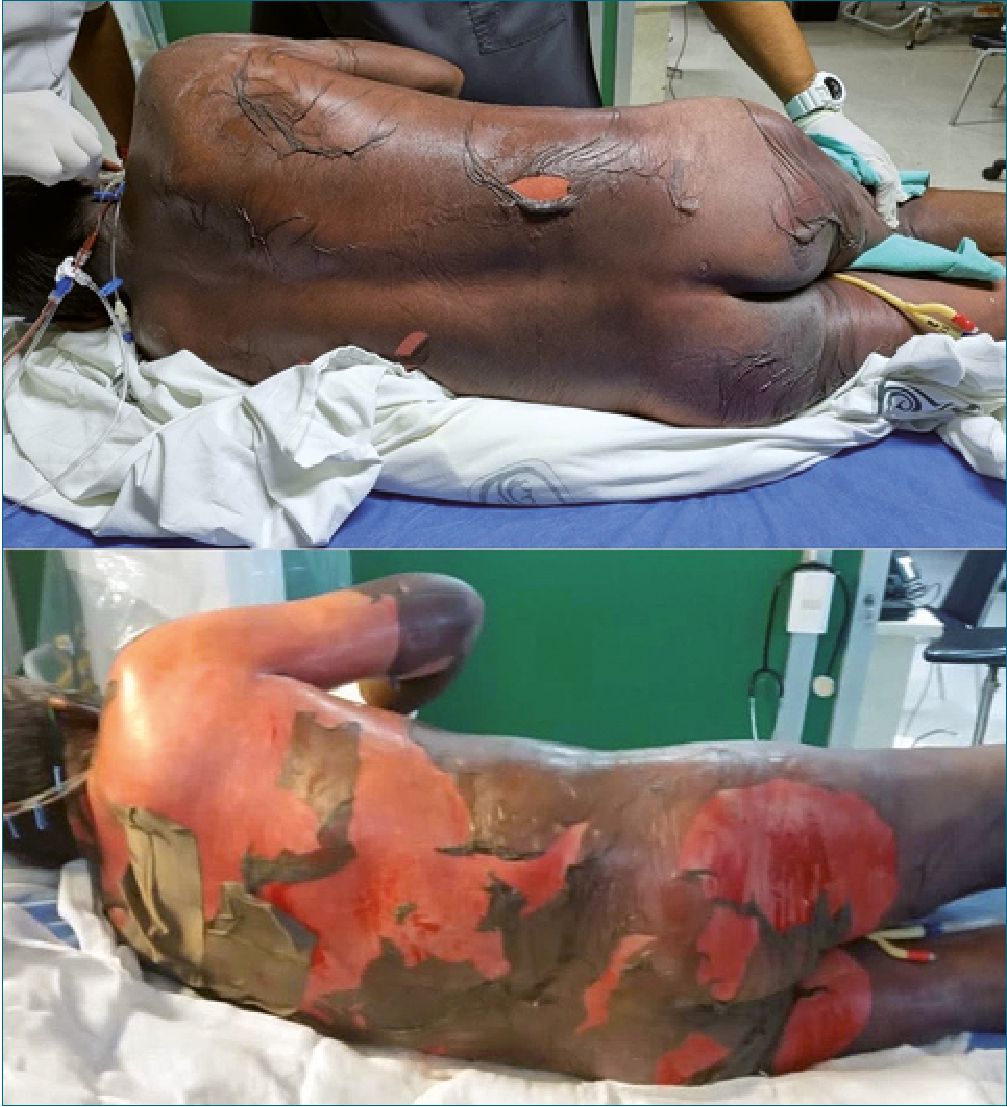
Figura 3. Paciente dentro de la primera semana de la aplicación de fenitoina, con datos de falla multiorganica.
-
Discusión
La necrólisis epidérmica toxica y el Síndrome de Steven Jonhson son reacciones idiosincráticas secundarias a la aplicación principalmente, de fármacos[1]. Se caracteriza por presentar un período prodrómico caracterizado por síntomas inespecíficos como fiebre, cefalea, mialgias, artralgias y ataque al estado general, que se pueden presentar hasta 3 semanas después de haber consumido, el fármaco culpable. Posteriormente, se van desarrollando maculas y placas de aspecto eritematoso y eritea- mtoviolaceo de bordes definidos y tendencia a confluir, generalmente, comenzando en tronco que después se convertiran en lesiones vesiculo ampollosas fragiles de contenido seroso y serohematico, pudiendo ser muy dolorosas al reventarse y dejar la piel denudada[2].
Es importante señalar que la NET y SSJ son una sola enfermedad en diferente espectro, y lo unico que la diferencia es el area de superficie corporal que afectan[2].
Es causada por múltiples mecanismos fisiopatológicos inmunitarios, todos teorizados y no comprobados, principalmente, por la captación del fármaco por células presentadoras de antígeno, activando los linfocitos TCD8 y Natural Killer que liberaran sustancias como granulisina, enzima que daña la superficie de membrana celular y promueve la apoptosis; también se activa el FAS ligando con la producción celular de interferón, lo que activa la apoptosis celular programada. Por último, otras enzimas también liberadas y que se han encontrado en grandes cantidades en las lesiones ampollosas, son la granzina y la per- forina, también enzimas proteolíticas que dañan la superficie de membrana promoviendo la destrucción celular[3].
Por estas teorías de vías fisiopatológicas se han intentado establecer distintas terapéuticas que bloqueen cada una de ellas, sin obtener grandes resultados estadísticos, como lo es el uso de esteroides a grandes dosis desde el estudio realizado por Liue et al., que concluye una disminución de la mortalidad en base a la escala de SCORTEN de ingreso[4]. Estudio con muchas limitantes, como: dosis de esteroide no estandarizadas, selección de pacientes no estandarizado y las condiciones terapéuticas distintas[5]. Otra opción disponible es el uso de inmunoglobulina, para el bloqueo Fas-FasL, Viard et al. Donde administró inmunoglobulina a dosis variables no estandarizadas que iban desde los 0,2-0,75 gr/kg durante 4 días consecutivos observando interrupción de la enfermedad[6],[7].
La Japanese Research Committee on Severe Cutaneous Adverse Reaction recomienda el uso de esteroide de preferencia la metilprednisolona 1-2 mg/kg[8], y el uso de inmunoglobulina al no haber mejoria al tercer día de terapeutica con esteoride como monoterapia. Su recomendación son dosis de 1 gr/kg/día por 3 días con un total de 3 gr/kg[9],[10].
-
Conclusión
La NET y el SSJ son entidades que aún no se han esclarecido bien sus mecanismos fisiopatológicos y todas son vías meramente teoricas. Asi mismo, los tratamientos que existen en estos momentos, son basados en estudios retrospectivos no estandarizados, por lo cual son de muy baja evidencia científica, basandose solamente con un nivel recomendación de experto, y que además no han demostrado realmente una disminución de la mortalidad, pero si un incremento de los efectos secundarios de su uso, tal es es caso de infecciones, promoviendo el estado séptico y aumentando la mortalidad. Lo único que ha logrado disminuir la mortalidad en estos pacientes al igual que en cualquier otro paciente crítico, han sido las medidas generales llevadas a tiempo y en forma adecuada como la ventilación mecanica protectora, alimentacion temprana, líquidos parenterales llevando a balances neutros, evitar la sobrecarga y, sobre todo y no menos importante, la rehabilitación temprana. Así mismo, llevar el manejo de una forma multidiciplinaria con otros especialistas médicos.
Referencias
1. Bastuji-Garin S, Rzany B, Stern RS, Shear NH, Naldi L, Roujeau JC. Clinical classification of cases of toxic epidermal necrolysis, Stevens-Johnson syndrome, and erythema multiforme. Arch Dermatol. 1993 Jan;129(1):92–6. https://doi.org/10.1001/archderm.1993.01680220104023 PMID:8420497
2. Chen CB, Abe R, Pan RY, Wang CW, Hung SI, Tsai YG, et al. An updated review of the molecular mechanisms in drug hypersensitivity. J Immunol Res. 2018 Feb;2018:6431694. https://doi.org/10.1155/2018/6431694 PMID:29651444
3. Stevens A, Johnson F. A new eruptive fever associated with stomatits and ophthalmia: report of two cases in children. Am J Dis Child. 1922;24:526–33. https://doi.org/10.1001/archpedi.1922.04120120077005.
4. Rhen T, Cidlowski JA. Antiinflammatory action of glucocorticoids—new mechanisms for old drugs. N Engl J Med. 2005 Oct;353(16):1711–23. https://doi.org/10.1056/NEJMra050541 PMID:16236742
5. Zimmermann S, Sekula P, Venhoff M, Motschall E, Knaus J, Schumacher M, et al. Systemic immunomodulating therapies for stevens-Johnson syndrome and toxic epidermal necrolysis: a systematic review and meta-analysis. JAMA Dermatol. 2017 Jun;153(6):514–22. https://doi.org/10.1001/jamadermatol.2016.5668 PMID:28329382
6. Viard I, Wehrli P, Bullani R, Schneider P, Holler N, Salomon D, et al. Inhibition of toxic epidermal necrolysis by blockade of CD95 with human intravenous immunoglobulin. Science. 1998 Oct;282(5388):490–3. https://doi.org/10.1126/science.282.5388.490 PMID:9774279
7. Lee HY, Lim YL, Thirumoorthy T, Pang SM. The role of intravenous immunoglobulin in toxic epidermal necrolysis: a retrospective analysis of 64 patients managed in a specialized centre. Br J Dermatol. 2013 Dec;169(6):1304–9. https://doi.org/10.1111/bjd.12607 PMID:24007192
8. Wang CW, Yang LY, Chen CB, Ho HC, Hung SI, Yang CH, et al.; the Taiwan Severe Cutaneous Adverse Reaction (TSCAR) Consortium. Randomized, controlled trial of TNF-α antagonist in CTL-mediated severe cutaneous adverse reactions. J Clin Invest. 2018 Mar;128(3):985–96. https://doi.org/10.1172/JCI93349 PMID:29400697
9. Sunaga Y, Kurosawa M, Ochiai H, Watanabe H, Sueki H, Azukizawa H, et al. The nationwide epidemiological survey of Stevens-Johnson syndrome and toxic epidermal necrolysis in Japan, 2016-2018. J Dermatol Sci. 2020 Dec;100(3):175–82. https://doi.org/10.1016/j.jdermsci.2020.09.009 PMID:33046331
10. Hsieh MH, Watanabe T, Aihara M. Recent Dermatological Treatments for Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis in Japan. Front Med (Lausanne). 2021 Jul;8:636924. https://doi.org/10.3389/fmed.2021.636924 PMID:34395458

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution