Eddisson Quispe Pilco1,*, Jhoscy Quispe Pilco2, Marjorie Calderón Lozano2, Jessica León Castillo3, Jorge Solsol Figueroa3, Magaly Cavalcanti Castillo4
Recibido: 16-06-2023
Aceptado: 23-07-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 6 pp. 629-633|https://doi.org/10.25237/revchilanestv52n6-13
PDF|ePub|RIS
Dipyrone anaphylaxis in a pregnant patient during labor epidural analgesia
Abstract
Anaphylaxis is a severe systemic hypersensitivity reaction with a sudden and unpredictable onset, it presents a clinical features that severely compromises the cutaneous, respiratory and cardiovascular systems. In pregnant women, diagnosis and treatment can be difficult due to the physiological changes of pregnancy and the risk of fetal well-being. The case of a pregnant woman in labor is reported, who presented anaphylaxis after the administration of dipyrone and epidural labor analgesia. A good response to treatment with adrenaline was evidenced, with adequate recovery after the event. The patient had no history of hypersensitivity to dipyrone or other drugs, in order to identify the causative agent, a basophil activation test to dipyrone was performed, which was negative, subsequently skin tests were performed: Prick Test and intradermal test with all suspected drugs giving both positive tests to dipyrone.
Resumen
La anafilaxia es una grave reacción sistémica de hipersensibilidad de inicio súbito e impredecible, presenta un cuadro clínico que compromete gravemente los sistemas cutáneo, respiratorio y cardiovascular. En gestantes el diagnóstico y tratamiento pueden ser difíciles por los cambios fisiológicos del embarazo y el riesgo del bienestar fetal. Se reporta el caso de una gestante en trabajo de parto que presenta anafilaxia luego de la administración de dipirona y analgesia epidural de parto. Se evidenció buena respuesta al tratamiento con adrenalina, con adecuada recuperación luego del evento. La paciente no tenía antecedentes de hipersensibilidad a la dipirona u otros fármacos, para identificar el agente causal se realizó una prueba de activación de basófilos a la dipirona resultando negativa y posteriormente se realizaron pruebas cutáneas: Prick Test y prueba intradérmica con todos los fármacos sospechosos dando ambas pruebas positivas a dipirona.
-
Introducción
-
Descripción del caso
La anafilaxia es una grave reacción sistémica de hipersen- sibilidad de aparición súbita e impredecible[1],[2], en gestantes su incidencia es de 1,6 a 2,7 casos por 100.000 nacimientos[2],[3],[4], se presenta generalmente en el parto[5], con una mortalidad entre 3,5% a 5%[3],[5]. El colapso materno cardiovascular y respiratorio puede causar morbimortalidad fetal y neonatal por hipoperfusión útero-placentaria[6], se ha reportado 14,3% de incidencia de encefalopatía hipóxica neonatal en casos de anafilaxia en gestantes[5].
La primera causa de anafilaxia en gestantes son los antibióticos especialmente penicilinas[2],[4], siguen los antiinflamatorios no esteroideos (AINES), misoprostol, ácido tranexámico, er- gometrina, hierro endovenoso, coloides, clorhexidina y látex[7]; es muy rara la alergia a anestésicos locales y opioides.
La dipirona (metamizol) derivada de la pirazolona, se utiliza como analgésico y antipirético, reportándose graves reacciones adversas como síndrome de Stevens-Johnson, agranulocitosis y anafilaxia[8], con una incidencia de reacciones alérgicas de 1/5.000 administraciones parenterales[8]. Está prohibida y restringida en varios países, en Latinoamérica es muy utilizada por ser un fármaco económico y fácil de administrar.
La anafilaxia se inicia por dos vías, una por unión del antí- geno a la inmunoglobulina E (Ig E) específica formada en una sensibilización previa (60% de casos) y otra por interacción del antígeno con inmunoglobulina G (Ig G) causando activación del complemento (40% de casos)[9]. Los complejos antígeno- anticuerpo causan que mastocitos y basófilos liberen grandes cantidades de histamina, triptasa, carboxipeptidasa-A y sero- tonina[3], aumentando la producción de prostaglandinas, cito- quinas y leucotrienos[7],[9].
Los cambios fisiológicos de la gestación como la hipotensión y edema en piel y mucosas pueden dificultar el diagnóstico de anafilaxia en gestantes debido a que el cuadro clínico es muy variable comprometiendo diversos sistemas[9] (Tabla 1).
El objetivo de este reporte es describir el cuadro clínico, diagnóstico, tratamiento, y evolución de una reacción anafilác- tica por dipirona posterior a la administración de una analgesia epidural de parto, también se describen las pruebas inmunoló- gicas para identificar el agente desencadenante.
Gestante de 22 años, ingresa a centro obstétrico (CO) con diagnósticos de segundigesta nulípara de 40 semanas, óbito fetal, trabajo de parto fase activa, corioamnionitis y obesidad mórbida. Antecedente de asma desde los 10 años de edad, última crisis un mes antes. No refirió alergia a medicamentos o alimentos. Antecedente de un legrado uterino.
Al examen físico: peso 100 kg, talla 154 cm; saturación de oxígeno (SpO2) 98%, presión arterial (PA) 130/80 mmHg, frecuencia cardíaca (FC) 114/min, frecuencia respiratoria (FR) 14/ min y temperatura (T°) 38°C. Al tacto vaginal: dilatación cervical de 4 cm, membranas rotas con líquido amniótico meconial. Latidos fetales ausentes. En laboratorio: hemoglobina 13 g/dL, leucocitosis de 16,300/mm3 sin desviación izquierda, no alteraciones de coagulación. Un día antes inició antibioticoterapia con ceftriaxona, clindamicina y amikacina endovenosa (EV) por corioamnionitis. Se indicó manejo activo de trabajo de parto con oxitocina, continuar antibióticos, dimenhidrinato, dipirona y analgesia de parto.
Se inició analgesia epidural 20 minutos después de culminada la administración de 1,5 g de dipirona EV, con funciones vitales: PA 125/79 mmHg, FC 119/min, FR 24/min, T° 38°C y SpO2 98%, se infiltró piel con lidocaína al 2% en zona lumbar L3-L4 y con aguja Touhy N°18 se ubicó espacio epidural al primer intento, infundiéndose 20 ml de bupivacaína al 0,125% colocando catéter epidural sin eventualidades, se registró rápido alivio del dolor sin bloqueo motor. A los 5 minutos post analgesia, la paciente refirió súbitamente disnea y malestar general, registrando PA 76/40 mmHg, FC 140/min, FR 35/min y SpO2 70%-80%; la hipotensión arterial progresó a shock con PA de 56/35 mmHg, trastorno del sensorio, urticaria generalizada a predominio toraco-abdominal y sibilancias de gran intensidad en ambos campos pulmonares. Se suspendió la infusión de oxitocina EV iniciándose hidratación con ClNa 9% 1.000 ml infusión EV, oxígeno por máscara con bolsa de reservorio a 10L/ min, salbutamol inhalatorio 10 puff, hidrocortisona 250 mg/EV, clorfenamina 10 mg/EV y sulfato de magnesio 2 g/EV.
Debido a la persistencia del shock y broncoespasmo severo se administró adrenalina 0,3 mg subcutáneo, al no observar respuesta se inició adrenalina 50 mcg EV cada 3 minutos hasta
Tabla 1. Cuadro clínico de anafilaxia en gestante
| Piel y mucosas: prurito, eritema, urticaria, cianosis, edema facial de párpados, labios, lengua y úvula |
| Respiratorio: disnea, edema glótico, estridor laríngeo, broncoespasmo, hipoxemia, desaturación, taquipnea |
| Cardiovascular: taquicardia, bradicardia, arritmias, hipotensión, shock, signos de isquemia en el electrocardiograma (alteraciones en segmento ST y onda T) |
| Neurológico: agitación, trastorno del sensorio, síncope |
| Gastrointestinal: náuseas y vómitos, dolor abdominal tipo cólico severo, incontinencia de esfínter rectal |
| Musculoesquelético: hipotonía muscular, dolor torácico y lumbar |
| Reproductor y genital: contracciones uterinas, prurito vaginal y vulvar, incontinencia de esfínteres urinarios |
| Fetal: taquicardia, bradicardia fetal, encefalopatía hipóxico-isquémica, muerte fetal |
| Fuente: autores. |
llegar a 300 mcg en total obteniéndose buena respuesta de: PA de 132/59 mmHg, FC de 130/min, FR 20/min, SpO2 de 100%. La paciente despertó, la urticaria desapareció y las sibilancias disminuyeron en frecuencia e intensidad.
Se decidió cesárea de emergencia, pero al tacto vaginal se encontró dilatación de 10 cm, optándose por parto vaginal, el cual se realizó sin complicaciones, con buen pujo en el expulsivo y sin dolor.
La paciente fue derivada a la unidad de cuidados intensivos (UCI) con los diagnósticos de puérpera inmediata, crisis asmática severa en remisión y probable reacción adversa a la dipirona. La broncoconstricción residual fue controlada con salbutamol inhalatorio y se continuó con los mismos antibióticos para corioamnionitis sin presentar incidentes, reemplazándose la dipirona por paracetamol para manejo del dolor y fiebre. El alta de UCI se dio a las 72 h, en hospitalización se agregó beclo- metasona y bromuro de ipratropio inhalatorios más ejercicios de espirometría, tres días después fue dada de alta totalmente restablecida.
-
Discusión
El inicio de la anafilaxia generalmente se da 5 a 20 minutos post exposición al antígeno dependiendo de la vía de contac- to[9], pero también se ha descrito varias horas después del con- tacto[8]. En este caso la dipirona fue el último fármaco administrado antes de la analgesia epidural y la anafilaxia se presentó post-analgesia, esto generó confusión en el diagnóstico, puesto que la hipotensión se asocia al uso de analgesia neuroaxial y el antecedente de asma orientó inicialmente hacia una crisis asmática severa, siendo la presencia de urticaria lo que ayudó a sospechar anafilaxia.
La anafilaxia puede presentarse sin antecedente de aler- gias[9]. La paciente presentaba múltiples factores de riesgo de reacción alérgica como el uso de diversos medicamentos, asma y cofactores amplificadores de alergia (corioamnionitis, estrés emocional y obesidad)[1]. La anafilaxia en gestantes puede comprometer los sistemas cutáneo y/o mucosas (80%-90%), respiratorio (70%), cardiovascular (45%) y gastrointestinal (45%)[9], pero pueden estar ausentes uno o varios de estos componentes dificultando el diagnóstico[3],[9].
La Organización Mundial de la Alergia (WAO)[1] y el Instituto Nacional de alergias y enfermedades infecciosas de los
E.E.U.U. (NIAID)[1] establecen dos criterios diagnósticos de ana- filaxia (Tabla 2). El caso descrito cumplía ambos criterios.
El tratamiento de anafilaxia en gestante es similar a la no gestante[6]. En primera línea se incluyen el uso de adrenalina, suspensión de medicamentos, retiro de contacto con potenciales alergenos, hidratación endovenosa y oxigenoterapia[1],[7]. La gestante debe ser colocada en decúbito lateral izquierdo durante el evento[1],[3],[4], en decúbito dorsal se puede desplazar manualmente el útero a la izquierda[4]. El tratamiento de segunda línea incluye antihistamínicos, glucocorticoides y p-2 agonistas[1].
La adrenalina es la piedra angular del tratamiento para evitar el colapso respiratorio y cardiovascular[4],[5],[9], existen dos vías de administración: la vía intramuscular con dosis de ataque de 0,5 mg cada 5 minutos en la cara externa del muslo[4] y la vía endovenosa con dosis de 50-100 mcg cada 3 minutos en bolos hasta obtener mejoría, la mayoría de pacientes se recuperará con una o dos dosis de administración[1]. En este caso se utilizó inicialmente adrenalina por vía subcutánea sin obtener adecuada respuesta, optándose por la vía endovenosa con rápida mejoría. No se recomienda adrenalina subcutánea debido a su irregular y lenta absorción.
Existe el temor de usar adrenalina en gestantes por el riesgo fetal, pero la disminución transitoria del flujo placentario es contrarrestada por el potente aumento de la presión arterial mejorando la perfusión placentaria[4], el objetivo debe ser una presión sistólica > 90 mmHg para una óptima perfusión útero- placentaria y oxigenación fetal[7]. En el caso reportado al tratarse de un óbito no se tuvo el problema de riesgo fetal.
Es importante la rápida administración de suero fisiológico a una dosis de ataque de 20 ml/kg1, se debe contar con catéteres intravenosos de gran calibre debido a que la anafilaxia se caracteriza por un rápido estado de hipovolemia por pérdida de líquidos del intravascular hacía los tejidos[9]. Los glucocorti- coides y antihistamínicos son empleados para aminorar la reacción alérgica y evitar reacciones bifásicas, pero no hay pruebas concluyentes que respalden su administración[1],[9],[10]. La clorfenamina pueden causar hipotensión arterial por infusión rápida[1]. En el caso se mencionó el uso de sulfato de magnesio endovenoso por sus propiedades broncodilatadoras pero este no forma parte del tratamiento de anafilaxia.
En anafilaxia durante el trabajo de parto es fundamental estabilizar a la madre y guiarse del bienestar fetal para decidir cómo terminar el embarazo[4], es importante el monitoreo fetal
Tabla 2. Criterios diagnósticos de probable anafilaxia
| Cualquiera de las 2 presentaciones: |
| 1. Inicio súbito (minutos a horas) con compromiso cutáneo y/o mucosas (urticaria, prurito, rash, edemas labio-lengua-úvula) y al menos uno de los siguientes criterios: |
| – Compromiso respiratorio- Hipotensión arterial y/o síntomas de disfunción de órganos (síncope, hipotonía muscular, incontinencia de esfínteres)
– Compromiso gastrointestinal severo |
| 2. Inicio súbito luego de exposición a un probable alergeno con o sin presencia de signos cutáneos y cualquiera de los siguientes signos: |
| – Hipotensión arterial- Broncoespasmo
– Obstrucción laríngea Fuente: adaptado de: Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Fernández Rivas M, Fineman S, et al. World allergy organization anaphylaxis guidance 2020. World Allergy Organ J. 2020;13(10):100472. |
continuo[9], se debe valorar la dilatación del cuello uterino y si hay condiciones para completar rápidamente la dilatación. Si la anafilaxia ha sido controlada, lo conveniente es continuar parto vaginal. El tratamiento refractario y persistencia de inestabilidad en las funciones vitales maternas o fetales son indicaciones de cesárea inmediata[4].
En este caso se estabilizó a la paciente y se culminó el parto por vía vaginal, evitando la cesárea que hubiese ocasionado mayor sangrado y el uso de fármacos anestésicos que podrían haber agravado el cuadro clínico. La cesárea tiene mayor riesgo de anafilaxia que un parto vaginal[2].
En sospecha de anafilaxia es recomendable el dosaje sérico de histamina y triptasa[7],[9],[11], sus elevaciones son altamente específicas de una reacción alérgica[9],[11], pero valores normales (50% de casos)[5] no excluyen una reacción alérgica[1]; en este caso no se realizaron dosajes por falta de insumos.
Es importante determinar el agente causal de la anafi- laxia[12], los casos deberían referirse a un especialista en alergia e inmunología[1],[4], se utilizan pruebas in vitro como la prueba de Ig E específicas, test de activación de basófilos y pruebas in vivo como el prick test (sensibilidad de 30,7% a 69,7%)[6], test intradérmico y test de provocación[12], pero se deben realizar al menos cuatro semanas después del evento para evitar falsos
Doce meses después del evento se realizó test de activación de basófilos a la dipirona al ser el principal agente sospechoso; sin embargo, no se observó reacción de hipersensibilidad, dando solo sospecha de intolerancia a la dipirona (Figura 1).
Debido a este resultado se realizaron prick test y prueba intradérmica para los fármacos involucrados en el evento: anestésicos locales (lidocaína y bupivacaína), dimenhidrinato, dipiro- na, fentanilo y látex. En ambas pruebas el resultado fue positivo a la dipirona (Figura 2), sugiriéndolo como el desencadenante de la anafilaxia. En 40% de los casos de reacciones alérgicas nunca se logra determinar el agente responsable[9].
-
Conclusiones
El diagnóstico temprano y tratamiento oportuno de la ana- filaxia en gestantes disminuye la morbimortalidad materna, es importante el uso precoz de los medicamentos de primera línea especialmente la adrenalina.
La anafilaxia en gestantes en trabajo de parto obliga a tomar una rápida decisión de como terminar la gestación una vez lograda la estabilización de la paciente.
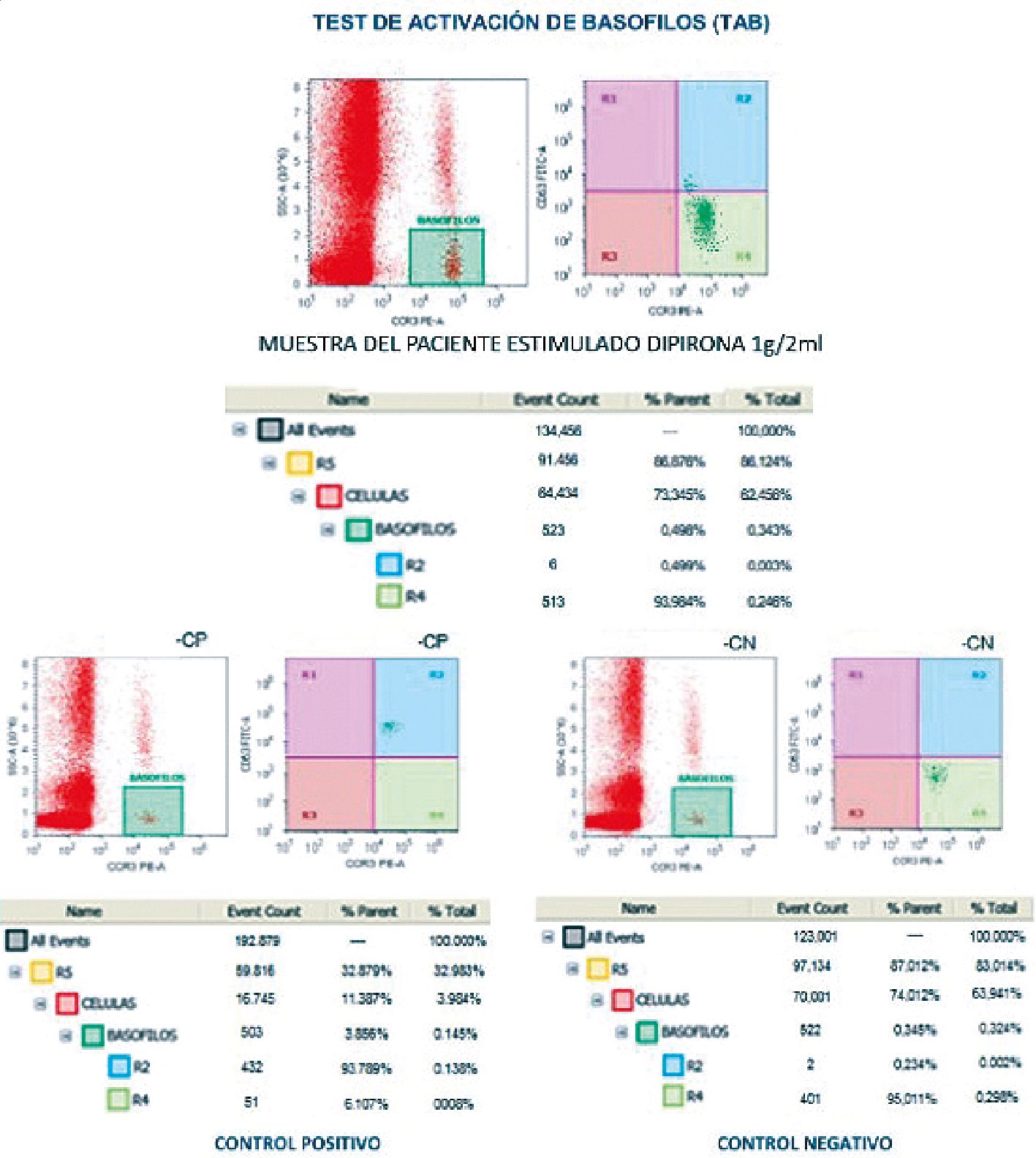
Figura 1.
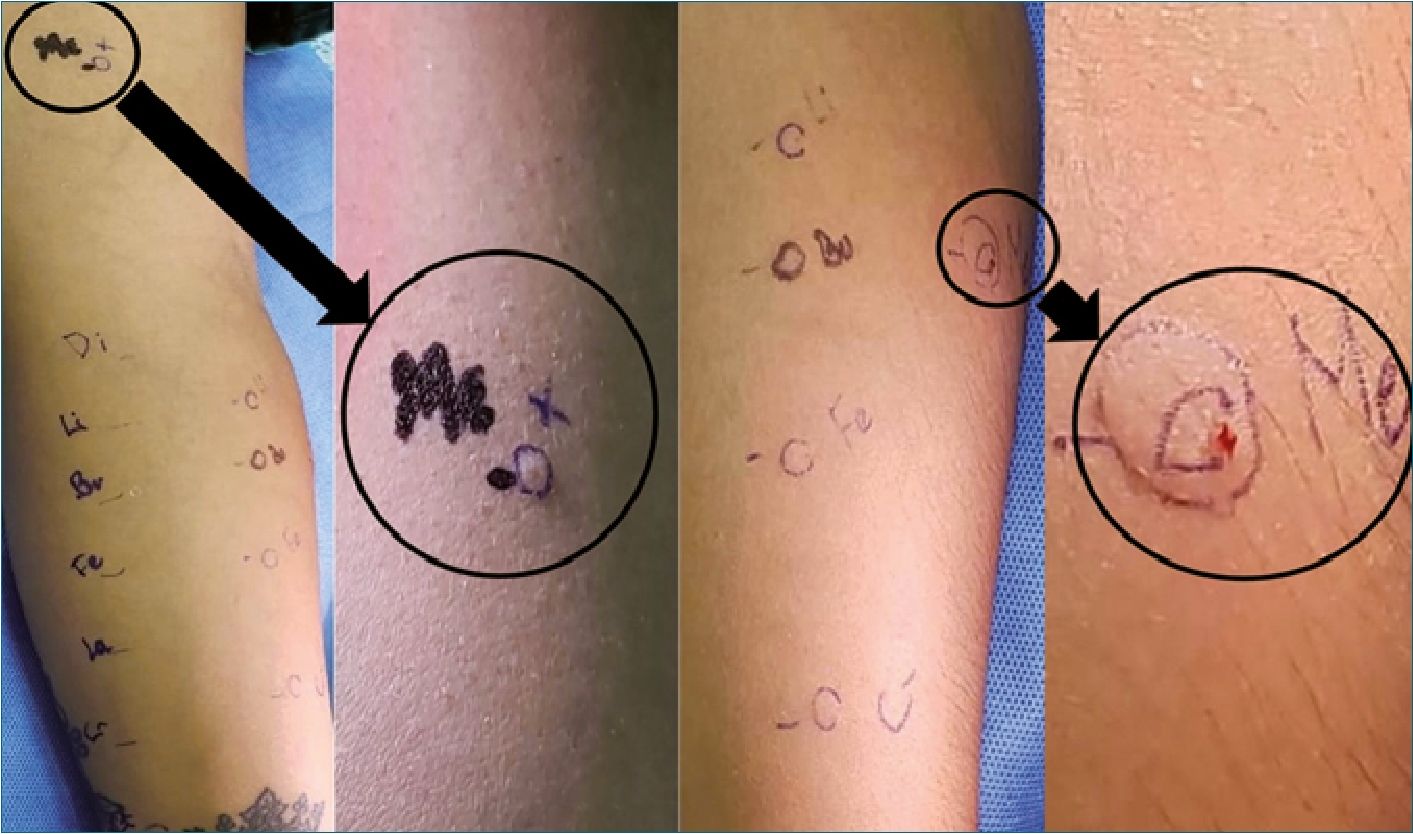
Figura 2.
Es importante determinar el agente causal de la reacción alérgica, para esto contamos con pruebas in vitro como el test de liberación de basófilos y pruebas in vivo como el Prick test cutáneo y la intradermoreacción.
Financiamiento: Los autores no recibieron patrocinio para realizar este artículo.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
Referencias
1. Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Fernandez Rivas M, Fineman S, et al. World allergy organization anaphylaxis guidance 2020. World Allergy Organ J. 2020 Oct;13(10):100472. https://doi.org/10.1016/j.waojou.2020.100472 PMID:33204386
2. McCall SJ, Kurinczuk JJ, Knight M. Anaphylaxis in pregnancy in the United States: risk factors and temporal trends using national routinely collected data. J Allergy Clin Immunol Pract. 2019;7(8):2606–2612.e3. https://doi.org/10.1016/j.jaip.2019.04.047 PMID:31102701
3. Simionescu AA, Danciu BM, Stanescu AM. Severe anaphylaxis in pregnancy: A systematic review of clinical presentation to determine outcomes. J Pers Med. 2021 Oct;11(11):1060. https://doi.org/10.3390/jpm11111060 PMID:34834412
4. Tan E, O’Sullivan M, Crozier T, Kolawole H, Mantas S, Said M, et al. Acute management of anaphylaxis in pregnancy. Aust J Gen Pract. 2022 Jun;51(6):405–8. https://doi.org/10.31128/AJGP-03-21-5918 PMID:35637583
5. McCall SJ, Bonnet MP, Ayras O, Vandenberghe G, Gissler M, Zhang WH, et al. Anaphylaxis in pregnancy: A population-based multinational European study. Obstet Anesthes Dig. 2021;41(3):124–124. https://doi.org/10.1097/01.aoa.0000766052.11437.00.
6. Jeon HJ, Ryu A, Min J, Kim NS. Maternal anaphylactic shock in pregnancy: A case report. Medicine (Baltimore). 2018 Sep;97(37):e12351. https://doi.org/10.1097/MD.0000000000012351 PMID:30212990
7. Simionescu AA, Stanescu AM, Popescu FD. State-of-the-art on biomarkers for anaphylaxis in obstetrics. Life (Basel). 2021 Aug;11(9):870. https://doi.org/10.3390/life11090870 PMID:34575019
8. Machado-Alba JE, Urbano-Garzón SF, Gallo-Gómez YN, Zuluaica S, Henao Y, Parrado-Fajardo IY. Reacción de anafilaxia grave por dipirona sin antecedente de hipersensibilidad. Informe de caso. Rev Colomb Anestesiol. 2017;45:8–11. https://doi.org/10.1016/j.rca.2015.11.010.
9. Tacquard C, Iba T, Levy JH. Perioperative Anaphylaxis. Anesthesiology. 2023 Jan;138(1):100–10. https://doi.org/10.1097/ALN.0000000000004419 PMID:36413685
10. Højlund S, Søe-Jensen P, Perner A, Bestle MH, Carl P, Thormar K, et al. Low incidence of biphasic allergic reactions in patients admitted to intensive care after anaphylaxis. Anesthesiology. 2019 Feb;130(2):284–91. https://doi.org/10.1097/ALN.0000000000002500 PMID:30418213
11. Carra S, Schatz M, Mertes PM, Torres MJ, Fuchs F, Senna G, et al. Anaphylaxis and pregnancy: A systematic review and call for public health actions. J Allergy Clin Immunol Pract. 2021 Dec;9(12):4270–8. https://doi.org/10.1016/j.jaip.2021.07.046 PMID:34365055
12. Takahashi M, Hotta K, Inoue S, Takazawa T, Horiuchi T, Igarashi T, et al. Mepivacaine-induced anaphylactic shock in a pregnant woman undergoing combined spinal and epidural anesthesia for cesarean delivery: a case report. JA Clin Rep. 2019 Dec;5(1):84. https://doi.org/10.1186/s40981-019-0302-6 PMID:32026066

 ORCID
ORCID