Jován González1,*, María Loreto Astudillo2,3, Daniella Rigo-Righi2,3, José Luis Briones4
Recibido: 04-09-2023
Aceptado: 08-09-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 8 pp. 729-733|https://doi.org/10.25237/revchilanestv52n8-06
PDF|ePub|RIS
Viscoelastic tests in the perioperative management of oncology patients
Abstract
Viscoelastic tests in perioperative management have shown utility in various areas related to anesthesiological activity, for example, in patients undergoing heart surgery, trauma patients, in the management of obstetric haemorrhage, in patients undergoing liver surgery and in patients with massive hemorrhage of different causes. Cancer patients have special hemostatic characteristics for whom accurate interpretation of their hemostatic status is sometimes difficult with traditional coagulation tests. Viscoelastic tests can have a significant impact on diagnosis and management of coagulopathy that these patients may suffer in the perioperative period. In the present evidence based review, these techniques are presented to assess the prothrombotic state and the risk of perioperative thromboembolic disease, as well as their usefulness in guiding the replacement of hemostatic products during the perioperative period in cancer patients.
Resumen
Las pruebas viscoelásticas en el manejo perioperatorio han mostrado utilidad en diversas áreas relacionadas con la actividad anestesiológica; por ejemplo, en pacientes sometidos a cardiocirugía, pacientes víctimas de trauma, en el manejo de la hemorragia obstétrica, en pacientes sometidos a cirugía hepática y en pacientes con hemorragia masiva de diversas causas. Los pacientes oncológicos tienen características hemostáticas particulares para los cuales una interpretación precisa de su estado hemostático a veces resulta difícil con las pruebas de coagulación tradicionales. Las pruebas viscoelásticas en este grupo de pacientes pueden tener un impacto significativo en el diagnóstico y manejo de la coagulopatía que pueden sufrir estos pacientes en el perioperatorio. En la presente revisión se presenta evidencia de estas pruebas para evaluar el estado protrombótico y el riesgo de enfermedad tromboembólica perioperatoria, así como su utilidad para guiar la reposición de productos hemostáticos durante el perioperatorio de los pacientes oncológicos.
-
Introducción
La primera descripción de la técnica que dio origen a las actuales pruebas viscoelásticas data del año 1948[1]. Sin embargo, pasaron varias décadas sin que los médicos valoraran sus aportes al estudio de la coagulación y por lo tanto, sin ser exploradas. Estas pruebas son exámenes que evalúan la hemostasia de forma global prácticamente en tiempo real. Es una visión global porque tienen la capacidad de estimar la contribución de la mayoría de los componentes de la hemostasia en su conjunto (plaquetas, fibrinógeno, factores de la coagulación y otras proteínas), y no por separado como los hacen los test de coagulación tradicionales.
Estos métodos evalúan el cambio en las propiedades físicas del coágulo durante la transformación desde un estado líquido a un estado gelificado mediante diversos mecanismos dependiendo de la tecnología que incorpore el dispositivo. Los dispositivos más conocidos son los que realizan tromboelastografía (TEG) y tromboelastometría rotacional (ROTEM). La descripción detallada de sus mecanismos y variables a medir no es parte de esta revisión.
-
Pruebas viscoelásticas en entornos no oncológicos
Las pruebas viscoelásticas han demostrado gran utilidad en el manejo de pacientes en determinados escenarios. El área donde existen más estudios es en cirugía cardiovascular. En esta especialidad existen varios estudios clínicos y metaanálisis que demuestran su superioridad para la gestión de hemoderivados y factores hemostáticos en comparación al juicio clínico y las pruebas coagulación convencionales[2], demostrando una disminución en la necesidad de transfusión de glóbulos rojos, plaquetas y plasma fresco congelado. Hay estudios que han insinuado una disminución en la mortalidad, aunque no ha sido demostrado en forma sistemática.
Otro escenario donde ha sido útil el uso de las pruebas viscoelásticas es en hemorragia posparto, en quienes se ha demostrado que el manejo en base a protocolos guiados por ROTEM®, específicamente con el parámetro A5 de la curva de FIBTEM®, disminuye la cantidad de unidades de hemoderivados transfundidos al guiar la reposición según el factor estimado como deficitario, principalmente fibrinógeno, con la consiguiente disminución en los efectos adversos a las transfusiones[3]. Similares resultados se han obtenido de trabajos realizados en pacientes sometidos a cirugía hepática y víctimas de trauma[4].
Hay experiencias que muestran el impacto de estas pruebas cuando se incluyen en los algoritmos de manejo de ciertas patologías, como el estudio que demostró que una reanimación guiada por TEG® mejoraba la sobrevida de los pacientes con aneurisma aórtico abdominal roto[5]. En un ensayo controlado aleatorizado[6] se evaluó la reanimación hemostática de pacientes víctimas de trauma guiada por protocolo y pruebas de coagulación convencionales versus TEG, y se observó una mayor sobrevida en el grupo guiado por TEG, con un consumo menor de hemo componentes. Resultados equivalentes han sido reportados en centros de trauma donde se han integrado las pruebas viscoelásticas al algoritmo de manejo de sus pacientes[7].
-
Hemostasia en pacientes oncológicos
Para la formación de un coágulo interaccionan en forma compleja elementos celulares como plaquetas y el endotelio con diversos factores no celulares que tienen acción anticoagulante y procoagulante; bajo la regulación de la fibrinolisis que disuelve la red de fibrina. Este balance hemostático en pacientes oncológicos está severamente alterado por diversos mecanismos, tanto por factores propios del paciente, como de los tratamientos y/o de la enfermedad en particular. Según el tipo de neoplasia, el desbalance puede tender a la trombosis o al sangrado.
El estado protrombótico fue descrito ya en 1865 por Armand Trousseau, y más tarde se describirían diversos mecanismos que explican el mayor riesgo de trombosis[8]. Las células tumorales expresan frecuentemente factor tisular (TF) en su superficie, y también pueden liberarlo a la circulación periférica en forma de vesículas[9],[10], el cual es capaz de activar directamente la cascada de la coagulación. La mayor expresión de fosfolípidos aniónicos en la célula tumoral permite una superficie idónea para la formación del coágulo. También está descrita la secreción de heparanasa, con la consiguiente degradación del heparan sulfato e interferencia en la actividad del inhibidor de la vía del factor tisular (TFPI) y una mayor actividad del TF en las superficies celulares, incluyendo la superficie endotelial. Otro factor procoagulante descrito es el procoagulante del cáncer (CP), capaz de activar directamente al factor X. El factor tisular puede ir asociado a la superficie de las MP, que son pequeñas vesículas liberadas frecuentemente por las plaquetas, pero que también pueden provenir de las células tumorales, y suelen verse en mayores concentraciones ante tumores metastásicos.
También se han descrito mecanismos de activación y agregación plaquetaria directamente por efecto de la célula tumoral, como por ejemplo la expresión de podoplanina[11]. Además, ciertos tipos de células tumorales liberan difosfato de adenosina (ADP) y trombina. Por último, recientemente se ha descrito la liberación de trampas extracelulares de neutrófilos (NET), que funcionan como redes que aumentan la activación y agregación plaquetaria.
A los factores mencionados previamente se suma el aumento del riesgo tromboembólico que por diversos mecanismos inducen los quimioterapéuticos y otros fármacos de uso frecuente en pacientes con cáncer. Este riesgo también puede aumentar en el posoperatorio debido a la injuria de los tejidos y el estado inflamatorio que sufren los pacientes luego de una intervención quirúrgica.
Con respecto a los mecanismos anticoagulantes, destaca que son más frecuentes en leucemias agudas, donde se describe la mayor producción de activadores del plasminógeno y la expresión de anexina II, que son capaces de activar directamente la fibrinolisis. Por otro lado, el inhibidor del activador del plasminógeno-1 (PAI-1) está expresado en exceso en ciertos tipos de cáncer, disminuyendo la capacidad fibrinolítica[12].
En la Figura 1 se esquematizan los elementos que en forma habitual interaccionan para lograr la formación del coágulo como también los factores que se agregan en los pacientes con cáncer que cambian el equilibrio en el estado de coagulación.
De la Figura 1 podemos inferir que la coagulación de un paciente no depende en forma aislada de un único factor, sino más bien de la interrelación de ellos para generar un coágulo. Así si un factor procoagulante esta disminuido, pero además lo están los factores anticoagulantes, el coágulo resultante de este nuevo equilibrio podrá ser el mismo o muy similar que si estos elementos están en rangos normales, obviamente dentro de cierto rango de tolerancia. Otra situación ocurre cuando un factor procoagulante está reducido, pero al sistema se agregan otros elementos procoagulantes que antes no estaban considerados en la ecuación como ocurre con los pacientes con cáncer.
Si tomamos en cuenta que exámenes como el tiempo de protrombina sólo evalúan elementos no celulares contenidos en el plasma y además únicamente valoran los factores de la vía extrínseca y común, podemos comprender que una caída del factor VII con el consiguiente aumento del tiempo de protrombina significa muy poco si no se estima el estado de los otros elementos de la coagulación. Es en estas situaciones donde las pruebas viscoelásticas adquieren especial importancia.
-
Coagulopatía asociada a malignidad y enfermedad tromboembólica perioperatoria
La gran mayoría de las investigaciones con pruebas viscoelásticas en pacientes oncológicos en el perioperatorio están enfocadas en detectar a los pacientes que cursan con un estado hipercoagulable y que están en mayor riesgo de desarrollar un evento trombótico o embólico en el curso de su enfermedad.
Se ha estudiado a pacientes que cursan con patología oncológica con compromiso óseo en los cuales se realizaron pruebas viscoelásticas, en este caso ROTEM®, y se compararon sus resultados con controles sanos. Se logró demostrar que había una diferencia significativa en algunos parámetros de ROTEM® con valores que orientaban hacia una hipercoagulabilidad en los pacientes con tumores óseos. Lo más relevante de este estudio, es que en ambos grupos se realizaron pruebas coagulación convencionales (tiempo de protrombina, tiempo parcial de tromboplastina) las cuales no pudieron mostrar diferencias entre ambos grupos. Este estudio además demostró que había correlación entre la extensión de la enfermedad y el grado de hipercoagulabilidad detectado por ROTEM®[13]. Similares hallazgos han sido reportados en pacientes con cáncer de próstata en los cuales se realizó TEG®[14], y también en pacientes con cáncer de pulmón[15].
Otro estudio es el que desarrolló Hinckers et al., el que evalúo el desarrollo de complicaciones tromboembólicas posoperatorias en pacientes que se sometían a cirugía mayor no cardíaca. En su muestra se incluyó a pacientes oncológicos, los cuales representaban 47% del total de pacientes del estudio. Se realizaron pruebas de coagulación convencionales y ROTEM® a los pacientes previo a la intervención y se buscó relación con el desarrollo de eventos tromboembólicos en el posoperatorio. Los resultados informan una asociación entre parámetros ligados a estados de hipercoagulabilidad en ROTEM® con episodios tromboembólicos en el posoperatorio, dentro de los cuales destaca el valor A10 en INTEM como el mejor predictor del riesgo tromboembólico con un área bajo la curva ROC de 0,75, con un mayor poder predictivo si hay resultados similares en EXTEM o FIBTEM[16].
Los estudios poseen una muestra pequeña y la cantidad de eventos tromboembólicos que pudieron incluir en sus análisis son limitados, por lo que aún no se puede realizar una recomendación precisa en cuanto a la evaluación de riesgo de estos pacientes, así como en las intervenciones que se deberían realizar[14],[15]. A pesar de esta limitante, un metaanálisis analizó la capacidad predictiva de enfermedad tromboembólica en diversos entornos, incluyendo algunos estudios en pacientes oncológicos, e informó una habilidad moderada para identificar a los pacientes en riesgo de enfermedad tromboembólica con sensibilidad y especificidad del 56% y 76%, respectivamente, y un OR de 3,6 (95%CI 2,6-4,9) para pacientes que tenían un estado hipercoagulable versus los que no lo presentaban. Llamativamente, en el análisis de subgrupos los pacientes oncológicos, junto con los pacientes críticos, eran los que mostraban un mejor rendimiento del test con ROC 0,77[17]. Nuevamente, estos estudios eran pequeños y con incidencia variable de eventos trombóticos.
Si bien aún no se puede realizar una recomendación clara, al parecer estas pruebas abren la puerta a una evaluación más precisa del singular estado de coagulación que poseen los pacientes oncológicos y podrían potenciar en un futuro las herramientas de predicción de enfermedades tromboembólicas disponibles para el perioperatorio.
-
Predicción de trombosis de colgajo
Durante el tratamiento del cáncer una fase relevante es la cirugía reconstructiva, que puede ocurrir en el mismo tiempo quirúrgico que se realiza la extirpación tumoral o en forma diferida.
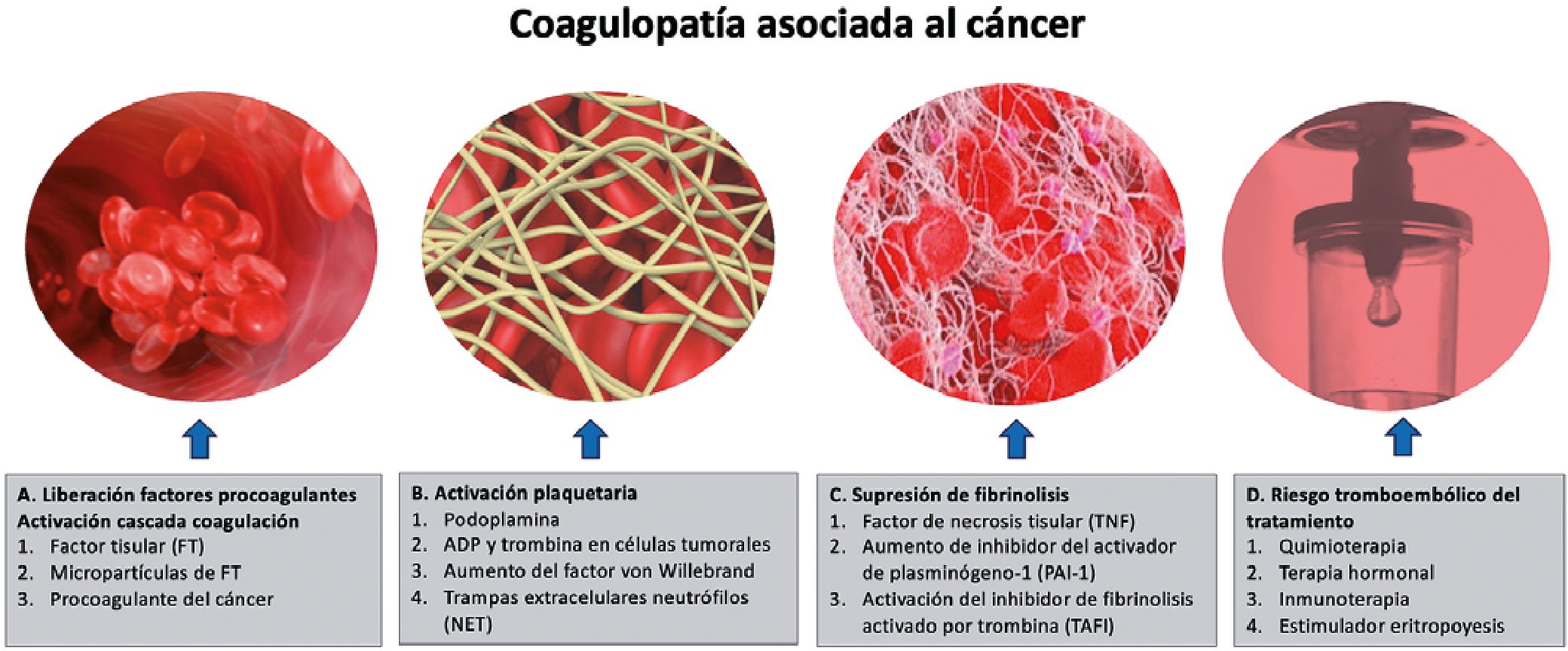
Figura 1. Fisiopatología de la coagulopatía asociada al cáncer.
Las técnicas de reconstrucción son variadas, pero cada vez se opta por estrategias que otorguen un resultado funcional y estético superior. Una de estas técnicas de reconstrucción son colgajos microquirúrgicos, los cuales poseen un desafío técnico y requieren equipos especializados. En esta intervención se describe como complicación infrecuente pero devastadora la trombosis del colgajo. Las pruebas viscoelásticas se han propuesto como una herramienta más para predecir el riesgo de esta complicación y así ajustar la terapia preventiva de trombosis. Existen varias series de casos que han mostrado la capacidad predictiva de las pruebas viscoelásticas de trombosis del colgajo. Sin embargo, aún faltan estudios con mayor número de pacientes, dada la baja incidencia de esta complicación, que actualmente están en torno al 5%[18],[19].
-
Manejo de hemo componentes y factores hemostáticos en el perioperatorio
El sangrado perioperatorio y sus consecuencias sobre la hemostasia es una causa importante de morbimortalidad asociado a cirugía mayor. Parte de los sangrados excesivos se deben a trastornos de la hemostasia basales de los pacientes, o bien que se desarrollan en el intraoperatorio por coagulopatía dilucional a causa del uso desbalanceado de cristaloides y hemoderivados durante la reanimación ante sangrados de gran cuantía.
Para evaluar la capacidad hemostática de los pacientes previo a la cirugía tradicionalmente se han realizado pruebas de coagulación convencionales como el tiempo de protrombina (TP) y el tiempo de tromboplastina parcial activado (TTPA), además del conteo de plaquetas. Sin embargo, estas pruebas no han sido validadas para este objetivo en entornos perioperatorios, observándose en la literatura una falta de evidencia que respalde su uso[20]. Tampoco son recomendadas de manera universal para el tamizaje preoperatorio de trastornos de la coagulación[21] y, si bien se han publicado estudios realizados con grandes bases de datos que concluyen cierta utilidad para predecir la necesidad de transfusiones en el perioperatorio[22], su desempeño para predecir el sangrado perioperatorio es pobre[23].
Lo anterior es aún más relevante en el ambiente preoperatorio de pacientes oncológicos que, como se mencionó previamente, suelen tener un estado procoagulante, pueden tener test de coagulación convencionales alterados que pueden interpretarse erróneamente como coagulopáticos y favorecer medidas de prevención o manejo inadecuadas, con sus riesgos y costos innecesarios.
En la práctica clínica actual, es común utilizar pruebas de coagulación convencionales para diagnosticar y manejar la coagulopatía adquirida secundaria a sangrados graves. Sin embargo, es importante evaluar la evidencia detrás de estas pruebas en diversos contextos y considerar la incorporación de pruebas viscoelásticas en la práctica clínica.
Hay estudios que han evaluado la precisión de pruebas de coagulación convencionales para detectar trastornos adquiridos de la hemostasia en el perioperatorio. McCully et al., evaluó la capacidad del INR para detectar coagulopatía y la necesidad de plasma fresco congelado (PFC) en pacientes que se sometieron a cirugía mayor y en víctimas de trauma. Interesantemente, encontró que la corrección de un INR alterado con plasma fresco congelado (PFC) a menudo no mejoraba significativamente la concentración de factores de coagulación ni los parámetros de la tromboelastografía (TEG), que seguían dentro de los rangos de normalidad antes y después de la administración de PFC[24].
En cirugía hepática, un estudio realizado por Louis et al., en 78 pacientes sometidos a hepatectomía mayor por causa oncológica, observó que después de la cirugía los pacientes tenían niveles bajos de factores de coagulación procoagulantes y aumento del INR. Sin embargo, al mismo tiempo, tenían niveles plasmáticos reducidos de factores anticoagulantes. En cambio, el análisis de tromboelastografía (TEG) mostró que los pacientes estaban en un estado hipercoagulable[25].
Los resultados destacan las limitaciones de las pruebas de coagulación convencionales para detectar estados de hipo e hipercoagulabilidad, ya que estas pruebas evalúan la actividad de factores de coagulación de manera aislada, sin considerar su interacción con los demás componentes de la hemostasia. Las pruebas viscoelásticas si son capaces de detectar esta compleja relación entre factores procoagulantes, anticoagulantes y otros factores difíciles de medir, como los efectos del estado inflamatorio quirúrgico o las moléculas procoagulantes en pacientes con cáncer. En resumen, las pruebas viscoelásticas ofrecen una evaluación más completa y precisa de la coagulación en situaciones clínicas complejas.
-
Conclusiones
Los pacientes oncológicos experimentan cambios en su sistema de coagulación debido a la enfermedad, lo que hace esencial comprender su estado hemostático para planificar tratamientos y correcciones durante el perioperatorio. Las pruebas de coagulación estándar ofrecen una visión limitada en estos casos.
Si bien es importante identificar a los pacientes oncológicos con mayor riesgo de enfermedad trombótica, las pruebas viscoelásticas pueden tener un impacto aún más significativo en su manejo perioperatorio, similar a lo que se ha demostrado en cirugía cardíaca, trauma y hemorragia posparto. Esto incluye la posibilidad de reducir la necesidad de transfusiones de productos sanguíneos y posiblemente influir en la mortalidad. Es posible que el uso de pruebas viscoelásticas para guiar la terapia transfusional durante las cirugías oncológicas permita reducir el uso de hemocomponentes. Dado que aún la evidencia de alta calidad es limitada, se necesitan más estudios antes de generar recomendaciones más específicas.
-
Referencias
1. Hartert H. Blutgerinnungsstudien mit der Thrombelastographie; einem neuen Untersuchungs verfahren. Klin Wochenschr. 1948 Oct;26(37-38):577–83. https://doi.org/10.1007/BF01697545
2. Wikkelsø A, Wetterslev J, Møller AM, Afshari A. Thromboelastography (TEG) or thromboelastometry (ROTEM) to monitor haemostatic treatment versus usual care in adults or children with bleeding. Cochrane Database of Systematic Reviews [Internet]. 2016 Aug 22;2018(12). Available from: http://dx.doi.org/10.1002/14651858.cd007871.pub3
3. McNamara H, Kenyon C, Smith R, Mallaiah S, Barclay P. Four years’ experience of a ROTEM®‐guided algorithm for treatment of coagulopathy in obstetric haemorrhage. Anaesthesia [Internet]. 2019 Apr 5;74(8):984–91. Available from: http://dx.doi.org/10.1111/anae.14628
4. Dias JD, Sauaia A, Achneck HE, Hartmann J, Moore EE. Thromboelastography‐guided therapy improves patient blood management and certain clinical outcomes in elective cardiac and liver surgery and emergency resuscitation: A systematic review and analysis. Journal of Thrombosis and Haemostasis [Internet]. 2019 Jun;17(6):984–94. Available from: http://dx.doi.org/10.1111/jth.14447
5. Johansson PI. Goal-directed hemostatic resuscitation for massively bleeding patients: The Copenhagen concept. Transfusion and Apheresis Science [Internet]. 2010 Dec;43(3):401–5. Available from: http://dx.doi.org/10.1016/j.transci.2010.09.002
6. Gonzalez E, Moore EE, Moore HB, Chapman MP, Chin TL, Ghasabyan A, et al. Goal-directed Hemostatic Resuscitation of Trauma-induced Coagulopathy. Annals of Surgery [Internet]. 2016 Jun;263(6):1051–9. Available from: http://dx.doi.org/10.1097/sla.0000000000001608
7. Cochrane C, Chinna S, Um JY, Dias JD, Hartmann J, Bradley J, et al. Site-Of-Care Viscoelastic Assay in Major Trauma Improves Outcomes and Is Cost Neutral Compared with Standard Coagulation Tests. Diagnostics [Internet]. 2020 Jul 17;10(7):486. Available from: http://dx.doi.org/10.3390/diagnostics10070486
8. Noble S, Pasi J. Epidemiology and pathophysiology of cancer-associated thrombosis. British Journal of Cancer [Internet]. 2010 Apr;102(S1):S2–9. Available from: http://dx.doi.org/10.1038/sj.bjc.6605599
9. Zwicker JI, Liebman HA, Neuberg D, Lacroix R, Bauer KA, Furie BC, et al. Tumor-Derived Tissue FactorBearing Microparticles Are Associated With Venous Thromboembolic Events in Malignancy. Clinical Cancer Research [Internet]. 2009 Nov 11;15(22):6830–40. Available from: http://dx.doi.org/10.1158/1078-0432.ccr-09-0371
10. Khorana AA, Ahrendt SA, Ryan CK, Francis CW, Hruban RH, Hu YC, et al. Tissue Factor Expression, Angiogenesis, and Thrombosis in Pancreatic Cancer. Clinical Cancer Research [Internet]. 2007 May 15;13(10):2870–5. Available from: http://dx.doi.org/10.1158/1078-0432.ccr-06-2351
11. Suzuki‐Inoue K, Osada M, Ozaki Y. Physiologic and pathophysiologic roles of interaction between C‐type lectin‐like receptor 2 and podoplanin: partners from in utero to adulthood. Journal of Thrombosis and Haemostasis [Internet]. 2017 Feb;15(2):219–29. Available from: http://dx.doi.org/10.1111/jth.13590
12. Andrén-Sandberg Å, Lecander I, Martinsson G, Åstedt B. Peaks in plasma plasminogen activator inhibitor-1 concentration may explain thrombotic events in cases of pancreatic carcinoma. Cancer [Internet]. 1992 Jun 15;69(12):2884–7. Available from: http://dx.doi.org/10.1002/1097-0142(19920615)69:12<2884::aid-cncr2820691204>3.0.co;2-s
13. Tsantes AG, Loukopoulou I, Papadopoulos DV, Trikoupis IG, Roustemis AG, Goumenos S, et al. The Hypercoagulable Profile of Patients with Bone Tumors: A Pilot Observational Study Using Rotational Thromboelastometry. Cancers [Internet]. 2022 Aug 15;14(16):3930. Available from: http://dx.doi.org/10.3390/cancers14163930
14. Toukh M, Siemens DR, Black A, Robb S, Leveridge M, Graham CH, et al. Thromboelastography Identifies Hypercoagulablilty and Predicts Thromboembolic Complications in Patients with Prostate Cancer. Thrombosis Research [Internet]. 2014 Jan;133(1):88–95. Available from: http://dx.doi.org/10.1016/j.thromres.2013.10.007
15. Davies NA, Harrison NK, Sabra A, Lawrence MJ, Noble S, Davidson SJ, et al. Application of ROTEM to assess hypercoagulability in patients with lung cancer. Thrombosis Research [Internet]. 2015 Jun;135(6):1075–80. Available from: http://dx.doi.org/10.1016/j.thromres.2015.03.021
16. Hincker A, Feit J, Sladen RN, Wagener G. Rotational thromboelastometry predicts thromboembolic complications after major non-cardiac surgery. Critical Care [Internet]. 2014 Oct;18(5). Available from: http://dx.doi.org/10.1186/s13054-014-0549-2
17. Harahsheh Y, Ho KM. Use of viscoelastic tests to predict clinical thromboembolic events: A systematic review and meta‐analysis. European Journal of Haematology [Internet]. 2018 Jan 5;100(2):113–23. Available from: http://dx.doi.org/10.1111/ejh.12992
18. Malapati H, Hanwright PJ, Tuffaha SH. Utility of Viscoelastic Tests to Predict Flap Thrombosis: A Systematic Review. Plastic and Reconstructive Surgery – Global Open [Internet]. 2021 Aug;9(8):e3769. Available from: http://dx.doi.org/10.1097/gox.0000000000003769
19. Thakkar M, Rose A, Bednarz B. Thromboelastography in Microsurgical Reconstruction: A Systematic Review. JPRAS Open [Internet]. 2022 Jun;32:24–33. Available from: http://dx.doi.org/10.1016/j.jpra.2021.12.005
20. Haas T, Fries D, Tanaka KA, Asmis L, Curry NS, Schöchl H. Usefulness of standard plasma coagulation tests in the management of perioperative coagulopathic bleeding: is there any evidence? British Journal of Anaesthesia [Internet]. 2015 Feb;114(2):217–24. Available from: http://dx.doi.org/10.1093/bja/aeu303
21. Practice Parameter. Practice guidelines for perioperative blood management: an updated report by the American Society of Anesthesiologists Task Force on perioperative blood management. American Society of Anesthesiologists. 2015, Anesthesiology, págs. Vol. 122, 241–275
22. Lim K, Satkunasivam R, Nipper C, Xu J, Hsu E, Slawin JR, et al. Association between isolated abnormal coagulation profile on transfusion following major surgery: A NSQIP analysis of individuals without bleeding disorders. Transfusion [Internet]. 2022 Oct 17;62(11):2223–34. Available from: http://dx.doi.org/10.1111/trf.17146
23. Hasan RA, Hess AS, Hess JR. Preoperative coagulation testing and patient blood management. Transfusion [Internet]. 2022 Oct 14;62(11):2155–7. Available from: http://dx.doi.org/10.1111/trf.17149
24. McCully SP, Fabricant LJ, Kunio NR, Groat TL, Watson KM, Differding JA, et al. The International Normalized Ratio overestimates coagulopathy in stable trauma and surgical patients. Journal of Trauma and Acute Care Surgery [Internet]. 2013 Dec;75(6):947–53. Available from: http://dx.doi.org/10.1097/ta.0b013e3182a9676c
25. Louis SG, Barton JS, Riha GM, Orloff SL, Sheppard BC, Pommier RF, et al. The international normalized ratio overestimates coagulopathy in patients after major hepatectomy. The American Journal of Surgery [Internet]. 2014 May;207(5):723–7. Available from: http://dx.doi.org/10.1016/j.amjsurg.2013.12.021

 ORCID
ORCID