Priscilla Ulloa V. MD. 1 , Valeria Epulef MD, MSc 1 ,2,*
Recibido: 07-08-2021
Aceptado: 06-10-2021
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 2 pp. 168-174|https://doi.org/10.25237/revchilanestv5104021443
PDF|ePub|RIS
Perioperative fluids in pediatric patients
Abstract
Fluid therapy is the most widely used medical treatment, with indications and risks that are important to know. Its indication in the pediatric perioperative period has continuously changed with the upward understanding of the physiology of newborns, infants and children, as well as in the knowledge of the composition of the different fluids available for use in this patient’s population. This is evident in the various existing guidelines on this topic. It is important to consider the preoperative fasting of our patient, which must be decreased to the maximum. We must differentiate the two objectives of fluid therapy: maintenance and replacement fluid therapy. The latest recommendations on maintenance fluid therapy indicate preferring the use of balanced solutions, and if not having these, preferring lactate ringer serum by adding glucose for a concentration of 1-2.5%, especially in patients with a higher risk of hypoglycemia. On the other hand, in replacement fluid therapy, it should always be started with crystalloids preferring isotonic balanced solutions of electrolytes. The use of colloids is controversial given the scarce scientific evidence in pediatric patients. Finally, when indicating blood products, the risks associated with transfusion should always be considered, however, we should also consider the threshold of hematocrit and platelets to transfuse if necessary, and calculate the maximum volume of blood loss allowed to be transfused.
Resumen
La fluidoterapia es el tratamiento médico más ampliamente utilizado, con indicaciones y riesgos que es importante conocer. Su indicación en el perioperatorio pediátrico ha cambiado continuamente a medida que se avanza en la comprensión de la fisiología de los recién nacidos, lactantes y niños, como también en el conocimiento de la composición de los diferentes fluidos disponibles para su uso en esta población de pacientes. Esto queda en evidencia en las diversas guías existentes respecto al tema. Es importante considerar el ayuno preoperatorio de nuestro paciente, que debe ser disminuido al máximo. Debemos diferenciar los dos objetivos de la fluidoterapia: fluidoterapia de mantención y de reposición. Las últimas recomendaciones sobre fluidoterapia de mantención indican preferir el uso de soluciones balanceadas, y de no disponer de éstas, preferir suero ringer lactato añadiendo glucosa para una concentración de 1%-2,5%, especialmente en pacientes con mayor riesgo de hipoglicemia. Por otro lado, en la fluidoterapia de reposición, se debe iniciar siempre con cristaloides prefiriendo soluciones balanceadas isotónicas de electrolitos. El uso de coloides es controversial dado la escasa evidencia científica en pacientes pediátricos. Por último, al indicar hemoderivados, siempre se deben considerar los riesgos asociados a transfusión, sin embargo, también debemos considerar el umbral de hematocrito y plaquetas para transfundir en caso necesario, y calcular el volumen de pérdida sanguínea máxima permitida para transfundir.
La fluidoterapia es el tratamiento médico más universalmente practicado en toda especialidad, y, como todo tratamiento médico, es de gran importancia tener claridad respecto a como indicar esta terapia, beneficios, riesgos, y otras consideraciones.
En el contexto perioperatorio, su principal objetivo es mantener una adecuada perfusión tisular y contrarrestar los efectos hemodinámicos de la intervención quirúrgica y anestésica, manteniendo un estado fisiológico apropiado, lo que se logra al reunir los requerimientos por déficits perioperatorios tales como: el ayuno, la hemorragia, las pérdidas gastrointestinales, el tercer espacio, etc[1],[2]. En este sentido, es importante considerar que la composición del agua corporal cambia con la edad. El agua corporal total disminuye a medida que aumenta la edad, principalmente a expensas de una disminución en el líquido extracelular, mientras que el líquido intracelular aumenta a medida que aumenta la edad (Tabla 1)[3],[4].
Por otro lado, existen diversos tipos de fluidos que se pueden utilizar para fluidoterapia, pero el tipo (cristaloides, coloides) y la composición (tonicidad) del fluido a utilizar han sido tema de debate. Se han desarrollado diversas guías por distintas sociedades, sobre fluidoterapia perioperatoria[1]-[3],[5]-[7]. Además, la fluidoterapia se subdivide en terapia de mantención y de reposición, cada una con diferentes objetivos, y que debemos saber diferenciar.
El objetivo de esta revisión es reunir las diferentes recomendaciones existentes a la fecha en relación a fluidoterapia pe- rioperatoria en pediatría, para guiar una adecuada indicación médica, teniendo en cuenta diferentes aspectos al momento de manejar a nuestros pacientes.
El propósito del ayuno es lograr tener un estómago vacío para reducir la incidencia de regurgitación de contenido gástrico y el riesgo de aspiración[8],[9]. Sin embargo, un ayuno muy prolongado se acompaña de efectos adversos tales como: una alta concentración de ácidos grasos libres que aumentan la resistencia a la insulina en el tejido muscular, esto, combinado con el estrés quirúrgico, aumenta la liberación de catecolami- nas, cortisol y glucagón, llevando a hiperglicemia en el postoperatorio, y culminando en complicaciones postoperatorias y mayor estadía hospitalaria[1],[3],[9]. Además, los niños más pequeños tienen una menor reserva de glicógeno hepático y muscular, siendo más sensibles al ayuno[1]. La reducción del ayuno presenta importantes ventajas: disminuye los cuerpos cetónicos, la resistencia a la insulina, optimiza las condiciones hemodinámicas y mejora la experiencia perioperatoria, tanto del paciente, como de sus padres o cuidadores[8].
Tabla 1. Agua Corporal por edad
| Edad | Agua corporal (%) | Agua extracelular (%) | Agua intracelular (%) |
| Feto | 90 | 60 | 25 |
| RN Pretérmino | 80 | 55 | 30 |
| RN Término | 70 | 50 | 35 |
| 6-12 meses | 60 | 30 | 40 |
RN: Recién Nacido. Adaptado de: Marciniak B. Growth and Development. In: A Practice of Anesthesia for Infants and Children. 2018. p. 89-141.
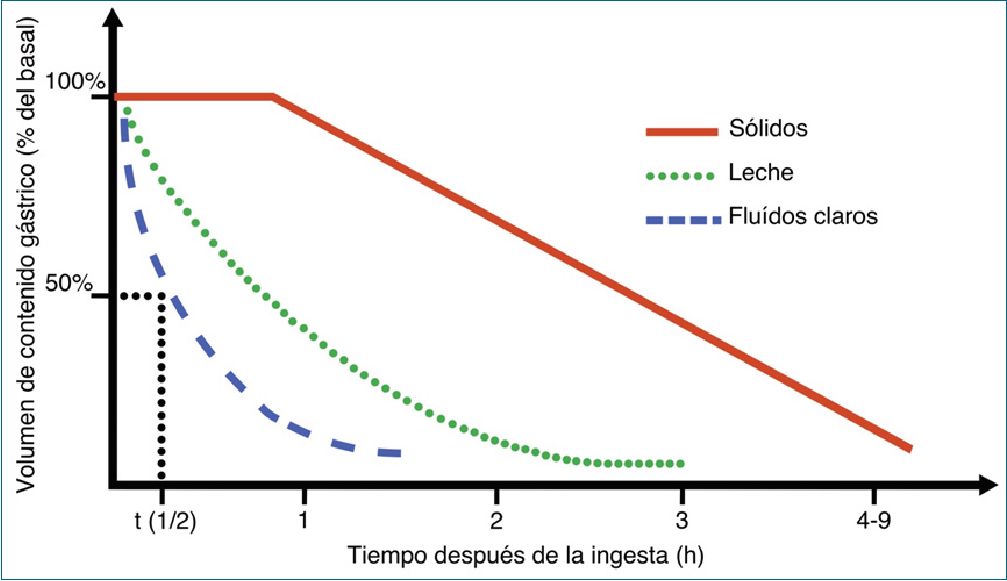
Figura 1. Patrón de vaciamiento gástrico de sólidos y líquidos. Los sólidos (línea roja), tras una fase de retraso, se aclaran en forma lineal, y el tiempo total de vaciado depende de la densidad calórica de la comida. La leche de vaca (línea punteada verde) muestra una fase inicial rápida seguida de un vaciado más o menos lineal. Los líquidos claros (línea discontinua azul) siguen una cinética de primer orden con una vida media de 10-26 min. Adaptado de: Andersson H, Schmitz A, Frykholm P. Preoperative fasting guidelines in pediatric anesthesia: Are we ready for a change? Curr Opin Anaesthesiol. 2018;31(3):342-8.
Las guías más actualizadas se basan en un balance entre el riesgo de aspiración pulmonar y el de un ayuno preoperatorio prolongado. Los diferentes tipos de alimentos difieren en su cinética de eliminación, además, el vaciamiento gástrico se basa en un mecanismo de retroalimentación en relación a la composición de nutrientes y el volumen detectado en el estómago e intestino delgado (Figura 1)[9],[10]. Clásicamente se ha recomendado un ayuno de 6 h para comidas sólidas y leche de fórmula, 4 h para la leche materna, y 2 h para líquidos claros[1],[3],[8]. La declaración de consenso sobre ayuno para líquidos claros para anestesia general pediátrica electiva de la Asociación de Anestesia Pediátrica de Gran Bretaña e Irlanda (APA), de la Sociedad Europea de Anestesia Pediátrica (ESPA) y de la Sociedad Francesa de Anestesia Pediátrica, recomiendan reducir las clásicas 2 h de ayuno preoperatorio para líquidos claros a 1 h, ya que se demostró que esto no altera el pH gástrico ni el volumen residual comparado con 2 h[8],[9],[11]. Por otro lado, las Guías de la Sociedad Alemana de Anestesiología y Medicina Intensiva mencionan que si se mantiene un breve período de ayuno para procedimientos cortos, no es necesario el uso fluidos endovenosos perioperatorios (excepto en recién nacidos)[2].
Existen diferentes tipos de soluciones para fluidoterapia: Cristaloides, coloides y hemoderivados.
Tabla 2. Cristaloides
| Componentes | NaCla | RLb | BSc |
| Cationes (mmol/L) | |||
| Na+ | 154 | 130 | 145 |
| K+ | – | 5 | 4 |
| Ca+2 | – | 1 | 2,5 |
| Mg+2 | – | 1 | 1 |
| Aniones (mmol/L) | |||
| Cl- | 154 | 112 | 127 |
| HCO3- | – | – | – |
| Acetato | – | – | 24 |
| Lactato | – | 27 | – |
| Maleato | – | – | 5 |
| Osmolaridad teórica (mOsmol/L)d | 308 | 276 | 309 |
| Osmolalidad in-vivo (mOsmol/Kg H2O)e | 286 | 256 | 287 |
| Exceso de base potencial (mmol/L) | -24 | +3 | + 10 |
aSalino 0,9%; bRinger Lactato; “Solución de electrolitos balanceada isotónica; dZ (cationes + aniones); eOsmolaridad x coeficiente osmótico 0,926/ contenido de agua 0,997. Adaptado de: Sümpelmann R, Becke K, Zander R, Witt L. Perioperative fluid management in children: can we sum it all up now? Curr Opin. 2019;32(3):384-91.
Son soluciones de agua y electrolitos (Tabla 2). Según su tonicidad se clasifican en isotónicas, hipotónicas e hipertónicas. Isotónicas: Aquellas que tienen una tonicidad similar al plasma. Según su composición electrolítica se dividen en:
• Balanceadas o equilibradas. Como PlasmaLyte® (Baxter In- ternational Inc., Deerfield, IL, EE. UU.), formuladas a pH fisiológico, con patrón electrolítico y tonicidad similar al plasma, contienen acetato como precursor del bicarbonato, este es rápidamente metabolizado por el hígado (comparado con lactato)[1],[3].
• No balanceadas. Dentro de esta se encuentra el Suero Fisiológico 0,9% (SF 0,9%), formado por agua y NaCl. La concentración de cloro aportada es mucho mayor a la plasmática, el bicarbonato cae en respuesta al aumento de cloro, produciendo una acidosis metabólica hiperclorémica, lo cual disminuye la contractilidad muscular y miocárdica llevando a una hipoperfusión de los órganos terminales. Además, la sobrecarga de cloro lleva a una supresión del flujo sanguíneo renal y el sistema renina angiotensina aldos- terona. Todo esto lleva a: falla renal, coagulopatía y disfunción inmune[1],[3]. En cuanto al sodio, también posee una mayor concentración que la plasmática, produciendo hiper- natremia, sobrecarga de fluidos, edema e hipertensión[3].
• Casi isotónicas: Tienen una tonicidad algo inferior al plasma, aunque se considera suficiente para fluidoterapia de mantenimiento y reposición. Su representante es el Suero Ringer Lactato (SRL). Esta solución contiene sodio y cloro en concentraciones más similares al plasma, además de calcio y magnesio. También contiene lactato, un anión estable y que se metaboliza a bicarbonato (que es inestable) una vez infundido, eliminando de esta forma, el riesgo de la acidosis metabólica hiperclorémica que se produce al infundir grandes cantidades de SF 0,9%.
Hipotónicas: Sustancias con tonicidad inferior al plasma. Ya no usadas actualmente, por lo que no se tratarán en esta revisión.
Hipertónicas: Sustancias con tonicidad mayor al plasma. No utilizadas en este contexto por lo que no se abordará el tema.
Son soluciones compuestas por sustancias de alto peso molecular. Su uso en pediatría es controversial por la poca cantidad de estudios al respecto en estos pacientes[3]. Inicialmente, en pediatría era más frecuente el uso de coloides naturales como la albúmina, pero fue progresivamente desplazada por sustancias más económicas y de almacenamiento más fácil como las gelatinas (GES) y el Hydroxyethyl Starch (HES)[3]. Pese a la evidencia de falla renal en pacientes con sepsis secundario al uso de HES, esto no se ha demostrado en estudios en animales pediátricos con dosis moderadas y altas de GES y HES[1],[3]. En cuanto a alteraciones en la hemostasia, éstas se presentan sólo con dosis altas de GES y HES. El uso de HES 130 (peso molecular: 130.000 Dalton) se ha demostrado seguro en niños con función renal normal sometidos a cirugías mayores[12]. En cuanto a las reacciones alérgicas relacionadas con GES, la incidencia pareciera ser menor en niños comparado con adultos, sin embargo, hasta el momento no hay estudios de seguridad con GES en niños disponibles[1].
El requerimiento de transfusión dependerá de factores tales como: edad, cantidad de pérdida sanguínea, y concentración basal de hemoglobina, entre otros. En cuanto a la edad, los recién nacidos y lactantes tienen un mayor volumen sanguíneo por peso (Tabla 3), sin embargo, son menos tolerantes a las pérdidas, en parte por un mayor consumo de oxígeno debido a una tasa metabólica aumentada y por poseer un mayor porcentaje de hemoglobina fetal, lo que implica una menor entrega de oxígeno tisular[3],[4]. Por otro lado, esta población tiene una mayor prevalencia de anemia ferropénica en el preopera- torio[3]. Es por esto que el umbral de transfusión difiere según edad, siendo indicación de transfusión una hemoglobina de 7 g/dL en lactantes y niños, y alrededor de 12 g/dL en recién nacidos (controversial)[13]. Se debe considerar que la transfusión de hemoderivados aumenta el riesgo de morbimortalidad debido al daño pulmonar agudo relacionado a transfusión, sobrecarga circulatoria y reacción hemolítica[3],[13]. Por esto, el principal objetivo en un paciente pediátrico con pérdida sanguínea es mantener una normovolemia, inicialmente reponiendo las pérdidas con cristaloides o coloides en una razón de 2:1, y siempre considerando el umbral de transfusión[3]. Es importante calcular inicialmente el volumen máximo permitido de pérdida sanguínea (Volumen máximo permitido = Volumen sanguíneo estimado x [hematocrito inicial – hematocrito mínimo acepta- ble]/ hematocrito inicial), para poder reponer adecuadamente las pérdidas ante un eventual sangrado intraoperatorio no pre- visto[3].
| Tabla 3. Volumen sanguíneo por edad | |
| Edad | Volumen Sanguíneo (ml/kg) |
| RN de pre-término | 90 |
| RN de término – 3 meses | 80 – 90 |
| > 3 meses | 70 – 80 |
| > 2 años | 70 |
RN: recién nacidos. Adaptado de: Bhardwaj N. Perioperative fluid therapy and intraoperative blood loss in children. Indian J Anaesth. 2019;63(9):729-36.
La elección del tipo de hemoderivado a utilizar dependerá de la situación clínica particular. En la Tabla 4 se muestran las recomendaciones de la cantidad a transfundir según el tipo de hemoderivado[13],[14].
Es la encargada de aportar los requerimientos de fluidos y electrolitos debido a pérdidas fisiológicas anticipadas[3]. Nace en 1930, cuando Hirschfeld, Hyman y Wanger utilizan goteo endovenoso de mantención en pacientes hospitalizados[15]. En 1931 Karelitz y Shick agregan glucosa a las soluciones de mantención para prevenir la hipoglicemia[15].
Más tarde, en 1957, Holliday y Segar, son los primeros en calcular las necesidades de mantención con fluidoterapia parenteral, basados en el gasto calórico en niños, y en el principio de que los requerimientos de agua están vinculados al gasto energético, instaurando la fórmula 4-2-1 (Figura 2), una de las más usadas en la actualidad[3],[16]. Luego analizaron la composición de la leche humana y de vaca para calcular las necesidades de mantención de electrolitos, concluyendo que la solución ideal sería una solución salina 0,225%-0,45%, lo cual corresponde a una solución hipotónica[16].
Entre 1980-1990, se realizaron diversos estudios en relación a las muertes ocurridas en pacientes que recibían fluidoterapia, muchas debido a encefalopatías hiponatrémicas en el postoperatorio[3],[17]. Actualmente, se recomienda usar soluciones balanceadas con glucosa 1%-2%, para prevenir la hiponatre- mia, hipoglicemia, hiperglicemia, lipólisis, y acidosis hiperclorémica[1],[18].
La incidencia de hiponatremia en el posoperatorio corresponde a 15%-30%, con un peak a las 6-12 h posoperatorias, siendo la causa principal una liberación de ADH que produce retención de agua libre, disminuyendo el sodio sérico[3]. Diversos estímulos en el perioperatorio producen un aumento en la secreción de ADH, siendo el principal, un aumento en la osmolaridad. Estímulos no osmóticos incluyen: hipovolemia, hipotensión, ventilación a presión positiva, hipoxia, estado postoperatorio, dolor, náuseas y vómitos, estrés, narcóticos, entre otros[3].
Es importante considerar que el cerebro pediátrico es más susceptible a los efectos de la hiponatremia. El cerebro de los niños crece hasta los 6 años (tamaño adulto), mientras que el cráneo lo hace hasta los 16 años, por lo que entre los 6-16 años, tienen una menor área para una potencial expansión cerebral. Además, el volumen de líquido cefalorraquídeo intracraneano en niños es menor en relación al contenido en la médula espinal[17],[19].
En cuanto a la necesidad o no de añadir glucosa a la terapia de mantención, sabemos que ésta es esencial para el funcionamiento del sistema nervioso central. Además, la hipoglicemia puede provocar respuestas de estrés contrarreguladoras (con aumento del cortisol, epinefrina, glucagón y hormona del crecimiento), pérdida de la autorregulación vascular cerebral y aumento del flujo sanguíneo cerebral. Además, puede alterar el metabolismo cerebral, la homeostasis iónica y producir un desequilibrio ácido-base[19]. La incidencia reportada de hipoglicemia en el perioperatorio es de 0%-2,5%, usualmente asociada a ayunos de 8-19 h[19]. Por otro lado, la hiperglicemia (muchas veces resultante al añadir glucosa 5%) puede llevar a diuresis osmótica con deshidratación y trastornos electrolíticos. Es por esto que existe controversia respecto al agregar o no glucosa a la terapia de mantención. Por un lado, está claro que para pacientes con riesgo de hipoglicemia como los recién nacidos, niños que reciben hiperalimentación y algunas endocrinopatías, se debe añadir glucosa, pero en el resto de los pacientes queda a criterio del anestesiólogo[19],[20]. En cuanto a la concentración, la literatura reporta que soluciones con glucosa al 1%- 2,5% serían las ideales, dado que han demostrado mantener la normoglicemia disminuyendo los efectos adversos tanto de la hipoglicemia como de la hiperglicemia[19],[20].
| Tabla 4. Transfusión de hemoderivados | |
| Componente
Glóbulos rojos |
Dosis Comentario
5-15 ml/kg Cada 5 ml/kg aumenta 1-1,5 g/dL la hemoglobina Incremento deseado de Hba x 5 x kg Deben ser frescos, irradiados y leucoreducidos |
| Plaquetas | 10-20 ml/kg Tras reemplazo del 100% del volumen sanguíneo del paciente o plaquetas
0,1 U/kg < 50.000/uL |
| Plasma fresco congelado Crioprecipitado | 10-20 ml/kg Tras reemplazo del 50-100% del volumen sanguíneo del paciente
0,1 U/kg Si fibrinógeno < 80-100 mg/dL |
Hb: hemoglobina.
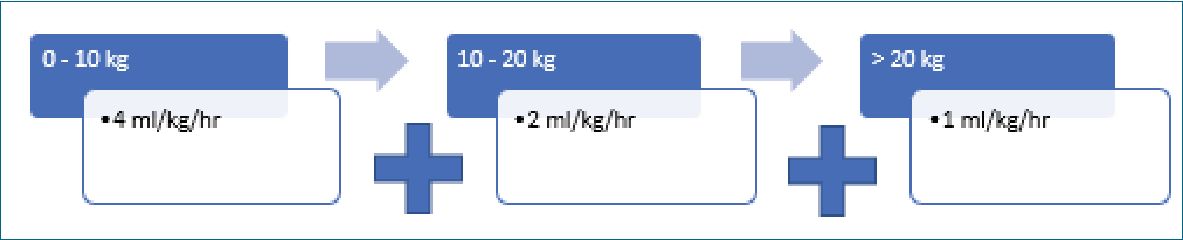
Figura 2. Fórmula de Holliday & Segar.
Ejemplo: Paciente de 25Kg.
(4 ml/h x 10 kg) + (2 ml/h x 10 kg) + (1 ml/h x 5 kg) = 65ml/h.
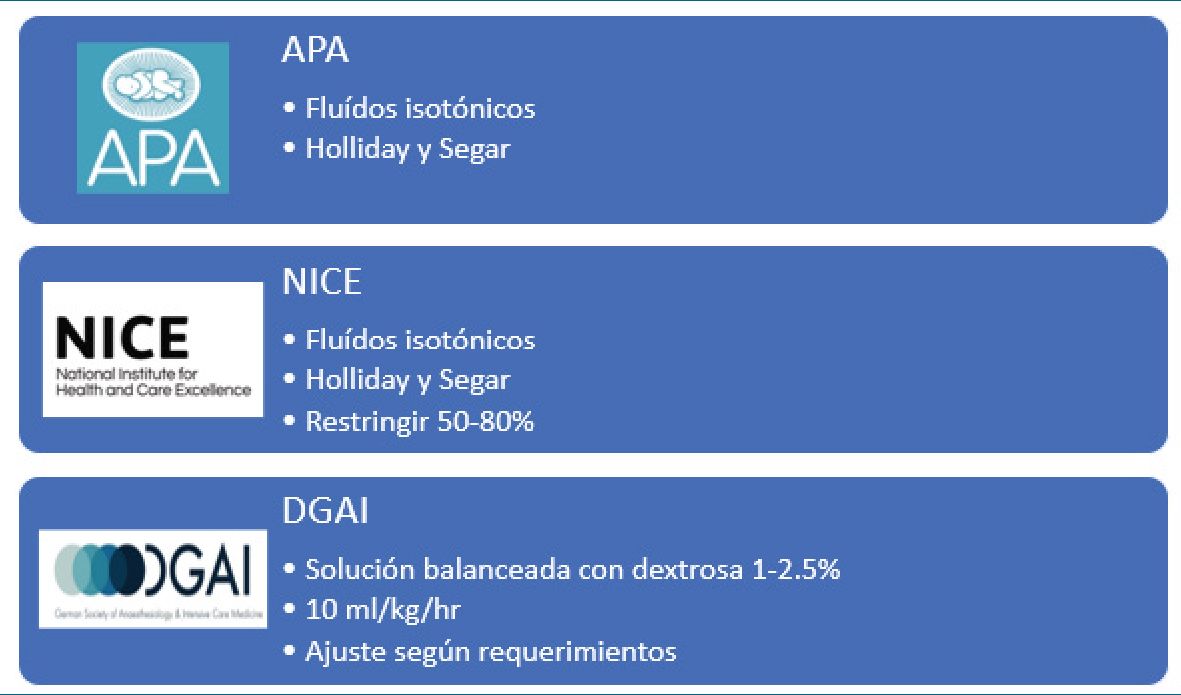
Figura 3. Recomendaciones fluidoterapia de mantención.
• Asociación de Anestesia Pediátrica de Gran Bretaña e Irlanda (APA). Recomienda utilizar fluidos isotónicos y la fórmula de Holliday y Segar para el cálculo de la dosis de manten- ción[5].
• National Institute for Health and Care Excellence (NICE). Recomienda el uso de fluidos isotónicos, utilizar la fórmula de Holliday y Segar para el cálculo de la fluidoterapia de mantención, pero restringir lo calculado en 50%-80%, considerando el riesgo de retención de agua por la secreción no osmótica de ADH[7].
• Sociedad Alemana de Anestesiología y Medicina Intensiva. Recomienda el uso de soluciones balanceadas con dextrosa al 1%-2,5%, a una infusión de 10 ml/kg/hr y ajustar según requerimientos[2].
Una de las causas principales de paro cardíaco relacionado a la anestesia en pediatría es la hipovolemia por pérdida sanguí- nea[21]. Considerando el aumento de la morbimortalidad des
crito en relación a las transfusiones sanguíneas, es importante contar con fluidos para reemplazo de las pérdidas intraoperato- rias, ya sea por hemorragia, tercer espacio, etc[3].
La fluidoterapia de reemplazo fue introducida en 1831 por Thomas Latta, quien realizó infusiones endovenosas de soluciones salinas combinando variadas proporciones de potasio, sodio, bicarbonato y cloro en pacientes con cólera, observando una mejoría en la sobrevida de estos pacientes[15]. En 1882, Sydney Ringer, agregó potasio y calcio a las soluciones de NaCl, para sostener la contractilidad en corazones aislados de ranas, originando la “Solución Ringer” (SR)[1]. Un año después, en 1883, Hartog Hamburger, realizó experimentos con glóbulos rojos en varias concentraciones de sal, y mostró que el suero fisiológico (NaCl 0,9%) era isotónico con el plasma[15]. Más adelante, en 1932, Alexis Hartmann, un pediatra americano, modificó la SR, agregando el anión lactato como precursor de bicarbonato para combatir la acidosis metabólica en niños con diarrea, dando origen al “Suero Ringer Lactato” (SRL)[15]. Actualmente, existen un grupo de soluciones denominadas “Soluciones Electrolíticas Balanceadas” que imitan la composición del fluido extracelular, y contienen acetato como precursor de bicarbonato, este, en comparación al lactato, tiene una meta- bolización significativamente más rápida e independiente de la función hepática, con menos aumento del consumo de oxígeno, y además, no interfiere con el uso de lactato como marcador de baja perfusión[1].
En cuanto al uso de coloides para reponer pérdidas, la calidad de la evidencia existente sobre su uso en pediatría es baja, ya que la mayoría de los estudios se han realizado en adul- tos[1]-[3],[5],[6],[12].
• Asociación de Anestesia Pediátrica de Gran Bretaña e Irlanda terapia (APA). Recomienda reponer las pérdidas in- traoperatorias con soluciones isotónicas, coloides o sangre
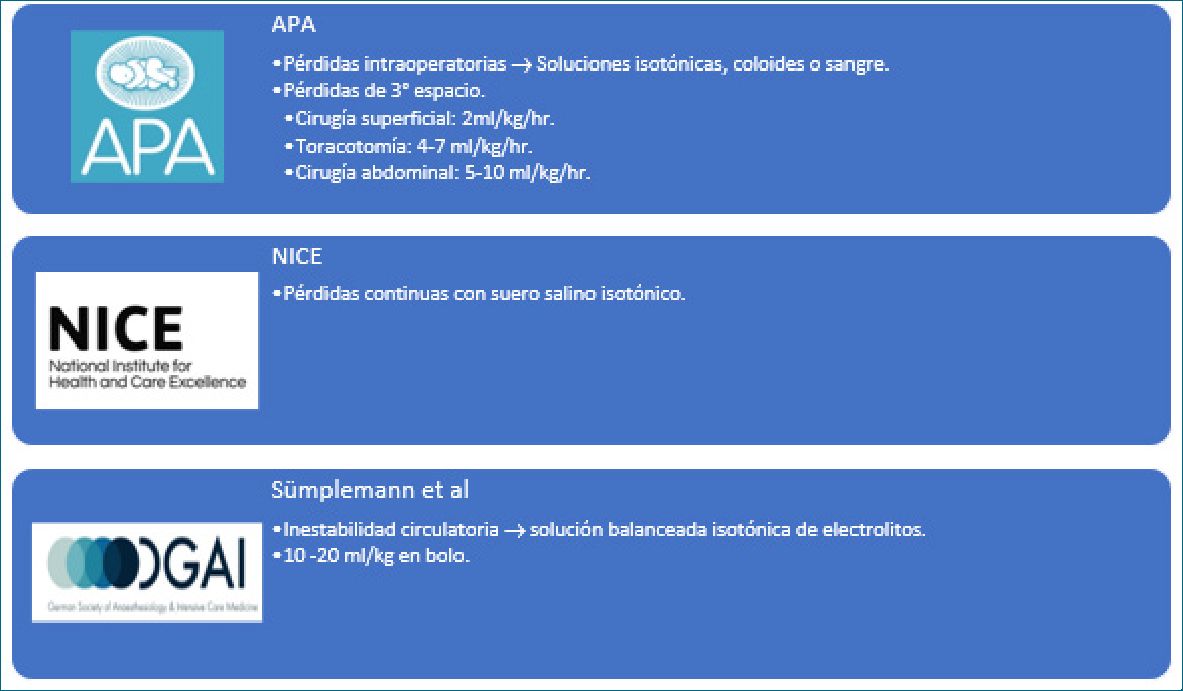
Figura 4. Recomendaciones fluidoterapia de reemplazo.
(según el hematocrito del paciente). Además, considerar y reponer las pérdidas de tercer espacio según cirugía: en cirugía superficial 2 ml/kg/h, en toracotomía 4-7 ml/kg/h y en cirugía abdominal 5-10 ml/kg/h[5].
• National Institute for Health and Care Excellence (NICE). Recomiendan reponer las pérdidas continuas con suero salino isotónico (SF 0,9%). No recomiendan tasas de infusión para reponer pérdidas del tercer espacio, debido a que es difícil de cuantificar[7].
• Sümplemann et al. Recomienda reponer las pérdidas con soluciones balanceadas isotónicas de electrolitos, y ante una inestabilidad circulatoria administrar bolos de 10-20 ml/kg1.
-
Fluidoterapia en el posoperatorio
Se debe favorecer el reinicio temprano de fluidos vía oral, lo que debe ser tan pronto como lo requiera el paciente. Mientras, se debe continuar con terapia de mantención utilizando de preferencia soluciones balanceadas, hasta el reinicio de la alimentación enteral[1],[22].
Para administrar esta terapia en pacientes pediátricos, existen además recomendaciones prácticas relacionadas con los dispositivos de infusión. En cuanto a los recipientes, deben evitarse los contenedores rígidos para prevenir la embolia aérea (preferir uso de bolsas). Además, se recomienda retirar de la bolsa el exceso de fluido que se va a utilizar, para prevenir la sobredosificación. También se recomienda el uso de bombas de infusión para lograr un aporte preciso de lo requerido por cada paciente, y, del mismo modo, en caso de neonatos y niños pequeños deben utilizarse bombas de jeringa de 20 o 50 ml. En caso de niños mayores pueden utilizarse bolsas de 250 ml para procedimientos cortos[2].
La fluidoterapia durante el perioperatorio ha ido evolu
cionando a lo largo de la historia gracias al avance en el conocimiento de la fisiología del crecimiento y desarrollo de los pacientes pediátricos, y a la evidencia más reciente sobre el beneficio de un ayuno reducido. El manejo perioperatorio de fluidos en el paciente pediátrico debe basarse en su fisiología y enfocarse en mantener la homeostasis.
La terapia de fluidos debe revisarse continuamente durante el acto quirúrgico anestésico, dado que los requerimientos cambian constantemente según el contexto clínico, particularmente en el paciente quirúrgico y en los pacientes críticamente enfermos.
En el preoperatorio y postoperatorio, la recomendación es optimizar el tiempo de ayuno y así disminuir el grado de des- hidratación de los pacientes, estado catabólico y disconfort. Se recomienda el consumo de líquidos claros hasta una hora previo anestesia. Y tras la anestesia, se debe favorecer el reinicio precoz del consumo de líquidos vía oral en el momento que el paciente lo requiera.
La fluidoterapia contempla: la terapia de mantención y la terapia de reposición. Basándonos en las recomendaciones actuales, para la terapia de mantención se debe utilizar una solución balanceada isotónica de electrolitos con glucosa 1%- 2,5% a 10 ml/kg/h. En cuanto a la terapia de reposición, en caso de pérdidas perioperatorias con repercusión hemodiná- mica, o alteraciones hemodinámicas por efecto de fármacos anestésicos en un paciente con ayuno prolongado, se debe reponer fluidos en bolos de 10-20 ml/kg de una solución cristaloide de electrolitos balanceada (sin glucosa) en primera instancia. En caso de ser refractario a cristaloides, puede utilizarse coloides, recordando los efectos adversos y la poca cantidad de estudios en pacientes pediátricos, en una cantidad de 5-10 ml/kg. Además, especialmente en el paciente pediátrico, es importante estar atento a las pérdidas sanguíneas y calcular desde el inicio el volumen máximo permitido de pérdida sanguínea previo transfusión, así como considerar continuamente el umbral mínimo para indicar transfusión de hemoderivados en nuestros pacientes.
Finalmente, la fluidoterapia debe individualizarse según cada paciente, comorbilidades, su estado preoperatorio, tipo de cirugía, y cambios durante el intraoperatorio. Se recomienda el uso de bombas de infusión para lograr un aporte preciso de lo requerido por cada paciente.
Fuente de financiamiento: Ninguna.
Declaramos no tener conflicto de interés.
Referencias
1. Sümpelmann R, Becke K, Zander R, y cols. Perioperative fluid management in children : can we sum it all up now? Curr Opin. 2019;32:384–91.
2. Sümpelmann R, Becke K, Brenner S, Breschan C, Eich C, Höhne C, et al. Perioperative intravenous fluid therapy in children: guidelines from the Association of the Scientific Medical Societies in Germany. Paediatr Anaesth. 2017 Jan;27(1):10–8. https://doi.org/10.1111/pan.13007 PMID:27747968
3. Bhardwaj N. Perioperative fluid therapy and intraoperative blood loss in children. Indian J Anaesth. 2019 Sep;63(9):729–36. https://doi.org/10.4103/ija.IJA_493_19 PMID:31571686
4. Marciniak B. Growth and Development. In: A Practice of Anesthesia for Infants and Children., 2018:89–141.
5. APA. APA Consensus Guideline on Perioperative Fluid Management in Children. 2007;2007:1–37.
6. Sümpelmann R, Becke K, Crean P, Jöhr M, Lönnqvist PA, Strauss JM, et al.; German Scientific Working Group for Paediatric Anaesthesia. European consensus statement for intraoperative fluid therapy in children. Eur J Anaesthesiol. 2011 Sep;28(9):637–9. https://doi.org/10.1097/EJA.0b013e3283446bb8 PMID:21654319
7. Instituto Nacional para la Excelencia en la Salud y la Atención (NICE). Intravenous fluid therapy in children and young people in hospital NICE. United Kingdom, 2015:5–35. Available at: https://www.nice.org.uk/guidance/ng29?platform=hootsuite
8. Schmidt AR, Buehler P, Seglias L, Stark T, Brotschi B, Renner T, et al. Gastric pH and residual volume after 1 and 2 h fasting time for clear fluids in children. Br J Anaesth. 2015 Mar;114(3):477–82. https://doi.org/10.1093/bja/aeu399 PMID:25501720
9. Andersson H, Schmitz A, Frykholm P. Preoperative fasting guidelines in pediatric anesthesia: are we ready for a change? Curr Opin Anaesthesiol. 2018 Jun;31(3):342–8. https://doi.org/10.1097/ACO.0000000000000582 PMID:29443724
10. Hellström PM, Grybäck P, Jacobsson H. The physiology of gastric emptying. Baillieres Best Pract Res Clin Anaesthesiol. 2006 Sep;20(3):397–407. https://doi.org/10.1016/j.bpa.2006.02.002 PMID:17080692
11. Thomas M, Morrison C, Newton R, Schindler E. Consensus statement on clear fluids fasting for elective pediatric general anesthesia. Paediatr Anaesth. 2018 May;28(5):411–4. https://doi.org/10.1111/pan.13370 PMID:29700894
12. Sümpelmann R, Kretz FJ, Luntzer R, de Leeuw TG, Mixa V, Gäbler R, et al. Hydroxyethyl starch 130/0.42/6:1 for perioperative plasma volume replacement in 1130 children: results of an European prospective multicenter observational postauthorization safety study (PASS). Paediatr Anaesth. 2012 Apr;22(4):371–8. https://doi.org/10.1111/j.1460-9592.2011.03776.x PMID:22211931
13. Rouette J, Trottier H, Ducruet T, Beaunoyer M, Lacroix J, Tucci M; Canadian Critical Care Trials Group; PALISI Network. Red blood cell transfusion threshold in postsurgical pediatric intensive care patients: a randomized clinical trial. Ann Surg. 2010 Mar;251(3):421–7. https://doi.org/10.1097/SLA.0b013e3181c5dc2e PMID:20118780
14. Lacroix J, Hébert PC, Hutchison JS, Hume HA, Tucci M, Ducruet T, et al.; TRIPICU Investigators; Canadian Critical Care Trials Group; Pediatric Acute Lung Injury and Sepsis Investigators Network. Transfusion strategies for patients in pediatric intensive care units. N Engl J Med. 2007 Apr;356(16):1609–19. https://doi.org/10.1056/NEJMoa066240 PMID:17442904
15. Awad S, Allison SP, Lobo DN. The history of 0.9% saline. Clin Nutr. 2008 Apr;27(2):179–88. https://doi.org/10.1016/j.clnu.2008.01.008 PMID:18313809
16. Holliday MA, Segar WE. The maintenance need for water in parenteral fluid therapy. Pediatrics. 1957 May;19(5):823–32. https://doi.org/10.1542/peds.19.5.823 PMID:13431307
17. Arieff AI. Postoperative hyponatraemic encephalopathy following elective surgery in children. Paediatr Anaesth. 1998;8(1):1–4. https://doi.org/10.1046/j.1460-9592.1998.00730.x PMID:9483590
18. Abdessalam S. Hypotonic versus isotonic maintenance fluid administration in the pediatric surgical patient. Semin Pediatr Surg. 2019 Feb;28(1):43–6. https://doi.org/10.1053/j.sempedsurg.2019.01.007 PMID:30824133
19. Berleur MP, Dahan A, Murat I, Hazebroucq G. Perioperative infusions in paediatric patients: rationale for using Ringer-lactate solution with low dextrose concentration. J Clin Pharm Ther. 2003 Feb;28(1):31–40. https://doi.org/10.1046/j.1365-2710.2003.00456.x PMID:12605616
20. Nishina K, Mikawa K, Maekawa N, Asano M, Obara H. Effects of exogenous intravenous glucose on plasma glucose and lipid homeostasis in anesthetized infants. Anesthesiology. 1995 Aug;83(2):258–63. https://doi.org/10.1097/00000542-199508000-00004 PMID:7631946
21. Bhananker SM, Ramamoorthy C, Geiduschek JM, Posner KL, Domino KB, Haberkern CM, et al. Anesthesia-related cardiac arrest in children: update from the Pediatric Perioperative Cardiac Arrest Registry. Anesth Analg. 2007 Aug;105(2):344–50. https://doi.org/10.1213/01.ane.0000268712.00756.dd PMID:17646488
22. Brindle ME, McDiarmid C, Short K, Miller K, MacRobie A, Lam JY, et al. Consensus Guidelines for Perioperative Care in Neonatal Intestinal Surgery: Enhanced Recovery After Surgery (ERAS®) Society Recommendations. World J Surg. 2020 Aug;44(8):2482–92. https://doi.org/10.1007/s00268-020-05530-1 PMID:32385680

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution