Pamela Rojo Sánchez1,*
Recibido: 11-09-2023
Aceptado: 12-09-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 8 pp. 754-761|https://doi.org/10.25237/revchilanestv52n8-10
PDF|ePub|RIS
Cardioncology reality 2023
Abstract
Cardio-oncology is a subspecialty of cardiology with the central objective of preventing, detecting, and treating all cardiovascular diseases in patients with cancer, whether secondary to the action of any oncotherapy (in patients with active cancer or with a history of previous oncological treatment), as well as other less known aspects, including primary or metastatic cardiac tumors and or cardiac amyloidosis.
Resumen
La cardiooncología es una subespecialidad de la cardiología con objetivo central de prevenir, detectar y tratar todas las enfermedades cardiovasculares de los pacientes con cáncer, ya sea secundaria a la acción de cualquier oncoterapia (en pacientes con cáncer activo o con antecedentes de tratamiento oncológico previo), como otros aspectos menos conocidos, incluido tumores cardíacos primarios o metastásicos y amiloidosis cardíaca.
-
Introducción
Si bien la Cardiooncología (CO) es una nueva rama de la cardiología el interés de los médicos por el cuidado de los pacientes oncológicos ha sido un objetivo de larga data. En la antigua Grecia, Hipócrates y sus discípulos describieron el primer caso de cáncer de mama comparándolo con un cangrejo que rodea y destruye el tejido sano (Karkinos). Recién en el siglo XVII por las disecciones y autopsias se conocen los tumores internos. En 1882 el Dr. William Halsted realiza la primera mastectomía radical y la radioterapia (Rtx) se incorpora -como agente terapéutico -siete años después[1]. Teóricamente, el inicio de la quimioterapia se debe al conocimiento de los efectos secundario del gas mostaza durante la primera guerra mundial, usándose luego para control del crecimiento linfático. Posteriormente, los estudios científicos permitieron crear al menos 4 líneas de terapias (A) Agentes alquilantes; (B) Antimetabolitos; (C) Antibióticos; (D) Hormonas y esteroides. A pesar de estos esfuerzo, en 1950, la sobrevida del cáncer,
en base a cirugía y radioterapia, solo era de 20% a 5 años[2]. En los últimos 30 años hay un mejoría de la respuesta a la quimioterapia (Qtx) gracias a la aparición, en 1990 de anticuerpos monoclonales (Herceptin o trastuzumab, rituximab); terapias dirigidas (inhibidores de los factores de crecimiento, inhibidores de la angiogénesis, estimuladores de apoptosis) y, desde el 2000 la inmunoterapia[2] fármacos que han logrado aumentar la sobrevida de cánceres con muy alta letalidad. El esfuerzo actual se basa en estudiar las mutaciones genéticas específicas y nuevas sustancias proteicas que modifiquen diversas vías de señalización intracelular.
El primer caso de efectos cardíacos adversos de las antra- ciclinas se conoció en la década de 1970[3]. Al inicio la complicación más temida era la insuficiencia cardíaca (IC) que condicionaba peor pronóstico y menor sobrevida. Desde esa fecha hemos ido aprendiendo a reconocer numerosos otros aspectos de la cardiotoxicidad y, que el uso de cualquier terapia oncohe- matológica, puede condicionar la probabilidad de presentar cardiotoxicidad.
Tabla 1. incidencia y mortalidad en Chile[5]
| Global | Muertes | Hombres | Muertes | Mujeres | Muertes |
| Tipo cáncer | (%) | Tipo de cáncer | (%) | Tipo de cáncer | (%) |
| 1 Pulmón | 12,6% | Estómago | 15,6% | Mama | 12,5% |
| 2 Estómago | 12,1% | Próstata | 15,1% | Colorrectal | 11,8% |
| 3 Colorrectal | 11,1% | Pulmón | 3,7% | Pulmón | 11,3% |
| 4 Próstata | 8,0% | Colorrectal | 10,4% | Estómago | 8,3% |
| 5 Mama | 5,9% | Hígado | 5,2% | Vesícula | 7,9% |
-
Generalidades
En Chile, según cifras de GLOBOCAN (observatorio global del Cáncer), en el 2020 existieron 53.000 nuevos casos de cáncer con 28.500 muertes anuales, constituyéndose por primera vez en la historia en la primera causa de mortalidad en nuestro país. Para el 2040 se proyecta 78% de aumento de casos nuevos con casi 56.000 fallecimientos anuales[4],[5]. Informes estadísticos definen que los cánceres más frecuentes en la población chilena masculina son próstata, colorrectal y estómago pero los de mayor mortalidad son estómago, próstata y pulmón; en mujeres la mayor incidencia corresponde a mama, colon y vesícula y la mortalidad se relaciona a mama, colon y pulmón (Tabla 1).
La significativa actividad de la comunidad médica en on- cohematología ya sea en prevención, diagnóstico precoz, cirugías más agresiva y optimización de oncoterapia ha condicionado un aumento de la sobrevida de pacientes con cáncer ya sea, por remisión, curación o estabilización, definiendo que el cáncer sea otra patología crónica. En estudios del 2022 en USA, se registran 18.100 millones de largo superviviente de un cáncer, siendo 67% de ellos, mayores de 65 años[6].
-
Definiciones
Los avances en la investigación clínica en oncohematología ha condicionado un franco aumento del arsenal terapéutico contra el cáncer. El trabajo de onco-hematólogos y cardiólogos ha otorgado evidencias de que, tanto el cáncer como la terapia oncológica, pueden originar efectos deletéreos sobre el sistema cardiovascular (CV) y, a su vez, las enfermedades cardiovasculares (ECV), condicionan un estadio pre-oncogéni- co[7]. Además, en la población de largo superviviente, las ECV constituyen la principal causa de mortalidad no relacionada con el cáncer[8] y, hay mayor riesgo de cáncer en pacientes con ECV[9] ya que ambas patologías comparten factores de riesgo y patogénesis.
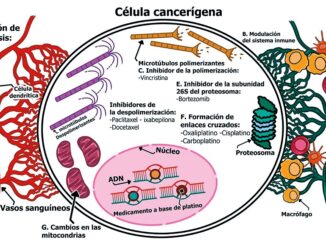
Las primeras guías de cardio oncología de la Sociedad Europea de Cardiología (ESC) en conjunto con European Hematology Association (EHA), European Society for Therapeutic Radiology and Oncology (ESTRO) y la International CardioOncology Society (IC-OS)[10] definen la Cardiotoxicidad (CTx) como ”cualquier evento cardiovascular relacionado con la terapia oncológica” (Figura 1).
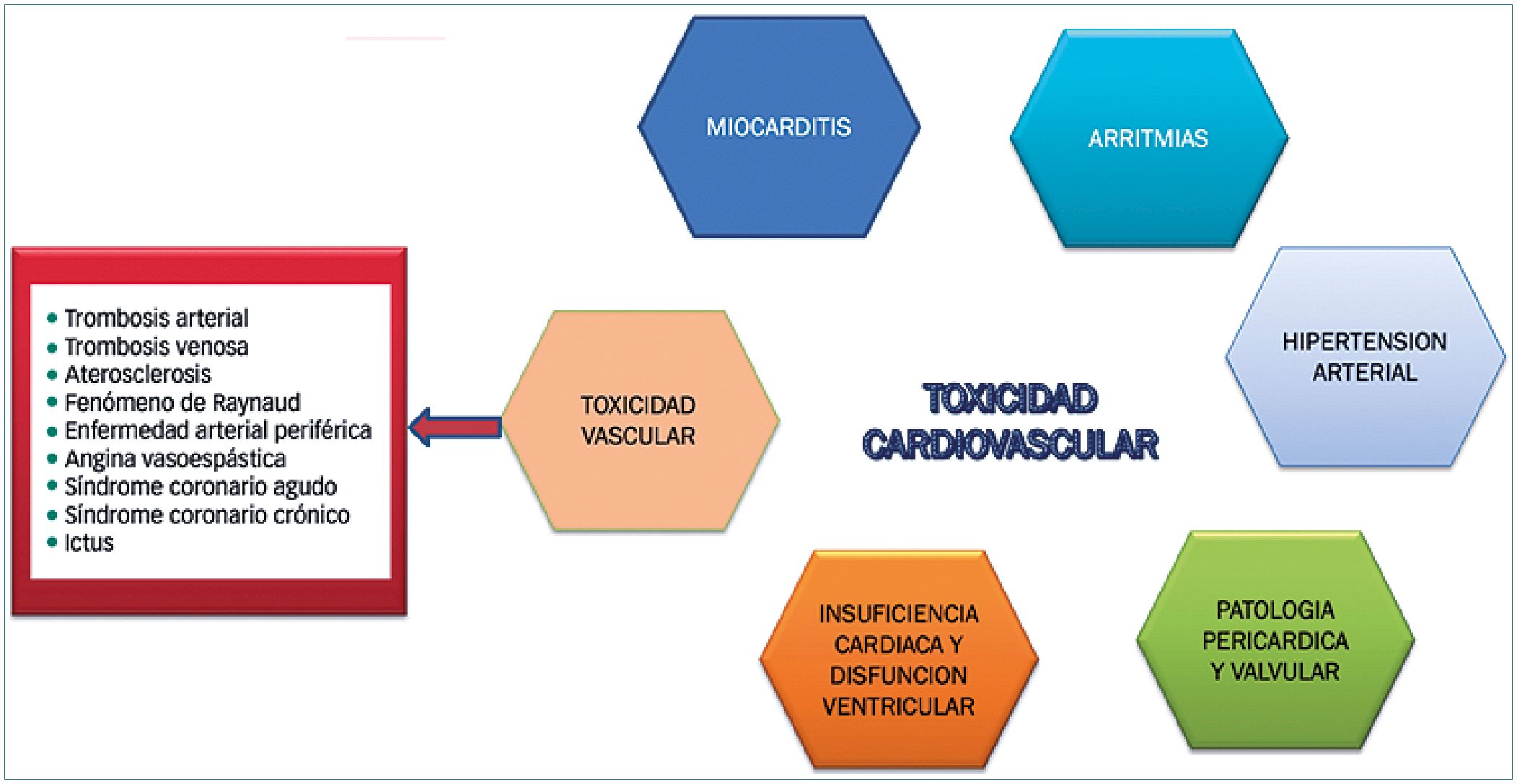
Figura 1. Definición actual de cardiotoxicidad según guías cardiooncología[10].
-
Disfunción miocárdica
Han existido numerosas definiciones para la CTx lo que dificulta las comparaciones y resultados de los distintos registros. Ahora se acepta el termino DC-RTC (disfunción cardíaca relacionada a la terapia del cáncer) y las primeras guías de CO, la definen basándose en la clínica, alteraciones ecocardiográficas (fracción de eyección del ventrículo izquierdo (FEVI), deformación global longitudinal del ventrículo izquierdo (GLS) y biomar- cadores. Según esto, la clasifica en dos grandes grupos dependiendo si tienen o no síntomas. En asintomáticos se consideran los siguientes criterios ecocardiográficos (caída absoluta de > 10% en la FEVI; valores diferenciados de FEVI con corte de 50; 40-49 y menor de 40% y, como marcador temprano de Ctx, ratifica la caída del GLS de > 15% (comparando con valor basal del paciente) al igual que un aumento de los biomarcadores. Si el paciente tiene síntomas se diferenciará de acuerdo con la necesidad de incrementar la terapia de insuficiencia cardíaca ya sea ambulatoria o con hospitalización (Figura 2). Existen numerosos fármacos relacionados con la DC-RTC más allá de la antraciclina y anti HER2. (Trastuzumab o Herceptin) y las asociaciones farmacológicas aumentan este riesgo. Se ha establecido como norma que el antecedente de cualquier terapia oncológica define un estadio A de IC.
-
Miocarditis
Relacionada a terapia con ICI (inmune check point); se debe plantear luego de descartar miocarditis infecciosa o síndrome coronario agudo y se basa en presencia de criterio mayor (resonancia cardíaca según criterios de Lake-Louise) o al menos dos criterios menores: clínica (disnea, fatiga, astenia, mialgias, arritmias, dolor torácico, sincope, shock cardiogénico) arritmias ventriculares (incluido paro cardíaco) o nueva enfermedad del sistema excito conductor como bloqueo de rama izquierda; ecocardiográficos (caída de la FEVI y alteración motilidad segmentaria) más otras alteraciones inmunológicas (miositis, miastenia gravis, miopatía) o resonancia sugestiva. Según intensidad puede ser fulminante con inestabilidad hemodinámica; no fulminante (estable más otra alteración inmunológica) y refractaria a corticoides (aquellas que empeoran o no se resuelven a pesar de terapia con dosis altas de metil prednisolona). Es poco frecuente (1%-3%) pero con alta letalidad (50%).
-
Valvulopatías
Se puede observar cómo complicación a largo plazo de la Rtx torácica e incrementa el riesgo de Ctx, tanto si es de diagnóstico reciente como daño previo. Si el compromiso es severo y requiere una intervención más agresiva, el riesgo de la cirugía dependerá de la fragilidad, comorbilidades y pronóstico de su cáncer. Si hay historia de Rtx torácica previa existirá mayor probabilidad de aorta en porcelana y fibrosis mediastínica lo que favorecerá una intervención percutánea. Siempre se debe considerar el riesgo de endocarditis y tratar según guías vigentes y pronóstico de su proceso oncológico.
-
Enfermedad pericárdica
Relacionada a terapia con ICI (inhibidores del punto de control inmunitario). Pueden ser episodios de pericarditis, derrames leves y derrame pericárdico recurrente, que pueda requerir manejo con cirugía (ventana pericárdica) o uso de fármacos esclerosantes intrapericárdicos. También es una de las complicaciones relacionada con antecedentes previo de Rtx en zona del área cardíaca con clínica de pericarditis constrictiva.
-
Arritmias cardíacas
Destaca la disfunción autonómica caracterizada por taquicardia sinusal inapropiada (subdiagnosticada y confundida con stress). El QT prolongado (valor > 500 ms medido por formula de Fridericia) puede condicionar torsión de puntas y se relaciona con alteraciones electrolíticas, numerosas oncoterapias e interacción farmacológica con antidepresivos, antibióticos y otros. Por otro lado, en oncología existe un incremento de arritmias supraventriculares, en especial de fibrilación auricular (FA) (destaca el ibrutinib) lo que duplica el riesgo de tromboembolia sistémica/accidente cerebro vascular (ACV) y un aumento de hasta 6 veces de IC. La terapia debe seguir el algoritmo de las guías pero dependerá de la terapia oncológica que se use paralelamente (Figura 3).
-
Vascular
Abarca un amplio espectro de compromiso vascular relacionado a múltiples terapias oncológicas: inhibidores de crecimiento vascular, tirosin kinasas, inmunoterapia, ICI, dasatinib, cisplatino, 5 FU, lenalidomida, inhibidores Bcr/Abi y muchos otros (Figura 4).
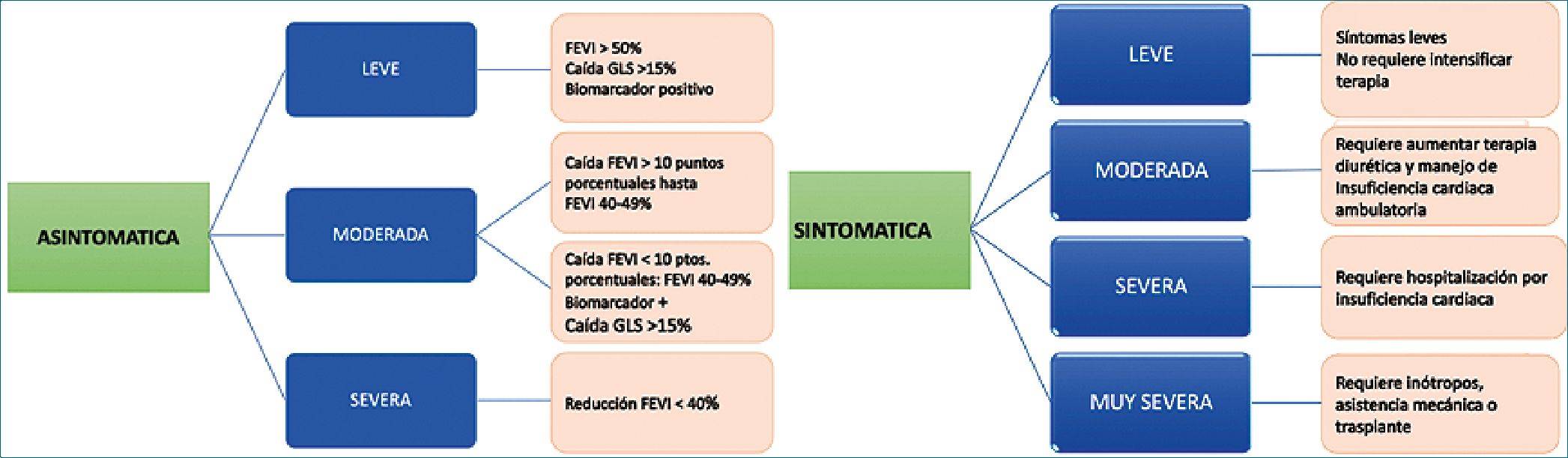
Figura 2. Esquema de clasificación de la DC-RTC: a la izquierda DCRCT asintomática que se divide en 3 condiciones: leve; moderada y severa dependiendo de FEVI, GLS y biomarcadores. A la derecha esquema de clasificación de DCRTC con síntomas que se clasifica en leve, moderada, severa y muy severa dependiendo la necesidad de incrementar terapia de insuficiencia cardíaca (FEVI: función sistólica ventricular izquierda; GLS: deformación global longitudinal promedio)[10].
Se describe patologías como hipertensión arterial, hipertensión pulmonar, fenómenos de Raynaud, trombosis arterial y venosa, compromiso del árbol coronario y neurológico.
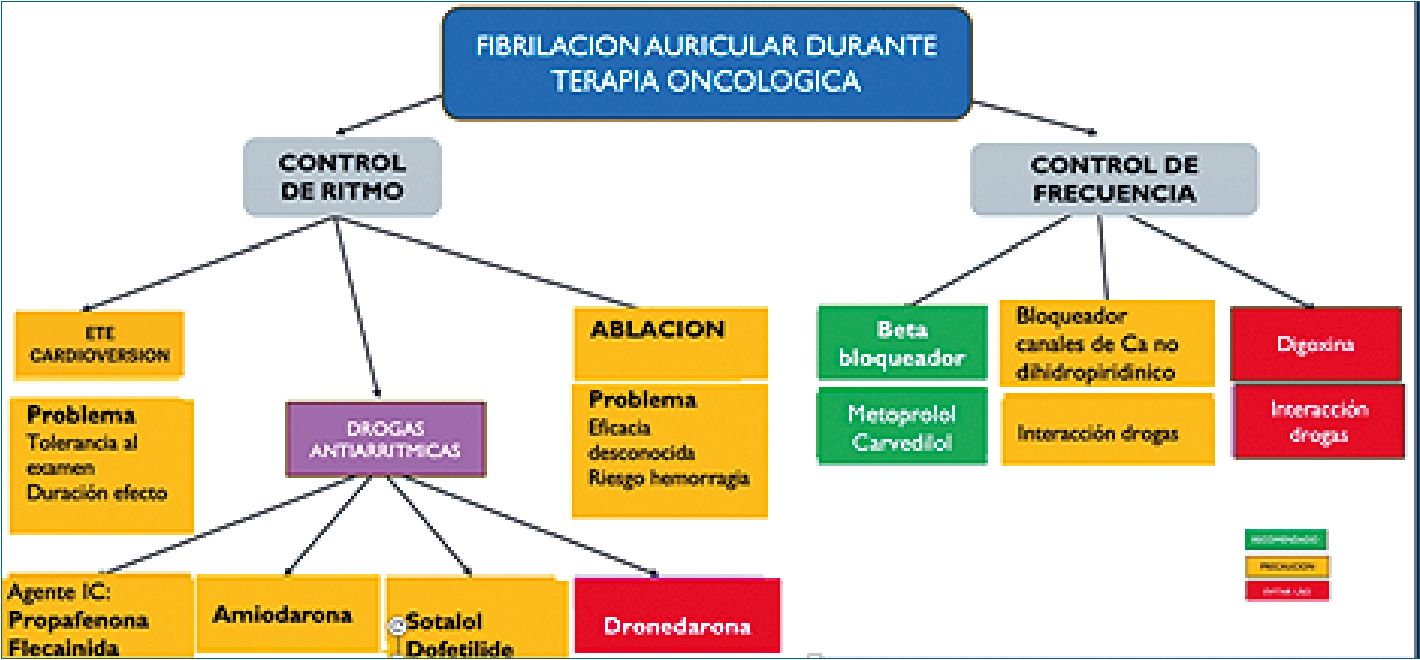
Figura 3. Esquema de manejo de fibrilación auricular en oncología.
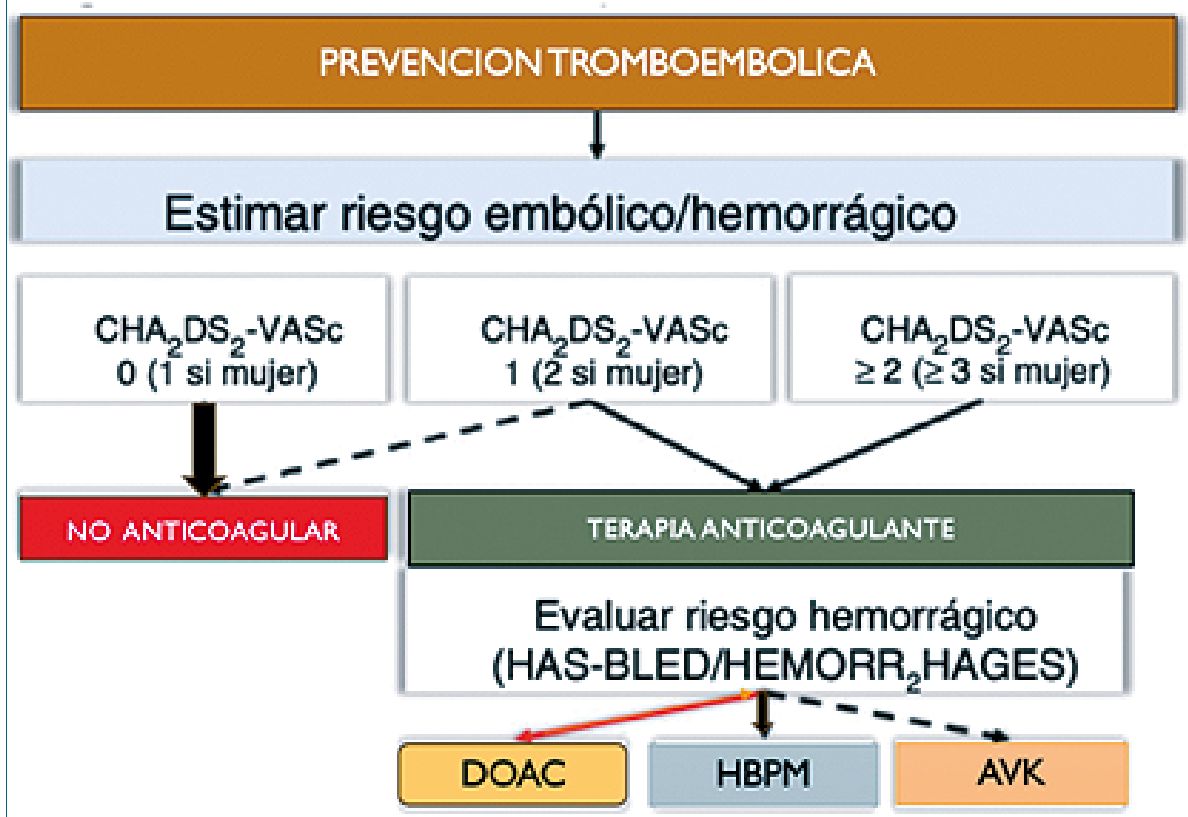
Figura 4. Esquema de manejo en la decisión de anticoagulación en cáncer.
-
Hipertensión arterial
La hipertensión no controlada condicionaría DC-RTC con terapias que usan antraciclinas, ibrutinib o inhibidores del factor de crecimiento endotelial vascular.
Se debe suspender o no iniciar oncoterapia si existe cifras sistólicas > 180 mmHg y diastólica >110 mmHg. El objetivo será controlar la presión arterial hasta lograr niveles menores de 130/80 mmHg (o menor de 140/85 mmHg en > 65 años) con terapia específica.
-
Trombosis
Los pacientes oncológicos tienen un riesgo 5-6 veces mayor de trombosis- por alteración de la triada de Virchow -duplicando el riesgo de mortalidad y hemorragias. Se considera como un marcador de progresión tumoral y está relacionado con: factores del paciente (edad, género, comorbilidades, historia de Trombosis venosa (TV) y alteración previa de la coagulación); factores del cáncer (mayor incidencia en tumor gastrointestinal, genitourinario, páncreas, pulmón, mieloma múltiple; histología: adenocarcinoma; estadio avanzado y mutaciones; factores de la terapia (postración, catéteres centrales, cirugías).
Para prevención primaria, se recomienda profilaxis con heparina de bajo peso molecular (HBPM) en pacientes hospitalizados. En casos ambulatorios con alto riesgo, puede usarse HBPM o DOAC (anticoagulantes directos) si no hay contraindicaciones. Para prevención secundaria, el primer paso (igual que en FA) se debe considerar el riesgo tromboembólico, riesgo hemorrágico, interacciones del tratamiento y preferencias del paciente (Acrónimo TBIP propuesto en las guías de CO[10].
En caso de iniciar anticoagulación se debe evaluar si existe contraindicación para ello, se aconseja HBPM en caso de cáncer gastrointestinal (GI) o genitourinario no operado, comorbilidades (toxicidad GI, insuficiencia renal grave (clearance < 15 ml/ min), interacciones farmacológicas de los DOAC y recuento plaquetario < 50.000/pl. Se indica HBPM a mitad de dosis en caso de recuento plaquetario entre 25.000 y 50.000/pl.
En otras situaciones, se recomienda DOAC teniendo en cuenta la preferencia del paciente y se debe privilegiar DOAC a los antagonistas de la vitamina K (AVK) en FA no valvular.
Los riesgos embólico y hemorrágico de los pacientes con cáncer se pueden evaluar con las escalas CHA2DS2-VASC y HAS-BLED y en oncología debe plantearse el mayor riesgo de trombosis (Figura 4). Si existe un riesgo hemorrágico muy alto (fenómenos activos, hemorragia mayor reciente, lesiones intracraneales en evolución o recuento de plaquetas < 25.000/ pl, debe suspenderse la anticoagulación, aun en presencia de trombosis activa.
-
Cardiopatía coronaria
La población oncológica tienen mayor riesgo de ECV por compartir FRCV, más toxicidad de la oncoterapia, el estado proinflamatorio y protrombótico inducido por el cáncer. La sospecha diagnóstica varia desde cuadros típicos a clínica enmascarada por el mismo cáncer, dolor por metástasis o terapia oncológica. La confirmación diagnostica es similar a la población no oncológica basado en alteración electrocardiográfica o ecocardiográfica y enzimas positivas. El mayor problema es el manejo terapéutico ya que se asocia a mayor riesgo de trombosis/hemorragia, trombocitopenia y la necesidad de uso de antiagregantes plaquetarios. En caso de infarto (IAM) con supradesnivel (en especial si hay inestabilidad hemodinámica, shock o arritmias ventriculares) la evidencia apoya estudio invasivo precoz con angioplastia (PTCA) si la sobrevida del cáncer es mayor a 6 meses. La PTCA no ha demostrado utilidad en caso de cánceres avanzados y con IMA sin supradesnivel donde se puede optar por terapia médica. En caso de trombocitopenia severa se recomienda PTCA con balón (con malos resultados); se debe privilegiar el uso de stent liberadores de fármacos ya que disminuyen el tiempo de la doble antiagregación plaqueta- ria (DAP). Se recomienda que la DAP se mantenga por un corto período (no más de 3 meses) y suspender el clopidogrel si el recuento plaquetario es menor de 30.000 y la aspirina si hay menos de 10.000 plaquetas. En caso de no encontrar lesiones significativas en la coronariografía se recomienda la resonancia cardíaca para estudio de otras causas (Tako-tsubo; miocarditis). Si se sospecha que el fármaco oncológico es causal del IMA se debe suspender y usar esquemas alternativos; si no es possible cambiar la terapia puede reiniciarse luego de full terapia cardiológica (no validado). Si se considera que el fármaco usado no es causal del síndrome coronario se puede reiniciar una vez que el paciente este estable hemodinamicamente.
-
Evaluación del riesgo de cardiotoxicidad
Se conoce que el riesgo de presentar cardiotoxicidad es una variable constante y dinámica que se presenta durante todo el proceso oncológico. La evaluación sigue varias etapas:
*Antes del inicio de la oncoterapia: se consideran los FRCV, ECV previa, historia de cáncer y oncoterapia previa. Es realizada por oncólogo o hematólogo; si hay riesgo bajo solo se indica un electrocardiograma y, en pacientes con alto riesgo, un ecocardiograma o biomarcadores con derivación a cardiólogo para inicio de prevención primaria o secundaria, privilegiando óptimo control de FRCV.
*Durante la oncoterapia: depende del riesgo basal a lo que se agrega la terapia especifica a usar. Las guías aceptan la propuesta de la sociedad europea de IC en cáncer[11], que plantea un enfoque diferencial dependiendo de la droga a utilizar, lo que permite un control y seguimiento particular para cada esquema terapéutico (antraciclina; Anti-Her2, inhibidor VEGF; inhibidor BCR-ABL, terapias contra mieloma; inhibidor RAF-MEK; ICI; terapias CAR-T, trasplante de células hematopoyéticas, radioterapia).
*Posterior a la terapia oncológica o seguimiento del largo superviviente: el control abarca el primer año de finalizada la terapia, momento en que se debe realizar una nueva estratificación del riesgo para el seguimiento del largo superviviente, Se reclasifica en Bajo riesgo donde continúa el monitoreo habitual por oncología fomentando chequeo anual de FRCV. Riesgo moderado control anual de FRCV y chequeo CV cada 5 años o antes si aparecen síntomas. Alto riesgo deben ser derivados a cardiología para iniciar terapia de prevención con control periódico y seguimiento con imágenes cardíacas cada 1-3 años o antes si hay síntomas.
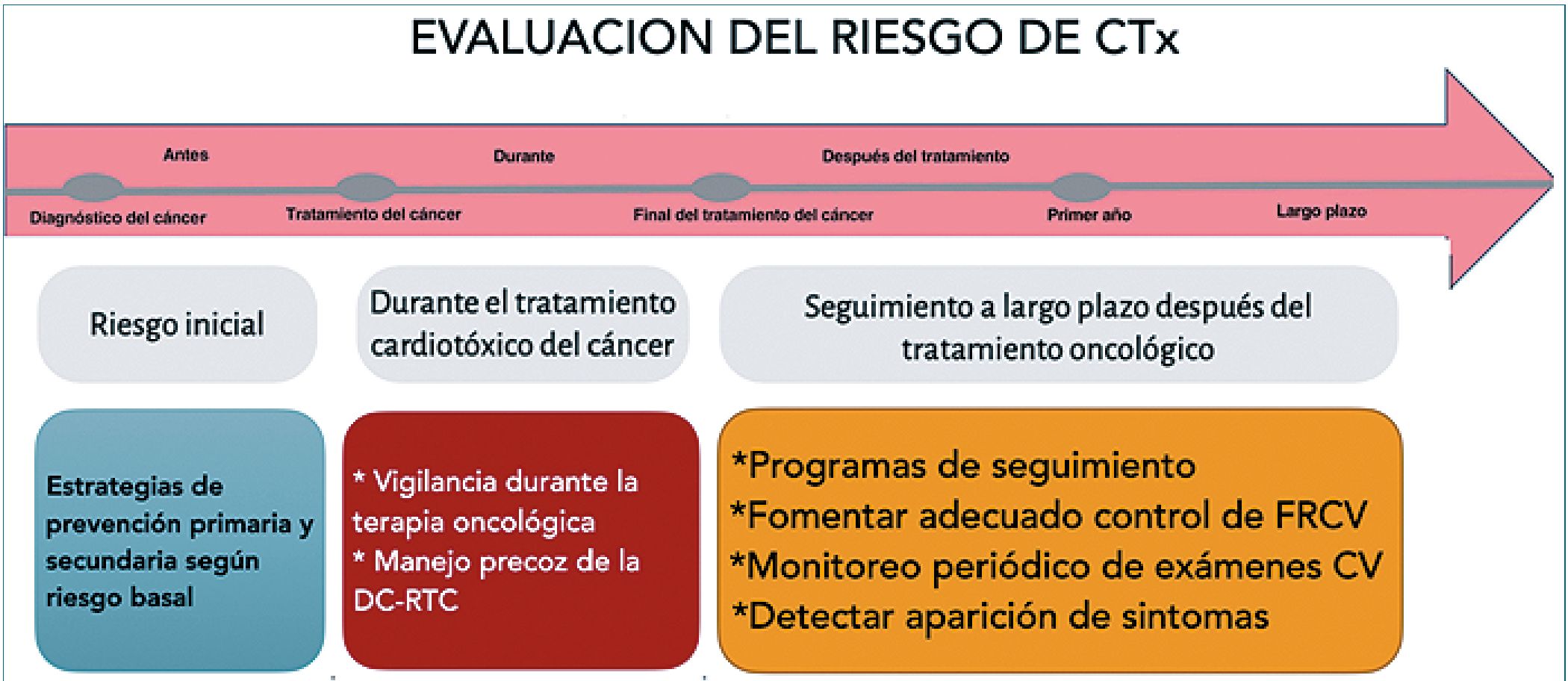
Figura 5. Esquema de la evaluación del riesgo de cardiotoxicidad según guías[10].
-
Cirugía y cáncer
Como ya se ha comentado, los pacientes oncológicos tienen mayor prevalencia de factores de riesgo y enfermedades CV, constituyéndose en un grupo de mayor probabilidad de eventos adversos post cirugía oncológica. Las complicaciones CV perioperatorias están determinadas por FRCV del paciente, tipo de tumor, terapias oncológicas concomitantes y el riesgo quirúrgico esperado. El principal objetivo en estadio preoperatorio es el de optimizar el control de los factores de riesgo y de enfermedades CV previas. Uno de los aspectos a destacar es el uso concomitante o previo de quimioterapia potencialmente cardiotóxica o de radioterapia en el área torácica -que incluye el corazón- lo que puede condicionar un aumento de enfermedades CV a edades más precoces. Otro de los puntos a considerar – en la toma de decisiones – es la evaluación de la funcionalidad; la escala más conocida es la de Karnofsky, siendo considerada un instrumento confiable y validado. En 1960, apareció la escala ECOG (Eastern Cooperative Oncology Group) basada en la capacidad de deambular y necesidad de cuidados por terceros. Ambas escalas pueden usarse aunque se conoce que subvaloran el grado de disfuncionalidad en geriatría por lo que ahí se plantea usar escalas de evaluación geriátrica.
El riesgo quirúrgico en pacientes oncológicos se considera similar a la población general y la evaluación preoperatoria no debe retrasar la cirugía (Figura 5).
Las consultas cardiológicas deben dirigirse solo a 3 grupos: pacientes con ECV previa significativa o sintomática, pacientes con alto riesgo de cardiotoxicidad para un tratamiento oncológico adyuvante post cirugía y pacientes que recibieron terapia oncológica neoadyuvante pre-cirugía potencialmente cardiotóxica. En los 2 primeros grupos los test indicados deben ser guiados por las Guías de la ESC[12] y en el tercer grupo se debe observar si se registraron eventos CV durante el monitoreo de la terapia (Figura 6).
Las guías no recomiendan una escala de riesgo específica para cirugía no cardíaca. La Tabla 2 resume algunas herramientas: calculadora de Riesgo Quirúrgico (GUPTA) predice el riesgo intraoperatorio de IMA o paro cardíaco a los 30 días (bajo riesgo < 1% y alto riesgo > 5%); índice revisado de riesgo cardíaco (RCRI) basada en escala de Lee[13] que incluye antecedentes de factores clínicos y el score NCQIP que incluye 21 variables quirúrgicas); el más utilizado es el score RCRI fácil de aplicar (Figura 6).
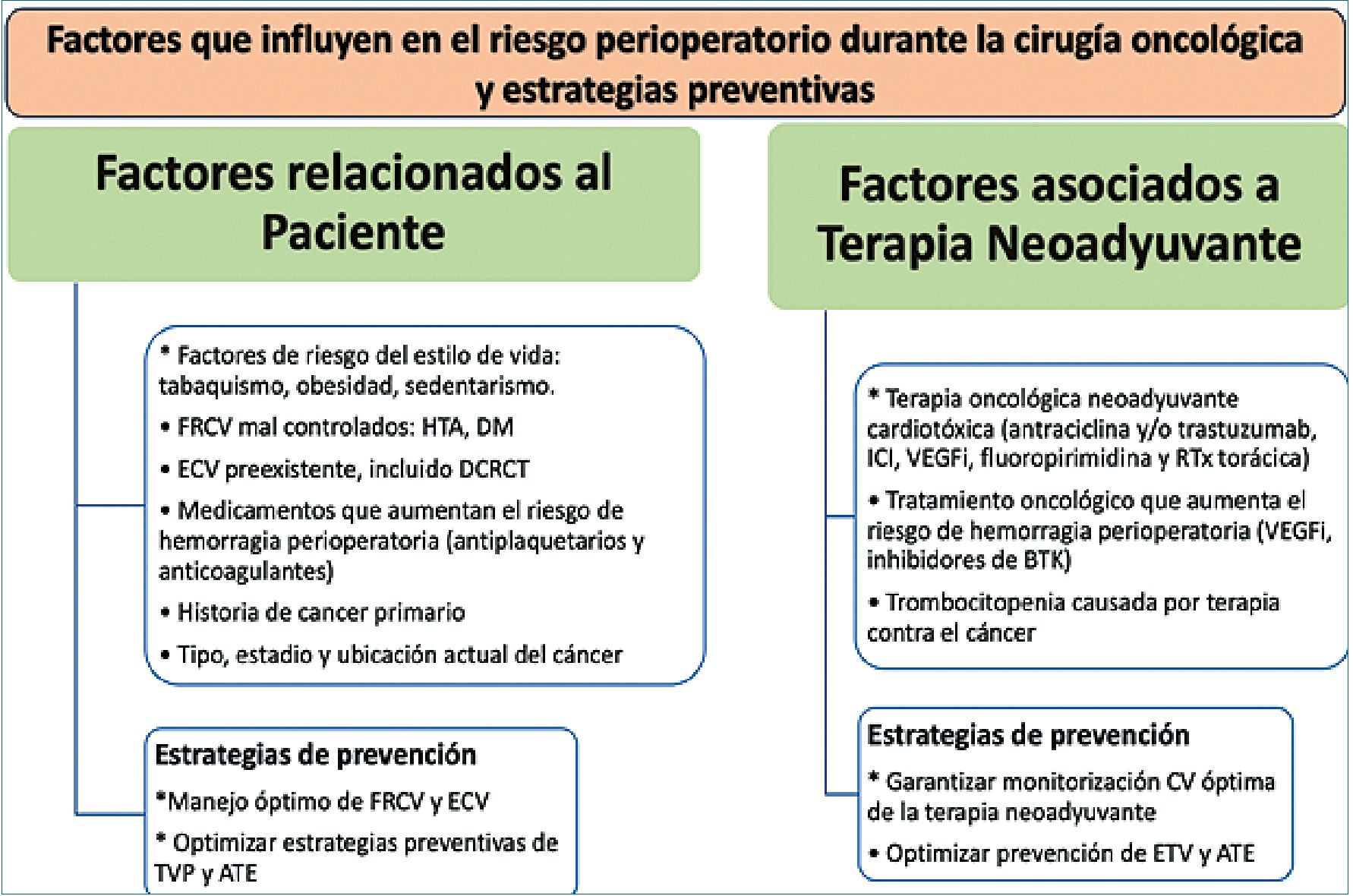
Figura 6. Factores que influyen en la evaluación perioperatoria. Adaptado de las guías CO[10] (FRCV: factores de riesgo cardiovascular; HTA: hipertensión arterial; DM: diabetes mellitus; ECV: enfermedad cardiovascular; DCRCT: disfunción cardíaca relacionada a terapia del cáncer; TVP: trombosis venosa profunda; ATE: ateroesclerosis; ICI: inhibidor de inmuno check point; VEGF: factor inhibidor del receptor de crecimiento vascular; RTx: radioterapia; BTK: tirosin kinasa de Bruton.
-
Cáncer de mama
El enfrentamiento quirúrgico es parte fundamental de la terapia en la mayoría de pacientes con cáncer de mama en estadios precoces. La incidencia de complicaciones post cirugía es baja y no existen diferencias significativas considerando la edad, genero, comorbilidades o índice de masa corporal. Lo más frecuente son infecciones de las heridas y los eventos CV tienen una incidencia menor a 1% por lo que se recomienda solo evaluación CV preoperatoria en aquellos pacientes que presenten muchos factores de riesgo o historia de enfermedades CV previas. El uso de drogas con mayor potencial cardiotóxico como
antraciclinas, antagonistas de Her-2 y tirosin-kinasas son habitualmente utilizadas y por ello se recomienda la evaluación de la función ventricular con eco transtorácico antes de la cirugía solo para optimizar el monitoreo posterior.
| Tabla 2. Resumen de escalas usadas en oncología para evaluación preoperatoria | |||
| RCRI (Lee 1999) | NSQIP MICA/GUPTA (2011) | NSQIP surgical Risk (2013) | |
| Criterios | Cirugía de alto riesgo | Tipo de cirugía | 20 variables |
| Cardiopatía coronaria | Estado de funcionalidad | Basado en tipo de cirugía | |
| Insuficiencia cardíaca | Creatinina > 2 | Variables del paciente | |
| Historia de ACV | Mayor edad | riskcalculator.facs.org/ | |
| Terapia diabética con insulina | ASA (clase American Society Anesthesiologist) | RiskCalculator | |
| Creatinina > 2 mg/dl | |||
-
Pulmón
Es uno de los cánceres con mayor letalidad y morbilidad CV por compartir FRCV (en especial tabaquismo y edad avanzada); casi 70% de pacientes en estadio 1-2 se someterán a terapia quirúrgica. Puede usarse el ThRCRI (Thoracic Revised Cardiac Risk Index basado en cuatro parámetros: planificación de neumonectomía, historia de cardiopatía coronaria (IMA 6 meses previo a cirugía, PTCA previa, angina 1 mes antes, historia previa de ACV o crisis isquémica transitoria (TIA) y creatinina > 2 mg/dL[14]; pacientes con mayor puntaje o condición cardíaca activa (IAM < 1 mes, angina inestable, estenosis aórtica severa, arritmias graves y capacidad funcional < 4 mets (no es capaz de subir 1 piso de escaleras), requieren evaluación cardiológica siempre y cuando permitan cambiar conducta, la revascularización coronaria debe plantearse sólo si hay una indicación distinta a la cirugía oncológica ya que, el uso “profiláctico” de la revascularización, no se ha acompañado con buenos resultados a corto o largo plazo[10]. En general se registran 30%-40% de complicaciones postoperatorias y las más destacadas son: respiratorias, hemorragias, infección herida, quilotórax, daño del laríngeo recurrente y FA en 12% de casos.
-
Cáncer GI
Otro de los cánceres más frecuentes a nivel mundial es el colorrectal y la resección quirúrgica es uno de los puntos básicos en la terapia. Tiene mayor riesgo de IMA perioperatorio por compartir numerosos FRCV (tabaquismo y obesidad). Los riesgos de la cirugía colorrectal son similares a otra cirugía abdominal mayor, sin embargo, los factores de mayor riesgo son la edad avanzada, género masculino, cirugía abdominal previa, obesidad (riesgo 25% mayor en obesidad tipo 1, 45% para grado II y 75% para tipo III), EPOC, TV, diabetes (triplica el riesgo) y ECV (ACV e HTA). La FA es una complicación muy frecuente en posoperatorio de colectomía y resección esofágica, pero no hay evidencia que justifique profilaxis con antiarrítmicos (aunque puede usarse beta bloqueo). La trombosis se considera un factor de progresión tumoral y se observa en posoperatorio de: esofagectomía (7,3%), pancreatectomía (3,4%). La trombo- profilaxis debe iniciarse durante la estancia hospitalaria (hasta 12 h antes de la cirugía) y debe mantenerse hasta la total movilización o alta hospitalaria. En casos de alto riesgo se puede extender terapia con HBPM por 3 a 4 semanas.
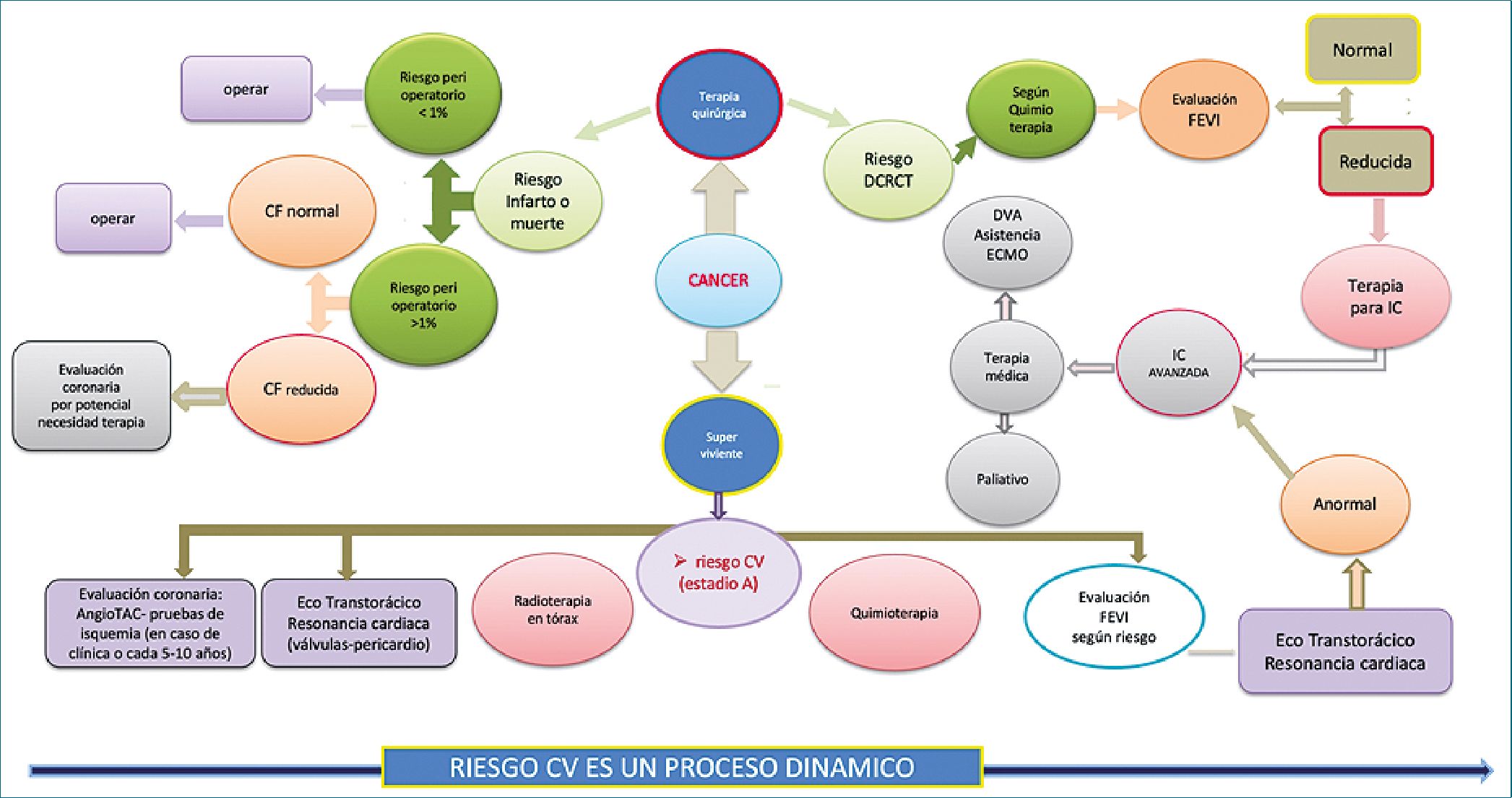
Figura 7. Esquema de evaluación cardiovascular precirugía en paciente con cáncer activo o antecedentes de oncoterapia previa (CV: cardiovascular; CF: capacidad funcional; DCRCT: disfunción cardíaca relacionada a terapia del cáncer; IC: insuficiencia cardíaca: DVA; FEVI: función sistólica del ventrículo izquierdo).
Se presenta un esquema de manejo CV pre y post operatorio en oncología (Figura 7).
-
Ideas para recordar
• La cardiotoxicidad abarca todas las complicaciones cardiovasculares -precoces o a largo plazo- relacionados con la terapia oncológica.
• La evaluación del riesgo de presentar cardiotoxicidad es un proceso continuo y variable que debe plantearse en cualquier momento de vida del paciente con cáncer.
• El cáncer y las enfermedades cardiovasculares comparten factores de riesgo.
• El monitoreo de la cardiotoxicidad dependerá del riesgo basal y del esquema de oncoterapia que se debe usar.
• El antecedente de cualquier terapia oncológica define de inmediato un estadio A de insuficiencia cardíaca.
• La evaluación pre cirugía no varía de la población sin cáncer.
• La evaluación del riesgo preoperatorio no debe retrasar la cirugía oncológica.
-
Referencias
1. DeVita VT Jr, Chu E. A history of cancer chemotherapy. Cancer Res. 2008 Nov;68(21):8643–53. https://doi.org/10.1158/0008-5472.CAN-07-6611 PMID:18974103
2. CANCER RESEARCH 43, 2382, May 1983] 0008-5472/83/0043-
3. Von Hoff DD, Layard MW, Basa P, Davis HL Jr, Von Hoff AL, Rozencweig M, et al. Risk factors for doxorubicin-induced congestive heart failure. Ann Intern Med. 1979 Nov;91(5):710–7. https://doi.org/10.7326/0003-4819-91-5-710 PMID:496103
4. World Health Organization. International Agency for Research on Cancer (IARC) [Internet]. 2022; Available from: https://gco.iarc.fr
5. Parra-Soto S, Petermann-Rocha F, Martínez-Sanguinetti MA, Leiva-Ordeñez AM, Troncoso-Pantoja C, Ulloa N, et al. Cáncer en Chile y en el mundo: una mirada actual y su futuro escenario epidemiológico. Revista médica de Chile [Internet]. 2020 Oct;148(10):1489–95. Available from: http://dx.doi.org/10.4067/s0034-98872020001001489
6. Miller KD, Nogueira L, Devasia T, Mariotto AB, Yabroff KR, Jemal A, et al. Cancer treatment and survivorship statistics, 2022. CA Cancer J Clin. 2022 Sep;72(5):409–36. https://doi.org/10.3322/caac.21731 PMID:35736631
7. Aboumsallem JP, Moslehi J, de Boer RA. Reverse cardio-oncology: cancer development in patients with cardiovascular disease. J Am Heart Assoc. 2020 Jan;9(2):e013754. https://doi.org/10.1161/JAHA.119.013754 PMID:31960736
8. Mehta LS, Watson KE, Barac A, Beckie TM, Bittner V, Cruz-Flores S, et al.; American Heart Association Cardiovascular Disease in Women and Special Populations Committee of the Council on Clinical Cardiology; Council on Cardiovascular and Stroke Nursing; and Council on Quality of Care and Outcomes Research. cardiovascular disease and breast Cancer: where these entities intersect: a scientific statement from the American Heart Association. Circulation. 2018 Feb;137(8):e30–66. https://doi.org/10.1161/CIR.0000000000000556 PMID:29437116
9. Banke A, Schou M, Videbaek L, Møller JE, Torp-Pedersen C, Gustafsson F, et al. Incidence of cancer in patients with chronic heart failure: a long-term follow-up study. Eur J Heart Fail. 2016 Mar;18(3):260–6. https://doi.org/10.1002/ejhf.472 PMID:26751260
10. A.R. Lyon, T. López-Fernández, L.S. Couch, 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS), et al. Eur Heart J., (2022)
11. Lyon AR, Dent S, Stanway S, Earl H, Brezden-Masley C, Cohen-Solal A, et al. Baseline cardiovascular risk assessment in cancer patients scheduled to receive cardiotoxic cancer therapies: a position statement and new risk assessment tools from the Cardio-Oncology Study Group of the Heart Failure Association of the European Society of Cardiology in collaboration with the International Cardio-Oncology Society. Eur J Heart Fail. 2020 Nov;22(11):1945–60. https://doi.org/10.1002/ejhf.1920 PMID:32463967
12. Halvorsen S, Mehilli J, Cassese S, Hall TS, Abdelhamid M, Barbato E, et al.; ESC Scientific Document Group. 2022 ESC Guidelines on cardiovascular assessment and management of patients undergoing non-cardiac surgery. Eur Heart J. 2022 Oct;43(39):3826–924. https://doi.org/10.1093/eurheartj/ehac270 PMID:36017553
13. Lee TH, Marcantonio ER, Mangione CM, Thomas EJ, Polanczyk CA, Cook EF, et al. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation. 1999 Sep;100(10):1043–9. https://doi.org/10.1161/01.CIR.100.10.1043 PMID:10477528
14. Brunelli A, Ferguson MK, Salati M, Vigneswaran WT, Jimenez MF, Varela G. Thoracic Revised Cardiac Risk Index Is Associated With Prognosis After Resection for Stage I Lung Cancer. Ann Thorac Surg. 2015 Jul;100(1):195–200. https://doi.org/10.1016/j.athoracsur.2015.03.103 PMID:26004925

 ORCID
ORCID