Marcela Ávila Á. MD, Mg.1,*, Jose Ulloa H. MD.2, Michael Serrano MD.3, Víctor Contreras4, Luis Ignacio Cortínez MD.5
Recibido: 24-09-2023
Aceptado: 05-11-2023
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 1 pp. 60-65|https://doi.org/10.25237/revchilanestv53n1-11
PDF|ePub|RIS
Abstract
Severe burn patients undergo major pathophysiological changes. There are 2 major phases: hypodynamic and hyperdynamic. Total intravenous anesthesia, in target control infusion mode is an alternative during the hyperdynamic phase, but there is little evidence of the predictive capacity of the models been used. Given such uncertainty, plasma propofol concentrations were measured in a cohort of severe burn patients admitted to the Hospital de Urgencia Asistencia Pública and compared with the concentrations predicted for the Marsh and Schnider models. To determine performance, bias and absolute error of the model were calculated. 112 plasma concentration measurements belonging to 11 patients were evaluated. For Schnider, the bias was -8%, and the overall error was 48.7%. For Marsh, the bias was -13.5% and the overall error 40.5%. This study allows to validate the use of the Marsh model in severe burns patientes, in their hyperdynamic phase.
Resumen
Los pacientes grandes quemados sufren grandes cambios fisiopatológicos. Existen 2 grandes fases: hipodinámica e hiperdinámica. La Anestesia total intravenosa, en modo target control infusión es una alternativa durante la fase hiperdinámica, pero, existe escasa evidencia de la capacidad de predicción de los modelos usados actualmente. Dada tal incertidumbre, se midió concentraciones plasmáticas de propofol en una cohorte de pacientes grandes quemados ingresados al Hospital de Urgencia Asistencia Pública y se comparó con las concentraciones predichas para los modelos Marsh y Schnider. Para la determinación de desempeño se calculó sesgo y error absoluto del modelo. Se evaluaron 112 mediciones de concentración plasmática pertenecientes a 11 pacientes. Para Schnider, el sesgo fue -8%, y el error global 48,7%. Para Marsh, el sesgo fue -13,5% y el error global 40,5%. Este estudio permite validar el uso del modelo Marsh en pacientes grandes quemados en fase hiperdinámica.
-
Introducción
Las lesiones por quemadura son un problema prevalente.
De acuerdo a la OMS, el 2004 cerca de 11 millones de personas presentaron quemaduras graves que requirieron atención médica.
En el 2007, el Ministerio de Salud (MINSAL) registró 6.435 egresos hospitalarios por quemaduras y el Instituto Nacional de Estadísticas informó de 569 muertes por esta causa. Ese mismo año, la tasa de mortalidad específica por quemadura en Chile fue 4,5 por 100.000 habitantes[1]. En un estudio descriptivo de una cohorte de 936 adultos ingresados al Centro de referencia del “Hospital de Urgencia Asistencia Pública” (HUAP) entre enero de 2006 y diciembre de 2010, 72% de los pacientes correspondía a menores de 60 años[2], por tanto, en plena edad productiva.
La sobrevida en quemaduras extensas ha mejorado progresivamente, gracias a los avances en la comprensión de la fisiopatología del cuadro y al tratamiento más agresivo de la misma[1].
Estos pacientes deben ser intervenidos en múltiples ocasiones, mayormente con anestesia general. El manejo anestésico debe considerar las diferentes fases fisiopatológicas que se presentan durante la evolución de la lesión. En la etapa inicial o de shock hipodinámico, el paciente requiere el aporte abundante de fluidos, los cuales diluyen proteínas plasmáticas y expanden el volumen intravascular. Tras la reanimación inicial, se presenta una fase hiperdinámica caracterizada por incremento del gasto cardíaco y aumento del flujo a órganos que puede durar hasta meses, hasta la cobertura de todas las zonas cruentas[3]. Los cambios antes mencionados, pueden afectar la respuesta a analgésicos e hipnóticos utilizados en la práctica anestésica habitual[4].
Gran parte de los procedimientos realizados en grandes quemados requieren de Anestesia General. Siendo la Anestesia Total Intravenosa (TIVA) una alternativa válida, y en algunos aspectos ventajosa (por sobre la anestesia inhalatoria), tales como: disminución de náuseas y vómitos posoperatorios (NVPO), menor contaminación ambiental, un despertar con menor agitación (de suma importancia considerando la alta tasa de trastornos de personalidad y abuso de sustancia en esta población) y el efecto antihiperalgésico del propofol (de gran relevancia e impacto por la alta prevalencia de hiperalgesia en este grupo de pacientes)[4],[5],[6],[7].
Por otra parte, los modelos Farmacocinéticos- Farmacodinámicos (FC-FD) para dosificar propofol fueron construidos con poblaciones de pacientes que no incluían pacientes grandes quemados[8]. Han et al., en el 2005, midió la actividad cerebral con BIS a pacientes grandes quemados candidatos a escarectomía durante la fase hiperdinámica, a los que se anestesió con propofol usando el modelo de Marsh. En este estudio se destacó la relación no linear, sino más bien bifásica entre el BIS y la concentración (diana) a sitio efecto (Ce). Dado que no se midió concentraciones plasmáticas, no se puede determinar si esto es a causa de cambios FC y/o FD o al algoritmo del BIS.
Existen múltiples razones desde el punto de vista FC que pueden explicar la variación en esta población: aumento del gasto cardíaco, en el flujo hepático, anemia, cambios en la vasculatura pulmonar asociados a injuria inhalatoria (y su potencial impacto en esta vía de metabolismo de propofol), e hipo albuminemia entre otros. Aun cuando el error de predicción clínicamente aceptable para la mayoría de sistemas de administración de propofol usando Target Control Infusion es del orden del 20%-30% respecto de lo normal, se han reportado errores de hasta 60%, lo cual supone que podría ser aún peor en pacientes críticos como los grandes quemados, por lo cambios previamente descritos.
En lo que respecta a los cambios FD, la resistencia a drogas es comúnmente encontrada en grandes quemados. Proliferación de formas inmaduras del receptor GABAA podrían explicar el plateau del BIS alrededor de 50 a pesar de aumentar la diana de propofol en el estudio de Han[9].
El mismo Han, en el 2009[10], estudió sistemáticamente los cambios farmacocinéticos del propofol en grandes quemados en fase hiperdinámica. En este trabajo se logró determinar a través de medición de las concentraciones plasmáticas de la droga un aumento en su volumen de distribución y del clearence, concluyendo que para lograr una determinada diana en un paciente gran quemado, se requerirá mayor masa de droga. Cabe destacar que, solo usó propofol en la inducción y la mantención de la anestesia fue con gases halogenados, lo cual sin duda, limita la extrapolación de estos resultados al uso de propofol en TIVA.
Yamashita et al. (2010)[11], también logró demostrar estos cambios en la FC del propofol en grandes quemados, usando “nonlinear mixed-effect modeling” (NONMEM). Los hallazgos más sobresalientes del estudio fueron: la FC de propofol fue mejor descrita por un modelo tricompartamental; la disposición del propofol fue mejor caracterizada por aumento del clearence, seguido por aumento del volumen de distribución; y, quemadura (“BURN”) fue la covariable más significativa, seguida de la variable peso (“WEIGHT”). Al agregar ambas, mejoró la capacidad de predicción del modelo. Lamentablemente, en este estudio, no se evaluó FD.
Guo en el 2015)[12] publico un estudio donde los pacientes grandes quemados candidatos a escarectomía, recibieron anestesia con TCI con remifentanilo (modelo de Minto, ajustado según hemodinamia y/o movimientos del paciente frente a estímulos) y TCI de propofol (modelo de Marsh, ajustando la diana a BIS de 40-50); cuyos resultados de éste estudio mostraron que el BIS está altamente correlacionado con la diana de TCI para propofol. No obstante, no midieron concentraciones plasmáticas para determinar parámetros FC y elaborar una curva dosis respuesta[14].
En el Centro de referencia de manejo de quemados del HUAP se ha observado sistemáticamente un mayor requerimiento de propofol en TIVA en grandes quemados en fase hiperdinámica. Cabe preguntarse si ello corresponde a un aumento en los requerimientos por cambios FD o solo reflejan el uso de un modelo FC-FD inadecuado para esta población. Por lo cual, el presente estudio busca evaluar el desempeño de los modelos de TCI de propofol existentes en esta población.
-
Material y Métodos
Se realizó un estudio prospectivo, en una muestra por conveniencia de un grupo de pacientes adultos grandes quemados, los cuales recibieron anestesia general usando TIVA
con propofol manual ajustada a valores de BIS (40-60) y TCI de remifentanil registrado en ClinicalTrials.gov (NCT03704285) aprobado por el comité Ético Científico de las Pontificia Universidad Católica de Chile n° 171215006.
Los criterios de inclusión fueron: Pacientes adultos mayores de 18 años grandes quemados con riesgo vital que requieren tratamiento en Unidades de Quemados y/o Unidades de Paciente Crítico, según definición guía GES (Tabla 1), exceptuando a los
quemados eléctricos; en fase hiperdinámica (> 48 h desde la lesión), en ventilación espontánea y con valores de la escala agitación sedación (SAS) igual a 4.
Los criterios exclusión fueron: Pacientes con ASA IV o V; imposibilidad de uso de la frente para instalación del monitoreo de profundidad anestésica (zona quemada, zona dadora de injerto). Uso de la droga en estudio 24 h previo al procedimiento anestésico quirúrgico.
Tabla 1. Muestra las características de la muestra estudiada versus los ingresos al servicio de quemados entre los años 2017 y 2018 (excluidos los fallecidos en las primeras 48 h)
| Parámetro | Muestra (n = 11) | Universo (n = 120) |
| Edad (años) | 44,2 ± 16,2 (25-75) | 46,89 ± 20 (15-86) |
| Género (hombres/mujeres) | 6/5 (54%) | 77/43 (64%) |
| Peso (kg) | 75, 6± 14,17 | 77,7 ± 17 |
| Talla (cm) | 162,2 ± 18,6 | 163 ± 23 |
| IMC | 29,1 ± 5,7 (21-38) | 28,42 ± 6,7 (19-66) |
| SCQ total | 38,4 ± 14,2 (23-67,5) | 37,6 ± 17,6 (20-85) |
| SCQ tipo B | 8,2 ± 10,8 (0-35) | 7,14 ± 15 (0-84) |
| IG | 121,5 ± 32,2 (74-165) | 126,34 ± 44 (58-282) |
IMC = índice de masa corporal = peso (kg)/altura(m). En la muestra, 3 pacientes eran normopeso (IMC 20-25), 4 en sobrepeso (26-30), y 4 obesos (> 30); SCQ = superficie corporal quemada; SCQ tipo B = SCQ profunda (A=superficial; A-B= intermedia); IG = índice de Gárces (de gravedad) = edad + (SCQ A*1)+(SCQ A-B*2)+(SCQ B*3).
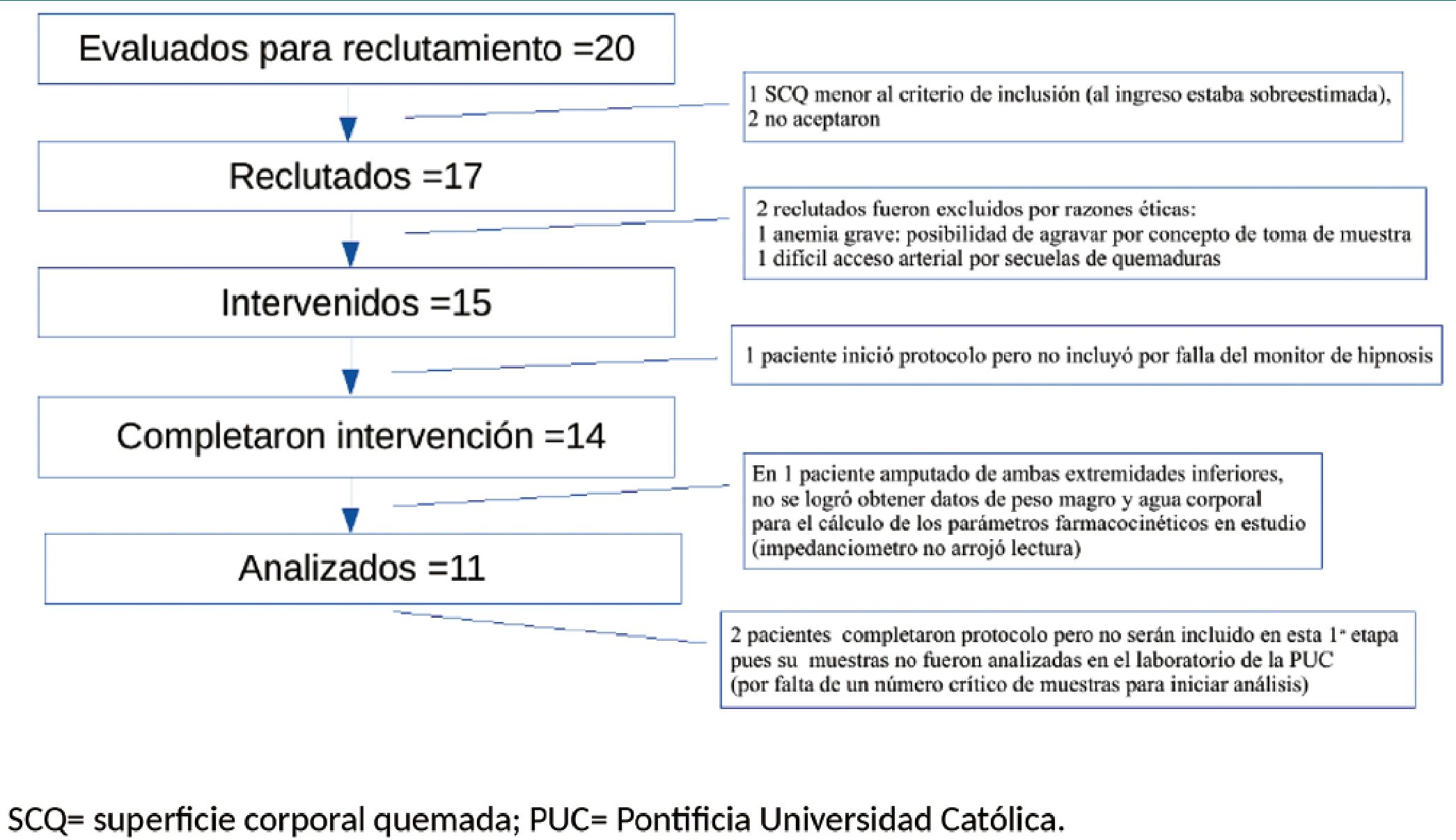
Figura 1. Descripción del proceso de reclutamiento, intervención y análisis, sus tamaños de muestra y causas de pérdidas de acuerdo a la recomendación CONSORT para el reporte de ensayos clínicos.
Previa firma del consentimiento informado, del paciente o sus representantes, los pacientes fueron sometidos a una impedanciometría (estimación de masa magra y agua y grasa corporal total) y luego llevados a pabellón quirúrgico.
Al ingreso a pabellón quirúrgico se aseguró un acceso venoso (periférico o central), a través del cual se administraron las drogas. A quienes no contaban con línea arterial, se les instaló una para toma de muestra de sangre y medición de presión arterial invasiva. Se realizó monitorización estándar con ECG, pulsioximetría, capnografía, temperatura y monitorización con BIS que fue registrado automáticamente y manualmente durante toda la cirugía.
La inducción anestésica fue con propofol y remifentanilo. El propofol fue administrado utilizando un bolo inicial de 1-2 mg/ kg de acuerdo al criterio del anestesista y luego una infusión continua de 10 mg/kg/h que fue ajustada para mantener un BIS entre 40 y 60 (idealmente más cercano a 50).
El remifentanilo fue administrado en TCI utilizando el modelo de Minto en una bomba AnestFusor (gentileza Dr. Andrés Stutzin, U de Chile). La concentración inicial fue de 4-6 ng/ml la cual se ajustó para mantener presión arterial y frecuencia cardíaca en un rango de variabilidad no mayor a 20% del basal (promedio de las 3 últimas mediciones de ficha clínica). Luego de la pérdida de conciencia, se administró rocuronio 0,6 mg/kg para facilitar la intubación traqueal. La ventilación fue asistida, con oxígeno al 50% con aire y ventilación mecánica para mantener normocapnia. Cerca del final de la cirugía se administró metadona 0,1 mg/kg.
Para el análisis de muestras plasmáticas se tomó 3 ml de sangre arterial para medición a los 2, 5, 10, 30, 60 y 120 minutos luego de iniciar la administración de propofol. En el posoperatorio, luego de la suspensión de la infusión, se tomaron muestras a los 0, 5, 15, 30, 60, 120, 240 minutos y a las 6-12 h. Las muestras fueron centrifugadas y almacenadas a -20°C hasta su análisis por HPLC (del inglés high-performance liquid chromatography). Por razones de costo, aleatoriamente una de las muestras del intraoperatorio y otra del posoperatorio fueron eliminadas. El límite inferior de capacidad de detección (LLOQ, del inglés lower concentration limit observed) de la técnica es 0,125 ng/ml.
La determinación del desempeño global fue calculada usando la metodología propuesta por Varvel et al.[16]. El sesgo del modelo (MPE del inglés median predicted error) es un valor que representa la dirección del error (valores positivos significan que el modelo subestima, valor de 0 corresponde a no sesgo, valores negativos significan sobre estimación del modelo). El error absoluto de desempeño (MAPE del inglés median absolute performance error) representa la magnitud del error (precisión), independiente de su dirección.
Se calculó primeramente el error de desempeño de cada observación individual (PE del inglés performance error) de acuerdo a la siguiente fórmula:

Y con este dato se calculó:

Se ha sido sugerido que al evaluar el desempeño de un modelo el sesgo (MPE) no sea mayor al 10%-20% y el error absoluto (MAPE) caiga entre 20% y 40%[17)].
Los concentraciones medidas de propofol fueron cotejadas con los modelos ya existentes para propofol en adultos, a fin de determinar su desempeño en esta población a través del cálculo del sesgo y error absoluto de acuerdo a la metodología recién descrita.
Se evaluaron 15 pacientes. Al completar los 15 pacientes se realizó un análisis preliminar de datos y de acuerdo a los resultados decidir la eventual necesidad de reclutar más pacientes al estudio.
-
Resultados
Un total de 20 pacientes fueron evaluados para reclutamiento, entre noviembre de 2018 y octubre de 2019. Solo 11 fueron finalmente analizados (Figura 2). Un total de 136 muestras arteriales fueron analizadas por HPLC. La mediana fue 10 muestras por paciente (9-12), 22 de ellas estuvieron por debajo del LLOQ de 0,125 ng/ml. Estas 22 muestras fueron censuradas.
La mediana de muestras bajo LLOQ por paciente fue de 3 (0-3). Todas las muestras bajo el LLOQ correspondieron al período post infusión, con una mediana de tiempo para la primera detección bajo el LLOQ de 240 minutos posterior a la infusión (120-720 minutos).
Es importante señalar que la evaluación para reclutamiento no fue sistemática.
Debido a que solo 2 anestesiólogos participaron del mismo.
Se extrajo los datos de los CRF y completó con ellos una planilla de Google Drive. Éstos se extrapolaron a una planilla de formato compatible con NONMEM (csv).
Primeramente, se graficó en Excel la curva de concentración en el tiempo para cada paciente para observar su plausibilidad biológica (lógica), detectar con mayor precisión los outliers y evaluar su génesis. Se determinó en varios casos errores de tipeo.
Posteriormente, se procedió a graficar las concentraciones de propofol observadas y calculadas con los 2 modelos de propofol de adultos más usados versus tiempo.
Para Schnider, el sesgo (MPE) es de -8% (-53% a 37%), y el error global (MAPE) de 48,7% (7% – 91%) (Figura 2). Para Marsh, el sesgo es de -13,5% (-52% a 25%) y el error global de 40,5% (5% a 77%). Los porcentajes corresponden a la media y en paréntesis están sus intervalos de confianza del 95%. Concentración de propofol vs tiempo: Modelo Marsh.
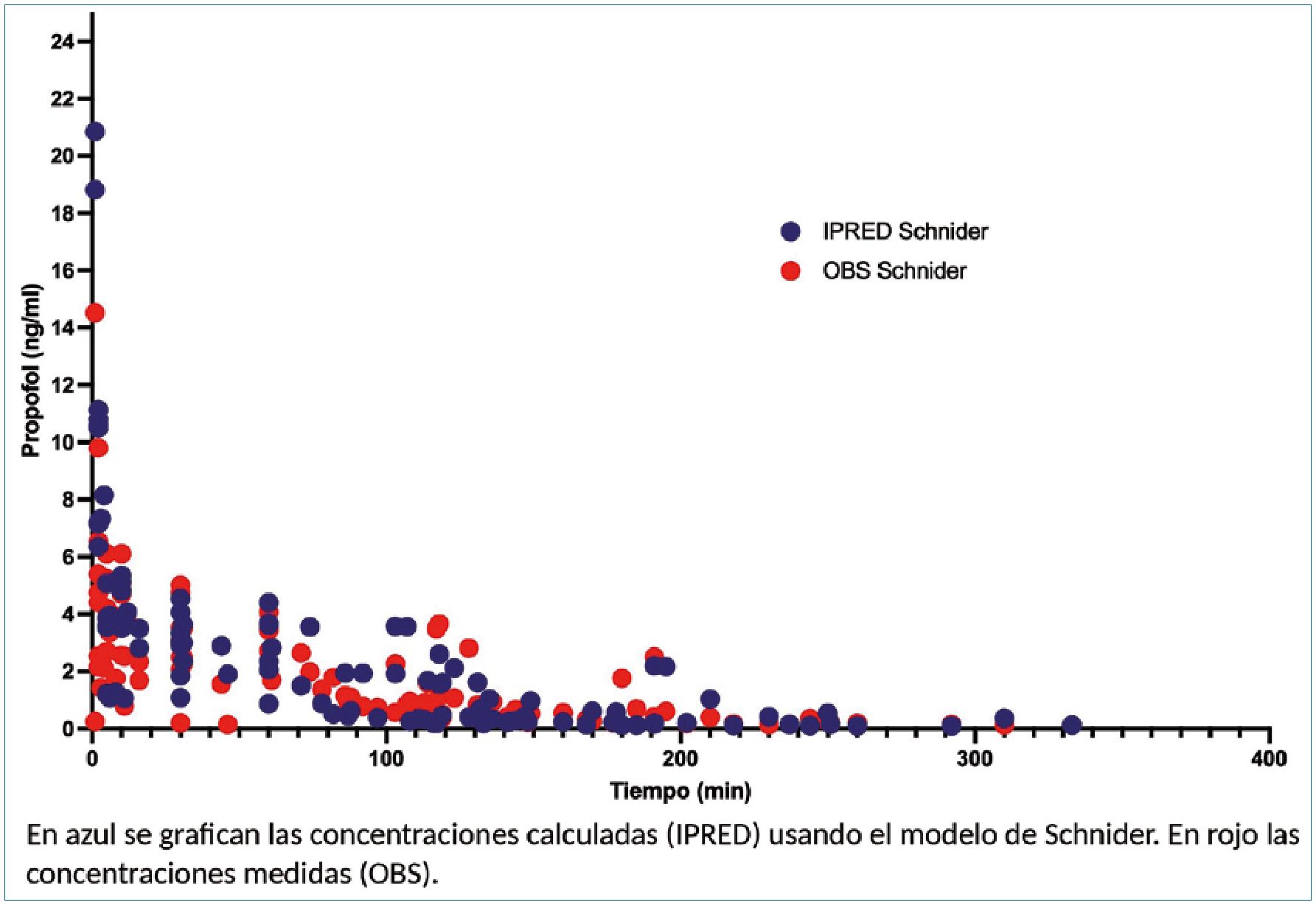
Figura 2. Concentración de Propofol vs tiempo: Modelo Schnider.
-
Conclusiones y Discusión
En base a 112 mediciones de concentraciones plasmáticas de propofol en 11 pacientes grandesquemados se logró determinar que los modelos actualmente disponibles tienen un nivel de sesgo y error considerado aceptable de acuerdo a reportes de la literatura[13]. Sepúlveda evaluó estos 2 modelos (Marsh y Schnider) en 14 ancianos y observaron que Schnider califica con un rendimiento en rango aceptado (MPE = 12,2%; MAPE = 25,9%). En el caso de Marsh, el MPE fue de 60,4% y el MAPE de 62,4%[14]. Cortínez en 20 obesos calcula para Marsh un MPE de 36,6% y MAPE de 39,9% y para Schnider MPE de 79,7% y MAPE de 79,7%[15]. Cabe recordar que el rendimiento de los modelos existentes es considerada aceptable un rendimiento de MPE < 20% y MAPE entre 20%-40%[16].
Considerando que tanto Marsh como Schnider están ampliamente disponibles en la actualidad, es conveniente contar con datos de rendimientos para los distintos subgrupos.
Dentro de las limitaciones de este estudio, cabe mencionar que se trata de un estudio de un solo centro, que si bien es centro de referencia nacional, deja generalmente afuera al paciente trabajador que puede comportarse diferente frente al insulto de la quemadura (el trabajador es un paciente en general sano y bien nutrido, con buena red de apoyo).
Nuestra cohorte tiene un alto predominio de pacientes con antecedentes de alcoholismo, drogadicción, desnutrición,
transtornos psiquiátricos y epilepsia mal manejada, junto con mala red de apoyo. Esto sin duda afecta la validez externa del estudio. También hay un sesgo de selección, al no realizarse sistemáticamente evaluación para eventual reclutamiento. Sin embargo, (se eliminó de éste a los pacientes que fallecen antes de llegar a fase hiperdinámica, habitualmente de mayor edad, pues para ellos no aplicaría esta técnica). La media de SCQ también es similar, sin embargo, el rango es más estrecho en la muestra, y es esperable dado los criterios de inclusión: gran quemado en base a SCQ (algunos pacientes ingresan al centro por quemadura en zona especial: cara, manos, genitales, etc; todas ellas menos extensas) y en ventilación espontánea (las SCQ más extensamente tardan muchísimo en salir de ventilación mecánica, y muchas fallecen antes de lograr ser extubadas). Lo mismo se observa con el rango del IG, probablemente por la misma razón.
Sin duda, su mayor debilidad es su bajo tamaño muestral. En este punto vale la pena citar a Mould en una revisión sobre modelamiento poblacional: “la farmacocinética poblacional no requiere una base de datos “rica” (muchas observaciones o sujetos), como el requerido para el análisis de un solo sujeto…“datos escasos” (pocas observaciones/ sujetos, o una combinación, puede ser usados”[17]. Se analizaron 11 sujetos y 112 observaciones (muestras medidas a diferentes tiempo durante la infusión y posterior a su término). Los mundialmente conocidos modelos de Marsh y Schnider solo analizaron 18 y 24 sujetos respectivamente[8]. Eleveld en cambio, analizó 660 sujetos, pero ellos provienen de 21 bases de datos y por ello es capaz de predecir dosis en distintos subgrupos de pacientes: niños, ancianos, obesos, entre otros[18].
Como conclusión, el presente estudio permite validar el uso del modelo de Marsh para realizar TCI en grandes quemados en fase hiperdinámica. El reclutamiento de un mayor número de pacientes permitiría la formulación de un modelo PK-PD un modelo potente, con menor sesgo y error global,que considere las variables propias de este grupo de pacientes, tales como: grado de lesión, estado inflamatorio y superficie corporal comprometida; asociado a variables generales como son: edad, peso y nutrición, Permitiría reducir el error predictivo en esta población mejorando así la dosificación de estos pacientes al usar TCI.
agradecimientos: Nuestros más sinceros agradecimientos al equipo de enfermería del Servicio de quemados del HUAP, especial mención a la enfermera Patricia Medalla que nos ayudó, entre otros, en la toma de muestras durante la inducción. También a los asistentes técnicos de Fresenius-kabi quienes nos entrenaron en el uso de Anestfusor y nos acompañaron a gran parte de los casos realizados, particularmente a Claudia Molina. Por último, pero no menos importante, a los residentes del Programa de Anestesiología USACH, por su presencia y apoyo durante el reclutamiento y realización y seguimiento de los casos.
-
Referencias
1. MINISTERIO DE SALUD. Guía Clínica. Manejo del paciente gran quemado. Santiago: Minsal, 2016.
2. Albornoz CR, Jorge Villegas, Verónica Peña, Sandra Whittle. Epidemiología del paciente gran quemado adulto : experiencia del Servicio de Quemados del Hospital de la Asistencia Pública de Santiago. Rev Médica Chile. 2013;141:181-6. https://doi.org/10.4067/S0034-98872013000200006
3. Edward A. Bittner, Erik Shank, Lee Woodson, J.A. Jeevendra Martyn. Acute and Perioperative Care of the Burn-Injured Patient. Anesthesiology. 2015 February ; 122(2): 448-464. https://doi.org/10.1097/ALN.0000000000000559
4. Tae-Hyung Han, David J. Greenblatt, J. A. Jeevendra Martyn. Propofol Clearance and Volume of Distribution Are Increased in Patients With Major Burns. Journal of Clinical Pharmacology, 2009; 49:768-772. https://doi.org/10.1177/0091270009335767
5. Timothy E. Miller, Tong J. Gan. Total Intravenous Anesthesia and Anesthetic Outcomes. Journal of Cardiothoracic and Vascular Anesthesia- 2015; 29 (S1): S11-S15. https://doi.org/10.1053/j.jvca.2015.01.022
6. Belén Larrea, Marcela Ávila, Cindy Raddatz. Manejo del dolor en pacientes quemados. Rev Chil Anest 2015; 44: 78-95. https://doi.org/10.25237/revchilanestv44n01.08
7. Ricardo Bustamante, Renato Chacón. Consideraciones farmacológicas en el manejo anestésico del paciente quemado. Rev Chil Anest 2015; 44: 31-48. https://doi.org/10.25237/revchilanestv44n01.05
8. Absalom AR, Mani V, De Smet T, Struys MM. Pharmacokinetic models for propofol–defining and illuminating the devil in the detail. Br J Anaesth. 2009 Jul;103(1):26-37. https://doi.org/10.1093/bja/aep143
9. T-H. HAN, J-H. LEE, IN-S UK KWAK, H-Y. K IL, K-W. HAN and K-M. KIM. The relationship between bispectral index and targeted propofol concentration is biphasic in patients with major burns. Acta Anaesthesiol Scand 2005; 49: 85- 91. https://doi.org/10.1111/j.1399-6576.2004.00532.x
10. Tae-Hyung Han, David J. Greenblatt, J. A. Jeevendra Martyn. Propofol Clearance and Volume of Distribution Are Increased in Patients With Major Burns. Journal of Clinical Pharmacology, 2009;49:768-72. https://doi.org/10.1177/0091270009335767
11. Susumu Yamashita, Kotaro Kaneda, Tae-Hyung Han. Population pharmacokinetics of a propofol bolus administered in patients with major burns. Burns 2010; 36: 1215-21. https://doi.org/10.1016/j.burns.2010.03.003
12. Z.G. Guo, X.P. Jia, X.Y. Wang, P. Li, X.J. Su, J.H. Hao. Bispectral index for monitoring anesthetic depth in patients with severe burns receiving target-controlled infusion of remifentanil and propofol. Genet. Mol. Res. 2015, 14 (3): 7597-7604. https://doi.org/10.4238/2015.July.13.3
13 CF Swinhoe, JE Peacock, JB Glen & CS Reilly. Evaluation of the predictive performance of a ‘Diprifusor’ TCI system. Anaesthesia, 1998; 53 (S1): 61-67. https://doi.org/10.1111/j.1365-2044.1998.53s104.x
14. P. Sepúlveda y L. Abadía. Anestesia total intravenosa en geriatría: el ejemplo del propofol. Rev Esp Anestesiol Reanim. 2013, 60 (6): 327-335. https://doi.org/10.1016/j.redar.2012.09.016
15. L Cortínez, N De la Fuente, D Eleveld, A Oliveros, F Crovari, P Sepulveda, M Ibacache, & S Solari. Performance of Propofol Target-Contr olled Infusion Models in the Obese: Pharmacokinetic and Pharmacodynamic Analysis. Anesth Analg 2014;119:302-10. https://doi.org/10.1213/ANE.0000000000000317
16. John Varvel, David Donoho, and Steven Shafera. Measuring the Predictive Performance of Computer-Controlled Infusion Pumps. Journal o f Pharmacokinetics and Biopharmaceutics 1992, 20 (1): 63- 94. https://doi.org/10.1007/BF01143186
17. DR Mould & RN Upton. Basic Concepts in Population Modeling, Simulation, and Model-Based Drug DevelopmentPharmacometrics & Systems Pharmacology (2012) 1, e6. https://doi.org/10.1038/psp.2012.4
18. Douglas Eleveld, Johannes H. Proost, Luis Cortínez, Anthony Absalom, and Michel Struys. A General Purpose Pharmacokinetic Model for Propofol. Anesth Analg 2014;118:1221-37. https://doi.org/10.1213/ANE.0000000000000165

 ORCID
ORCID