Diego Cáceres M.1,*, Margarita Mena G.2,4, Ricardo Eltit V.3,4
Recibido: 18-11-2023
Aceptado: 08-01-2024
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 2 pp. 135-150|https://doi.org/10.25237/revchilanestv53n2-09
PDF|ePub|RIS
Arrhythmias in general pediatric population: a review of the literature
Abstract
Arrhythmias include abnormalities in heart rate or rhythm; the incidence of this condition in the general pediatric population is estimated at 55.1 per 100,000 consultations in children’s emergency units and tends to have a bimodal distribution. The most common arrhythmias in this group include sinus tachycardia, supraventricular tachycardia, bradycardia, premature ventricular and supraventricular contractions. This work aims to review the clinical, electrocardiographic characteristics and general management of the main arrhythmias described. Sinus tachycardia corresponds to a discharge of the sinus node with a frequency greater than normal for the patient’s age; it usually corresponds to a compensatory response to the increased metabolic demand of the body. Supraventricular tachycardia is a generic term used to refer to arrhythmias originating above the ventricular tissue. There are different mechanisms responsible, the main one being atrioventricular reentry; most of these patients have a structurally normal heart. Acute management varies according to hemodynamic stability; in stable cases the pillars correspond to vagal maneuvers and adenosine. Another important condition is long QT syndrome, which corresponds to a disorder of ventricular repolarization. It can be of congenital or acquired origin, responsible for 3,000 to 4,000 cases of sudden death per year in the United States. It has a risk of progression to a particular arrhythmia called Torsade de Pointes (TdP), which consists of a potentially fatal polymorphic ventricular tachycardia, which has specific management with magnesium sulfate. In relation to bradyarrhythmias, sinus bradycardia is the most common, it can be associated with vagal stimulation, acute elevation of intracranial pressure, acidosis, hypoxemia, the latter being the most frequent cause.
Resumen
Las arritmias incluyen anormalidades en frecuencia cardíaca o ritmo; la incidencia de esta condición en población pediátrica general se estima en 55,1 por 100.000 consultas en unidades de emergencia infantil y tiende a poseer una distribución bimodal. Las arritmias más comunes en este grupo incluyen taquicardia sinusal, taquicardia supraventricular, bradicardia, contracciones prematuras ventriculares y supraventriculares. Este trabajo tiene por objetivo revisar las características clínicas, electrocardiográficas y manejo general de las principales arritmias descritas. La taquicardia sinusal corresponde a una descarga del nodo sinusal con una frecuencia mayor a la normal para la edad del paciente, suele corresponder a una respuesta compensatoria al aumento de demanda metabòlica del organismo. La taquicardia supraventricular es un término genérico utilizado para referirse a arritmias originadas por sobre el tejido ventricular, existen distintos mecanismos responsables, siendo el principal la reentrada atrioventricular; en su mayoría estos pacientes poseen un corazón estructuralmente normal. El manejo agudo varía según la estabilidad hemo- dinámica, en los casos estables los pilares corresponden a maniobras vagales y adenosina. Otra condición de importancia es el síndrome de QT prolongado que corresponde a un desorden de la repolarización ventricular, puede ser de origen congènito o adquirido, responsable de 3.000 a 4.000 casos de muerte súbita por año en Estados Unidos. Posee riesgo de progresión a una arritmia particular denominada , que consiste en una taquicardia ventricular polimorfa potencialmente fatal, que posee un manejo específico con sulfato de magnesio. En relación a las bradiarritmias, la bradicardia sinusal es la más frecuente, puede estar asociada a estimulación vagal, elevación aguda de presión intracraneal, acidosis, hipoxemia, siendo esta última la causa más frecuente.
-
Introducción
El concepto arritmias incluye anormalidades en frecuencia cardíaca (taquiarritmias y bradiarritmias) o ritmo (regular o irregular). La incidencia de esta condición en población pediátrica varía en la literatura, sin embargo, se describe entorno a 55,1 por 100.000 consultas en unidades de emergencia infantil. Tiende a poseer una distribución bimodal con un primer peak en lactantes y un segundo peak en adolescentes, destacando también que pueden presentarse en pacientes con o sin cardiopatía congénita, sea esta corregida quirúrgicamente o no[1].
Las arritmias más frecuentes son diferentes dependiendo de la población pediátrica estudiada; es así como en población pediátrica general destacan: taquicardia sinusal (50%), taquicardia supraventricular (13%), bradicardia (6%), contracciones prematuras ventriculares y supraventriculares[2]. Por su parte en pacientes portadores de cardiopatía congénita operada se describe que la más frecuente es la taquicardia ectópica de la unión (JET) con una incidencia de 65% de los casos, seguido de bloqueo cardiaco completo (18%), taquicardia ventricular (6,5%), taquicardia supraventricular (4,8%) y fibrilación ventricular (3,8%). La mayor incidencia es en relación a pacientes con defectos septales atrioventriculares y transposición de grandes arterias[3].
-
Conceptos generales de electrocardiografía en pediatría
Las indicaciones más comunes para solicitar un electrocardiograma (EKG) en pacientes pediátricos corresponden a dolor torácico, palpitaciones, convulsiones, síncope, exposición a drogas, quemaduras eléctricas, alteraciones electrolíticas y hallazgos patológicos en examen físico[2]. Al interpretar un EKG es recomendable un abordaje sistemático con especial atención en: frecuencia cardíaca, ritmo, análisis de eje, hipertrofia atrial o ventricular y búsqueda de signos de isquemia o alteraciones de la repolarización, considerando que en población pediátrica la particularidad radica en la variación de los parámetros según la edad del paciente (Tabla 1)[4].
Frecuencia cardíaca (FC). En pacientes pediátricos, el gasto cardiaco (GC) es determinado principalmente por la FC por sobre el volumen sistólico (VS); con la edad éste posee un mayor rol a medida que se desarrollan los ventrículos.
Eje complejo QRS. Durante la vida intrauterina, existe un shunt en la circulación mediante el ductus arterioso, desviando la sangre del territorio pulmonar, por lo que el ventrículo derecho provee la mayor parte del flujo sanguíneo sistémico (aproximadamente 70%), y constituye la cámara cardíaca dominante en el recién nacido. En el EKG del neonato y lactante menor de 2 meses se puede identificar una desviación del eje QRS a derecha, por la mayor masa ventricular derecha. Además, se identifica una onda R amplia en V1 – V2 y de menor amplitud en V5 – V6, patrón que se va modificando a medida que el sistema circulatorio madura y el ventrículo izquierdo se hace dominante[4].
Intervalo PR y duración complejo QRS. Se modifican con la edad, incrementando gradualmente asociado al desarrollo y aumento de masa cardíaca.
Intervalo QT. Representa la sumaria de la despolarización y repolarización ventricular. Su medición es desde el inicio de onda Q hasta el final de la onda T en la derivada que muestre el mayor intervalo. El iQT es inversamente proporcional a la FC y se corrige a una FC estandarizada de 60 lpm para mejorar el diagnóstico; el método más común para obtener el iQTc es la fórmula de Bazett: QTc = QT/(RR)1/2[5].
-
Ondas T
En pediatría, los cambios en onda T tienden a ser inespecíficos. Sin embargo, está descrito que la presencia de ondas T invertidas en el recién nacido es normal. De hecho, el hallazgo de ondas T invertidas en V1 – V4 es habitual hasta la edad de 8 años, descrito como patrón de onda T juvenil[4].
-
Taquiarritmias
La taquicardia se define como una frecuencia cardíaca sobre límite superior normal para la edad del paciente o una secuencia de 3 o más latidos con una frecuencia 25% mayor de la frecuencia cardiaca basal[6].
Tabla 1. Parámetros normales EKG pediátrico
| Edad | Frecuencia cardíaca (latidos por minuto, lpm) | Eje QRS (grados) | Intervalo PR (seg, s) | Intervalo QRS (s) |
| lera semana | 90 – 160 | 60 – 180 | 0,08 – 0,15 | 0,03 – 0,08 |
| 1 – 3 semanas | 100 – 180 | 45 – 160 | 0,08 – 0,15 | 0,03 – 0,08 |
| 1 – 2 meses | 120 – 180 | 30 – 135 | 0,08 – 0,15 | 0,03 – 0,08 |
| 3 – 5 meses | 105 – 185 | 0 – 135 | 0,08 – 0,15 | 0,03 – 0,08 |
| 6 – 11 meses | 110 – 170 | 0 – 135 | 0,07 – 0,16 | 0,03 – 0,08 |
| 1 – 2 años | 90 – 165 | 0 – 110 | 0,08 – 0,16 | 0,03 – 0,08 |
| 3 – 4 años | 70 – 140 | 0 – 110 | 0,09 – 0,17 | 0,04 – 0,08 |
| 5 – 7 años | 65 – 140 | 0 – 110 | 0,09 – 0,17 | 0,04 – 0,08 |
| 8 – 11 años | 60 – 130 | -15 – 110 | 0,09 – 0,17 | 0,04 – 0,09 |
| 12 – 15 años | 65 – 130 | -15 – 110 | 0,09 – 0,18 | 0,04 – 0,09 |
| Más 16 años | 50 – 120 | – 15 – 110 | 0,12 – 0,20 | 0,05 – 0,10 |
Extracto de Doniger SJ, Sharieff GQ. Pediatric dysrhythmias. Pediatr Clin North Am. 2006 Feb;53(1):85-105.
Tabla 2. Valores normales QTc
| QTc (ms) | 1 – 12 años | Mujer (mayor 12 años) | Hombre (mayor 12 años) |
| Corto | Menor 390 | Menor 390 | |
| Normal | 390 – 460 | 390 – 450 | |
| Prolongado | Mayor 450 | Mayor 460 | Mayor 450 |
Extracto de Niimi N, Yuki K, Zaleski K. Long QT Syndrome and Perioperative Torsades de Pointes: What the Anesthesiologist Should Know. J Cardiothorac Vasc Anesth. 2022 Jan;36(1):286-302.
Las manifestaciones clínicas son variadas y de carácter inespecífico; por ejemplo, los lactantes pueden presentar taquip- nea, dificultad en alimentación, vómitos, agitación; y dependiendo de la severidad, compromiso hemodinámico y duración puede progresar a palidez, cianosis periférica, insuficiencia cardiaca y shock. Los pre-escolares y escolares pueden referir molestias torácicas, palpitaciones, disnea, presíncope/síncope y raramente presentarse como muerte súbita[7].
Las taquiarritmias varían ampliamente según su origen, etiología, relevancia clínica, existiendo múltiples sistemas de clasificación. La base de datos de enfermedades pediátricas las clasifica según los siguientes criterios:
• Localización: atrial, atrioventricular, ventricular, de la unión.
• Mecanismo: reentrada, focal (con automatismo aumentado o actividad gatillada).
• Etiología: posprocedimiento, mecánica, isquémica, metabó- lica, infecciosa, multifactorial.
• Duración: sostenida (mayor o igual a 30 segundos), no sostenida (menor a 30 segundos).
• Frecuencia: paroxística (inicio y término abrupto), recurrente, recurrente crónica, permanente (presente sobre 20% del tiempo)[8].
En general existen 2 mecanismos básicos responsables de la arritmogénesis:
• Desórdenes de generación del impulso eléctrico: automatismo alterado o estímulos gatillados posdepolarización, éstos a la vez pueden ser tempranos, en fases 2 y 3 del potencial de acción miocárdico (PA) o tardíos, en fase 4 del PA. Se puede producir un aumento en la frecuencia y amplitud de estímulos posdepolarización en el contexto de alteraciones electrolíticas (principalmente hipokalemia e hipocalcemia), aumento de niveles de catecolaminas circulantes o en ciertas canalopatías (ej. síndrome QT largo congénito).
• Desórdenes de conducción de impulso eléctrico asociados a fenómeno de reentrada[9].
A continuación, se revisarán los principales tipos de taquia- rritmias en población pediátrica general.
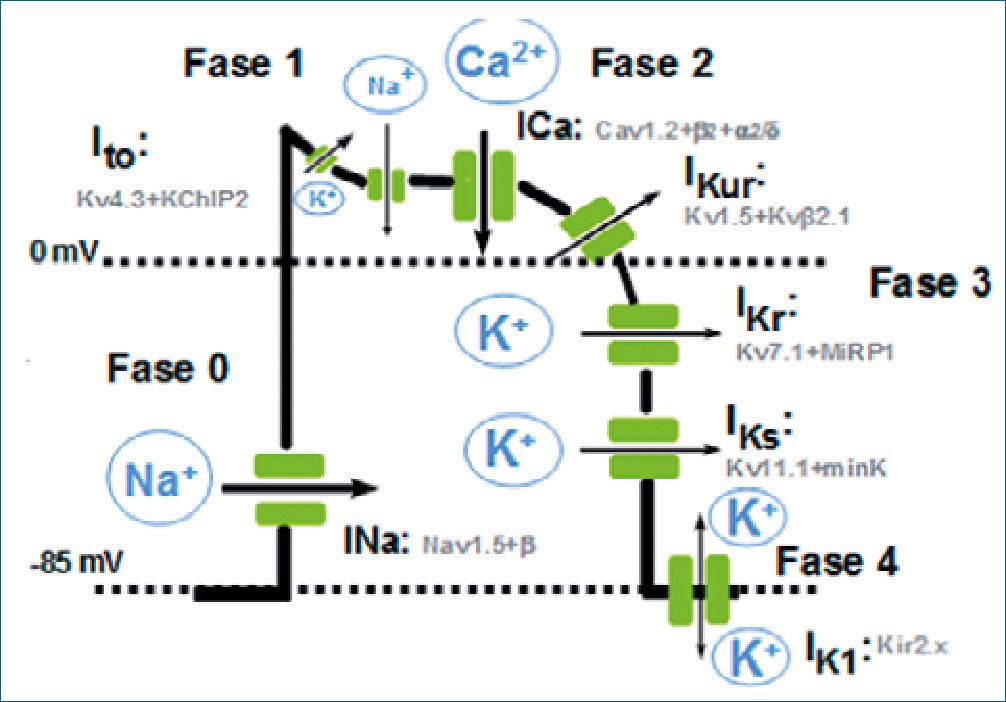
Figura 1. Fases de PA, corrientes iónicas predominantes y canales implicados. Fase 0: despolarización; – INa: Corriente rápida de Na+ (canales Na+ voltaje dependientes); Fase 1: repolarización rápida – Ito: Corriente transitoria de K+; Fase 2: meseta – INaL: Corriente lenta de Na+ – ICa: Corriente de Ca+2 (canales Ca+2 tipo L); Fase 3: repolarización – IKur: Corriente rectificadora de K+ ultrarrápida – IKr: Corriente rectificadora de K+ rápida – IKs: Corriente rectificadora de K+ lenta; Fase 4 (isoeléctrica) en la que se restituyen concentraciones iónicas. – Bomba Na+/K+ ATPasa – Intercambiador Na+/Ca+2.
-
Contracciones prematuras (CP)
Pueden clasificarse en supraventricular o ventricular según se originen sobre o bajo bifurcación de Haz de His.
Las CP supraventriculares tienden a ser idiopáticas y clinicamente silentes, pero en ocasiones son diagnosticadas durante vida fetal. En población neonatal pueden gatillar una condición denominada pseudobradicardia, cuando la conducción a los ventrículos es bloqueada, ésta tiende a desaparecer durante el primer año de vida. Este tipo de arritmia no requiere ser tratada.
Las CP ventriculares también suelen ser idiopáticas y asintomáticas, sin embargo, si son documentadas requieren la exclusión de una cardiopatía o arritmia más compleja. Se consideran benignas cuando ocurren en un corazón estructuralmente normal, característicamente monomorfas, con presentación aislada y suprimidas por el ejercicio. En este caso, no requieren ser tratadas y desaparecen con el desarrollo del paciente[6].
-
Taquicardia sinusal (TS)
Corresponde a una descarga del nodo sinusal (NS) con una frecuencia mayor a la normal para la edad del paciente, ésta suele ser mayor a 140 lpm en pre-escolares y mayor a 160 lpm en lactantes[1]. TS suele constituir una respuesta compensatoria al aumento de la demanda metabólica del organismo, considerando que los niños aumentan su gasto cardíaco principalmente a expensas de la FC por sobre el volumen sistólico (VS). Este aumento de demanda metabólica puede producirse en contexto de ejercicio, ansiedad, infecciones, anemia, insu
ficiencia cardiaca, hipoxia, hipovolemia (principalmente por deshidratación), shock, isquemia miocárdica, edema pulmonar, hipertiroidismo (o en caso extremo de tirotoxicosis), asociado a ciertas drogas como atropina o catecolaminas, hipocalcemia, fiebre, entre otras. Se ha descrito un ascenso lineal de la FC en relación a aumentos de temperatura corporal central en pacientes mayores de 2 meses; por cada grado Celsius se produce un aumento en 9,6 lpm[10].
La TS presenta las siguientes características:
• Ondas P negativas en derivada aVR y positivas en derivadas inferiores.
• Ondas P preceden cada complejo QRS.
• Inicio y término paulatino.
• Presencia de cambios en la FC asociado a la ventilación (arritmia sinusal).
• Generalmente, no presenta bloqueo AV asociado a una prueba de adenosina.
• Ausencia de prolongación de intervalo PR.
• FC generalmente, menor a 180 lpm en pre-escolares y menor a 220 lpm en lactantes.
El manejo está orientado a identificar precozmente la causa y tratarla dirigidamente.
-
Taquicardia supraventricular (TSV)
Corresponde a un término genérico utilizado para referirse a arritmias originadas por sobre el tejido ventricular. Su incidencia es 1:250 a 1:1.000 pacientes pediátricos. Aproximadamente, el 50% de los pacientes presenta su primer episodio durante la lactancia con resolución espontánea entorno al 90% de los casos; ocurre un segundo peak aprox. en el 30% de los casos a una media entre los 8 y 12 años. En los pacientes cuyo diagnóstico inicial se hace posterior al año de vida, sólo 15% posee resolución espontánea[11]. La mayoría de los niños con este tipo de arritmia posee un corazón estructuralmente normal; sin embargo, también existe asociación a cardiopatías congénitas (9% – 32% de los casos) siendo las más comunes la anomalía de Ebstein, transposición de grandes arterias, prolapso de válvula mitral y comunicación interventricular[6].
Existen distintos subtipos según su mecanismo arritmogénico:
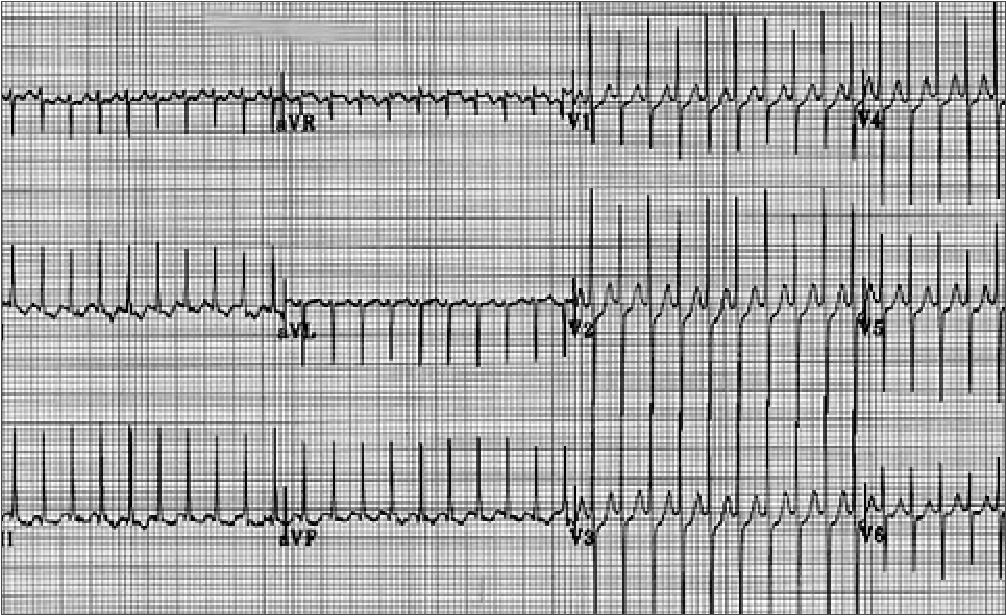
Figura 2. EKG de taquicardia supraventricular[2].
-
Taquicardia por reentrada atrioventricular (TRAV)
Corresponde al subtipo más frecuente de TSV en niños (60%-80% de los casos). Son mediadas por vías accesorias que pueden conducir de forma anterógrada (desde aurícula a ventrículo) o retrógrada (desde ventrículo a aurícula, más frecuente). Además, puede dividirse en TRAV ortodrómica (cuando la conducción anterógrada ocurre por el nodo AV y la retrógrada por la vía accesoria, más común) o TRAV antidrómica (cuando la conducción anterógrada ocurre por la vía accesoria y la retrógrada por el nodo AV, este tipo es menos frecuente y produce un complejo QRS ancho al EKG de superficie). Cuando las vías accesorias son capaces de conducción anterógrada, muestran preexitación ventricular al EKG; la asociación de preexitación ventricular y síntomas relacionados a la TSV se denomina síndrome de Wolff – Parkinson – White[12].
-
Taquicardia por reentrada nodal atrioventricular (TRNAV)
Responsable de 15% de las arritmias en niños, su incidencia aumenta con la edad. Se produce por la existencia de 2 vías de conducción diferentes a nivel del nodo AV, con propiedades electrofisiológicas distintas, siendo una de conducción lenta y otra rápida. Al EKG se evidencia complejos QRS angostos, con intervalo PR corto, conducción AV 1:1. Las ondas P están sobreimpuestas en QRS o al final del QRS causando un patrón de pseudo -r. La FC suele ser sobre 220 lpm en infantes y sobre 180 lpm en pre-escolares y escolares. Es considerada de buen pronóstico y posee una respuesta efectiva al tratamiento con ablación[1].
-
Taquicardia ectópica atrial
Es rara en pacientes pediátricos (14% de todas las TSV). Se produce por un foco ectópico auricular cuya localización más frecuente es el apéndice derecho, cresta terminal, alrededor de venas pulmonares, sin embargo, puede existir en cualquier sitio de aurícula izquierda o derecha. Al EKG se evidencia ondas P con diferente morfología, cada onda P se conduce al ventrículo. Como el foco ectópico es más rápido que el nodo sinusal, determina la frecuencia cardíaca. La frecuencia atrial puede oscilar entre 130 y 300 lpm; pero puede haber asociado bloqueo AV de 1er y 2do grado[6].
-
Taquicardia ectópica multifocal
Es una condición rara; es más común en neonatos de género masculino. Usualmente es idiopática, pero puede estar asociada con infección por virus respiratorio sincicial. Al EKG se evidencia ondas P con 3 o más morfologías y generalmente es incesante. Bloqueo AV de 1er y 2do grado causa intervalos PR y RR variables[6].
-
Manejo agudo
En TSV e inestabilidad hemodinámica (hipotensión, alteración perfusión) o alteración del estado mental se debe aplicar cardioversión eléctrica (CVE): 0,5 – 1,5 J/kg[13].
En pacientes hemodinámicamente estables se puede utilizar:
• Maniobras vagales: valsalva y masaje carotideo, con mayor efectividad en niños mayores (aproximadamente 70% de los pacientes responden). La presión del masaje carotideo debe ser aplicada de forma posteromedial hasta 5 seg en una ocasión y unilateral.
• Adenosina (endovenosa): corresponde a un análogo nu- cleósido que se une a receptores específicos en nodo sinusal y nodo AV, inhibiendo el flujo iónico mediado por AMPc, resultando en bloqueo de la conducción. Este fármaco permite diferenciar si la TSV es nodo AV dependiente (TRAV o TRNAV) o independiente (taquicardia ectópica atrial). En las nodo AV dependientes la adenosina termina la taqui- cardia[14]. Posee una vida media de 10 segundos; por lo que, se requiere su administración en un bolo rápido en una vena proximal para lograr su efecto. Se utiliza en dosis de 0,1 a 0,2 mg/kg, con una dosis máxima de 400 mcg/kg. Dos dosis permiten terminar con el 95% de las TSV. En relación a sus efectos adversos (EA) se describe broncoespasmo, apnea, asistolia prolongada y conducción rápida por vía accesoria causando arritmia ventricular[1], sin embargo, éstos son de muy baja incidencia.
• Procainamida, flecainida (1,5 – 2 mg/kg en 3 a 5 minutos) y amiodarona (utilizada en casos refractarios o en pacientes con fracción de eyección reducida; 5 mg/kg en 60 minutos seguido de infusión de 5 – 15 mcg/kg/min)[15].
Una TSV refractaria se define cuando la arritmia no cede tras la administración de 2 dosis incrementales de adenosina, descartando un error en la técnica de administración.
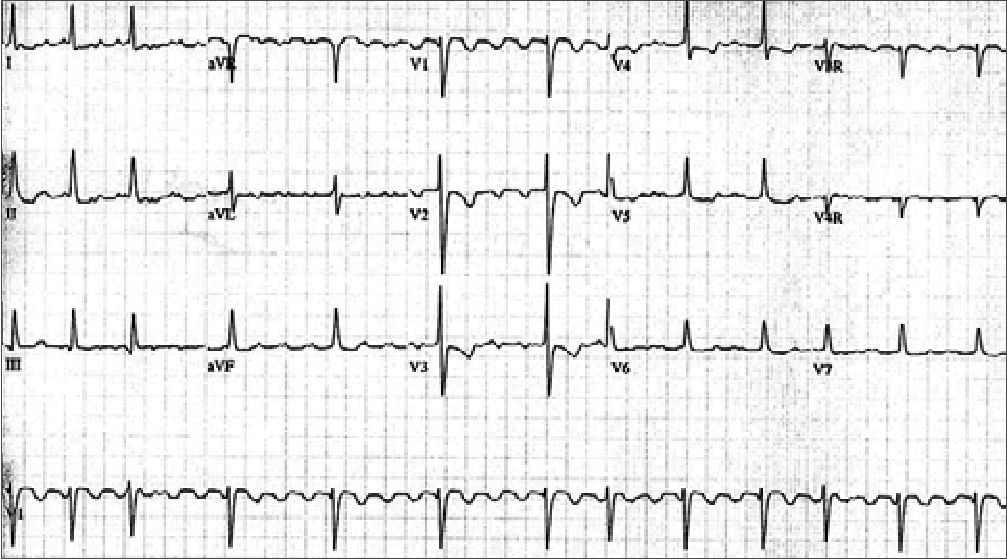
Figura 3. EKG de flutter atrial[2].
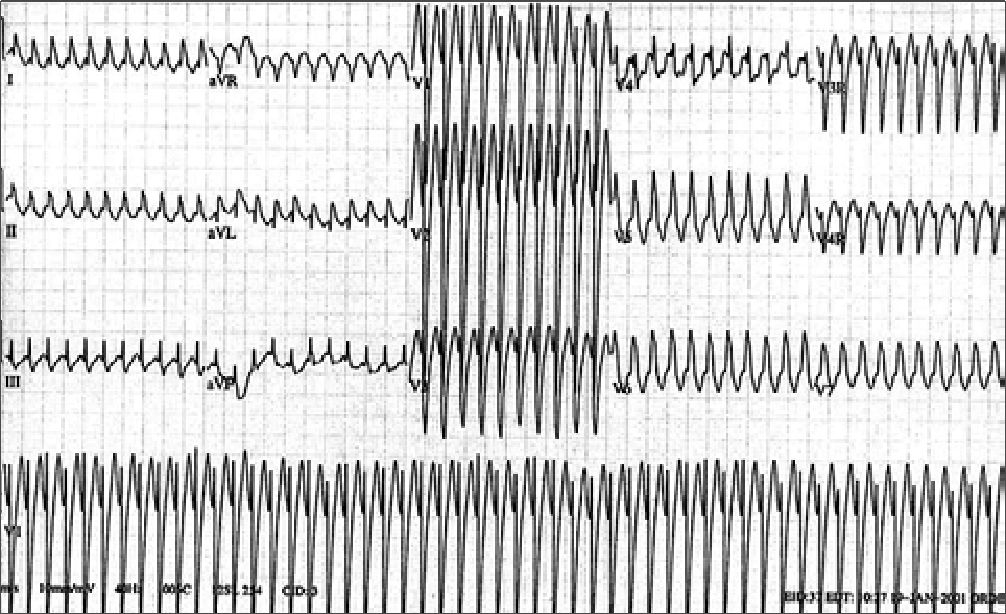
Figura 4. EKG de taquicardia ventricular[2].
-
Flutter atrial
Corresponde a un ritmo poco frecuente en población pediátrica (0,03% de los casos). Se puede presentar con frecuencia auricular que oscila entre 275 y 580 lpm con una respuesta ventricular dependiente de la conducción por el nodo AV.
Entre sus causas destaca cardiopatía estructural, incluyendo dilatación auricular, miocarditis, complicación posoperatoria de cirugías correctivas de cardiopatías congénitas, como reparación de comunicación interauricular, cirugía de Mustard para transposición de grandes arterias o cirugía de Fontan para ventrículo único, procedimientos en los cuales se produce disrup- ción del sistema de conducción especializado. También se ha asociado a distrofia muscular de Duchenne y lesiones de sistema nervioso central.
Al EKG se observa un patrón típico de ondas de flutter (“aletas de tiburón”) identificado principalmente en derivadas DII, DIII y V1. La frecuencia atrial es en promedio 300 lpm, impulsos que son bloqueados a nivel de nodo AV, pudiendo generarse bloqueo 2:1, 3:1 o 4:1; el complejo QRS generalmente, es de configuración normal. Si la frecuencia ventricular es muy alta, el gasto cardíaco puede ser insuficiente al comprometer el tiempo de llenado ventricular; constituyendo una causa de morbimortalidad principalmente en pacientes con cardiopatías congénitas[2].
En relación al manejo de pacientes hemodinámicamente inestables, éstos requieren cardioversión eléctrica. En pacientes usuarios de digoxina, es recomendable evitar la CVE, debido a que su combinación se ha asociado a arritmias ventriculares
malignas. Los pacientes con hemodinamia estable pueden recibir digoxina para aumentar el bloqueo AV, disminuyendo la frecuencia ventricular. Se puede complementar con el uso de propranolol (3 – 4 veces por día). Para prevención de recurrencias puede utilizarse quinidina.
-
Taquicardia ventricular (TV)
Es un ritmo raro en población pediátrica. Puede ser idiopá- tica o expresión de enfermedad cardíaca estructural (ej. cardio- miopatía, miocarditis, tumor cardíaco). Las formas secundarias son más frecuentes que las idiopáticas y tienden a ser de peor pronóstico, que depende del proceso primario. Dentro de las TV idiopáticas se encuentra: TV con origen en tracto salida de ventrículo derecho (58% de los casos), TV fascicular (23%) y TV polimórfica (19%)[2]-[6].
Los signos típicos de TV al EKG son: complejos QRS anchos, eje de QRS diferente al del ritmo sinusal, disociación AV, fusión de ritmos[16]. Estos pacientes deben completar el estudio diagnóstico con ecocardiograma, holter de ritmo, test de esfuerzo y electrolitos plasmáticos; dependiendo del resultado puede ser necesario estudio electrofisiológico u otras imágenes cardíacas.
El manejo depende de la sintomatología asociada; en casos severos (hemodinamia inestable o insuficiencia cardíaca) se requiere cardioversión eléctrica sincronizada, luego se debe iniciar terapia para prevención de recurrencias: lidocaína (1 mg/kg en bolo EV, con eventual repetición a los 5 minutos, seguido de infusión de 20 – 50 mcg/kg/min), sulfato de magnesio (30 – 50 mg/kg en bolo EV) y/o amiodarona. Si la TV es hemodinámi- camente estable, amiodarona es la droga de elección en caso de fracción de eyección reducida (FEr); si la FE está preservada (FEp) puede utilizarse propafenona, flecainida, sotalol, propranolol, metoprolol. En los casos de refractariedad a terapia farmacológica o en los pacientes mayores (peso sobre 30 kg) la TV puede ser tratada con ablación transcatéter[6].
-
Abordaje para identificación de arritmias
En relación al enfrentamiento de taquiarritmias para reconocer el ritmo especifico es recomendable distinguir si son de complejo angosto/ancho y la relación atrioventricular[17].
-
Síndrome QT prolongado – torsade de pointes
El síndrome de QT prolongado o largo (SQTL) corresponde a un desorden de la repolarización ventricular, caracterizado al EKG por un intervalo QT largo. Puede ser de origen congénito (ej. canalopatías) o adquirido en contexto de administración de drogas, trastornos electrolíticos, hipotermia, enfermedades cardiacas, disfunción tiroidea, entre otros. Es una condición arrit- mogénica de particular importancia en la población pediátrica, principalmente en su forma congénita, motivo por el cual se comentará en extenso en esta revisión. Se ha estimado una incidencia de SQTL congénito de 1:10.000 a 1:15.000 pacientes pediátricos, responsables de 3.000 a 4.000 casos de muerte súbita por año en Estados Unidos[18].
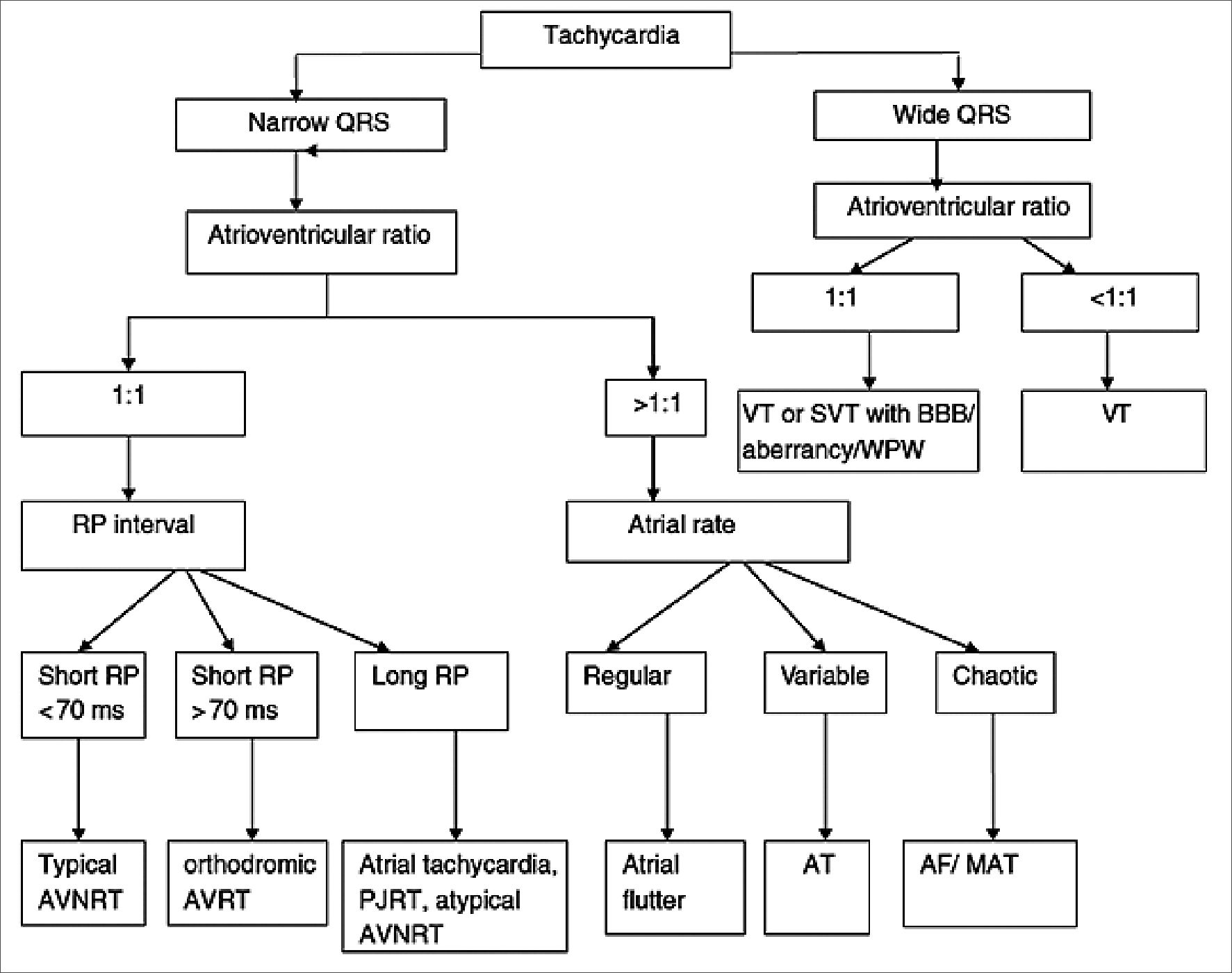
Figura 5. Algoritmo de aproximación a taquiarritmias pediátricas[1].
-
Torsade de pointes
El SQTL posee riesgo de progresión a un tipo de arritmia particular denominada Torsade de Pointes (TdP), que corresponde a una taquicardia ventricular polimorfa potencialmente fatal. Al EKG se describe con complejos QRS cuya amplitud varía gradualmente, oscilando entorno a la línea isoeléctrica. Generalmente, es autolimitada, pero potencialmente puede degenerar en fibrilación ventricular y paro cardiorrespiratorio. Su incidencia ha sido reportada entorno 0,004% a 0,343% por año.
Desde el punto de vista fisiopatológico la prolongación del QT se debe a una disminución de la corriente de salida de potasio o incremento de la corriente de entrada de calcio o sodio durante la fase 3 del potencial de acción en el sistema de conducción cardíaco. La TdP ocurre por un retraso en la repolarización asociado a pospotenciales tempranos. Los pospotenciales corresponden a una despolarización segundaria inapropiada durante la fase 2 o 3 del potencial de acción miocárdico. La disminución en la corriente de salida de potasio causa un incremento en la captura de calcio mediante los canales voltaje dependientes generando una subsecuente liberación de calcio desde el retículo sarcoplásmico, este aumento en calcio citosó- lico genera una nueva corriente de entrada de sodio mediante los intercambiadores sodio – calcio generando una nueva despolarización y un complejo ventricular prematuro[5].
-
Dispersión de repolarización transmural
A pesar de que la prolongación del iQTc es un factor de riesgo para TdP, requiere de la adición de otros elementos, uno de los principales es el aumento de la dispersión de la repolarización transmural (TDR). Al EKG la morfología de la onda T representa el tiempo diferencial intrínseco de la repolarización regional a través del miocardio. El TDR puede ser medido desde el peak de la onda T hasta el final de la onda T (TPE). Los pacientes con SQTL suelen poseer morfología de onda T anormal (ej. bifásica o mellada, ondas T alternantes) además de un TPE máximo y medio mayor, indicando un TDR anormal. El punto de corte del valor de TPE asociado con aumento del riesgo de arritmogenicidad no se ha establecido; existe un metaanálisis de Tse et al., que plantea que el valor de corte de prolongación de TPE para aumentar el riesgo en población general es 113,6 ms, sin embargo, faltan estudios para confirmarlo[5].
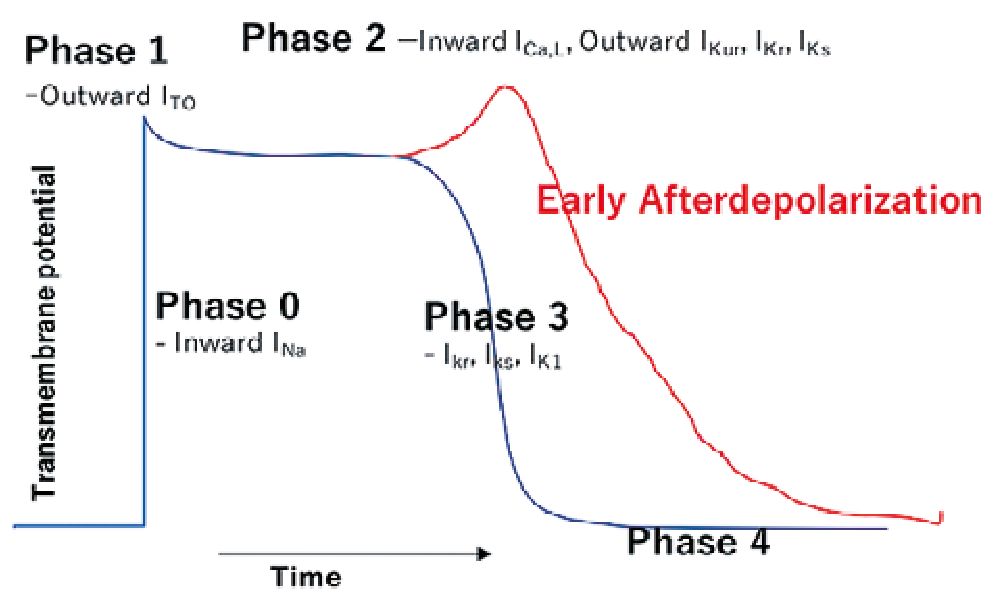
Figura 6. Potencial de acción cardíaco y representación de fenómeno de postpotencial temprano[5].
-
Síndrome QT largo congénito (SQTLc)
Corresponde a la enfermedad genética arritmogénica más común, con una prevalencia estimada de 1:2.000. Se han descrito 17 genes de susceptibilidad con niveles variables de evidencia para explicar la causa de esta condición. Los genotipos más frecuentes son SQTL1, SQTL2 y SQTL3, responsables del 40% – 55%, 30% – 45% y 5% -10% de los casos, respectivamente. Se puede manifestar clinicamente como síncope recurrente, convulsiones, paro cardíaco o muerte súbita. La mortalidad asociada a SQTLc es 0,6% a 2,9% por año vinculado a arritmias malignas. En pacientes con SQTLc sintomático sin tratamiento se describe una tasa de mortalidad de 21% al año posterior al primer episodio de síncope y de 50% a los 10 años versus los pacientes tratados que poseen una mortalidad de 0,05% al año[19].
El SQTL1 es causado por una mutación en el gen KCNQ1 (canal de potasio activado por voltaje, subfamilia KQT, miembro 1; responsable del componente lento de la corriente rectificadora de potasio) ocasionando una disminución de la corriente de salida de potasio durante la fase 2 del PA, generando un retraso en la despolarización ventricular y prolongación de iQTc. Los eventos arritmogénicos son gatillados principalmente por estimulación adrenérgica como en el contexto de ejercicio (se describe que particularmente son gatillados por la natación).
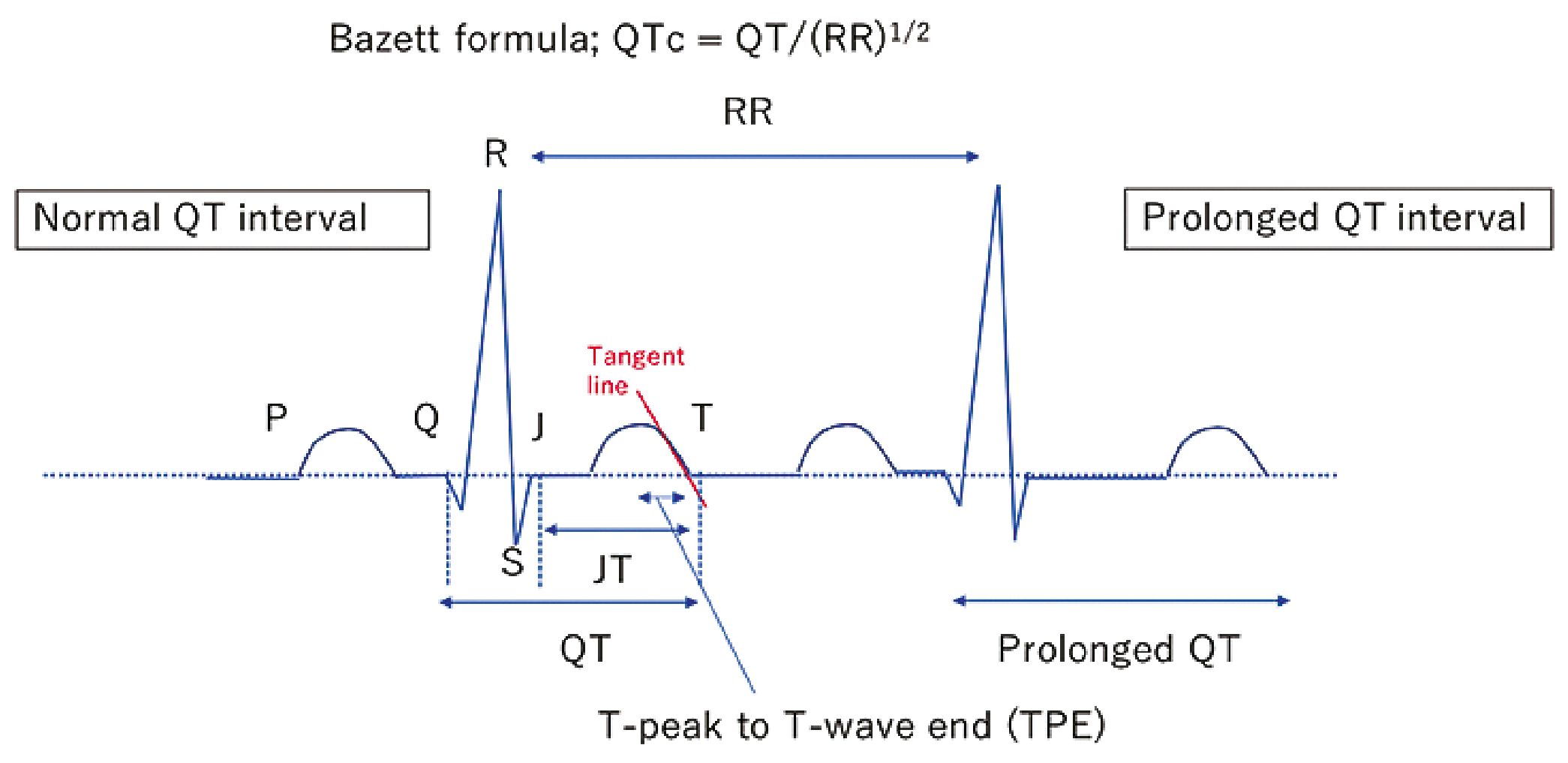
Figura 7. Representación esquemática de EKG e identificación de intervalo QT y TPE[5].
| Tabla 3. Score de Schwartz | |
| Item | Puntaje |
| Hallazgos electrocardiografíasQTc mayor 480 ms | + 3 |
| QTc 460 – 479 ms | + 2 |
| QTc 450 – 459 ms en hombres | + 1 |
| QTc mayor 480 ms en 4 minutos de recuperación de ejercicio | + 1 |
| Torsade de pointes | + 2 |
| Onda T con notch en 3 derivadas | + 1 |
| Onda T alternantes | + 1 |
| Bradicardia (Menor p2 para la edad) | + 0,5 |
| Historia clínica | |
| Síncope (con estrés) | + 2 |
| Síncope (sin estrés) | + 1 |
| Hipoacusia congénita | + 0,5 |
| Historia familiar | |
| Miembro familiar con diagnóstico definitivo de SQTL | + 1 |
| Muerte súbita inexplicada en un familiar en 1er grado menor 30 años | + 0,5 |
Extracto de Wallace E, Howard L, Liu M y cols. Long QT Syndrome: Genetics and Future Perspective. Pediatr Cardiol. 2019 Oct;40(7):1419-1430.
| Tabla 4. Lista de fármacos prolongadores de QT | |
| Clase | Ejemplos |
| Antiarrítmicos | Disopiramida, quinidina, procainamida, sotalol. |
| Antibióticos | Macrólidos, fluoroquinolonas |
| Antifúngicos | Fluconazol, ketoconazol, itraconazol |
| Antimaláricos | Cloroquinina, quinidina |
| Antineoplásicos | Lapatinib, nilotinib, sunitinib, tamoxifeno |
| Antidepresivos | Amitriptilina, imipramina, paroxetina, fluoxetina, doxepina, trimipramina |
| Antipsicóticos | Risperidona, quetiapina, haloperidol, fenotiazinas, Clorpromazina |
| Antihistamínicos | Difenhidramina, terfenadina |
| Antagonistas receptores H2 | Famotidina |
| Broncodilatadores | Salmeterol, metaproterenol, albuterol |
| Anestésicos intravenosos | Metadona, ketamina |
| Anestésicos volátiles | Casi todos los anestésicos volátiles |
| Bloqueadores neuromusculares y reversores | Bloqueadores neuromusculares despolarizantes, anticolinesterásicos/anticolinérgicos (glicopirrolato, atropina, neostigmina) |
| Vasoactivos | Dopamina, dobutamina, epinefrina, norepinefrina |
| Antieméticos | Ondansetrón, droperidol |
| Anestésicos locales | Cocaína |
Extracto de Niimi N, Yuki K, Zaleski K. Long QT Syndrome and Perioperative Torsades de Pointes: What the Anesthesiologist Should Know. J Cardiothorac Vasc Anesth. 2022 Jan;36(1):286-302.
El ejercicio es utilizado como test diagnóstico en individuos con sospecha de SQTL1. Tienden a poseer eventos cardíacos más jóvenes en comparación a otros genotipos. Al EKG se identifican ondas T simétricas de base amplia. El manejo con b – blo- queadores es altamente efectivo. Este genotipo suele además asociarse al síndrome de Jervell – Lange – Nielsen.
El SQTL2 es causado por mutación en el gen KCNH2 (canal de potasio activado por voltaje, subfamilia H, miembro 2), responsable del componente rápido de la corriente rectificadora de potasio; en estos pacientes ésta se encuentra retrasada generando una mayor duración del PA. Los eventos arritmogéni- cos generalmente se producen en contexto de estímulos auditivos principalmente durante período de sueño. Las mujeres postparto que poseen este síndrome poseen un riesgo particular de eventos cardíacos (principalmente los primeros 9 meses). Al EKG se identifican ondas T bífidas o con notch, asimétricas y con baja amplitud.
El SQTL3 es causado por una mutación en el gen SCN5A (canal de sodio activado por voltaje, tipo V, subunidad alfa) que codifica la subunidad alfa del canal Nav1.5 y permite una excesiva corriente de entrada de sodio tardía durante la fase meseta (fase 2) del PA, generando su prolongación. Los eventos cardíacos tienden a ocurrir más tardíamente en la vida y ser de mayor letalidad en comparación a los genotipos 1 y 2. No se han identificado estímulos arritmogénicos específicos, pero estos eventos tienden a asociarse a bradicardia generalmente, durante el reposo o sueño. Al EKG se identifican ondas T picudas y tardías. La respuesta al uso de b – bloqueadores es escasa [18].
Para el diagnóstico de SQTL se puede utilizar:
• Score de riesgo (Schwartz) mayor o igual a 3,5 en ausencia de causa secundaria de prolongación QT.
• Presencia de una mutación patogénica inequívoca de uno de los genes de SQTL.
• Presencia de intervalo QTc (usando fórmula Bazett) mayor o igual a 500 ms en EKG de 12 derivadas repetidos en ausencia de causa secundaria de prolongación QT[20].
El score de Schwartz permite estimar la probabilidad de SQTL; considera historia familiar, historia clínica y hallazgos electrocardiográficos. Se clasifica de la siguiente manera:
• Menor o igual 1 punto: baja probabilidad de SQTL.
• 1,5 a 3 puntos: probabilidad intermedia.
• 3,5 puntos o más: probabilidad alta.
-
Síndrome QT largo adquirido (SQTLa)
Es caracterizado por una prolongación de QT secundaria a estresores exógenos como administración de drogas, trastornos electrolíticos (ej. hipokalemia, hipomagnesemia, hipocloremia e hiponatremia), hipotermia, enfermedades cardíacas (hipertensión, insuficiencia cardíaca, miocardiopatía isquémica, post bypass cardiopulmonar en cirugía cardíaca), injuria cerebrovascular, insuficiencia renal, cirrosis, disfunción endocrina. Algunos factores de riesgo asociados son género femenino e índice de masa corporal elevado.
-
Síndrome QT largo inducido por drogas (SQTLid)
Corresponde a la causa más común de prolongación de QT adquirida. La lista de fármacos que puede causar esta condición es muy amplia y variada (Tabla 4). Los antiarrítmicos, especialmente clase III de la clasificación de Vaughan Williams, son las drogas más asociadas a prolongación de QT[21].
Se ha demostrado que en la mayoría de los casos el mecanismo patogénico corresponde a la inhibición del canal de corriente rectificadora rápida de potasio, codificado por el gen KCNH2, causando un fenotipo similar al SQTL2. El SQTLid se asocia a factores de riesgo ambientales, epigenéticos y genéticos como alta concentración de la droga, administración endovenosa rápida, hipokalemia, hipomagnesemia, género femenino, etnia, bradicardia, reciente conversión desde fibrilación atrial, insuficiencia cardiaca, SQTL subclínico, polimorfismos de genes de SQTL.
A pesar de lo anunciado anteriormente, lo más importante es reconocer precozmente signos de alerta de riesgo de TdP. La American Heart Association y American College of Cardiology Foundation’s han propuesto los siguientes elementos como indicativos de riesgo para desarrollo de arritmias posterior al inicio de una droga asociada a prolongación de QT:
• Aumento de 60 ms en iQTc desde el basal pre administración de la droga.
• Prolongación iQTc sobre 500 ms.
• Distorsión de ondas T – U (exagerado en el latido posterior a una pausa).
• Ondas T alternantes.
• Ectopia ventricular de nuevo inicio.
• Taquicardia ventricular polimórfica no sostenida iniciada en un latido posterior a una pausa[5].
-
Tratamiento TdP
Cuando se gatilla la TdP en contexto de SQTL, se debe administrar un bolo endovenoso o intraóseo de 25 – 50 mg/kg (máximo 2 g) de sulfato de magnesio durante 2 – 3 minutos (o hasta 10 – 20 minutos si paciente está estable), seguido por un bolo adicional posterior a 10 – 15 minutos y luego una infusión de mantención. Este fármaco es utilizado para estabilizar la membrana miocárdica, modulando los canales de sodio, potasio y calcio. Si la TdP es dependiente de bradicardia o pausas, se requiere la instalación de un marcapasos temporal o administración de isoproterenol. En todos los pacientes la causa subyacente de la prolongación del iQTc debe ser identificada y revertida. Cuando la TdP degenera en fibrilación ventricular o cuando existen episodios prolongados refractarios a otra terapia se debe utilizar la cardioversión eléctrica. En relación al manejo hidroelectrolítico el potasio debe mantenerse en nivel normal – alto[22].
-
Bradiarritmias
Bradicardia se define como una frecuencia cardíaca menor al límite normal para la edad del paciente. Los mecanismos responsables de esta condición son depresión de la actividad del marcapasos natural en el nodo sinusal y bloqueos del sistema de conducción[6].
En la población pediátrica la bradicardia puede asociarse a estimulación vagal, elevación aguda de presión intracraneal, acidosis, hipoxemia; siendo esta última la causa más frecuente.
-
Bradicardia sinusal
Corresponde a una FC menor a la normal para la edad con ondas P que preceden a cada complejo QRS. Es predominantemente una entidad benigna que se presenta con mayor frecuencia en atletas y durante el sueño, sin embargo, se puede asociar a ciertas condiciones patológicas como aumento agudo de presión intracraneal (parte de triada de Cushing), hipoxemia, hiperkalemia, hipercalcemia, hipotermia, hipotiroidismo y uso de medicamentos (digitálicos, b-bloqueadores)[23].
Es importante diferenciar la bradicardia sinusal de bradicardia de la unión, en el EKG ésta no presenta ondas P o son invertidas postcomplejos QRS que presentan configuración normal, pero con frecuencias que oscilan entre 40 y 60 lpm[2].
El manejo está orientado a tratar la causa subyacente, al ser la hipoxemia la causa más frecuente, se deben iniciar medidas de asistencia de ventilación y oxigenación adecuadas; si persiste la bradicardia sintomática a pesar de medidas iniciales, se debe continuar con manejo farmacológico con atropina (0,02 mg/kg EV) o epinefrina (10 mcg/kg EV). Compresiones torácicas deben iniciarse con FC menor a 60 lpm y compromiso hemodinámico.
-
Alteraciones de conducción eléctrica
-
Bloqueo aurículo – ventricular de 1er grado
Corresponde a un retraso anormal en la conducción a través del nodo aurículo-ventricular (AV). Se manifiesta al EKG como un intervalo PR prolongado para la edad, se mantiene el ritmo sinusal y la configuración normal del complejo QRS.
Suele corresponder a un hallazgo electrocardiográfico, sin embargo, puede estar asociado a enfermedades infecciosas, miocarditis (en contexto de fiebre reumática o enfermedad de Lyme), miocardiopatías y cardiopatías congénitas (ej. comunicación interauricular o anomalía de Ebstein).
-
Bloqueo aurículo – ventricular de 2do grado
Existen 2 tipos: Mobitz I y Mobitz II.
El bloqueo AV Mobitz I se produce por un aumento del período refractario a nivel del nodo AV. Se manifiesta al EKG como un intervalo PR que se va prolongando progresivamente hasta que no conduce a un complejo QRS, entidad conocida como fenómeno de Wenckebach. Suele ocurrir entre 3 a 6 ciclos cardiacos seguido de una pausa; luego se reinicia el ciclo. La configuración del complejo QRS es normal.
Puede ser un hallazgo en individuos sanos o asociado a patologías como miocarditis, infarto miocárdico, miocardiopatías, cardiopatías congénitas, toxicidad por digitálicos o dentro del posoperatorio de cirugía cardíaca.
El bloqueo AV Mobitz II se produce por una alteración de la conducción a nivel del haz de His, con una prolongación del periodo refractario en el sistema His – Purkinje. En el EKG existe una conducción AV normal con un intervalo PR normal o bloqueo completo de la conducción; fenómeno conocido como “todo o nada”; la frecuencia ventricular depende del número de impulsos atriales conducidos.
-
Bloqueo aurículo – ventricular de 3er grado
También conocido como bloqueo AV completo, se produce cuando ninguno de los impulsos atriales se conduce a los ventrículos. Existe pérdida completa de la conducción del ritmo desde un marcapasos auricular funcional, permitiendo la actividad del marcapasos ventricular.
En el EKG, las ondas P están completamente disociadas del complejo QRS; el ritmo auricular y ventricular es regular, por lo que, se mantiene un intervalo PP y RR regular. La duración del complejo QRS suele ser normal si es que el bloqueo es proximal al haz de His.
Este bloqueo puede corresponder a una anomalía aislada, ser de origen congénito, asociado a lesiones estructurales como transposición de grandes arterias o desórdenes del tejido conectivo materno, o adquirido principalmente asociado al posoperatorio de cirugía cardíaca, especialmente aquellas que involucren sutura de tejido auricular, o a otras condiciones como patológicas infecciosas (miocarditis, enfermedad de Lyme, fiebre reumática, difteria), infamatorias (enfermedad de Kawasaki y lupus eritematoso sistémico), infarto miocárdico, tumor cardíaco, distrofias musculares e hipocalcemia[2],[24].
Los pacientes con bloqueo AV 1er grado en su gran mayoría son asintomáticos, pero tienen el potencial riesgo de progresar a otro de mayor grado; los de 2do grado Mobitz II son los de mayor riesgo de progresión a bloqueo AV completo; éstos pacientes pueden presentarse con signos de insuficiencia cardíaca congestiva, especialmente si el bloqueo se produce durante el periodo de lactante; los pacientes de mayor edad pueden presentar fatiga, mareo, escasa tolerancia al ejercicio, confusión, síncope, ataques de Stokes – Adams o incluso muerte súbita.
En relación al manejo, los pacientes con BAV 1er grado no requieren tratamiento. Los pacientes con BAV 2do grado Mobitz II y 3er grado requieren instalación de marcapasos; de terapia de soporte pueden requerir administración de atropina o isoproterenol[25].
-
Consideraciones de arritmias pediátricas en perioperatorio
En el contexto perioperatorio de pacientes pediátricos sin cardiopatía congénita la taquicardia sinusal es la arritmia más
Figura 8. EKG de bloqueo AV completo[2].
frecuente; ésta puede ser considerada como una respuesta adaptativa a situaciones de estrés, ansiedad, dolor, infecciones o asociadas a medicamentos. En relación a las disrritmias patológicas, la taquicardia supraventricular es la más frecuente (60% – 80% de los casos), en general suele tener mínimos efectos hemodinámicos, sin embargo, si es sostenida puede ocasionar deterioro de función cardiovascular. El halotano ha sido históricamente el agente anestésico con mayor potencial arrítmico, sin embargo, otros anestésicos tienen efectos deletéreos. Tiopental y propofol causan retraso en conducción por nodo AV; los anestésicos inhalados tienen efecto a nivel de conducción atrial, repolarización ventricular y función del nodo AV de forma concentración dependiente[26].
Existen escasos reportes de casos de arritmias pediátricas en contexto perioperatorio de pacientes sin cardiopatías congé- nitas. El 2014, se publicó en Journal of Clinical Anesthesia una serie de 36 pacientes con sospecha de taquicardia supraventricular intraoperatoria de un total de 285.353 que recibieron anestesia en Children’s Hospital of Philadelphia desde julio de 1998 hasta junio de 2011: 22 fueron considerados de “alta probabilidad” y 14 de “baja probabilidad”, según las características del evento (inicio súbito, término súbito tras maniobras va- gales o manejo farmacológico, FC alcanzada en el evento). Los casos de alta probabilidad ocurrieron durante las distintas fases de la anestesia y ninguno se asoció a inestabilidad hemodinámica. Los pacientes de “alta probabilidad” se sometieron principalmente a cirugía general, ortopedia y otorrinolaringología; sobre el 50% de los casos se produjo en la fase de mantención, sin embargo, también hubo casos en inducción y emergencia. Los fármacos de inducción con mayor asociación fueron sevo- fluorano, tiopental, propofol; la mayoría de los casos recibieron desfluorano para la mantención. El manejo incluyó maniobras vagales (12/22) (la maniobra más utilizada fue masaje carotídeo con respuesta de 75% de los casos) y antiarrítmicos (11/22), el fármaco de primera línea fue adenosina, con respuesta de todos los casos (a excepción de 1 que requirió una segunda dosis), otros fármacos utilizados fueron esmolol y propranolol. Tres pacientes requirieron cuidados posoperatorios en UCI y 3 fueron dados de alta con administración de antiarrítmicos orales[27].
Como fue mencionado la taquicardia supraventricular es la disrritmia patológica más frecuente en el contexto perioperatorio de niños sin cardiopatía congénita; ésta se ha asociado principalmente a la estimulación simpática vinculada a la respuesta inflamatoria de la cirugía; se han reconocido múltiples factores de riesgo que se detallan a continuación:
• Factores anestésicos: depresión miocárdica asociado a anestésicos, uso de inótropos, hipervolemia, PEEP excesivo, shock, manipulación de catéteres vasculares, intoxicación por anestésicos locales.
• Factores quirúrgicos: dolor, trauma, anemia, inflamación local y sistémica (elevación IL – 6), manipulación mediastínica.
• Factores médicos agudos: hipoxia, hipovolemia, alteraciones ELP, acidosis respiratoria y metabólica, neumonía, neumotórax, sepsis, embolía pulmonar, hipohiperglicemia, hipo-hipertermia, miocarditis, pericarditis, drogas de abuso.
• Factores médicos crónicos: distensión atrial, hipoxia crónica (SAHOS), cardiomiopatía, vías conducción accesorias, hipertensión pulmonar, hipohipertiroidismo, malignidad asocia- da[28].
-
Síndrome QT prolongado en contexto perioperatorio
En el 2011, en la revista Anesthesia & Analgesia fue publicado un artículo de interés en el cual se identificó un total de 76 pacientes pediátricos con diagnóstico de síndrome QT prolongado congénito que recibieron en total 114 anestesias. El objetivo fue identificar la ocurrencia de eventos adversos (EA) perioperatorios en relación a arritmias, definido como desarrollo de cualquier arritmia que requiera tratamiento antiarrítmico o cardioversión eléctrica, o con inestabilidad hemodinámica, necesidad de prolongación de la hospitalización o admisión en UCI por el evento. En las exposiciones a anestesia general, en 10 ocasiones se utilizó anestesia total intravenosa (TIVA), 1 ocasión sedación y en el resto halogenados (en 29,1% se utilizó desfluorano, 48,5% isofluorano y 22,3% sevofluorano para mantención de la anestesia). De las 114 exposiciones, solo se identificaron 2 EA definitivos y 1 probable, lo que dio una incidencia de 2,63%. De éstos 2 fueron con exposición a isofluorano y el otro a desfluorano. Los 3 casos fueron durante la emergencia de la anestesia general (la MAC fue menor a 0,25); ocurrieron cercano a la administración de reversores de bloqueo neuromuscular (combinación anticolinesterásico/anti- colinégico) y al antiemético ondansetrón. De los 3 eventos, 1 fue descrito como TdP y manejado con sulfato de magnesio, los otros como taquicardia ventricular. En la conclusión del trabajo se destaca que a pesar de que la exposición a halogenados puede prolongar el iQT, es el sinergismo de múltiples drogas lo que genera mayor riesgo arritmogénico en estos pacientes[29].
-
Consideraciones anestésicas
No existen guías de consenso para el manejo de pacientes con SQTL, en general éste se basa en reporte o serie de casos. En el preoperatorio se recomienda la obtención de historia clínica y examen físico completo, indagar por síntomas como síncope, sordera o historia familiar de muerte súbita. Se debe solicitar EKG en todos los pacientes con historia de SQTL congé- nito, adquirido o TdP, con una interconsulta a electrofisiólogo de estar disponible. Además, solicitar electrolitos plasmáticos, debido a que la hipokalemia, hipomagnesemia e hipocalcemia se asocian con retraso de repolarización miocárdica, por lo que deben ser manejadas activamente previo al procedimiento, con objetivos de kalemia sobre 4,5 mEq/L y magnesemia sobre 2,0 mg/dl.
Si el paciente es usuario de betabloqueadores, éstos deben ser mantenidos, sin embargo, si no ha recibido este tratamiento, no se recomienda necesariamente su inicio debido a que en ciertas formas como SQTL3 puede ser deletéreo. Por último, evitar los fármacos que puedan prolongar QT (Tabla 4).
En relación al intraoperatorio como medidas generales:
• Abogar por un pabellón en silencio (existen subtipos de SQTLc que se manifiestan con estímulos auditivos).
• Controlar la ansiedad y dolor que pueden ser arritmogé- nicos (recomendada la premedicación, principalmente con midazolam).
• Mantener la normotermia con medidas de calefacción pasivas y activas, manteniendo temperatura central entorno a 37 grados Celsius (hipotermia puede generar prolongación de QT).
• Evitar hipoxia e hipercapnia (por el aumento del tono sim-
pático asociado).
• Tomar precauciones en pacientes portadores de marcapa- sos (MCP) o desfibriladores implantables (CDI). En caso de MCP idealmente programar en modo VOO o DOO para prevenir la interferencia con señales electromagnéticas externas y en caso de CDI idealmente desactivar programación e instalar parches de desfibrilación[22].
Con respecto a los fármacos utilizados en la inducción de anestesia general, se ha demostrado cuales son los que tienen mayor potencial de prolongación de QT, la precaución debe estar en el sinergismo para ese efecto. Un estudio reportó que aproximadamente el 80% de los pacientes desarrollan una prolongación del QT entorno a 23 ms (IC 95% 20 – 25 ms) asociado al efecto acumulado de las drogas de la inducción de la anestesia. En la Tabla 5 se indican los fármacos recomendados [22].
-
Fármacos utilizados en anestesia y su relación con arritmias
Los halogenados (principalmente sevofluorano, halotano e isofluorano) pueden retrasar la repolarización ventricular pro longando el intervalo QT; además pueden generar antagonismo de canales de calcio e incrementar la depolarización en fibras de Purkinje. El propofol en general no modifica la FC, pero puede generar bradicardia al estimular receptores muscaríni- cos, posee escaso efecto en la conducción cardiaca, genera ino- tropismo negativo debido principalmente a reducción del tono simpático y aumento de sensibilidad parasimpática. Ketamina puede causar disrritmia nodal, incrementando la frecuencia de descarga de nodo sinusal por activación simpática, a su vez disminuye la contractilidad miocárdica. El midazolam posee efecto bifásico en FC, alterando el tono simpático y parasimpático, sin embargo, su efecto en disrritmias no está claro.
Los opioides, excepto la meperidina, reducen la frecuencia cardíaca por un mecanismo central, reduciendo el tono simpático e incrementando el vagal, disminuyendo la frecuencia de descarga de nodo sinusal y prolongando la conducción AV. Fentanilo posee efecto directo en nodo sinusal[30].
Drogas que inducen bradiarritmias incluyen beta bloquea- dores, bloqueadores de canales de calcio, clonidina y dexmede- tomidina (puede presentarse en 5% de los pacientes, debiera ser evitada en los que tengan bloqueos cardíacos).
En relación a los bloqueadores neuromusculares, los despolarizantes como la succinilcolina, pueden activar receptores muscarínicos o nicotínicos generando taquicardia o bradicardia,
Tabla 5. Fármacos utilizados en anestesia sugeridos en SQTL

Extracto de O’Hare M, Maldonado Y, Munro J y cols. Perioperative management of patients with congenital or acquired disorders of the QT interval. Br J Anaesth. 2018 Apr;120(4):629-644.
| Tabla 6. Interacción entre anestésicos y antiarrítmicos | |
| Adenosina | Vasodilatación asociada a isofluorano y bloqueo neuroaxial Broncoconstricción con neostigminaAsistolía con neostigmina, dexmedetomidina y opioides Antagonismo con aminofilina |
| Amiodarona | Depresión miocárdica y vasodilatación con agentes inhalados |
| DigoxinaBeta bloqueadores | Bradicardia potenciada con halotano y succinilcolinaDepresión miocárdica potenciada con halotano Broncoconstricción con neostigmina y atracurio |
| QuinidinaProcainamida | Prolonga efectos de bloqueo neuromuscularAntagoniza neostigmina
Disrritmia ventricular combinada con fenotiazidas |
| Bloqueadores canales de calcio | Bradicardia y depresión miocárdica con halogenados y dantroleno Potencia bloqueo neuromuscular |
| Sulfato de magnesio Lidocaína | Prolonga efectos de bloqueo neuromuscular Potencia el bloqueo simpático con opioides |
Extracto de Lorentz MN, Vianna BS. Cardiac dysrhythmias and anesthesia. Rev Bras Anestesiol. 2011 Nov-Dec;61(6):798-813.
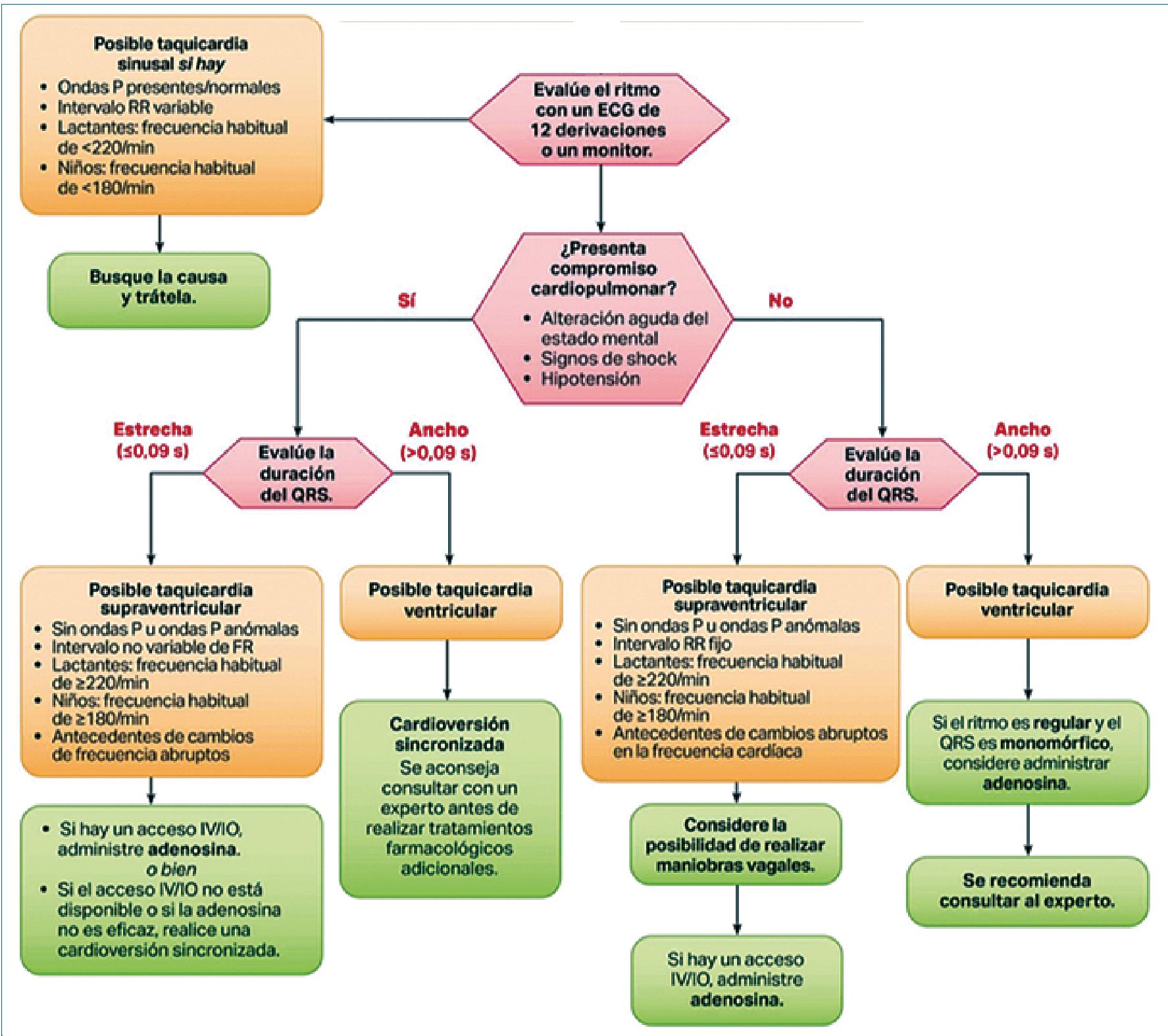
Figura 9. Algoritmo AHA de taquicardia pediátrica con pulso (traducción en español)[32].
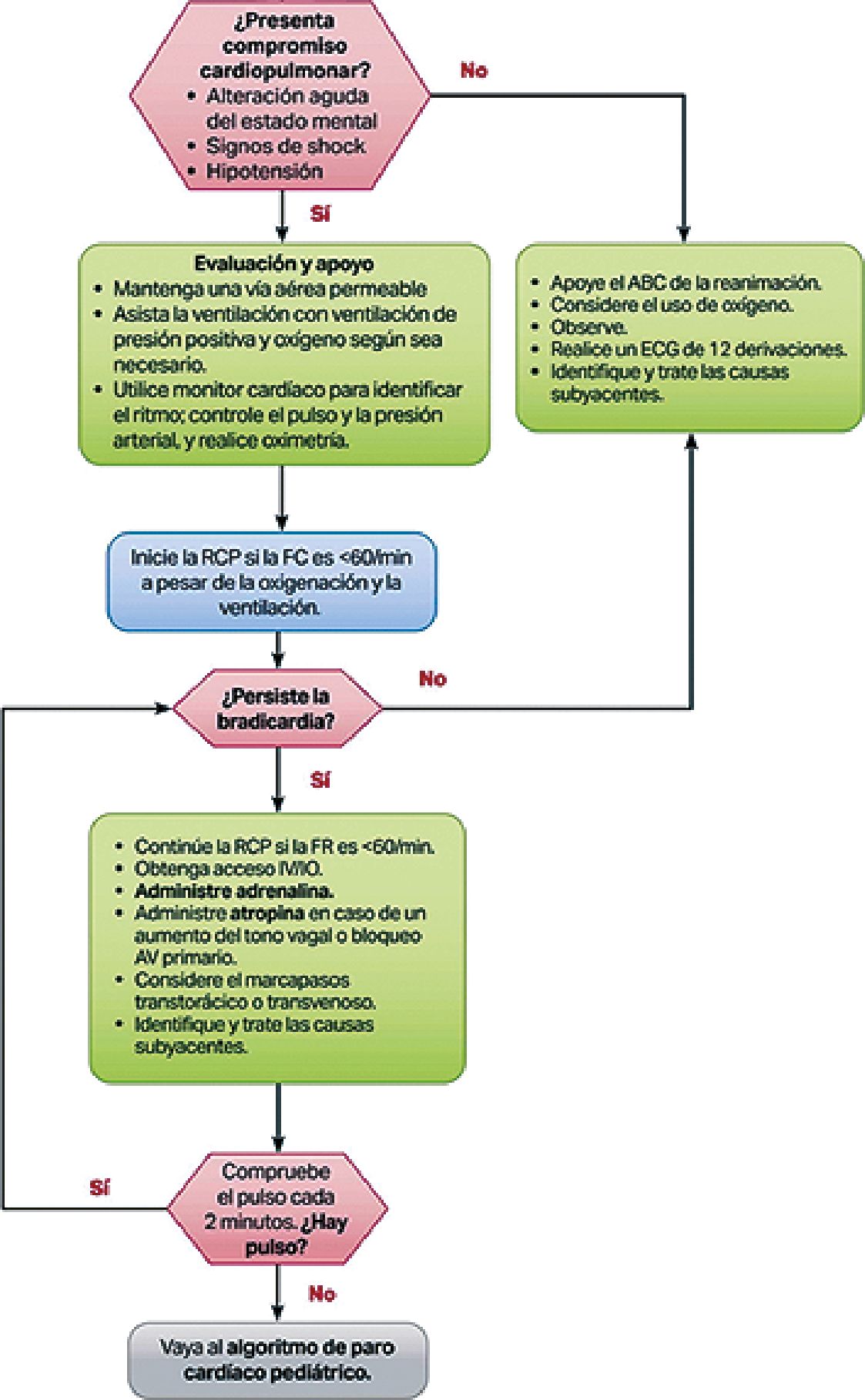
Figura 10. Algoritmo AHA de bradicardia pediátrica con pulso (traducción en español)[32].
pudiendo llegar a la asistolía. El pancuronio induce la liberación de catecolaminas e incrementa el automatismo, pudiendo generar taquicardia. El vecuronio disminuye el automatismo por bloqueo simpático, pudiendo generar bradicardia y ritmo de la unión.
Además, es interesante revisar la interacción que puede producirse entre fármacos antiarrítmicos y los utilizados en la práctica habitual en anestesiología[31].
-
Identificación y manejo agudo de arritmias
Un enfoque práctico para el abordaje agudo de las arritmias es el planteado por la American Heart Association actualizado el año 2020[32].
En relación a las taquiarritmias se indica una evaluación inicial y medidas básicas: mantención de vía aérea permeable, administración de oxígeno y apoyo de ventilación de ser necesario; monitorización para identificación de ritmo, obtención de acceso intravenoso/óseo.
Para una rápida toma de decisiones entorno al manejo se sugiere sistemáticamente evaluar:
• Presencia de taquicardia sinusal.
• Presencia de compromiso cardiopulmonar.
• Duración de complejo QRS (límite 90 mseg).
En pacientes con compromiso cardiopulmonar que requieran cardioversión sincronizada, se recomienda iniciar con 0,5 – 1 J/kg y aumentar hasta 2 J/kg, con sedación adecuada del paciente.
En relación al uso de adenosina considerar que se utiliza tanto en pacientes con QRS estrecho como ancho ante la posibilidad de taquicardia supraventricular con conducción aberrante. Se administra 1er bolo rápido de 0,1 mg/kg (máximo 6 mg), luego un 2do bolo de 0,2 mg/kg (máximo 12 mg).
En relación a las bradiarritmias se debe identificar si existe compromiso cardiopulmonar, ante el cual se deben iniciar precozmente maniobras de reanimación, considerando que la principal causa es la hipoxia: mantener vía aérea permeable, asistir ventilación con presión positiva, identificar precozmente ritmo.
La adrenalina se puede utilizar vía EV/IO con dosis de 0,01 mg/kg. Repetir cada 3 a 5 minutos. Además, se puede administrar por vía endotraqueal con dosis de 0,1 mg/kg.
La atropina se puede utilizar vía EV/IO con dosis de 0,02 mg/ kg, se puede repetir una vez, con dosis máxima de 0,5 mg.
-
Conclusiones
Las disrritmias patológicas corresponden a una condición infrecuente en el contexto de población pediátrica general (sin diagnóstico de cardiopatía congénita), sin embargo, es perentorio su reconocimiento precoz y manejo oportuno, para lo cual es necesario un enfoque sistematizado en el análisis de la sinto- matología de los pacientes, trazado electrocardiográfico y gravedad clínica (compromiso sensorio y hemodinámico). Posterior a la taquicardia sinusal, la taquicardia supraventricular continúa siendo la condición más frecuente, con un manejo escalonado que ha sido descrito ampliamente en la literatura.
No todas las disrritmias en el paciente pediátrico requieren un estudio completo y valoración por cardiólogo infantil, siendo algunas de ellas un hallazgo electrocardiográfico sin un mal pronóstico.
El síndrome de QT prolongado congénito es una condición de particular importancia por su presentación durante edad pediátrica, el sustrato genético se ha ido estudiando logrando identificar los distintos fenotipos y permitiendo una mejor caracterización de su presentación y comportamiento. Existen múltiples herramientas para un diagnóstico precoz basado en el análisis de mutaciones genéticas o en parámetros clínicos (utilizando por ej. score de Schwartz). Es necesario reconocer el potencial desarrollo de arritmia maligna Torsades de Pointes para un manejo oportuno basado en sulfato de magnesio.
-
Referencias
1. Rohit M, Kasinadhuni G. Management of Arrhythmias in Pediatric Emergency. Indian J Pediatr. 2020 Apr;87(4):295–304. https://doi.org/10.1007/s12098-020-03267-2 PMID:32166608
2. Doniger SJ, Sharieff GQ. Pediatric dysrhythmias. Pediatr Clin North Am. 2006 Feb;53(1):85-105, vi. https://doi.org/10.1016/j.pcl.2005.10.004..
3. Ishaque S, Akhtar S, Ladak AA, Martins RS, Memon MK, Kazmi AR, et al. Early postoperative arrhythmias after pediatric congenital heart disease surgery: a 5-year audit from a lower- to middle-income country. Acute Crit Care. 2022 May;37(2):217–23. https://doi.org/10.4266/acc.2020.00990 PMID:35172530
4. Sharieff GQ, Rao SO. The pediatric ECG. Emerg Med Clin North Am. 2006 Feb;24(1):195-208, vii-viii. https://doi.org/10.1016/j.emc.2005.08.014..
5. Niimi N, Yuki K, Zaleski K, Long QT. Long QT Syndrome and Perioperative Torsades de Pointes: What the Anesthesiologist Should Know. J Cardiothorac Vasc Anesth. 2022 Jan;36(1):286–302. https://doi.org/10.1053/j.jvca.2020.12.011 PMID:33495078
6. Drago F, Battipaglia I, Di Mambro C. Neonatal and Pediatric Arrhythmias: Clinical and Electrocardiographic Aspects. Card Electrophysiol Clin. 2018 Jun;10(2):397–412. https://doi.org/10.1016/j.ccep.2018.02.008 PMID:29784491
7. Case CL. Diagnosis and treatment of pediatric arrhythmias. Pediatr Clin North Am. 1999 Apr;46(2):347–54. https://doi.org/10.1016/S0031-3955(05)70122-X PMID:10218079
8. Deal BJ, Mavroudis C, Jacobs JP, Gevitz M, Backer CL. Arrhythmic complications associated with the treatment of patients with congenital cardiac disease: consensus definitions from the Multi-Societal Database Committee for Pediatric and Congenital Heart Disease. Cardiol Young. 2008 Dec;18(S2 Suppl 2):202–5. https://doi.org/10.1017/S104795110800293X PMID:19063792
9. Smith AH. Arrhythmias in Cardiac Critical Care. Pediatr Crit Care Med. 2016 Aug;17(8 Suppl 1):S146–54. https://doi.org/10.1097/PCC.0000000000000817 PMID:27490593
10. Hanna CM, Greenes DS. How much tachycardia in infants can be attributed to fever? Ann Emerg Med. 2004 Jun;43(6):699–705. https://doi.org/10.1016/j.annemergmed.2003.10.002 PMID:15159699
11. Moffett BS, Salvin JW, Kim JJ. Pediatric Cardiac Intensive Care Society 2014 Consensus Statement: Pharmacotherapies in Cardiac Critical Care Antiarrhythmics. Pediatr Crit Care Med. 2016 Mar;17(3 Suppl 1):S49–58. https://doi.org/10.1097/PCC.0000000000000620 PMID:26945329
12. Ko JK, Deal BJ, Strasburger JF, Benson DW Jr. Supraventricular tachycardia mechanisms and their age distribution in pediatric patients. Am J Cardiol. 1992 Apr;69(12):1028–32. https://doi.org/10.1016/0002-9149(92)90858-V PMID:1561973
13. de Caen AR, Kleinman ME, Chameides L, Atkins DL, Berg RA, Berg MD, et al.; Paediatric Basic and Advanced Life Support Chapter Collaborators. Part 10: Paediatric basic and advanced life support: 2010 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations. Resuscitation. 2010 Oct;81 Suppl 1:e213–59. https://doi.org/10.1016/j.resuscitation.2010.08.028 PMID:20956041
14. Dixon J, Foster K, Wyllie J, Wren C. Guidelines and adenosine dosing in supraventricular tachycardia. Arch Dis Child. 2005 Nov;90(11):1190–1. https://doi.org/10.1136/adc.2005.077636 PMID:16243875
15. Ratnasamy C, Rossique-Gonzalez M, Young ML. Pharmacological therapy in children with atrioventricular reentry: which drug? Curr Pharm Des. 2008;14(8):753–61. https://doi.org/10.2174/138161208784007644 PMID:18393874
16. Fazio G, Visconti C, D’Angelo L, Novo G, Barbaro G, Novo S. Pharmacological therapy in children with atrial fibrillation and atrial flutter. Curr Pharm Des. 2008;14(8):770–5. https://doi.org/10.2174/138161208784007707 PMID:18393877
17. Srinivasan C. Diagnosis and Acute Management of Tachyarrhythmias in Children. Indian J Pediatr. 2015 Dec;82(12):1157–63. https://doi.org/10.1007/s12098-015-1881-5 PMID:26411729
18. Wallace E, Howard L, Liu M, O’Brien T, Ward D, Shen S, et al. Long QT Syndrome: Genetics and Future Perspective. Pediatr Cardiol. 2019 Oct;40(7):1419–30. https://doi.org/10.1007/s00246-019-02151-x PMID:31440766
19. Vignati G. Pediatric arrhythmias: which are the news? J Cardiovasc Med (Hagerstown). 2007 Jan;8(1):62–6. https://doi.org/10.2459/01.JCM.0000247438.12817.9e PMID:17255819
20. Schwartz PJ, Crotti L, Insolia R. Long-QT syndrome: from genetics to management. Circ Arrhythm Electrophysiol. 2012 Aug;5(4):868–77. https://doi.org/10.1161/CIRCEP.111.962019 PMID:22895603
21. Gupta A, Lawrence AT, Krishnan K, Kavinsky CJ, Trohman RG. Current concepts in the mechanisms and management of drug-induced QT prolongation and torsade de pointes. Am Heart J. 2007 Jun;153(6):891–9. https://doi.org/10.1016/j.ahj.2007.01.040 PMID:17540188
22. O’Hare M, Maldonado Y, Munro J, Ackerman MJ, Ramakrishna H, Sorajja D. Perioperative management of patients with congenital or acquired disorders of the QT interval. Br J Anaesth. 2018 Apr;120(4):629–44. https://doi.org/10.1016/j.bja.2017.12.040 PMID:29576105
23. García – Arreola D, Alcántara – Morales MA. Bradicardia en el niño durante anestesia general. Revista mexicana de anestesiología. 2015; 38 (1): S107 – S109.
24. Jaeggi ET, Hamilton RM, Silverman ED, Zamora SA, Hornberger LK. Outcome of children with fetal, neonatal or childhood diagnosis of isolated congenital atrioventricular block. A single institution’s experience of 30 years. J Am Coll Cardiol. 2002 Jan;39(1):130–7. https://doi.org/10.1016/S0735-1097(01)01697-7 PMID:11755298
25. Silvetti MS, Di Carlo D, Ammirati A, Placidi S, Di Mambro C, Ravà L, et al. Left ventricular pacing in neonates and infants with isolated congenital complete or advanced atrioventricular block: short- and medium-term outcome. Europace. 2015 Apr;17(4):603–10. https://doi.org/10.1093/europace/euu180 PMID:25115169
26. Morrison DE, Wang SM. Cardiac dysrhythmias in pediatric patients during general anesthesia. J Clin Anesth. 2014 Jun;26(4):255–6. https://doi.org/10.1016/j.jclinane.2014.04.007 PMID:24927656
27. Cripe CC, Patel AR, Markowitz SD, Behringer TS, Litman RS. Supraventricular tachycardia during pediatric anesthesia: a case series and qualitative analysis. J Clin Anesth. 2014 Jun;26(4):257–63. https://doi.org/10.1016/j.jclinane.2013.11.020 PMID:24882607
28. Stewart AM, Greaves K, Bromilow J. Supraventricular tachyarrhythmias and their management in the perioperative period. Contin Educ Anaesth Crit Care Pain. 2015 Apr;15(2):90–7. https://doi.org/10.1093/bjaceaccp/mku018.
29. Nathan AT, Berkowitz DH, Montenegro LM, Nicolson SC, Vetter VL, Jobes DR. Implications of anesthesia in children with long QT syndrome. Anesth Analg. 2011 May;112(5):1163–8. https://doi.org/10.1213/ANE.0b013e3182121d57 PMID:21346158
30. Barnes BJ, Hollands JM. Drug-induced arrhythmias. Crit Care Med. 2010 Jun;38(6 Suppl):S188–97. https://doi.org/10.1097/CCM.0b013e3181de112a PMID:20502173
31. Lorentz MN, Vianna BS. Cardiac dysrhythmias and anesthesia. Rev Bras Anestesiol. 2011;61(6):798–813. https://doi.org/10.1016/S0034-7094(11)70090-3 PMID:22063382
32. Topjian A, Raymond T, Atkins D, Chan M, Duff JP, Joyner BL Jr, et al. Atkins D y cols. Part 4: Pediatric Basic and Advanced Life Support: 2020 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 2020 Oct;142(16 Suppl 2):S469–523. https://doi.org/10.1161/CIR.0000000000000901 PMID:32967446

 ORCID
ORCID