Ismael Puig1,*, Joaquín Gutiérrez2, Ana Guillén3
Recibido: 08-06-2023
Aceptado: 02-07-2023
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 2 pp. 192-195|https://doi.org/10.25237/revchilanestv53n2-14
PDF|ePub|RIS
Return of consciousness during resuscitation compressions an approach to its phenomenology. Case report
Abstract
Introduction: High-quality chest compressions can lead to the return of consciousness in patients experiencing cardiac arrest. We present a case of a 52-year-old patient with stage D heart failure who suffered a cardiac arrest and experienced a return of consciousness through chest compressions. Additionally, possible explanations for this phenomenon are discussed.
Resumen
Introducción: Las compresiones torácicas de buena calidad pueden producir retorno de la conciencia en pacientes con paro cardiorrespirato- rio. Se presenta un caso de un paciente de 52 años con insuficiencia cardíaca estadio D que desarrolla un paro cardiorrespiratorio y retorno de la conciencia con compresiones torácicas. Se presenta además posibles explicaciones del fenómeno.
Introducción
-
Caso clínico
Las compresiones torácicas son utilizadas en pacientes con paro cardiorrespiratorio en un intento de restaurar la circulación de sangre oxigenada hacia órganos vitales[1], principalmente corazón y cerebro, en un esfuerzo de detener los procesos degenerativos que acompañan a la isquemia e hipoxia hasta que se restaure la circulación espontánea. Es durante este momento en que se puede producir retorno de la conciencia durante las compresiones por restauración artificial de la perfusión cerebral. Esto puede causar desconcierto e interrupciones en los reanimadores si no están familiarizados con el fenómeno.
Describimos un caso de un paciente de sexo masculino de 52 años, con antecedentes de tabaquismo, insuficiencia cardíaca avanzada estadio D de la clasificación de American College of Cardiology y American Heart Association, hipertensión arterial, cardiopatía isquémica y anticoagulación, medicado con digoxina, acenocumarol, enalapril, bisoprolol, atorvastatina y aspirina que consulta por disnea súbita clase funcional IV y dolor precordial tipo opresivo de 5 h de evolución que lo despierta durante la madrugada y no lo deja tomar su medicación habitual. Sus signos vitales al ingreso son Frecuencia cardíaca (FC) 92lpm, Tensión arterial (TA): 85/30mmHg, Frecuencia Respiratoria (FR): 28 rpm, Temperatura (T): 35°C y saturación de oxígeno (SO2): 89% aire ambiente y 98% con oxígeno (O2) con máscara con reservorio. El paciente se encontraba colaborador, con cianosis periférica, yugulares no ingurgitadas, sin edemas, murmullo vesicular presente y sin estertores pulmonares.
El ECG de ingreso muestra FC: 92 latidos por minuto, ritmo sinusal, onda p: 0,08”; con signos de crecimiento auricular izquierdo; pQ 0,20” p; eje -60°, ST isoeléctrico, T simétricas V2-V5; patrón QS V1-V2; QT 0,36” QTc: 0,45” (Figura 1).
Rx tórax: infiltrado alveolar bilateral con broncograma aéreo basal derecho, cardiomegalia grado III (Figura 2).
Laboratorio: CK 90, MB 24 (27%), PCR 1,3; ProBNP 13.538.
En el Ecocardiograma de dos semanas previas:
• Dilatación de Ventrículo izquierdo con función disminuida en forma severa (diámetro telediastólico 8 cm, diámetro te- lesistólico 7 cm; FEy 27%).
• Dilatación de aurícula izquierda (antero-posterior 3,2 cm; superficie 27cm2).
• Insuficiencia mitral leve.
Cinecoronagriografía previa: Coronaria derecha dominante con una lesión que compromete su luz en 100%, sin flujo an- terógrado, con circulación colatareal homo y heterocoronaria. Descendente anterior: lesión en tercio medio que compromete su luz en 100%. Con flujo anterógrado. Con circulación colateral homocoranaria. Circunfleja: Lesión en tercio proximal que compromete la luz en 100%. Sin flujo anterógrado. Sin circulación colateral. Diagonal: De gran tamaño: Lesión en toda la arteria, lesión localizada, de bordes irregulares, excéntrica, que compromete su luz en 95%.
Se comienza con tratamiento para insuficiencia cardíaca descompensada en shock room. Se valora paciente frío y seco (cuadrante L según esquema de Stevenson) y se comienza con reposición de fluidos hasta optimizar presión venosa central (PVC). Al persistir con el cuadro se agrega noradrenalina (0,05 mcg/kg/min), Dobutamina (4 mcg/kg/min) y ventilación no invasiva con excelente respuesta. Se solicita cama en unidad de terapia intensiva (UTI) para continuar tratamiento. Permanece con monitoreo multiparamétrico (registro electrocardiográfico de 2 derivaciones, TA, FC, FR, T° y SO2), diuresis, PVC y sensorio.
Durante la espera de la habilitación de cama en UTI, el paciente presente arritmia maligna (fibrilación ventricular) con registros en el monitor multiparamétrico. Se lo valora sin respuesta, sin ventilación y sin pulso. Se comienzan con maniobras de Reanimación Cardiopulmonar (RCP) con compresiones torácicas y ventilaciones con dispositivo bolsa-válvula-máscara (BVM). Luego de 15 compresiones aproximadamente el paciente retorna a la conciencia con apertura ocular, dirige la mirada, verbaliza sonidos incomprensibles y retira el dispositivo BVM con sus extremidades superiores. Se abandonan las compresiones y se revalora: sin respuesta, sin pulso y con respiración agónica. Se chequea ritmo cardiaco evidenciando Fibrilación Ventricu-
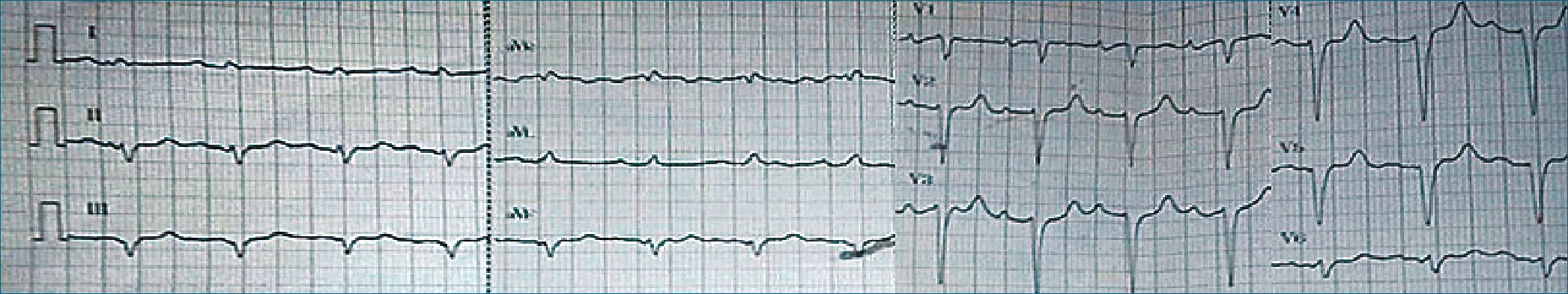
Figura 1. Electrocardiograma de 12 derivaciones del ingreso.
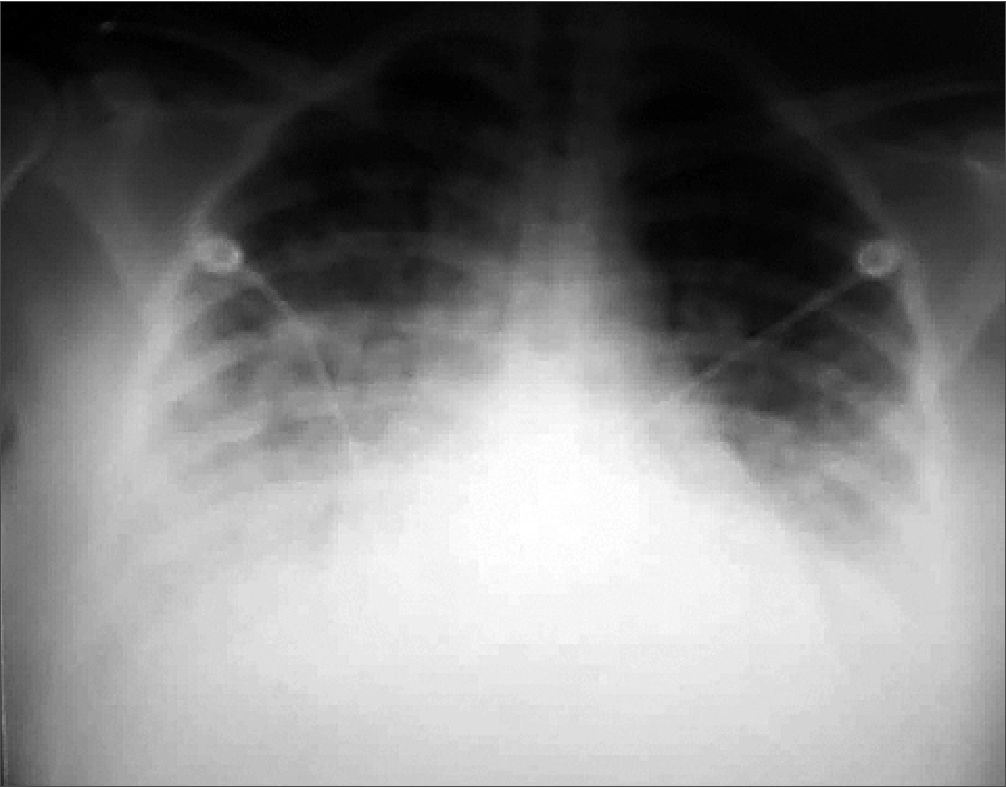
Figura 2. Radiografía de tórax del ingreso.
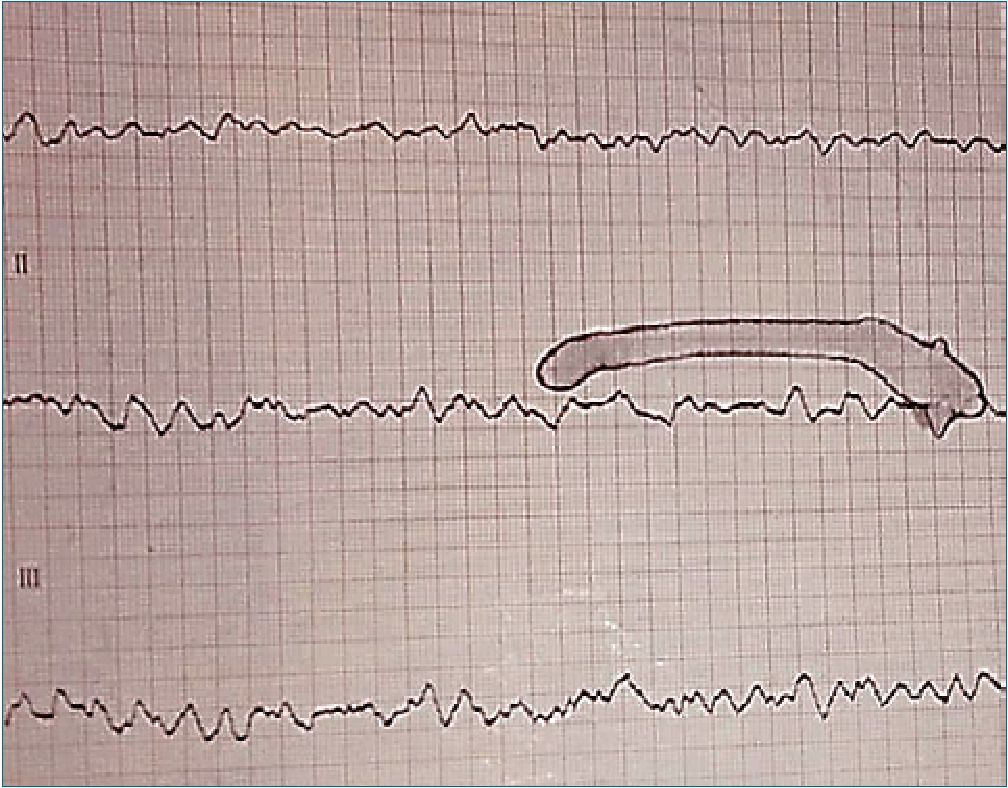
Figura 3. Electrocardiograma durante fibrilación ventricular.
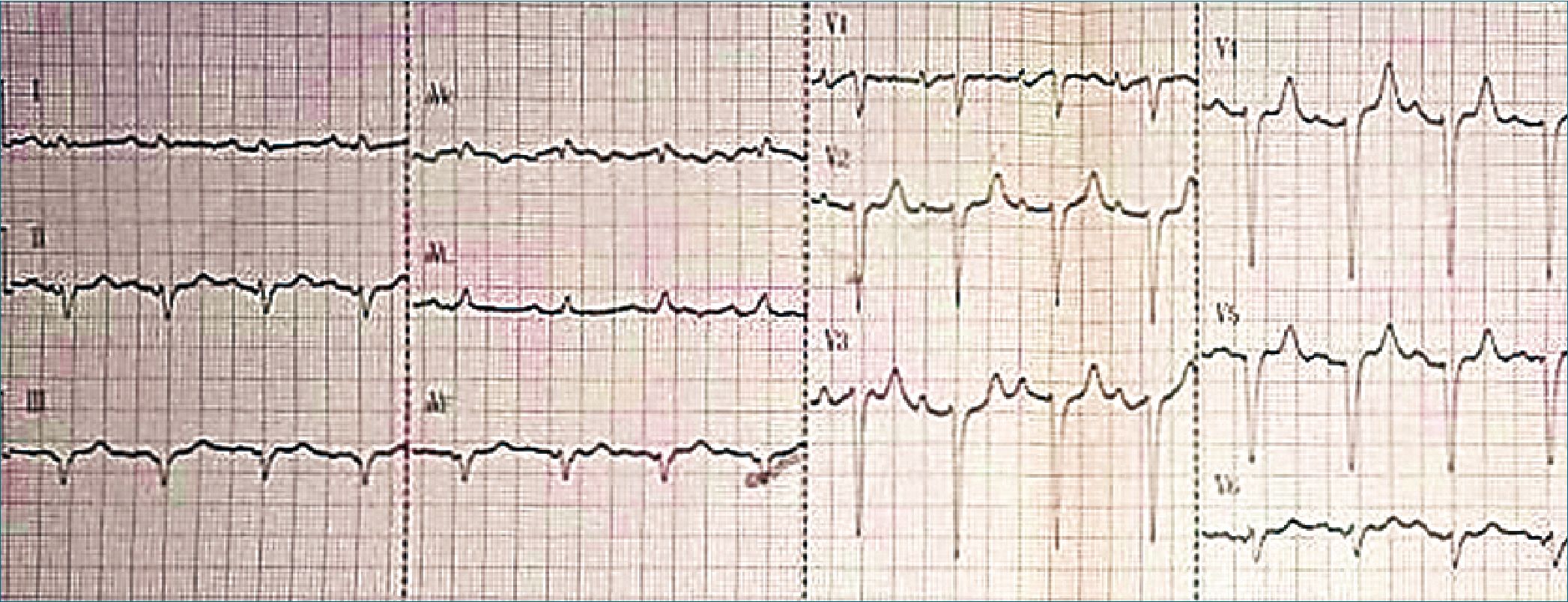
Figura 4. Electrocardiograma postparo del paciente.
lar (FV) en monitor y electrocardiograma (ECG) (Figura 3). Se retoman las compresiones y ventilaciones retornando nuevamente el paciente a la conciencia. Se interpreta como retorno a la conciencia durante la reanimación. Sin la desconexión de los otros monitores se realiza desfibrilación monofásica (monitor en FV) 360 joules, continuando inmediatamente con compresiones por 1 ciclo 30/2 y se valora pulso, FC 109 lpm; TA 100/70 mmHg, con ritmo espontáneo en monitor y ECG (Figura 4). Se realiza sedación/parálisis (midazolam/succinilcolina), intubación orotraqueal y cuidados postparo. El tiempo total desde el comienzo de la arritmia hasta la valoración de retorno a la circulación espontánea fue menor a 4 minutos.
En UTI cumple 11 días de estadía, 6 días con asistencia ven- tilatoria mecánica, 4 días con requerimiento de noradrenalina, 6 días con dobutamina, luego 4 días en unidad de cuidados intermedios y 30 días en sala general con buena evolución y sin secuelas neurológicas. En sala general se interroga al paciente el cual presenta recuerdos hasta antes del PCR ocurrido en SR y refiere recobrar la conciencia en el recién en el servicio de UTI. Se externa luego de 45 días por asistencia social a casa de contención. El Paciente cumple con criterios de trasplante cardíaco, a la espera de valoración de equipo se salud.
-
Discusión
Se han reportado varios casos y revisiones de retorno a la conciencia durante la reanimación por lo que éste no es un fenómeno nuevo[2]. Los pacientes con PCR y retorno a la conciencia presentan mayor posibilidad de supervivencia al alta hospitalaria[3]. No existe una definición exacta acerca del retorno a la conciencia durante la reanimación[4] aunque lo más frecuente son movimientos dirigidos, verbalización o gemidos, apertura ocular e interferencias en la reanimación que cesan cuando se interrumpen las compresiones torácicas[5].
Tanto en nuestro caso, como en múltiples consultados en la bibliografía, se pudo estimar que la mayoría de los pacientes presentaban cardiopatías[2],[6],[7] y algunos con signos o sospecha de insuficiencia cardíaca y agrandamiento ventricular izquierdo por antecedentes o estudios realizados[8]. Las causas de este fenómeno no están claras, aunque se podría hipotetizar que las compresiones de buena calidad en pacientes que presentan un “saco” ventricular agrandado podría albergar mayor volumen sanguíneo y el flujo artificial creado por cada compresión torácica sería mayor permitiendo la recuperación de la conciencia al lograr mayores presiones vasculares cerebrales permitiendo una mejor perfusión cerebral.
-
Fisiología de las compresiones torácicas
La técnica de compresiones torácicas en personas fue descripta por Kouwenhoven y colaboradores en 1960, como la forma de proveer circulación artificial adecuada para mantener el corazón y el sistema nervioso central hasta brindar la oportunidad de desfibrilar si fuera necesario[9]. El mecanismo por el cual las compresiones torácicas producen restauración del flujo sanguíneo es controversial y continúa en disputa por al menos dos teorías: La primera es la teoría de la bomba cardíaca que considera que la responsable del flujo sanguíneo artificial es la compresión directa de las cavidades cardíacas. Y la segunda teoría es que la compresión precordial mantiene el flujo sanguíneo mediante la eyección de sangre de un reservorio in- tratorácico con la implicación de que el corazón sirve como un conducto pasivo[10],[11]. Deshmukh y colaboradores, proveen evidencia de que el flujo hacia adelante estaría asociado con las compresiones cardíacas, debido a compresión del corazón entre el esternón y la columna vertebral[12]. Esto posteriormente, fue confirmado por estudios con ecocardiografía transesofágicas en humanos por Kim y colaboradores, evidenciando flujo desde el ventrículo izquierdo anterógrado hacia la aorta y retrógrado hacia la aurícula izquierda, además de aumento de presiones dentro del VI[13].
Es conocido que el flujo sanguíneo generado por las compresiones torácicas durante un paro cardíaco es solo del 17% al 27% del gasto cardíaco normal[14],[15]. Estos estudios estuvieron realizados en animales que presumiblemente estaban sanos. En humanos con dilatación ventricular posiblemente estos porcentajes estarían incrementados, por lo tanto, cada compresión podría generar mayor flujo cerebral permitiendo el despertar durante la reanimación cardioplumonar. Se estima que una reducción del 50% de la velocidad media del flujo sanguíneo cerebral en la arteria cerebral media y una reducción del 10%-15% de oxihemoglobina cerebral se asocia con pérdida de conocimiento[16]. Entonces la restauración de este fenómeno podría generar el retorno a la conciencia y valores menores no la producirían.
Más fenómenos se producen en pacientes con insuficiencia cardíaca. Los pacientes con esta afección presentan retención hídrica y este aumento de líquido corporal y del volumen de sangre es un factor importante para compensar la disminución de la capacidad de bomba del corazón al aumentar el retorno venoso.
El flujo sistémico realizado por las compresiones cardíacas se explica porque el corazón se exprime entre el esternón y la columna vertebral. En condiciones normales el volumen del ventrículo izquierdo es de 110 a 120 ml con una fracción de eyección del 60% y expulsa un volumen de 70 ml en cada latido. Durante las compresiones este volumen puede llegar a 32 ml (hasta el 27%) en cada compresión, pero en condiciones de aumento de volumen sistémico asociado además a un aumento de la precarga (volumen de sangre en los ventrículos por dilatación ventricular excéntrica), el volumen eyectado en cada compresión estaría también aumentado, lo que podría determinar un mayor volumen/presión de sangre oxigenada hacia el cerebro a velocidades suficientes para producir el recupero de la conciencia.
Además, los pacientes con insuficiencia cardíaca y fracción de eyección disminuida tienen menor saturación tisular de oxígeno cerebral que pacientes sanos[17] por lo que, el umbral de pérdida de conciencia, y recuperación, podrían también ser menores. En la revisión de Olaussen[3] y colaboradores, la presunta causa cardíaca aumenta las probabilidades de retorno a la conciencia. Esto podría ser un confundidor ya que el riesgo de PCR se encuentra aumentado en esta población y los datos en este estudio están realizados sin el ajuste correspondiente.
Estudios adicionales serían necesarios para confirmar o rechazar la explicación antes mencionada.
-
Referencias
1. Escobar J. Fisiopatología del paro cardiorrespiratorio. Fisiología de la reanimación cardiopulmonar. Rev Chil Anest. 2012;41(1):18–22.
2. Olaussen A, Shepherd M, Nehme Z, Smith K, Jennings PA, Bernard S, et al. CPR-induced consciousness: A cross-sectional study of healthcare practitioners’ experience. Australas Emerg Nurs J. 2016 Nov;19(4):186–90. https://doi.org/10.1016/j.aenj.2016.07.002 PMID:27478148
3. Olaussen A, Nehme Z, Shepherd M, Jennings PA, Bernard S, Mitra B, et al. Consciousness induced during cardiopulmonary resuscitation: an observational study. Resuscitation. 2017 Apr;113:44–50. https://doi.org/10.1016/j.resuscitation.2017.01.018 PMID:28161214
4. Singh RP, Adhikari S, Landsberg D, Kaul V. Cardiopulmonary resuscitation-induced consciousness. Proc Bayl Univ Med Cent. 2020 Oct;34(1):187–8. https://doi.org/10.1080/08998280.2020.1823799 PMID:33456196
5. Doan TN, Adams L, Schultz BV, Bunting D, Parker L, Rashford S, et al. Insights into the epidemiology of cardiopulmonary resuscitation-induced consciousness in out-of-hospital cardiac arrest. Emerg Med Australas. 2020 Oct;32(5):769–76. https://doi.org/10.1111/1742-6723.13505 PMID:32220008
6. Tobin JM, Mihm FG. A hemodynamic profile for consciousness during cardiopulmonary resuscitation. Anesth Analg. 2009 Nov;109(5):1598–9. https://doi.org/10.1213/ANE.0b013e3181b89432 PMID:19843796
7. Olaussen A, et al. Return of consciousness during ongoing cardiopulmonary resuscitation: A systematic review. Resuscitation. 2014. PMID:25447435
8. Lewinter JR, Carden DL, Nowak RM, Enriquez E, Martin GB. CPR-dependent consciousness: evidence for cardiac compression causing forward flow. Ann Emerg Med. 1989 Oct;18(10):1111–5. https://doi.org/10.1016/S0196-0644(89)80942-4 PMID:2802288
9. Kouwenhoven WB, Jude JR, Knickerbocker GG. Closed-chest cardiac massage. JAMA. 1960 Jul;173(10):1064–7. https://doi.org/10.1001/jama.1960.03020280004002 PMID:14411374
10. Rudikoff MT, Maughan WL, Effron M, Freund P, Weisfeldt ML. Mechanisms of blood flow during cardiopulmonary resuscitation. Circulation. 1980 Feb;61(2):345–52. https://doi.org/10.1161/01.CIR.61.2.345 PMID:7351060
11. Niemann JT, Rosborough JP, Hausknecht M, Garner D, Criley JM. Pressure-synchronized cineangiography during experimental cardiopulmonary resuscitation. Circulation. 1981 Nov;64(5):985–91. https://doi.org/10.1161/01.CIR.64.5.985 PMID:7026084
12. Deshmukh HG, Weil MH, Gudipati CV, Trevino RP, Bisera J, Rackow EC. Mechanism of blood flow generated by precordial compression during CPR. I. Studies on closed chest precordial compression. Chest. 1989 May;95(5):1092–9. https://doi.org/10.1378/chest.95.5.1092 PMID:2707067
13. Kim H, Hwang SO, Lee CC, Lee KH, Kim JY, Yoo BS, et al. Direction of blood flow from the left ventricle during cardiopulmonary resuscitation in humans: its implications for mechanism of blood flow. Am Heart J. 2008 Dec;156(6):1222.e1–7. https://doi.org/10.1016/j.ahj.2008.09.003 PMID:19033024
14. Barsan WG, Levy RC. Experimental design for study of cardiopulmonary resuscitation in dogs. Ann Emerg Med. 1981 Mar;10(3):135–7. https://doi.org/10.1016/S0196-0644(81)80377-0 PMID:7469152
15. Voorhees WD, Babbs CF, Tacker WA Jr. Regional blood flow during cardiopulmonary resuscitation in dogs. Crit Care Med. 1980 Mar;8(3):134–6. https://doi.org/10.1097/00003246-198003000-00008 PMID:7363627
16. Van Lieshout JJ, Wieling W, Karemaker JM, Secher NH. Syncope, cerebral perfusion, and oxygenation. J Appl Physiol (1985). 2003 Mar;94(3):833-48.
17. Chen YJ, Wang JS, Hsu CC, Lin PJ, Tsai FC, Wen MS, et al. Cerebral desaturation in heart failure: potential prognostic value and physiologic basis. PLoS One. 2018 Apr;13(4):e0196299. https://doi.org/10.1371/journal.pone.0196299 PMID:29689105
18. Lewinter JR, Carden DL, Nowak RM, Enriquez E, Martin GB. CPR-dependent consciousness: evidence for cardiac compression causing forward flow. Ann Emerg Med. 1989 Oct;18(10):1111–5. https://doi.org/10.1016/S0196-0644(89)80942-4 PMID:2802288

 ORCID
ORCID