Juan Pablo Ghiringhelli M.1, Herman Granados S.2, Javier García C.3
Recibido: 05-11-2023
Aceptado: 11-01-2024
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 3 pp. 214-223|https://doi.org/10.25237/revchilanestv53n3-03
PDF|ePub|RIS
Monitored anesthesia care in non-operating room anesthesia. Is Ketodex a safer alternative in complex patients?
Abstract
There is an increasing need and demand for the anesthesiologist in non-operating room anesthesia (NORA) procedures, where procedural sedation and analgesia, commonly called monitored anesthetic care, represent a major challenge in adverse circumstances such as agitated patients, urgent procedures with lack of fasting and significant comorbidities. NORA procedures are associated with higher risk of malpractice, death, respiratory depression, and pulmonary aspiration compared to procedures in the surgical suite, with inadequate oxygenation/ventilation being the most frequent cause. Most anesthetic agents used consist of a mixture of various agents, with propofol being the most common. However, it is also the one most implicated in claims of respiratory depression and adverse outcomes in NORA anesthesia’s. The combination of ketamine and dexmedetomidine, widely known as Ketodex, has several advantages in the terms of hemodynamic stability, lack of respiratory depression, good postoperative analgesia, and recovery. Several previous studies and case reports have been demonstrated the therapeutic utility of Ketodex as the mix balance out the undesirable effects of both drugs and provide smooth and safe sedation. We present this review including six urgent different clinical scenarios, where Ketodex had used as a unique anesthetic agent providing a safe alternative to general anesthesia which could be challenging in this setting.
Resumen
Existe una creciente necesidad y demanda del anestesiólogo para procedimientos con anestesia fuera de pabellón (AFP), donde la sedación y los cuidados anestésicos monitorizados representan un gran desafío en circunstancias adversas como pacientes agitados, procedimientos de urgencia con falta de ayuno y comorbilidades importantes. Los procedimientos fuera de quirófano tienen más demandas de mala praxis, muerte, depresión respiratoria y aspiración pulmonar al compararlos con procedimientos en pabellón quirúrgico, siendo la inadecuada oxigenación/ventilación la causa más frecuente. La mayoría de los agentes anestésicos utilizados consisten en una mezcla de diversos agentes como anestésicos locales, ansiolíticos, opioides y sedantes, siendo el propofol el más frecuente. Sin embargo, también es el que está más involucrado en las demandas por depresión respiratoria y resultado adverso en AFP. La combinación de ketamina y dexmedetomidina, ampliamente conocida como Ketodex, tiene varias ventajas en términos de estabilidad hemodinámica, ausencia de depresión respiratoria, buena analgesia posoperatoria y una recuperación favorable. Estudios previos han demostrado la utilidad terapéutica de Ketodex, ya que esta mezcla equilibra los efectos indeseables de ambos medicamentos y proporciona una sedación estable y segura. Presentamos esta revisión incluyendo seis escenarios clínicos en el setting de urgencia y AFP en los que se utilizó Ketodex como agente anestésico único, ofreciendo una alternativa segura a otros agentes como propofol y a la anestesia general, que podría resultar desafiante en este contexto.
-
Introducción
Ha aumentado el requerimiento del anestesiólogo en otros lugares fuera del pabellón quirúrgico como en el servicio de urgencia, unidades de intermedio, endoscopía, radiología y resonancia nuclear magnética, sacándolo de su zona de confort y teniendo que familiarizarse con otros dispositivos de monitorización, líneas de suministro de oxígeno y personal auxiliar para otorgar una analgesia y anestesia segura para el paciente[1],[2]. Además, los pacientes que requieren AFP son más longevos, más complejos teniendo mayor score ASA y requieren procedimientos de urgencia más frecuentemente, con mayor proporción de anestesia general y comenzando más en horario no hábil[3].
-
Importancia
– En la próxima década se espera que los casos de AFP constituyan más del 50% de los procedimientos anestésicos realizados en un hospital[4].
– Las demandas por negligencia en la atención de AFP tienen una proporción más de alta de reclamaciones por muerte y morbilidad severa en comparación con los procedimientos realizados en el pabellón quirúrgico[5].
– Los resultados adversos en AFP a menudo estaban vinculados a una atención subóptima y a la falta de adherencia de los principios básicos de práctica segura establecidos por la ASA[6].
– La sedación y los cuidados anestésicos monitorizados (CAM) pueden representar un gran desafío al ser la técnica más utilizada en estos escenarios, encontrando muchas veces pacientes agitados, procedimientos de urgencia con falta de ayuno y pacientes añosos con comorbilidades importantes[7],[8].
La más reciente revisión de resultados adversos en AFP incluye un análisis de la base de datos de demandas en anestesiología (Anesthesia Closed Claims) entre 2000-2012[9], incluyendo 72 casos fuera de pabellón y de un registro de reportes anestésicos entre 2010-2013 de Estados Unidos, llamado Registro de Outcomes Clínicos Anestésicos (NACOR por sus siglas en inglés), llevado por el “Anesthesia Quality Institute”[10], incluyendo cerca de 1.900.000 casos de AFP. Esta revisión señala que los procedimientos originados fuera de quirófano tienen más demandas de mala praxis, muerte, depresión respiratoria y aspiración pulmonar al compararlos con procedimientos en pabellón quirúrgico, siendo la inadecuada oxigenación/ventilación la causa más frecuente en un tercio de las demandas[5]. Otros problemas más reportados en este escenario fueron la intubación difícil e intubación esofágica. Por otra parte, al ser menos utilizada que en pabellón hubo menos demandas relacionadas con anestesia regional. El área más frecuentemente involucrada en las demandas fue procedimientos relacionados al ámbito gastrointestinal, fluctuando entre 50%-80%, seguido de radiología, cardiología y litotripsia[5],[10].
-
Definición Cuidados Anestésicos Monitorizados (CAM)
El método más comúnmente utilizado en AFP es la sedación y cuidados anestésicos monitorizados (CAM). Esta es definida como una técnica analgésica donde se combinan anestésicos locales con fármacos intravenosos con el fin de otorgar una sedación segura, analgesia y satisfacción mientras el paciente es monitorizado para prevenir efectos adversos como hipoxia, hipotensión y bradicardia[11],[12]. Otros reportes la catalogan como sedación y analgesia para procedimientos, definida como la administración de sedantes, ansiolíticos y analgésicos a pacientes en los cuales se va a realizar un procedimiento. La sedación y analgesia sistémica es provista por el anestesiólogo mientras que la analgesia local incluida la infiltración o el campo operatorio es realizada por el cirujano. La pricipal ventaja de CAM fuera de pabellón es que otorga una rápida recuperación posoperatoria, utilizando pequeñas dosis de sedantes y analgésicos al compararlos con la anestesia general. Sin embargo, la aplicación de sedantes y analgésicos debe ser dosificada para evitar una depresión respiratoria y obstrucción de la vía aérea, ya que la vía aérea del paciente no está “asegurada” en los CAM[12]. La CAM debiese ser diferenciada de una simple sedación/analgesia en la cual ésta es ejecutada por un no anestesiólogo, mientras que CAM es realizada por un equipo de cuidado anestesiológico. Por esto mismo, la evaluación preoperatoria, monitorización durante el procedimiento y el cuidado posoperatorio de los pacientes con CAM debe seguir el mismo estándar anestésico que cuando el paciente recibe anestesia general o regional en el pabellón[12].
-
Requisitos del lugar y entorno de cuidado anestésico[6]
– Los lugares que brindan servicios de anestesia fuera de pabellón deben ubicarse cercanos al pabellón quirúrgico o alternativamente, si no es posible, en proximidad cercana entre sí, para mejorar la eficacia, eficiencia y prontitud de los servicios de anestesiología para todos los pacientes.
– Cada sala donde se otorgue AFP debe contar con lo siguiente.
1. Una fuente confiable de oxígeno adecuada para la duración del procedimiento, incluido un suministro de respaldo. Así, se recomienda disponer de oxígeno desde una red central con un cilindro E completo como sistema de respaldo.
2. Una fuente de succión/aspiración previamente testeada y funcionando.
3. En áreas donde se administren anestésicos inhalatorios, se debe contar con una máquina de anestesia, la que debe revisarse periódicamente para mantenerse funcionando.
4. Suficientes tomas de corriente eléctrica para satisfacer los requisitos de la máquina de anestesia (si está presente), cualquier otro equipo de anestesia necesario (como bombas infusión y videolaringoscopios), equipo de monitorización.
5. Iluminación adecuada para el paciente, máquina de anestesia (si está presente) y el equipo de monitorización. Se debe contar con pilas adicionales para laringoscopio y se recomienda también una fuente de iluminación de respaldo idealmente con baterías.
6. Suficiente espacio para el procedimiento en sí mismo y el personal necesario, permitiendo un acceso rápido al paciente y el equipo de monitorización en caso de que se requiera.
7. En el caso de procedimientos AFP en radiología se debe tener disponible uso de protección personal como delantales
de plomo y protectores tiroideos, protección ocular y mantención distancia de las fuentes de radiación[1].
Tabla 1. Escalas de sedación utilizadas en los CAM[13]
| Escala de sedación de la ASA | Escala de Sedación Ramsay Modificada | Escala Evaluación del Observador de Vigilancia y Sedación (OAA/S) | ||
| Sedación mínima/ ansiolisis: pacientes responden a comandos verbales | 1 | Paciente despierto y alerta, mínimo o nulo deterioro cognitivo | 5 | Responde fácilmente al nombre pronunciado en tono normal |
| Sedación moderada (o consciente): pacientes que responden intencionadamente a comandos verbales, ya sea sólos o acompañados de estimulación táctil ligera | 2 | Paciente despierto y tranquilo, respuestas intencionadas a comandos verbales a nivel conversación | 4 | Respuesta letárgica al nombre pronunciado en tono normal |
| 3 | Paciente parece estar dormido, respuesta intencionada a comandos verbales | 3 | Responde después que se llama al nombre en voz alta, repetidamente o ambos | |
| 4 | Parece dormido, respuestas intencionadas a comandos pero a un nivel sonoro más fuerte que una conversación requiriendo un ligero toque región glabelar | 2 | Responde sólo después de un ligero estímulo o sacudida suave | |
| Sedación profunda: respuesta después de estimulación repetida o dolorosa | 5 | Paciente dormido, respuestas intencionadas lentas ante comandos verbales fuertes o toque fuerte en la región glabilar o ambos | 1 | Respionde sólo a la estimulación dolorosa |
| 6 | Dormido, respuestas intencionadas lentas solo ante estímulos dolorosos | |||
| Anestesia general: paciente no puede ser despertado incluso mediante estimulación dolorosa | 7 | Dormido, retirada refleja solo ante estímulos dolorosos | 0 | No responde a la estimulación dolorosa |
| 8 | Sin respuesta a estímulos externos incluido el dolor | |||
-
Monitorización estándar acorde requisitos de la ASA[6]
– Cada sala de procedimientos de AFP debe estar equipada con monitorización adecuada similar a una anestesia en pabellón, recomendando también la capnografía especialmente ante sedación moderada-profunda, cuando no se puede ver directamente la ventilación como scanner o resonancia y cuando se ocuparon múltiples medicamentos[13]. Se debe monitorizar continuamente la oxigenación, ventilación, circulación y temperatura, cumpliendo los estándares ASA para el monitoreo básico de anestesia. La electrocardiografía también se recomienda según la condición clínica del paciente.
– Cada sala de procedimientos debe contar con los medicamentos anestésicos adecuados, fluidos intravenosos, dispositivos de vía aérea, ecografía y todo lo necesario para dar anestesia general y técnicas regionales. Además, debido a que cada vez más los pacientes en AFP son más complejos y de urgencia, podrían requerir más monitorización invasiva y mayores requerimientos de sedación[6].
– Se debe realizar monitorización continua de la sedación y nivel de consciencia, especialmente si la anestesia realizada son CAM, ya que la administración de la sedación puede ser un continuo que va desde la ansiolisis hasta incluso la anestesia general, variando la profundidad de la sedación durante el procedimiento[13]. La cooperación del paciente es fundamental durante los CAM. Para este propósito
se pueden utilizar métodos clínicos o electroencefalográficos[12].
1. Métodos clínicos. Existen tres escalas para evaluar, el nivel de sedación. La escala de la ASA[14], la Escala Evaluación del Observador de Vigilancia y Sedación (OAA/S por sus siglas en inglés) y la escala de sedación de Ramsay modificada (RSS modificada por sus siglas en inglés) que se exponen en la Tabla 1[13]. Esta última fue modificada, ya que la original introducida en el año 1974 era para evaluar nivel de consciencia y agitación en pacientes recibiendo sedantes en la unidad de cuidados intensivos[15]. Se expone en la Tabla 2, sólo para establecer una diferencia de la modificada, que es más detallada y es la que se recomienda en los CAM. La RSS modficada evalúa el nivel de consciencia y sedación mediante la observación del comportamiento y la respuesta del paciente a la voz, un estímulo auditivo fuerte o un toque glabelar, con un puntaje máximo de 8 que correspondería a una anestesia general. Para CAM algunos estudios han establecido el objetivo en un puntaje RSS modificado mayor o igual a 5[16]. La escala de OAA/S va con puntaje decreciente de 5 a 0, siendo 5 un paciente alerta despierto y 0 dormido sin responder a estímulos dolorosos. La escala de la ASA clasifica la sedación en mínima o superficial, moderada y profunda, acuñando el término de sedación consciente a la sedación moderada, donde el paciente mantiene su ventilación, pero responde a ordenes verbales y táctiles[14]. Sin embargo, este término puede ser algo confuso, ya que si vamos a la escala de RSS modificada esta definición podría corresponder tanto a puntaje de 3 (despierto) como 4 o incluso 5 (dormido), prefiriendo esta escala para valorar más objetivamente la sedación. Actualmente, no existe una escala mejor que la otra, recomendando que se utilice alguna escala para monitorizar continuamente la sedación, aunque la de RSS modificada es la técnica más utilizada en los estudios[13],[16].
2. Electroencefalográficos. Para evitar estar continuamente estimulando al paciente lo que puede interferir con el procedimiento, se puede realizar monitorización continua de la sedación con métodos electroencefalográficos como índice biespectral (BIS). Los sedantes y analgésicos cambian la frecuencia y amplitud de las ondas del electroencefalograma, que están correlacionadas con un valor numérico según el BIS. En un estudio, usando BIS para sedación con propofol, este método evaluó la profundidad de sedación alcanzada con propofol, ya que una disminución en el BIS se asoció con amnesia y también episodio de apnea, durante la operación[12]. No obstante, no hay correlación entre el BIS y los distintos niveles de sedación anteriormente expuestos, indicando por ejemplo que un BIS de 80 puede corresponder a un paciente con un OASS de 1 hasta 5, presentando falta de discriminación[13]. Además, no presenta mucha utilidad si se ocupa ketamina en combinación con otros sedantes para CAM, por lo que no reemplaza una escala de sedación y si se quiere utilizar se debería ocupar solo como método adicional[8],[17].
– Se debe proporcionar un manejo postanestésico adecuado, similar a procedimientos en el quirófano. Si es posible, cada ubicación de AFP debería contar con una unidad de cuidados postanestésicos (PACU) en el mismo lugar o cerca. Cuando esto no sea posible, además del anestesiólogo, se debe disponer de un número adecuado de personal capacitado y equipos apropiados para transportar al paciente de manera segura a la PACU del pabellón quirúrgico[6],[7].
Tabla 2. Escala de sedación de Ramsay original para pacientes en UCI, midiendo estado de consciencia y agitación[15]
| Estado | Respuesta al estímulo /commando | Puntaje |
| Despierto | Paciente ansioso y/o agitado | 1 |
| Paciente cooperador, orientado y tranquilo | 2 | |
| Paciente responde solo a ordenes verbales | 3 | |
| Dormido | Paciente responde a breves respuestas al sonido y luz | 4 |
| Sólo respuesta estímulo intenso táctil o dolor | 5 | |
| No hay respuesta | 6 |
-
AFP en Pediatría
Una revisión de los datos del registro nacional de resultados clínicos (NACOR) evidencia que los procedimientos AFP en pediatría representan el 22,7% del total de procedimientos, siendo la mayoría de ellos en gastroenterología y radiología. También los pacientes pediátricos en AFP eran más complejos (mayor puntaje ASA), pero a diferencia de los adultos, los procedimientos ocurrieron más en horario hábil[18]. Un estudio de Clavero y cols[19], evaluó los outcomes de MAC con propofol en AFP en cerca de 49.000 pacientes pediátricos encontrando mayor incidencia de problemas relacionados con la vía aérea y aparato respiratorio (apnea, laringoespasmo, estridor, obstrucción vía aérea y otros), evidenciando también cuatro casos de aspiración pulmonar y dos casos donde se tuvo que practicar reanimación cardiopulmonar. Si bien no hubo muertes, el estudio sugiere que se debe tener precaución por la incidencia de complicaciones, especialmente con el uso de propofol y que la presencia de un anestesiólogo pediátrico puede prevenir resultados catastróficos[19],[20].
-
Agentes anestésicos utilizados
El fármaco perfecto para los CAM debería tener una latencia corta, con corta duración de acción y tiempo de recuperación, sin efectos adversos y que mantenga la estabilidad cardiovascular y respiratoria[21]. La mayoría de los agentes utilizados consisten muchas veces en una mezcla de diversos agentes como anestésicos locales, ansiolíticos, opioides y sedantes, siendo el propofol el más frecuente[1],[22].
La mayoría de ellos y especialmente el propofol, tienen el gran inconveniente de provocar apnea, llevando muchas veces a la decisión de optar por una anestesia general con intubación endotraqueal para evitar la broncoaspiración y manteniendo una vía aérea segura. Las ventajas y desventajas de estos agentes en los CAM fuera de pabellón se exponen en la Tabla 3. El más reciente análisis de demandas de anestesia fuera de pabellón señala que en 69% de estas se utilizó CAM, comparado con sólo 9% en las demandas ocurridas en el pabellón. La lista es completada con 24% de anestesia general, 1% regional y 6% no se utilizó ningún agente, solo monitorizando al paciente. Además, el cuidado anestésico se consideró subestándar en 66% de los casos[5].
La sobresedación con la consiguiente depresión respiratoria fue responsable de 20 de los 72 casos de demandas en AFP, dos tercios de estos casos fueron en unidades de gastroenterología. En los 20 casos (100%) hubo resultado adverso severo con muerte o morbilidad severa como daño permanente cerebral. El 68% de estas demandas de sobresedación (13 casos), se concluyó que podría haberse prevenido con una monitorización más adecuada. De estas 13 reclamaciones en 12 no se usó capnografía y en el caso restante se señaló que la monitorización fue pobre. Cuando se analizaron el tipo de fármacos involucrados en estas demandas por depresión respiratoria, el propofol asociado a no, estuvo involucrado en 16 casos (cerca de 90% de los casos), administrándose asociado a benzodiacepinas, ketamina, opioides y lidocaína en 12 casos[5]. En los otros casos se utilizó benzodiacepinas y opioides y en dos casos no se utilizó fármaco alguno.
Sin embargo, ¿Qué pasaría si tenemos un agente anestésico que brinda la opción de dar CAM sin apnea, en forma efectiva y segura evitando desenlaces adversos como depresión respiratoria y al mismo tiempo la anestesia general en estos escenarios?.
| Tabla 3 Agentes anestésicos utilizados en los CAM fuera de pabellón, ventajas y desventajas en AFP[7],[12] | ||
| Agente | Ventajas | Desventajas |
| Propofol | Rápida recuperación
Rápida acción Antiemético |
Depresión respiratoria (Apnea)
Hipotensión Requiere bombas de infusión Uso limitado solo IV Sin analgesia, siendo usual la coadministración de opioides y otros agentes |
| Ketamina | Analgésico
Sin depresión respiratoria Rápida acción Diversas vías administración (Nasal, intramuscular,oral, IV) |
Excesiva salivación
Taquicardia Vómitos Delirium Recuperación más larga |
| Dexmetedomidina | Mínima depresión respiratoria
Sedante Analgésico Diversas vías administración (Nasal, intramuscular,oral, IV) |
Bradicardia (bolo)
Latencia prolongada Hipertensión (bolo) Hipotensión (infusion) Recuperación más larga |
| Midazolam | Antídoto eficaz y disponible (flumazenil) Amplio perfil de seguridad | Sedación superficial
Sin analgesia Alta tasa de falla en la sedación Duración corta (dosis única) Usual la coadministración de otros agentes, mayor riesgo de depresión respiratoria Precaución adultos mayores, mayor sensibilidad |
| Remidazolam | Rápida acción
Rápida recuperación Antídoto disponible Menos hipotensión que propofol |
Pocos estudios en AFP
No disponible en la mayoría de los centros |
| Fentanilo | Analgésico
Requiere dosis repetidas Antídoto disponible (naloxona) |
Sin efecto hipnótico ni amnésico Náuseas-vómitos, prurito |
| Remifentanilo | Acción rápida Recuperación rápida | Sin efecto hipnótico ni amnésico
Requiere infusión Depresión respiratoria Hipotensión (bolo) Hiperalgesia |
-
¿Cómo surge Ketodex?
La ketamina surgió popularmente en la guerra de Vietnam, para analgesia y manejo de heridas en terreno, describiéndolo inicialmente como “Special K”, debido a la experiencia disociativa que experimentaban los soldados. Es un análogo no competitivo del receptor receptor glutamaergico N-metil-d-aspartato (NMDA), aunque también ejerce acción en los receptores opioides y monoaminérgicos. Es utilizada para anestesia y analgesia, ofreciendo también propiedades broncodilatadoras y amnésicas, preservando la vía aérea y el tono simpático[23].
Por otro lado, la dexmetedomidina es un agonista alfa2 altamente selectivo relativamente nuevo, siendo recién aprobado en 2008 para anestesia en adultos. Sus efectos farmacológicos incluyen: hipnosis, sedación, analgesia y simpaticolisis, siendo su principal efecto adverso la bradicardia[24]. Un metaanálisis de su uso en AFP evidenció beneficios significativos respiratorios con menor incidencia de desaturación y apnea, pero también mayor tiempo de recuperación, mayor incidencia de hipotensión y bradicardia[25].
El uso combinado de ambos agentes en la misma jeringa permite evitar los efectos adversos de cada uno por separado, (Tabla 4), otorgando una sedación tranquila, sin apnea y segura. De hecho, al utilizarse juntos, la dexmedetomidina puede prevenir la taquicardia, hipertensión, salivación y el fenómeno disociativo de emergencia de la ketamina, mientras que la keta- mina puede prevenir la bradicardia, que ha sido reportada con la dexmedetomidina[26]. Como lo demostró un estudio cuando se ocupa ketodex disminuye la incidencia de agitación a 2% en la recuperación al compararlo si sólo se ocupa ketamina (20%) [27]. Un beneficio adicional es que la ketamina tiene una rápida latencia de 30 segundos con un peak de efecto al minuto, eliminando la latencia lenta cuando sólo se utiliza la dexmedetomidina como agente único[16],[26]. Un estudio reciente postula que la dexmetedomidina tiene un efecto antiemético, muchas veces disminuyendo las náuseas y vómitos reportadas con el uso único de ketamina, lo que también ha sido corroborado por otros reportes[27],[28].
En cuanto a las dosis sugeridas, el método más efectivo fue el uso de una dosis única de ketamina de 0,5-1 mg/kg y una dosis única de dexmetedomidina de 1 mcg/kg. Esto podría ser seguido por una infusión de dexmetedomidina de 1-2 mcg/ kg/h y una dosis única adicional de ketamina de 0,5-1 mg/kg según sea necesario[16],[26],[27].
Presentaremos 6 casos en los cuales Ketodex se utilizó como alternativa segura en el setting de urgencia en AFP y en pacientes con alguna complicación eventual al uso de otros sedantes y anestesia general como edades extremas, SAHOS, falta de ayuno, dolor imposibilitando anestesia regional, delirium hiperactivo imposibilitando preoxigenación y extubación reciente tras ventilación mecánica prolongada.
Tabla 4. Efectos de ketamina / dexmetedomidina por separado y cómo surge el raciocinio de Ketodex
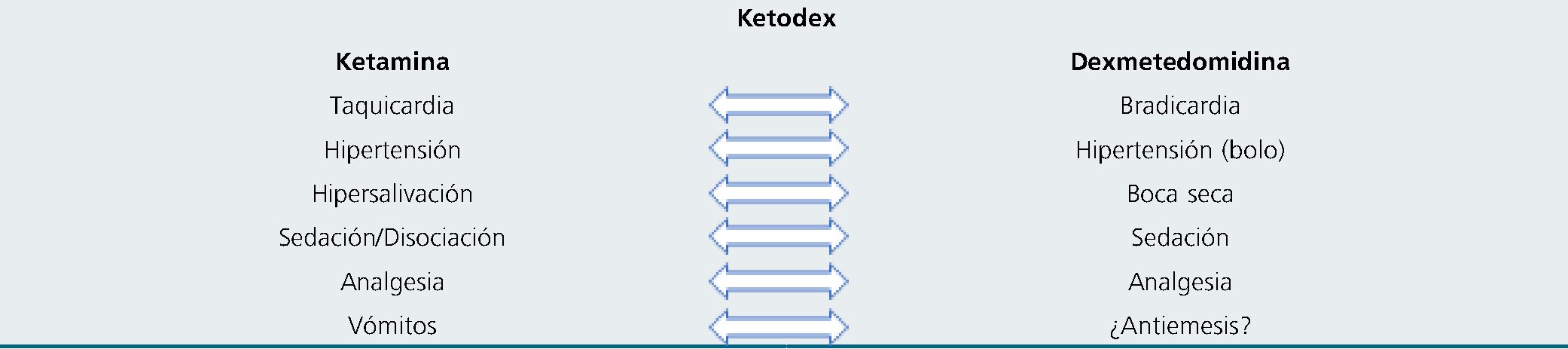
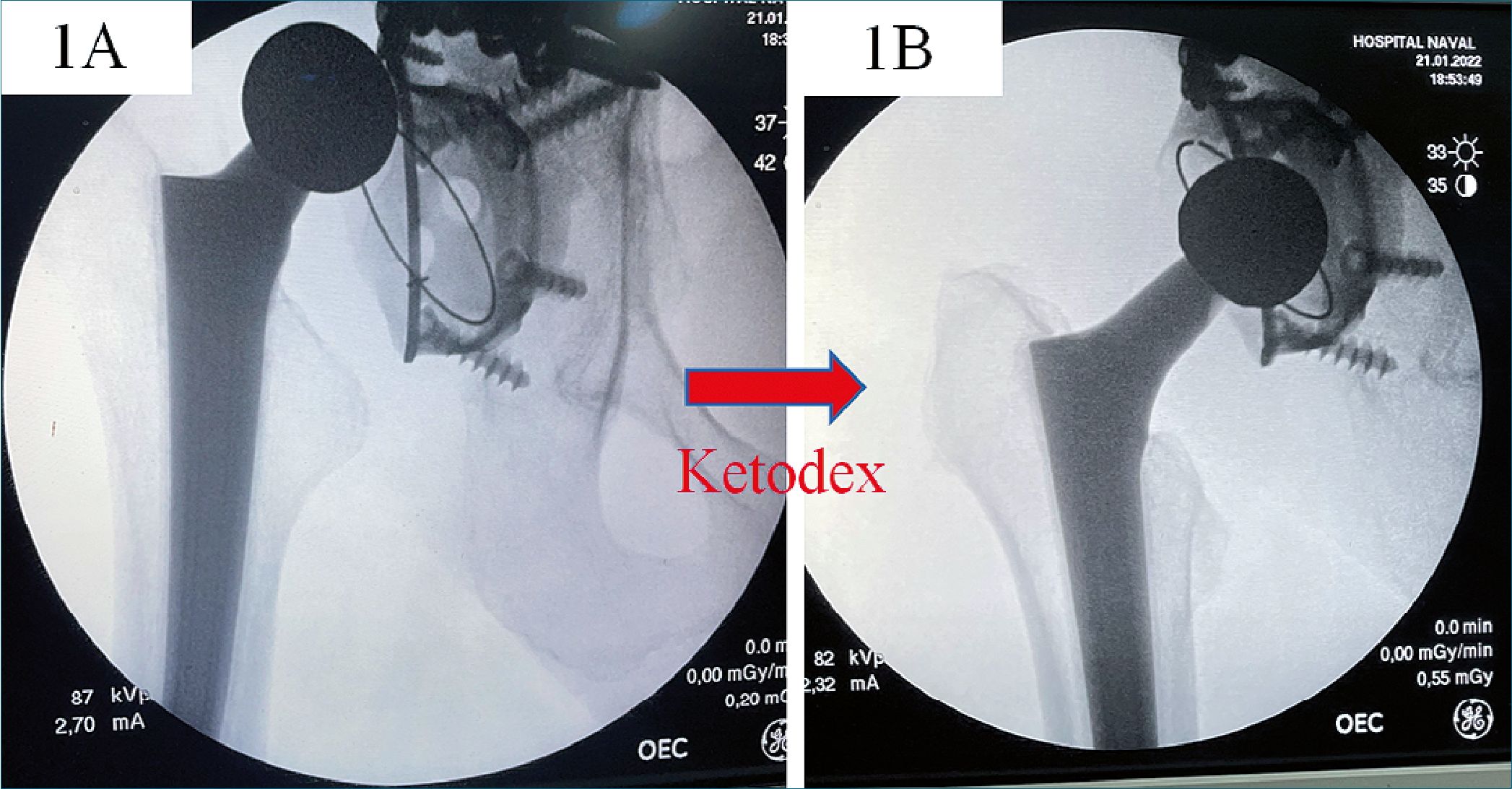
Figura 1A. Luxación de cadera periprotésica / Figura 1B. Reducción exitosa tras sedación con ketodex.
Caso 1
Paciente de 90 años, con antecedentes de hipertensión arterial y prótesis de cadera derecha hace 5 años. Acude al servicio de urgencia del Hospital Naval por dolor e impotencia funcional de la extremidad inferior derecha. La radiografía objetiva una luxación periprotésica de la cadera derecha (Figura 1A), por lo que el traumatólogo solicita apoyo anestésico para planificar una reducción cerrada. A la llegada se constata al ingreso una SatO2 de 95% ambiental, frecuencia cardiaca de 110 x min, presión arterial 160/78 mmHg, dolor por Escala Visual Análoga (EVA) de 10/10 aunque la paciente estaba orientada y sin agitación. La paciente no tenía ayuno (última ingesta de comida sólida hace 3 h) y no se podía sentar para una anestesia espinal ni movilizar la cadera por el dolor. La paciente pesaba 51 kilos y su altura era de 152 cm. Se obtuvo el consentimiento informado anestésico para sedación con Ketodex.
Se decide un bolo de ketodex a pasar en 2 minutos, conformado por ketamina 25 mg y precedex 50 ug, la reducción se realizó sin incidentes (Figura 1B), presentando estabilidad hemodinámica, sedación y ansiolisis. La valoración de la sedación según RSS modificada fue de 4 inicialmente tras 2 minutos y 5 tras los 2 minutos, donde se comenzó a realizar la reducción. Los signos vitales posterior al bolo fueron FC 65 x min, PA 168/90 y saturación de 99% con bigotera de 3 litros, la que solo se utilizó como medida de seguridad. Evolucionó favorablemente siendo dada de alta el mismo día. La monitorización posoperatoria fue en la PACU de pabellón quirúrgico.
Caso 2
Paciente de 95 años, delirium hiperactivo refractario a terapia farmacológica (lorazepam, haldol) FC 145 x min, saturando 91%, PA 110/85. Se vuelve agresivo infringiéndose un corte en oreja izquierda con sangrado profuso. Cirujano no puede suturar por movimientos, por lo que solicita apoyo anestésico en la unidad de intermedio. Se inyecta bolo de ketodex: ketamina 50 mg y dexmetedomidina 50 ug en 2 minutos, bajando la frecuencia cardíaca a 88 x minuto, con ligera hipertensión 150/100 sedación de buena calidad (RSS modificada puntaje de 5), permitiendo al cirujano suturar la oreja con anestesia local.
Caso 3
Paciente de 73 años, con cáncer de próstata en cuidados paliativos T4N1Mx. Acude al servicio de urgencia agitado con un estado confusional agudo, saturando 80%, taquicárdico 130 x minuto e hipertenso 180/100. Se realiza una radiografía de tórax en la que se objetiva un derrame pleural masivo. La cirujana de turno en urgencia intenta poner anestesia local para instalar tubo pleural izquierdo, volviendo al paciente más agitado, solicitando ayuda del anestesiólogo para procedimiento. A la llegada al servicio de urgencia, paciente satura 85% con O2 100% (con mascarilla con recirculación) y se mantiene taquicárdico e hipertenso. Se decide bolo de ketodex, conformado por ketamina 50 mg y dexmetedomidina 50 ug en 1 minuto, presentando buena tolerancia, bajando la adrenergia a FC 95 x minuto, subiendo la saturación a 94%, manteniendo la misma presión arterial, sedación según RSS modificada de 5, permitiendo la anestesia local y posterior instalación de tubo pleural exitosa por parte del cirujano (Figura 2). La monitorización postprocedimiento fue en observación de la unidad de emergencia, manteniendo monitorización continua sedación y de los signos vitales.
Se obtuvo el consentimiento informado del paciente al día siguiente.
Caso 4
Paciente de 70 años, SAHOS con uso de CPAP, posoperado de un absceso paravertebral y extubado hace 12 h en la UCI de forma exitosa tras 13 días en ventilación mecánica. En las últimas 3 h había presentado fiebre alta no encontrándose foco, taquicardia y deterioro del sensorio y se sospecha nuevamente un absceso paravertebral, solicitando una resonancia nuclear magnética (RNM) de urgencia, la que se intenta realizar sin anestesia, pero el paciente no la tolera y se solicita apoyo anestésico por agitación en RNM. A la llegada al servicio de resonancia el paciente presentaba SAO2 95% ambiental, FC 110 x minuto en el contexto de una agitación y presión arterial 95/55. Se obtiene el consentimiento de la paciente y la familia para sedación con ketodex y cuidados anestésicos monitorizados, quienes enfatizan el requerimiento si es posible no intubar al paciente, dado que fue extubado recientemente. El paciente pesaba 90 kilos y medía 1,60. Se decide monitorizar con capnografía conectada a la mascarilla de alto flujo con 8 litros de oxígeno. Se inyecta bolo de ketodex (ketamina 70 mg y dexmetedomidina 70 ug) en 3 minutos, presentando buena adherencia con ligera hipertensión PA 165/99, permitiendo el examen, Ramsay modificado con puntaje de 6. El bolo se repitió tras 45 minutos (50 mg ketamina y 50 ug precedex), cuando el paciente presentaba Ramsay modificado de 4, para evitar nueva agitación, terminando la RNM sin inconvenientes. No se optó por infusión porque las bombas de infusión disponibles eran incompatibles con el resonador. La monitorización postprocedimiento se realizó en la UCI.
Caso 5
Paciente de sexo femenino de 98 años con un sangrado digestivo en estudio, programada para endoscopia/colonosco- pia y biopsia de forma prioritaria. Los signos vitales de ingreso a la unidad de gastroenterogía del Hospital Simón Bolívar de Bogotá fueron: FC 82, FR 16, SAO2 de 92%, con FiO2 al 28%, PA 112/58. Dentro de los paraclínicos contábamos con hemoglobina de 10,7 g/dl secundario al sangrado digestivo. Dentro de las consideraciones se habló con los familiares quienes refieren por estado de la paciente no considerar maniobras invasivas de reanimación como la intubación endotraqueal. Teniendo en cuenta la necesidad de mantenimiento de estabilidad hemodinámica y ventilación espontánea sin intubación endotraqueal se consideró uso de ketodex como esquema de sedación para este procedimiento. Para la endoscopia se utilizó 20 mcg de dexmedetomidina más 20 mg de ketamina siendo aproximadamente 0,5 mg-mcg/kg de peso de la paciente, teniendo un peso de 42 kg. Para la colonoscopia utilizamos un bolo inicial de 20 mcg de dexmedetomidina más 20 mg de ketamina y un refuerzo de 10 mcg de dexmedetomidina más 10 mg de ketamina de forma única. Se mantuvo en ventilación espontánea sin cambios significativos en la hemodinamia (PA 130/76). La duración total de los dos procedimientos fue de aproximada mente 15 minutos sin inconvenientes. La valoración de la sedación tras bolo de ketodex y durante el procedimiento fue de 5. (Escala de Ramsay).
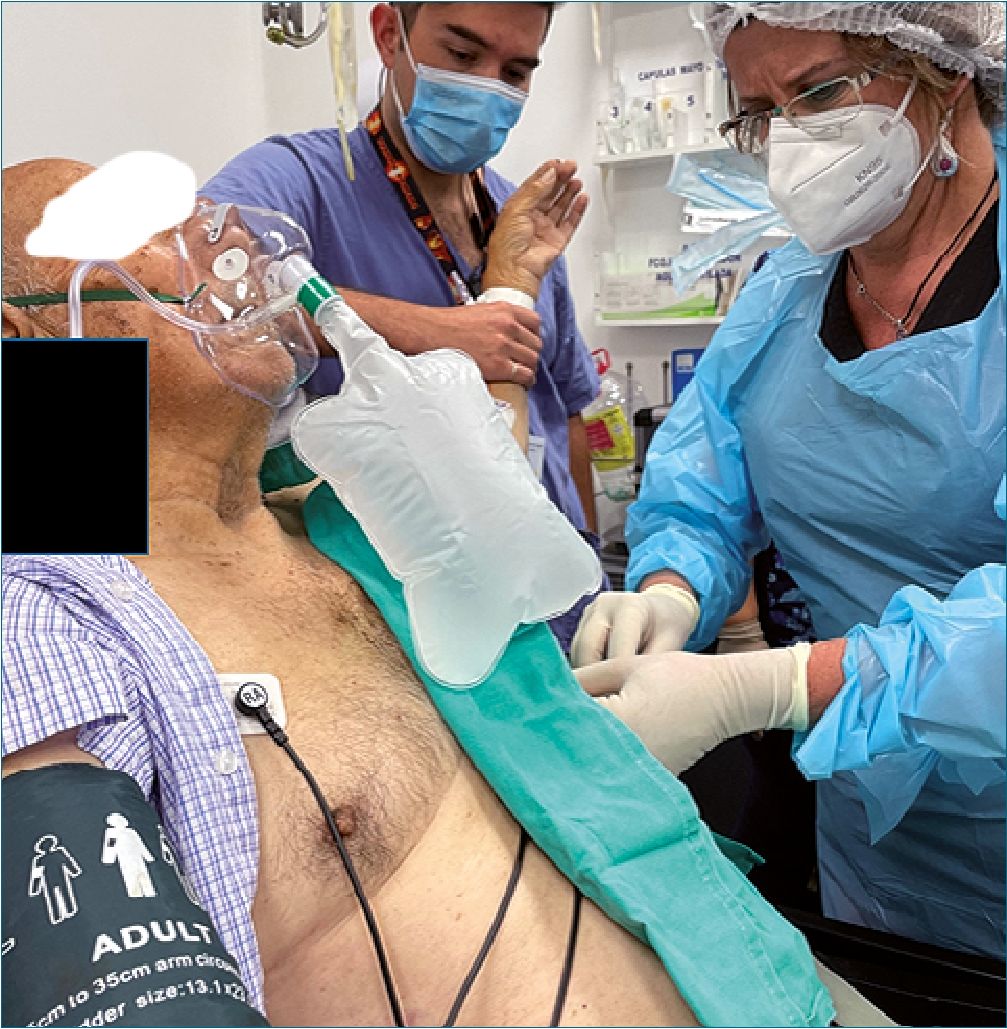
Figura 2. Tras inyección de Ketodex se instala exitosamente drenaje pleural por cirujano masivo en box de reanimación de urgencia, Hospital Naval Almirante Nef.
Caso 6
Paciente femenina de 5 meses de edad y 7 kg de peso, que ingresa a la Clínica Sagrada Familia, Quindio, Colombia con cuadro de 4 días de evolución consistente en tos, vómitos, fiebre y adenopatía cervical de 5×4 cm. Tras evaluación por pediatría se solicita ecografía de tejidos blandos que reporta adenitis abscedada, requiriéndose drenaje urgente guiado por ultrasonido por parte de radiología internacional. A destacar dentro de los paraclínicos hemoglobina de 9,5 g/dL, leucocitos 17.500, sin dificultad respiratoria, pero progresión a tos húmeda. Los signos vitales eran FC 118 x min, FR 38, PA 102/53 SAO2 95% ambiental. Debido a la falta de ayuno y vómitos recientes se obtuvo el consentimiento de la familia para sedación con ketodex y cuidados anestésicos monitorizados, aceptando técnica anestésica y quirúrgica. Dado que el paciente ya tenía una vía venosa, se usó 10 mg de ketamina más 10 mg de dexmedetomidina, (1,4 mg-mcg/kg) en un bolo infundido durante 3 minutos con buena tolerancia al procedimiento que en total fue de 20 minutos. Se decidió apoyar con oxígeno por cánula nasal. La FC máxima y mínima durante el procedimiento fue de 125 y 86 x min, respectivamente. La PA máxima reportada fue de 135/68.
-
Comparación de ketodex con otros agentes y combinaciones
Combinar un agente hipnótico con un fármaco analgésico ofrece la ventaja de cubrir ambos objetivos, facilitando una inducción suave, mantenimiento sin dolor y una recuperación más rápida, disminuyendo las dosis de cada uno y los efectos adversos de cada fármaco[14]. Así, por ejemplo, se ha reportado que la dexmetedomidina es insuficiente por sí sola para otorgar analgesia y una correcta sedación en procedimientos fuera de pabellón[29].
La combinación de propofol y ketamina (ketofol) habría surgido como una alternativa eficaz, ya que al compararlo con ketodex tendría una más rápida recuperación, estabilidad hemo- dinámica y mejor satisfacción del endoscopista, pero también tuvo más episodios de apnea y desaturaciones que ketodex en procedimientos de endoscopía y de urgencia[17],[27]. Así, esto es corroborado por otros reportes donde ketodex representa una alternativa eficaz con un perfil de seguridad mejor al compararse con ketofol y otras combinaciones en pacientes en ERCP, endoscopía y RNM[16],[26],[30],[31],[32]. La combinación de midazolam-fentanilo otorga muchas veces una sedación insuficiente, teniendo que sobredosificar aumentando los efectos adversos de cada fármaco y muchas veces usando propofol con el mayor riesgo de apnea. Un reporte reciente de Gregoire y cols., sostiene que ketodex es recomendable para procedimientos en el servicio de urgencia especialmente en pacientes frágiles, otorgando una sedación consciente, analgesia y óptimas condiciones quirúrgicos y estabilidad hemodinámica[33]. Sin embargo, la sedación y recuperación es más lenta versus otros agentes, teniendo también una incidencia de hipertensión de 23%, que también se vio en los casos de esta revisión. Como ya se señaló, los procedimientos de AFP tienen más demandas de muerte y depresión respiratoria, siendo la sobresedación, no uso de capnografía y la inadecuada oxigenación/ventilación las causas involucradas[5]. En estas demandas el agente más utilizado en los CAM fue el propofol en casi 90% de los casos otorgando un cuidado subestándar en la mayoría y no seguro debido a los casos de sobresedación reportados que terminaron en muerte o incapacidad permanente en 20 pacientes. Considerando estas complicaciones y que además ketodex no se reportó dentro de los medicamentos utilizados esta combinación podría surgir como una alternativa más segura en la anestesia fuera de pabellón, especialmente en procedimientos de urgencia y en pacientes más complejos como los expuestos previamente, previniendo la apnea, sobresedación y consiguiente depresión respiratoria que tienen otros agentes. No obstante, se recomienda igual mantener una monitorización constante de la sedación, un suministro de oxígeno y tener disponible capnografía especialmente si el anestesiólogo no está inmediatamente cerca del paciente como en anestesia en RNM o si se está pensando en realizar una intubación endotraqueal. Además, probablemente en un escenario de procedimientos electivos y ambulatorios con pacientes jóvenes y sanos, ketodex tendría una recuperación más lenta, habiendo otros fármacos y combinaciones con mejor perfil de recuperación si se está pensando en un alta precoz[27].
En esta serie de casos en tres centros latinoamericanos, ketodex se presenta como una opción viable fuera de pabellón para una gran variedad de procedimientos de urgencia como los relatados en este reporte: endoscopías, colonoscopías, suturas, resonancia, drenaje pleural, drenaje por radiología intervencional y luxación ortopédica peri-protésica. En muchos de estos casos y tal como lo señala la definición de CAM fue necesaria la anestesia local. También, como se puede ver en este reporte, ketodex se constituye una alternativa para una gran variedad de pacientes: edades extremas, estómago lleno, comorbilidades importantes, ASA III/IV, extubación reciente después de ventilación mecánica prolongada y pacientes con delirium, todos los cuales podrían haber tenido alguna complicación con el uso de otros sedantes como propofol, como lo reportó el estudio de Woodward y cols[5]. Por último, se postulaba que si el paciente no cooperaba los CAM no eran una opción, teniendo que optar por la anestesia general[12}. Sin embargo, en este reporte se utilizó ketodex aun en pacientes con delirium y con dificultad para cooperar con los CAM, otorgando una sedación profunda (RSS modificada > 5) y anestesia segura, evitando la anestesia general que podría haber sido aún más desafiante y que no era la elección de la familia al menos en dos de estos casos. Dado que se incluyó un caso de CAM/ AFP en pediatría, varios reportes de ketodex avalan su uso y seguridad[30],[31],[32], prefiriéndola sobre propofol en niños con alguna comorbilidad, por la mayor cantidad de complicaciones reportadas[19],[20].
En esta revisión se concluye ketodex podría ser una opción más segura en pacientes complejos (ASA 3-4) y en situaciones de urgencia fuera del quirófano, donde a menudo no es posible llevar a cabo ensayos clínicos prospectivos o aleatorizados debido a la falta de consentimiento por el delirium o la urgencia del procedimiento en sí. Aun así, resulta fundamental contar con estudios de mayor escala de ketodex que permitan agrupar un mayor número de pacientes en el escenario de urgencia para ratificar sus ventajas y así poder hacer una recomendación basada en evidencia de mejor calidad.
-
Referencias
1. Wong T, Georgiadis PL, Urman RD, Tsai MH. Non-Operating Room Anesthesia: Patient Selection and Special Considerations. Local Reg Anesth. 2020 Jan;13:1–9. https://doi.org/10.2147/LRA.S181458 PMID:32021414
2. Nagrebetsky A, Gabriel RA, Dutton RP, Urman RD. Growth of nonoperating room anesthesia care in the United States: a contemporary trends analysis. Anesth Analg. 2017 Apr;124(4):1261–7. https://doi.org/10.1213/ANE.0000000000001734 PMID:27918331
3. Aguirre MM, Izquierdo C. Anestesia fuera de pabellón, es tiempo de proyectarla al futuro en su debido lugar. Revista Chilena de Anestesia. 2019;48(5):402–8. https://doi.org/10.25237/revchilanestv48n05.04 .
4. Boggs SD, Barnett SR, Urman RD. The future of nonoperating room anesthesia in the 21st century: emphasis on quality and safety. Curr Opin Anaesthesiol. 2017 Dec;30(6):644–51. https://doi.org/10.1097/ACO.0000000000000528 PMID:28984638
5. Woodward ZG, Urman RD, Domino KB. Safety of Non-Operating Room Anesthesia: A Closed Claims Update. Anesthesiol Clin. 2017 Dec;35(4):569–81. https://doi.org/10.1016/j.anclin.2017.07.003 PMID:29101947
6. American Society of Anesthesiologists (ASA). ASA statement on nonoperating room anesthetizing locations. Available at: https://www.asahq.org/standards-and-practice-parameters/statement-on-nonoperating-room-anesthesia-services. Accessed December 14, 2023.
7. Hinkelbein J, Lamperti M, Akeson J, Santos J, Costa J, De Robertis E, et al. European Society of Anaesthesiology and European Board of Anaesthesiology guidelines for procedural sedation and analgesia in adults. Eur J Anaesthesiol. 2018 Jan;35(1):6–24. https://doi.org/10.1097/EJA.0000000000000683 PMID:28877145
8. Das S, Ghosh S. Monitored anesthesia care: an overview. J Anaesthesiol Clin Pharmacol. 2015;31(1):27–9. https://doi.org/10.4103/0970-9185.150525 PMID:25788769
9. Cheney FW. The American Society of Anesthesiologists Closed Claims Project: what have we learned, how has it affected practice, and how will it affect practice in the future? Anesthesiology. 1999 Aug;91(2):552–6. https://doi.org/10.1097/00000542-199908000-00030 PMID:10443619
10. Chang B, Kaye AD, Diaz JH, et al. Interventional Procedures Outside of the Operating Room: Results From the National Anesthesia Clinical Outcomes Registry. J Patient Saf. 2015;1–7. https://doi.org/10.1097/PTS.0000000000000156 PMID:29461406
11. Hinkelbein J, Schmitz J, Lamperti M, Fuchs-Buder T. Procedural sedation outside the operating room. Curr Opin Anaesthesiol. 2020 Aug;33(4):533–8. https://doi.org/10.1097/ACO.0000000000000885 PMID:32628400
12. Sohn HM, Ryu JH. Monitored anesthesia care in and outside the operating room. Korean J Anesthesiol. 2016 Aug;69(4):319–26. https://doi.org/10.4097/kjae.2016.69.4.319 PMID:27482307
13. Sheahan CG, Mathews DM. Monitoring and delivery of sedation. Br J Anaesth. 2014 Dec;113(2 Suppl 2):ii37–47. https://doi.org/10.1093/bja/aeu378 PMID:25498581
14. American Society of Anesthesiologists Task Force on Sedation and Analgesia by Non-Anesthesiologists. Practice guidelines for sedation and analgesia by non-anesthesiologists. Anesthesiology. 2002 Apr;96(4):1004–17. https://doi.org/10.1097/00000542-200204000-00031 PMID:11964611
15. Ramsay MA, Savege TM, Simpson BR, Goodwin R. Controlled sedation with alphaxalone-alphadolone. BMJ. 1974 Jun;2(5920):656–9. https://doi.org/10.1136/bmj.2.5920.656 PMID:4835444
16. Singh A, Iyer KV, Maitra S, Khanna P, Sarkar S, Ahuja V, et al. Ketamine and dexmedetomidine (Keto-dex) or ketamine and propofol (Keto-fol) for procedural sedation during endoscopic retrograde cholangiopancreatography: which is safer? A randomized clinical trial. Indian J Gastroenterol. 2022 Dec;41(6):583–90. https://doi.org/10.1007/s12664-022-01291-y PMID:36576697
17. Kakarla A, Senapati LK, Das A, Acharya M, Sukanya S, Pradhan A. Intravenous Dexmedetomidine-Ketamine Versus Ketamine-Propofol for Procedural Sedation in Adults Undergoing Short Surgical Procedures: A Randomized Controlled Trial. Cureus. 2023 Jun;15(6):e40676. https://doi.org/10.7759/cureus.40676 PMID:37485154
18. Louër R, Szeto M, Grasfield R, McClain CD, Urman RD, Brovman EY. Trends in pediatric non-operating room anesthesia: Data from the National Anesthesia Clinical Outcomes Registry. Paediatr Anaesth. 2023 Jun;33(6):446–53. https://doi.org/10.1111/pan.14644 PMID:36726283
19. Cravero JP, Beach ML, Blike GT, Gallagher SM, Hertzog JH; Pediatric Sedation Research Consortium. The incidence and nature of adverse events during pediatric sedation/anesthesia with propofol for procedures outside the operating room: a report from the Pediatric Sedation Research Consortium. Anesth Analg. 2009 Mar;108(3):795–804. https://doi.org/10.1213/ane.0b013e31818fc334 PMID:19224786
20. Maddirala S, Theagrajan A. Non-operating room anaesthesia in children. Indian J Anaesth. 2019 Sep;63(9):754–62. https://doi.org/10.4103/ija.IJA_486_19 PMID:31571689
21. Ghojazadeh M, Sanaie S, Paknezhad SP, Faghih SS, Soleimanpour H. Using ketamine and propofol for procedural sedation of adults in the emergency department: a systematic review and meta-analysis. Adv Pharm Bull. 2019 Feb;9(1):5–11. https://doi.org/10.15171/apb.2019.002 PMID:31011553
22. Chang B, Urman RD. Non-operating room anesthesia: the principles of patient assessment and preparation. Anesthesiol Clin. 2016 Mar;34(1):223–40. https://doi.org/10.1016/j.anclin.2015.10.017 PMID:26927750
23. Kumar A, Kohli A. Comeback of ketamine: resurfacing facts and dispelling myths. Korean J Anesthesiol. 2021 Apr;74(2):103–14. https://doi.org/10.4097/kja.20663 PMID:33423410
24. Beloeil H, Garot M, Lebuffe G, Gerbaud A, Bila J, Cuvillon P, et al.; POFA Study Group; SFAR Research Network. Balanced Opioid-free Anesthesia with Dexmedetomidine versus Balanced Anesthesia with Remifentanil for Major or Intermediate Noncardiac Surgery. Anesthesiology. 2021 Apr;134(4):541–51. https://doi.org/10.1097/ALN.0000000000003725 PMID:33630043
25. Fonseca FJ, Ferreira L, Rouxinol-Dias AL, Mourão J. Effects of dexmedetomidine in non-operating room anesthesia in adults: a systematic review with meta-analysis. Braz J Anesthesiol. 2023;73(5):641–64. https://doi.org/10.1016/j.bjane.2021.12.002 PMID:34933035
26. Tobias J. D. Dexmedetomidine and ketamine: an effective alternative for procedural sedation?. Pediatric critical care medicine : a journal of the Society of Critical Care Medicine and the World Federation of Pediatric Intensive and Critical Care Societies 2012; 13(4), 423–427. https://doi.org/10.1097/PCC.0b013e318238b81c..
27. Esmaillian M, Kouhestani S, Azizkhani R, Heydari F, Safavi MR. Dexmedetomidine versus propofol: An effective combination with ketamine for adult procedural sedation: A randomized clinical trial. Am J Emerg Med. 2023 Nov;73:95–101. https://doi.org/10.1016/j.ajem.2023.08.025 PMID:37639920
28. Song Y, Shim JK, Song JW, Kim EK, Kwak YL. Dexmedetomidine added to an opioid-based analgesic regimen for the prevention of postoperative nausea and vomiting in highly susceptible patients: A randomised controlled trial. Eur J Anaesthesiol. 2016 Feb;33(2):75–83. https://doi.org/10.1097/EJA.0000000000000327 PMID:26258655
29. Jalowiecki P, Rudner R, Gonciarz M, Kawecki P, Petelenz M, Dziurdzik P. Sole use of dexmedetomidine has limited utility for conscious sedation during outpatient colonoscopy. Anesthesiology. 2005 Aug;103(2):269–73. https://doi.org/10.1097/00000542-200508000-00009 PMID:16052108
30. Li HP, Liu KP, Yao L. Dexmedetomidine in combination with ketamine for pediatric procedural sedation or premedication: A meta-analysis. Am J Emerg Med. 2021 Dec;50:442–8. https://doi.org/10.1016/j.ajem.2021.08.073 PMID:34492589
31. Goyal R, Singh S, Shukla RN, Patra AK, Bhargava DV. Ketodex, a combination of dexmedetomidine and ketamine for upper gastrointestinal endoscopy in children: a preliminary report. J Anesth. 2013 Jun;27(3):461–3. https://doi.org/10.1007/s00540-012-1538-8 PMID:23223916
32. Magoon R, Choudhary N, Wadhawan S. Ketodex for MRI sedation in syndromic children with congenital cardiac anomalies – A case series. Indian J Anaesth. 2022 Jun;66(6):456–9. https://doi.org/10.4103/ija.ija_606_21 PMID:35903587
33. Grégoire C, De Kock M, Henrie J, Cren R, Lavand’homme P, Penaloza A, et al. Procedural Sedation With Dexmedetomidine in Combination With Ketamine in the Emergency Department. J Emerg Med. 2022 Aug;63(2):283–9. https://doi.org/10.1016/j.jemermed.2022.01.017 PMID:35550843

 ORCID
ORCID