Jonatan Vargas Caño1, Martín Zabalza Murillo1, Silvia Valdivieso Fernández1, Karmelo Intxaurraga Fernández1, Sorkunde Telletxea Benguria1
Recibido: 29-07-2022
Aceptado: 30-01-2023
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 3 pp. 289-292|https://doi.org/10.25237/revchilanestv53n3-14
PDF|ePub|RIS
Paradoxical CO2 embolism after laparoscopic liver resection
Abstract
Paradoxical carbon dioxide (CO2) embolism in laparoscopic partial hepatectomy is a rare event, but a recognized source of ischemic brain injury[1]. Despite not being common, due to its high morbidity, we consider essential to acquire the necessary skills to recognize and treat it. Therefore, we present the case of a 28-year-old man who, during a laparoscopic atypical liver resection, an episode of desaturation with a decreased in etCO2 is documented, without hemodynamic repercussions, which coincided with the incidental section of the middle suprahepatic vein. At the end of the surgical intervention, extubation is carried out, but at that time the patient begins an episode of agitation and disconnection from the environment, accompanied by desaturation, even with the reversal of the different drugs used intraoperatively, for which it is decided to reintubation and transfer to the Resuscitation Unit where CO2 embolism with neurological involvement is suspected and its management is continued.
Resumen
La embolia de dióxido de carbono (CO2) paradójica durante una hepatectomía parcial laparoscópica es un evento infrecuente, pero una reconocida fuente de lesiones isquémicas cerebrales[1]. A pesar de ser poco común, dada su alta morbilidad, consideramos fundamental adquirir las habilidades necesarias para reconocerla y tratarla. Por ello, presentamos el caso de un varón de 28 años que, durante una resección hepática atípica laparoscópica, se documenta un episodio de desaturación con disminución de etCO2, sin repercusión hemodinámica, que coincide con la sección incidental de la vena suprahepática media. Al finalizar la intervención quirúrgica se procede a la extubación, tras la cual el paciente inicia un episodio de agitación y desconexión del medio acompañado de desaturación a pesar de la reversión de los diferentes fármacos utilizados intraoperatoriamente. En consecuencia, se decide reintubación y traslado al Servicio de Reanimación donde se sospecha embolismo de CO2 con afectación neurológica y se continúa su manejo.
-
Introducción
La embolia gaseosa paradójica es una entrada de gas de la circulación venosa a la circulación arterial sistémica a través de una derivación de derecha a izquierda, como sucede en el foramen oval permeable (FOP)[2]. Dicho evento se ha de tener en consideración debido al aumento del número de procedimientos laparoscópicos. El CO2 es el gas más utilizado para la insuflación porque es incoloro, económico, no inflamable y, en condiciones fisiológicas, tiene una mayor solubilidad en sangre que el aire[3], lo que permite una rápida absorción en el torrente sanguíneo a través del peritoneo[4].
-
Caso clínico
Se presenta el caso de un hombre de 28 años, sano y mesomorfo, que ingresó en el hospital de forma programada para resección atípica de segmento V hepático por vía laparoscópica, por hallazgo accidental de LOE en una ecografía abdominal. Como antecedentes personales destacan: asma infantil sin tratamiento y consumidor ocasional de cannabis.
Durante el procedimiento quirúrgico, se evidenció un episodio de desaturación de hasta 91% con descenso brusco de etCO2 tras sección accidental de la vena suprahepática media durante el clampaje del hilio hepático. Ante la sospecha de embolia gaseosa, se detuvo la intervención quirúrgica e inmediatamente se colocó al paciente en posición de Trendelenburg y decúbito lateral izquierdo y se aumentó la FiO2 al 100%, recuperando rápidamente SpO2 óptimas y una auscultación pulmonar anodina. El paciente, con presión arterial monitorizada de manera no invasiva, no experimentó repercusión hemodinámi- ca, pese a percibir un leve soplo continuo en la auscultación cardiaca que transcurridos 5 minutos no se volvió a detectar. Por ello, tras optimización respiratoria del paciente, se reanudó la intervención vía laparoscópica llevando a cabo la sutura de la sección venosa sin nuevas complicaciones quirúrgicas.
Después de la reversión completa del bloqueo neuromuscular con 180 mg de sugammadex, alcanzando un TOF ratio > 90%, y observando apertura ocular espontánea con mecánica ventilatoria aparentemente óptima, realizando volumen tidal > 6 ml/kg sin necesidad de presión soporte, se procedió a la extubación. Sin embargo, el paciente mostró agitación, confusión, alteración de la conciencia y no respondió a ningún tipo de estímulo, con un valor de 8 en la escala de Glasgow (GCS). Además, se identificaron sibilantes espiratorios generalizados, que no cedieron a pesar de nebulización de salbutamol y 100 mg de hidrocortisona i.v. Asimismo, se descartó etiología farmacológica revirtiendo de nuevo el bloqueo neuromuscular y antagonizando los opiáceos. A pesar de las medidas adoptadas el paciente no mostró mejoría clínica, por lo que se volvió a intubar.
Se trasladó al Servicio de Reanimación intubado, sedoa- nalgesiado, relajado y conectado a ventilación mecánica bien adaptado al respirador con SpO2 del 100%, manteniéndose he- modinámicamente estable con TAM > 70 mmHg y frecuencia cardíaca en torno a 80 lpm. A su llegada, se realizó ecoscopia a pie de cama apreciando una función biventricular conservada, sin signos indirectos de sobrecarga del ventrículo derecho y sin objetivar burbujas de aire en cavidades derechas. Tampoco se detectaron imágenes sugestivas de patología pulmonar. Una vez obtenidos los parámetros gasométricos, con PaO2/FiO2 240, comprobar la correcta mecánica ventilatoria y observar el estado neurológico aparentemente adecuado con un GCS 10 (E3VtM6), se intentó de nuevo la extubación transcurridas 2 h desde su llegada a Reanimación. Aun así, el paciente mostró la misma clínica que en el intento anterior con agitación, nula conexión con el medio y desaturación con sibilantes generalizados. Dado el contexto en el que se iniciaron las incidencias durante el período intraoperatorio, se continuó sospechando accidente cerebrovascular por embolia de CO2. Se decidió realizar una tomografía computarizada cerebral y torácica, en la que no se objetivo lesión alguna, así como un electroencefalograma sin hallazgos compatibles con lesión cerebral.
Al día siguiente se realizó ventana neurológica con recuperación completa, por lo que se procedió a la extubación con éxito. Para confirmar la sospecha clínica de embolismo gaseoso paradójico, se realizó ecocardiografía cardiaca transtorácica reglada con el paciente en decúbito lateral izquierdo. No se objetivaron alteraciones cardiacas estructurales ni funcionales. Tampoco se demostró aumento de presiones en cavidades derechas. Se administró una solución salina agitada, visualizándose el paso importante de burbujas a cavidades izquierdas en los primeros 3 latidos (> 20 en situación basal) en la ventana apical 4 cámaras, siendo claramente sugestivo de FOP (Figura 1).
No se requirió el uso de Doppler color ni ninguna otra función ecográfica dada la óptima visualización del paso de burbujas en dicha ventana.
El paciente no volvió a mostrar clínica neurológica y se trasladó a planta de hospitalización a cargo del Servicio de Cirugía General para la continuación del control postoperatorio. Tras el alta domiciliaria, se citó en consultas de Neurología y Cardiología para revaloración del paciente y seguimiento del FOP.
-
Discusión
La embolia de CO2 es una complicación peligrosa de la cirugía laparoscópica y está asociada con una tasa de mortalidad del 28%[5]. Su tasa de incidencia es de aproximadamente 0,2%-1,5% para hepatectomía mayor laparoscópica, y aunque la incidencia real de la embolia paradójica es desconocida, se considera significativamente menor[6]. Tal y como sucede en el caso expuesto, la embolia paradójica puede suceder por la presencia de un FOP, que se ubica en la pared interauricular y permite una derivación derecha-izquierda desde el desarrollo fetal[7]. Generalmente, el foramen se cierra tras el nacimiento, pero puede permanecer permeable en el 25% de la población general[8].
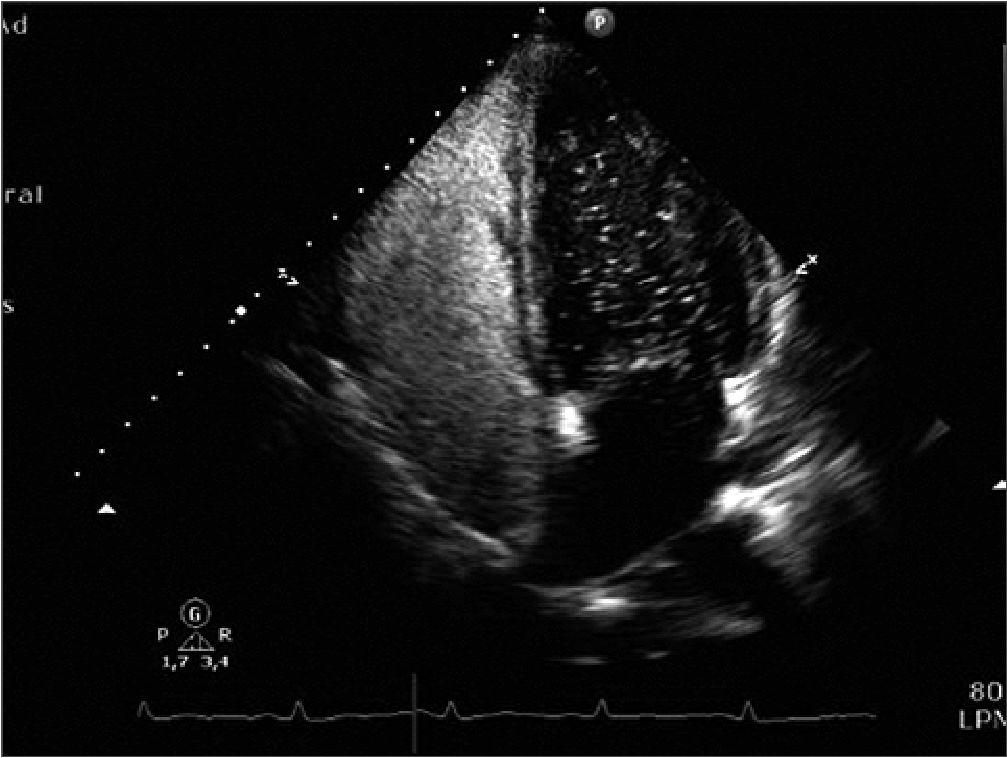
Figura 1. Plano de 4 cámaras ecocardiográfico en el que se observa el paso significativo interauricular de burbujas (> 20 burbujas).
La cirugía hepática parece conllevar una mayor probabilidad de embolia de CO2 por su proximidad con la vena cava infe- rior[2]. En un principio, la hepatectomía mayor laparoscópica tiene un riesgo aumentado de embolia gaseosa sobre la hepa- tectomía parcial, debido al mayor plano de sección hepática, mayor duración quirúrgica y a la disección de venas de alto ca- libre[6]. El riesgo aumenta si la intervención se lleva a cabo con una presión venosa central (PVC) baja para minimizar la pérdida de sangre, dado que la presión de insuflación de CO2 excederá la PVC[1].
La clínica es variable, desde una presentación asintomática hasta manifestaciones neurológicas por embolia paradójica con o sin FOP, obstrucción de la eyección del ventrículo derecho, insuficiencia cardíaca, hipotensión sistémica, taquipnea, disnea, cianosis, taquicardia o bradicardia, arritmia y asistolia[3],[4]. En nuestro caso, una FOP no conocida provocó una embolia gaseosa paradójica cuando el CO2 entró por el sistema venoso tras la sección de la vena suprahepática media. Aun así, el paciente permaneció hemodinámicamente estable durante todo el evento. Los síntomas neurológicos también pueden ser secundarios a la reducción del gasto cardíaco si hay inestabilidad hemodi- námica. Dichos síntomas pueden ser: convulsiones, pérdida de conocimiento, confusión, alteración del estado mental y despertar tardío[9]. Estos últimos síntomas se manifestaron en el caso presentado.
El diagnóstico inicial es de sospecha, tanto por la clínica como por la existencia de un factor de riesgo conocido[10]. La ecocardiografía transtorácica (ETT) y transesofágica (ETE) han sido utilizadas para documentar la presencia de aire en las cámaras cardíacas, así como en los grandes vasos. La ETT a pie de cama no es tan sensible como la ETE[10], que detecta émbolos gaseosos de 0,02 ml, por lo que es el método gold estándar[4]. Describir inicialmente el FOP como etiología de la embolia paradójica puede ser difícil por encontrarse cerrado en condiciones basales, puesto que su apertura y la derivación derecha-izquierda se producen al superar la presión de la aurícula derecha la presión de la izquierda[11]. En el caso presente, ante la sospecha de embolia gaseosa podría haberse examinado mediante ETE intraoperatoria la existencia del FOP. Se utilizó la ETT para el diagnóstico del FOP en un segundo tiempo administrando una solución salina agitada[7]. Además, en el tiempo intraqui- rúrgico también se podría emplear doppler transcraneal para el control de los casos con alto riesgo de embolia cerebral[10].
Otro recurso diagnóstico es la capnografía que es sensible y no invasiva[4]. Ante un evento de embolísmo aéreo suele producirse una caída del etCO2 por aumento del espacio muerto fisiológico y el empeoramiento de la relación ventilación-perfu- sión[10]. También se objetiva un aumento de la presión arterial pulmonar en caso de estar monitorizada[4], y un soplo de “rueda de molino” durante todo el ciclo cardíaco[10], como en la auscultación de nuestro paciente. En cuanto a las pruebas de imagen la sensibilidad y la especificidad suelen ser bajas por la rápida absorción aérea. La tomografía computarizada cerebral puede revelar gas intraparenquimatoso y edema difuso al igual que la RMN[10].
Para comenzar el manejo de la embolia de CO2, su insuflación para el neumoperitoneo debe interrumpirse[4], aunque si hay una lesión vascular visible, simultáneamente al inicio de las medidas de soporte que se describen a continuación, sería posible realizar una sutura laparoscópica del vaso para minimizar el daño embólico[12]. Es necesario tener en cuenta la relación riesgo-beneficio del paciente según la situación en el que se encuentre. En el caso presentado, se decidió detener el neumo- peritoneo, pero tras verificar la estabilidad cardiopulmonar, se procedió a la sutura de la vena vía laparoscópica.
El tratamiento de soporte consiste en proporcionar una alta FiO2 mediante la oxigenoterapia necesaria (valorando la reintubación y conexión a ventilación mecánica si es preciso) para aumentar la velocidad de reabsorción del embolismo aéreo. Con este mismo fin, se debe suspender el N2O en caso de estar siendo utilizado. Otra medida fundamental es la fluidoterapia y los vasopresores para la conservación tensional, con expansión de volumen para elevar la PVC y evitar una mayor entrada de gas en el sistema venoso[10]. La extracción aérea por el catéter venoso central tiene un beneficio limitado porque el volumen de aire recuperado suele ser inferior a 20 ml. Por ello, la canalización de una vía venosa central tras el evento es con- trovertida[10]. El posicionamiento del paciente debe realizarse colocándole en decúbito lateral izquierdo (maniobra de Durant), posición de Trendelenburg o posición de decúbito lateral izquierdo con la cabeza hacia abajo[10], para permitir que las burbujas de gas se eleven hasta el vértice de la aurícula derecha y evitar de este modo la entrada a la arteria pulmonar[4]. En pacientes con inestabilidad hemodinámica severa, se pueden realizar compresiones torácicas como último recurso para expulsar el aire del tracto de salida pulmonar hacia los vasos pulmonares más pequeños[10].
La terapia dirigida es la oxigenoterapia hiperbárica (HBOT) y se plantea en casos de embolización aérea arterial, inestabilidad hemodinámica y en déficits neurológicos. Preferiblemente debe comenzarse en las primeras 4-6 h, pero se ha informado de un beneficio con hasta 30 h de retraso. Esta terapia proporciona oxígeno a presiones superiores, alcanzando un estado de hi- peroxia sistémica y provocando que el nitrógeno se desplace desde el interior de la burbuja aérea, lo que a su vez reduce el tamaño de esta y el grado de obstrucción mecánica para detener el flujo sanguíneo arterial. Asimismo, mejora el suministro de oxígeno, mejora la isquemia tisular[10] y reduce la presión intracraneal[4]. En el caso expuesto, debido a la no disponibilidad de HBOT en nuestro centro y a la estabilidad cardiopulmo- nar del paciente, sin datos clínico-radiológicos de deterioro, se decidió no trasladarle.
-
Conclusión
Dada la morbimortalidad de la embolia gaseosa paradójica, es esencial conocer su presentación clínica, manejo y los factores de riesgo asociados, como es la manipulación quirúrgica de las estructuras venosas en la hepatectomía laparoscópica.
Si es sospechada, la ecocardiografía es el método diagnóstico más utilizado actualmente. El tratamiento debe ser inmediato con la desinflación del neumoperitoneo y el tratamiento de soporte (FiO2 100%, mantenimiento tensional con fluidoterapia y vasopresores y el cambio de posicionamiento del paciente). Por último, la HBOT es un recurso para considerar en pacientes seleccionados. Por tanto, ante una sintomatología neurológica no conocida al despertar y la embolia gaseosa paradójica ha de considerarse en el diagnóstico diferencial.
Financiación: La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de intereses: Los autores declaran no tener ningún conflicto de interés.
-
Referencias
1. Van Gorp V, Diltoer M, Delvaux G, Verborgh C. Delayed recovery following laparoscopic partial hepatectomy. Eur J Anaesthesiol. 2012 Feb;29(2):105–7. https://doi.org/10.1097/EJA.0b013e32834c149f PMID:21946825
2. Kawahara T, Hagiwara M, Takahashi H, et al. Cerebral Infarction by Paradoxical Gas Embolism During Laparoscopic Liver Resection with Injury of the Hepatic Vessels in a Patient without a Right-to-Left Systemic Shunt. Am J Case Rep. 2017;18:687-691. Published 2017 Jun 20. https://doi.org/10.12659/AJCR.903777 .
3. Li Y, Zhang E, Yuan H. Cerebral carbon dioxide embolism after kidney cancer laparoscopic surgery with full neurological recovery: A case report. Medicine (Baltimore). 2020 Jul;99(27):e20986. https://doi.org/10.1097/MD.0000000000020986 PMID:32629713
4. Park EY, Kwon JY, Kim KJ. Carbon dioxide embolism during laparoscopic surgery. Yonsei Med J. 2012 May;53(3):459–66. https://doi.org/10.3349/ymj.2012.53.3.459 PMID:22476987
5. Gutt CN, Oniu T, Mehrabi A, Schemmer P, Kashfi A, Kraus T, et al. Circulatory and respiratory complications of carbon dioxide insufflation. Dig Surg. 2004;21(2):95–105. https://doi.org/10.1159/000077038 PMID:15010588
6. Otsuka Y, Katagiri T, Ishii J, Maeda T, Kubota Y, Tamura A, et al. Gas embolism in laparoscopic hepatectomy: what is the optimal pneumoperitoneal pressure for laparoscopic major hepatectomy? J Hepatobiliary Pancreat Sci. 2013 Feb;20(2):137–40. https://doi.org/10.1007/s00534-012-0556-0 PMID:23001192
7. Buchholz S, Shakil A, Figtree GA, Hansen PS, Bhindi R. Diagnosis and management of patent foramen ovale. Postgrad Med J. 2012 Apr;88(1038):217–25. https://doi.org/10.1136/postgradmedj-2011-130368 PMID:22282739
8. Homma S, Messé SR, Rundek T, et al. Patent foramen ovale. Nat Rev Dis Primers. 2016;2:15086. Published 2016 Jan 21. https://doi.org/10.1038/nrdp.2015.86 .
9. McCarthy CJ, Behravesh S, Naidu SG, Oklu R. Air Embolism: Diagnosis, Clinical Management and Outcomes. Diagnostics (Basel). 2017;7(1):5. Published 2017 Jan 17. https://doi.org/10.3390/diagnostics7010005 .
10. O’Dowd L, Kelley M. Air embolism. In: Mandel J, ed. UpToDate, Waltham, MA. 2021. https://www.uptodate.com/contents/air-embolism?search=co2%20embolism&source=search_result&selectedTitle=2~150&usage_type=default&display_rank=2#H1009040456. Accessed February 6, 2022.
11. Kobayashi A, Shirozu K, Karashima Y, Matsushita K, Yamaura K. Cerebral infarction detected after laparoscopic partial hepatectomy: case report. JA Clin Rep. 2019;5(1):82. Published 2019 Dec 12. https://doi.org/10.1186/s40981-019-0301-7 .
12. Yao Y, Xu M. Carbon dioxide: the cause of devastating stroke without hemodynamic compromise during laparoscopic nephrectomy with injury of the inferior vena cava: A case report. Medicine (Baltimore). 2021 Feb;100(8):e24892. https://doi.org/10.1097/MD.0000000000024892 PMID:33663119

 ORCID
ORCID