Luis Ignacio Cortínez1
Recibido: 03-04-2024
Aceptado: 07-04-2024
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 4 pp. 369-376|https://doi.org/10.25237/revchilanestv53n4-11
PDF|ePub|RIS
Total intravenous anesthesia in obese
Abstract
The obese patient generally receives total intravenous anesthesia extrapolated from the pharmacological model of mesomorph patients. A new formula is proposed to adjust and adapt the values so that they are more adjusted and useful for obese patients.
Resumen
El paciente obeso en general recibe anestesia total intravenosa de extrapolación de mójelos farmacológicos de pacientes mesomorfos. Se propone una nueva fórmula para ajusta y adecuar los valores de tal forma que sean más ajustados y útiles para los obesos.
Introducción
La obesidad es una enfermedad crónica frecuente en adultos y niños, caracterizada por la presencia de un exceso de grasa corporal que conlleva un aumento en el riesgo de sufrir problemas de salud. Tradicionalmente, la administración de anestesia intravenosa (TIVA manual y TCI) en pacientes obesos se ha realizado utilizando esquemas de dosis extrapolados de pacientes no obesos. El uso de tales esquemas ha demostrado ser inadecuado en los obesos y, comúnmente, se asocian con sobredosis[1],[2]. Las estrategias de dosificación de anestésicos intravenosos en pacientes obesos requieren enfoques que difieren de los utilizados en pacientes delgados debido a los cambios fisiológicos y farmacológicos asociados con la obesidad[3]. En los últimos años se han desarrollado nuevas investigaciones y desarrollado modelos farmacocinéticos que incluyen información proveniente de pacientes obesos. Estos nuevos modelos han permitido mejorar los esquemas de dosificación y la seguridad de la TIVA y TCI en estos pacientes.
En este capítulo revisaremos primero los cambios de composición corporal del paciente obeso y sus implicancias en la dosificación de anestésicos intravenosos, analizando distintos descriptores de tamaño corporal. Luego describiremos escenarios clínicos simulados de TCI para propofol, remifentanil y dexmedetomidina en pacientes obesos, pediatricos y adultos.
Clasificación
El grado y la severidad de la obesidad, generalmente se definen en función del Índice de Masa Corporal (IMC), que se calcula como el peso total del cuerpo en kilogramos (kg) dividido por la altura en metros al cuadrado. Los pacientes pueden clasificarse con sobrepeso o levemente obesos si su IMC está entre 25 y 29,9 kg/m2, moderadamente a severamente obesos con un IMC de 30 a 39,9 kg/m2 y mórbidamente obesos si el IMC es > 40 kg/m2.
La obesidad es más difícil de definir en niños. La fórmula utilizada para calcular el IMC en adultos no es directamente aplicable en niños como medida para definir grados de obesidad. El peso no aumenta linealmente con la edad[4] o la altura. El IMC en niños debe interpretarse con referencia a la edad y el sexo. Un IMC de 20 kg/m2 en un joven adulto implica delgadez; el mismo IMC en un niño de 5 años sugiere un grado de obesi- dad[5]. Hay tablas disponibles que sirven como referencias para el IMC por edad[6]. Sin embargo, hay técnicas más precisas para diagnosticar y cuantificar la grasa corporal, como la bio impedanciometría y la densitometría corporal[7].
Cambios de composición corporal y sus implicancias farmacológicas
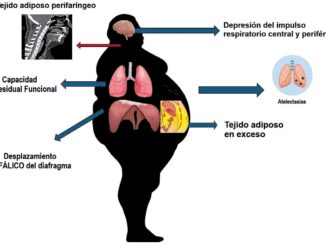
La obesidad se caracteriza por la presencia de exceso de grasa corporal. El aumento desproporcionado de la masa grasa va acompañado de un aumento moderado de la masa corporal magra y la tasa metabólica basal[8]-[11]. Además, el incremento en la secreción de péptidos proinflamatorios generados por el exceso de grasa visceral, junto con un mayor consumo de energía, debido a una mayor masa magra, están asociados con cambios significativos en el sistema cardiovascular, que incluyen: aumento del volumen sanguíneo, mayor volumen sistólico y un gasto cardíaco más alto[11].
El mayor tamaño corporal de los pacientes obesos generalmente, provoca un mayor volumen de distribución y mayor eliminación de medicamentos que los observados en un individuo delgado. Sin embargo, la magnitud de este aumento es variable, dependiendo de las propiedades físicas del medica- mento[12]. Además, la obesidad se considera una enfermedad inflamatoria crónica que se asocia con diabetes tipo 2, enfermedades cardiovasculares[11], compromiso renal[13], enfermedad hepática grasa[14] y fibrosis hepática[15]. La comorbilidad asociada puede tener impacto en la disposición de las drogas y contribuye en la alta variabilidad farmacocinética observada en esta población. Pese a los esfuerzos por construir modelos far- macocinéticos de obesos, persiste un alto grado de variabilidad interindividual no predicha con las covariables disponibles en los modelos actuales.
Descriptores de tamaño corporal
Uno de los principales problemas en la modelación farma- cocinética es el ajuste de los volúmenes y los aclaramientos al tamaño corporal. Idealmente, los modelos farmacocinéticos y los esquemas de dosificación deberían basarse en descriptores que reflejen con mayor precisión los cambios en la composición corporal de los obesos que sean relevantes para cada fármaco en particular. El descriptor necesario para predecir la dosis inicial o de carga puede no ser el mismo que se requiere para predecir la dosis de mantenimiento. Sorprendentemente, pocos estudios han intentado distinguir entre los efectos de la obesidad y aquellos debidos a diferencias en tamaño[16].
Peso real o peso total
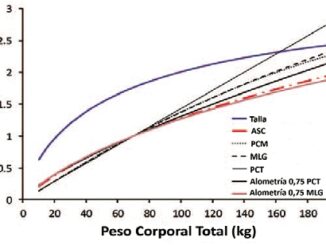
El peso total es el descriptor del tamaño corporal más utilizado en la dosificación de medicamentos. Los modelos de dosificación por kg de peso total asumen que los volúmenes y las velocidades de aclaramiento aumentan, proporcionalmente al peso de manera lineal. Dado que la depuración o aclaramien- to de un medicamento aumenta de manera no lineal con el peso[17], el uso de modelos proporcionales al peso, derivados de sujetos delgados, en pacientes obesos los pone en riesgo de sobredosis[18],[19] (Figura 1). Los conceptos alométricos han sido utilizados con éxito para describir cambios no lineales relacionados con el tamaño en las depuraciones o clearances. Un modelo alométrico escala los volúmenes usando un exponent de 1, las depuraciones o clearances usando un exponente de 3/4 y los tiempos de vida media con un exponente de 1/4, con respecto al tamaño corporal[2],[20],[21]. Los beneficios para la predicción de dosis utilizando alometría, particularmente en los extremos del peso están comprobados[2],[20],[22]-[25]. Una revisión de la escala de tamaño alométrico en obesos se puede encontrar en publicaciones previas[26]. Otras opciones de escalado no lineal incluyen el uso de otros descriptores como la superficie corporal[27], el peso magro[28], la masa libre de grasa (FFM) o la masa magra 7 y la masa de grasa normal (NFM) [29] (Figura 2).
Peso ideal
La altura y sexo se utilizan comúnmente para estimar el peso ideal en adultos[30]. Alternativamente, se puede derivar utilizando el método inverso del IMC. Este es el IMC ideal (IMC50; el valor medio del IMC de una población), corregido por la altura en metros (Ecuación 1).

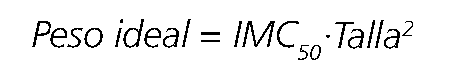
Aunque el peso ideal es, frecuentemente, utilizado para la dosificación de medicamentos, tanto en adultos obesos como en niños obesos[31], comúnmente es necesario una mayor dosis que la estimada a partir de este escalar, por lo que su uso podría asociarse a sub dosificación[17],[32]-[36]. Esto se explica porque las dosis ajustadas a peso ideal no cambian con el aumento de masa magra y/o masa grasa presentes en el paciente obeso. Es decir, un paciente normo peso y otro obeso de la misma estatura recibirían la misma dosis.
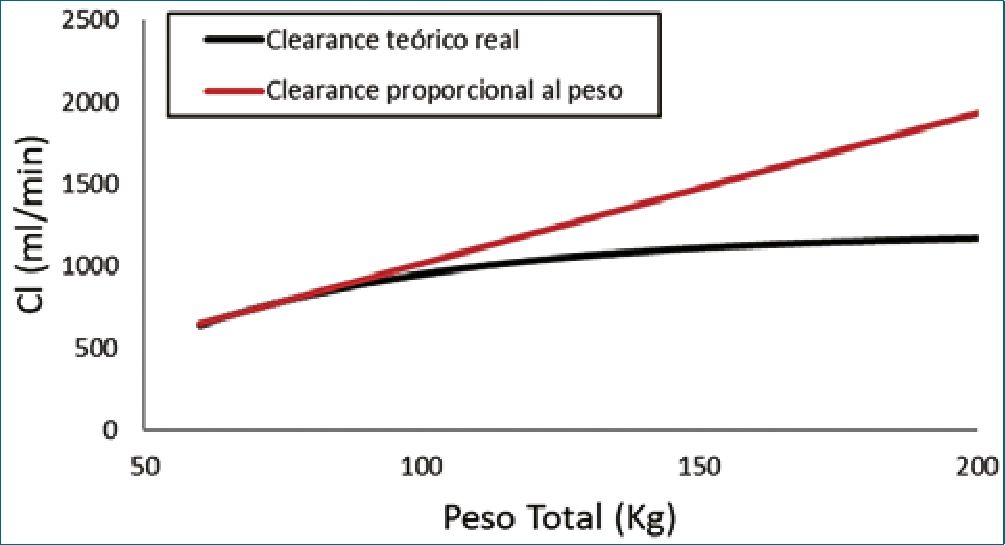
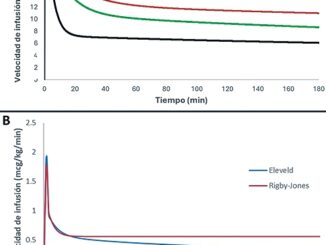
Figura 1. Métricas del tamaño corporal utilizadas para describir el acla- ramiento de una droga. Las predicciones se basan en un sujeto típico de 70 kg y se extrapolan a 200 kg. Existe una relación no lineal entre el peso y el aclaramiento y el uso del modelo lineal basado en el peso total sobreestima cada vez más el aclaramiento en adultos con un peso superior a 70 kg.
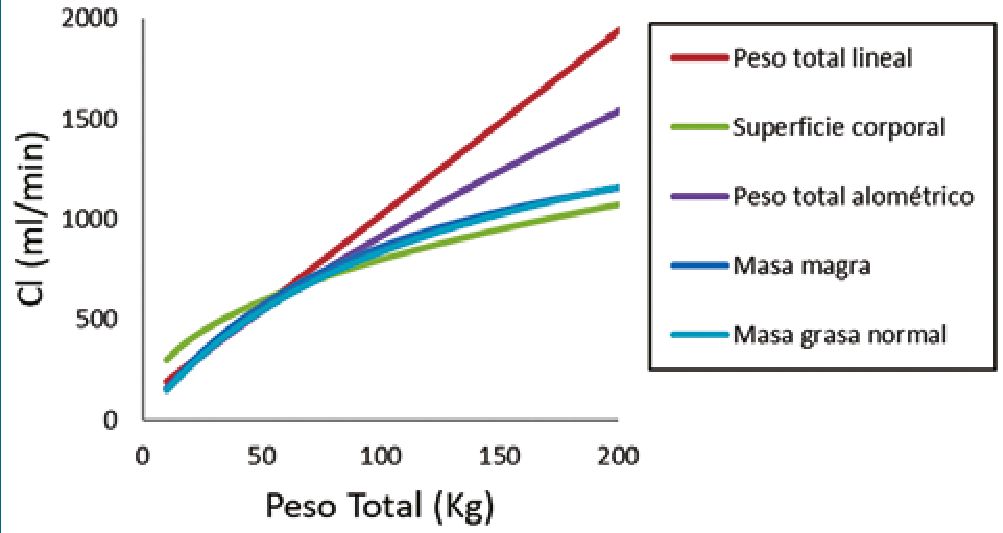
Figura 2. Distintas métricas utilizadas para describir la relación entre tamaño corporal y aclaramiento.
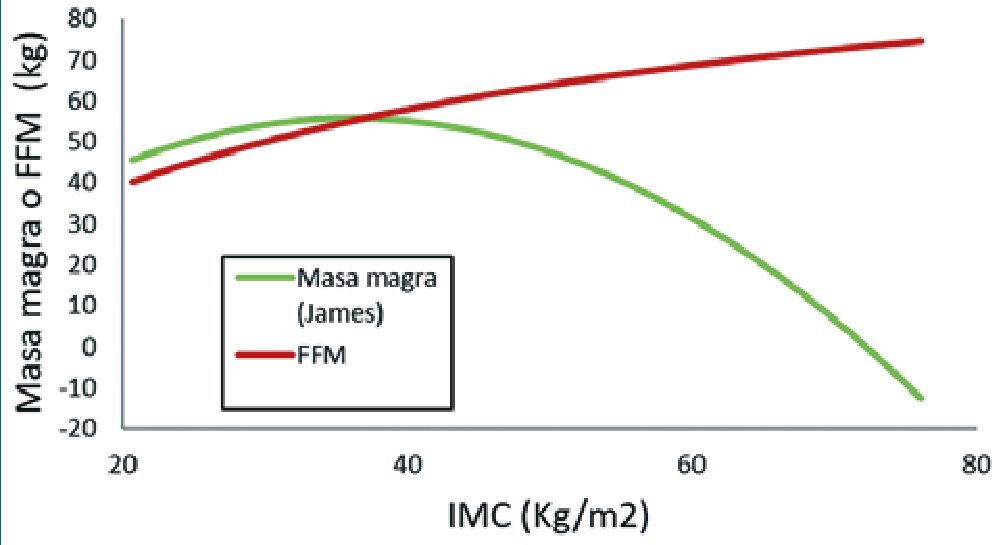
Figura 3. Comportamiento anómalo de ecuación de masa magra (ecuación descrita por James) en obesidad mórbida. Esta ecuación es utilizada en los modelos de Schnider y Minto.
Peso ajustado o peso corregido
Este descriptor se derivó para ajustar las dosis en personas obesas[37]. Utiliza el peso ideal más una cantidad variable de exceso de peso, que se estima para cada fármaco mediante un factor de corrección (FC). El peso ajustado con un FC de 0,4 (40% del exceso de peso) ha sido propuesto para ajustar las dosis de mantención de propofol con buenos resultados[34],[38]. Su cálculo es simple lo que lo hace muy atractivo para la clínica. (Ecuación 2).
Peso corregido = Peso ideal + FC (Peso total-Peso ideai)
Peso magro o masa magra
El peso total de un individuo se compone de masa magra y masa grasa. La masa magra es la diferencia entre el peso total y la masa grasa. Normalmente, la masa magra varía entre el 70% y el 90% del peso total. Esta proporción disminuye en la obesidad debido al exceso de grasa. Se ha afirmado que la masa magra es el descriptor de tamaño óptimo para la mayoría de los fármacos utilizados en anestesia con la suposición explícita de que la depuración de los fármacos está linealmente relacionada con la masa magra[39]-[42].
Hay problemas para implementar la masa magra en la práctica de la TCI porque las fórmulas (ecuación 3 y 4) utilizadas en los modelos de Schnider[43] y Minto[44], para calcular la masa magra[28], son inapropiadas para los pacientes con obesidad mórbida generando valores, progresivamente, menores después de un IMC crítico (42 kg/m2 en hombre 36 kg/m2 en la mujer)[45] (Figura 3). Los métodos utilizados para sortear este problema en las bombas TCI utilizadas para adultos incluyen el cálculo de una altura ficticia[46], un peso corporal ajustado[47]
o estableciendo límites en el peso máximo programable permi- tido[48].
Masa magra (hombre) = 1.W-Peso-0.0128-IMC-Peso
Masa magra (mujer) = 1.07^ Peso-0.0148dMGPeso
Existen cálculos simplificados para la estimación de la Masa Magra en niños o adultos, utilizando un peso ajustado con un factor de corrección de 30% asumiendo que en promedio el 30% del exceso de peso es tejido magro[40],[49],[50]. Esto se puede expresar de la siguiente manera (Ecuación 5):
Masa magra = Peso ideal+0.3^(Peso total-Peso ideai)
Masa libre de grasa
Una métrica de tamaño alternativa a la masa magra es la masa libre de grasa (FFM; “free fat mass”). La masa magra comprende músculos, huesos, órganos vitales y líquido extracelular. La FFM además incluye lípidos en el SNC, la médula ósea y las membranas celulares[51],[52]. Este lípido comprende menos del 3%-5% del peso corporal total y, en consecuencia, la FFM se utiliza a menudo, indistintamente, con la masa magra en la práctica clínica. La FFM se puede medir utilizando impedancio- metría o se puede predecir a partir del sexo, la altura y el peso corporal (Ecuación 6). Esta ecuación está validada para uso en obesidad mórbida.

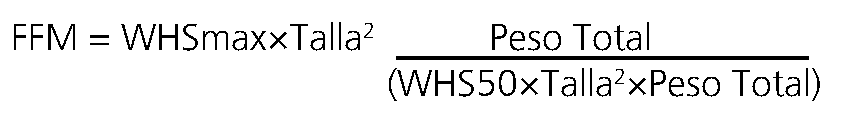
Para hombres, WHSmax es 42,92 kg.m-2 y WHS50 es 30,93 kg.m-2 y para mujeres WHSmax es 37,99 kg.m-2 y WHS50 es 35,98 kg.m-2.[7].
El ajuste de la composición corporal con FFM puede mejorar las predicciones de la tasa de filtración glomerular y el aclaramiento del fármaco[16]. El aclaramiento de remifentanilo y dexmedetomidina aumenta con la FFM[20],[23]. Además, la FFM funcionó bien para escalar dosis de remifentanilo[23], dex- medetomidina[20] y cisatracurio[53].
La extrapolación de la fórmula FFM desarrollada en adultos se ha descrito para niños de tan solo 3 años[54]. Este trabajo sugiere que las niñas tienen una FFM similar a la predicha en adultos según la altura, el peso y el sexo. Los niños tienen una FFM inferior a la prevista hasta aproximadamente el inicio de la pubertad y se acercan a las predicciones de los adultos en la edad adulta temprana.
Masa grasa normal
La idea de agregar una fracción de masa grasa a la FFM se ha utilizado para estimar la masa que describa mejor la estructura y la función al ser usada en modelación alometrica. Esta masa se ha denominado masa grasa normal (NFM). En[55] se puede encontrar una revisión de los conceptos alométricos y su aplicación al NFM. La NFM se calcula a partir de la FFM y la masa grasa (es decir, Peso Total menos FFM) y un parámetro adicional Ffat que es específico de la estructura biológica o variable de función (Ecuación 7). Este descripor fue superior a FFM para descibir los cambios de volumen de distribucion de dexmedetomidina en una población diversa que incluía niños y adultos (obesos y no obesos)[56].
NFM = FFM+Ffat •(Peso Total-FFM)
TCI de propofol en obesos
La limitación más importante para realizar TCI con propofol en pacientes con obesidad mórbida es la ausencia de modelos apropiados para esta población en las bombas TCI disponibles actualmente. Los modelos farmacocinéticos tradicionales empleados en TCI no se derivaron de pacientes obesos[43],[57] y las observaciones en los obesos revelaron una capacidad predic- tiva deficiente y una tendencia a la sobredosis[1],[47],[58]. Los cambios en el aclaramiento de propofol en adultos obesos se predicen mejor utilizando alometría y el peso como descriptor de tamaño en lugar de la masa magra o el peso ideal[59],[60]. Las consideraciones en adultos para aumentar la dosis de propofol mediante escalamiento alométrico del peso total son similares en niños (> 2 años)[2],[25],[61],[62].
De los nuevos modelos disponibles para pacientes obesos, los desarrollados por el grupo de Eleveld et al.[61],[63] merecen una mención especial, ya que ha mostrado un buen desempeño en pacientes adultos obesos[47]. Además, debería ser apropiado para su uso de un amplio rango etario. Existe otro modelo derivado para realizar TCI a sitio de efecto en pacientes con obesidad mórbida (IMC > 35 kg/m2). A diferencia de nuestro modelo anterior[59] y el primer modelo de Eleveld[61], derivados de individuos obesos y delgados, este modelo se desarrolló, exclusivamente, a partir de datos de pacientes obesos y escala linealmente todos los parámetros al peso total, lo que limita su uso sólo para los obesos. El modelo mostró un buen rendimiento predictivo en datos independientes de pacientes con obesidad mórbida.
Para comprender mejor el comportamiento de los modelos actuales de propofol en el paciente obeso, realizamos un escenario TCI simulado (Figura 4). Esta simulación muestra una concordancia, relativamente buena, entre ambos modelos desarrollados con individuos obesos (los modelos Eleveld y Corti- nez) y respalda el uso de peso ajustado con FC de 0,4 como una forma sencilla de mejorar el rendimiento del modelo Marsh. Este mismo ajuste puede ser usado en TIVA manual.
La TCI en niños obesos es más incierta que en adultos según los escasos estudios disponibles. Realizamos un escenario TCI simulado en un niño obeso para comparar los modelos Ab- salom[64], Kataria[65], y Eleveld[61] (Figura 5). Aunque ninguno de estos modelos se desarrolló con datos de niños obesos, se debe esperar que las relaciones alométricas del peso total incluidas en los modelos de Absalom y de Eleveld funcionen mejor que las relaciones lineales de peso total presentes en el modelo de Kataria. Este último modelo, probablemente, provocará una sobredosis en el niño obeso y pudiera ser una mejor opción utilizarlo con un peso corregido como se muestra en la Figura 5.
Dada la alta variabilidad farmacocinética de los pacientes obesos un ajuste de dosis basado en electroencefalografía es altamente recomendable en niños y adultos.
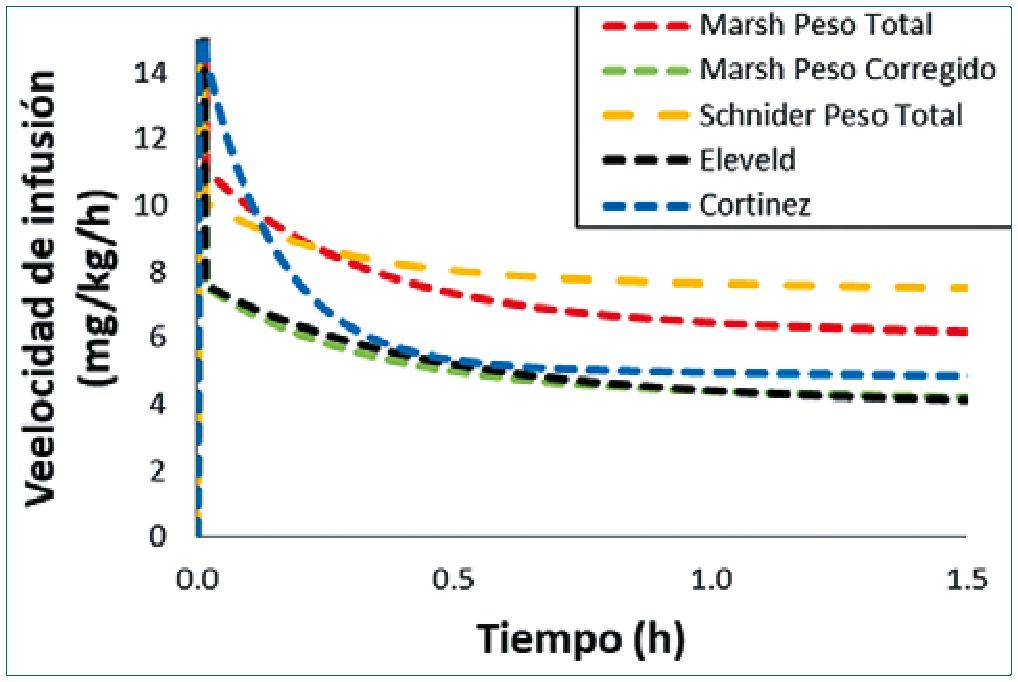
Figura 4. Velocidades de infusión de propofol previstas para alcanzar y mantener una concentración plasmática objetivo de 3 mcg/ml. Las predicciones se realizan con el modelo Marsh con peso total o peso ajustado, el modelo Schnider con peso total, el modelo Eleveld con peso total, y el nuevo modelo Cortinez con peso total. El escenario simulado es el de un sujeto masculino de 30 años, 170 cm, con un peso de 140 kg.
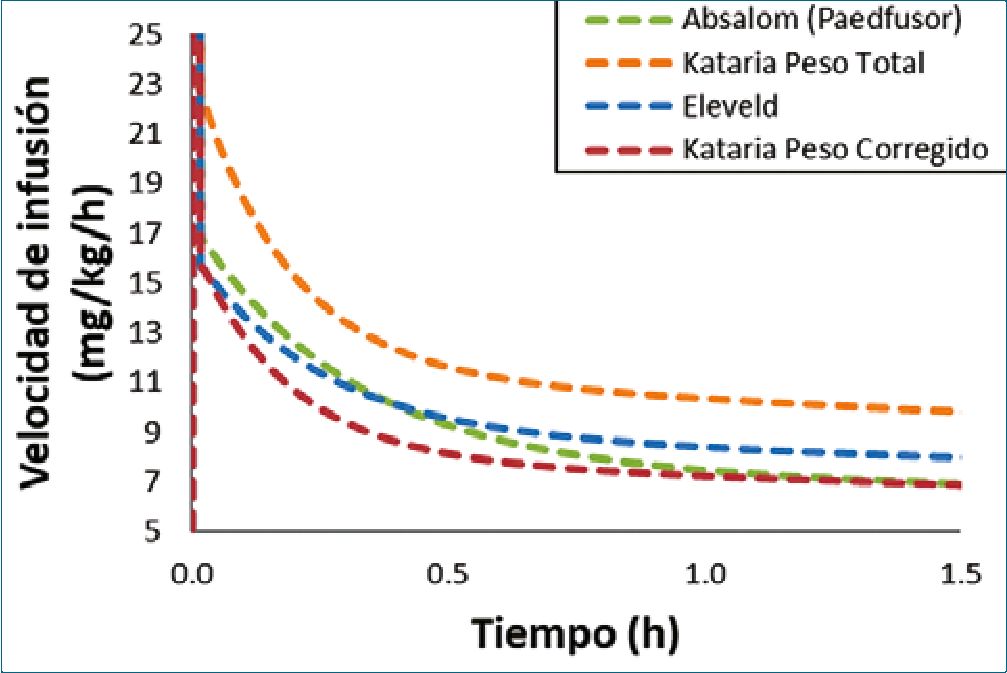
Figura 5. Velocidades de infusión de propofol previstas para alcanzar y mantener una concentración plasmática objetivo de 3 mcg/ml. Las predicciones se realizan con el modelo Absalom (Paedfusor), el modelo Kataria (peso total y peso ajustado FC=0,4) y el modelo Eleveld. El escenario simulado es el de un niño varón de 5 años, de 105 cm, con un peso total de 36 kg.
TCI de remifentanil en obesos
Al igual que con el propofol, la limitación más importante para realizar TCI con remifentanilo en pacientes con obesidad mórbida es la ausencia de modelos apropiados en las bombas TCI. El modelo Minto[44] actualmente incorporado en las bombas TCI no se obtuvo con individuos obesos. Además, este modelo escala algunos de sus parámetros (V1, V2, CL) con la masa magra, que se calcula con una ecuación que no es apropiada para personas con obesidad mórbida[66]. Egan y cols., describieron por primera vez que los regímenes de dosificación de remifentanilo en personas obesas y delgadas escalaban mejor utilizando la masa corporal magra que con el peso total 67. Un estudio reciente de Kim et al.[68], caracterizó la disposición de remifentanilo en sujetos adultos de pesos muy diferentes. El conjunto de datos utilizado para la construcción del modelo procedía de nueve estudios publicados anteriormente [43],[66],[68]-[74] e incluía rangos de IMC de 16,1 a 73,7 kg/m2. El modelo desarrollado incorporó peso total, masa magra y edad como covariables de los parámetros farmacocinéticos. Otro estudio, reciente realizado por Eleveld et al.[22], caracterizó el perfil farmacocinético y farmacodinámico de remifen- tanilo en pacientes adultos y niños no obesos a partir de tres conjuntos de datos anteriores[44],[69],[70]. Se derivó modelo final con todos los parámetros escalados a FFM[54] utilizando relaciones alométricas[61].
Un escenario TCI simulado muestra que tanto el modelo Eleveld[61] como el de Kim[68] disminuyen consistentemente sus velocidades de infusión (mcg/kg/min) en un paciente obeso (Figura 6). Esta simulación respalda el uso de ambos modelos en la población obesa. Aunque el modelo de Eleveld no se derivó con datos de sujetos obesos, la escala de tamaño de los volúmenes y los aclaramientos utilizando relaciones alométricas con la FFM parece predecir, adecuadamente, los cambios far- macocinéticos del remifentanilo en esta población. El modelo de Minto[44] predice esquemas de infusión más bajos en los obesos que los predichos en un paciente normo peso. A diferencia de lo que ocurre con el modelo de Schnider de propofol en obesos, la estimación errónea de la masa magra, en este modelo determina una pequeña subpredicción del aclaramien- to de remifentanilo en obesos (Figura 6).
No existen modelos pediátricos de remifentanilo derivados con datos de niños obesos y, por lo tanto, las predicciones del modelo son inciertas en esta población. La administración de remifentanilo mediante TCI sigue siendo problemática porque los niños tienen, en proporción a su tamaño, mayores volúmenes de aclaramiento y distribución que los adultos[69],[71]-[73]. Tanto el modelo de Eleveld[61] como el de Rigby-Jones[74] derivados de datos que incluyen niños se utilizan para simular un escenario de TCI (Figura 7). En coherencia con las simulaciones realizadas en sujetos adultos, se predicen tasas de infusión más bajas (mcg/kg/min) en un niño obeso que en un niño delgado.
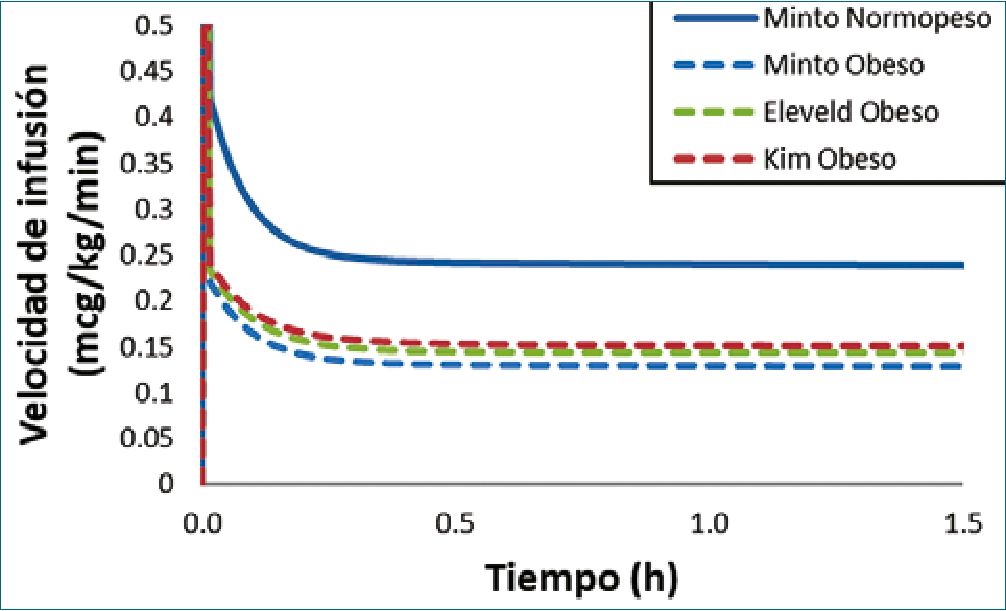
Figura 6. Velocidades de infusión de remifentanilo previstas para alcanzar y mantener una concentración plasmática objetivo de 6 ng/ml. Las predicciones se realizan con el modelo Minto (paciente normo peso y beso), el modelo Eleveld, y el modelo Kim. El escenario simulado es el de un sujeto masculino de 30 años, de 170 cm, con un peso total de 70 kg o 140 kg.
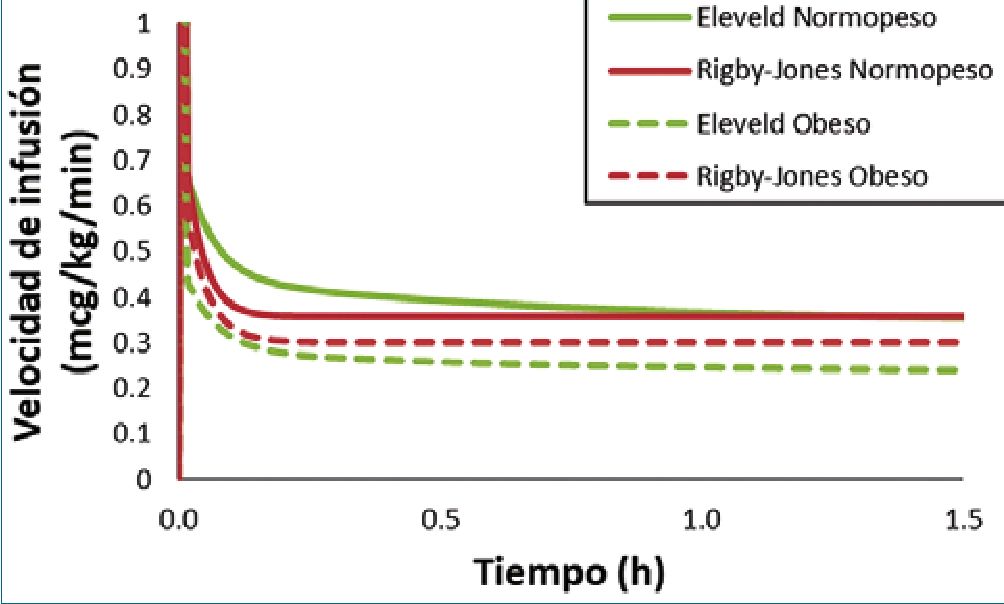
Figura 7. Velocidades de infusión de remifentanilo previstas para alcanzar y mantener una concentración plasmática objetivo de 6 ng/ml. Las predicciones se realizan con el modelo Rigby-Jones y el modelo Eleveld. El escenario simulado es el de un niño varón de 5 años, de 105 cm, con un peso total de 18 kg o 36 kg.
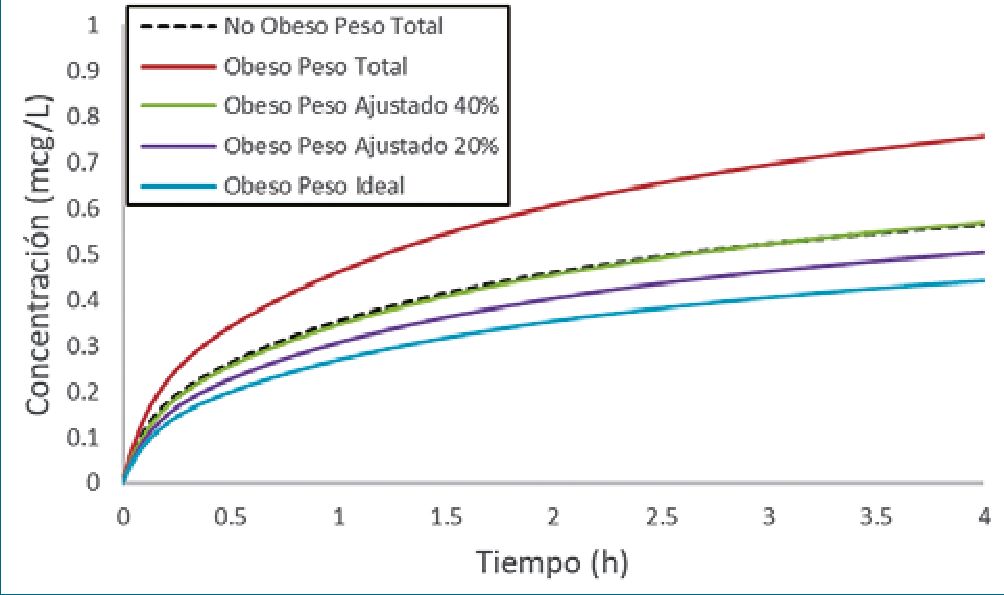
Figura 8. Infusiones continuas de dexmedetomidina de 0,5 mcg/kg/h utilizando diferentes descriptores de tamaño. De acuerdo con el modelo de Morse un peso ajustado de 0,4 en un paciente simulado de 140 kg resulta en concentraciones similares al esquema de peso real en paciente normo peso (70 kg).
TCI de dexmedetomidina en obesos
La dexmedetomidina se administra, frecuentemente, como adyuvante anestésico en TIVA, disminuyendo el consumo de propofol y opioides[76],[77]. Al igual que con las otras drogas revisadas, las infusiones de dexmedetomidina por kilogramo de peso total generan concentraciones más altas del fármaco en pacientes obesos que en los no obesos[75]. Estas concentraciones más altas se explican por el poco efecto de la masa grasa sobre los volúmenes y clearances de la droga. La masa libre de grasa (FFM) es un descriptor adecuado para escalar las dosis de dexmedetomidina en los obesos[76]. Un modelo farmaco- cinético universal construido con datos de adultos (obesos y no obesos) y niños ha sido descrito por Morse y colaboradores para dexmedetomidina[56]. En este modelo la FFM fue el mejor descriptor de los cambios de clearances asociados al tamaño corporal y NFM, un escalar que permite agregar una fracción de masa grasa a la FFM, fue el mejor descriptor para describir los cambios observados en los volúmenes de distribución. En consecuencia las velocidades de infusión de dexmedetomidina durante el mantenimiento anestésico (mcg/kg/h) deben reducirse con el aumento del peso corporal. Una forma simple puede ser utilizando un peso ajustado con un factor de corrección de aproximadamente 0,3-0,4 (Figura 8).
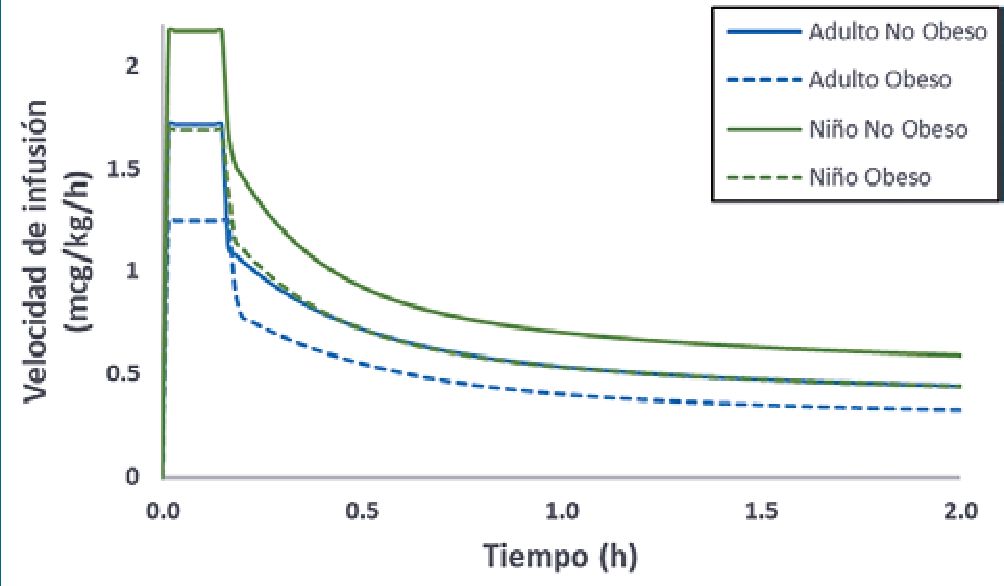
Figura 9. Velocidades de infusión de dexmedetomidina con bolo inicial de 10 minutos previstas para alcanzar y mantener una concentración plasmática objetivo de 0,5 ng/ml. Las predicciones se realizan con el modelo universal de Morse. El escenario simulado es el de un adulto de 30 años, de 170 cm, con un peso total de 70 kg o 140 kg y de un niño de 5 años, de 105 cm, con un peso total de 18 kg o 36 kg.
Actualmente, hay modelos de dexmedetomidina para adultos en bombas TCI. Lamentablemente, si bien se han, desarrollado modelos de dexmedetomidina para niños estos no están disponibles en las bombas de TCI[77]. La farmacocinética de dexmedetomidina se ha descrito en niños considerando escalamiento alométrico y maduración de clearances con la edad 78. Utilizando el modelo universal de dexmedetomidina de Morse se puede apreciar la disminución de dosis de mantención (mcg/ kg/h) necesarias en pacientes obesos tanto en adultos como en niños (Figura 9).
Referencias
1. Coetzee JF. Allometric or lean body mass scaling of propofol pharmacokinetics: towards simplifying parameter sets for target-controlled infusions. Clin Pharmacokinet. 2012 Mar;51(3):137–45. https://doi.org/10.2165/11596980-000000000-00000 PMID:22316280
2. Eleveld DJ, Proost JH, Absalom AR, Struys MM. Obesity and allometric scaling of pharmacokinetics. Clin Pharmacokinet. 2011 Nov;50(11):751–3. https://doi.org/10.2165/11594080-000000000-00000 PMID:21973272
3. Cheymol G. Effects of obesity on pharmacokinetics implications for drug therapy. Clin Pharmacokinet. 2000 Sep;39(3):215–31. https://doi.org/10.2165/00003088-200039030-00004 PMID:11020136
4. Sumpter AL, Holford NH. Predicting weight using postmenstrual age—neonates to adults. Paediatr Anaesth. 2011 Mar;21(3):309–15. https://doi.org/10.1111/j.1460-9592.2011.03534.x PMID:21320235
5. Must A, Anderson SE. Body mass index in children and adolescents: considerations for population-based applications. Int J Obes (Lond). 2006 Apr;30(4):590–4. https://doi.org/10.1038/sj.ijo.0803300 PMID:16570087
6. Cole TJ, Bellizzi MC, Flegal KM, Dietz WH. Establishing a standard definition for child overweight and obesity worldwide: international survey. BMJ. 2000 May;320(7244):1240–3. https://doi.org/10.1136/bmj.320.7244.1240 PMID:10797032
7. Janmahasatian S, Duffull SB, Ash S, Ward LC, Byrne NM, Green B. Quantification of lean bodyweight. Clin Pharmacokinet. 2005;44(10):1051–65. https://doi.org/10.2165/00003088-200544100-00004 PMID:16176118
8. Webb P. Energy expenditure and fat-free mass in men and women. Am J Clin Nutr. 1981 Sep;34(9):1816–26. https://doi.org/10.1093/ajcn/34.9.1816 PMID:7282608
9. McNeill G, Rivers JP, Payne PR, de Britto JJ, Abel R. Basal metabolic rate of Indian men: no evidence of metabolic adaptation to a low plane of nutrition. Hum Nutr Clin Nutr. 1987 Nov;41(6):473–83. PMID:3429266
10. Horgan GW, Stubbs J. Predicting basal metabolic rate in the obese is difficult. Eur J Clin Nutr. 2003 Feb;57(2):335–40. https://doi.org/10.1038/sj.ejcn.1601542 PMID:12571669
11. Wong C, Marwick TH. Obesity cardiomyopathy: pathogenesis and pathophysiology. Nat Clin Pract Cardiovasc Med. 2007 Aug;4(8):436–43. https://doi.org/10.1038/ncpcardio0943 PMID:17653116
12. Abernethy DR, Greenblatt DJ. Drug disposition in obese humans. An update. Clin Pharmacokinet. 1986;11(3):199–213. https://doi.org/10.2165/00003088-198611030-00002 PMID:3524955
13. Deliberato RO, Ko S, Komorowski M, de La Hoz MA, Frushicheva MP, Raffa JD, et al. Severity of illness scores may misclassify critically ill obese patients. Crit Care Med. 2017. PMID:29194147
14. Adams JP, Murphy PG. Obesity in anaesthesia and intensive care. Br J Anaesth. 2000 Jul;85(1):91–108. https://doi.org/10.1093/bja/85.1.91 PMID:10927998
15. Moretto M, Kupski C, da Silva VD, Padoin AV, Mottin CC. Effect of bariatric surgery on liver fibrosis. Obes Surg. 2012 Jul;22(7):1044–9. https://doi.org/10.1007/s11695-011-0559-y PMID:22108808
16. Han PY, Duffull SB, Kirkpatrick CM, Green B. Dosing in obesity: a simple solution to a big problem. Clin Pharmacol Ther. 2007 Nov;82(5):505–8. https://doi.org/10.1038/sj.clpt.6100381 PMID:17952107
17. Green B, Duffull SB. What is the best size descriptor to use for pharmacokinetic studies in the obese? Br J Clin Pharmacol. 2004 Aug;58(2):119–33. https://doi.org/10.1111/j.1365-2125.2004.02157.x PMID:15255794
18. Holford S, Allegaert K, Anderson BJ, Kukanich B, Sousa AB, Steinman A, et al. Parent-metabolite pharmacokinetic models for tramadol – tests of assumptions and predictions. J Pharmacol Clin Toxicol. 2014;2:1023.
19. Shibutani K, Inchiosa MA Jr, Sawada K, Bairamian M. Accuracy of pharmacokinetic models for predicting plasma fentanyl concentrations in lean and obese surgical patients: derivation of dosing weight (“pharmacokinetic mass”). Anesthesiology. 2004 Sep;101(3):603–13. https://doi.org/10.1097/00000542-200409000-00008 PMID:15329584
20. Cortínez LI, Anderson BJ, Holford NH, Puga V, de la Fuente N, Auad H, et al. Dexmedetomidine pharmacokinetics in the obese. Eur J Clin Pharmacol. 2015 Dec;71(12):1501–8. https://doi.org/10.1007/s00228-015-1948-2 PMID:26407689
21. Anderson BJ, McKee AD, Holford NH. Size, myths and the clinical pharmacokinetics of analgesia in paediatric patients. Clin Pharmacokinet. 1997 Nov;33(5):313–27. https://doi.org/10.2165/00003088-199733050-00001 PMID:9391745
22. Germovsek E, Barker CI, Sharland M, Standing JF. Scaling clearance in paediatric pharmacokinetics: all models are wrong, which are useful? Br J Clin Pharmacol. 2017 Apr;83(4):777–90. https://doi.org/10.1111/bcp.13160 PMID:27767204
23. Eleveld DJ, Proost JH, Vereecke H, Absalom AR, Olofsen E, Vuyk J, et al. An Allometric Model of Remifentanil Pharmacokinetics and Pharmacodynamics. Anesthesiology. 2017 Jun;126(6):1005–18. https://doi.org/10.1097/ALN.0000000000001634 PMID:28509794
24. Cortínez LI, Anderson BJ, Penna A, Olivares L, Muñoz HR, Holford NH, et al. Influence of obesity on propofol pharmacokinetics: derivation of a pharmacokinetic model. Br J Anaesth. 2010 Oct;105(4):448–56. https://doi.org/10.1093/bja/aeq195 PMID:20710020
25. Diepstraten J, Chidambaran V, Sadhasivam S, Esslinger HR, Cox SL, Inge TH, et al. Propofol clearance in morbidly obese children and adolescents: influence of age and body size. Clin Pharmacokinet. 2012;51(8):543–51. https://doi.org/10.1007/BF03261930.
26. Holford NH, Anderson BJ. Allometric size: the scientific theory and extension to normal fat mass. Eur J Pharm Sci. 2017 Nov;109S:S59–64. https://doi.org/10.1016/j.ejps.2017.05.056 PMID:28552478
27. Du Bois D, Du Bois EF. Clinical calorimetry: tenth paper. A formula to estimate the approximate surface area if height and weight be known. Arch Intern Med (Chic). 1916;17(6_2):863–71. https://doi.org/10.1001/archinte.1916.00080130010002.
28. James W. Research on obesity. London: Her Majesty’s Stationary Office; 1976.
29. Duffull SB, Dooley MJ, Green B, Poole SG, Kirkpatrick CM. A standard weight descriptor for dose adjustment in the obese patient. Clin Pharmacokinet. 2004;43(15):1167–78. https://doi.org/10.2165/00003088-200443150-00007 PMID:15568893
30. Pai MP, Paloucek FP. The origin of the “ideal” body weight equations. Ann Pharmacother. 2000 Sep;34(9):1066–9. https://doi.org/10.1345/aph.19381 PMID:10981254
31. Collier H, Nasim M, Gandhi A. Prescribing in obese children: how good are paediatricians? Arch Dis Child. 2017 Jan;102(1):61–2. https://doi.org/10.1136/archdischild-2016-310603 PMID:27461279
32. Anderson BJ, Holford NH. Getting the dose right for obese children. Arch Dis Child. 2017 Jan;102(1):54–5. https://doi.org/10.1136/archdischild-2016-311696 PMID:27655657
33. Badaoui R, Cabaret A, Alami Y, Zogheib E, Popov I, Lorne E, et al. Reversal of neuromuscular blockade by sugammadex in laparoscopic bariatric surgery: in support of dose reduction. Anaesth Crit Care Pain Med. 2016 Feb;35(1):25–9. https://doi.org/10.1016/j.accpm.2015.09.003 PMID:26597732
34. Servin F, Farinotti R, Haberer JP, Desmonts JM. Propofol infusion for maintenance of anesthesia in morbidly obese patients receiving nitrous oxide. A clinical and pharmacokinetic study. Anesthesiology. 1993 Apr;78(4):657–65. https://doi.org/10.1097/00000542-199304000-00008 PMID:8466066
35. Traynor AM, Nafziger AN, Bertino JS Jr. Aminoglycoside dosing weight correction factors for patients of various body sizes. Antimicrob Agents Chemother. 1995 Feb;39(2):545–8. https://doi.org/10.1128/AAC.39.2.545 PMID:7726530
36. Meyhoff CS, Lund J, Jenstrup MT, Claudius C, Sørensen AM, Viby-Mogensen J, et al. Should dosing of rocuronium in obese patients be based on ideal or corrected body weight? Anesth Analg. 2009 Sep;109(3):787–92. https://doi.org/10.1213/ane.0b013e3181b0826a PMID:19690247
37. Bauer LA, Edwards WA, Dellinger EP, Simonowitz DA. Influence of weight on aminoglycoside pharmacokinetics in normal weight and morbidly obese patients. Eur J Clin Pharmacol. 1983;24(5):643–7. https://doi.org/10.1007/BF00542215 PMID:6873144
38. Cortinez LI, De la Fuente N, Eleveld DJ, Oliveros A, Crovari F, Sepulveda P, Ibacache M, Solari S: Performance of Propofol Target-Controlled Infusion Models in the Obese: Pharmacokinetic and Pharmacodynamic Analysis. Anesth Analg 2014
39. Ingrande J, Lemmens HJ. Dose adjustment of anaesthetics in the morbidly obese. Br J Anaesth. 2010 Dec;105 Suppl 1:i16–23. https://doi.org/10.1093/bja/aeq312 PMID:21148651
40. Mortensen A, Lenz K, Abildstrøm H, Lauritsen TL. Anesthetizing the obese child. Paediatr Anaesth. 2011 Jun;21(6):623–9. https://doi.org/10.1111/j.1460-9592.2011.03559.x PMID:21429056
41. Lemmens HJ. Perioperative pharmacology in morbid obesity. Curr Opin Anaesthesiol. 2010 Aug;23(4):485–91. https://doi.org/10.1097/ACO.0b013e32833b0a8c PMID:20531173
42. Scherrer PD, Mallory MD, Cravero JP, Lowrie L, Hertzog JH, Berkenbosch JW; Pediatric Sedation Research Consortium. The impact of obesity on pediatric procedural sedation-related outcomes: results from the Pediatric Sedation Research Consortium. Paediatr Anaesth. 2015 Jul;25(7):689–97. https://doi.org/10.1111/pan.12627 PMID:25817924
43. Schnider TW, Minto CF, Gambus PL, Andresen C, Goodale DB, Shafer SL, et al. The influence of method of administration and covariates on the pharmacokinetics of propofol in adult volunteers. Anesthesiology. 1998 May;88(5):1170–82. https://doi.org/10.1097/00000542-199805000-00006 PMID:9605675
44. Minto CF, Schnider TW, Egan TD, Youngs E, Lemmens HJ, Gambus PL, et al. Influence of age and gender on the pharmacokinetics and pharmacodynamics of remifentanil. I. Model development. Anesthesiology. 1997 Jan;86(1):10–23. https://doi.org/10.1097/00000542-199701000-00004 PMID:9009935
45. Green B, Duffull S. Caution when lean body weight is used as a size descriptor for obese subjects. Clin Pharmacol Ther. 2002 Dec;72(6):743–4. https://doi.org/10.1067/mcp.2002.129306 PMID:12496756
46. La Colla L, Albertin A, La Colla G. Pharmacokinetic model-driven remifentanil administration in the morbidly obese: the ‘critical weight’ and the ‘fictitious height’, a possible solution to an unsolved problem? Clin Pharmacokinet. 2009;48(6):397–8. https://doi.org/10.2165/00003088-200948060-00005 PMID:19650678
47. Cortínez LI, De la Fuente N, Eleveld DJ, Oliveros A, Crovari F, Sepulveda P, et al. Performance of propofol target-controlled infusion models in the obese: pharmacokinetic and pharmacodynamic analysis. Anesth Analg. 2014 Aug;119(2):302–10. https://doi.org/10.1213/ANE.0000000000000317 PMID:24977639
48. Bouillon T, Shafer SL. Does size matter? Anesthesiology. 1998 Sep;89(3):557–60. https://doi.org/10.1097/00000542-199809000-00002 PMID:9743389
49. Forbes GB, Welle SL. Lean body mass in obesity. Int J Obes (Lond). 1983;7(2):99–107. PMID:6862762
50. Smith HL, Meldrum DJ, Brennan LJ. Childhood obesity: a challenge for the anaesthetist? Paediatr Anaesth. 2002 Nov;12(9):750–61. https://doi.org/10.1046/j.1460-9592.2002.00781.x PMID:12519133
51. Keys A, Brozek J. Body fat in adult man. Physiol Rev. 1953 Jul;33(3):245–325. https://doi.org/10.1152/physrev.1953.33.3.245 PMID:13088292
52. Lohman TG. Skinfolds and body density and their relation to body fatness: a review. Hum Biol. 1981 May;53(2):181–225. PMID:7239496
53. Li JY, Zou QR, Peng XM. [Pharmacokinetics of a cisatracurium dose according to fat-free mass for anesthesia induction in morbidly obese patients]. Nan Fang Yi Ke Da Xue Xue Bao. 2016 Oct;36(10):1396–400. PMID:27777205
54. Al-Sallami HS, Goulding A, Grant A, Taylor R, Holford N, Duffull SB. Prediction of Fat-Free Mass in Children. Clin Pharmacokinet. 2015 Nov;54(11):1169–78. https://doi.org/10.1007/s40262-015-0277-z PMID:25940825
55. Holford NH, Anderson BJ. Allometric size: the scientific theory and extension to normal fat mass. Eur J Pharm Sci. 2017 Nov;109S:S59–64. https://doi.org/10.1016/j.ejps.2017.05.056 PMID:28552478
56. Morse JD, Cortinez LI, Anderson BJ. A Universal Pharmacokinetic Model for Dexmedetomidine in Children and Adults. J Clin Med. 2020 Oct;9(11):9. https://doi.org/10.3390/jcm9113480 PMID:33126702
57. Marsh B, White M, Morton N, Kenny GN. Pharmacokinetic model driven infusion of propofol in children. Br J Anaesth. 1991 Jul;67(1):41–8. https://doi.org/10.1093/bja/67.1.41 PMID:1859758
58. Absalom AR, Mani V, De Smet T, Struys MM. Pharmacokinetic models for propofol—defining and illuminating the devil in the detail. Br J Anaesth. 2009 Jul;103(1):26–37. https://doi.org/10.1093/bja/aep143 PMID:19520702
59. Cortínez LI, Anderson BJ, Penna A, Olivares L, Muñoz HR, Holford NH, et al. Influence of obesity on propofol pharmacokinetics: derivation of a pharmacokinetic model. Br J Anaesth. 2010 Oct;105(4):448–56. https://doi.org/10.1093/bja/aeq195 PMID:20710020
60. van Kralingen S, Diepstraten J, Peeters MY, Deneer VH, van Ramshorst B, Wiezer RJ, et al. Population pharmacokinetics and pharmacodynamics of propofol in morbidly obese patients. Clin Pharmacokinet. 2011 Nov;50(11):739–50. https://doi.org/10.2165/11592890-000000000-00000 PMID:21973271
61. Eleveld DJ, Proost JH, Cortínez LI, Absalom AR, Struys MM. A general purpose pharmacokinetic model for propofol. Anesth Analg. 2014 Jun;118(6):1221–37. https://doi.org/10.1213/ANE.0000000000000165 PMID:24722258
62. Schüttler J, Ihmsen H. Population pharmacokinetics of propofol: a multicenter study. Anesthesiology. 2000 Mar;92(3):727–38. https://doi.org/10.1097/00000542-200003000-00017 PMID:10719952
63. Eleveld DJ, Colin P, Absalom AR, Struys MM. Pharmacokinetic-pharmacodynamic model for propofol for broad application in anaesthesia and sedation. Br J Anaesth. 2018 May;120(5):942–59. https://doi.org/10.1016/j.bja.2018.01.018 PMID:29661412
64. Absalom A, Kenny G. ‘Paedfusor’ pharmacokinetic data set. Br J Anaesth. 2005 Jul;95(1):110. https://doi.org/10.1093/bja/aei567 PMID:15941735
65. Kataria BK, Ved SA, Nicodemus HF, Hoy GR, Lea D, Dubois MY, et al. The pharmacokinetics of propofol in children using three different data analysis approaches. Anesthesiology. 1994 Jan;80(1):104–22. https://doi.org/10.1097/00000542-199401000-00018 PMID:8291699
66. James WP. Research on Obesity. London: Her Majesty’s Stationary Office; 1976.
67. Egan TD, Huizinga B, Gupta SK, Jaarsma RL, Sperry RJ, Yee JB, et al. Remifentanil pharmacokinetics in obese versus lean patients. Anesthesiology. 1998 Sep;89(3):562–73. https://doi.org/10.1097/00000542-199809000-00004 PMID:9743391
68. Kim TK, Obara S, Egan TD, Minto CF, La Colla L, Drover DR, Vuyk J, Mertens M, the Remifentanil Pharmacokinetics in Obesity I: Disposition of Remifentanil in Obesity: A New Pharmacokinetic Model Incorporating the Influence of Body Mass. Anesthesiology 2017; 126: 1019-1032
69. Ross AK, Davis PJ, Dear Gd GL, Ginsberg B, McGowan FX, Stiller RD, et al. Pharmacokinetics of remifentanil in anesthetized pediatric patients undergoing elective surgery or diagnostic procedures [table of contents]. Anesth Analg. 2001 Dec;93(6):1393–401. https://doi.org/10.1097/00000539-200112000-00008 PMID:11726413
70. Mertens MJ, Olofsen E, Engbers FH, Burm AG, Bovill JG, Vuyk J. Propofol reduces perioperative remifentanil requirements in a synergistic manner: response surface modeling of perioperative remifentanil-propofol interactions. Anesthesiology. 2003 Aug;99(2):347–59. https://doi.org/10.1097/00000542-200308000-00016 PMID:12883407
71. Davis PJ, Wilson AS, Siewers RD, Pigula FA, Landsman IS. The effects of cardiopulmonary bypass on remifentanil kinetics in children undergoing atrial septal defect repair. Anesth Analg. 1999 Oct;89(4):904–8. https://doi.org/10.1213/00000539-199910000-00016 PMID:10512263
72. Marsh DF, Hodkinson B. Remifentanil in paediatric anaesthetic practice. Anaesthesia. 2009 Mar;64(3):301–8. https://doi.org/10.1111/j.1365-2044.2008.05731.x PMID:19302645
73. Rigby-Jones AE, Priston MJ, Sneyd JR, McCabe AP, Davis GI, Tooley MA, et al. Remifentanil-midazolam sedation for paediatric patients receiving mechanical ventilation after cardiac surgery. Br J Anaesth. 2007 Aug;99(2):252–61. https://doi.org/10.1093/bja/aem135 PMID:17578905
74. Rigby-Jones AE, Nolan JA, Priston MJ, Wright PM, Sneyd JR, Wolf AR. Pharmacokinetics of propofol infusions in critically ill neonates, infants, and children in an intensive care unit. Anesthesiology. 2002 Dec;97(6):1393–400. https://doi.org/10.1097/00000542-200212000-00010 PMID:12459664
75. Cortínez LI, Anderson BJ, Holford NH, Puga V, de la Fuente N, Auad H, et al. Dexmedetomidine pharmacokinetics in the obese. Eur J Clin Pharmacol. 2015 Dec;71(12):1501–8. https://doi.org/10.1007/s00228-015-1948-2 PMID:26407689
76. Rolle A, Paredes S, Cortínez LI, Anderson BJ, Quezada N, Solari S, et al. Dexmedetomidine metabolic clearance is not affected by fat mass in obese patients. Br J Anaesth. 2018 May;120(5):969–77. https://doi.org/10.1016/j.bja.2018.01.040 PMID:29661414
77. Morse JD, Cortinez LI, Anderson BJ. Pharmacokinetic concepts for dexmedetomidine target-controlled infusion pumps in children. Paediatr Anaesth. 2021 Sep;31(9):924–31. https://doi.org/10.1111/pan.14235 PMID:34085357
78. Potts AL, Anderson BJ, Warman GR, Lerman J, Diaz SM, Vilo S. Dexmedetomidine pharmacokinetics in pediatric intensive care—a pooled analysis. Paediatr Anaesth. 2009 Nov;19(11):1119–29. https://doi.org/10.1111/j.1460-9592.2009.03133.x PMID:19708909
8909

 ORCID
ORCID