Florencia G. Cullari1, Stella Verlangieri1, Romina Suardiaz1
Recibido: 18-05-2024
Aceptado: 15-06-2024
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 4 pp. 429-432|https://doi.org/10.25237/revchilanestv53n4-19
PDF|ePub|RIS
Abstract
Laparoscopic surgery is currently the minimally invasive surgical approach of choice given its lower morbidity and mortality rate (0.3% – 1.8%) compared to conventional techniques. However, one of its complications, although rare, is the development of a tension capnothorax, which potential fatally hemodynamic alterations require an early diagnosis, justified in the physiopathogenesis and therapeutic management, that differs substantially from the approach of other tension pneumothorax with distinctive ethiopathogenesis. In this case report we describe an event of a bilateral tension capnothorax during a revision laparoscopic gastric bypass surgery. The objective is to discuss the importance of a little-known complication, and familiarize anesthesiologists with diagnostic methods and treatments, to lead to a fast and effective resolution.
Resumen
La cirugía laparoscópica es actualmente el abordaje quirúrgico, mínimamente, invasivo por elección dada su menor tasa de morbi-mortalidad (0,3% – 1,8%) comparada con las técnicas convencionales. Sin embargo, una de sus complicaciones, si bien infrecuente, es el desarrollo de un capnotorax a tensión, cuyas alteraciones hemodinámicas, potencialmente fatales, exigen un diagnóstico diferencial inmediato, justificado en su fisiopatogenia y manejo terapéutico, los cuales difieren, sustancialmente, del abordaje de un neumotórax a tensión aéreo de otra etiopatogenia. Se reporta el caso de un paciente que presentó Capnotórax Bilateral a tensión durante una cirugía de revisión de laparoscópico. El objetivo de este reporte de caso es discutir la importancia de una complicación poco conocida, y la familiarización de los anestesiólogos con métodos diagnósticos y terapéuticos, para llevar a su rápida y efectiva resolución.
-
Introducción
La cirugía laparoscópica es, actualmente, el abordaje quirúrgico mínimamente invasivo por elección, dada su menor tasa de morbi-mortalidad (0,3% – 1,8%) comparada con las técnicas convencionales[1]. Sin embargo, una de sus complicaciones, si bien infrecuente, es el desarrollo de un capnotorax a tensión, cuyas alteraciones hemodinámicas, potencialmente fatales, exigen un diagnóstico diferencial inmediato[2].
El capnotórax se define como la presencia de dióxido de carbono en el espacio pleural. Si bien la incidencia de neumotórax es un evento poco frecuente, descrito tan sólo en 1,9% de los pacientes durante un abordaje quirúrgico laparoscópico, el mismo responde a diferentes mecanismos fisiopatogénicos.
Mientras que el neumotórax parece ser más común durante un procedimiento de funduplicatura laparoscópica, este puede también desarrollarse durante cualquier procedimiento laparoscópico al abrir los conductos peritoneo-pleurales que existen como restos embrionarios. Dentro de las posibles etiologías se describe la ruptura de bullas pleurales en el contexto de barotrauma, colocación de vía central, defectos congénitos no reconocidos del diafragma, fistulas pleuroperitoneales hasta la misma difusión de dióxido de carbono peri-Cavo/Aórtico y lesiones directas de la pleura parietal (Tabla 1)[3],[4].
El capnotórax ocurre cuando una solución de continuidad en la pleura parietal permite, ante un gradiente de presión entre la cavidad abdominal y el espacio pleural, el pasaje de dióxido de carbono[5].
Se han hallado diferentes factores que aumenta la probabilidad de desarrollo, como son las presiones de insuflación de neumoperitoneo mayores a 15 mmHg, tiempos quirúrgicos mayores a 200 minutos, PetCO2 mayores a 50 mmHg, edad avanzada, re-operaciones y la utilización de más de 5 puertos laparoscópicos. Así mismo, se ha observado esta complicación en abordajes laparoscópicos, tanto intraperitoneales como retroperitoneales, de intervenciones quirúrgicas gástricas, urológicas como ginecológicas[6].
Tabla 1 Posibles causas de neumotórax intraoperatorio
| Difusión simple |
| Defectos congénitos: |
| 1. Espacios paraaórticos o paracavo |
| 2. Foramene diafragmático permeable congènito |
| 3. Espacio inguinal (vía retroperitoneo) |
| Iatrogénico: |
| 1. Disección hiatal o esofágica |
| 2. Barotrauma con bullas pleurales o parénquima enfisematoso |
| 3. Desgarro/trauma diafragmático |
| 4. Colocación de vía central |
| 5. Sitios de colocación del trocar (a través del tejido subcutáneo) |
| 6. Fallas en el equipo/conexiones incorrectas |
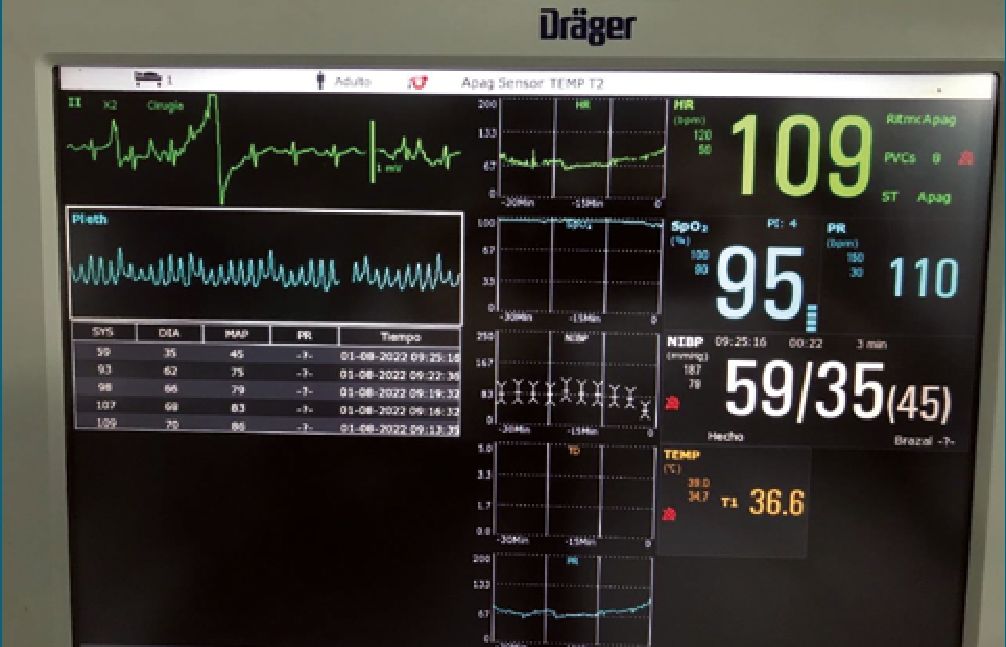
Figura 1. Imagen del monitoreo estándar intraoperatorio que muetra las tendencias de la evolución hemodinámica del paciente, obtenida de la pantalla monitor Primus Dräger marca registrada. Monitoreo de variables establecido cada 3 minutos. Nótese en el gráfico de curva de tendencias el cambio súbito de la estabilidad hemodinámica del paciente con caída de la PANI, SPO2 y PI junto con el aumento de la FC y un con cambio a patrón sinusoidal de la onda pletismográfica. Mantenimiento de la normotermia.
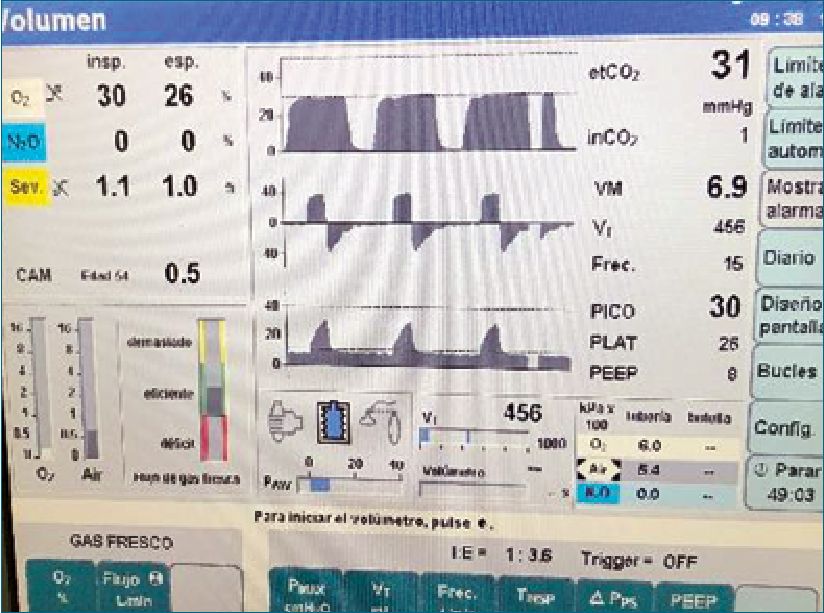
Figura 2. Parámetros ventilatorios en modo VCV, intraevento neumotórax. Imagen obtenida de Mesa de Anestesia Primus Dräger marca registrada. Nótese en el gráfico, caída PetCO2 31 mmHg, el exceso de tiempo de la fase espiratoria, aumento de Presión PICO 30 cmH2O, Presión Plateu 26 cmH2O. FIO 30%. 0,5 CAM. Flujo 0,85 L/ min. VT 450 ml. FR 15. I: E 1:3,6. PEEP 8 cmH2O.
-
Caso clínico
Paciente de sexo femenino, 54 años, 170 cm de altura y 85 kilogramos de peso corporal, ASA II, antecedentes de obesidad grado III, y cirugía bariátrica realizada en 2020, con posterior desarrollo de enfermedad por reflujo gastroesofágico refractario a tratamiento médico convencional, propuesta para revisión de cirugía bariátrica laparoscópica.
Se realiza anestesia general balanceada bajo monitoreo estándar, con maniobra de pre-oxigenación durante 3 minutos e inducción anestésica con secuencia rápida de intubación haciendo uso de 1 mg/kg de lidocaína, 200 mcg de fentanilo, 80 mg de propofol, 1,2 mg/kg de rocuronio.
Se lleva a cabo el mantenimiento anestésico con remifen- tanilo 0,3 mcg/kg/min, lidocaína 1 mg/kg/h, dexmedetomidina 0,4 mcg/kg/h y sevofluorano 0,5 CAM y seteo de la ventilación mecánica en modo Mandatorio Continuo Controlado por Volumen (VCV), utilizando un volumen Tidal (VT) de 7 ml/kg de peso corporal teórico (60 kg), FR 15 por minuto, R I:E 1:3,6, pausa inspiratoria 30%, PEEP 8 cmH2O, FIO 40% y Flujo 0,85 L/ min resultando en valores de Presión PICO 18 cmH2O, Presión Plateu 15 cmH2O, PetCO2 36 mmHg, FiO2 30%.
La insuflación del neumoperitoneo se inicia con presión de 15 mmHg, lo que produjo cambios en los parámetros de ventilación mecánica correspondiéndose con un aumento de Presión Pico 22 cmH2O, Presión Plateu 20 cmH2O, PetCO2 39 mmHg. La saturación se mantuvo en 98% con FiO2 30%. La tensión arterial permaneció estable en un rango de 100-110/60-70 mmHg (Figura 1) con dosis estresoras de noradrenalina 0,02 mcg/kg/ min.
A los 49 minutos de iniciada la relajación neuromuscular con rocuronio, se presenta una caída súbita del PetCO2 31 mmHg, aumento de Presión Pico 30 cmH20 y Presión Plateu 26 cmH2O, (Figura 2) con desaturación en primera instancia del 95% y posterior 88% con FIO2 30%. La curva pletismográfica muestra variabilidad donde se evidencia a 6,5 mm/seg un patrón sinusoidal no presente previamente interpretándose, como deterioro severo de la precarga (Figura 1). La tensión arterial cae repentinamente a 59/35 (54) (Figura 1). Se comienza con las maniobras de resucitación hemodinámicas, aumentando la FIO2 al 100%, administrando bolo de vasoactivo (noradrenalina 2 mcg) más aumentos titulados del mismo con bomba volumétrica a una dilución de 8 mcg/ml, junto con la expansión de 100 ml de Ringer Lactato.
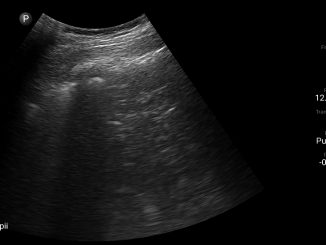
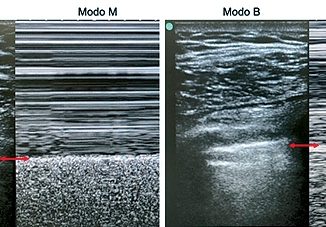
Se dispone de forma inmediata del equipo de ecografía para realización de ultrasonografía pulmonar, donde se observa ausencia de “Lung Sliding”, líneas B y “Signo del pulso pulmonar” junto con la presencia a nivel de la línea axilar media derecha en modo M del signo de “Lung Point” (Figura 3).
Al examen físico se comprueba ausencia de auscultación de ruidos ventilatorios en ambos hemitórax. Así mismo se constata la ausencia de intubación selectiva. Ante el diagnóstico de Capnotórax a tensión se avisa la situación al equipo de quirúrgico, los cuales informan sobre la probabilidad de lesión pleural. Una vez lograda la recuperación hemodinámica del paciente se consensua el descenso de la presión del neumoperitoneo a 10 mmHg, y procede a realizar maniobra de reclutamiento pulmonar en modo ventilación Mandatoria Continua controlada por Presión (PCV) con posterior titulación de la PEEP a 15 cmH2O. El equipo de cirujanos repara la pleura parietal y una vez finalizada la intervención quirúrgica se repite la ultrasonografía Pulmonar control, certificándose la re-expansión pulmonar bilateral con presencia de signo de “Lung Slinding”. Se discute con equipo de cirugía la conducta terapéutica coservadora de no colocación de tubos de avenamiento pleural y revierte relajante neuromuscular con sugammadex 2 mg/kg. La paciente es ex- tubada exitosamente sin complicaciones, siendo llevada a sala de recuperación, con ventilación espontánea, buena mecánica ventilatoria, saturando 96% con FIO2 21%, y hemodinamica- mente estable. Al cabo de 3 h se toma placa radiográfica de tórax control donde se comprueba ausencia capnotorax, y presencia de neumoperitoneo residual con signo de “Semiluna” suprahepática.
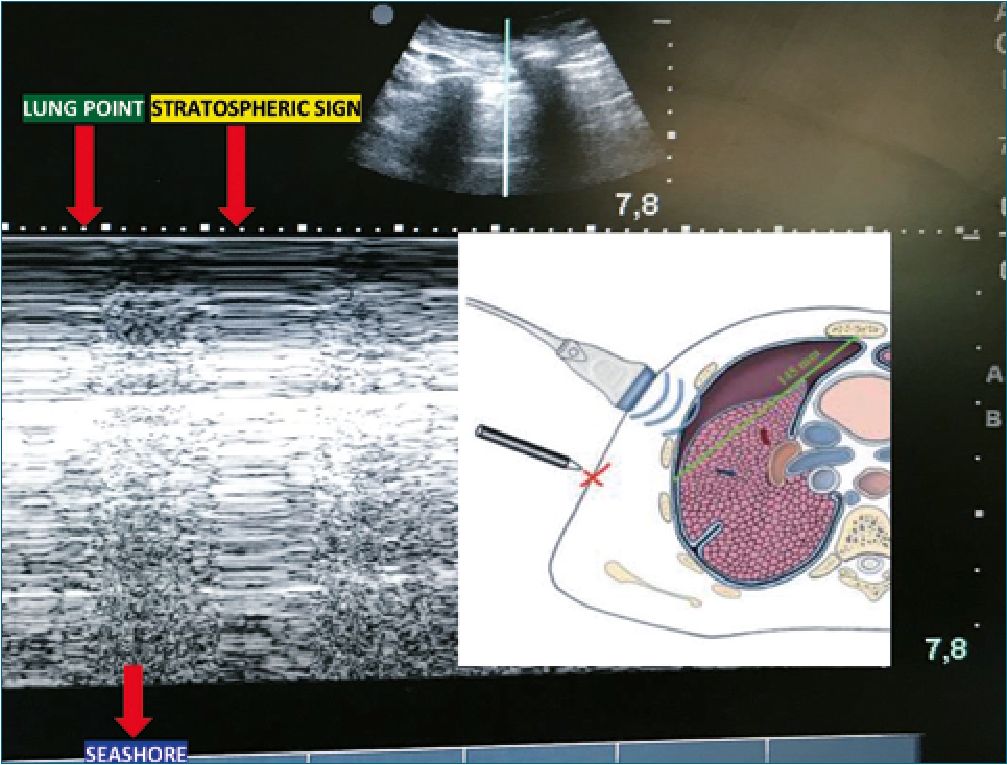
Figura 3. A: Signo del punto pulmonar (Lung Point sign) Imagen ecográfica tomada intraevento Capnotórax en paciente hemodinámicamente estable. Se utiliza sonda lineal de 6-12 MHz en plano longitudinal, línea medio axilar, hemitórax derecho 7°-8° costillas: en modo M se produce una sucesión de imágenes normales (arenosas:seashore) durante la inspiración y líneas horizontales (código de barra: stratospheric sign). Este punto corresponde a la zona de separación de la pleura viceral y parietal que durante la inspiración toma contacto con el pulmón en el seno de un neumotórax no masivo. Representa el sitio donde termina el neumotórax; B: Esquema extraído K. Touverud. CMI.
-
Discusión
Durante el abordaje quirúrgico laparoscópico el gasto cardíaco se ve comprometido por el aumento de las presiones intraabdominales. El dióxido de carbón CO2 inducirá cambios he- modinámicos, metabólicos y ventilatorios. Particularmente, la Compliance toraco-pulmonar disminuye y, en consecuencia, la Presión PICO y Presión Plateu aumentan rápidamente después del comienzo de la insuflación intraabdominal.
Por otro lado, el posicionamiento del paciente también impactará sobre el retorno venoso y la Precarga[1]. De esta manera, un aumento súbito de las presiones intrapleurales generará una mayor caída de la precarga sumado a un desplazamiento del mediastino y compresión de las cavidades cardíacas que comprometerán aún más el volumen sistólico. La velocidad con la cual se genera la descompensación hemodinámica dependerá en parte del tamaño del defecto pleural que actuará como válvula unidireccional.
Los hallazgos clínicos que deben hacer sospechar de un capnotorax son el aumento inexplicable de las presiones en la vía aérea en caso de ventilación en modo VCV (lo que permite en parte descartar la posibilidad de embolia gaseosa de dióxido de carbono, si se acompaña de aumento de PetCO2) o bien la caída súbita del VT en modo Presión Control. Hipoxemia acompañada de aumento de PetCO2 por difusión del dióxido de carbono CO2, a pesar que en el caso de los Capnotorax a tensión, esto se verá más tardíamente a una caída inicial del PetCO2 secundario a la descompensación hemodinámica. Otros signos
descriptos son la presencia de enfisema subcutáneo en rostro y cuello por la elevada solubilidad del dióxido de carbono[4].
En cuanto al diagnóstico, en la actualidad no se puede negar la importancia que ha tenido el desarrollo de la ultrasono- grafía pulmonar, constituyendo una herramienta segura, no invasiva, libre de radiación que permite evaluar al paciente “bed side” aplicándose de forma oportuna en diferentes entornos. La sensibilidad de la ecografía pulmonar en la detección del neumotórax es superior a la de la radiografía de tórax convencional y similar a la de la tomografía computarizada[7].
Para su diagnóstico debemos seguir el algoritmo propuesto por un Consenso de Expertos reconociendo tres signos con valor predictivo negativos y un signo con valor predictivo positivo[8].
-“Lung Sliding”. Se trata de un movimiento horizontal ligero y brillante de la línea pleural que permite con la confianza exclusión de neumotórax con un valor predictivo negativo del 100%. La ausencia de deslizamiento pulmonar no confirma neumotórax, ya que otras condiciones, como atelectasia masiva, intubación selectiva, Síndrome de Distrés Respiratorio Agudo (SDRA) y adherencias pleurales, pueden causar pleura inmóvil.
–Ausencia de Líneas B. Se propagan, verticalmente, como rayos ecogénicos. En neumotórax, su significado es indirecto, porque representa una demostración segura de la adherencia de la pleura visceral a la pleura parietal. La visualización de líneas B descarta neumotórax con un valor predictivo negativo de 100 %[7].
–Pulso pulmonar. La capa de aire intrapleural no permite la transmisión de movimientos horizontales y verticales a la pleura parietal. Por lo tanto, la visualización del pulso pulmonar descarta neumotórax[7].
–Signo del punto pulmonar (“Lung Point sign”). Contrariamente a los signos mencionados hasta ahora, el punto pulmonar permite la confirmación de neumotórax con una especificidad del 100%. Este punto corresponde a un fenómeno que ocurre en el sitio donde termina el neumotórax no masivo y se restablece el contacto normal entre la pleura parietal y visce- ral[9]. En modo M se caracteriza por una sucesión de imágenes normales (arenosas-seashore) durante la inspiración y líneas horizontales (código de barra, stratospheric sign) (Figura 3).
El tratamiento del capnotórax dependerá del estado hemo- dinámico del paciente y de sus condiciones basales. Se recomienda en aquellos pacientes hemodinamicamente estables o bien compensados, la reducción de las presiones del neumope- ritoneo sin necesidad de conversión de la cirugía laparoscópica a convencional, como así también solicitar al equipo quirúrgico la aspiración del capnotórax, a la vez que se realizan maniobras de reclutamiento y titulación de la PEEP que permitan reducir el gradiente de presión entre el abdomen y el espacio pleural. Estas maniobras suelen ser suficientes, aún ante capnotórax tensionales graves sin requerir la necesidad de punciones per- cutáneas en el segundo espacio intercostal para liberación de la tensión[1],[4]. Es sumamente necesario que previo a realizar dichas intervenciones se confirme el diagnóstico de capnotorax, descartando otros tipos de neumotórax aéreo donde las maniobras de reclutamiento y aumento de PEEP llevarían a mayor deterioro hemodinámico del paciente como se observa en neumotórax por barotrauma. Es infrecuente la necesidad de colocación de tubos de avenamiento pleural dado que la evidencia clínica demostró que la mayoría de los Capnotorax se resuelven con re-expasión pulmonar completa al cabo de 30 a 60 minutos, inclusive sin maniobras de aspiración. Este punto clave que diferencia el capnotórax de otros tipos de neumotórax aéreos está justificado en la alta solubilidad de dióxido de carbono CO2, 20 veces superior al nitrógeno, y por presentar un coeficiente de difusión mayor que los gases que componen el aire (predominantemente nitrógeno y oxígeno)[4]. Ahora bien, esta conducta conservadora se podrá llevar a cabo siempre y cuando la lesión pleural no se acompañe a daño parenquimatoso, o que la capacidad funcional respiratoria de base del paciente no se halle gravemente deteriorada. En un paciente hemodinámicamente inestable que no responde a los tratamientos conservadores, la toracocentesis seguida de la colocación de un tubo torácico para la descompresión es fundamental[4].
Cuando la decisión sea el manejo terapéutico conservador, es recomendable realizar un seguimiento adecuado del paciente con control radiográfico al corto plazo[3].
En conclusión, el capnotórax, si bien es una complicación infrecuente, la misma con un diagnóstico tardío constituye una entidad potencialmente mortal[2].
Ante el creciente aumento de las intervenciones laparoscó- picas en la actualidad, consideramos necesario que los anes-
tesiólogos se encuentren familiarizados con la posibilidad de desarrollo de este tipo de evento crítico, que consta de pocas publicaciones a nivel mundial, y ninguna de ellas con evidencia imagenológica intraoperatoria[10].
El diagnóstico precoz idealmente utilizando la ultrasonogra- fía pulmonar como “point of care” permitirá iniciar de forma inmediata una terapéutica más conservadora que la diferencia sustancialmente del abordaje terapéutico del resto de los neumotórax aéreos con distinto mecanismos fisiopatogénico, permitiendo así la reducción de la morbilidad asociada a dichos procedimientos[5],[6].
-
Referencias
1. Atkinson TM, Giraud GD, Togioka BM, Jones DB, Cigarroa JE. Cardiovascular and Ventilatory Consequences of Laparoscopic Surgery. Circulation. 2017 Feb;135(7):700–10. https://doi.org/10.1161/CIRCULATIONAHA.116.023262 PMID:28193800
2. Wu, Q., Zhang, H. Neumotórax por dióxido de carbono después de una 018-0662-x
3. Mehran A. MD1*; Oscar Brasesco, MD1; Eric De Velasco, MD2; Samuel Szomstein, MD1; Raul Rosenthal, MD1 The Bariatric Institute, Cleveland Clinic. Obes Surg. 2004;14(04):124–8. https://doi.org/10.1381/096089204772787428 PMID:14980047
4. Dunn T, Misra L. Intraoperative Capnothorax during Robotic Diaphragmatic Endometriosis Excision. Case Rep Anesthesiol. 2022 Apr;2022:5935312. https://doi.org/10.1155/2022/5935312 PMID:35520147
5. Joris JL, Chiche JD, Lamy ML. Pneumothorax during laparoscopic fundoplication: diagnosis and treatment with positive end-expiratory pressure. Anesth Analg. 1995 Nov;81(5):993–1000. PMID:7486090
6. Hirata T, Nakazawa A, Fukuda S, Hirota Y, Izumi G, Takamura M, et al. Four Cases of Postoperative Pneumothorax Among 2814 Consecutive Laparoscopic Gynecologic Surgeries: A Possible Correlation Between Postoperative Pneumothorax and Endometriosis. J Minim Invasive Gynecol. 2015;22(6):980–4. https://doi.org/10.1016/j.jmig.2015.04.023 PMID:25936271
7. Volpicelli G. Sonographic diagnosis of pneumothorax. Intensive Care Med. 2011 Feb;37(2):224–32. https://doi.org/10.1007/s00134-010-2079-y PMID:21103861
8. Acosta CM, Acosta AI, Tusman G. Ultrasonido pulmonar en el manejo del paciente crítico. Conceptos básicos y aplicación clínica. Revista Chilena de Anestesia [Internet]. 2020;49(5):640–67. http://dx.doi.org/10.25237/revchilanestv49n05-08
9. Cirocchi, Roberto,Skulec, Roman, Parizek, Tomas,David, Martin, Matousek, Vojtech,Cerny, Vladimir-Lung Point Sign in Ultrasound Diagnostics of Pneumothorax: Imitations and Variants. . Emergency Medicine International-Hindawi2021-2090-2840 https://doi.org/10.1155/2021/6897946
10. Mamic I, Danolic D, Puljiz M, et al. Neumotórax y neumomediastino como rara complicación de la cirugía laparoscópica. Acta Clin croata. 2016;55(3):501-4.

 ORCID
ORCID