Edgardo Banille1,5, Silvina Longo2, Alejandro Contreras1, Gabriel Paz3, Marco Jiménez Texcalpa4, Alejandro Peirone1
Recibido: 05-04-2024
Aceptado: 12-05-2024
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 6 pp. 557-571|https://doi.org/10.25237/revchilanestv53n6-04
PDF|ePub|RIS
Noninvasive hemodynamic monitoring second part
Abstract
In this second part of the “POCUS/Ecodynamics” approach, for the diagnosis of hemodynamic instability/shock states in pediatric patients, we will analyze the 5 “Ps”: 1- right atrial pressure (RAP); 2- left atrial pressure (LAP); 3- pulmonary artery pressure (PAP); 4- lung ultrasound, and 5- intra-abdominal pressure (IAP). In addition, insonation of the pleuro/peritoneal cavities will allow us to estimate extravascular water and collections at that level. We perform a functional analysis integrating the variables to identify hemodynamic profiles and intracardiac interactions, extended to those that occur at the cardiopulmonary-abdominal level, to be able to choose the appropriate medical strategies according to the clinical context.
Resumen
En esta segunda parte de enfoque “POCUS/Ecodinamia”, para el diagnóstico de los estados de inestabilidad hemodinámica/shock en pacientes pediátricos, analizaremos las 5 “P”: 1- presión de aurícula derecha (PAD); 2- presión de aurícula izquierda (PAI); 3- presión de arteria pulmonar (PAP); 4- ecografía pulmonar y 5- presión intraabdominal (PIA). Además, la insonación de las cavidades pleuro/peritoneales nos permitirán estimar el agua extravascular y colecciones a ese nivel. Realizamos un análisis funcional integrando las variables para identificar los perfiles hemodinámicos y las interacciones intracardíacas, extendidas a las que ocurren a nivel cardiopulmonar-abdominal, de este modo poder elegir las estrategias médicas adecuadas de acuerdo al contexto clínico.
-
Introducción
El enfoque moderno del monitoreo hemodinámico requiere un abordaje bimodal, en la primera parte las “5 E”, nos ocupamos del extremo arterial con la estimación del volumen sistólico, utilizando la velocidad integral de flujo aórtico (VTI), esta variable expresa la eficiencia mecánica del ventrículo izquierdo para generar la presión arterial y la perfusión orgánica. En este apartado nos ocupamos del extremo venoso para categorizar la congestión, estimando indirectamente la presión de aurícula derecha, analizando la vena cava inferior y el score VExUS[1]-[6]. Este score permite además evaluar, indirectamente, la perfusión de órganos debido a que la congestión venosa interfiere con la presión de perfusión, por disminución del gradiente arterio-venoso, a nivel esplácnico, siendo más notable a nivel cerebral y renal al ser órganos encapsulados.
-
Objetivo
El objetivo es realizar un enfoque integral de la ecodinamia completando la “Hoja de Ruta” del enfoque POCUS, siguiendo el esquema de las 5 “P”[1]. Describiremos nuevos métodos de monitoreo ecocardiográfico para estimar la presión de la aurícula derecha (PAD), la presión de aurícula izquierda (PAI), la presión pulmonar; ecografía pulmonar y la presión intraabdominal (PAI) [2]-[6].
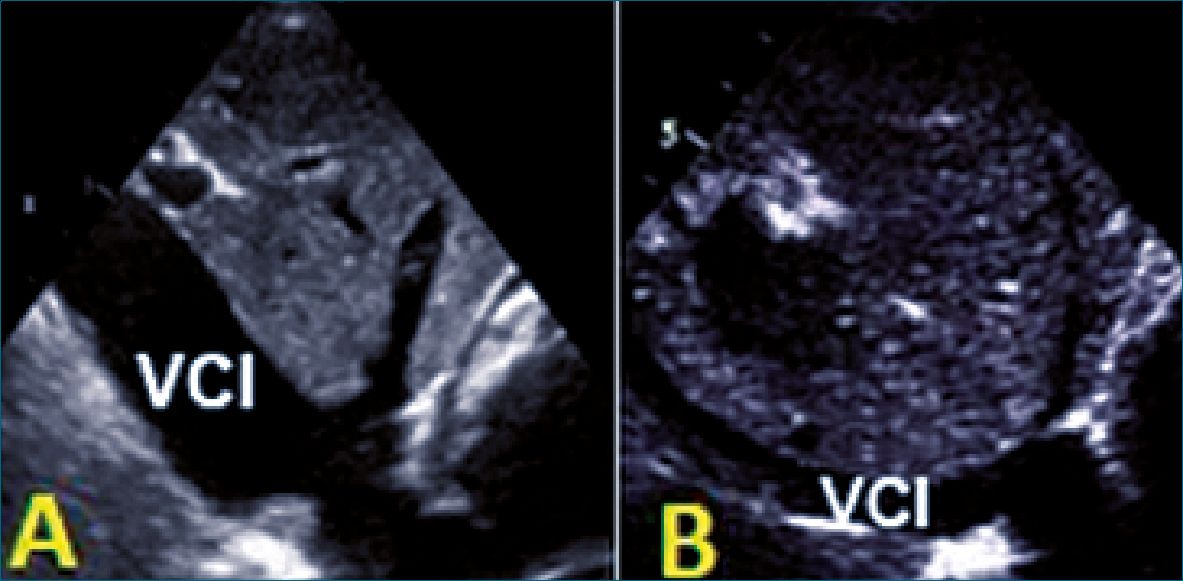
Figura 1. A: VCI dilatada sin colapso ¿Hipervolemia/ Disfunción VD?; B. VCI pequeña. Con colapso: ¿hipovolemia?
Tabla 1. Relación entre la vena cava inferior / presión de aurícula derecha en pacientes adultos
| Diámetro VCI (cm) | Índice de colapso (%) | PAD estimada (mmHg) |
| < 2,1 | > 50 | 3 (0-5) |
| < 2,1 | < 50 | 8 (5-10) |
| > 2,1 | > 50 | |
| > 2,1 | < 50 | 15 (10-20) |
Rudsky LS, et al. J Am Soc of Echocardiography 2010;23:685-713[11].
Evaluación ecográfica de la congestión
1. “P”. Presión de la aurícula derecha (PAD)
A. Análisis de la vena cava inferior (VCI)
La evaluación del diámetro y el grado de colapso de la vena cava inferior (VCI) es muy útil para estimar en forma no invasivas la PAD, pero su evaluación debe ser realizada teniendo en cuenta el contexto clínico del paciente, debido a la presencia de muchos factores confundidores que puede conducir a un diagnóstico erróneo (Figura 1).
Un enfoque simplista sería que una VCI pequeña sugiere hipovolemia y una VCI dilatada expresa una sobrecarga de volumen. Este es un concepto erróneo instalado en el colectivo médico, por lo que intentaremos explicar los contrastes o matices a la hora de interpretar las imágenes. Una VCI dilatada es más probable que refleje una distensibilidad alterada del ventrículo derecho (imposibilidad de lograr un flujo anterógrado adecuado)[1],[2],[6],[7].
Son muchas las influencias que intervienen sobre la VCI, como las variables de la función cardíaca y la función de retorno venoso, las interacciones cardiopulmonares durante la respiración espontánea o en asistencia respiratoria mecánica, el aumento de la presión intraabdominal, la presencia de hipertensión pulmonar, neumotórax, derrame pericárdico o pleural, las cardiopatías congénitas que cursan con insuficiencia tricúspidea o los efectos de la presión intrabdominal o de la infusión de volumen o de drogas vasoactivas[6]-[8].
La evaluación de la VCI fue considerada durante muchos años, como el “ESTANDAR ORO” no invasivo para estimar la PAD en pacientes adultos, sin embargo, solo ofrece una débil correlación con la PAD real[6]-[8].
Otras mediciones de la VCI, como los índices de colapsabilidad y de distensibilidad y de excentricidad adquiere gran importancia cuando se valora la respuesta a fluidos[9],[10],[11].
La medición del diámetro de la VCI en pediatría se realiza en eje corto y se relaciona con la medida de la aorta abdominal, también en eje largo antes de la desembocadura de las venas suprahepáticas. El diámetro es variable debido a las marcadas diferencias etarias y antropométricas. Las publicaciones más referenciadas en pediatría son la de Kathiuria y cols.[12], quién muestra los diámetros medios de la VCI, pero con rangos etarios muy amplios, por ejemplo, no puede considerarse un mismo diámetro de VCI para un recién nacido que para un niño de 2 años (Tabla 1).
Mannarino y cols.[13], realiza un estudio con una población más amplia con niños caucásicos italianos, relacionado los diámetros de la VCI la aorta abdominal, considerando normal una relación VCI/Ao abdominal > 0,83.
En pacientes pediátricos, Banille y cols., inician el enfoque POCUS de la VCI, considerándola dilatada, si se evidencia de mayor tamaño que la aorta abdominal y carece de colapso. En la evaluación ecográfica se fija, arbitrariamente, el valor VCI/Ao > 1 para hablar de dilatación de VCI, la evaluación se realiza en forma conjunta con el perfil de flujo de las venas suprahepáticas (VSH, con el tamaño de las cavidades cardíacas, la función contráctil cualitativa, la relación E/A del flujo transmitral y la relación E/e’ con Doppler tisular para las y presiones de llenado y el aporte del eco pulmonar en busca de líneas B[14],[15] (Figura 2, 3 y 4).
Limitaciones: es un parámetro de muy baja sensibilidad, la ausencia de colapso no excluye la precarga dependencia. Tanto en hipovolemia real como relativa secundaria a vasodilatación patológica (shock séptico, vasoplejía, anafilaxia, shock neurogénico, enfermedad de Addison, agentes anestésicos).
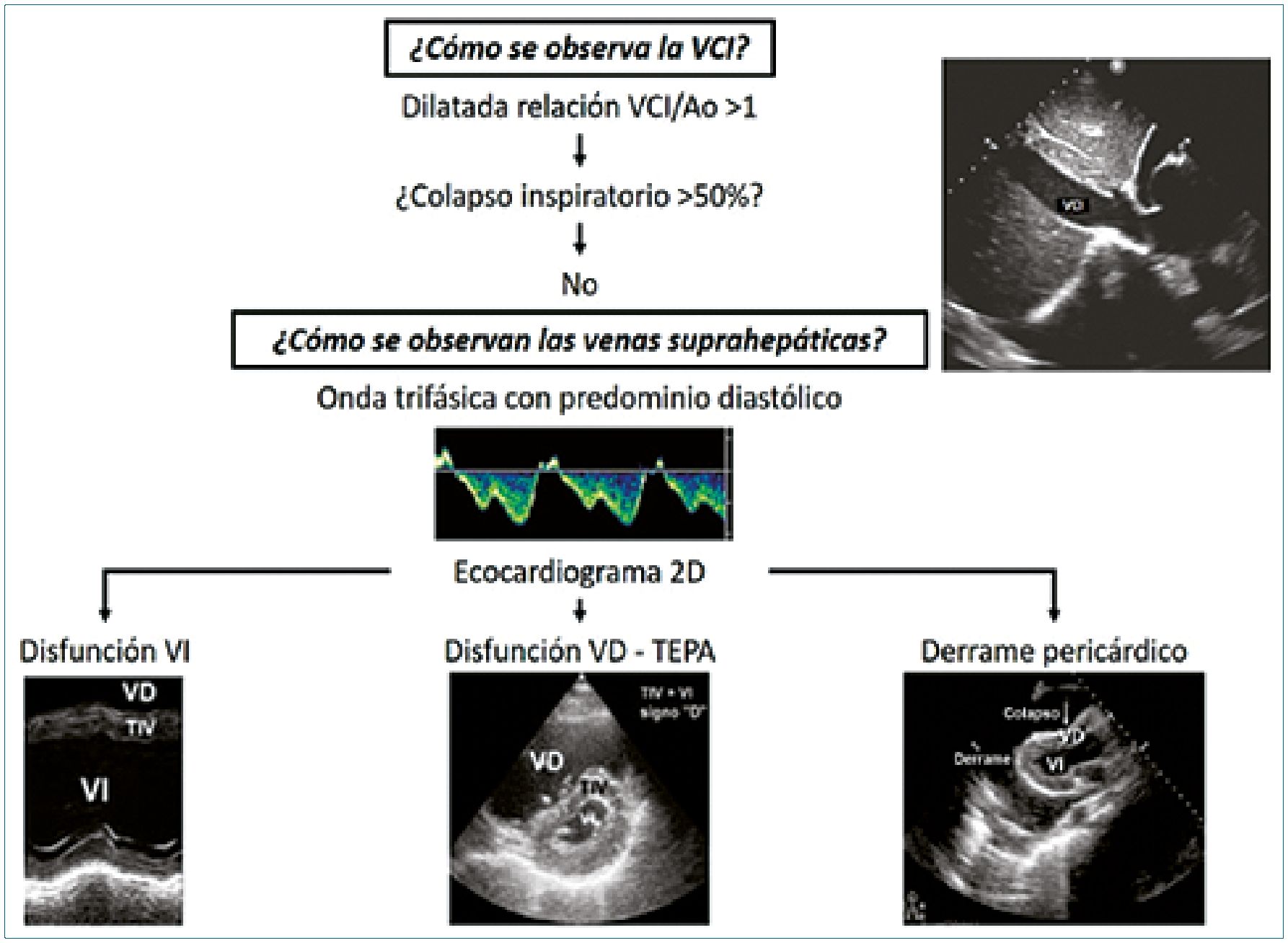
Figura 2. VCI dilatada. Venas suprahepáticas con inversión del patrón normal (S > D). Banille E. Ecografía más allá del corazón Cap 5. En Monitoreo cardiopulmonar Pediátrico. Editorial RecFot 2019. (14) Nota: también se valora el incremento de presiones de llenado con Doppler transmitral: Rel E/A > 2. TDI: onda e’> 10. Eco pulmonar: perfil B (+ de 3 líneas B por cuadrante).
B. Score VExUS
El score VExUS es un sistema de puntuación utilizado, inicialmente, para evaluar la sobrecarga hídrica. Se realiza un análisis de los perfiles de flujo de las venas abdominales, de acuerdo con ello, podremos estimar la PAD con mayor exactitud que la evaluación de la VCI[14]-[17]. La experiencia inicial fue en un centro terciario que incluyó 145 pacientes adultos sometidos a cirugía cardiovascular, encontrando asociación entre el grado de congestión, la presión venosa central y la presencia de insuficiencia renal aguda[18]. Esta información es respaldada por un metaanálisis reciente[19]. Esta metodología permite además el monitoreo de la evolución de la congestión frente a las estrategias médicas utilizadas[18],[19]. Si bien es un método emergente, ha despertado gran interés en la comunidad médica, y se extendió su aplicación en diferentes escenarios clínicos. En la población pediátrica existe correlación entre el grado de congestión y los valores de PVC en pacientes críticos[20].
Se ha utilizado desde fetos con insuficiencia cardíaca hasta una paciente adolescente con cardiopatía congénita descompensada[21]-[23].
Normalmente, la transmisión retrógrada de la presión generada a nivel de la AD es amortiguada a nivel de las venas sistémicas. La congestión venosa se produce en condiciones donde se incrementa la PAD, se traduce con un aumento de la pulsatilidad en vasos pequeños y capilares. El patrón de flujo en venas suprahepáticas (VSH), muestra una imagen en espejo de las ondas de la PVC debido a la proximidad con la VCI y reflejan los cambios que se generan en la AD con el ciclo cardíaco[14]-[23] (Figura 5).
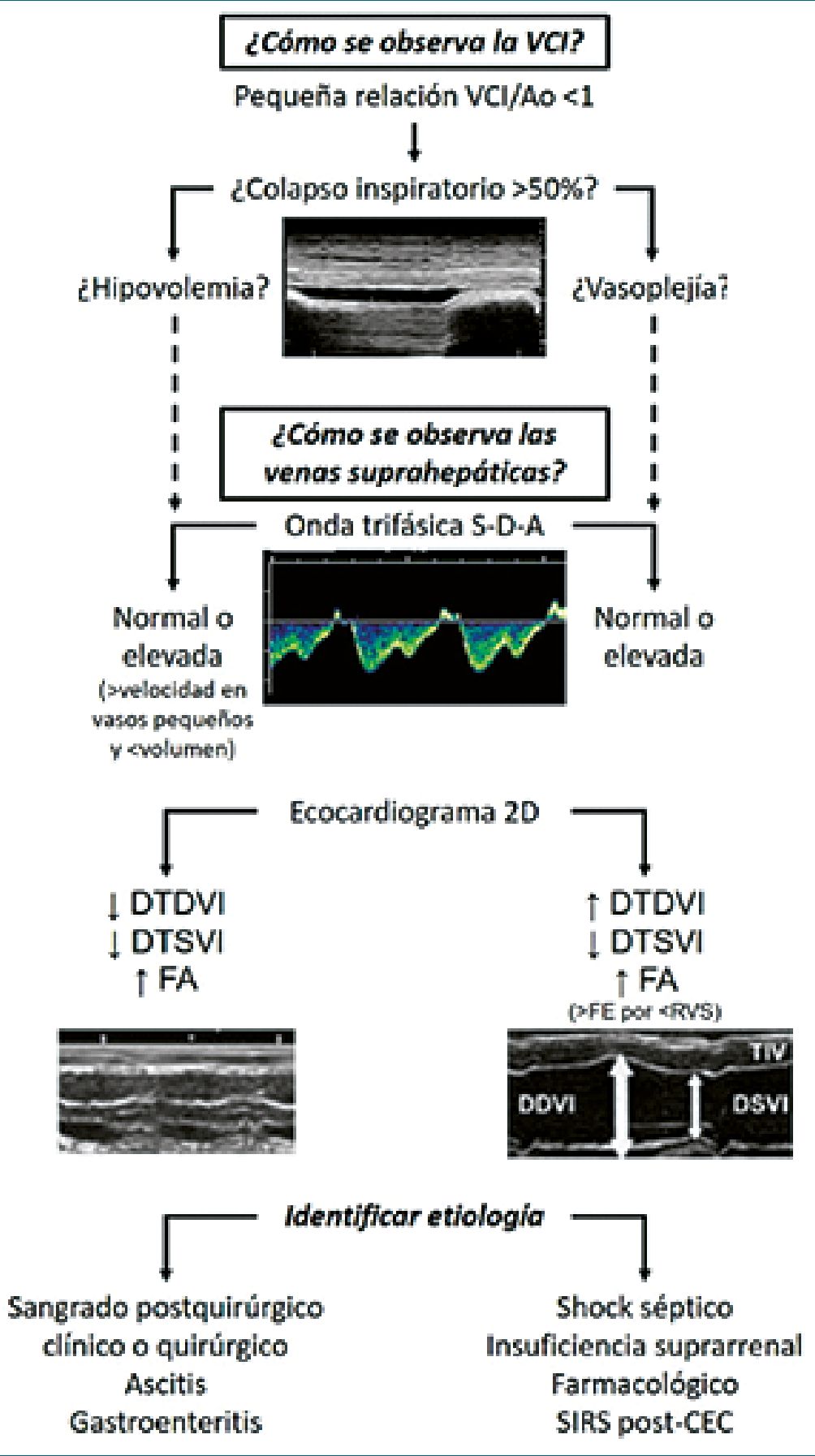
Figura 3. VCI pequeña. Diagnóstico diferencial. Referencias: DTDVI: diámetro telediastólico ventrículo izquierdo. Diámetro telesistólico de ventrículo izquierdo; FA: Fracción de acortamiento; SIRS: Síndrome de respuesta inflamatoria sistémica; CEC: Circulación extracorpórea. Banille; E: Ecografía más allá del corazón Cap 5. En Monitoreo cardiopulmonar Pediátrico. Editorial RecFot 2019[14]. Nota: Disminuición de presiones de llenado: Doppler transmitrai: Rel E/A: 0,-2. TDI: e'< 10. Eco pulmonar: perfil A (normal. Solo líneas A).
Flujo en vena porta
El flujo normal es monofásico continuo, ”es el parámetro más útil para evaluar la congestión”, debido al efecto “Buffer”, que ejercen las sinusoides hepáticas estimado en 10 mmHg, esto evita la transmisión de la presión venosa retrógrada. Una vez que se supera ese límite de presión, la repercusión de la congestión se manifiesta con aparición de la pulsatilidad en su trazado que se incrementa de acuerdo con la gravedad. Trazados similares se observarán en las venas renales Inter lobares y aún en las venas femorales[25]-[27] (Figura 4).
1. Existen patologías asociadas como cirrosis o patologías que incrementan la presión intraabdominal (tumores, malformaciones congénitas en riñones, tumores) que pueden alterar la puntuación.
2. Una vez que mejora el paciente (patrón descongestivo). Algunas publicaciones afirman que se inicia en la vena porta[26]-[29], en nuestra experiencia la respuesta a las estrategias terapéuticas fue variable, quizás obedezca a los diferentes escenarios clínicos (hipertensión pulmonar, insuficiencia cardíaca crónica). Tratando de buscar una explicación, Banille E., propone una teoría imaginando otro escenario de congestión (circuito vial), donde se podría esperar que los vehículos agilicen su marcha en el sitio más cercano a la obstrucción una vez removido el obstáculo, pero a pesar de ser un circuito rígido, los vehículos más alejados pueden tener salvoconductos como calles laterales, túneles o puentes para poder circular antes.
En el modelo del aparato circulatorio, esperaríamos que las VSH sean las primeras en mejorar su perfil cuando disminuye la PAD. Nos preguntamos ¿Será la circulación portal el salvoconducto? La explicación tentativa sería que los sinusoides hepáticos recuperan su independencia del sistema venoso sistémico y también su función Buffer una vez que la PAD es inferior a los 10 mmHg, valor que señala la capacidad de amortiguación de la pulsatilidad en estos vasos. Se requieren trabajos experimentales con mediciones simultáneas de PAD y en las sinusoides con VExUS diferentes para corroborarla.
C. Evaluación multiparamétrica de la PAD
Basado en el principio que la vena cava superior (VCS), el pulso venoso yugular (PVY) y la vena cava inferior (VCI) son prolongaciones fisiológicas de la aurícula derecha, sus presiones serán similares en ausencia de obstrucción. EL. Rad et al.[30], estima la PVC por intermedio de una ecuación multiparamétrica para lo cual relaciona el diámetro máximo de la VCI/diámetro máximo de la aorta abdominal, la velocidad de la onda sistólica (S) y de la onda diastólica (D) a nivel de la VCS, el diámetro vertical de la aurícula derecha y el tiempo de aceleración de las ondas A del flujo tricúspideo. Rad y cols.[30], estudiaron esta ecuación en pacientes pediátricos con cardiopatías congénitas y encontraron una robusta correlación con la PVC medida en forma invasiva (Pearson r = 0,698, p = 0,002).
Limitaciones: método de reciente aplicación que requiere muchos cálculos matemáticos por lo que mínimos errores de medición pueden alterar el resultado final de la PAD. No aplica a enfoque POCUS.
D. Estimación de la PAD a través de la profundidad de la aurícula derecha y la evaluación del pulso venoso yugular
El método POCUS ofrece métodos alternativos para estimar la PAD al pie de cama, Istrail y cols.[31], describen una técnica en 39 pacientes a quienes mide la profundidad de la aurícula derecha por intermedio del ecocardiograma y se compara con los valores obtenidos en el cateterismo cardíaco derecho. Koratala[32] y Valderrábano Salas[33] replican esta experiencia y muestran videos explicativos del procedimiento (Figuras 5, 6, 7).
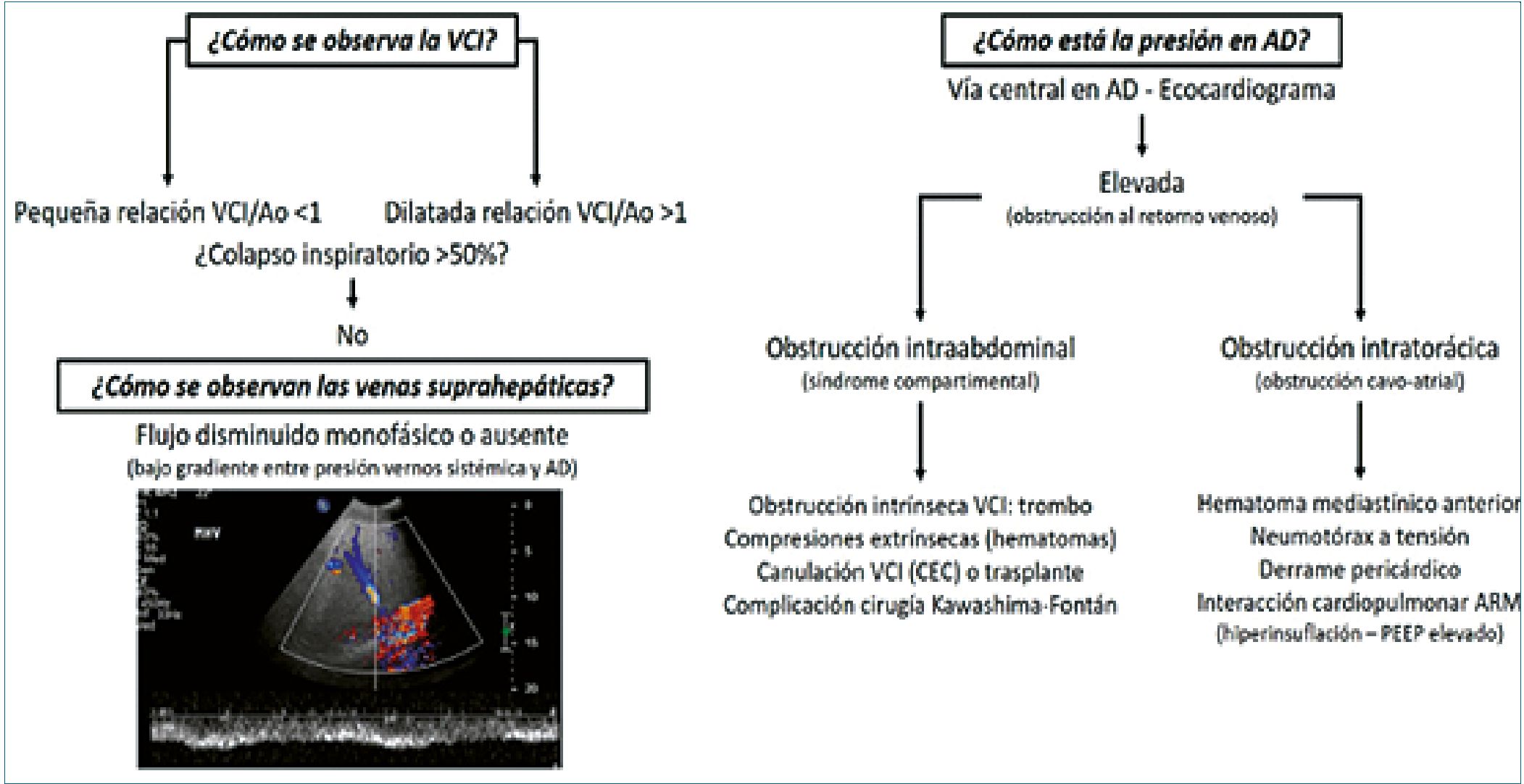
Figura 4. Diagnóstico diferencial de obstrucción de VCI: intratoràcica/intraabdominal; VCI: pequeña. Diagnóstico diferencial. Banille E. Ecografía más allá del corazón Cap 5. En Monitoreo cardiopulmonar Pediátrico. Editorial RecFot 2019[14].
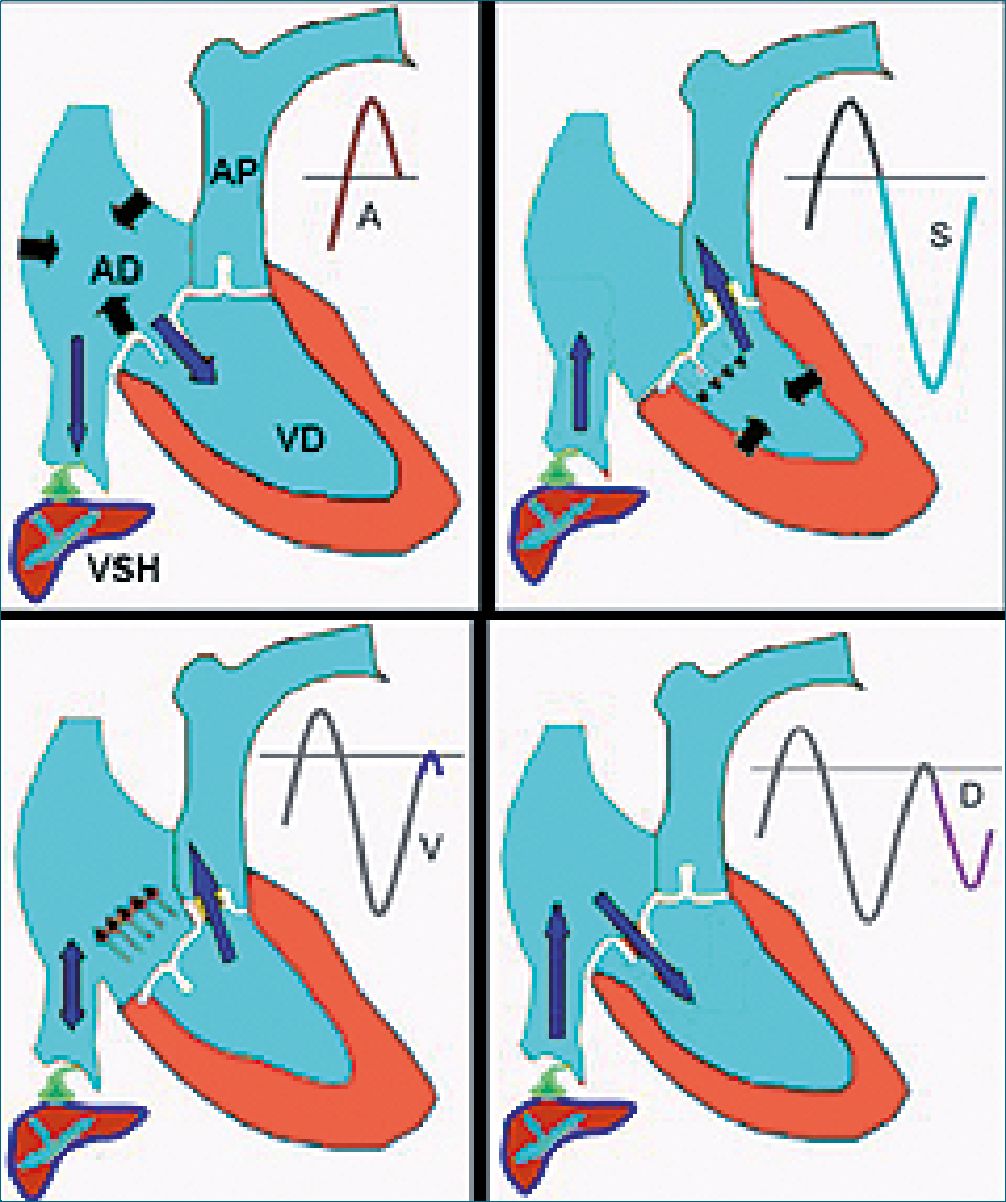
Figura 5. Flujo VSH: vista subcostal. 1. onda A reversa: sístole auricular, la misma se observa arriba de la línea de base; 2. onda sistólica “S”: corresponde al descenso del anillo tricúspideo durante la sístole del VD (corresponde a la onda X de la PVC). La onda es anterógrada, debajo de la línea de base debido a que la PAD disminuye y se incrementa el retorno venoso por la VCI; 3. onda V: pequeña onda ocasionada por el ascenso del anillo tricúspideo al final de la sístole; 4. diastólica “D”: la apertura de la VT disminuye la PAD. Onda D anterógrada idem a la onda “S”, aunque de menor amplitud. (Onda y de la PVC). Modificada de Meir H. Scheinfeld et al. Understanding the Spectral Doppler Waveform of the Hepatic Veins in Health and Disease, Radio Graphics 2009; 29:2081-98[24].
Técnica
1° paso Primero se mide la hipotética profundidad de la aurícula derecha en vista paraesternal eje largo (ELPE) trazando una línea desde el esternón hasta el límite posterior del tracto de salida del ventrículo izquierdo (TSVI) a nivel de la inserción de la válvula no coronariana (VNC). Este punto se eligió sustituto del centro de la AD porque se encuentran en el mismo plano coronal (Figuras 8 A y B).
2° paso A continuación, se coloca el transductor a la altura del cartílago cricoides en eje transversal por encima de la clavícula. Se visualiza la vena yugular interna (VYI) y se mide el grado de colapso. Pueden obtenerse 3 opciones:
a) colapso completo: se considera distención ausente,
b) parcialmente llena con variación respiratoria, y c) dilatada y sin variación respiratoria: se considera distención de la VYI.
3° paso Se desplaza el transductor cranealmente para identificar el punto del colapso venoso (paredes venosas contactan entre sí), luego se gira el transductor 90° en el plano longitudinal para confirmar este punto, se denomina “Signo de la botella de vino”, por su parecido a la unión entre el cuerpo y la parte superior de una botella. Desde este punto se mide la distancia hasta el esternón, esta cifra se suma a la profundidad para estimar el valor de la PAD (Figuras 8 C y D).
A- Si la VYI colapsa por completo a nivel supraclavicular con la cabecera de la paciente ubicada en 45°, se considera ausencia de distención. Para estimar la PAD en este caso se baja la cabecera a 30°, en busca de ingurgitación de la VYI. Si ésta se hace evidente, la PAD se anota: cm de agua y se utiliza la fórmula: profundidad AD x 0,75.
B- Si no aparece a los 30°, se baja la cabecera a 0°, si aparece la ingurgitación, la fórmula utilizada es: profundidad de PAD x 0,50 y si no aparecía a 0°, la fórmula es profundidad de AD x 0,25. Finalmente, se convierte el valor a mmHg multiplicándola por 0,735.
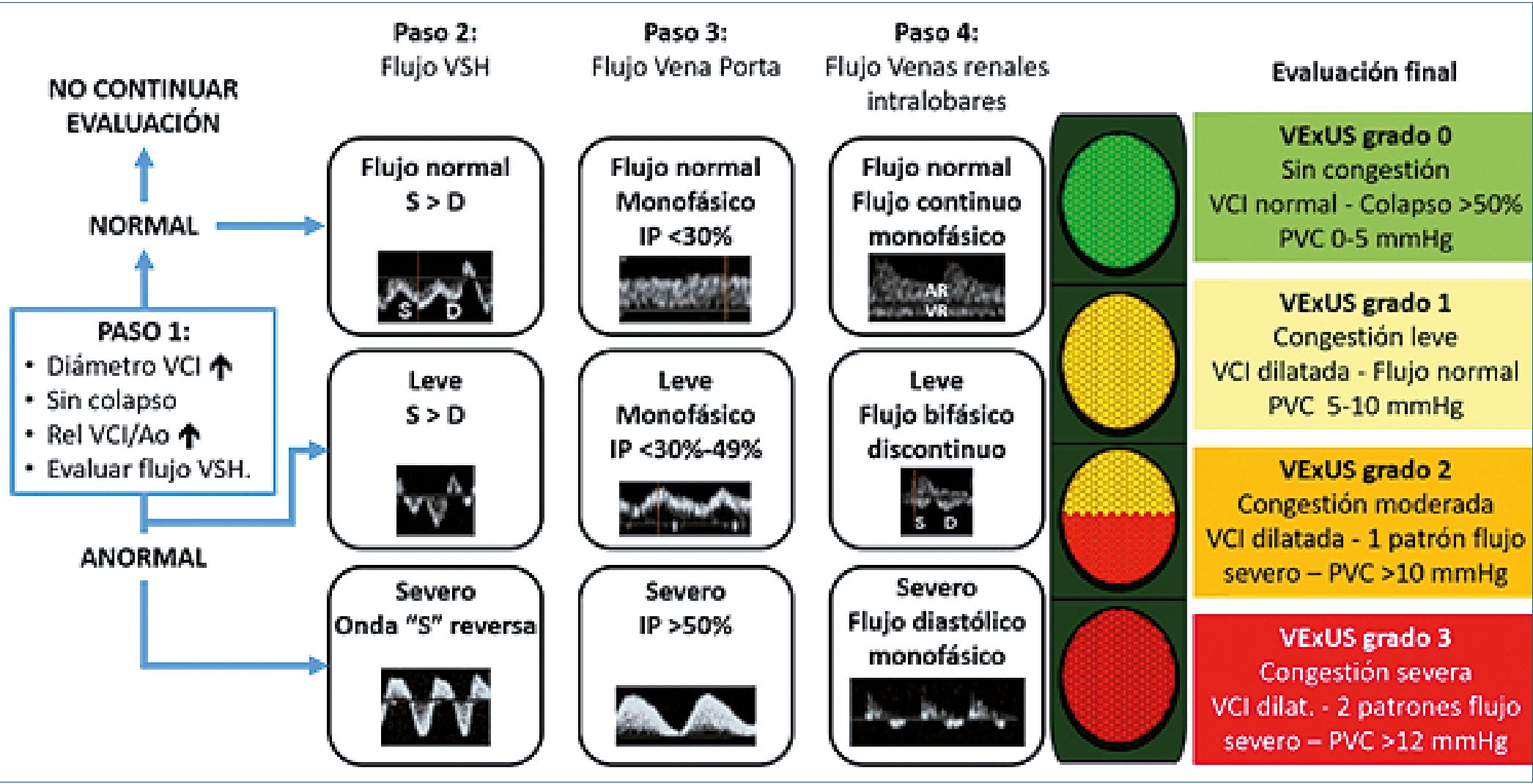
Figura 6. Score VExUS. Banille E. Modificado de Waldrom A.[26] y González Delgado D y Romero González D.[28]. Nota: en pacientes pediátricos utilizamos el score VExUS cuando la VCI se encuentra dilatada/sin colapso y con relación VCI/Ao abdominal > 1 y perfil de flujo Doppler de VSH alterado. En pacientes adultos se inicia cuando la VCI es > 2 cm.
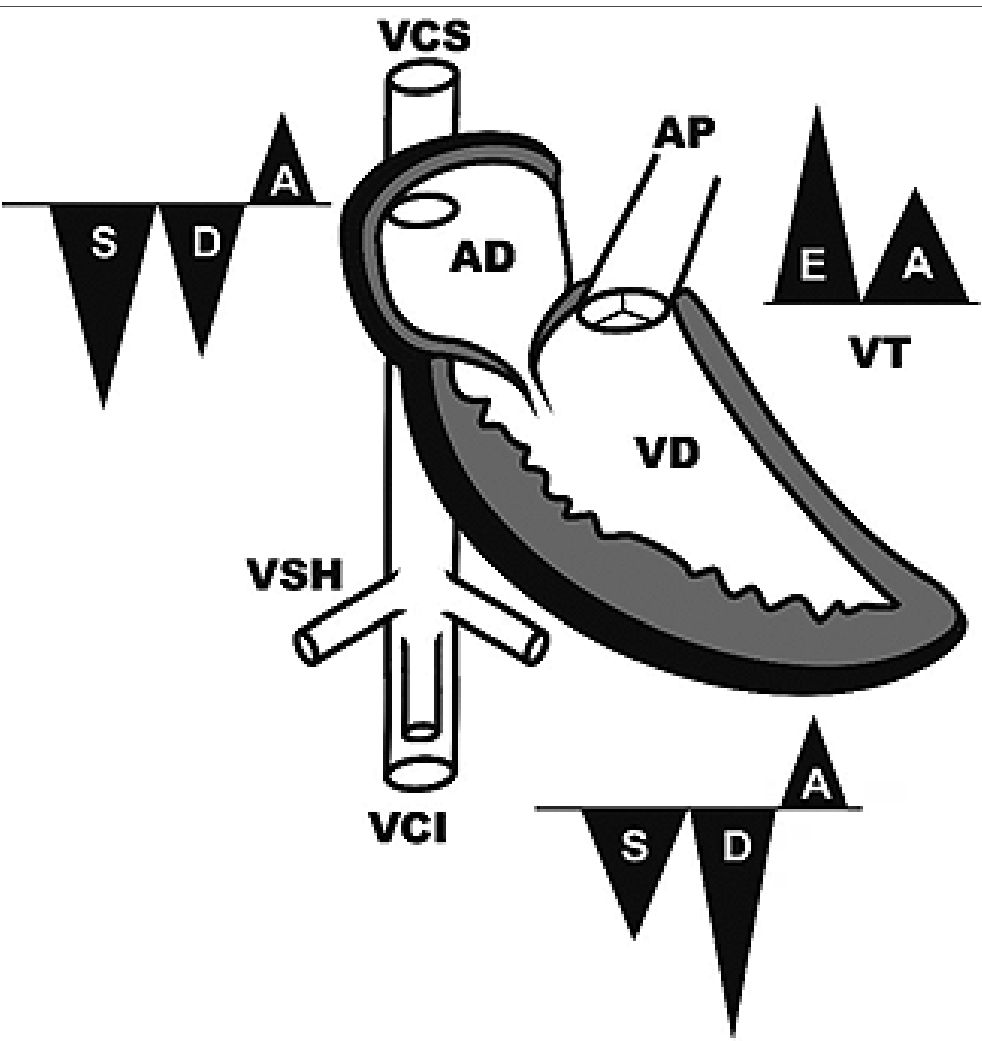
Figura 7. Ecuación multiparamétrica de PAD. Estimación de la PAD/ PVC = 4,36 + (2,35 x VCI max/ AoAbd max + (1,06 x VCS (ondas S y D) + (0,059 x AD vd) + (0,001 xTA VT). Imagen modificada de Raad[30].
Kenny[34], muestra la relación de todo el territorio venoso (vena cava superior, vena yugular y las venas abdominales) como intercambiables y las ondas sistólica y diastólica ocurrían en sintonía con los descensos X e Y del trazo de la PCV/PAD. La ecografía Doppler de vena yugular muestra que frente a incrementos de la PAD o en casos de disfunción de ventrículo derecho, la onda sistólica es menor que la onda diastólica.
No hallamos publicaciones en pediatría, debido a las diferencias anatómicas (cuello más corto, menor longitud de la vena yugular), dificultades para evaluar el colapso de la VYI y las diferencias interáreas y antropométricas. Además, diferentes cardiopatías congénitas producen sobrecargas volumétricas o de presión a nivel de las cavidades derechas. No obstante, podría encontrar una potencial utilidad si se cuenta con un dispositivo que pueda evaluar el trazado del pulso yugular y estimar la sobrecarga de manera similar a lo que ocurre en venas suprahepáticas en el score VExUS[35],[36] (Figura 8 E).
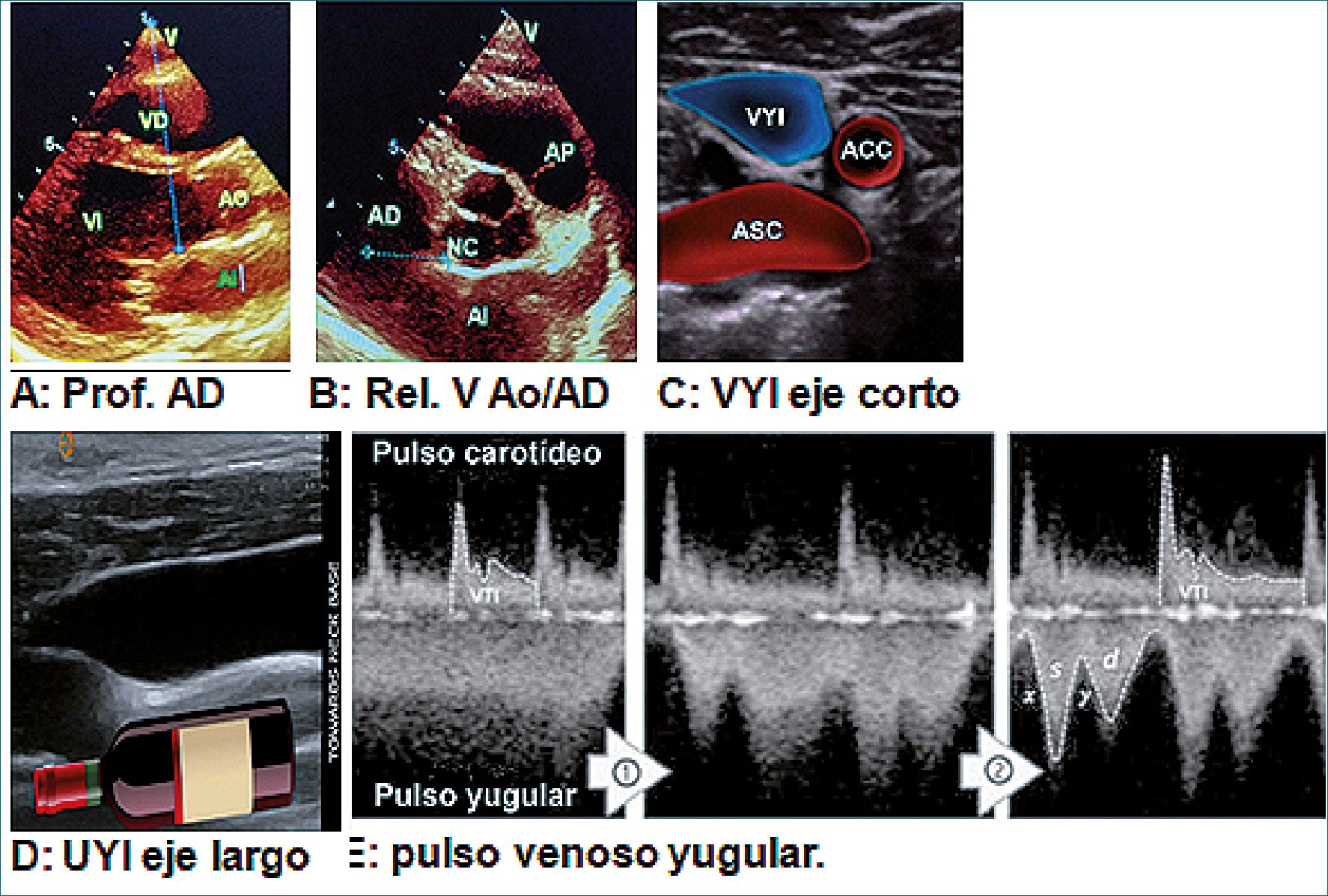
Figura 8. A: Profundidad de la AD por Ecocardiograma. Vista PEEL; B: Vista ECPE relación de la válvula aórtica con la AD. (Imágenes Dr. E. Banille); C: PVY corte transversal; D: VYI eje largo. Imagen en “botella de vino”. (Imágenes Dr. A. Koratala); E: pulso venoso yugular (Imágenes Dr. JE Kenny).
2 “P”. Evaluación de la presión auricular izquierda (PAI)
En pediatría la estimación de la PAI es muy importante en la evaluación postquirúrgica de cardiopatías complejas (transposición de los grandes vasos, drenaje pulmonar venoso anómalo), sobre todo en etapa neonatal. También en miocarditis, miocardiopatías, cardiopatías congénitas con hiperflujo pulmonar o patologías obstructivas del corazón izquierdo[36],[37].
El incremento de las presiones de llenado del corazón izquierdo se evidencia con ondas E de mayor velocidad y ondas A disminuidas en el Doppler transmitral. También se considera la presencia de ondas e’ pequeñas en el Doppler tisular y un predominio de ondas diastólicas del flujo de venas pulmonares con el incremento de PAI. Actualmente se considera también los hallazgos de ondas B en la ecografía pulmonar[36]-[39].
Si bien la presión tele diastólica de ventrículo izquierdo (PTDVI), es utilizada como intercambiable con la PAI, brinda, fundamentalmente, información de la complacencia del ventrículo izquierdo[36]-[39].
¿cómo se encuentra la PAI?
Se realiza una evaluación cualitativa comparándola con el
tamaño de la aurícula derecha, observando además si el tabique interauricular (TIA) tiene una posición intermedia o se desvía hacia la derecha. En pacientes con ARM un TIA desplazado hacia la derecha sin variaciones cíclicas sugiere elevación de la PAI[36]-[39].
EQUALITY auricular: > PAI = AI > AD y TIA abomba hacia la derecha.
Nota: la AI es incapaz de dilatarse como la AD en una patología aguda, así, es posible encontrar pacientes críticos con PAI aumentada con tamaño normal de la AI, como ocurre en sobrecarga de fluidos, sepsis, disfunción diastólica aguda o insuficiencia mitral aguda[36]-[39].
Segundo Interrogante
¿Cómo se estima ecográficamente el aumento de la PAI?
La relación E/e’ es una variable bien validada y aceptada como subrogante a la PAI, este valor se obtiene del cociente entre la velocidad pico transmitral de la onda “E” obtenida por Doppler pulsado (DP), dividido por la onda “e’ tomada con Doppler tisular (TDI) que evalúa la elongación de las fibras longitudinales a nivel del anillo mitral (septal o lateral)[39]-[41].
Esta relación E/e, sirve para diferenciar una PAI normal de una PAI elevada y sugiere presiones de llenado.
La relación E/e’ se correlaciona bien con la presión de oclusión de arteria pulmonar (POAP) y se calcula con la fórmula: POAP: (E/e’ x 1,24) + 1,29 (Figura 9).
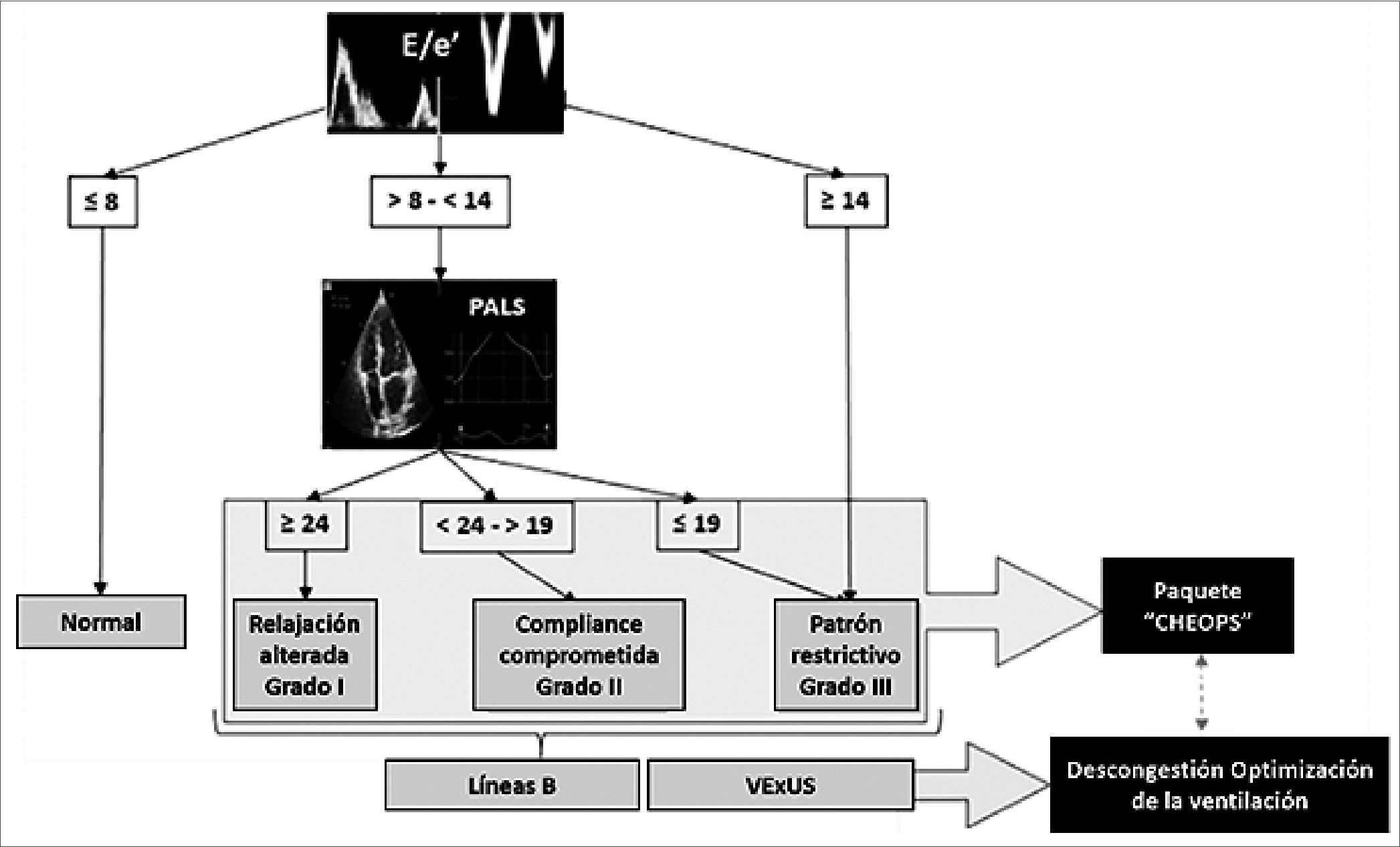
Figura 9. Evaluación de la función diastólica. Modificado de González F.[43]. Modificado de Oulego I.[44].
Tabla 2. Perfiles hemodinámicos basados en la relación entre disfunción diastólica (onda e’) y presión de llenado(E/e’)
| Sin congestión pulmonar | Congestión pulmonar presente |
| Relajación anormal (e’ < 8 cm/s)
Presión de llenado normal (E/e’ < 8) |
Relajación anormal (e'<8 cm/s)
Aumento de PAI (E/e’>14) |
| Hipovolemia severa Shock séptico | Shock cardiogénico |
| Relajación normal (e’ > 8 cm/s)
Presión de llenado normal (E/e’ < 8) |
Relajación normal (e’ > 8 cm/s)
Aumento de PAI (E/e’ > 14) + AI dilatada (> 34 mL/m2) |
| Hemodinamia normal | Sobrecarga volumétrica
Shunt. Insuficiencia valvular |
Modificado de Oulego I.[44].
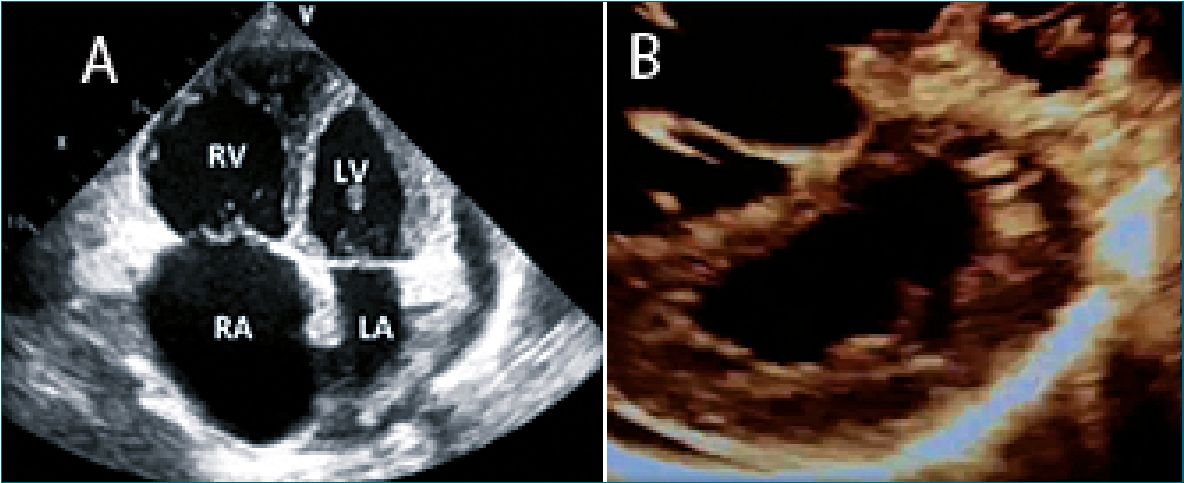
Figura 10. A: Dilatación VD. 4 C; B: VI en forma de D. Ventana ECPE.
¿Cómo se encuentra la función diastólica?
La evaluación clásica incluye las curvas Doppler de lleno transmitral ondas E de llenado rápido, onda A: de contracción auricular y el tiempo de relajación isovolumétrica. También se incluye la relación E/e’, la velocidad de regurgitación tricúspidea y el volumen de aurícula izquierda[39]-[42] (Figura 10).
Se describen 3 estadios de disfunción diastólica:
I. Disfunción leve. Alteración de la relajación. La complacencia y las presiones: de llenado de VI (PTDVI), son normales. Expresa la dificultad que tiene la AI de completar el llenado ventricular. En el flujo transmitral se observa E < A y con Doppler tisular onda e'< a’.
II. Disfunción moderada o pseudo normalización: se agrega la alteración de la complacencia y el aumento de la PTDVI. El Doppler transmitral muestra una relación E/A normal, con Doppler tisular: relación e’/a‘anormal.
III. Disfunción severa: Empeora la complacencia y mayor incremento de la PTDVI. En el Doppler transmitral onda E prominentes y mayor diferencia de la relación E/e’, causados por el incremento de la PTDVI. Esto ocurre porque la onda E es precarga dependiente y la onda e’ es precarga independiente[36]-[42] (Tabla 2).
Nota: No es lo mismo función diastólica (capacidad de relajación representada por la onda e’), que presiones de llenado: precarga, que se evalúa con el lleno transmitral y la relación E/e'[36]-[41].
El enfoque especializado contempla además el strain auricular, el índice de acoplamiento atrio-ventricular y la inteligencia artificial[36]-[43]
3 “P”. Evaluación de la presión pulmonar
La clasificación hemodinámica de la hipertensión pulmonar (HP) fue modificada en el reciente consenso de la Asociación Europea de Cardiología (ESV) y las guías de la Sociedad Respiratoria Europea (ERS)[20]. Disminuye el valor umbral para definir HP a valores de (PAPM) de 25 a 20 mmHg + 2 DS, y a las cifras de resistencia vascular pulmonar (RVP) de 3 unidades Wood (UW) a 2 UW. Estos cambios están basados en recientes estudios que demuestran que leves elevaciones de PAPM (rango 21-24 mmHg y RVP > 2,2 UW, se asocian a resultados adversos[45].
La evaluación de la HP con el enfoque POCUS brinda un informe clínico sobre las repercusiones de los distintos subgrupos de hipertensión pulmonar repercuten sobre la función del ventrículo derecho (TAPSE) y en el acoplamiento ventrículo arterial (relación TAPSE / PSAP)[1],[36],[37].
La evaluación se inicia en forma cualitativa (Equality) comparando el tamaño del VD/VI y la ubicación y movimiento del tabique interventricular[36].
Realizamos un cuestionario inicial
¿El ventrículo derecho se encuentra dilatado y el ventrículo izquierdo disminuido? a SI. EQUALITY.
Se identifica en vista apical de 4 cámaras y vista PE ejes largo y corto.
¿El ventrículo izquierdo tiene forma de D en eje corto esternal? a SI.
Sugiere hipertensión pulmonar[36],[37].
¿Se puede evaluar, ecográficamente, la hipertensión pulmonar en pre o post capilar y estimar el gradiente transpulmonar? a SI.
La incorporación una nueva fórmula ecocardiográfica, permite calcular el gradiente transpulmonar (GTP) (diferencia de la PSAP/relación E/e’): e-PLAR (Figura 11).
Fórmula: e-PLAR (m/s) = Vel IT máxima m/s / relación mitral E/e’, fundamental para diferenciar la presión pulmonar precapilar de la presión postcapilar[46],[47].
1- La presión sistólica de la arteria pulmonar (PSAP) se obtiene con Doppler continuo, la velocidad de la insuficiencia tricús- pidea mediante la ecuación de Bernoulli modificada (4 x vel IT 2 + PAD).
2- La presión de aurícula izquierda (PAI) es estimada por la relación E/e’. La onda E se obtiene por intermedio del flujo Doppler transmitral y se divide por la onda e’ ubicada por Doppler tisular a nivel del anillo mitral septal o lateral. Esta relación permite diferenciar una PAI normal de una PAI elevada. Los valores del índice e-PLAR son > 0,30 m/s en HPT+ precapilar y < 0,20 m/s en HP postcapilar.
Mediante la ecografía pulmonar se puede identificar pulmones normales, pacientes con patología respiratoria (neumonías, atelectasias, neumonitis intersticial, neumotórax), hiperflujo o edema pulmonar y derrame pleural[48] (Figura 12).
Integrando la ecografía pulmonar y cardíaca podemos comprender la interacción cardiopulmonar (Figura 13).
5 “P”. Presión intraabdominal (PIA). Pleura y peritoneo
Diferentes escenarios postquirúrgicos abdominales en pacientes pediátricos pueden conducir a inestabilidad hemodinámica y shock. Patologías como oclusión (vólvulos, malrotación o invaginación), perforación intestinal, infarto intestino mesentéricos, hernias inguinales atascadas. Otras condiciones como trombosis de VCI post ECMO, compresiones extrínsecas como tumores hepáticos o renales, pueden incrementar la PIA en forma aguda[49].
Estas situaciones generan interacciones abdominales y cardiopulmonares desfavorables y se convierten en un desafío para en médico anestesista o intensivistas, porque el rápido incremento de la PIA a valores > 20 mmHg conducen a un fallo multiorgánico. La reposición de fluidos inadecuada o intestinos que se encuentran mal perfundidos provocan edema intestinal y fuga de líquidos hacia la cavidad abdominal, generando ascitis que puede causar compresión de VCI y otros órganos abdominales, sobre todo los riñones que al ser un órgano encapsulado sufre las consecuencias del edema intersticial secundario a la presión venosa elevada y, además, la compresión externa reducen el flujo por las arteriolas renales provocando isquemia e insuficiencia renal. También hay disminución del retorno venoso y del gasto cardíaco completando el circulo vicioso con menor perfusión orgánica anterógrada[49].
Para cerrar este enfoque holístico de eco dinamia hacemos mención a la cavidad pleural y peritoneal. En el espacio pleural se puede detectar derrames con una S > 92% y E 100%. El protocolo e-FAST es muy aplicado en shock hemorrágico traumático para detectar, hemopericardio, derrame pleural y líquido libre abdominal: espacios de Morison, Koller y Douglas en menos de 3 minutos. Otros protocolos eco-clínicos utilizados son el RE-FAST para detectar hematoma retroperitoneal y los protocolos EFAST+ SLOOW para identificar líquido libre interesas utilizando transductor lineal.
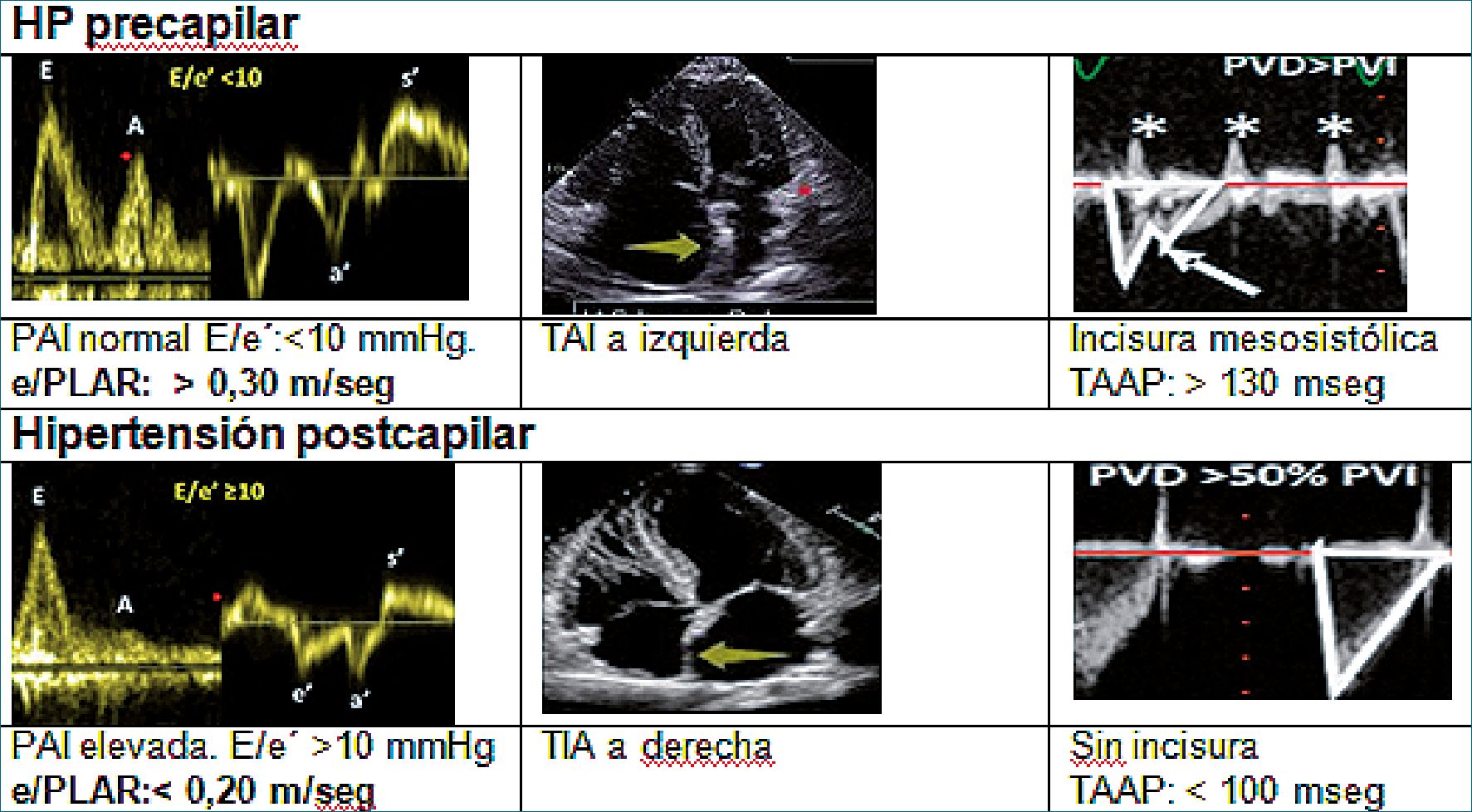
Figura 11. Diagnóstico diferencial de hipertensión pulmonar (HP). Banille[36],[37].
| Hipovolemia. Criterios ecográficos | Hipervolemia. Criterios ecográficos |
| 1- Área ventricular y DTDVI disminuidos
VTI < 15 cm. P° llenado. Eco Doppler transmitrai: Rel E/A: 0,8-2. TDI: onda e'<10 Eco pulmonar: perfil A |
1- Dilatación de cavidades
Presión de llenado. Eco Doppler transmitral: Rel E/A >2. TDI: onda e’ > 10 Eco pulmonar: perfil B |
| 2- Obliteración sistòlica de la cavidad de VI y obstrucción dinámica del TSVI, vista apical de 5 cámaras | 2- Podría evidenciarse hiperflujo en venas pulmonares |
| 3- Signo del beso parietal: contacto del tabique interventricular, con la pared posterior del VI por hipercontractilidad. (contracción en vacío). Vista paraesternal eje largo. VPEEL | Criterios extracardíacos |
| 4- Contacto valva anterior mitral con septum interventricular (punto E/septal) | 1- Dilatación de VCI y falta de colapso |
| Criterios extracardíacos | |
| 1- Vena cava inferior pequeña y con colapso > 50% | 2- Alteración del score VExUS: 2 o 3 |
| 2- Venas suprahepáticas con ondas sistòlica y diastólica disminuidas | 3-Líneas B y/o derrame pleural en ecografía pulmonar |
| Banille E. Monitoreo cardiovascular pediátrico. Editorial RecFot 2019[16].
Nota de hipovolemia: En adultos el colapso de la VCI > 50% tiene una S 70% y una E 80%. En adultos un diámetro de VCI < 12 mm es sugestivo de hipovolemia. Diagnóstico diferencial: infusión de drogas vasoactivas en exceso o innecesaria, cardiomiopatía hipertrófica y algunos casos de neumotorax a tensión. Nota de hipervolemia: en pacientes adultos si: VCI > 20 mm, con score VExUS 2 o 3: no administrar fluidos hasta determinar si se trata de hipervolemia o por disfunción diastólica del VD. |
|
Ecografía funcional. Integración de las variables
1- Criterios ecográficos del estado de volemia.
2- Monitoreo Hemodinámico dicotomizado.
El enfoque clínico/ecográfico en pacientes adultos comprende un enfoque bidimensional, estimando simultáneamente y luego de cada intervención terapéutica, el extremo arterial con la determinación del volumen sistólico (VTI) y el extremo venoso con la estimación de la PAD con el análisis
de la VCI y el score VExUS. Este enfoque hemodinámico se adapta a la clasificación de Diamond y Forrester descripta en pacientes con infarto de miocardio hace más de 60 años, pensamos se podría extrapolar a pacientes pediátricos[50]. 1- Se dicotomiza la PAD:
Tabla 3. Integración de las variables ecocardiográficas para el diagnóstico diferencial entre hipertensión pulmonar precapilar
| Parámetros ecográficos | HP precapilar | HP postcapilar |
| Tamaño VD | Agrandado | Agrandado o normal |
| Tamaño AI | Disminuido | Dilatada |
| Relación AD/AI | Aumentada | Normal (AI > AD) |
| Tabique interauricular | Abomba de D a I | Abomba de I a D |
| Muesca en flujo TSVD | Presente | Ausente o infrecuente |
| Relación E/A. Flujo TC | << 1 | > 1 |
| E’ anillo TC | Normal | Disminuida |
| Relación E/e’ lateral | < 8 | > 10 |
| TAAP | Normal > 130 msg | Alta > 100 msg |
| PP capilar de Wedge | < 15 mmHg | > 15 mmHg |
| Relación PDAP/PPCW | > 7 mmHg | < 5 mmHg |
Referencias: HP: hipertensión pulmonra; VD: ventrículo derecho; AD: aurícula derecha; AI: aurícula izquierda; TC: tricúspide; TAAP: tiempo de aceleración de arteria pulmonar; PDAP/PPCW: Relación presión diastólica pulmonar/presión pulmonar capilar de Wedge. Modificada de[36],[37].
Tabla 4. Efectos orgánicos del incremento de la PIA[49]

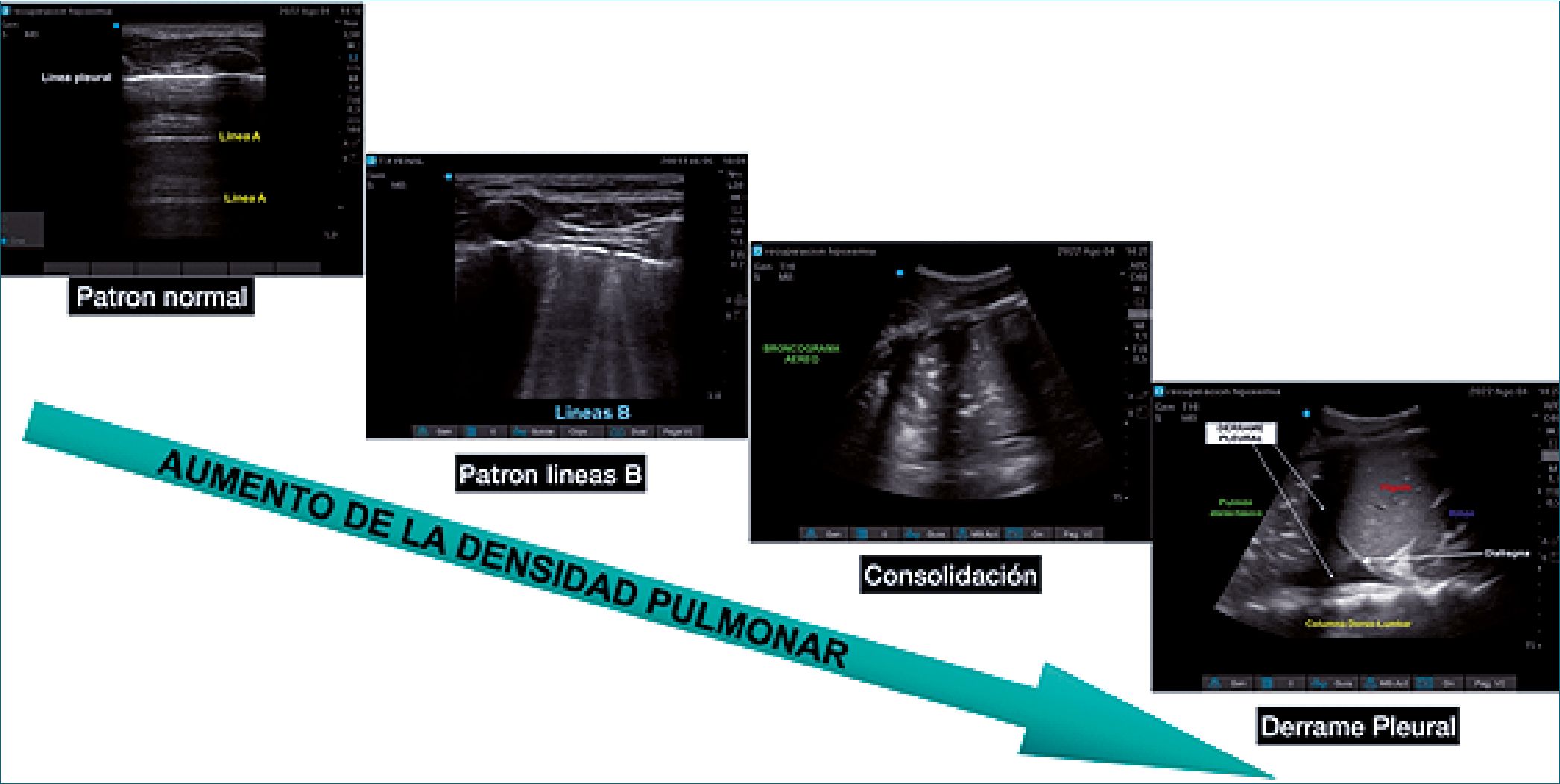
Figura 12. Diferentes patrones pulmonares. Imágenes, gentileza Dra. Silvina Longo.
A baja: pacientes con score VExUS: 0 o 1, o B: alta: score
VExUS 2 o 3.
2- Se dicotomiza el volumen sistólico con el valor del VTI Ao.
A: VTI bajo: valor < 16 cm o B: normal o alto >18 cm
3- Se crea una factorial de 2 en 2 de la siguiente manera:
Se ilustran dos pacientes, en la Figura 14, con hipotensión arterial y relleno capital prolongado. Se ubican en cuadrante 3 (VExUS: 0 y VTI 10 cm). Reciben una carga de fluidos y se evalúa a los 30 minutos. En el paciente 1, con deshidratación el VExUS no se modificó, pero el VTI aumentó a 17 cm pasa al cuadrante 1. El paciente 2, shock séptico en fase fría, el VExUS se elevó a 3 y el VTI baja a 12 cm pasa al cuadrante 4. Ambos son sensibles a precarga, pero muestran función cardíaca diferente (A: función normal), si ambos continúan hipotensos el paciente A podría recibir otra carga de fluidos o un agente vasoconstrictor, en cambio el paciente B debe realizarse un ecocardiograma completo para evaluar su función sistodiastólica y recibir drogas inotrópicas[50].
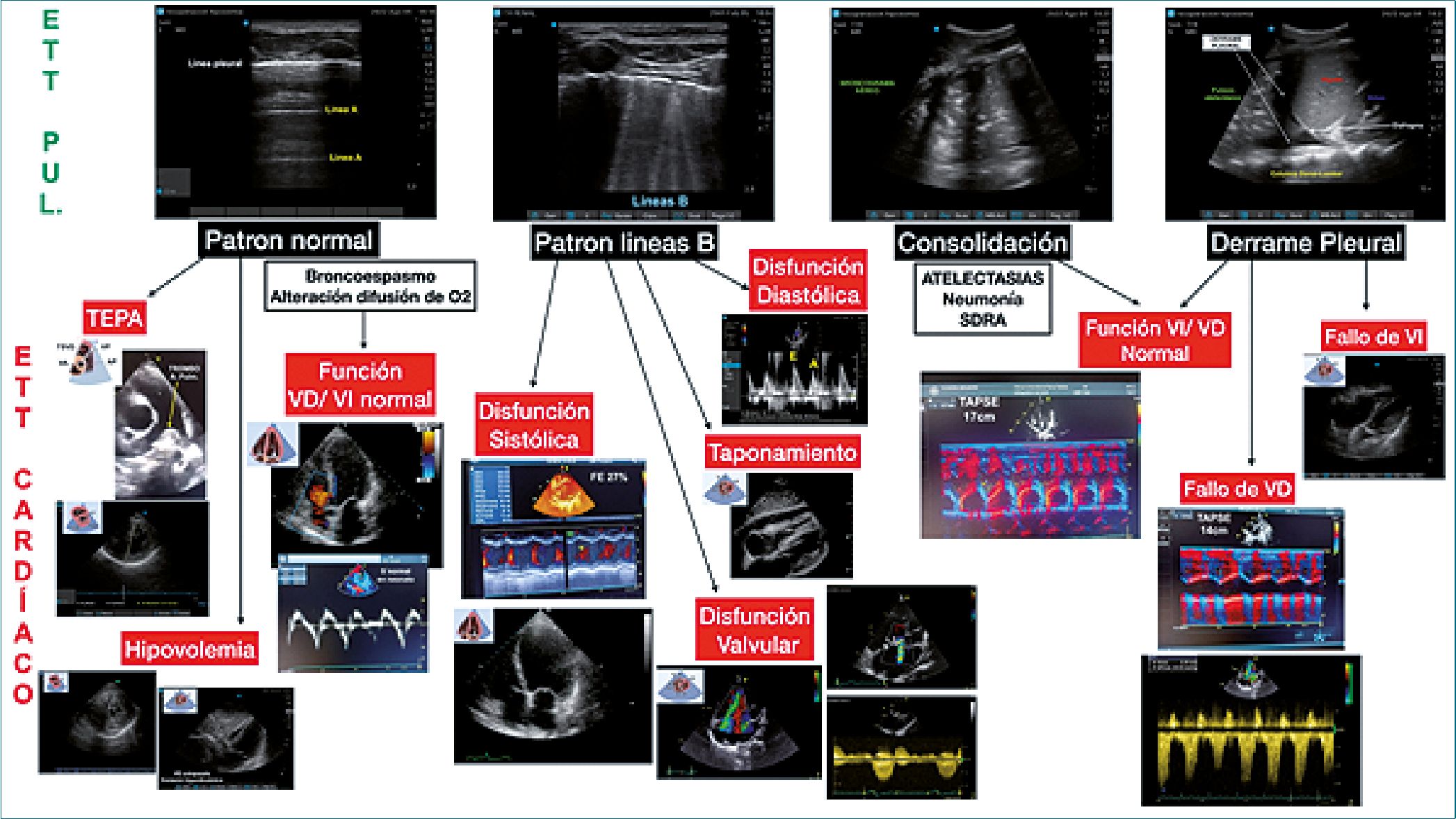
Figura 13. Evaluación ecográfica cardiopulmonar. ETT: ecografía transtoráxica; PUL: pulmonar. Imágenes. Gentileza de Dra. Silvina Longo.
| Cuadrante 1 (paciente normal) | VExUS 0 – 1 y VTI > 16 cm |
| Cuadrante 2 (cálido y congestivo) | VExUS 2 – 3 y VTI < 18 cm |
| Cuadrante 3 (frío con baja presión de llenado) | VExUS 0 – 1 y VTI < 16 cm |
| Cuadrante 4 (frío y congestivo) | VExUS 2 o 3 y VTI < 16 cm |
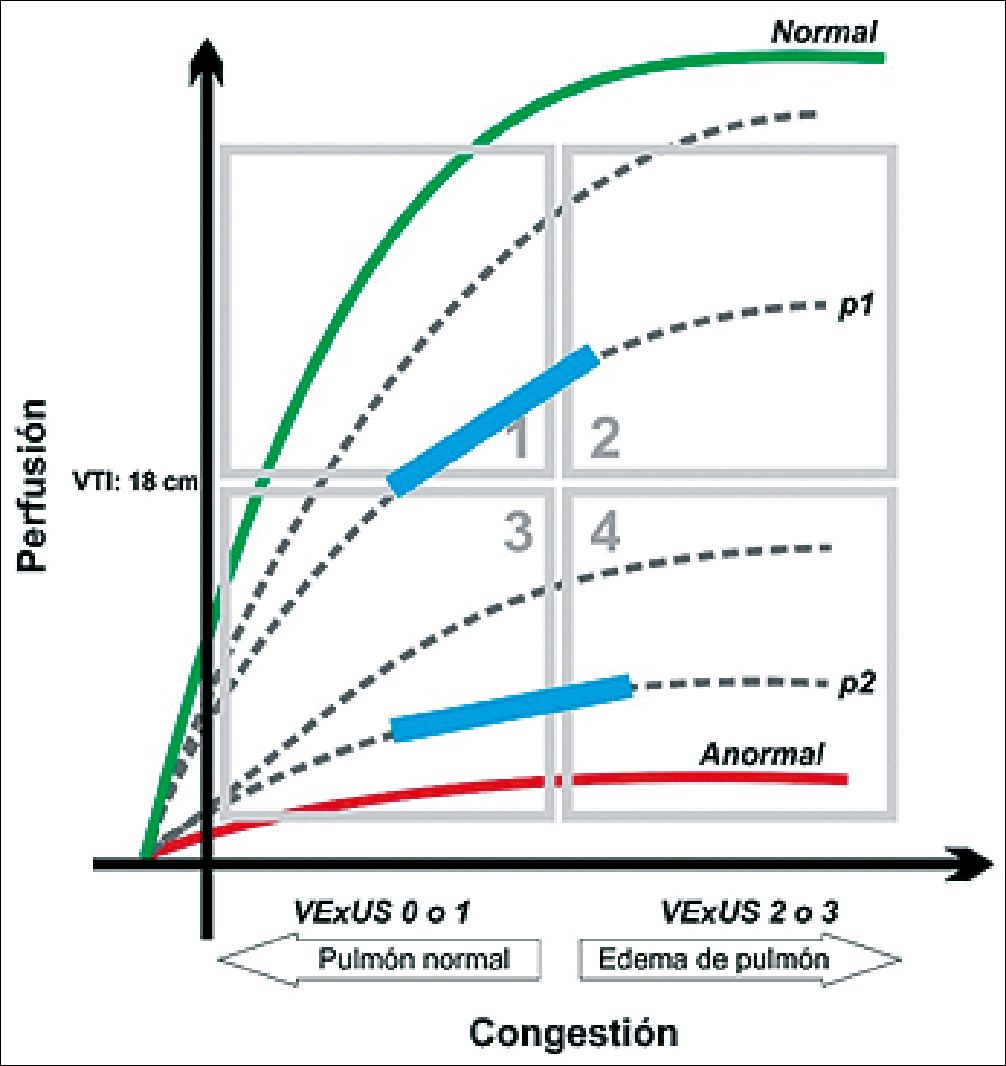
Figura 14. Protocolo enfoque dicotomizado. Carga hídrica (recuadro celeste) Modificada de: Kenny JE.[50].
3. Ecografía funcional para evaluar la precarga
Si la relación E/e’ < 8. Sugiere PAI y PTDVI normales, el paciente es respondedor a fluidos. Se administrarán si el contexto clínico lo sugiere.
Si la relación E/e’: entre 8 y 14: zona gris o indeterminada, la PAI podría ser normal. ¿Podría ser precarga dependiente? ¿Se
encuentra en la línea vertical de la curva de Frank Starling? Esta zona es precarga dependiente. Frente a esta duda, la conducta correcta es realizar una ecografía pulmonar:
Se busca presencia de líneas B (líquido intersticial), si están ausentes: se indica fluidos.
Si presenta líneas B (+ de 3/campo): completar:
1- Estudio ecográfico pulmonar, para realizar diagnóstico diferencial: ¿neumonía, edema, derrame, neumonitis?
2- Realizar ecocardiograma completo para descartar patología cardíaca.
3- Si persiste la duda y el paciente respira espontáneamente, se debe realizar un VTI dinámico que evalúa la reserva contráctil, se indica una carga de fluidos). Si aumenta el VTI: 10% -12%, es un paciente respondedor a volumen.
4- Si el paciente se encuentra en asistencia respiratoria mecánica (ARM), se evalúa la variabilidad del flujo aórtico: si es > 12%, se indica fluidos.
5- Si se indicó reposición de fluidos y la respuesta es incremento de la relación E/e’ y disminución de la onda e’, sugiere incremento de la PAI.
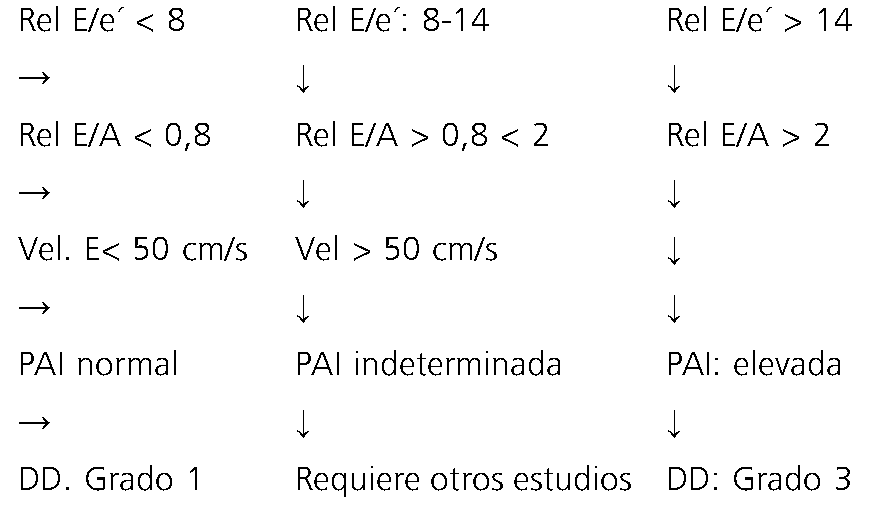
Relación E/e’ > 14: sugiere incremento de PAI-PTDVI, baja tolerancia y respuesta negativa a fluidos. Este paciente se encuentra en la meseta de la curva de Frank Starling Sarnoff, (zona precarga independiente).
Conducta: ¿El paciente se encuentra en shock?: NO: se debe indicar diuréticos.
SI: optar por agentes inotrópicos.
Limitaciones para predecir la PTDVI/PAI. Taquicardia, fibrilación auricular, bloqueo aurículo-ventricular, paciente en ARM[36],[37].
Agradecimientos: Al Sr. Alfredo Benito, Editorial RecFot, por la corrección editorial, elaboración de tablas y figuras.
-
Referencias
1. Banille E, Contreras A, Longo S, Urbano Villascusa J, Paz G, Jiménez Texcalpa M, et al. Monitoreo hemodinámico no invasivo. Ecodinamia Primera parte. Rev Chil Anest. 2024;53(5):451–61. https://doi.org/10.25237/revchilanestv53n5-04.
2. Koratala A, Romero-González G, Soliman-Aboumarie H, Kazory A. Unlocking the Potential of VExUS in Assessing Venous Congestion: The Art of Doing It Right. Cardiorenal Med. 2024;14(1):350–74. Available from: https://doi.org/ https://doi.org/10.1159/000539469 PMID:38815571
3. Soliman-Aboumarie H. Integrated Multiorgan Ultrasound for Assessment of Congestion: A New Frontier for Heart Failure Management. J Am Soc Echocardiogr. 2024 Jun 29: S0894-7317(24)00323-7. https://doi.org/10.1016/j.echo.2024.06.010.
4. Tavazzi G, Spiegel R, Rola P, Price S, Corradi F, and Hockestein M. Multi-organ Evaluation of Perfusion and Congestion Using Ultrasound in Patient with Shock. Oxford University Press on behalf of The European Society of Cardiology. 2024
5. Haycok K, Spiegel R, Rola P. Bedside Ultrasound: a primer for clinical integration. Special Skills: Venous Congestion. Chapter 6. 2019; pp100-107.
6. Di Nicolò P, Tavazzi G, Nannoni L, Corradi F. Inferior Vena Cava Ultrasonography for Volume Status Evaluation: An Intriguing Promise Never Fulfilled. J Clin Med. 2023 Mar;12(6):2217. https://doi.org/10.3390/jcm12062217 PMID:36983218
7. Kazory A, Olaoye OA, Koratala A. Nuances of Point-of-Care Ultrasound in Nephrology: A Clarion Call for Deeper Understanding. Blood Purif. 2024;53(7):598–602. https://doi.org/10.1159/000538909 PMID:38621364
8. Magder S. The use of Guyton’s approach to the control of cardiac output for clinical fluid management. Ann Intensive Care. 2024 Jul;14(1):105. https://doi.org/10.1186/s13613-024-01316-z PMID:38963533
9. Beaubien-Souligny W, Bouchard J, Desjardins G, Lamarche Y, Liszkowski M, Robillard P, et al. Extracardiac Signs of Fluid Overload in the Critically Ill Cardiac Patient: A Focused Evaluation Using Bedside Ultrasound. Can J Cardiol. 2017 Jan;33(1):88–100. https://doi.org/10.1016/j.cjca.2016.08.012 PMID:27887762
10. Kutty S, Li L, Hasan R, Peng Q, Rangamani S, Danford DA. Systemic venous diameters, collapsibility indices, and right atrial measurements in normal pediatric subjects. J Am Soc Echocardiogr. 2014 Feb;27(2):155–62. https://doi.org/10.1016/j.echo.2013.09.002 PMID:24120318
11. Rudsky LS, et al. J Am Soc Echocardiogr. 2010;23:685–713. https://doi.org/10.1016/j.echo.2010.05.010 PMID:20620859
12. Kathuria N, Ng L, Saul T, Lewiss RE. The baseline diameter of the inferior vena cava measured by sonography increases with age in normovolemic children. J Ultrasound Med. 2015; 34(6:1091-6. https://doi.org/10.7863/ultra.34.6.1091.
13. Mannarino S, Bulzomì P, Codazzi AC, Rispoli GA, Tinelli C, De Silvestri Aet al. Inferior vena cava, abdominal aorta, and IVC-to-aorta ratio in healthy Caucasian children: Ultrasound Z-scores according to BSA and age. J Cardiol. 2019 Oct;74(4):388-393. https://doi.org/10.1016/j.jjcc.2019.02.021.
14. Banille E. Ecografia más allá del corazón. Cap 5. Monitoreo Cardiopulmonar Pediátrico. Editorial RecFot. Año; 2019.
15. Denault AY, Casas C, Puentes W, Eljaiek R, Iglesias I. Ultrasonidos de la cabeza a los pies: opinion actual sobre su7 utilidad en inestabilidad hemodinámica, hypoxemia, oligoanuria y en el paciente con estado neurológico alterado. Rev Colomb Anestesiol. 2017;45(4):317–30. https://doi.org/10.1016/j.rca.2017.07.006.
16. Heiden Telo G, Petersen Saadi M, Paes Silvano G, Donelli Da Silva A, Biolo A. Contribution of Lung Ultrasound and VExUS in the Diagnosis and Monitoring of Patients with Heart Failure. Arq Bras 2024;4 (1): e20240010. https://doi.org/ https://doi.org/10.36660/abchf.20240010i.
17. Koratala A, Ronco C, Kazory A. Need for Objective Assessment of Volume Status in Critically Ill Patients with COVID-19: The Tri-POCUS Approach. Cardiorenal Med. 2020;10(4):209–16. https://doi.org/10.1159/000508544 PMID:32460302
18. Beaubien-Souligny W, Rola P, Haycock K, Bouchard J, Lamarche Y, Spiegel R, et al. Quantifying systemic congestion with Point-Of-Care ultrasound: development of the venous excess ultrasound grading system. Ultrasound J. 2020 Apr;12(1):16. https://doi.org/10.1186/s13089-020-00163-w PMID:32270297
19. Gupta B, Ahluwalia P, Gupta A, Ranjan N, Kakkar K, Aneja P. Utility of VExUS score in the peri-operative care unit, intensive care unit, and emergency setting – A systematic review. Indian J Anaesth. 2023 Nov;67 Suppl 4:S218–26. https://doi.org/10.4103/ija.ija_475_23 PMID:38187971
20. Menéndez-Suso JJ, Rodríguez-Álvarez D, Sánchez-Martín M. Feasibility and Utility of the Venous Excess Ultrasound Score to Detect and Grade Central Venous Pressure Elevation in Critically Ill Children. J Ultrasound Med. 2023 Jan;42(1):211–20. https://doi.org/10.1002/jum.16057 PMID:35811405
21. Banille E, Rodríguez Portelles A, Ponce J, Vega B, Ledesma R, Maure C, et al. Puntuación de VExUS fetal. Rev Chil Anest. 2023;52(5):558–64. https://doi.org/10.25237/revchilanestv52n5-19 .
22. Banille E, Ledesma R, Rosso C, Espósito M, Traferi C, Fernández C, et al. Ecografía Doppler de los vasos abdominales. Nuevo paradigma de Monitoreo en inestabilidad hemodinámica. Revista Chilena de Anestesia. 2021;50(6):881–4. https://doi.org/10.25237/revchilanestv5007101025 .
23. Banille E, Haycock K, Iriarte M, Peirone A, Contreras A, Muñoz F, et al. Utilidad de VExUS en paciente pediátrico portador de anomalía de Ebstein. Rev Chil Anest. 2022;51(2):221–4. https://doi.org/10.25237/revchilanestv5109021632.
24. Scheinfeld MH, Bilali A, Koenigsberg M. Understanding the spectral Doppler waveform of the hepatic veins in health and disease. Radiographics. 2009 Nov;29(7):2081–98. https://doi.org/10.1148/rg.297095715 PMID:19926763
25. Denault AY, Aldred MP, Hammoud A, Zeng YH, Beaubien-Souligny W, Couture EJ, et al. Doppler Interrogation of the Femoral Vein in the Critically Ill Patient: The Fastest Potential Acoustic Window to Diagnose Right Ventricular Dysfunction? Crit Care Explor. 2020 Sep;2(10):e0209. https://doi.org/10.1097/CCE.0000000000000209 PMID:33063023
26. Koratala A, Argaiz ER. Femoral Vein Doppler for Guiding Ultrafiltration in End-Stage Renal Disease: A Novel Addition to Bedside Ultrasound. CASE 2024; in press: 1-9. doi.org/https://doi.org/10.1016/j.case.2024.05.014..
27. Bhardwaj V, Rola P, Denault A, Vikneswaran G, Spiegel R. Femoral vein pulsatility: a simple too for venous congestion assessment. Ultrasound J. 2023, ;15(1) (2|4. https://doi.org/10.1186/s13089-023-00321-w .
28. González Delgado D, Romero González G. Valoración ultrasonográfica de la congestión venosa: VExUS una herramienta de medicina de precisión a pie de cama. RETIC. Revista de Ecocardiografía Práctica y otras técnicas de imagen cardíaca. 2021; 15:1-13.
29. Rola P, Miralles-Aguiar F, Argaiz E, Beaubien-Souligny W, Haycock K, Karimov T, et al. Clinical applications of the venous excess ultrasound (VExUS) score: conceptual review and case series. Ultrasound J. 2021 Jun;13(1):32. https://doi.org/10.1186/s13089-021-00232-8 PMID:34146184
30. Malakan Rad E, Parizadeh N, Radmehr H, Sheykhian T, Gharib B, Zeinaloo A. Correlation between echocardiographic estimation of right atrial pressure and invasive measurement of central venous pressure in postoperative pediatric patients with congenital heart disease: a prospective observational study. Egypt Heart J. 2024 Feb;76(1):25. https://doi.org/10.1186/s43044-024-00456-8 PMID:38381260
31. Istrail L, Kiernan J, Stepanova M. A Novel Method for Estimating Right Atrial Pressure With Point-of-Care Ultrasound. J Am Soc Echocardiogr. 2023 Mar;36(3):278–83. https://doi.org/10.1016/j.echo.2022.12.008 PMID:36521834
32. Koratala A. Internal jugulas vein (IJV). Ultrasound for the estimation fof right atrila pression. Nephropocus 2024. Disponible en: Instagram.com/p/C5UYcufJd6Q/
33. Valderrábano Salas B. Un método novedoso para estimar la presión de aurícula derecha con POCUS. J Am Soc Echocardiogr. 2023;36:278–83.
34. Kenny JE. ICU Physiology in 1000 Words. The Venous Excess Ultrasound Score is Not the Mean Systemic Pressure. Pul CCCM. The Lasted in Critical Care 9.9.24
35. Kenny JE. Assessing Fluid Intolerance with Doppler Ultrasonography: A Physiological Framework. Journals Medical Sciences; 2022. https://doi.org/10.3390/medsci10010012 .
36. Banille E. Manejo Integral del Bajo Gasto Cardíaco. Cap 38. Tomo 2. En Cardiointensivismo Pediátrico II. Una Mirada Ampliada. Ed RecFot. 2015
37. Banille E, Ponce J. ProE+CCri, Programa de actualización en emergencias y cuidados críticos. Módulo II. Clase 5: Monitoreo hemodinámico ecoguiado. Sociedad Argentina de Pediatría; 2024. 68 pp.
38. Alerhand S, Adrian JR, Taylor LA. Cardiac Point-of- Care Ultrasound. Emerg Med Clin N Am; 2024. https://doi.org/10.1016/j.emc.2024.05.004.
39. Bowcock EM, Mclean A. Bedside assessment of left atrial pressure in critical care: a multifaceted gem. Crit Care. 2022 Aug;26(1):247. https://doi.org/10.1186/s13054-022-04115-9 PMID:35964098
40. Sunderji I, Singh V, Fraser AG. When does the E/e′ index not work? The pitfalls of oversimplifying diastolic function. Echocardiography. 2020 Nov;37(11):1897–907. https://doi.org/10.1111/echo.14697 PMID:32608167
41. Fortuni F, Carluccio E, Ambrosio G. Rethinking diastolic function assessment in HFmrEF: bridging the gap with advanced imaging and novel echocardiographic indices. Int J Cardiol. 2024 Dec;417:132531. https://doi.org/10.1016/j.ijcard.2024.132531 PMID:39245074
42. Pérez C, Diaz-Caicedo D, Almanza Hernández DF, Moreno-Araque L, Yepes AF, Carrizosa Gonzalez JA. Critical Care Ultrasound in Shock: A Comprehensive Review of Ultrasound Protocol for Hemodynamic Assessment in the Intensive Care Unit. J Clin Med. 2024 Sep;13(18):5344. https://doi.org/10.3390/jcm13185344 PMID:39336831
43. Gonzalez FA, Santonocito C, Maybauer MO, Lopes LR, Almeida AG, Sanfilippo F. Diastology in the intensive care unit: challenges for the assessment and future directions. Echocardiography. 2024 Feb;41(2):e15773. https://doi.org/10.1111/echo.15773 PMID:38380688
44. Oulego I. Protocolo de Valoración Hemodinámica por Ultrasonidos. Valoración de la precarga y respuesta a fluidos SECIOP. 2021.
45. Rosenkranz S, Hoeper MM, Maron BA. Pulmonary hypertension in heart failure: the good, the bad, and the ugly. Eur Heart J. 2024 Sep;45(35):3289–91. https://doi.org/10.1093/eurheartj/ehae518 PMID:39132978
46. Scalia GM, Scalia IG, Kierle R, Beaumont R, Cross DB, Feenstra J, et al. ePLAR – The echocardiographic Pulmonary to Left Atrial Ratio – A novel non-invasive parameter to differentiate pre-capillary and post-capillary pulmonary hypertension. Int J Cardiol. 2016 Jun;212:379–86. https://doi.org/10.1016/j.ijcard.2016.03.035 PMID:27061467
47. Sanfilippo F, Messina A, Scolletta S, Bignami E, Morelli A, Cecconi M, et al. The “CHEOPS” bundle for the management of Left Ventricular Diastolic Dysfunction in critically ill patients: an experts’ opinion. Anaesth Crit Care Pain Med. 2023 Dec;42(6):101283. https://doi.org/10.1016/j.accpm.2023.101283 PMID:37516408
48. Santus P, Radovanovic D, Saad M, Zilianti C, Coppola S, Chiumello DA, et al. Acute dyspnea in the emergency department: a clinical review. Intern Emerg Med. 2023 Aug;18(5):1491–507. https://doi.org/10.1007/s11739-023-03322-8 PMID:37266791
49. Nejmi S. Anesthetic Implications in Children with Abdominal Compartment Syndrome (ACS). 2024. disponible en: https://www.linkedin.com/feed/update/urn:li:activity:7207310904432963584/?updateEntityUrn=urn%3Ali%3Afs_updateV2%3A%28urn%3Ali%3Aactivity%3A7207310904432963584%2CFEED_DETAIL%2CEMPTY%2CDEFAULT%2Cfalse%29
50. Kenny JS, Prager R, Rola P, Haycock K, Basmaji J, Hernández G. Unifying Fluid Responsiveness and Tolerance With Physiology: A Dynamic Interpretation of the Diamond-Forrester Classification. Crit Care Explor. 2023 Dec;5(12):e1022. https://doi.org/10.1097/CCE.0000000000001022 PMID:38094087

 ORCID
ORCID