Josefina Morena Yates1, Martín Lacassie2, Eduardo Vega Pérez3, Antonia Cárdenas3, Cristóbal Pedemonte3, María Francisca Elgueta Le-Beuffe3
Recibido: 23-10-2023
Aceptado: 10-12-2023
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 6 pp. 598-604|https://doi.org/10.25237/revchilanestv53n6-08
PDF|ePub|RIS
Acute and chronic pain in elderly patients
Abstract
The article addresses the challenges of pain management in elderly surgical patients due to the increasing aging population worldwide. The elderly population faces a higher prevalence of surgical pathologies and chronic pain conditions, making pain control a significant concern for anesthesiologists. The neurophysiology of pain perception changes with age, affecting both the peripheral and central nervous systems. Neurochemical alterations and reduced neurotransmitter levels impact nociception and pain modulation, potentially leading to chronic pain issues in elderly patients. The physiological changes that come with aging also affect the pharmacokinetics and pharmacodynamics of drugs used for pain management. These changes require careful consideration when selecting appropriate analgesics. This article suggests various pharmacological options for pain management in elderly patients. However, it emphasizes the importance of a multimodal approach to pain management, considering non-pharmacological interventions as well. The authors conclude that treating pain in elderly patients requires a comprehensive understanding of the physiological changes related to aging and individual comorbidities. More research is needed to improve pain management strategies for this growing population.
Resumen
El artículo aborda los desafíos del manejo del dolor en pacientes quirúrgicos de edad avanzada debido al envejecimiento creciente de la población mundial. La población de personas mayores enfrenta una mayor prevalencia de patologías quirúrgicas y condiciones de dolor crónico, lo que convierte el control del dolor en una preocupación importante para los anestesiólogos. La neurofisiología de la percepción del dolor cambia con la edad, afectando los sistemas nerviosos periférico y central. Las alteraciones neuroquímicas y la disminución de los niveles de neurotransmisores afectan la nocicepción y la modulación del dolor, lo que puede conducir a problemas de dolor crónico en pacientes ancianos. Los cambios fisiológicos propios del envejecimiento también afectan la farmacocinética y la farmacodinamia de los analgésicos, por lo que requieren una cuidadosa consideración al seleccionar fármacos adecuados. El artículo sugiere diversas opciones farmacológicas para el tratamiento del dolor en pacientes ancianos. Sin embargo, es fundamental el manejo multimodal que involucra medidas no farmacológicas. Los autores concluyen que tratar el dolor en pacientes ancianos requiere una comprensión integral de los cambios fisiológicos relacionados con el envejecimiento y las comorbilidades individuales. Se necesita más investigación para mejorar las estrategias de manejo del dolor en esta creciente población.
-
Introducción
La edad poblacional de España y el mundo ha seguido una tendencia hacia el envejecimiento en los últimos veinte años, siendo el grupo etario de mayores de 65 años el que más se ha incrementado. Según el Instituto Nacional de Estadísticas, con datos del año 2022, 20,1% de la población española es mayor de 65 años y se estima que para el 2050 llegue a 30,4%, lo que significará un crecimiento en más de 6,5 millones de personas con respecto a la actualidad. Además, el perfil etario dentro de este grupo se modificaría, aumentando la proporción de personas mayores de 80 años desde 6,1% a un estimado 11%[1].
Este grupo poblacional se somete más, frecuentemente, a cirugías debido a la mayor prevalencia de patologías qui- rúrgicas[2], además de presentar una alta prevalencia de enfermedades que cursan con dolor crónico como: la patología osteoarticular, que constituye la primera causa de dolor crónico en este grupo; el dolor secundario a patologías sistémicas, como el cáncer y el dolor por complicaciones de diabetes mellitus o secundario a un ictus cerebral; neuralgia post herpéti- ca y causas misceláneas, como dolor miofascial, dolor crónico postquirúrgico, entre otros[3],[4]. Así, nos veremos enfrentados cada vez con mayor frecuencia a personas mayores con cuadros de dolor agudo posoperatorio o bien, dolor crónico. Sumado a esto y se ha demostrado que el dolor agudo posoperatorio en los pacientes mayores con déficit cognitivo se asocia a mayor riesgo de desarrollar demencia posoperatoria[5]. Por otro lado, aproximadamente 65% de los pacientes mayores de 65 años reportan presentar dolor crónico[3].
El dolor crónico posoperatorio es una complicación común en pacientes quirúrgicos de edad avanzada. A los 3 y 6 meses de una operación electiva, la incidencia es de 35,6% [intervalo de confianza del 95% (IC95%) 32,7% – 38,8%] y 21,5% (IC del 95% 19,0% – 23,9%) respectivamente. Este tiene características neuropáticas en 45% de los pacientes con dolor crónico a los 3 meses, mientras que a los 6 meses, es de 31%. Interesantemente, la ansiedad y la depresión preoperatorias, la cirugía traumatológica y una mayor intensidad del dolor posoperatorio agudo al movimiento, se asocian con un mayor riesgo de dolor crónico posoperatorio[6].
Las personas mayores presentan dificultades y desafíos en el tratamiento del dolor, derivados de los cambios fisiológicos propios del envejecimiento normal. Existen cambios tanto en la neurofisiología del dolor como en el metabolismo, funciones orgánicas y composición corporal que plantean alteraciones de la farmacocinética y farmacodinamia de las drogas. Así también, existe una alta prevalencia de comorbilidades y polifar- macia que impactarán también en el perfil de efectos adversos de los fármacos[7]. Existen además mitos y creencias respecto al dolor en las personas mayores, como que sienten menos dolor o bien que el dolor es un fenómeno normal del proceso de envejecimiento, lo que lleva a este grupo o sus familiares a no consultar o bien a los médicos a subtratarlos[8]. El manejo inadecuado del dolor interfiere con las actividades de la vida diaria, disminuye la deambulación, causa alteraciones del ánimo y aumenta el deterioro cognitivo. Todo lo anterior puede llevar a otras comorbilidades como trombosis venosa profunda, tromboembolismo pulmonar, fracturas y una menor calidad de vida[3].
La evaluación y manejo del dolor en lo adultos mayores suele ser dificultoso por la alta incidencia de demencia y alteraciones sensoriales. Nuestro objetivo es realizar una revisión narrativa con respecto al dolor agudo y crónico en personas mayores, con énfasis en el tratamiento farmacológico, considerando los cambios propios de este grupo etario.
-
Cambios neurofisiológicos en la nocicepción y percepción del dolor
El proceso normal de envejecimiento cursa con cambios en la neurofisiología de la nocicepción y percepción del dolor a nivel del sistema nervioso central y periférico, a lo que se suman los cambios propios del envejecimiento y las comorbilidades asociadas[9]. Se revisan a continuación los principales cambios observados en personas mayores.
-
Sistema nervioso periférico
Se han descrito cambios estructurales, funcionales y bioquímicos. Hay una disminución en la densidad de fibras mieliniza- das y no mielinizadas a partir de los sesenta años. Existe además un descenso en la producción de sustancia P a nivel periférico, así como también de péptido relacionado al gen de la calcitoni- na (PRGC). En axones de ratas envejecidas, se ha observado un patrón de expresión de neurotransmisores similar al de axones dañados[10].
-
Sistema nervioso central
En adultos mayores sanos ocurren cambios degenerativos difusos a nivel del asta dorsal de la médula espinal. Se observa una marcada disminución de la densidad de mielina, involución axonal y alteración de la neuroquímica medular[6]. A este nivel también disminuyen la sustancia P y el PRGC. Así mismo hay evidencia de una progresiva pérdida de neuronas serotoninér- gicas y noradrenérgicas relacionada con la edad.
Existen también cambios importantes en el neuro procesamiento de la nocicepción, especialmente, de las vías de modulación descendentes.
Varios estudios han documentado un aumento en la respuesta inmunorreactiva de la sustancia P y el PRGC a los estímulos nociceptivos o al daño de nervios sensitivos en el asta dorsal de la médula espinal lo que puede tener gran importancia en cuanto a los procesos de cronificación del dolor.
Encéfalo: ocurre muerte y pérdida de arborización dendrí- tica de forma difusa en el cerebro al envejecer, tanto en la corteza como en regiones infratentoriales. Estos cambios incluyen regiones involucradas en el procesamiento de señales nocicep- tivas. Se ha reportado disminución de síntesis de diversos neu- rotransmisores involucrados, principalmente, en las señales de modulación del dolor tales como el ácido gama amino butírico (GABA) y catecolaminas, así como una disminución en los receptores opioides y serotoninérgicos. La sustancia P y somatos- tatina en cambio, parecen no disminuir su síntesis a este nivel.
Cuando ocurren estímulos nociceptivos o estrés ambiental intensos, se activan sistemas de modulación descendente que pueden ser clasificados como -opioides dependiente- y -no opioides dependientes-. Se ha documentado una disminución de actividad relacionada con la edad en ambos sistemas.
Esto podría significar dolor más intenso ante una estimulación repetida en personas mayores y una compensación de los efectos a nivel de sistema nervioso periférico que podrían determinar un aumento del umbral y disminución de la transmisión del dolor. Se propone que las alteraciones en la percepción, probablemente, sean intensidad dependiente. A menores intensidades de estimulación predomina el efecto de disminución de transmisión a nivel del sistema nervioso central y periférico mientras que a niveles más intensos de estimulación predomina el efecto de disminución de las vías de modulación descendentes.
El aumento de umbral permanece como algo controversial y difícil de demostrar debido a que se presentan distintos resultados dependiendo del tipo, lugar y duración del estímulo[10].
-
Cambios fisiológicos propios del envejecimiento
El envejecimiento es un proceso fisiopatológico que se caracteriza por una disminución en la función de distintos órganos. Producto de esto, se producen cambios en la farmacocinética y farmacodinamia de las drogas que deben ser considerados al momento de elegir la terapia farmacológica más adecuada para una persona mayor. Específicamente, se afectan la absorción, distribución, metabolismo y eliminación de las drogas[8].
De especial relevancia son los cambios en la composición corporal y disminución de la función renal y hepática. El aumento del porcentaje de grasa corporal que ocurre de forma normal con la edad dará cuenta de un mayor volumen de distribución de drogas liposolubles, mientras que las drogas hidrosolubles tendrán menores volúmenes de distribución secundario a una disminución del agua corporal total. La función hepática disminuye con la edad a partir de los cincuenta años[8], sin embargo, el impacto clínico de esta disminución es difícil de evaluar en la práctica y suele ser poco relevante, siempre y cuando no haya un mayor deterioro secundario a patología hepática. La función renal también disminuirá, y podrá verse afectada en mayor medida por patologías de alta prevalencia en esta población como la hipertensión arterial y la diabetes mellitus[11], por lo que es importante considerar esto a la hora de elegir la terapia farmacológica, sobre todo al utilizar fármacos, potencialmente, nefrotóxicos como, por ejemplo, los antiinflamatorios no esteroidales (AINEs).
Otros cambios que pueden tener impacto en la farmaco- cinética y farmacodinamia incluyen una disminución del gasto cardiaco, con una distribución más lenta de las drogas y la disminución de la reserva respiratoria, con mayor riesgo de depresión respiratoria[10].
-
Evaluación y medición dolor
La evaluación del dolor en personas mayores presenta diversos desafíos. Suele haber un subreporte de este síntoma secundario a mitos y creencias erróneas, déficits sensoriales y deterioro cognitivo que dificultan el reporte de dolor. Por lo tanto, el dolor debe ser activa y, apropiadamente, buscado. La evaluación debe comenzar con una anamnesis y examen físico completo[12], considerando el estado global del paciente y su funcionalidad. Se debe identificar la causa del dolor, pero se debe tomar en cuenta que los adultos mayores suelen tener más de un factor causal del dolor y que la falta de reserva y pérdida del dolor como signo de alarma aumenta la probabilidad
de que el dolor se presente de forma atípica[3],[13]. A su vez, puede haber dificultad para aplicar escalas habituales de dolor debido a deterioro cognitivo o un bajo nivel educacional. Es por ello que debemos elegir escalas de medición adecuadas para cada paciente. El mejor indicador de la intensidad del dolor será el autoreporte[3] y podremos utilizar escalas de medición de dolor habituales (como la escala visual análoga (EVA) o la escala numérica simple) con pacientes que no presenten deterioro cognitivo o que presenten deterioro leve[10]. Para pacientes con deterioro moderado a intenso deberemos utilizar escalas especiales como la de malestar, la escala Pain Assessment in Advanced Dementia (PAINAD)[15], desarrollada para pacientes con demencia avanzada, y la escala Critical Pain Observation Tool (CPOT)[7], para pacientes con deterioro cognitivo mayor, cuya ventaja es el uso de criterios objetivos que el evaluador observa en el paciente. En la Tabla 1 se resumen escalas recomendadas para evaluar el dolor en adultos mayores[14].
-
Alternativas para el tratamiento dolor
Es importante mencionar que las medidas no farmacológicas son fundamentales en el tratamiento del dolor crónico, donde el manejo interdisciplinario será clave para obtener un éxito terapéutico. El ejercicio físico, la correcta nutrición, la corrección de anemia y el cese del tabaquismo pudieran ser factores muy determinantes en el desenlace posoperatorio[16],[17] Los fármacos serán sólo un pilar más del tratamiento[4]. En la Figura 1 se resumen los pilares del manejo analgésico en adulto mayor, que serán tratados a continuación.
-
1. Acetaminófeno
El acetaminófeno o paracetamol es un fármaco analgésico de acción central, con mecanismo de acción poco conocido, que actuaría inhibiendo la enzima ciclooxigenasa-3 (COX-3) a nivel de SNC, entre otros mecanismos descritos[18]. Es un excelente analgésico para dolor leve y actúa como un ahorrador de opioides en casos de dolor moderado a intenso, por lo que, se debe tener en cuenta como parte de la estrategia de analgesia multimodal[19],[20]. En general es bien tolerado por personas mayores y tiene un perfil de seguridad favorable en este grupo. No se requiere ajuste de dosis en esta población a menos que exista un deterioro grave de la función hepática[26].
-
2. Antiinflamatorios no esteroidales (AINEs)
Este grupo de fármacos actúa inhibiendo las enzimas ciclooxigenasa 1 y 2 (COX-1 y COX-2) que participan en la síntesis de prostaglandinas involucradas en procesos de inflamación y dolor; pero también, son responsables de la síntesis de prostanoides esenciales en la fisiología normal, involucrados por ejemplo en la protección de la mucosa gástrica, coagulación y regulación del flujo sanguíneo renal, lo que explica su gran número de efectos adversos[18]. En este grupo específico de pacientes, el perfil de seguridad de los AINEs es desfavorable, presentando las personas mayores, mayor riesgo de efectos adversos gastrointestinales, cardiovasculares y renales que la población general[22]. Es por esto, que su prescripción se debe hacer de forma cuidadosa, valorando siempre el perfil de riesgo/beneficio y otros factores de riesgo para cada efecto adverso tales como: factores de riesgo cardiovascular, compromiso hemodinámico, sepsis, uso concomitante de corticosteroides, etc.
Tabla 1. Escalas de Evaluación del Dolor en Adultos Mayores[3]
| Instrumento | Descripción | Niveles | Observaciones |
| Escala numérica simple | Escala de 11 puntos | 0 (nada de dolor) a 10 (el peor dolor conocido) | Primera línea si no hay deterioro cognitivo
Requiere pensamiento abstracto moderado |
| Escala Visual Análoga (EVA) | Línea continua que se le presenta al paciente y éste selecciona el nivel de su dolor | Se determina un punto en la línea. | Útil para investigación
Puede ser difícil señalar el punto en la línea si hay dificultad de movilización |
| Requiere alta capacidad de pensamiento abstracto | |||
| Escala Verbal | Escala categórica de 4 puntos | Evalúa dolor en ausente, leve, moderado y severo | Difícil de aplicar si hay dificultades en el lenguaje
Requiere pensamiento abstracto moderado |
| Escala facial de dolor | Escala visual categórica, evalúa dolor en 6, 7 y hasta 11 niveles | Dibujos de expresiones faciales con distinta intensidad del dolor | Validado en distintas razas Requiere pensamiento abstracto moderado |
| PAINAD | Escala observacional para pacientes con demencia avanzada, considera 5 comportamientos | Evalúa respiración, vocalización, expresión facial, lenguaje corporal y consolabilidad de 0 a 2 puntos cada uno par aun total de 0 a 10 puntos | Alta sensibilidad y baja especificad para dolor en pacientes con demencia
No requiere pensamiento abstracto |
| CPOT | Escala observacional en paciente críticos que considera 4 variables | Evalúa expresión facial, movimiento corporal, acomplamiento al ventilador y tensión muscular. Los puntajes varían de 0 a 2 por variable, con un valor total de 0 a 8 | De uso en pacientes conectados a ventilación mecánica
No requiere pensamiento abstracto del paciente |
En caso de considerarse favorable el perfil riesgo/ beneficio se recomienda usarlos en la menor dosis y por el menor tiempo posible[22], utilizando dosis 25%-50% menores o bien aumentando el intervalo de administración[6] y siempre monitorizan- do la aparición de efectos adversos. En caso de deterioro de la función renal, caracterizado por una velocidad de filtración glomerular (VFG) < 60 ml/min/m2, su uso está contraindicado[7].
A pesar de las desventajas que tiene para este grupo etario, el uso de AINEs tópicos (como diclofenaco) ha mostrado gran eficacia para tratar el dolor osteoarticular crónico y tiene mínima absorción sistémica[22].
-
3. Opioides
Este grupo de analgésicos engloba diversos fármacos que producen analgesia al interactuar con los receptores opioides mu, delta y kappa[23]. Existe poca evidencia disponible respecto al uso de este grupo de fármacos en personas mayores[24]. Como regla general, se observa una mayor potencia y duración de los fármacos opioides, por lo que puede ser necesario reducir las dosis y aumentar los intervalos de administración, sin embargo, la variabilidad interindividual es amplia, siendo necesario realizar una titulación cuidadosa. Así mismo, los efectos adversos son más frecuentes en estos pacientes, pudiendo aumentar el riesgo de caídas (y fracturas) por lo que se debe tener especial precaución[4]. La recomendación general es iniciar a la menor dosis posible (con una reducción de 25%-50%)[11] e ir titulando, muy lentamente, hasta alcanzar el efecto deseado, monitorizando la aparición de efectos adversos. La depresión respiratoria es, especialmente, preocupante ya que son pacientes con menor reserva respiratoria, lo que los hace más propensos a este efecto adverso, que puede tener resultados catastróficos. Podemos clasificarlos en opioides convencionales y atípicos según su agonismo completo en receptores mu y acción parcial o dual en otros receptores, respectivamente[25]. A continuación, se detallan las consideraciones para los principales opioides utilizados en la práctica clínica habitual.
a. Fentanilo: La sensibilidad cerebral está aumentada por lo que se requiere disminuir su dosis hasta en 50%[2]. Es un opioide lipofílico, por lo que se verá aumentada su dura- ción[11].
b. Morfina: Por tratarse de una droga hidrofílica, su volumen de distribución estará disminuido, alcanzando mayores concentraciones plasmáticas posterior a la administración de un bolo, aumentando el riesgo de efectos adversos[23]. El estado de equilibrio tardará más en alcanzarse por una distribución más lenta[2]. Debe tenerse precaución con el uso de dosis repetidas por la potencial acumulación de su metabolito morfina-6-glucurónido, que tiene excreción renal[26]. En general, se recomienda una reducción de la dosis en 50% con respecto a pacientes jóvenes, aumentando los intervalos de administración al doble del tiempo habitual[2].
c. Metadona: Es un opioide que se acumula con dosis repetidas, aumentando su duración, lo que ocurre más marcadamente en personas mayores[27]. Si bien no hay estudios en este grupo específico[28], se recomienda también disminuir la dosis en 50% ya que su potencia estará aumentada[2].
d. Tramadol: Es un fármaco con agonismo opioide débil que además inhibe la recaptación de serotonina y noradrenalina, potenciando así su efecto analgésico[4]. En general, es mal tolerado por adultos mayores, con una mayor incidencia de efectos adversos tales como náuseas, vómitos y mareos, aumentando también el riesgo de caídas[29]. Cabe destacar que la mayoría de eventos adversos se presenta al iniciar la administración el fármaco[29], por lo que se recomienda una disminución de la dosis y una titulación muy lenta, teniendo especial precaución con pacientes que presenten deterioro de la función renal (con VFG < 30) o de la función hepática, en quienes se debe evitar el uso de formulaciones de liberación prolongada[30],[31].
e. Tapentadol: Fármaco con un agonismo opioide fuerte e inhibición de la recaptura de noradrenalina, lo cual le da un efecto analgésico sinérgico[32]. Presenta un mejor perfil de tolerabilidad respecto a efectos adversos gastrointestinales, hipertensión y disfunción pulmonar. Junto con menos síndrome serotoninérgico, toxicidad endocrina y convulsiones[32]. Si bien estudios farmacocinéticos muestran que no es necesario ajustar dosis en pacientes mayores, debe considerarse la posibilidad de que presenten comorbilidad renal y hepática al momento de elegir las dosis[33]. Por otro lado, esta droga tiene una baja probabilidad de interacción con otros fármacos, lo cual es importante en este grupo, donde suele haber polifarmacia. Su uso ha demostrado ser efectivo en adultos mayores con dolor músculo esquelético[33].
f. Buprenorfina: Agonista parcial opioide, con agonismo de los receptores mu y antagonismo kappa y delta, lo que produce analgesia y un menor riesgo de efectos adversos como constipación, disforia, depresión respiratoria y abuso de sustancias. Puede administrarse por vía endovenosa, bucal y transdérmica, siendo la última especialmente útil en adultos mayores por su gran polifarmacia. Si bien tiene menos riesgo de eventos adversos, se recomienda titular su dosis en esta población[25].
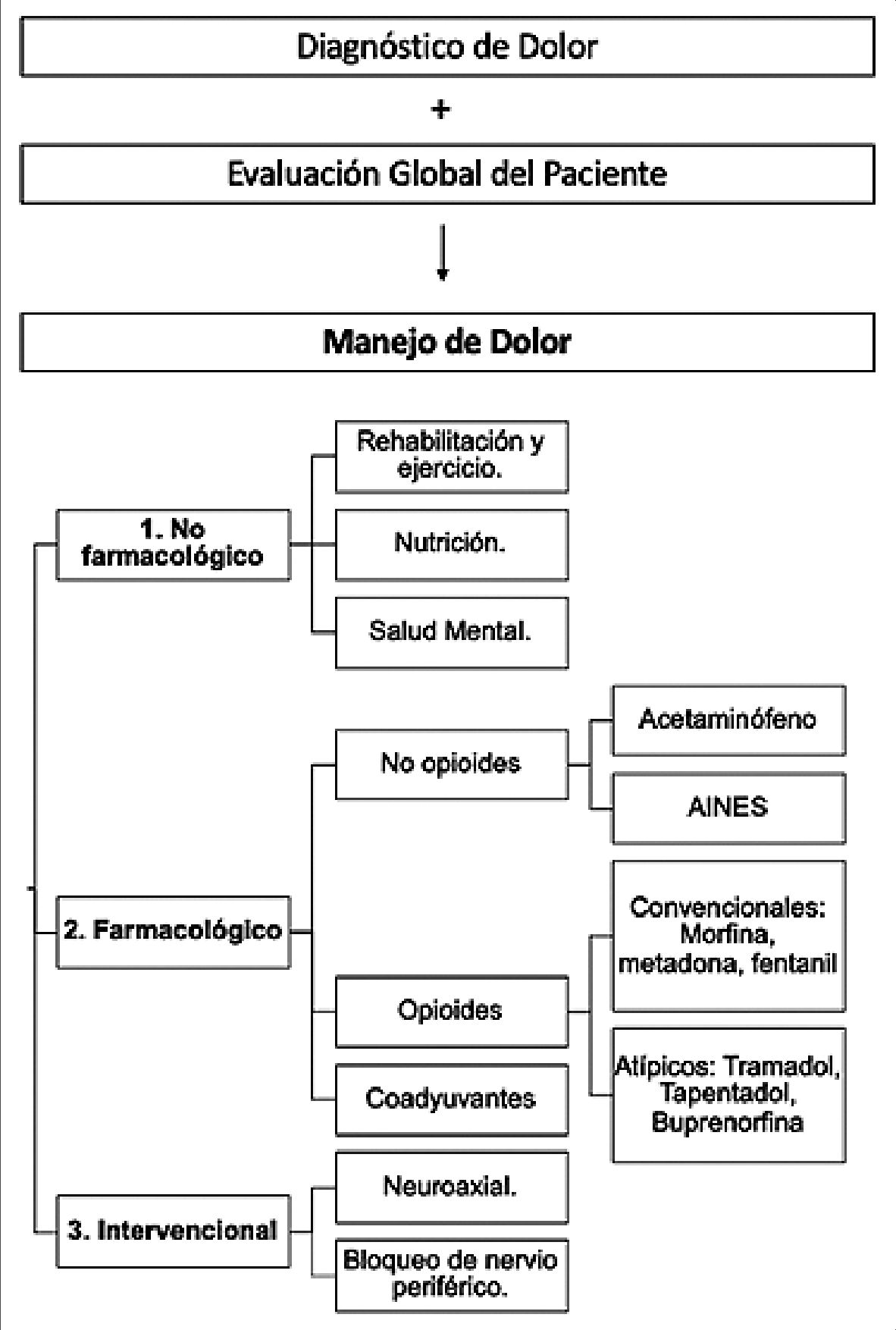
Figura 1. Alternativas de manejo analgésico en el adulto mayor.
-
4. Gabapentinoides (gabapentina y pregabalina)
Los gabapentinoides son fármacos ampliamente utilizados en el tratamiento del dolor crónico de origen neuropático. Cada vez más se han ido posicionando como una opción de tratamiento en el período perioperatorio[7]. Actúan inhibiendo la subunidad alfa2-delta1 de los canales de calcio dependientes de voltaje pre-sinápticos, disminuyendo así la liberación de neurotransmisores excitatorios[18]. Presentan como principales efectos adversos somnolencia y mareos, que se presentan ma- yoritariamente al iniciar al tratamiento y son dosis dependientes. En pacientes mayores, estos efectos pueden aumentar el riesgo de caídas, por lo que su inicio y titulación debe ser lenta y cuidadosa, sobre todo en pacientes con algún grado de insuficiencia renal. Especial cuidado debe tenerse también en pacientes que usen, concomitantemente, fármacos que produzcan depresión respiratoria como opioides, ya que su efecto depresor podría potenciarse[7]. Su eliminación es casi, exclusivamente, renal por lo que estará disminuida en personas mayores y debe ajustarse su dosis en pacientes con disminución del VFG[18].
-
5. Agonistas del receptor adrenérgico alfa-2 (dexmedeto- midina y clonidina)
Existe poca evidencia respecto al uso de estos fármacos en personas mayores, existiendo preocupación respecto a los efectos hemodinámicos y sedantes. El uso de dexmedetomidina podría reducir el delirium en pacientes sometidos a cirugía cardíaca, lo que podría ser de gran utilidad en pacientes mayores[7].
-
6. Anestésicos locales
Las infusiones endovenosas de lidocaína pueden utilizarse como estrategia de analgesia multimodal perioperatoria y también en algunos casos de dolor crónico. Debido a que la depuración de esta droga puede verse disminuida hasta en 40% en pacientes mayores, secundario a la disminución del flujo sanguíneo hepático, por lo que es prudente reducir las dosis utilizadas en infusión o bien, disminuir la duración de éstas[7].
-
7. Ketamina
Es un fármaco con múltiples mecanismos de acción propuestos, siendo el principal el antagonismo de receptores de glutamato tipo N-metil-D-aspartato (NMDA). Hay evidencia respecto a la eficacia analgésica de la ketamina en pacientes mayores[34], sin embargo, existe preocupación por los efectos adversos psicogénicos en este grupo poblacional, sin haberse comprobado que sea un grupo de especial riesgo. En este sentido, es más favorable el perfil de efectos adversos al administrarlo como infusión en vez de en bolo en el período perioperatorio y sería recomendado reducir las dosis en personas mayores[7].
-
8. Técnicas regionales
Las técnicas regionales son hoy en día parte esencial del manejo agudo posoperatorio, proporcionando analgesia potente y permitiendo disminuir así el uso de opioides y sus potenciales efectos adversos. Se recomienda, por lo tanto, siempre que sea posible, utilizar estas técnicas[19], sin embargo, hay algunas consideraciones que se deben tener en cuenta.
En primer lugar, las técnicas neuroaxiales, habitualmente, son de mayor dificultad técnica por cambios anatómicos degenerativos asociados a la edad que ocurren en la columna vertebral. Segundo, la depuración de anestésicos locales puede disminuir hasta 40%, por lo que las dosis máximas deben reducirse. También se observa un aumento en la sensibilidad de las fibras nerviosas a estos fármacos, pudiendo aumentar la duración del bloqueo y el riesgo de neurotoxicidad[35]. Así mismo, los efectos de los opioides administrados a nivel neuroaxial pueden ser más marcados en personas mayores por lo que se recomienda una reducción de la dosis en 50%[7].
-
Conclusiones
Las personas mayores son un grupo de pacientes que plantea múltiples desafíos al momento de elegir una terapia analgésica. Considerar los diferentes cambios fisiológicos del envejecimiento, las comorbilidades, la farmacocinética, la farmacodinamia y los medicamentos de uso crónico son las claves para la correcta elección de analgésicos en esta población, minimizando así el riesgo de efectos adversos e interacciones. En general, muchos fármacos requerirán una disminución de las dosis utilizadas y una titulación lenta, cobrando especial importancia la analgesia multimodal, con el objetivo de reducir así las dosis utilizadas y disminuir el riesgo de reacciones adversas. Aún la evidencia en este grupo es muy escasa y se hace urgente ampliar nuestro conocimiento con evidencia de calidad, considerando el acelerado envejecimiento de la población mundial.
Conflico de intereses: Los autores no tienen conflicto de intereses.
-
Referencias
1. Proyecciones de Población 2022-2072. 2022. https://www.ine.es/prensa/pp_2022_2072.pdf
2. Bentov I, Rooke GA (Barash P, Cullen B, Stoelting R, Cahalan M, Stock M, Ortega R, et al., editors). Anestesia del paciente anciano, Anestesia Clínica 8a edition. Wolters Kluwer; 2017. pp. 897–913.
3. Rajput K, Ng J, Zwolinski N, Chow RM. Pain Management in the Elderly: A Narrative Review. Anesthesiol Clin. 2023 Sep;41(3):671–91. https://doi.org/10.1016/j.anclin.2023.03.003 PMID:37516502
4. Schwan J, Sclafani J, Tawfik VL. Chronic Pain Management in the Elderly. Anesthesiol Clin. 2019 Sep;37(3):547–60. https://doi.org/10.1016/j.anclin.2019.04.012 PMID:31337484
5. Ma JH, Liu YF, Hong H, Li CJ, Cui F, Mu DL, et al. Effect of acute pain on the association between preoperative cognitive impairment and postoperative delirium: a secondary analysis of three trials. Br J Anaesth. 2023 Feb;130(2):e272–80. https://doi.org/10.1016/j.bja.2022.06.033 PMID:35933172
6. Jin J, Zhang T, Xiong X, Chen H, Jiang Y, He S. A prospective study of chronic postsurgical pain in elderly patients: incidence, characteristics and risk factors. BMC Geriatr. 2023 May;23(1):289. https://doi.org/10.1186/s12877-023-04006-w PMID:37173634
7. Rajan J, Behrends M. Acute Pain in Older Adults: Recommendations for Assessment and Treatment. Anesthesiol Clin. 2019 Sep;37(3):507–20. https://doi.org/10.1016/j.anclin.2019.04.009 PMID:31337481
8. Borsheski R, Johnson QL. Pain management in the geriatric population. Mo Med. 2014;111(6):508–11. PMID:25665235
9. Huang H, Wu J, Chang Y, Wang H, Tian Y, Chen Z, et al. Molecular and Cellular Mechanisms of Neuropathic Pain in Aging. ACS Chem Neurosci. 2023 May;14(10):1701–16. https://doi.org/10.1021/acschemneuro.3c00010 PMID:37104541
10. Gibson SJ, Farrell M. A review of age differences in the neurophysiology of nociception and the perceptual experience of pain. Clin J Pain. 2004;20(4):227–39. https://doi.org/10.1097/00002508-200407000-00004 PMID:15218407
11. Andres TM, McGrane T, McEvoy MD, Allen BF. Geriatric Pharmacology: an Update. Anesthesiol Clin. 2019 Sep;37(3):475–92. https://doi.org/10.1016/j.anclin.2019.04.007 PMID:31337479
12. Malec M, Shega JW. Pain management in the elderly. Med Clin North Am. 2015 Mar;99(2):337–50. https://doi.org/10.1016/j.mcna.2014.11.007 PMID:25700587
13. Raja SN, Sommer CL. Pain 2014 Refresher Course: 15th World Congress on pain. In: Comprehensive Treatment of Chronic Pain by Medical, Interventional and Integrative Approaches. Lippincott Williams & Wilkins; 2015.
14. Mcswain JR, Sirianni JM, Wilson SH. Perioperative Considerations for Patients with a Known Diagnosis of Dementia. Adv Anesth. 2021 Dec;39:113–32. https://doi.org/10.1016/j.aan.2021.07.007 PMID:34715970
15. Warden V, Hurley AC, Volicer L. Development and psychometric evaluation of the Pain Assessment in Advanced Dementia (PAINAD) scale. J Am Med Dir Assoc. 2003;4(1):9–15. https://doi.org/10.1097/01.JAM.0000043422.31640.F7 PMID:12807591
16. Beilstein CM, Krutkyte G, Vetsch T, Eser P, Wilhelm M, Stanga Z, et al. Multimodal prehabilitation for major surgery in elderly patients to lower complications: protocol of a randomised, prospective, multicentre, multidisciplinary trial (PREHABIL Trial). BMJ Open. 2023 Jan;13(1):e070253. https://doi.org/10.1136/bmjopen-2022-070253 PMID:36596634
17. Elgueta M, Astaburuga P, Clede L, Carmona J, Carrasco M, Figueroa C, Nicoletti M, Cortínez L, Ibacache M, Contreras V: Generación de un protocolo de acondicionamiento pre-quirúrgico oportuno para las personas mayores frágiles con el fin de reducir los días de hospitalización., XVII CONCURSO NACIONAL DE PROYECTOS DE INVESTIGACIÓN Y DESARROLLO EN SALUD FONIS 2020, 2020
18. Brogan S, Mandyam S, Odell D (Hemmings H, Egan T, editors). Nonopioid Analgesics., Pharmacology and Physiology for Anesthesia: Foundations and Clinical Application. 2nd ed. Elsevier; 2018.
19. Chou R, Gordon DB, de Leon-Casasola OA, Rosenberg JM, Bickler S, Brennan T, et al. Management of Postoperative Pain: A Clinical Practice Guideline From the American Pain Society, the American Society of Regional Anesthesia and Pain Medicine, and the American Society of Anesthesiologists’ Committee on Regional Anesthesia, Executive Committee, and Administrative Council. J Pain. 2016 Feb;17(2):131–57. https://doi.org/10.1016/j.jpain.2015.12.008 PMID:26827847
20. Ghai B, Jafra A, Bhatia N, Chanana N, Bansal D, Mehta V. Opioid sparing strategies for perioperative pain management other than regional anaesthesia: A narrative review. J Anaesthesiol Clin Pharmacol. 2022;38(1):3–10. https://doi.org/10.4103/joacp.JOACP_362_19 PMID:35706649
21. Mian P, Allegaert K, Spriet I, Tibboel D, Petrovic M. Paracetamol in Older People: Towards Evidence-Based Dosing? Drugs Aging. 2018 Jul;35(7):603–24. https://doi.org/10.1007/s40266-018-0559-x PMID:29916138
22. Barkin RL, Beckerman M, Blum SL, Clark FM, Koh EK, Wu DS. Should nonsteroidal anti-inflammatory drugs (NSAIDs) be prescribed to the older adult? Drugs Aging. 2010 Oct;27(10):775–89. https://doi.org/10.2165/11539430-000000000-00000 PMID:20883058
23. Ogura T, Egan T (Hemmings H, Egan T, editors). Nonopioid Analgesics., Pharmacology and Physiology for Anesthesia: Foundations and Clinical Application. 2nd ed. Elsevier; 2018. pp. 332–53.
24. Jassal M, Egan G, Dahri K. Opioid Prescribing in the Elderly: A Systematic Review. J Pharm Technol. 2020 Feb;36(1):28–40. https://doi.org/10.1177/8755122519867975 PMID:34752514
25. Hale M, Garofoli M, Raffa RB. Benefit-Risk Analysis of Buprenorphine for Pain Management. J Pain Res. 2021 May;14:1359–69. https://doi.org/10.2147/JPR.S305146 PMID:34079354
26. Prostran M, Vujović KS, Vučković S, Medić B, Srebro D, Divac N, et al. Pharmacotherapy of Pain in the Older Population: The Place of Opioids. Front Aging Neurosci. 2016 Jun;8:144. https://doi.org/10.3389/fnagi.2016.00144 PMID:27378916
27. Murphy GS, Szokol JW. Intraoperative Methadone in Surgical Patients: A Review of Clinical Investigations. Anesthesiology. 2019 Sep;131(3):678–92. https://doi.org/10.1097/ALN.0000000000002755 PMID:31094758
28. Taberna M, Villavicencio-Chávez C, González-Barboteo J. Uso de metadona en el anciano con dolor oncológico: una revisión sistemática [Use of methadone in the elderly with cancer pain: a systematic review]. Rev Esp Geriatr Gerontol. 2014;49(3):129–36. https://doi.org/10.1016/j.regg.2013.08.002 PMID:24457178
29. Musich S, Wang SS, Schaeffer JA, Slindee L, Kraemer S, Yeh CS. Safety Events Associated with Tramadol Use Among Older Adults with Osteoarthritis. Popul Health Manag. 2021 Feb;24(1):122–32. https://doi.org/10.1089/pop.2019.0220 PMID:32119805
30. Bosilkovska M, Walder B, Besson M, Daali Y, Desmeules J. Analgesics in patients with hepatic impairment: pharmacology and clinical implications. Drugs. 2012 Aug;72(12):1645–69. https://doi.org/10.2165/11635500-000000000-00000 PMID:22867045
31. Owsiany MT, Hawley CE, Triantafylidis LK, Paik JM. Opioid Management in Older Adults with Chronic Kidney Disease: A Review. Am J Med. 2019 Dec;132(12):1386–93. https://doi.org/10.1016/j.amjmed.2019.06.014 PMID:31295441
32. Polati E, Canonico PL, Schweiger V, Collino M. Tapentadol: an overview of the safety profile. J Pain Res. 2019 May;12:1569–76. https://doi.org/10.2147/JPR.S190154 PMID:31190968
33. Kern KU, Sohns M, Heckes B, Elling C. Tapentadol prolonged release for severe chronic osteoarthritis pain in the elderly: improvements in daily functioning and quality of life. Pain Manag. 2020 Mar;10(2):85–95. https://doi.org/10.2217/pmt-2019-0041 PMID:31973627
34. Motov S, Mann S, Drapkin J, Butt M, Likourezos A, Yetter E, et al. Intravenous subdissociative-dose ketamine versus morphine for acute geriatric pain in the Emergency Department: A randomized controlled trial. Am J Emerg Med. 2019 Feb;37(2):220–7. https://doi.org/10.1016/j.ajem.2018.05.030 PMID:29807629
35. Corcoran E, Kinirons B. Regional anaesthesia in the elderly patient a current perspective. Curr Opin Anaesthesiol. 2021 Feb;34(1):48–53. https://doi.org/10.1097/ACO.0000000000000940 PMID:33315640

 ORCID
ORCID