Julián Arias Grande1, Andrés Felipe Tejada Vergara1, Fredy Celis Luna1, Luis Bustamante Cristancho2
Recibido: 04-06-2024
Aceptado: 01-09-2024
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 6 pp. 644-654|https://doi.org/10.25237/revchilanestv53n6-14
PDF|ePub|RIS
Comparison of cardiac VTI and carotid flow by ultrasound to identify response to volume
Abstract
Background: In states of shock, it is essential to identify patients who respond to fluids and ultrasound has such utility; In this way, empirical administration of fluids is avoided. The passive lower limb elevation maneuver allows us to determine the potential for volume response, measuring cardiac VTI, but it can be difficult to perform due to inadequate ultrasound window. Simpler ultrasound tools are required, such as measurements of carotid flow by ultrasound, associated with the leg elevation test. Methods: Study of diagnostic tests comparing VTI and carotid flow velocity after passive lower limb elevation in 28 volunteers evaluated by an expert and by previously trained non-experts. We evaluated correlation and agreement of cardiac and carotid measurements. Results: 43% of participants were volume responders. The inter-observer agreement is good for the measurement of pre-leg raise carotid flow (expert Vs non-experts 0.76 and 0.709) and very good among non-experts (0.811). On the other hand, the post-leg raise agreement was moderate between non-experts Vs experts (0.592 and 0.586) and very good between nonexperts (0.868). The agreement was minimal in the definition of responder to carotid flow volume Vs cardiac VTI (0.1295, 0.1472 and -0.2143). Conclusions: There is little correlation between cardiac and carotid measurements, minimal correlation in volume responder with cardiac and carotid variables, as well as agreement between expert and trained non-experts, which calls into question the usefulness of carotid measurements for use during resuscitation with fluids.
Resumen
Antecedentes: En estado de choque es fundamental identificar pacientes respondedores a fluidos y la ecografía tiene tal utilidad, de esta manera se evita la administración empírica de fluidos. La maniobra de elevación pasiva de miembros inferiores permite determinar el potencial de respuesta a volumen, midiendo el VTI cardíaco, pero puede haber una inadecuada ventana ecográfica. Se requieren herramientas ecográficas más sencillas, como mediciones de flujo carotideo por ecografía, asociado a la prueba de elevación de piernas. Métodos: Estudio de pruebas diagnósticas comparando VTI y velocidad de flujo carotideo post-elevación pasiva de miembros inferiores en 28 voluntarios evaluados por experto y por no expertos previamente entrenados. Evaluamos correlación y concordancia de mediciones cardíacas y carotídeas. Resultados: 43% de los participantes fueron respondedores a volumen. La concordancia inter observador es buena para la medición del flujo carotídeo pre-elevación de piernas (experto vs no expertos 0,76 y 0,709) y muy buena entre los no expertos (0,811). En cambio, la concordancia post-elevación de piernas fue moderada entre no expertos vs experto (0,592 y 0,586) y muy buena entre los no expertos (0,868). La concordancia fue ínfima en la definición de respondedor a volumen por flujo carotídeo vs VTI cardíaco (0,1295, 0,1472 y -0,2143). Conclusiones: Hay poca correlación entre las mediciones cardíacas y carotídeas, ínfima correlación en respondedor a volumen con variables cardíacas y carotídeas, así como en la concordancia entre experto y no expertos entrenados, ello pone en duda la utilidad de las mediciones carotídeas para uso durante la reanimación con fluidos.
-
Introducción
Para el tratamiento de pacientes críticamente enfermos en el contexto de choque resulta apropiado la adecuada reanimación con fluidos ya que hasta en un tercio de los pacientes ingresados a la unidad de cuidados intensivos presentan algún tipo de choque, y por tanto, se vuelve importante contar con estrategias que permitan identificar los pacientes con condición de respondedor a volumen y así definirles manejo con fluidos entre otras estrategias[4].
El aporte de líquidos endovenosos para la optimización de los estados de choque puede ser la piedra angular en alguna parte de los casos, sin embargo, a pesar de contar con el argumento fisiológico para su administración, únicamente el 50% de los pacientes críticos, son realmente respondedores a volumen, concepto que se define como aumento del 10% al 15% del gasto cardíaco posterior a reto con fluidos[7],[8].
Lo anterior significa que una proporción de pacientes que recibe terapia hídrica con cristaloides quizá de manera innecesaria, aumentando así la morbilidad y la mortalidad[9],[10]. Por esta razón resulta fundamental utilizar métodos para identificar los pacientes respondedores a volumen a la cabecera del paciente, y de esta manera guiar así la terapia hídrica. Dado que los métodos, tradicionalmente, utilizados como la hipotensión, la oliguria o la presión venosa central resultan subóptimos para la determinación de potencial respondedores a volumen, se utiliza cada vez más variables hemodinámicas con diferentes tecnologías para identificarlos[11],[12].
Como guía de reanimación volumétrica se ha planteado una serie de parámetros, como las variables estáticas, presión venosa central (PVC) y presión de oclusión en la arteria pulmonar, sin embargo, estos tienen poca capacidad discriminative de potencial de respuesta a volumen[13],[14]. En los últimos años ha habido un incremento en el uso de variables dinámicas para estimar el cambio del gasto cardíaco en respuesta a un cambio en la precarga[15]. Para su utilización se requieren métodos no invasivos de monitoria como la ecografía o métodos tanto invasivos como, mínimamente, invasivos (monitores de gasto cardíaco)[16].
En el momento, no hay consenso sobre cual es el mejor método no invasivo, para la predicción de la capacidad de respuesta a líquidos. Sin embargo, la medición del flujo arterial, por medio de Doppler a nivel de arterias de gran calibre, como la carótida, aorta o la integral velocidad de tiempo (del inglés Velocity Time Integral: VTI) en el tracto de salida del ventrículo izquierdo (abreviado como TSVI) posterior a la maniobra de elevación de miembros inferiores, permite diferenciar el potencial de respuesta a volumen con una alta sensibilidad, especificidad y área bajo la curva (0,95) con un OR (Odds Ratio) de 88 [15],[17],[18],[19],[20],[21].
La base fisiológica de la elevación pasiva de piernas consiste en la “autoadministración” de volumen circulante, efectivo, presente en el sistema venoso a nivel de miembros inferiores (aproximadamente 150 a 300 ml)[22]. Lo anterior permite simular el aumento de la precarga como cuando se administra líquidos endovenosos, evitando usarlos y por tanto previniendo sus posibles efectos deletéreos en caso de que no los llegara a necesitar el paciente. Esta prueba, en conjunto con alguna herramienta de estimación del gasto cardíaco, permite identificar si el paciente se encuentra dependiente o independiente de
precarga según la curva de Frank Starling[23],[24].
El VTI medido en el tracto de salida del ventrículo izquierdo resulta ser de los mejores estimadores para evaluar respuesta a volumen en caso de identificar un aumento entre el 10% al 15% posterior a la elevación pasiva de piernas[25]. A pesar de esto, puede ser poco aplicable en servicios de urgencias o cuidado intensivo, dado que requiere experticia en ecografía y en una proporción de casos no se logra adecuada ventana ecográfica[2].
Por lo anterior se requiere de herramientas más sencillas para determinar respondedores a volumen como el flujo carotideo, con lo cual determinar un cambio del 20% posterior a la elevación pasiva de piernas es de utilidad[19]. Esta medición puede ser muy útil dado que la carótida es superficial, es técnicamente fácil de visualizar, se puede emplear al borde de la cama del paciente y puede realizarse por el personal médico a la cama del paciente y puede realizarse con la capacitación adecuada[26].
Hasta el momento, se ha hallado una correlación baja e incluso negativa entre el flujo carotideo y el índice cárdiaco en voluntarios sanos, también en pacientes críticamente enfermos post quirúrgicos[28]-[30]. Un estudio realizado, previamente, en voluntarios y pacientes de cirugía cardíaca demostró una mala correlación entre el gasto cardíaco y la velocidad del flujo carotideo. Con un tamaño de muestra pequeño, sin cálculo de muestra, lo cual afecta la extrapolación de los resultados por su pobre poder, desde el punto de vista estadístico. Dicho lo anterior, se requieren estudios más rigurosos desde el punto de vista metodológico para evaluar la correlación del VTI cardíaco y el Doppler carotideo para evaluar la respuesta a volumen[31].
En el presente estudio se evaluó la correlación entre VTI cardíaco y el flujo carotídeo posterior a la maniobra de elevación de miembros inferiores realizadas por personal experto y no experto entrenado en ecografía con el objetivo de identificar si utilizando el flujo carotídeo como sucedáneo a las mediciones cardíacas se puede obtener resultados de utilidad para la práctica clínica, puesto, es una técnica mucho más fácil de realizar y por tanto facilitaría la definición de los pacientes potenciales respondedores a volumen.
-
Métodos
Se realizó un estudio de pruebas diagnósticas en voluntarios sanos en Clínica Imbanaco y en el Hospital simulado de la Pontificia Universidad Javeriana, Cali, Se compararon métodos ecográficos (VTI, gasto cardíaco, volumen sistólico) versus flujo carotídeo, previo y posterior a maniobra de elevación pasiva de miembros inferiores por 2 minutos para así identificar el potencial de respuesta a volumen. De esta manera se evaluó la correlación y la concordancia entre variables medidas por experto y por no expertos entrenados en POCUS (point of care ultrasonography) cardiovascular. Los no expertos entrenados son residentes de medicina de urgencias de último año, quienes recibieron en total 50 h de teoría y 45 h de práctica en POCUS cardiovascular y hemodinámico, lo que es el estándar de entrenamiento para este tipo de POCUS en el posgrado de medicina de Urgencias de la Pontificia Universidad Javeriana y que supera de forma significativa el estándar sugerido en la literatura [2],[33],[34]; Adicionalmente, se ha realizado un perfeccionamiento de 4 h teórico-prácticas en Doppler carotídeo antes de iniciar la adquisiciones de imágenes en los pacientes del estudio.
Se incluyó voluntarios sanos del campus de la universidad y de la Clínica Imbanaco mediante convocatoria abierta. Dentro de los criterios de inclusión fueron voluntarios sanos mayores de 18 años. No se incluyeron voluntarios con espasticidad en miembros inferiores, con material ortopédico en piernas, con ausencia de extremidades inferiores o con mala ventana eco- gráfica, dado que la realización de la maniobra de elevación de piernas y su efecto hemodinámico podría verse limitada en estos casos[32].
Se realizó cálculo de muestra de esta fase piloto con un poder del 80%, confiabilidad de 0,60 mínima y esperada de 0,80, tasa de número de evaluadores sobre número de repeticiones por sujeto de 4, nivel de significancia 0,05 a dos colas, intervalo de confianza del 95% y tasa de abandono 10%. Con ello la muestra estimada fue de 28 pruebas.
Las mediciones, se realizaron con ecógrafo portátil marca Mindray Modelo M7 y Mindray Modelo Z6 y modelo Z60 equipados con un transductor lineal de alta frecuencia (5 a 10 MHz) para las mediciones carotídeas y transductor sectorial para las
mediciones cardíacas. La botonería y las aplicaciones son similares entre modelos de la marca del ecógrafo. La estandarización de mediciones se ha realizado al final de las adquisiciones en programa dedicado a imágenes OxiriS MD, donde el experto cuenta con licencia para su uso.
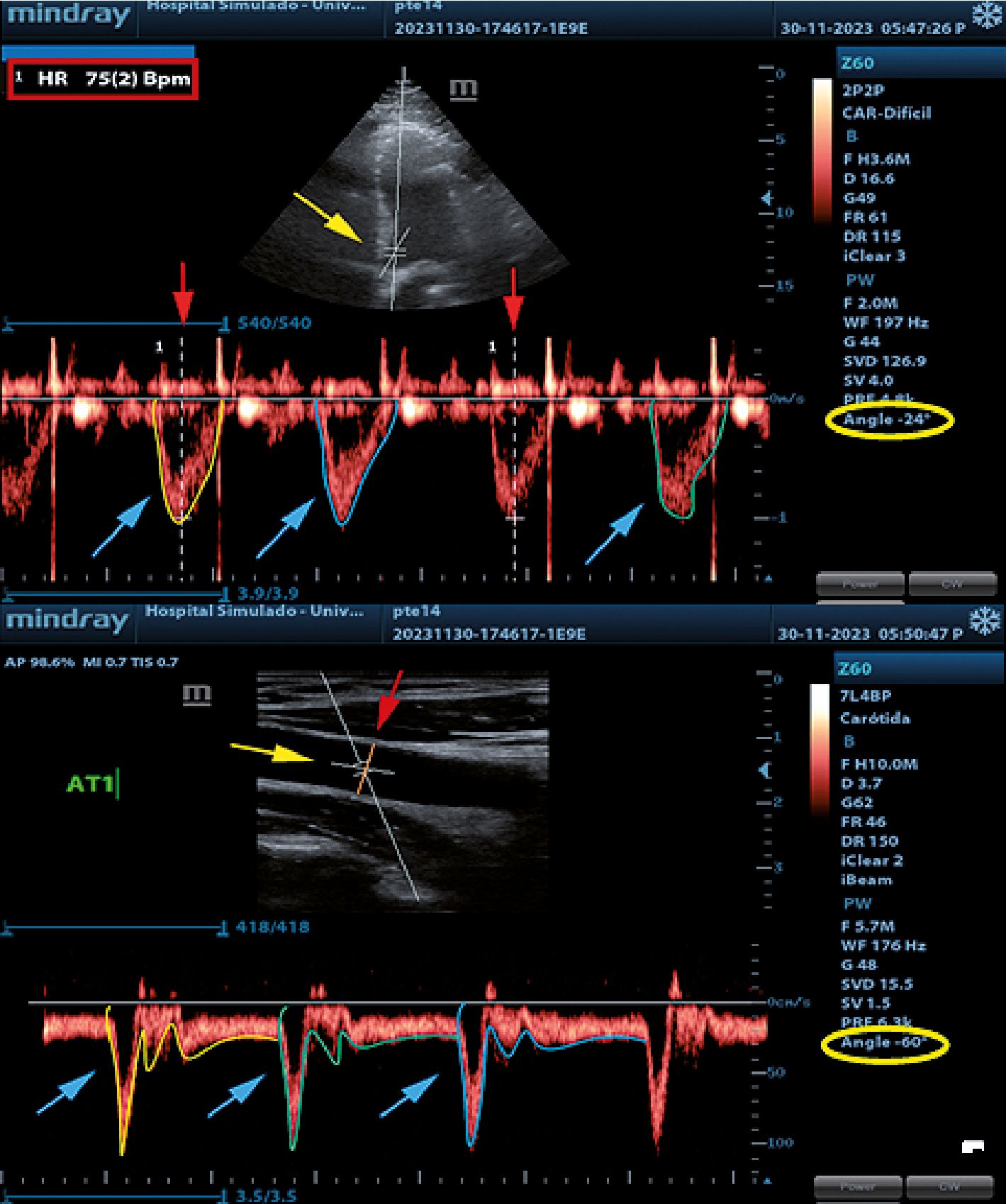
Figura 1. Medición gasto cardíaco y flujo carotídeo. Convenciones: A: Doppler pulsado realizado a nivel de tracto de salida del ventrículo izquierdo en ventana apical de 5 cámaras. Flecha amarilla muestra Doppler pulsado con ajuste de ángulo en tracto de salida del ventrículo izquierdo con ángulo final corregido menor de 60 grados (ovalo amarillo indicando -24 grados). Flechas rojas indican método para cálculo de la frecuencia cardiaca por método ecográfico (Rectángulo rojo indica valor de la frecuencia cardíaca). Flechas azules indican las mediciones de integral velocidad tiempo realizadas de las pulsaciones obtenidas en el tracto de salida del ventrículo izquierdo, tomándose 3 mediciones para el registro en la base de datos.
B: Doppler pulsado realizado a nivel de carótida derecha. Flecha amarilla muestra Doppler pulsado con ajuste de ángulo en carótida común derecha con ángulo final corregido máximo de 60 grados (ovalo amarillo indicando -60 grados). Flecha roja indica diámetro de la carótida común derecha medido de íntima a íntima. Flechas azules indican las mediciones de integral velocidad tiempo de las pulsaciones obtenidas en carótida común derecha, tomándose 3 mediciones para el registro en la base de datos.
-
Medidas ecográficas
En camilla, en posición semisentado a 45 grados y a cargo del experto, se realizó primeras mediciones en ventana paraesternal eje largo (medición del diámetro del tracto de salida del ventrículo izquierdo) y en ventana apical de 5 cámaras (VTI TSVI). Las mediciones del VTI fueron usando Doppler pulsado con ajuste de ángulo (siempre menor de 60 grados) y por triplicado, garantizando variabilidad entre las mediciones realizadas menor del 10%. Se computó para el análisis el valor promedio de los 3 VTI. Allí mismo, se calculó la frecuencia cardíaca para derivar las variables requeridas para el resto del análisis (se calculó el volumen sistólico, gasto cardíaco y si era respondedor o no respondedor con base en porcentaje de cambio de estas variables computadas con las mismas mediciones pos elevación de piernas) (Figura 1). Estas mediciones cardíacas se han hecho por parte del experto únicamente (referente estándar de oro para el estudio) pre y pos-elevación de piernas.
Adicionalmente, se realizó la medición del VTI (velocidad tiempo integral) con Doppler pulsado carotideo, utilizando la misma técnica y precauciones de medición que con el VTI a nivel cardíaco. Se volvió a medir frecuencia cardíaca y se realizó medición de diámetro de la carótida interna donde se estaba realizando la medición del flujo. Esta medición se realizó de intima a intima y a partir de estas variables se calculó el flujo carotídeo. Las mediciones carotídeas se han realizado pre y pos elevación de piernas por parte del experto y los no expertos entrenados.
Para el cálculo del gasto cardíaco por VTI [35],[36] y flujo carotídeo[37] pre y post elevación pasiva de piernas, se tuvo en cuenta las siguientes formulas: Tabla 1.
-
Maniobra de elevación pasiva de miembros inferiores
En posición semisentado, con la cabecera a 45 grados, se realizan las mediciones de DTSVI (diámetro del tracto de salida del ventrículo izquierdo), VTI (Velocidad tiempo integral) FC (Frecuencia cardíaca), DC (Diámetro carotídeo), FLC (Flujo caro- tídeo), (T0, T1, T2), por parte del experto y personal no experto, entrenado. Luego se realizó la elevación de miembros inferiores en un movimiento rápido y sincronizado se llevara la cabecera del paciente a 0° y se realizará la elevación de las piernas en ángulo de 45° con respecto a la camilla del paciente y se deja así durante 2 minutos (T3). Posteriormente, se descenderán las piernas sobre la camilla hasta lograr el decúbito supino, estando en esta posición se realizan, nuevamente, las mediciones mencionadas anteriormente (T4, T5), en un período máximo de 2 a 10 minutos[38]. En caso de no lograr la toma de mediciones en este período de tiempo la prueba se puede repetir en el mis
mo paciente posterior a un reposo de 30 minutos en posición semisentado.
Este proyecto fue sometido y aprobado por 2 comités de ética (el de la Pontificia Universidad Javeriana Cali y el de Clínica Imbanaco de Cali) puesto se realizó en conjunto entre ambas instituciones la adquisición de los voluntarios sanos.
-
Análisis estadístico
Las variables cuantitativas se resumieron con promedios con desviación estándar y las variables categóricas se presentaron en proporciones. Las variables cuantitativas se compararon con prueba t-student. Para medir la concordancia entre variables cardíacas y mediciones de las carótidas del experto mismo, del experto contra los no expertos entrenados y entre los no expertos entrenados se realizó “Concordance Correlation Coefficient” y la concordancia entre la evaluación del potencial de respuesta a volumen medido por variables cardíacas versus variables carotídeas entre experto y no expertos entrenados se realizó con “el coeficiente de kappa de Cohen”.
Todos los análisis se realizaron utilizando Stata versión 14 (StataCorp LP, College Station, TX).
Para el análisis de los datos se realizaron 12 pruebas de concordancia, aplicando coeficiente de correlación de concordancia o correlación kappa según cada tipo de variable, para las variables pre y post elevación pasiva de piernas.
Tabla 1. Variables

-
Resultados
En la Tabla 2, se resumen los datos obtenidos de los 28 voluntarios.
El porcentaje de respuesta a volumen según el cambio del gasto cardíaco mayor al 10% posterior a aplicación de elevación de piernas medido por el experto fue del 43%. La proporción de pacientes detectados como respondedores a volumen obtenido por el experto y calculado con volumen sistólico fue de 32% y por flujo carotídeo el 25%, sin embargo, la proporción de detectados respondedores de volumen por los no expertos entrenado 1 y 2 fue de 18% para ambos casos.
-
Evaluación de variables pre-elevación de pierna
En la evaluación de la concordancia de las mediciones realizadas pre elevación de piernas se evaluó la concordancia entre las mediciones del flujo carotídeo promedio pre elevación de piernas realizada por el experto versus el flujo carotídeo promedio pre elevación de piernas medida por el no experto 1, y el flujo carotídeo promedio pre elevación de piernas medida por el no experto 2, así como la concordancia entre las mediciones del flujo carotídeo promedio pre elevación de piernas entre los no expertos. Los resultados fueron 0,76 (IC 95% 0,599-0,921), 0,709 (IC 95% 0,526-0,893), 0,811 (IC 95% 0,682-0,94) respectivamente. Con base en ello, hay muy buena concordancia entre el flujo carotídeo medido por los no expertos y una buena concordancia entre las mediciones del flujo carotídeo del exper
to y los dos no expertos entrenados respectivamente, situación que conlleva a la definición de cómo, pese a tener un nivel de entrenamiento apropiado pero no siendo expertos, la concordancia es muy buena, sin embargo, la concordancia de esta condición versus el experto no es tan buena (Tabla 2).
En la evaluación de la correlación de las mediciones realizadas a nivel cardíaco (estándar de oro ecográfico) versus la medición del flujo carotídeo (prueba en estudio), ninguna de las mediciones realizadas por el experto (experto haciendo tanto el estándar de oro de medición cardíaca como la prueba de flujo carotídeo), así como tampoco, en las realizadas por el experto (experto realizando la prueba estándar de oro, ya fuera el volumen sistólico, el gasto cardíaco como el VTI en el TSVI) comparadas con los no expertos entrenados (no expertos entrenados realizando mediciones del flujo carotídeo) tuvo una correlación. El valor más alto de correlación lo obtuvo la medición del flujo carotídeo medido por el experto versus el gasto cardíaco medido por el experto (correlación 0,4678, valor p: 0,0121, lo cual le confiere una correlación pobre) (Tabla 3).
-
Evaluación de variables pos-elevación de pierna
Para el caso de las mediciones realizadas posterior a la elevación de piernas, el escenario cambia, específicamente en la evaluación de la concordancia entre la mediciones realizadas del flujo carotídeo promedio posterior elevación de piernas medidas por el experto versus las medidas por los no expertos entrenados 1 y 2 donde se identifica concordancia moderada (0,592 IC 95% 0,343-0,840 y 0,586 IC 95% 0,241-0,831 respectivamente) con una concordancia muy buena entre los no expertos entrenados (0,868 IC 95% 0,775-0,962), en base a ello se puede observar que persiste el mismo fenómeno sucedido en las evaluaciones pre elevación de piernas, pero con unos niveles de concordancia entre el experto y los no expertos en trenados, menor, pero manteniéndose la concordancia entre los no expertos entrenados.
Para las evaluaciones de correlación entre los estándares de oro ecográficos, medidos por el experto versus las mediciones de flujo carotídeo promedio pos-elevación de pierna del mismo experto y de los no expertos entrenados fue pobre. (Valor más alto de correlación 0,2512, valor P 0,1972, el cual corresponde a flujo carotídeo promedio pos-elevación de piernas de no experto entrenado 1 versus volumen sistólico medido por el experto) (Tabla 4).
Tabla 3. Pruebas pre-elevación pasiva de piernas
| Concordance | 95% CI | Correlación Kappa | Valor p | |
| correlation | Correlación | |||
| coefficient | ||||
| Experto vs Experto | – | – | 0,2007 | 0,3059 |
| Vn vs FLC experto vs No experto entrenado n°1 | – | – | 0,1371 | 0,4868 |
| Experto vs No experto entrenado n°2 | – | – | 0,0746 | 0,7059 |
| Experto vs Experto | – | – | 0,4678 | 0,0121 |
| GC vs FLC Experto vs No experto entrenado n°1 | – | – | 0,2965 | 0,1255 |
| Experto vs No experto entrenado n°2 | – | – | 0,2214 | 0,2576 |
| Experto vs Experto | – | – | 0,1727 | 0,3795 |
| VS vs FLC Experto vs No experto entrenado n°1 | – | – | 0,1145 | 0,5618 |
| Experto vs No experto entrenado n°2 | – | – | 0,0266 | 0,8932 |
| Experto vs No experto entrenado n°1 | 0,76 | 0,599 – 0,921 | – | – |
| FLC Experto vs No experto entrenado n°2 | 0,709 | 0,526 – 0,893 | – | – |
| No experto entrenado N°1 vs no experto entrenado n°2 | 0,811 | 0,682 – 0,94 | – | – |
Convenciones: VTI: velocidad tiempo integral; FLC: Flujo carotideo; GC: gasto cardíaco; VS: Volumen sistólico.
Tabla 4. Pruebas pos-elevación pasiva de piernas
| Concordance | 95% CI | Correlación | Valor p | ||
| correlation coefficient | Correlación | ||||
| VTI vs FLC | Experto vs Experto | – | – | 0,2203 | 0,2599 |
| Experto vs No experto entrenado n°1 | – | – | 0,1463 | 0,4576 | |
| Experto vs No experto entrenado n°2 | – | – | 0,1589 | 0,4194 | |
| GC vs FLC | Experto vs Experto | – | – | 0,1358 | 0,4908 |
| Experto vs No experto entrenado n°1 | – | – | 0,2767 | 0,154 | |
| Experto vs No experto entrenado n°2 | – | – | 0,1462 | 0,4578 | |
| VS vs FLC | Experto vs Experto | – | – | 0,1361 | 0,4898 |
| Experto vs No experto entrenado n°1 | – | – | 0,2512 | 0,1972 | |
| Experto vs No experto entrenado n°2 | – | – | 0,1171 | 0,5529 | |
| Experto vs No experto entrenado n°1 | 0,592 | 0,343 – 0,84 | – | – | |
| FLC | Experto vs No experto entrenado n°2 | 0,586 | 0,341 – 0,831 | – | – |
| No experto entrenado n°1 vs No experto entrenado n°2 | 0,868 | 0,775 – 0,962 | – | – | |
Convenciones: VTI: velocidad tiempo integral; FLC: Flujo carotídeo; GC: gasto cardíaco; VS: Volumen sistólico.
Entre las mediciones realizadas del flujo carotídeo que definía como respondedor los voluntarios (elevación del flujo ca- rotídeo mayor del 20% posterior a la elevación pasiva pierna), se realizó mediciones de concordancia versus la definición de los voluntarios que eran respondedores con base en los diferentes estándares de oro medidos por el experto (cambio del VTI mayor del 10% y cambio el flujo carotídeo mayor del 20% posterior a la elevación pasiva de piernas). En este ítem podemos identificar que la concordancia es baja entre la definición de respondedor a volumen por variables carotídeas de los no expertos entrenados versus las variables estándar de oro cardíacas y carotídea medida por el experto.
Por último, y como mecanismo para dar explicación a la escasa concordancia entre la respuesta a volumen definida por flujo carotídeo y la respuesta volumen definida por variables estándar de oro medidas a nivel cardíaco, se decide hacer una evaluación del rendimiento diagnóstico de lo estandarizado en la literatura médica vigente sobre la prueba de aumento del flujo carotídeo mayor del 20% posterior una elevación de piernas como prueba predictiva para discriminar los pacientes, potencialmente, respondedores o fluidos. Se encuentra un sensibilidad del 55,56%, especificidad 30%, valor predictivo positivo del 58,80%, valor predictivo negativo del 27,30%, AUC 0,4278, comparado con el gasto cardíaco (Tabla 5).
-
Discusión
En el presente estudio se encontró una proporción de respondedores a volumen del (43%) que, si bien está dentro de lo descrito en la literatura, cuando se mide por personal no experto entrenado (detectaron como respondedores el 18%), factible que se no logre identificar, apropiadamente, entre respondedor y no respondedor[39],[40],[41]. Hay que tener presente que este es un estudio realizado entre voluntarios sanos, con tono vascular preservado, sin vasodilatación ni criterios de choque, situación que pudiera indicarnos una respuesta completamente distinta en escenarios como los anteriormente descritos[42].
La correlación entre el VTI cardíaco y el flujo carotídeo para identificar respondedores a volumen fue baja entre las medidas del experto y las del personal no experto entrenado, por lo anterior, cabe la duda razonable de la posible limitante del flujo carotídeo como un subrogado del volumen sistólico, estimación del VTI, del VS y del GC puesto que parece que la pericia del que realiza la prueba de elevación de piernas impacta significativamente.
La concordancia entre los flujos carotídeos fue muy buena entre los no expertos entrenados en cuanto a variables pre y posterior a elevación pasiva de miembros inferiores, sin embargo, entre ellos y el experto fue pobre, lo cual puede sugerir necesidad de mayor entrenamiento entre el personal a capacitar, siendo claro que el tiempo de entrenamiento de los residentes ha favorecido el ejercicio de mayor tiempo en fase práctica y por tanto se irá ganando territorio con el uso de estas técnicas y herramientas[2],[26],[33].
Por otro lado, la correlación entre el gasto cardíaco y el flujo carotídeo fue moderada, previo a elevación pasiva de piernas, mientras que post prueba, fue incluso menor. Lo anterior demuestra una alta variabilidad de los datos, incluso en las medidas tomadas por el experto ya que, según los resultados, es limitada la utilidad del flujo carotídeo como subrogado del gasto cardíaco para identificar respuesta a volumen por el personal entrenado.
Los resultados, anteriormente mencionados, discrepan de estudios previamente realizados en pacientes en unidad de cuidados intensivos, post cirugía cardiovascular en donde encuentran una correlación entre el gasto cardíaco y el flujo carotideo aceptable[44],[45].
Finalmente, la capacidad de identificación de respondedores a volumen por flujo carotídeo, con las pruebas realizadas por el experto, tuvo una sensibilidad del 55,56%, especificidad del 30%, valor predictivo positivo del 20%, valor predictivo negativo del 58,8%, área bajo la curva de 0,4278. Lo cual difiere con los resultados, de estudios previos sobre la capacidad del flujo carotídeo para identificar respondedores a volumen[41]. Esto sugiere que la pobre correlación entre el gasto cardíaco y el flujo carotídeo para identificación de respuesta a volumen se debe a la pobre capacidad diagnóstica de la prueba en sí misma.
Dentro de las limitaciones del presente estudio se relaciona con la aplicación de dichas pruebas en personal voluntario, sanos, sin una evaluación objetiva del estado de hidratación de estos, lo cual puede explicar los resultados discrepantes entre el presente estudio y otros realizados en críticamente enfermos.
Adicionalmente, el estado de choque, presente en gran proporción, de los pacientes en la unidad de cuidados intensivos, podría generar una respuesta diferente al aplicar las pruebas en el presente estudio. Como fortaleza, el diseño metodológico utilizado permite responder a una pregunta claramente definida.
Según los resultados mencionados, el flujo carotídeo no debe ser una variable utilizada para la identificación de respuesta a volumen, comparada con el gasto cardíaco por VTI, por su baja correlación, incluso cuando hay experiencia en ultrasono- grafía en el paciente crítico.
Este estudio permite abrir la brecha del conocimiento sobre la aplicabilidad de otras medidas de respuesta a volumen a nivel carotídeo, como el tiempo de volumen carotídeo corregido o volumen sistólico[46] para identificar potencial de respuesta a volumen. Adicionalmente, según los resultados obtenidos, contrastados con la evidencia, se requiere de estudios en pacientes críticamente enfermos, para comparar los resultados obtenidos en voluntarios sanos, sin embargo, según los resultados mencionados, es necesario reevaluar el flujo carotideo como estrategia para definir los potenciales respondedores a fluidos.
-
Conclusiones
El flujo carotídeo comparado con las mediciones cardíacas para definir respuesta a volumen en la fase pre-elevación de piernas tiene buena concordancia entre no expertos entrenados y el experto, mientras que es muy buena entre los no expertos, y así mismo la correlación entre las mediciones carotídeas y cardíacas es pobre.
Para las fases pos-elevación de piernas el escenario empeora en cuanto a que entre los no expertos entrenados y el experto la concordancia es moderada, pero muy buena entre los no expertos entrenados. De igual manera, la correlación entre lo medido a nivel cardíaco y a nivel carotídeo es pobre, dado que la concordancia para la definición de paciente respondedor
y no respondedor entre las variables cardíacas y las variables carotídeas es ínfima y deja en duda la utilidad de las mediciones carotídeas como variable para ser utilizada como herramienta de definición de potencial de respuesta a volumen.
Tabla 5. Rendimiento diagnóstico de la respuesta a volumen medida por flujo carotídeo
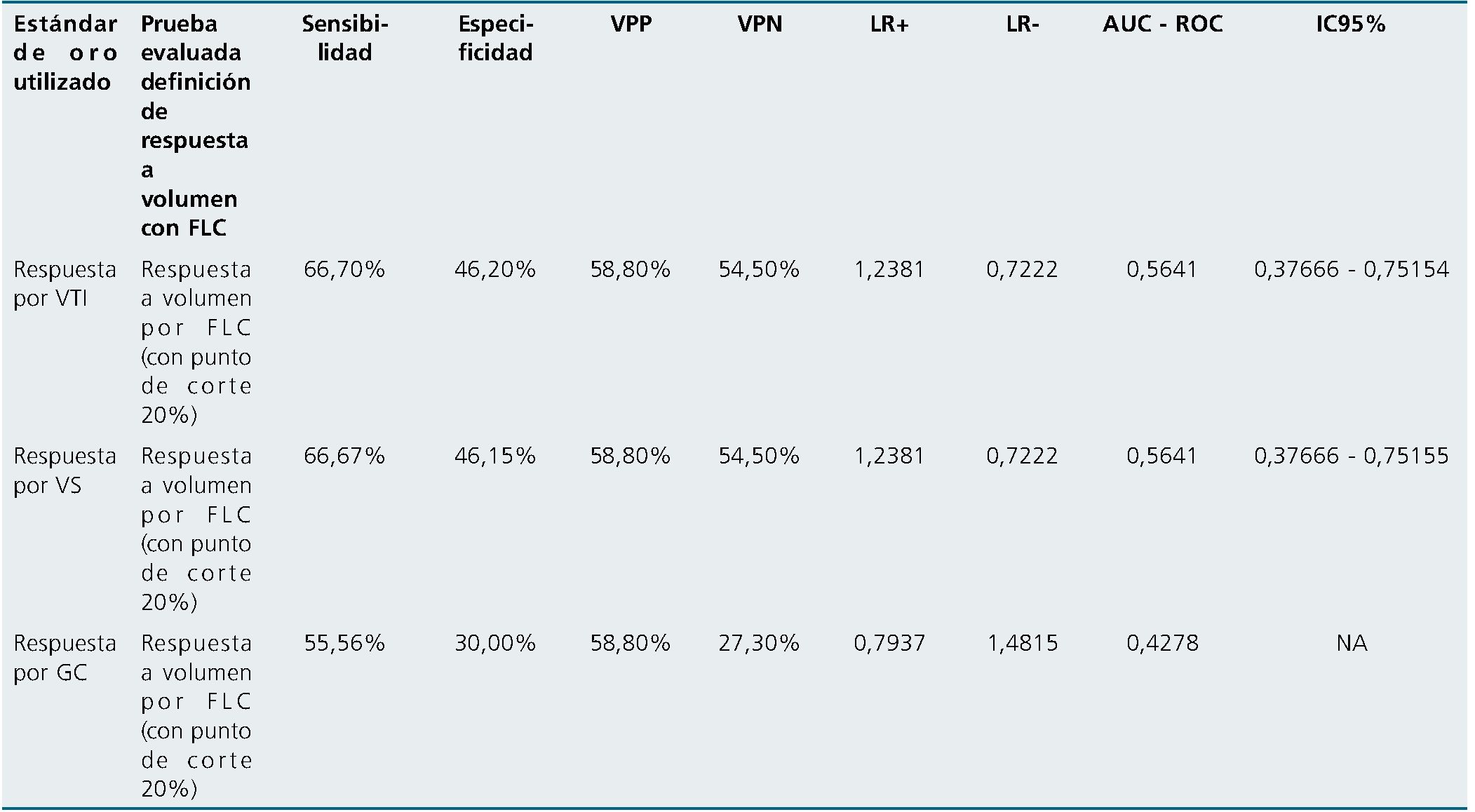
Convenciones: VTI: velocidad tiempo integral; FLC: Flujo carotídeo; GC: Gasto cardíaco; VS: Volumen sistólico; VPP: Valor predictivo positivo; VPN: Valor predictivo negativo; LR+: Likelihood ratio positivo; LR-: Likelihood ratio positivo; AUC ROC: del inglés área bajo la curva, curva ROC.
-
Referencias
1. Monnet X, Shi R, Teboul JL. Prediction of fluid responsiveness. What’s new? Ann Intensive Care. 2022 May;12(1):46. https://doi.org/10.1186/s13613-022-01022-8 PMID:35633423
2. Villavicencio C, Leache J, Marin J, Oliva I, Rodriguez A, Bodí M, et al. Basic critical care echocardiography training of intensivists allows reproducible and reliable measurements of cardiac output. Ultrasound J. 2019 Apr;11(1):5. https://doi.org/10.1186/s13089-019-0120-0 PMID:31359188
3. Arifin WN. Sample size calculator (web) [Internet]. 2023 [cited 16 November 2023]. Available from: http://wnarifin.github.io
4. Khorsand S, Helou MF, Satyapriya V, Kopanczyk R, Khanna AK. Not all Shock States Are Created Equal: A Review of the Diagnosis and Management of Septic, Hypovolemic, Cardiogenic, Obstructive, and Distributive Shock. Anesthesiol Clin. 2023 Mar;41(1):1–25. https://doi.org/10.1016/j.anclin.2022.11.002 PMID:36871993
5. Guérin L, Teboul JL, Persichini R, Dres M, Richard C, Monnet X. Effects of passive leg raising and volume expansion on mean systemic pressure and venous return in shock in humans. Crit Care. 2015 Nov;19(1):411. https://doi.org/10.1186/s13054-015-1115-2 PMID:26597901
6. Guyton AC. Determination of cardiac output by equating venous return curves with cardiac response curves. Physiol Rev. 1955 Jan;35(1):123–9. https://doi.org/10.1152/physrev.1955.35.1.123 PMID:14356924
7. Michard F, Teboul JL. Predicting fluid responsiveness in ICU patients: a critical analysis of the evidence. Chest. 2002 Jun;121(6):2000–8. https://doi.org/10.1378/chest.121.6.2000 PMID:12065368
8. Horejsek J, Kunstyr J, Michalek P, Porizka M. Novel Methods for Predicting Fluid Responsiveness in Critically Ill Patients-A Narrative Review. Diagnostics (Basel). 2022 Feb;12(2):513. https://doi.org/10.3390/diagnostics12020513 PMID:35204603
9. O’Connor ME, Prowle JR. Fluid Overload. Crit Care Clin. 2015 Oct;31(4):803–21. https://doi.org/10.1016/j.ccc.2015.06.013 PMID:26410146
10. Li D, Wang X, Liu D. Li D kai, Wang X ting, Liu D wei. Association between elevated central venous pressure and outcomes in critically ill patients. Ann Intensive Care. 2017;7(1):83. https://doi.org/10.1186/s13613-017-0306-1.
11. Ait-Hamou Z, Teboul JL, Anguel N, Monnet X. How to detect a positive response to a fluid bolus when cardiac output is not measured? Ann Intensive Care. 2019 Dec;9(1):138. https://doi.org/10.1186/s13613-019-0612-x PMID:31845003
12. Saugel B, Kirsche SV, Hapfelmeier A, Phillip V, Schultheiss C, Schmid RM, et al. Prediction of fluid responsiveness in patients admitted to the medical intensive care unit. J Crit Care. 2013 Aug;28(4):537.e1–9. https://doi.org/10.1016/j.jcrc.2012.10.008 PMID:23142517
13. Manuel E, Ivers R, Guyen RN, Uzanne S, Avstad H, Ulie J, et al. The New Eng land Jour nal of Medicine EARLY GOAL-DIRECTED THERAPY IN THE TREATMENT OF SEVERE SEPSIS AND SEPTIC SHOCK A BSTRACT. Volume 345. 2001.
14. Evans D, Ferraioli G, Snellings J, Levitov A. Volume responsiveness in critically III patients. J Ultrasound Med. 2014;33(1):3–7. https://doi.org/10.7863/ultra.33.1.3 PMID:24371093
15. Bentzer P, Griesdale DE, Boyd J, MacLean K, Sirounis D, Ayas NT. Will This Hemodynamically Unstable Patient Respond to a Bolus of Intravenous Fluids? JAMA. 2016 Sep;316(12):1298–309. https://doi.org/10.1001/jama.2016.12310 PMID:27673307
16. Feissel M, Michard F, Mangin I, Ruyer O, Faller JP, Teboul JL. Respiratory changes in aortic blood velocity as an indicator of fluid responsiveness in ventilated patients with septic shock. Chest. 2001 Mar;119(3):867–73. https://doi.org/10.1378/chest.119.3.867 PMID:11243970
17. Dark PM, Singer M. The validity of trans-esophageal Doppler ultrasonography as a measure of cardiac output in critically ill adults. Intensive Care Med. 2004 Nov;30(11):2060–6. https://doi.org/10.1007/s00134-004-2430-2 PMID:15368037
18. Monnet X, Marik P, Teboul JL. Passive leg raising for predicting fluid responsiveness: a systematic review and meta-analysis. Intensive Care Med. 2016 Dec;42(12):1935–47. https://doi.org/10.1007/s00134-015-4134-1 PMID:26825952
19. Marik PE, Levitov A, Young A, Andrews L. The use of bioreactance and carotid Doppler to determine volume responsiveness and blood flow redistribution following passive leg raising in hemodynamically unstable patients. Chest. 2013 Feb;143(2):364–70. https://doi.org/10.1378/chest.12-1274 PMID:22910834
20. Cherpanath TG, Hirsch A, Geerts BF, Lagrand WK, Leeflang MM, Schultz MJ, et al. Predicting fluid responsiveness by passive leg raising: A systematic review and meta-analysis of 23 clinical trials. Crit Care Med. 2016 May;44(5):981–91. https://doi.org/10.1097/CCM.0000000000001556 PMID:26741579
21. Monnet X, Rienzo M, Osman D, Anguel N, Richard C, Pinsky MR, et al. Passive leg raising predicts fluid responsiveness in the critically ill. Crit Care Med. 2006 May;34(5):1402–7. https://doi.org/10.1097/01.CCM.0000215453.11735.06 PMID:16540963
22. Aneman A, Sondergaard S. Understanding the passive leg raising test. Intensive Care Med. 2016 Sep;42(9):1493–5. https://doi.org/10.1007/s00134-016-4228-4 PMID:26846515
23. Mesquida J, Gruartmoner G, Ferrer R. Passive leg raising for assessment of volume responsiveness: a review. Curr Opin Crit Care. 2017 Jun;23(3):237–43. https://doi.org/10.1097/MCC.0000000000000404 PMID:28323719
24. Patterson SW, Memorial B, Fellow R, Starling EH. ON THE MECHANICAL FACTORS WHICH DETER-MINE THE OUTPUT OF THE VENTRICLES. BY. n.d.
25. Bentzer P, Griesdale DE, Boyd J, MacLean K, Sirounis D, Ayas NT. Will this hemodynamically unstable patient respond to a bolus of intravenous fluids? JAMA. 2016 Sep;316(12):1298–309. https://doi.org/10.1001/jama.2016.12310 PMID:27673307
26. Stolz LA, Mosier JM, Gross AM, Douglas MJ, Blaivas M, Adhikari S. Can emergency physicians perform common carotid Doppler flow measurements to assess volume responsiveness? West J Emerg Med. 2015 Mar;16(2):255–9. https://doi.org/10.5811/westjem.2015.1.24301 PMID:25834666
27. Cheong I, Otero Castro V, Sosa FA, Tort Oribe B, Früchtenicht MF, Tamagnone FM, et al. Passive leg raising test using the carotid flow velocity–time integral to predict fluid responsiveness. J Ultrasound. 2023;27(1):97–104. https://doi.org/10.1007/s40477-023-00824-1 PMID:37668901
28. Selvam V, Srinivasan S. Doppler-estimated Carotid and Brachial Artery Flow as Surrogate for Cardiac Output: Needs Further Validation. Indian J Crit Care Med. 2022 Feb;26(2):159–60. https://doi.org/10.5005/jp-journals-10071-24108 PMID:35712735
29. Weber U, Glassford NJ, Eastwood GM, Bellomo R, Hilton AK. A Pilot Assessment of Carotid and Brachial Artery Blood Flow Estimation Using Ultrasound Doppler in Cardiac Surgery Patients. J Cardiothorac Vasc Anesth. 2016 Jan;30(1):141–8. https://doi.org/10.1053/j.jvca.2015.06.025 PMID:26411812
30. Weber U, Glassford NJ, Eastwood GM, Bellomo R, Hilton AK. A pilot study of the relationship between Doppler-estimated carotid and brachial artery flow and cardiac index. Anaesthesia. 2015 Oct;70(10):1140–7. https://doi.org/10.1111/anae.13069 PMID:26010229
31. Weber U, Glassford NJ, Eastwood GM, Bellomo R, Hilton AK. A Pilot Assessment of Carotid and Brachial Artery Blood Flow Estimation Using Ultrasound Doppler in Cardiac Surgery Patients. J Cardiothorac Vasc Anesth. 2016 Jan;30(1):141–8. https://doi.org/10.1053/j.jvca.2015.06.025 PMID:26411812
32. Mesquida J, Gruartmoner G, Ferrer R. Passive leg raising for assessment of volume responsiveness: a review. Curr Opin Crit Care. 2017 Jun;23(3):237–43. https://doi.org/10.1097/MCC.0000000000000404 PMID:28323719
33. Moore CL, Rose GA, Tayal VS, Sullivan DM, Arrowood JA, Kline JA. Determination of left ventricular function by emergency physician echocardiography of hypotensive patients. Acad Emerg Med. 2002 Mar;9(3):186–93. https://doi.org/10.1197/aemj.9.3.186 PMID:11874773
34. Dinh VA, Ko HS, Rao R, Bansal RC, Smith DD, Kim TE, et al. Measuring cardiac index with a focused cardiac ultrasound examination in the ED. Am J Emerg Med. 2012 Nov;30(9):1845–51. https://doi.org/10.1016/j.ajem.2012.03.025 PMID:22795411
35. Blanco P. Rationale for using the velocity-time integral and the minute distance for assessing the stroke volume and cardiac output in point-of-care settings. Ultrasound J. 2020 Apr;12(1):21. https://doi.org/10.1186/s13089-020-00170-x PMID:32318842
36. Jabot J, Teboul JL, Richard C, Monnet X. Passive leg raising for predicting fluid responsiveness: importance of the postural change. Intensive Care Med. 2009 Jan;35(1):85–90. https://doi.org/10.1007/s00134-008-1293-3 PMID:18795254
37. Marik PE, Levitov A, Young A, Andrews L. The use of bioreactance and carotid Doppler to determine volume responsiveness and blood flow redistribution following passive leg raising in hemodynamically unstable patients. Chest. 2013 Feb;143(2):364–70. https://doi.org/10.1378/chest.12-1274 PMID:22910834
38. Geerts BF, van den Bergh L, Stijnen T, Aarts LP, Jansen JR. Comprehensive review: is it better to use the Trendelenburg position or passive leg raising for the initial treatment of hypovolemia? J Clin Anesth. 2012 Dec;24(8):668–74. https://doi.org/10.1016/j.jclinane.2012.06.003 PMID:23228872
39. Osman D, Ridel C, Ray P, Monnet X, Anguel N, Richard C, et al. Cardiac filling pressures are not appropriate to predict hemodynamic response to volume challenge. Crit Care Med. 2007 Jan;35(1):64–8. https://doi.org/10.1097/01.CCM.0000249851.94101.4F PMID:17080001
40. Marik PE, Baram M, Vahid B. Does central venous pressure predict fluid responsiveness? A systematic review of the literature and the tale of seven mares. Chest. 2008 Jul;134(1):172–8. https://doi.org/10.1378/chest.07-2331 PMID:18628220
41. Marik PE, Levitov A, Young A, Andrews L. The use of bioreactance and carotid Doppler to determine volume responsiveness and blood flow redistribution following passive leg raising in hemodynamically unstable patients. Chest. 2013 Feb;143(2):364–70. https://doi.org/10.1378/chest.12-1274 PMID:22910834
42. Evans D, Ferraioli G, Snellings J, Levitov A. Volume responsiveness in critically ill patients: use of sonography to guide management. J Ultrasound Med. 2014 Jan;33(1):3–7. https://doi.org/10.7863/ultra.33.1.3 PMID:24371093
43. Joshi M, Dhakane P, Bhosale SJ, Phulambrikar R, Kulkarni AP. Correlation between Carotid and Brachial Artery Velocity Time Integral and Their Comparison to Pulse Pressure Variation and Stroke Volume Variation for Assessing Fluid Responsiveness. Indian J Crit Care Med. 2022 Feb;26(2):179–84. https://doi.org/10.5005/jp-journals-10071-24115 PMID:35712738
44. Ma IW, Caplin JD, Azad A, Wilson C, Fifer MA, Bagchi A, et al. Correlation of carotid blood flow and corrected carotid flow time with invasive cardiac output measurements. Crit Ultrasound J. 2017 Dec;9(1):10. https://doi.org/10.1186/s13089-017-0065-0 PMID:28429291
45. Roehrig C, Govier M, Robinson J, Aneman A. Carotid Doppler flowmetry correlates poorly with thermodilution cardiac output following cardiac surgery. Acta Anaesthesiol Scand. 2017 Jan;61(1):31–8. https://doi.org/10.1111/aas.12822 PMID:27766613
46. Blehar DJ, Glazier S, Gaspari RJ. Correlation of corrected flow time in the carotid artery with changes in intravascular volume status. J Crit Care. 2014 Aug;29(4):486–8. https://doi.org/10.1016/j.jcrc.2014.03.025 PMID:24930363

 ORCID
ORCID