Marco Antonio Morales Osorio1,*, Alvaro Aguilera2, Luciano López2, Luis Pereira2, Lia Carolina Payares Meza3, Johana Mejía Mejía4
Recibido: 22-12-2023
Aceptado: 23-02-2024
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 1 pp. 27-37|https://doi.org/10.25237/revchilanestv54n1-03
PDF|ePub|RIS
COVID-19: A systematic review and meta-analysis
Abstract
Introduction: To better understand the risk factors associated with the severity of COVID-19, we sought to analyze the relationship between hypertension (HTN) and mortality and the need for admission to the intensive care unit (ICU) in patients with COVID-19. Methods: Databases such as Medline, Embase, CINAHL PLUS with full text, Cochrane Library Trials, Web of Science, and Scopus were consulted. Using the PRISMA-S diagram, studies were organized and tracked. Two reviewers, following PECOS criteria, evaluated and selected titles, abstracts, and full texts. Results: Out of 28 studies (n = 23,696), hypertensive patients had survival rates of 35.59%-97.47% while non-hypertensive patients had rates of 56.85%-98.34%. Hypertension was significantly associated with COVID-19 mortality (RR = 3.97, p < 0.01) and a higher need for ICU admission (14.9% vs 0.7%). Conclusions: The results indicate that HTN is a decisive factor in the progression of COVID-19 and the need for ICU admission.
Resumen
Introducción: Con el propósito de entender mejor los factores de riesgo asociados con la gravedad del COVID-19, buscamos analizar la asociación de la hipertensión arterial (HTA) en la mortalidad y requerimiento de ingreso a la unidad de cuidados intensivos (UCI) de los pacientes con COVID-19. Métodos: Se consultaron bases de datos como Medline, Embase, CINAHL PLUS con texto completo, Cochrane Library Trials, Web of Science y Scopus. Usando el diagrama PRISMA-S, se organizó y rastreó los estudios. Dos revisores, con criterios PECOS, evaluaron y seleccionaron títulos, resúmenes y textos completos. Resultados: De 28 estudios (n = 23.696), los hipertensos tenían tasas de supervivencia de 35,59%-97,47% mientras que los no hipertensos, de 56,85%-98,34%. La HTA se asoció significativamente a la mortalidad por COVID-19 (RR = 3,97, p < 0,01) y a un mayor requerimiento de ingreso a UCI (14,9% vs 0,7%). Conclusiones: Los resultados evidencian que la HTA es un factor determinante en la evolución del COVID-19 y en la necesidad de ingreso a la UCI.
-
Introducción
Desde su surgimiento en 2019, la pandemia de COVID-19 ha presentado un desafío sin precedentes para la salud global, con más de 630 millones de casos confirmados y más de 6,6 millones de muertes reportadas en todo el mundo[1].
Una de estas variables clave es la hipertensión arterial (HTA), una condición que afecta de manera desigual a hombres y mujeres en todo el mundo, con tasas de tratamiento y control más bajas en hombres (18%) en comparación con mujeres (23%) [2]-[4].
Recientes investigaciones han sugerido una posible asociación entre la HTA y un incremento en el riesgo de infección por SARS-CoV-2, así como con un pronóstico más grave en pacientes con COVID-19[5]-[8]. Sin embargo, la interpretación de esta relación es compleja, ya que la HTA a menudo coexiste con otros factores de riesgo cardiovascular y con la edad avanzada, lo que puede confundir o amplificar su impacto en los resultados relacionados con COVID-19[9]-[11].
Ante este escenario, el objetivo primario de la presente revisión sistemática y metaanálisis es analizar la asociación de la HTA en la mortalidad y requerimiento de ingreso a la UCI de los pacientes con COVID-19.
-
Método
Este metaanálisis se diseñó y ejecutó siguiendo rigurosamente las directrices de la lista de verificación Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA-S)[12],[13] y se registró en la plataforma PROSPERO (CRD42020179861). Adicionalmente, se adhirieron a las pautas de Meta-analysis Of Observational Studies in Epidemiology (MOOSE)[14].
-
Selección de la literatura y extracción de datos
La selección de literatura y la extracción de datos fueron realizadas de forma independiente por dos autores (MM y JM), con discrepancias resueltas mediante consulta con un tercer investigador (LO) para garantizar objetividad y consistencia en la selección.
-
Estrategia de búsqueda y filtrado de datos
Se implementó una estrategia de búsqueda comprensiva, incluyendo términos relevantes extraídos de dos revisiones sistemáticas previas[15],[16]. Los términos de búsqueda incluyeron ‘coronavirus disease 2019’, ‘COVID-19’, ‘SARS-CoV-2’, ‘coronavirus’, ‘nCoV-2019’, ‘hypertension’, ‘risk factor’, ‘characteristics’, y ‘clinical features’. No se aplicaron restricciones de fecha, idioma o estado de publicación. La última búsqueda se realizó el 1 de agosto de 2023 en bases de datos como Medline, Embase, CINAHL PLUS con texto completo, Cochrane Library Trials, Web of Science y Scopus (MM y JM).
-
Selección de la información
Los resultados de la búsqueda se organizaron inicialmente en una base de datos ENDNOTE y posteriormente, se importaron a Covidence (www.covidence.org), facilitando así el proceso de selección y revisión. Se empleó el diagrama de flujo PRISMA-S[17] para monitorear y registrar el progreso en la selección y exclusión de estudios. La revisión de títulos, resúmenes y textos completos fue llevada a cabo por dos revisores independientes (AA, LL), utilizando los criterios PECOS detallados en el Material Suplementario. Se excluyeron artículos de revistas depredadoras identificadas mediante la lista Beall’s[18], así como comentarios, cartas al editor, ponencias en congresos, capítulos de libros, registros de protocolos y resúmenes sin texto completo[19].
-
Extracción, síntesis de datos y análisis de subgrupos
Se llevó a cabo un análisis temático detallado de los hallazgos cualitativos, complementado con un análisis de contenido riguroso de los datos cuantitativos. Esto permitió obtener medidas resumidas y comparativas de las variables relevantes. Los hallazgos cualitativos se resumieron descriptivamente y se apoyaron con citas textuales directas para fortalecer las afirmaciones. Los datos cuantitativos fueron sometidos a análisis estadísticos meticulosos.
La síntesis de los datos se presentó de manera sistemática, empleando un enfoque transparente y metódico en su interpretación. Se utilizaron métodos de síntesis de datos rigurosos y bien fundamentados para lograr una comprensión integral de la evidencia disponible en relación con los objetivos específicos de esta revisión.
-
Evaluación de la calidad de los estudios
En nuestra metodología, utilizamos el Índice Metodológico para Estudios No Aleatorizados (MINORS)[20] para evaluar rigurosamente la calidad de los estudios incluidos. Dos revisores independientes (TO, MMO) evaluaron cada estudio siguiendo criterios específicos, como claridad de objetivos y adecuación en la selección de pacientes. En casos de discrepancias, se alcanzó un consenso mediante discusiones detalladas, asegurando una valoración justa y uniforme. Esta evaluación crítica nos permitió identificar posibles sesgos y su influencia potencial en nuestros resultados. Los detalles sobre las puntuaciones de calidad y su impacto en nuestro análisis se detallan en el material suplementario. Este procedimiento meticuloso refuerza la validez, transparencia y rigor de nuestra revisión sistemática y metaanálisis.
-
Análisis de datos y estadísticas
Para el metaanálisis de proporciones, se utilizó R versión 4.1.0 (R Foundation for Statistical Computing). El análisis se centró en dos objetivos primordiales: examinar la asociación entre la hipertensión arterial (HTA) y el riesgo de mortalidad en pacientes con COVID-19, y evaluar la asociación entre la HTA y la necesidad de ingreso a unidades de cuidados intensivos (UCI). Se aplicó un estimador transversal para el resultado principal esperado, estableciendo un nivel de significancia a de 0,05. Para abordar la heterogeneidad entre los estudios, se utilizó la función meta::metaprop[21]. Esta función permitió agrupar proporciones de mortalidad y necesidad de ingreso a UCI, ajustando por el tamaño de muestra a través de un
modelo de máxima verosimilitud restringida de efectos aleatorios (REML)[22],[23]. En situaciones donde los estudios reportaron múltiples proporciones, se seleccionó la proporción más alta para prevenir duplicaciones y sesgos en el tamaño del efecto.
La asociación entre la HTA y los resultados en pacientes con COVID-19 se evaluó utilizando la razón de probabilidades (OR) y los intervalos de confianza del 95% como medidas estándar de asociación. La heterogeneidad se cuantificó mediante el estadístico Q y el valor de I2, considerando significativa cualquier heterogeneidad con un valor de P en la prueba Q menor a 0,10. La heterogeneidad se clasificó en ausente (I2 del 25%), pequeña (25-50%), moderada (50-75%) y significativa (mayor al 75%).
Se llevaron a cabo análisis de riesgo relativo (RR) agrupadas, utilizando un modelo de efectos fijos para valores de I2 inferiores al 50% y un modelo de efectos aleatorios para valores superiores. Adicionalmente, se realizaron análisis de metarre- gresión para investigar el impacto de variables confusoras o modificadoras, como la edad y el sexo. Los diagramas de bosque se generaron para visualizar los resultados de cada análisis primario, y para evaluar la presencia de sesgo de publicación, se utilizaron gráficos de embudo y la prueba de regresión lineal de Egger.
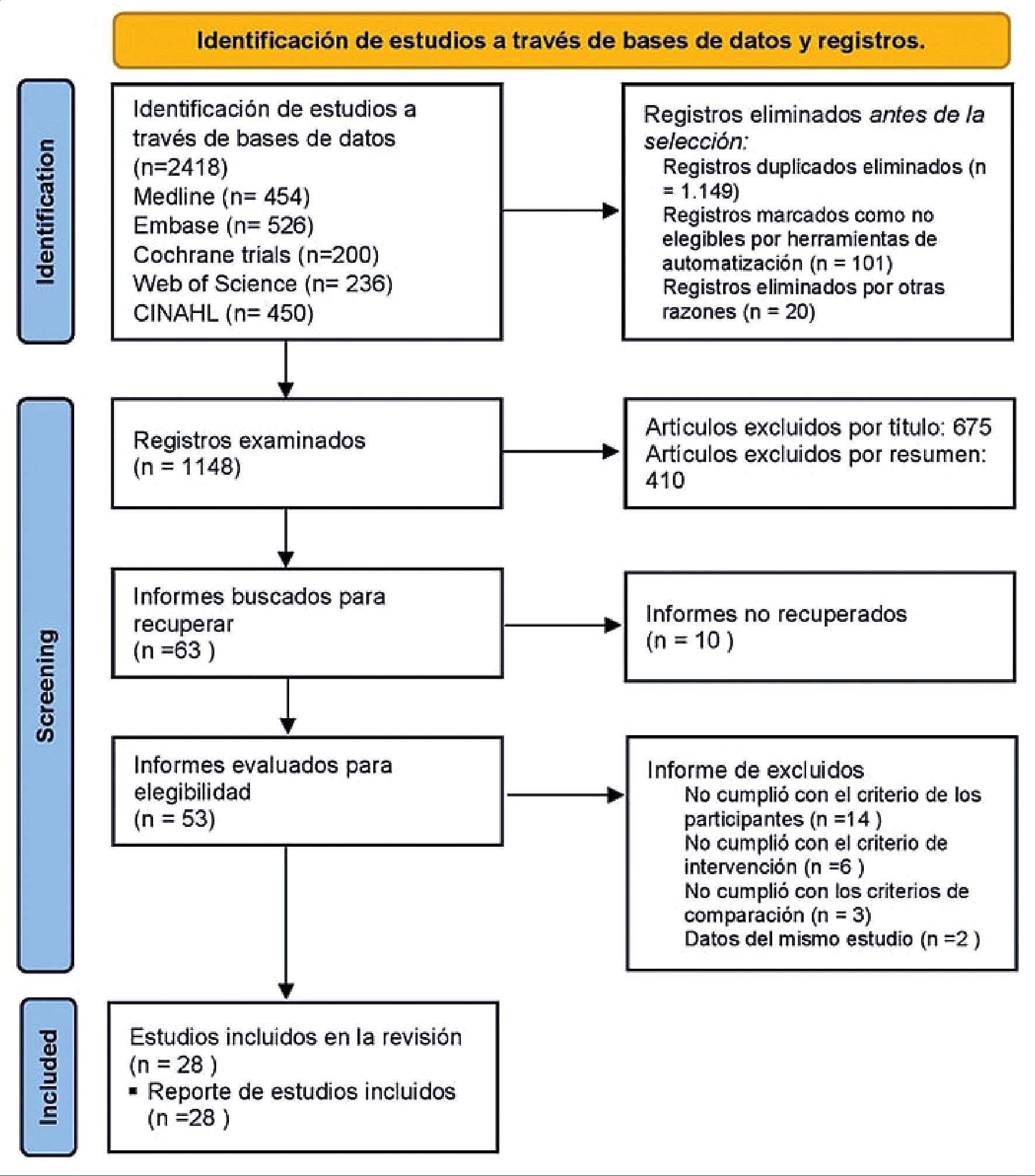
Figura 1. Diagrama de flujo para la identificación de estudios para su inclusión en el metaanálisis.
Tabla 1 Descripción de las características de los estudios incluidos con relación a la hipertensión arterial y la mortalidad en pacientes con COVID-19
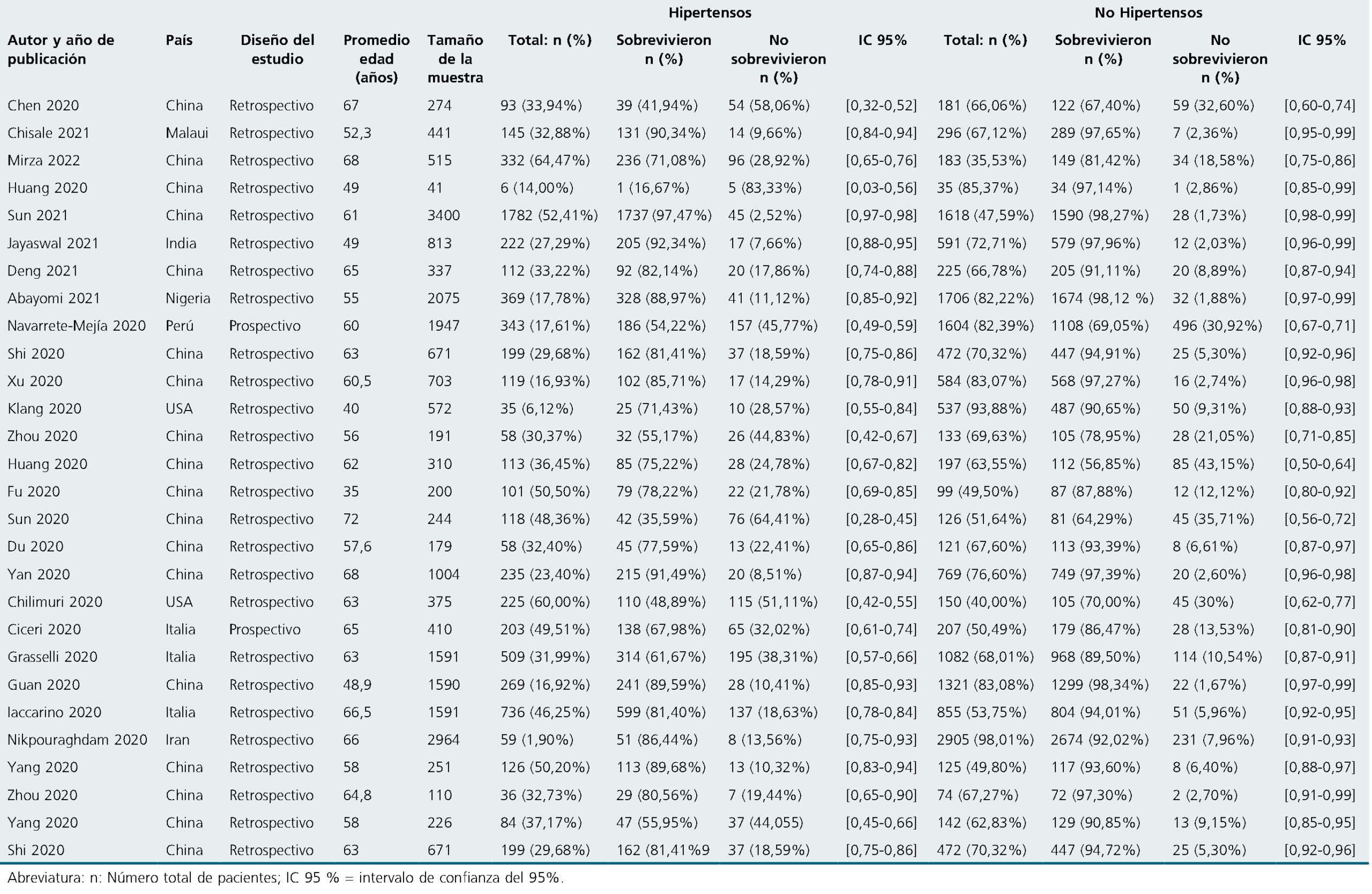
-
Resultados
Se identificaron 2.418 artículos en la búsqueda inicial realizada en diversas bases de datos. De estos, tras un proceso de selección y una revisión exhaustiva del texto completo, 28 estudios cumplieron con los criterios específicos de inclusión para este análisis[5],[24]-[50]. Las razones detalladas para la exclusión de los estudios se pueden consultar en el diagrama de flujo PRISMA-S proporcionado (Figura 1) y están disponibles bajo solicitud. A través del seguimiento de los estudios incluidos y la búsqueda manual en Scopus, no se identificaron estudios adicionales. Por lo tanto, se incluyeron 28 estudios en la síntesis narrativa, abarcando un total de 23.696 sujetos, de los cuales 6.886 eran pacientes con HTA.
-
Características de los estudios
Las características, resultados y conclusiones de los 28 estudios seleccionados se detallan en la Tabla 1. Por su parte, la Tabla 2 presenta las características específicas de los estudios que abordaron el requerimiento de ingreso a UCI. De los estudios incluidos, 28 investigaron la relación entre la HTA y la mortalidad por COVID-19, mientras que solo 7 estudios examinaron la asociación entre HTA y la gravedad de la infección por COVID-19, reflejada en la necesidad de ingreso a UCI[24],[29],[43],[44],[47]-[49]. Los pacientes con HTA tenían edades comprendidas entre 35 y 72 años, con un promedio de 60,9 años (DE = 8,60). Se observó una notable variabilidad en los resultados clínicos de estos pacientes, con tasas de supervivencia que variaron del 35,59% al 97,47%. En contraste, la tasa de supervivencia de los pacientes sin HTA fue consistentemente más alta, oscilando entre el 56,85% y el 98,34%, lo que sugiere un posible efecto protector de la ausencia de HTA. Además, se notó una mayor necesidad de ingreso a UCI en pacientes con HTA (14,9%) en comparación con aquellos sin HTA (0,7%). Sin embargo, no se encontraron diferencias significativas en la tasa de supervivencia entre pacientes con HTA (78,6%) y aquellos sin HTA (88,8%). El análisis individual de los estudios incluidos revela una variabilidad significativa en los resultados clínicos relacionados con la HTA y COVID-19. Por ejemplo, el estudio de Chen et al.[24], en China mostró una alta tasa de mortalidad en pacientes hipertensos, mientras que el estudio de Sun et al.[51], en el mismo país informó de tasas de supervivencia mucho más altas en este grupo. Esta diversidad en los hallazgos subraya la importancia de considerar factores contextuales, como las características demográficas de los pacientes y las diferencias en los protocolos de tratamiento entre los estudios. Además, la heterogeneidad observada en estos estudios resalta la necesidad de abordar con cautela la generalización de los resultados y enfatiza la importancia de realizar investigaciones adicionales para comprender mejor la relación entre la HTA y los desenlaces de COVID-19.
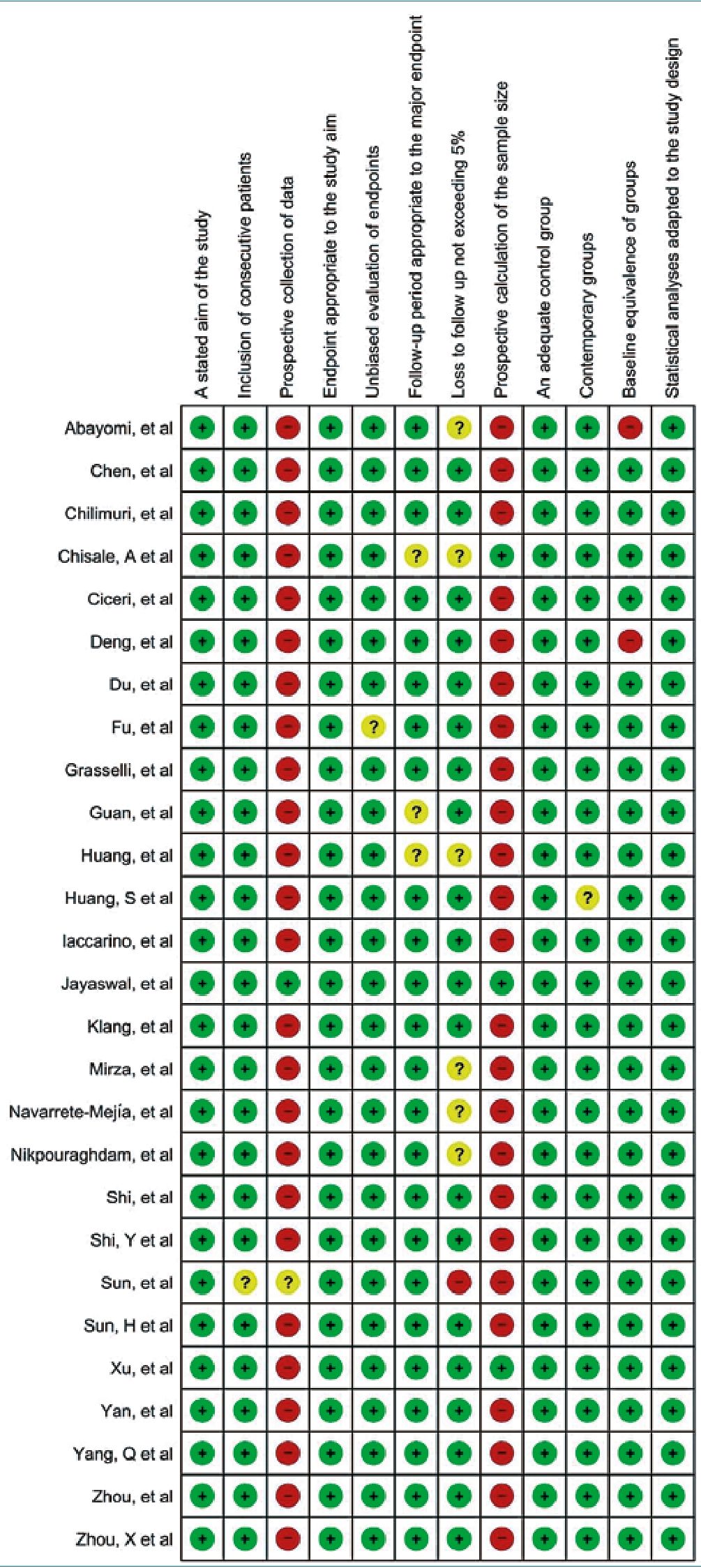
Figura 2. Resumen del riesgo de sesgo. Fuente: Propia con RevMan 5.3.
-
Evaluación del riesgo de sesgo (calidad)
Para evaluar la calidad metodológica de los estudios primarios, se empleó el Índice MINORS[20] (Figura 2).
Un hallazgo clave fue que la mayoría de los estudios incluidos eran de diseño retrospectivo y se basaban en análisis de historiales clínicos. Esta metodología tiende a incrementar el
riesgo de sesgo del evaluador, dado que los datos procedían de registros existentes en lugar de ser recopilados prospectivamente. Este aspecto es crucial para interpretar los resultados, ya que podría afectar la objetividad y la precisión de los hallazgos.
Además, se observó que muchos de los estudios no realizaron cálculos de tamaño de muestra previos a la investigación, lo que podría limitar la representatividad y la generalización de los resultados. La naturaleza retrospectiva y basada en registros también dificultó la determinación precisa del porcentaje de pérdidas de seguimiento, un factor que podría influir en la interpretación de los datos (Figura 3).
Tabla 2. Descripción de las características de los estudios incluidos con relación a la hipertensión arterial y la Unidad de Cuidados Intensivos en pacientes con COVID-19
| Unidad de Cuidados Intensivos | |||||||
| Autor y año de | País | Tamaño de la | Hipertensos | No | Sobrevivieron | No | Total UCI |
| publicación | muestra | hipertensos | sobrevivieron | ||||
| Chen 2020 | China | 274 | 90 | 26 | 23 | 93 | 116 |
| Mirza 2022 | China | 515 | 100 | 34 | 38 | 96 | 134 |
| Huang 2020 | China | 310 | 27 | 24 | 49 | 2 | 51 |
| Jayaswal 2021 | India | 813 | 12 | 0 | 14 | 11 | 25 |
| Deng 2021 | China | 337 | 22 | 19 | 40 | 1 | 41 |
| Abayomi 2021 | Nigeria | 2.075 | 24 | 17 | 40 | 1 | 41 |
| Shi 2020 | China | 671 | 26 | 36 | 33 | 29 | 62 |

Figura 3. Gráfico de riesgo de sesgo. Cada tipo de riesgo de sesgo se presentó como porcentajes en todos los estudios incluidos. La información se sintetizó para evaluar la calidad de cada estudio.
-
Hipertensión y mortalidad
En nuestro análisis, se observó una asociación notable entre la hipertensión arterial (HTA) y la mortalidad en pacientes con COVID-19 (Figura 4). Se utilizó un modelo de efectos aleatorios debido a la significativa heterogeneidad entre los estudios, como lo indica un valor de IA2 del 79,56% y un p < 0,01 en la prueba Q. A pesar de esta heterogeneidad, el riesgo relativo (RR) estimado fue de 3,96 (IC del 95%: 1,101 – 6,687), lo que sugiere un aumento considerable en el riesgo de mortalidad para pacientes con HTA en comparación con los no hiperten- sos. Este resultado se mantuvo significativo incluso después de ajustar por la variabilidad entre los estudios (p < 0,01). Para evaluar la presencia de sesgo de publicación, se aplicaron las pruebas de Egger y Begg. Los resultados de estas pruebas no fueron estadísticamente significativos (Egger: t = 0,92, df = 26, p = 0,37; Begg: z = 1,09, p = 0,28), lo que indica una baja probabilidad de sesgo en nuestros resultados.
Además, se empleó la Curva de Influencia Acumulativa (CIA) para evaluar la robustez de nuestros hallazgos y detectar posibles influencias excesivas de estudios individuales (Figura 5). Los valores de rstudent, dffits y cook.d sugieren cierta influencia en los resultados, pero el valor de cov.r indica una adecuada coherencia con los valores ajustados del modelo.
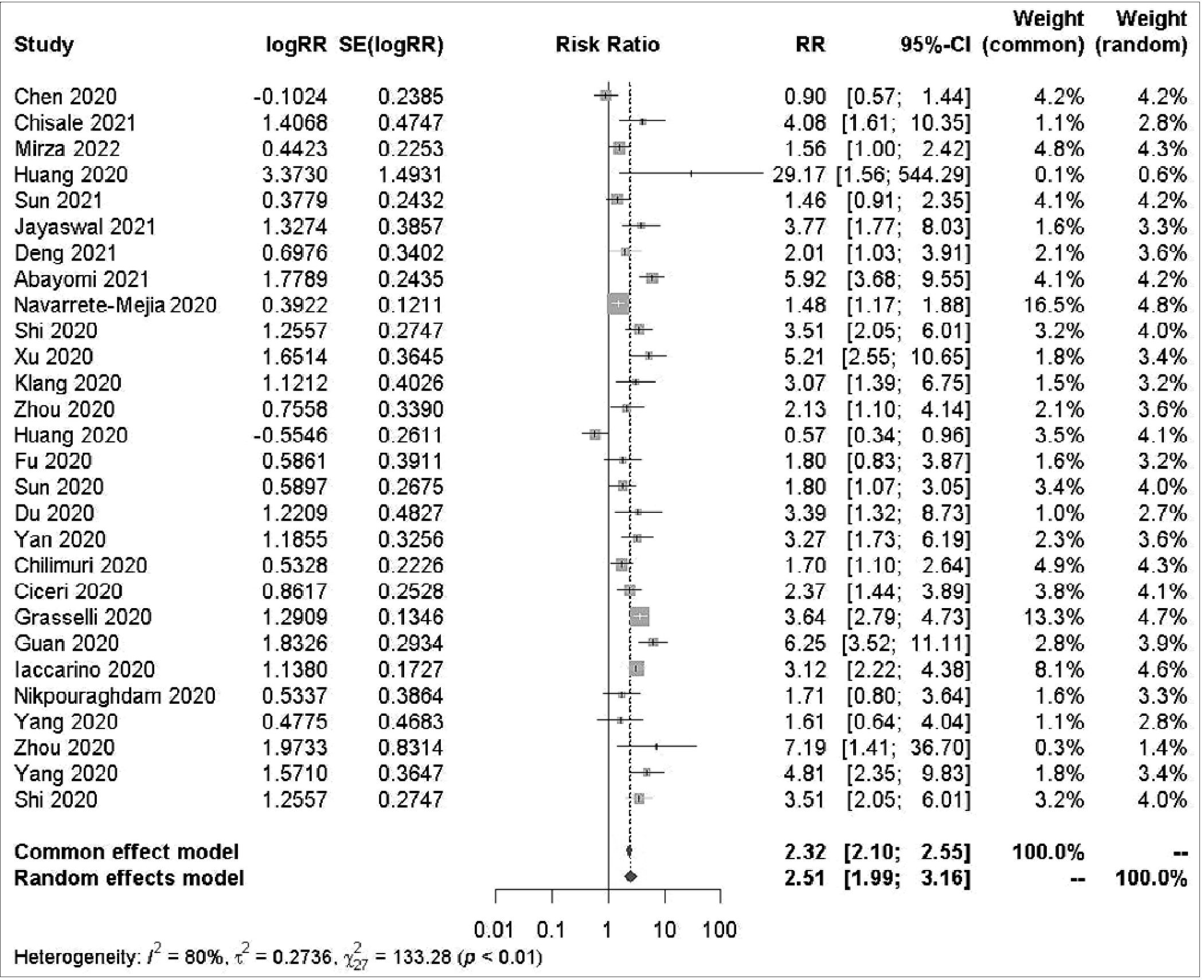
Figura 4. Diagrama de bosque que muestra que la hipertensión arterial es un factor de riesgo individual de mortalidad de pacientes con COVID-19. Eventos referidos a muertes de pacientes. RR: riesgo relativo en la cohorte estudiada; IC del 95%, intervalo de confianza del 95%.
-
Hipertensión y requerimiento de cuidados intensivos
Este análisis se centró en estudios que examinaron la relación entre la HTA y el requerimiento de ingreso a UCI, con tamaños de muestra que oscilaron entre 274 y 2.075 pacientes. Los tests de Egger y Begg se utilizaron para evaluar el sesgo de publicación. Mientras que el test de Egger no mostró evidencias de sesgo, el test de Begg sugirió una posible correlación positiva cercana al límite de significación, lo que podría indicar una tendencia hacia el sesgo de publicación.
El diagrama de bosque reveló una heterogeneidad considerable entre los estudios, con variaciones notables en las estimaciones del efecto (Figura 6). Se observó una tendencia general hacia una asociación positiva entre la hipertensión y la necesidad de ingreso a UCI, aunque la magnitud de esta asociación varió entre los estudios. Estos hallazgos subrayan la necesidad de considerar las diferencias entre los estudios al interpretar los resultados y destacan la importancia de la HTA como un posible factor de riesgo para el ingreso en UCI.
-
Discusión
Investigaciones previas han establecido que la presencia de comorbilidades, especialmente enfermedades cardiovasculares y diabetes, aumenta significativamente el riesgo de mortalidad en pacientes con COVID-19[52]. En este contexto, la HTA emerge como un factor de riesgo crítico para la muerte prematura y la discapacidad a nivel global, afectando aproximadamente al 31,2% de la población adulta mundial[53]. Sin embargo, es crucial reconocer la considerable heterogeneidad en los estudios que examinan la relación entre la HTA y COVID-19, lo que puede afectar la interpretación de estos hallazgos.
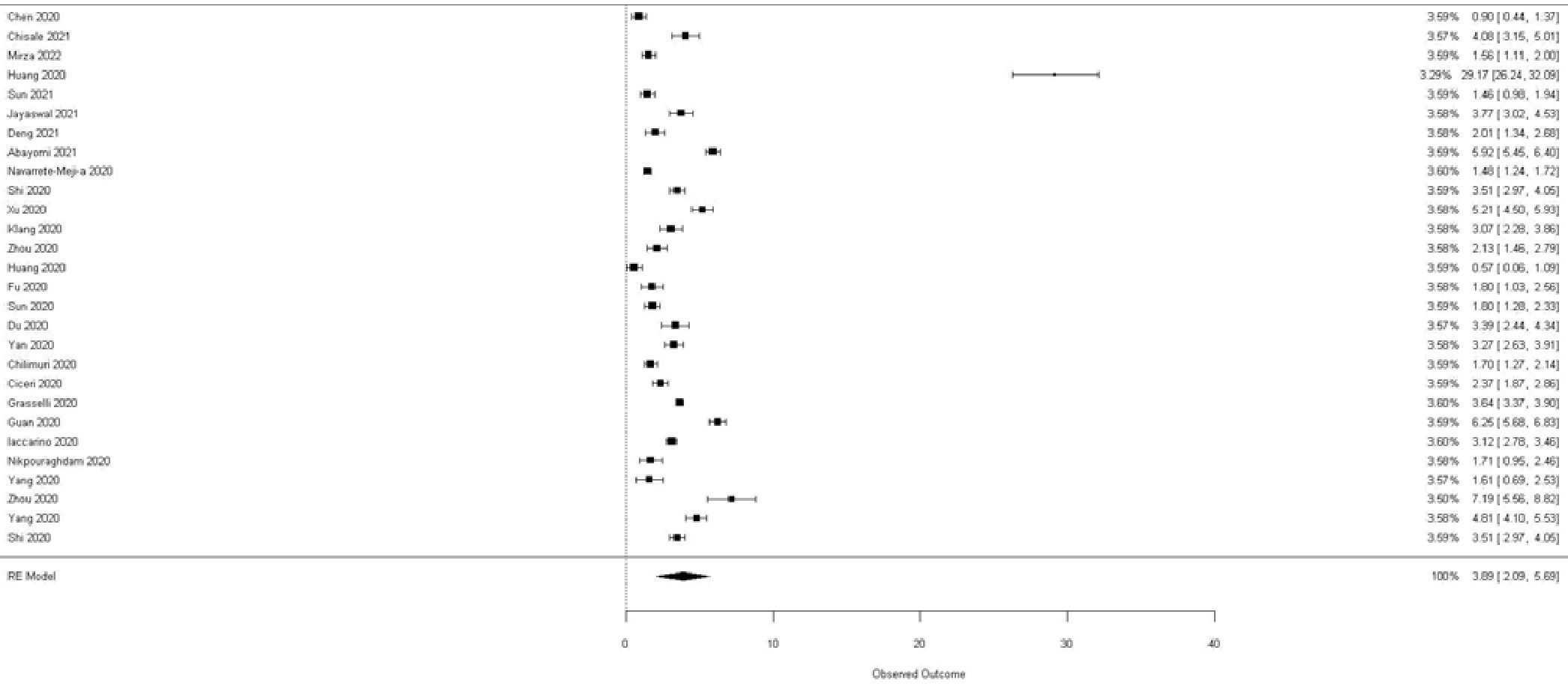
Figura 5. Curva de influencia acumulativa en el metaanálisis de la relación entre la hipertensión arterial y la mortalidad en pacientes con COVID-19.
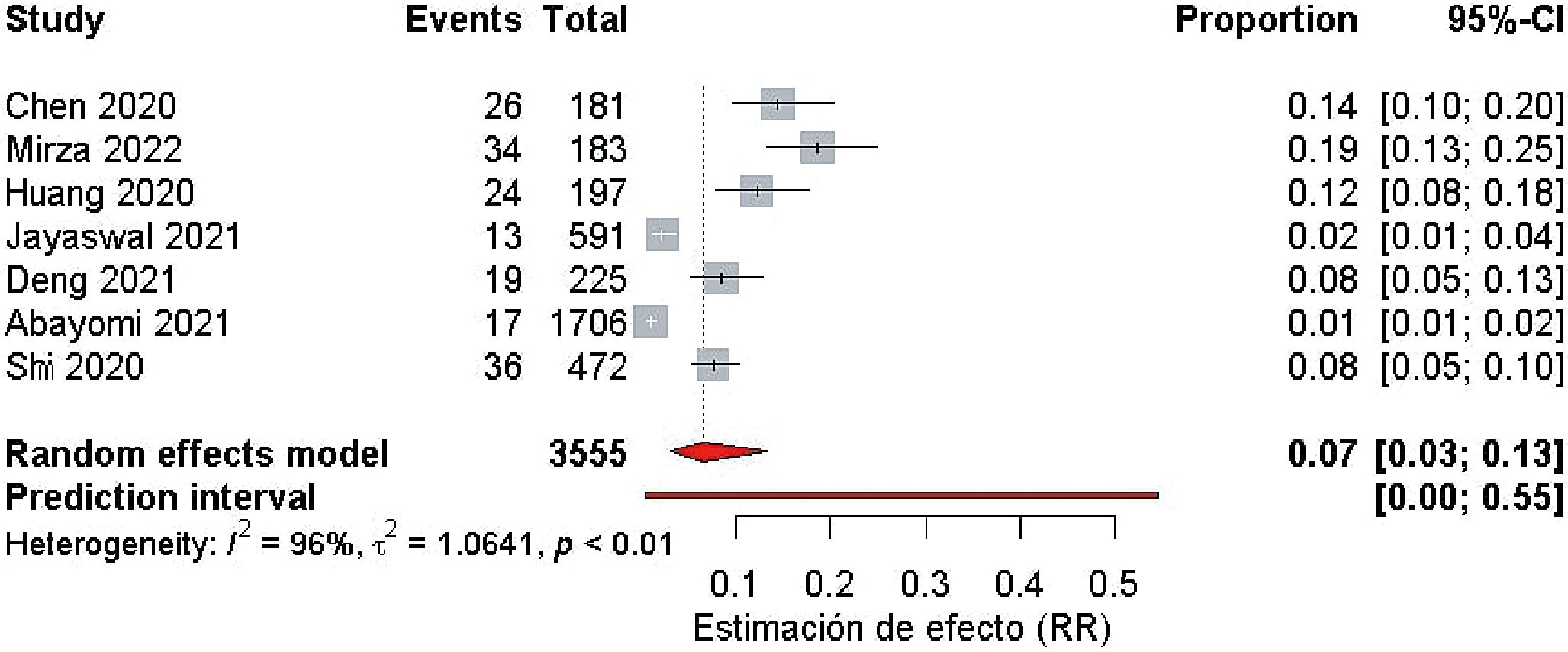
Figura 6. Diagrama de bosque que muestra una asociación positiva entre la hipertensión arterial y el requerimiento de ingreso a UCI.
Nuestro estudio, en línea con las investigaciones de Qian et al. y Du et al.[15],[16], confirma y amplía estos hallazgos, indicando un impacto adverso significativo de la HTA en los resultados clínicos de pacientes con COVID-19. Hemos encontrado un riesgo relativo de mortalidad de 3,96 en pacientes con HTA, lo que sugiere un riesgo casi cuádruple de fallecimiento en comparación con los pacientes no hipertensos. Además, observamos una mayor necesidad de cuidados intensivos en este grupo. A pesar de esto, es importante considerar la variabilidad y la precisión de estos resultados. Por ejemplo, estudios como el de Gao et al.[54], revelaron que los pacientes con COVID-19 e HTA tienen un riesgo de mortalidad dos veces mayor en comparación con aquellos sin hipertensión, lo que destaca la importancia de considerar otros factores de riesgo y comorbilidades.
Como se observa en el metaanálisis de Qian et al.[15], hay una correlación directa entre la HTA y las complicaciones de COVID-19. Esta consistencia en la literatura refuerza la idea de que la HTA es un factor clave en la progresión de la enfermedad. En conjunto, estos estudios aportan evidencia adicional que respalda el papel perjudicial de la hipertensión en los desenlaces clínicos de los pacientes con COVID-19.
Aunque nuestros hallazgos corroboran la idea de que la HTA puede agravar la severidad de COVID-19, la alta heterogeneidad observada entre los estudios sugiere la necesidad de interpretar estos resultados con cautela. La inconsistencia en las tasas de supervivencia y la necesidad de ingreso a UCI entre los estudios subraya la influencia de variables contextuales y la diversidad en los protocolos de tratamiento. Además, es fundamental reconocer las limitaciones inherentes a nuestro análisis, especialmente en lo que respecta a los sesgos y factores confundentes. Los estudios incluidos en nuestro metaanálisis, siendo en su mayoría observacionales, pueden estar sujetos a sesgos de selección y de información, lo que potencialmente afecta la generalización de los resultados. Por ejemplo, las diferencias en las características de los pacientes, como la edad, comorbilidades adicionales y el acceso a la atención médica pueden haber influido en los desenlaces observados. Además, la falta de detalles en algunos estudios sobre el manejo clínico de la HTA y las intervenciones terapéuticas para COVID-19 introduce una variabilidad significativa que podría haber afectado los resultados.
En este contexto, es importante considerar estas limitaciones al interpretar la relación entre la HTA y los desenlaces adversos en pacientes con COVID-19. Futuras investigaciones deberían centrarse en estudios prospectivos y controlados que permitan un análisis más preciso de esta relación, teniendo en cuenta los posibles sesgos y confundentes. Estos estudios podrían proporcionar una comprensión más clara de cómo la HTA interactúa con otros factores de riesgo en el contexto de COVID-19 y contribuir a estrategias de manejo más efectivas para estos pacientes.
-
Conclusión
Este metaanálisis resalta la HTA como un factor de riesgo clave en desenlaces adversos de COVID-19, evidenciando una relación directa con un aumento en la mortalidad y gravedad de la infección, incluyendo una mayor necesidad de ingreso en UCI. No obstante, la heterogeneidad significativa entre los estudios analizados, que podría atribuirse a variaciones metodológicas y demográficas, requiere una interpretación prudente de estos hallazgos. Se destaca la importancia de la HTA en la estratificación de riesgos y la gestión clínica del COVID-19. Futuras investigaciones deben enfocarse en superar las limitaciones actuales, desarrollando estrategias específicas para mejorar los resultados en pacientes con COVID-19 y HTA.
-
Referencias
1. WHO. World Health Organization. Coronavirus disease dashboard. 2022.
2. Lu J, Lu Y, Wang X, Li X, Linderman GC, Wu C, et al. Prevalence, awareness, treatment, and control of hypertension in China: data from 1·7 million adults in a population-based screening study (China PEACE Million Persons Project) [Internet]. Lancet. 2017 Dec;390(10112):2549–58. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0140673617324789 https://doi.org/10.1016/S0140-6736(17)32478-9 PMID:29102084
3. Zhou B, Carrillo-Larco RM, Danaei G, Riley LM, Paciorek CJ, Stevens GA, et al.; NCD Risk Factor Collaboration (NCD-RisC). Worldwide trends in hypertension prevalence and progress in treatment and control from 1990 to 2019: a pooled analysis of 1201 population-representative studies with 104 million participants [Internet]. Lancet. 2021 Sep;398(10304):957–80. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0140673621013301 https://doi.org/10.1016/S0140-6736(21)01330-1 PMID:34450083
4. Umemura S, Arima H, Arima S, Asayama K, Dohi Y, Hirooka Y, et al. The Japanese Society of Hypertension Guidelines for the Management of Hypertension (JSH 2019) [Internet]. Hypertens Res. 2019 Sep;42(9):1235–481. Available from: https://www.nature.com/articles/s41440-019-0284-9 https://doi.org/10.1038/s41440-019-0284-9 PMID:31375757
5. Iaccarino G, Grassi G, Borghi C, Ferri C, Salvetti M, Volpe M, et al.; SARS-RAS Investigators. Age and Multimorbidity Predict Death Among COVID-19 Patients: Results of the SARS-RAS Study of the Italian Society of Hypertension [Internet]. Hypertension. 2020 Aug;76(2):366–72. Available from: https://www.ahajournals.org/doi/10.1161/HYPERTENSIONAHA.120.15324 https://doi.org/10.1161/HYPERTENSIONAHA.120.15324 PMID:32564693
6. Mancusi C, Grassi G, Borghi C, Carugo S, Fallo F, Ferri C, et al.; SARS-RAS Investigators. Determinants of healing among patients with coronavirus disease 2019: the results of the SARS-RAS study of the Italian Society of Hypertension [Internet]. J Hypertens. 2021 Feb;39(2):376–80. Available from: https://journals.lww.com/10.1097/HJH.0000000000002666 https://doi.org/10.1097/HJH.0000000000002666 PMID:33186327
7. Semenzato L, Botton J, Drouin J, Cuenot F, Dray-Spira R, Weill A, et al. Chronic diseases, health conditions and risk of COVID-19-related hospitalization and in-hospital mortality during the first wave of the epidemic in France: a cohort study of 66 million people. Lancet Reg Heal – Eur [Internet]. 2021 Sep;8:100158. Available from: https://linkinghub.elsevier.com/retrieve/pii/S2666776221001356
8. Thakur B, Dubey P, Benitez J, Torres JP, Reddy S, Shokar N, et al. A systematic review and meta-analysis of geographic differences in comorbidities and associated severity and mortality among individuals with COVID-19 [Internet]. Sci Rep. 2021 Apr;11(1):8562. Available from: https://www.nature.com/articles/s41598-021-88130-w https://doi.org/10.1038/s41598-021-88130-w PMID:33879826
9. Vincent JL, Taccone FS. Understanding pathways to death in patients with COVID-19 [Internet]. Lancet Respir Med. 2020 May;8(5):430–2. Available from: https://linkinghub.elsevier.com/retrieve/pii/S221326002030165X https://doi.org/10.1016/S2213-2600(20)30165-X PMID:32272081
10. Deng G, Yin M, Chen X, Zeng F. Clinical determinants for fatality of 44,672 patients with COVID-19 [Internet]. Crit Care. 2020 Apr;24(1):179. Available from: https://ccforum.biomedcentral.com/articles/10.1186/s13054-020-02902-w https://doi.org/10.1186/s13054-020-02902-w PMID:32345311
11. Docherty AB, Harrison EM, Green CA, Hardwick HE, Pius R, Norman L, et al.; ISARIC4C investigators. Features of 20 133 UK patients in hospital with covid-19 using the ISARIC WHO Clinical Characterisation Protocol: prospective observational cohort study [Internet]. BMJ. 2020 May;369:m1985. Available from: https://www.bmj.com/lookup/doi/10.1136/bmj.m1985 https://doi.org/10.1136/bmj.m1985 PMID:32444460
12. Moher D, Liberati A, Tetzlaff J, Altman DG; PRISMA Group. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement [Internet]. PLoS Med. 2009 Jul;6(7):e1000097. Available from: https://dx.plos.org/10.1371/journal.pmed.1000097 https://doi.org/10.1371/journal.pmed.1000097 PMID:19621072
13. Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews [Internet]. Int J Surg. 2021 Apr;88:105906. Available from: https://linkinghub.elsevier.com/retrieve/pii/S1743919121000406 https://doi.org/10.1016/j.ijsu.2021.105906 PMID:33789826
14. Stroup DF, Berlin JA, Morton SC, Olkin I, Williamson GD, Rennie D, et al. Meta-analysis of observational studies in epidemiology: a proposal for reporting. Meta-analysis Of Observational Studies in Epidemiology (MOOSE) group [Internet]. JAMA. 2000 Apr;283(15):2008–12. Available from: http://jama.jamanetwork.com/article.aspx?doi=10.1001/jama.283.15.2008 https://doi.org/10.1001/jama.283.15.2008 PMID:10789670
15. Qian Z, Li Z, Peng J, Gao Q, Cai S, Xu X. Association between hypertension and prognosis of patients with COVID-19: A systematic review and meta-analysis [Internet]. Clin Exp Hypertens. 2022 Jul;44(5):451–8. Available from: https://www.tandfonline.com/doi/full/10.1080/10641963.2022.2071914 https://doi.org/10.1080/10641963.2022.2071914 PMID:35531646
16. Du Y, Zhou N, Zha W, Lv Y. Hypertension is a clinically important risk factor for critical illness and mortality in COVID-19: A meta-analysis [Internet]. Nutr Metab Cardiovasc Dis. 2021 Mar;31(3):745–55. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0939475320305184 https://doi.org/10.1016/j.numecd.2020.12.009 PMID:33549450
17. Hutton B, Salanti G, Caldwell DM, Chaimani A, Schmid CH, Cameron C, et al. The PRISMA extension statement for reporting of systematic reviews incorporating network meta-analyses of health care interventions: checklist and explanations [Internet]. Ann Intern Med. 2015 Jun;162(11):777–84. Available from: https://www.acpjournals.org/doi/10.7326/M14-2385 https://doi.org/10.7326/M14-2385 PMID:26030634
18. Beall. 2023. 2023 [cited 2023 Jun 16]. Beall’s List of Potential Predatory Journals and Publishers. Available from: https://beallslistnet/#update
19. Shamseer L, Moher D, Maduekwe O, Turner L, Barbour V, Burch R, et al. Potential predatory and legitimate biomedical journals: can you tell the difference? A cross-sectional comparison [Internet]. BMC Med. 2017 Mar;15(1):28. Available from: http://bmcmedicine.biomedcentral.com/articles/10.1186/s12916-017-0785-9 https://doi.org/10.1186/s12916-017-0785-9 PMID:28298236
20. Slim K, Nini E, Forestier D, Kwiatkowski F, Panis Y, Chipponi J. Methodological index for non-randomized studies (minors): development and validation of a new instrument [Internet]. ANZ J Surg. 2003 Sep;73(9):712–6. Available from: http://doi.wiley.com/10.1046/j.1445-2197.2003.02748.x https://doi.org/10.1046/j.1445-2197.2003.02748.x PMID:12956787
21. Balduzzi S, Rücker G, Schwarzer G. How to perform a meta-analysis with R: a practical tutorial. Evid Based Ment Heal [Internet]. 2019 Nov;22(4):153–60. Available from: https://ebmh.bmj.com/lookup/doi/10.1136/ebmental-2019-300117
22. Kenward MG, Roger JH. Small sample inference for fixed effects from restricted maximum likelihood [Internet]. Biometrics. 1997 Sep;53(3):983–97. Available from: https://www.jstor.org/stable/2533558?origin=crossref https://doi.org/10.2307/2533558 PMID:9333350
23. Miller JJ. The Inverse of the Freeman – Tukey Double Arcsine Transformation [Internet]. Am Stat. 1978 Nov;32(4):138–138. Available from: http://www.tandfonline.com/doi/abs/10.1080/00031305.1978.10479283
24. Chen T, Wu D, Chen H, Yan W, Yang D, Chen G, et al. Clinical characteristics of 113 deceased patients with coronavirus disease 2019: retrospective study [Internet]. BMJ. 2020 Mar;368:m1091. Available from: https://www.bmj.com/lookup/doi/10.1136/bmj.m1091 https://doi.org/10.1136/bmj.m1091 PMID:32217556
25. Shi S, Qin M, Cai Y, Liu T, Shen B, Yang F, et al. Characteristics and clinical significance of myocardial injury in patients with severe coronavirus disease 2019 [Internet]. Eur Heart J. 2020 Jun;41(22):2070–9. Available from: https://academic.oup.com/eurheartj/article/41/22/2070/5835730 https://doi.org/10.1093/eurheartj/ehaa408 PMID:32391877
26. Xu PP, Tian RH, Luo S, Zu ZY, Fan B, Wang XM, et al. Risk factors for adverse clinical outcomes with COVID-19 in China: a multicenter, retrospective, observational study [Internet]. Theranostics. 2020 May;10(14):6372–83. Available from: http://www.thno.org/v10p6372.htm https://doi.org/10.7150/thno.46833 PMID:32483458
27. Klang E, Kassim G, Soffer S, Freeman R, Levin MA, Reich DL. Severe Obesity as an Independent Risk Factor for COVID-19 Mortality in Hospitalized Patients Younger than 50. Obesity (Silver Spring). 2020 Sep;28(9):1595–9. https://doi.org/10.1002/oby.22913 PMID:32445512
28. Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study [Internet]. Lancet. 2020 Mar;395(10229):1054–62. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0140673620305663 https://doi.org/10.1016/S0140-6736(20)30566-3 PMID:32171076
29. Huang S, Wang J, Liu F, Liu J, Cao G, Yang C, et al. COVID-19 patients with hypertension have more severe disease: a multicenter retrospective observational study [Internet]. Hypertens Res. 2020 Aug;43(8):824–31. Available from: https://www.nature.com/articles/s41440-020-0485-2 https://doi.org/10.1038/s41440-020-0485-2 PMID:32483311
30. Fu L, Fei J, Xiang H, Xiang Y, Li M, Liu F, et al. Influence factors of death risk among COVID-19 patients in Wuhan, China: a hospital-based case-cohort study. ResearchSquare [Internet]. 2020;1–16. Available from: http://www.epistemonikos.org/documents/37f29e6b4347bc143475f85981df2ae1621d8f35
31. Sun H, Ning R, Tao Y, Yu C, Deng X, Zhao C, et al. Risk Factors for Mortality in 244 Older Adults With COVID-19 in Wuhan, China: A Retrospective Study. J Am Geriatr Soc. 2020 Jun;68(6):E19–23. https://doi.org/10.1111/jgs.16533 PMID:32383809
32. Du RH, Liang LR, Yang CQ, Wang W, Cao TZ, Li M, et al. Predictors of mortality for patients with COVID-19 pneumonia caused by SARSCoV- 2: A prospective cohort study. Eur Respir J. 2020;56(3):0–3.
33. Yan X, Li F, Wang X, Yan J, Zhu F, Tang S, et al. Neutrophil to lymphocyte ratio as prognostic and predictive factor in patients with coronavirus disease 2019: A retrospective cross-sectional study [Internet]. J Med Virol. 2020 Nov;92(11):2573–81. Available from: https://onlinelibrary.wiley.com/doi/10.1002/jmv.26061 https://doi.org/10.1002/jmv.26061 PMID:32458459
34. Chilimuri S, Sun H, Alemam A, Mantri N, Shehi E, Tejada J, et al. Predictors of mortality in adults admitted with COVID-19: retrospective cohort study from New York City. West J Emerg Med. 2020 Jul;21(4):779–84. https://doi.org/10.5811/westjem.2020.6.47919 PMID:32726241
35. Chisale MR, Nyambalo BW, Mitambo C, Kumwenda P, Mwale SE, Mbakaya BC. Comparative characterisation of COVID-19 patients with hypertension comorbidity in Malawi: a 1:2 matched retrospective case-control study [Internet]. IJID Reg. 2022 Mar;2(2):25–9. https://doi.org/10.1016/j.ijregi.2021.11.005 PMID:35721435
36. Ciceri F, Castagna A, Rovere-Querini P, De Cobelli F, Ruggeri A, Galli L, et al. Early predictors of clinical outcomes of COVID-19 outbreak in Milan, Italy [Internet]. Clin Immunol. 2020 Aug;217:108509. https://doi.org/10.1016/j.clim.2020.108509 PMID:32535188
37. Grasselli G, Zangrillo A, Zanella A, Antonelli M, Cabrini L, Castelli A, et al.; COVID-19 Lombardy ICU Network. Baseline Characteristics and Outcomes of 1591 Patients Infected With SARS-CoV-2 Admitted to ICUs of the Lombardy Region, Italy. JAMA. 2020 Apr;323(16):1574–81. https://doi.org/10.1001/jama.2020.5394 PMID:32250385
38. Guan W jie, Liang W hua, Zhao Y, Liang H rui, Chen Z sheng, Li Y min, et al. Comorbidity and its impact on 1590 patients with COVID-19 in China: a nationwide analysis. Eur Respir J [Internet]. 2020 May;55(5):2000547. Available from: http://erj.ersjournals.com/lookup/doi/10.1183/13993003.00547-2020
39. Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020 Feb;395(10223):497–506. https://doi.org/10.1016/S0140-6736(20)30183-5 PMID:31986264
40. Yang G, Tan Z, Zhou L, Yang M, Peng L, Liu J, et al. Effects of Angiotensin II Receptor Blockers and ACE (Angiotensin-Converting Enzyme) Inhibitors on Virus Infection, Inflammatory Status, and Clinical Outcomes in Patients With COVID-19 and Hypertension: A Single-Center Retrospective Study [Internet]. Hypertension. 2020 Jul;76(1):51–8. Available from: https://www.ahajournals.org/doi/10.1161/HYPERTENSIONAHA.120.15143 https://doi.org/10.1161/HYPERTENSIONAHA.120.15143 PMID:32348166
41. Zhou X, Zhu J, Xu T. Clinical characteristics of coronavirus disease 2019 (COVID-19) patients with hypertension on renin-angiotensin system inhibitors [Internet]. Clin Exp Hypertens. 2020 Oct;42(7):656–60. Available from: https://www.tandfonline.com/doi/full/10.1080/10641963.2020.1764018 https://doi.org/10.1080/10641963.2020.1764018 PMID:32404011
42. Yang Q, Zhou Y, Wang X, Gao S, Xiao Y, Zhang W, et al. Effect of hypertension on outcomes of adult inpatients with COVID-19 in Wuhan, China: a propensity score-matching analysis [Internet]. Respir Res. 2020 Jul;21(1):172. Available from: https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-020-01435-8 https://doi.org/10.1186/s12931-020-01435-8 PMID:32631365
43. Shi Y, Yu X, Zhao H, Wang H, Zhao R, Sheng J. Host susceptibility to severe COVID-19 and establishment of a host risk score: findings of 487 cases outside Wuhan [Internet]. Crit Care. 2020 Mar;24(1):108. Available from: https://ccforum.biomedcentral.com/articles/10.1186/s13054-020-2833-7 https://doi.org/10.1186/s13054-020-2833-7 PMID:32188484
44. Mirza H, Noori MA, Akbar H, Fichadiya H, Kaur IP, Sachdeva S, et al. Hypertension as an Independent Risk Factor for In-Patient Mortality in Hospitalized COVID-19 Patients: A Multicenter Study. Cureus [Internet]. 2022 Jul 11; Available from: https://www.cureus.com/articles/98251-hypertension-as-an-independent-risk-factor-for-in-patient-mortality-in-hospitalized-covid-19-patients-a-multicenter-study
45. MORALES C. Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet [Internet]. 2020 Feb;395(10223):497–506. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0140673620301835
46. Sun Y, Guan X, Jia L, Xing N, Cheng L, Liu B, et al. Independent and combined effects of hypertension and diabetes on clinical outcomes in patients with COVID-19: A retrospective cohort study of Huoshen Mountain Hospital and Guanggu Fangcang Shelter Hospital [Internet]. J Clin Hypertens (Greenwich). 2021 Feb;23(2):218–31. Available from: https://onlinelibrary.wiley.com/doi/10.1111/jch.14146 https://doi.org/10.1111/jch.14146 PMID:33369066
47. Jayaswal SK, Singh S, Malik PS, Venigalla SK, Gupta P, Samaga SN, et al. Detrimental effect of diabetes and hypertension on the severity and mortality of COVID-19 infection: A multi-center case-control study from India [Internet]. Diabetes Metab Syndr. 2021;15(5):102248. https://doi.org/10.1016/j.dsx.2021.102248 PMID:34412000
48. Deng Y ping, Xie W, Liu T, Wang S yi, Wang M rong, Zan Y xing, et al. Associação da Hipertensão com a Gravidade e a Mortalidade de Pacientes Hospitalizados com COVID-19 em Wuhan, China: Estudo Unicêntrico e Retrospectivo. Arq Bras Cardiol [Internet]. 2021 Jul 8; Available from: https://abccardiol.org/article/associacao-da-hipertensao-com-a-gravidade-e-a-mortalidade-de-pacientes-hospitalizados-com-covid-19-em-wuhan-china-estudo-unicentrico-e-retrospectivo/
49. Abayomi A, Osibogun A, Kanma-Okafor O, Idris J, Bowale A, Wright O, et al. Morbidity and mortality outcomes of COVID-19 patients with and without hypertension in Lagos, Nigeria: a retrospective cohort study (Global Health Research and Policy. Glob Heal Res Policy. 2021;6(1).
50. Navarrete-Mejía PJ, Lizaraso-Soto FA, Velasco-Guerrero JC, Loro-Chero LM. Diabetes mellitus e hipertensión arterial como factor de riesgo de mortalidad en pacientes con Covid-19. Rev del Cuerpo Médico del HNAAA [Internet]. 2021 Feb 14;13(4):361–5. Available from: http://cmhnaaa.org.pe/ojs/index.php/rcmhnaaa/article/view/766 https://doi.org/10.35434/rcmhnaaa.2020.134.766.
51. Sun Y, Guan X, Jia L, Xing N, Cheng L, Liu B, et al. Independent and combined effects of hypertension and diabetes on clinical outcomes in patients with COVID-19: A retrospective cohort study of Huoshen Mountain Hospital and Guanggu Fangcang Shelter Hospital. J Clin Hypertens (Greenwich). 2021 Feb;23(2):218–31. https://doi.org/10.1111/jch.14146 PMID:33369066
52. Li B, Yang J, Zhao F, Zhi L, Wang X, Liu L, et al. Prevalence and impact of cardiovascular metabolic diseases on COVID-19 in China [Internet]. Clin Res Cardiol. 2020 May;109(5):531–8. Available from: http://link.springer.com/10.1007/s00392-020-01626-9 https://doi.org/10.1007/s00392-020-01626-9 PMID:32161990
53. Mills KT, Bundy JD, Kelly TN, Reed JE, Kearney PM, Reynolds K, et al. Global Disparities of Hypertension Prevalence and Control: A Systematic Analysis of Population-Based Studies From 90 Countries [Internet]. Circulation. 2016 Aug;134(6):441–50. Available from: https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.115.018912 https://doi.org/10.1161/CIRCULATIONAHA.115.018912 PMID:27502908
54. Gao C, Cai Y, Zhang K, Zhou L, Zhang Y, Zhang X, et al. Association of hypertension and antihypertensive treatment with COVID-19 mortality: a retrospective observational study [Internet]. Eur Heart J. 2020 Jun;41(22):2058–66. Available from: https://academic.oup.com/eurheartj/article/41/22/2058/5851436 https://doi.org/10.1093/eurheartj/ehaa433 PMID:32498076

 ORCID
ORCID