Ricardo Fuentealba Ramírez1,2,*, Luciano Bravo3
Recibido: 14-08-2023
Aceptado: 02-09-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 7 pp. 656-661|https://doi.org/10.25237/revchilanestv52n7-05
PDF|ePub|RIS
Hemodynamic changes in preeclampsia
Abstract
Preeclampsia is a hypertensive disorder of pregnancy that represents one of the leading causes of maternal mortality worldwide. During pregnancy, the cardiovascular system undergoes physiological changes to adapt to the increased blood flow needed for fetal development. These changes include vasodilation and increased cardiac output. However, in preeclampsia, endothelial dysfunction occurs, affecting the relaxation of blood vessels and causing a reduction in placental perfusion. This can lead to serious complications for both mother and fetus. Ultrasound plays a crucial role in the management of preeclampsia. It allows assessment of hemodynamic and structural changes in the pregnant woman’s cardiovascular system, which helps to identify early signs of dysfunction and risk of complications. Knowledge of cardiovascular changes in preeclampsia is essential for anesthesiologists and other health care professionals who provide perioperative care to these patients. Understanding the pathophysiology of the disease and continuous monitoring of hemodynamic changes by ultrasound allows them to make informed decisions and provide optimal care during pregnancy, delivery, and postpartum.
Resumen
La preeclampsia (PE) es un trastorno hipertensivo del embarazo que representa una de las principales causas de mortalidad materna en todo el mundo. Durante el embarazo, el sistema cardiovascular experimenta cambios fisiológicos para adaptarse al aumento del flujo sanguíneo necesario para el desarrollo del feto. Estos cambios incluyen vasodilatación por influjo hormonal y aumento del gasto cardíaco para cubrir las necesidades de la unidad materno fetal. Sin embargo, en la PE, se produce una disfunción endotelial que afecta la relajación de los vasos sanguíneos y causa una reducción en la perfusión placentaria. Esto puede llevar a complicaciones graves tanto para la madre como para el feto. La ecografía desempeña un papel crucial en el manejo de la PE. Permite evaluar los cambios hemodinámicos y estructurales del sistema cardiovascular de la mujer embarazada, lo que ayuda a identificar tempranamente signos de disfunción y riesgo de complicaciones. El conocimiento de los fenómenos cardiovasculares y hemodinámicos en la PE es fundamental para los anestesiólogos y otros profesionales de la salud que brindan atención perioperatoria a estas pacientes. La comprensión de la fisiopatología de la enfermedad y el monitoreo continuo de estos permite tomar decisiones informadas y brindar un cuidado óptimo durante el embarazo, el parto y puerperio.
-
Introducción
Durante los últimos años, existe una creciente preocupación a nivel mundial debido al estancamiento y leve incremento de las tasas de mortalidad materna en países desarrollados o con un alto nivel de cuidados obstétricos. Este fenómeno se puede atribuir principalmente al aumento del número de mujeres, con enfermedades crónicas estables, bajo tratamiento con el objetivo de ser madres y al incremento del número de primíparas añosas que mediante técnicas de fertilización asistida logran la posibilidad de embarazo más allá del período de fertilidad natural[1].
En un artículo publicado durante el año 2017 se reportaron las causas principales de este fenómeno, destacando los trastornos hipertensivos del embarazo como la segunda causa de muerte materna después de la hemorragia obstétrica, siendo la preeclampsia (PE) como la más prevalente de este grupo[2].
En Chile, las cinco primeras causas de mortalidad materna en el período entre 2002 y 2015 fueron; enfermedades concurrentes; trastornos hipertensivos del embarazo; embarazo ectó- pico; hemorragia obstétrica y embolias. A su vez, el análisis por edad muestra que la razón de mortalidad materna asociada a enfermedades concurrentes, hipertensión arterial, aborto y hemorragia posparto aumenta en los extremos de edad materna, siendo mayor en el quinquenio superior[3]. Determinando así, la preeclampsia, una mayor morbimortalidad, número de ingreso a UCI y los consecuentes costes económicos que conlleva su atención.
Producto de los cambios anatómicos y fisiológicos que ocurren durante el embarazo y considerando que los problemas cardiovasculares asociados con la preeclampsia se observan tanto antes como después del embarazo, es razonable suponer que el sistema cardiovascular puede no ser sólo víctima, de una teórica inadecuada placentación en la preeclampsia, sino que en realidad, desempeña un papel fundamental en la patogénesis de la misma, es así como estudios recientes han investigado la asociación entre el sistema cardiovascular y la preeclampsia, en un esfuerzo por construir una hipótesis general para explicar la fisiopatología del trastorno[4].
En esta revisión, resumimos la evidencia con enfoque en las implicaciones clínicas de la asociación de la preeclampsia con el sistema cardiovascular, su impacto hemodinámico y la relevancia que tiene para el anestesiólogo en el enfrentamiento perioperatorio de estas pacientes.
Cambios cardiovasculares del embarazo: desde la fisiología de la gestación normal a la fisiopatología de la preeclampsia
El sistema cardiovascular presenta cambios considerados fisiológicos durante la progresión del embarazo que lo preparan para aumentar su gasto cardíaco, disminuir las resistencias vasculares sistémicas y preparar la hemodinamia materna para asimilar un nuevo lecho vascular, como el placentario, tolerar el influjo hormonal sobre el tono vascular y así compensar las pérdidas hemáticas durante parto[5].
Es en este contexto, es que resulta útil analizar la interacción entre la presión y el volumen del ventrículo izquierdo (VI) para entender el comportamiento del corazón de una mujer gestante sana. Inicialmente la distensibilidad del VI es semejante a la de una paciente no gestante. Sin embargo, durante el embarazo, la válvula mitral se cierra con un volumen de fin de diástole que es 40% mayor que en una paciente no embarazada. Además, la apertura de la válvula aórtica se produce a una presión más baja que en la paciente no embarazada debido a una menor resistencia vascular sistémica, mecanismo mediado por hormonas como la progesterona y estrógenos que en circulación materna, provocan dilatación periférica, un aumento en la actividad de la sintetasa de óxido nítrico (NO) y una disminución del 50% en la actividad del eje renina-angiotensina-aldosterona, lo cual determina el estado de vasodilatación propio del embarazo y un consecuente aumento del gasto cardíaco. Es importante destacar que el volumen telesistólico no se modifica, lo que significa que el aumento en el gasto cardíaco se debe a un mayor volumen eyectivo (± 25%) y una mayor frecuencia cardíaca (± 25%). Estos cambios se producen paulatinamente durante el avance del embarazo, por lo que ocurre un estiramiento crónico de las fibras musculares, lo cual no aumenta la contractilidad miocárdica como si ocurre durante una condición aguda en la cual un mayor estiramiento aumenta la contractilidad miocárdica según la ley de Frank Starling. Todos estos cambios hacen que, durante el período gestacional, la paciente dependa del gasto cardíaco para mantener su presión de perfusión[5].
Por otra parte, entender el rol endotelial es importante para comprender la fisiopatología del cuadro, es así como el endotelio normal responde al roce tangencial del flujo sanguíneo (shear stress) y protege a lo largo de la vida de la ateroesclerosis y sus complicaciones clínicas a través de la síntesis y liberación óxido nítrico, y de factores vasoactivos relacionados que actúan sobre lumen vascular previniendo la agregación de plaquetas sobre la íntima, reduciendo la infiltración de monocitos y la acumulación de lípidos y sobre la media relajando el musculo liso, previniendo su proliferación y la fibrosis intersticial[6]. En presencia de un endotelio reactivo la remodelación de las arterias espirales uterinas está precondicionada por el trofoblasto extravelloso que las aproxima liberando factores vasoactivos, la transforma antes de invadirla (priming), luego remplaza su capa muscular, alcanza el lumen endotelial y las convierte en vasos saculares que proveen una perfusión placentaria adecuada. El índice de pulsatilidad de arterias uterinas a las 23 semanas refleja la calidad de esta remodelación (adecuada o deficiente de las arterias espirales) y supera la sensibilidad de los marcadores de estrés oxidativo y de disfunción endotelial para predecir PE[6].
La disfunción endotelial, caracterizada por una reducción de la vasodilatación mediada por flujo, se convirtió en el factor central de la PE cuando Roberts, Taylor y cols.[7]y Redman y cols.[8], demostraron que la PE tiene dos etapas, por un lado, la remodelación deficiente de las arterias espirales que lleva a perfusión placentaria reducida, seguida del síndrome clínico provocado por injuria endotelial tanto por factores antiangiogénicos como por factores citotóxicos, inflamatorios, oxidativos e inmu- nológicos y, por otro lado, la isquemia/reperfusión placentaria y un probable efecto mecánico del flujo de sangre que ingresa al espacio intervelloso, desde las arterias musculares. Una revisión reciente estima que la preeclampsia temprana y la tardía representan extremos de un espectro, atribuyéndose el comienzo precoz a un defecto de la placentación y el comienzo tardío a cambios oxidativos de la placenta inducidos por el desequilibrio entre la perfusión materna y los requerimientos fetoplacentarios, unido a la predisposición materna, determinando distintos fenotipos de una misma enfermedad[9].
La pérdida de la función de barrera y vasodilatadora del endotelio es prevalente en la PE e implica distintas etapas de la enfermedad. Los cambios hemodinámicos que acompañan a la integridad comprometida de la unión endotelial, específicamente aquellos relacionados con la vasopresina, pueden preceder a los fallos tempranos en el desarrollo placentario. En la PE de inicio tardío, el daño endotelial puede hacer que la madre sea incapaz de amortiguar las señales neuroendocrinas de estrés derivadas del trofoblasto que se acumulan a lo largo del embarazo, pudiéndose estimar que los defectos vasculares de la preeclampsia en etapa tardía parecen dirigirse al endotelio en ciertos lechos vasculares. Esto se describe en distintos estudios que demuestran una capacidad restringida de la relajación del endotelio, demostrando así, una respuesta hemodinámica distinta del endotelio del músculo liso vascular de una paciente gestante preeclamptica, de una no preeclamptica y de una paciente no embarazada[6].
Durante el embarazo, se produce una expansión del volumen plasmático materno que comienza en el primer trimestre y continúa hasta aproximadamente las 32 semanas, lo que es esencial para el desarrollo fetal. Sin embargo, en mujeres con PE esta expansión se ve afectada y se produce una caída del volumen intravascular a pesar de que se sostenga una macrohe- modinamia. Este fenómeno es consecuencia de un leak capilar que conduce a una hipovolemia con la consecuente respuesta neurohormonal que explica los niveles más altos de vasopresina plasmática, lo cual fundamenta los distintos fenotipos maternos y placentarios típicos de este síndrome, pudiendo ser utilizada como un biomarcador temprano[10]. Además, de las sustancias vasodilatadoras como el óxido nítrico, los péptidos vasoconstrictores angiotensina II y endotelina-1 también juegan un papel en la fisiopatología de la preeclampsia. Aunque la an- giotensina II ejerce efectos contráctiles en las células musculares lisas vasculares, también puede actuar en las células endoteliales, promoviendo la síntesis de prostaciclina y la activación del mRNA de endotelina. Durante el embarazo las mujeres con PE tienen una sensibilidad aumentada a la angiotensina II y niveles circulantes disminuidos. La mayor sensibilidad a la angiotensina II persiste después del parto, junto con la disfunción microvascular, y los bloqueadores del receptor de angiotensina II facilitan la vasodilatación en este grupo de pacientes. A su vez, la endotelina-1 es un fuerte regulador del tono vasomotor y por lo tanto, de la respuesta hemodinámica, pudiendo afectar la perfusión uteroplacentaria en la paciente preeclamptica. Todos estos cambios descritos son iniciados antes de la etapa clínica de la enfermedad[10].
-
El corazón de la paciente preeclamptica
Como se describe previamente, los cambios hemodinámicos propios del embarazo alcanzan su punto máximo durante la mitad del tercer trimestre, luego el gasto cardíaco comienza a disminuir y la resistencia vascular sistémica aumenta hacia la semana 40 de gestación. Estos cambios en la hemodinamia, en la etapa tardía del embarazo, son biológicamente paradójicos, ya que las demandas respiratorias y metabólicas de la unidad materno-fetal aumentan exponencialmente con la progresión
de la gestación. Estudios ecocardiográficos de embarazos normales y sin complicaciones han demostrado un aumento de la masa del ventrículo izquierdo y remodelación incluso llegando a alteración de la relajación ventricular, sin significación patológica, que no es evidente de forma clínica y que está asociada en una proporción pequeña pero significativa de mujeres a término, todos los cuales revierten a la normalidad después del parto. Por esta razón, se ha descrito al embarazo como una prueba de estrés para el corazón de las gestantes[11].
Por otra parte, los estudios de ecocardiografía materna en la PE, han demostrado una disfunción cardíaca significativa tanto antes como en el momento del inicio clínico de esta. Va- lensise y cols.[12], demostraron por primera vez que el gasto cardíaco es significativamente menor en la PE de inicio temprano (< 34 semanas) en comparación con la PE de inicio tardío (> 34 semanas). Sus hallazgos fueron posteriormente confirmados y ampliados por el trabajo de Melchiorre y cols.[13], quienes mostraron que la PE también determina una geometría cardíaca anormal con la consecuente alteración de la relajación ventricular en la mayoría de ellas, con la consecuente disfunción diastólica en el 40% de las pacientes preeclampticas. Este hecho explica la poca tolerancia que tienen a cargas rápidas de volumen, determinando aumentos de los marcadores clínicos y de laboratorio sugerentes de aumento del agua libre extravascular pulmonar, congestión e incluso edema pulmonar agudo de no ser juicioso con la volemización.
Es en este contexto, complejo desde el punto de vista fisio- patológico es que, como especialistas en la asistencia clínica de la mujer gestante, tanto sana como enferma desde el inicio al fin del embarazo, incluyendo el puerperio, se hace necesario contar con apoyo en la toma de decisiones durante momentos críticos y así poder impactar aumentando la sobrevida de la paciente gestante con alguna patología grave. Siendo la ecocardiografía al lado del paciente y sus distintos protocolos; tanto cualitativos como cuantitativos, una atractiva y útil herramienta en estos escenarios.
-
Función diastólica
La función diastólica es uno de los elementos clínicos y ecocardiográficos más importantes de evaluar en una paciente preeclamptica. Se puede observar en la mitad de las pacientes sintomáticas que padecen dicha enfermedad. No solo condiciona una alteración en la relajación de la fibra miocárdica, sino que una tolerancia disminuida a las cargas rápidas de volumen. Considerar este hecho es de suma importancia y sugerimos buscar signos ecográficos en la paciente preeclamptica con el doppler pulsado (DP) transmitral y el doppler tisular de las paredes de ambos ventrículos (e> < 14) cm/s. Los rasgos distintivos en comparación con un embarazo normal incluyen también como característica recurrente encontradas; el grosor de la pared del ventrículo izquierdo > 1,0 cm, la relación E/e’ alterada, alteración del DP de las venas pulmonares y del DP transmitral con sus patrones patológicos característicos.
En un estudio cohorte heterogénea, las mujeres con preeclampsia presentaron niveles más elevados de presión sistólica en la arteria pulmonar (RVSP), disminución en la fracción de acortamiento longitudinal global del ventrículo derecho (RVLSS), aumento del tamaño de la aurícula izquierda, relajación cardíaca anormal del ventrículo izquierdo, aumento del
Tabla 1. A) Parámetros ecocardiográficos clínicamente significativos durante el embarazo normal y en paciente preeclamptica
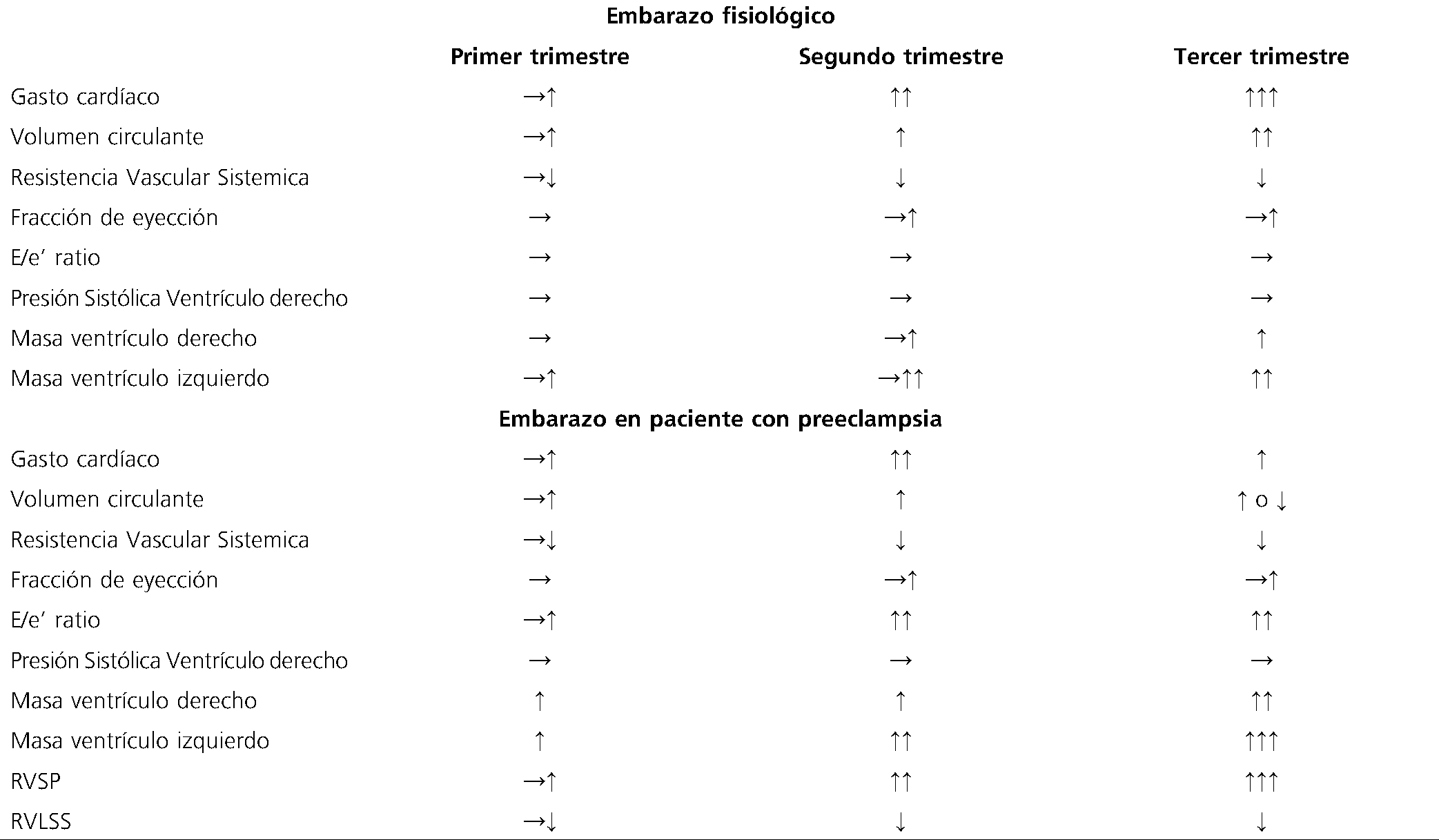
RVSP: presión sistólica en la arteria pulmonar; RVLSS: Fracción de acortamiento longitudinal global del ventrículo derecho.
grosor de la pared del ventrículo izquierdo y aumento de las presiones de llenado de este.
La reducción del volumen sistólico, la disfunción diastólica y la remodelación del ventrículo izquierdo son más marcados en la PE grave y de inicio temprano, y se asocian con resultados maternos y fetales adversos, independientemente de la clasificación convencional, basada en la gravedad clínica o la edad gestacional de inicio (Tabla 1)[11].
-
Efectos en la función sistólica en la preeclampsia
Algunos estudios han informado una disfunción sistólica del ventrículo izquierdo (VI), mientras que otros han encontrado resultados dispares[14]por lo tanto, estos hallazgos no son consistentes y deben ser evaluados paciente a paciente, lo concreto es que si dentro de la evaluación clínica y ecocardiográfi- ca de la paciente preeclamptica observamos caídas persistentes del gasto cardíaco y de la fracción de eyección asociados a la contractilidad miocardicardica, debemos sospechar otro tipo de miocardiopatía estructural aislada o concomitante, como por ejemplo, la miocardiopatía periparto. La función sistólica del ventrículo derecho (VD) a través de la medición de TAPSE y s’, se ha reportado disminuida en algunas publicaciones si bien la fracción de eyección (FE) del VD se mantiene dentro del rango normal. Esto se explicaría desde el punto de vista teórico por la poca tolerancia la fibra muscular del ventrículo derecho a los cambios de presión intracavitarios mediados por sustancias vasoconstrictoras que se encuentran elevadas en la PE, siendo
la hipertensión pulmonar, con sus distintas presentaciones, el diagnóstico principal a descartar[14].
Descripción Tabla 1. Se muestran los principales cambios ecocardiográficos de la paciente gestante sana y con PE, destacando la alteración característica de la masa del VI y de la relajación ventricular que se observa de forma predomínate en la gestante preeclamptica a diferencia de la embarazada sana, esto condiciona el delicado equilibrio en cuanto a la tolerancia a cargas rápidas de fluidos a pesar del intravascular disminuido característico de esta enfermedad.
-
Manejo anestésico periparto
Es importante recalcar al anestesiólogo como un profesional formado para una visión integral de los procesos que involucran el periparto, siendo fundamental el hecho de realizar una visita preanestésica y acompañar desde su ingreso al centro de salud, a la paciente embarazada que finaliza su gestación, es relevante considerar que para las pacientes preeclampticas, debido a la complejidad de su condición, este hecho cobra aun mayor relevancia. Sin embargo, el manejo debe ser multidisciplinario, con un plan de atención continua desde la sala de parto hasta la unidad de paciente crítico, aumentando así la probabilidad de un buen desenlace. Actualmente, se recomienda como objetivo mantener una presión arterial (PA) de 135/85 mmHg o menos. Cuando la PA se encuentra entre 140/90 y 159/109 mmHg, se pueden utilizar tratamientos con labetalol, nifedipino, metildo- pa, urapidil, aunque no hay suficiente evidencia para favorecer
un agente sobre los demás. Teórica y fisiopatológicamente la ecocardiografía al lado del paciente nos puede ayudar en la decisión de elegir el mejor fármaco antihipertensivo según los hallazgos encontrados optimizando así la terapia a las necesidades de la gestante y la tolerancia a los cambios bruscos en la precarga. El manejo de la hipertensión severa es particularmente relevante en el caso de necesitar realizar anestesia general con intubación traqueal debido a que la respuesta hipertensiva a la laringoscopia en presencia de una PA no controlada puede aumentar aún más el riesgo de hemorragia intracraneal[15].
Con respecto a la analgesia durante el trabajo de parto, se recomienda usar una técnica neuroaxial de forma precoz, disminuyendo así el efecto del dolor descontrolado sobre la presión arterial, esto ha sido ampliamente respaldado en guías clínicas y protocolos. También, hay que considerar que estas pacientes pueden tener asociado trombocitopenia, por lo que, se debe hacer una evaluación previa considerando el riesgo de desarrollar un hematoma epidural, aún siendo esta complicación muy infrecuente.
En caso de existir indicaciones maternas o fetales, puede ser necesario realizar una cesárea de urgencia, en ausencia de contraindicaciones se prefiere la anestesia neuraxial. Pueden ocurrir cambios relativamente pequeños en las variables he- modinámicas durante la inducción de la anestesia espinal en mujeres con PE severa en comparación con mujeres sanas que están en trabajo de parto[16], en casos en que se necesite tratamiento para la hipotensión, la fenilefrina es de elección por sobre la efedrina, ya que tiene un efecto menos perjudicial en el pH del cordón umbilical[17]y en casos de preeclampsia severa de inicio temprano con función ventricular preservada, también es de elección debido a su capacidad para restaurar la resistencia vascular sistémica y el gasto cardíaco a dosis relativamente más bajas, la noradrenalina asoma como una interesante droga vasoactiva aún con una función ventricular deprimida, ya que restaura en forma adecuada el acoplamiento ventrículo-arterial, manteniendo así la hemodinamia materna y consecuentemente la perfusión uteroplacentaria[18]. Se debe recurrir a la anestesia general cuando la neuroaxial está contraindicada o en caso de sufrimiento fetal en el contexto de una cesárea categoría 1 del Royal College, en estos casos reiteramos hacer especial énfasis en el manejo de la presión arterial para atenuar la hiperreac- tividad a la laringoscopía con la complicación subsecuente de hemorragia intracraneal[15].
Habiendo entendido la fisiopatología de la PE previamente, se explica el riesgo aumentado de edema pulmonar en estas pacientes, por lo que el manejo de fluidos debe ser juicioso. En la paciente con preeclampsia severa, la alteración del endotelio vascular, la alteración de la función renal, el estado intravascular con tendencia a la hipovolemia, y la alteración de la relajación ventricular, genera una condición clínica en la cual es extremadamente difícil y arriesgado tomar decisiones solo con la clínica. En este contexto la ecocardiografía al lado de la paciente y los monitores de GC mínimamente invasivos, ofrecen elementos fundamentales en la toma de decisiones clínicas, frente a una paciente con inestabilidad hemodinámica, considerando el impacto negativo que tiene sobre este grupo de pacientes una volemización no controlada[19],[20],[21]. Si asociamos la ecografía pulmonar, en búsqueda de líneas B, nos refuerza el diagnóstico diferencial con tromboembolismo pulmonar lo que cobra especial importancia en la paciente con preeclampsia se
vera con inestabilidad hemodinámica que presenta disnea asociada al cuadro.
Después del parto, los síntomas de la preeclampsia desaparecen simultáneamente con una reducción en el volumen sistó- lico, el GC y la presión arterial media. Estos síntomas y signos regresan a los rangos normales del embarazo dentro de los 3 a 4 días, pudiendo extenderse hasta 15 días excepto la resistencia vascular total y la presión arterial media, que siguen siendo significativamente más altas en comparación con los controles. Aproximadamente, el 50% de las mujeres tienen hipertensión persistente y tasas aumentadas de hipertensión nocturna, ambulatoria y enmascarada a las 12 semanas posparto. El riesgo de hipertensión crónica es más alto en los primeros años después del parto y es mayor en mujeres jóvenes que en mujeres mayores[11].
-
Conclusión
El conocimiento de la fisiopatolgía, el diagnóstico y manejo temprano de la preeclampsia son fundamentales para iniciar intervenciones terapéuticas oportunas. La ecografía es una ayuda fundamental en la evaluación de la función cardíaca y la hemodinamia materna de forma de asegurar el flujo sanguíneo uteroplacentario y la detección de signos tempranos de deterioro fetal. La ecografía pulmonar puede detectar el desarrollo de edema pulmonar y facilita el manejo de líquidos de forma más precisa.
El manejo efectivo de la preeclampsia requiere un enfoque multidisciplinario, siendo la colaboración y comunicación entre los tratantes, clave para la planificación de estrategias terapéuticas individualizadas. El anestesiólogo debe considerar y manejar la fisiopatología de la enfermedad junto a la repercusión cardiovascular y hemodinámica, considerando que el manejo adecuado de la hipertensión, el uso juicioso de fluidos, la elección de agentes vasoconstrictores y el monitoreo hemodiná- mico son aspectos clave en el abordaje exitoso de la gestante preeclamptica.
Referencias
1. Girotra V, Mushambi M. Cuidado crítico materno. 2013; Tutorial 310. University Hospitals, Leicester, UK.
2. Hofmeyr R, Matjila M, Dyer R. Preeclampsia in 2017: Obstetric and Anaesthesia Management. Best Pract Res Clin Anaesthesiol. 2017 Mar;31(1):125–38. https://doi.org/10.1016/j. bpa.2016.12.002
3. Héctor J, Lacassie HJ, Cárdenas A. Anestesia para emergencias en obstetricia. Revista Chilena de Anestesia. 2021;50(1): https://doi.org/10.25237/revchilanestv50n01-12.
4. Thilaganathan B, Kalafat E. Cardiovascular system in preeclampsia and beyond. Hypertension. 2019 Mar;73(3):522–31. https://doi.org/10.1161/HYPERTENSIONAHA.118.11191 PMID:30712425
5. Fuentealba Ramírez R, Bravo Pérez L. Inestabilidad hemodinámica en obstetricia. Revista Chilena de Anestesia. 2022;51(6):636–42. https://doi.org/10.25237/revchilanestv5127091639 .
6. Valdés SG. Preeclampsia y enfermedad cardiovascular: un Enfoque Integral Para detectar Las fases subclínicas de complicaciones obstétricas y cardiovasculares. Rev Chil Obstet Ginecol. 2020;85(2):185–200. https://doi.org/10.4067/S0717-75262020000200185.
7. Roberts JM, Taylor RN, Musci TJ, Rodgers GM, Hubel CA, McLaughlin MK. Preeclampsia: an endothelial cell disorder. Am J Obstet Gynecol. 1989 Nov;161(5):1200–4. https://doi.org/10.1016/0002-9378(89)90665-0 PMID:2589440
8. Redman CW, Sacks GP, Sargent IL. Preeclampsia: an excessive maternal inflammatory response to pregnancy. Am J Obstet Gynecol. 1999 Feb;180(2 Pt 1):499–506. https://doi.org/10.1016/S0002-9378(99)70239-5 PMID:9988826
9. Burton GJ, Redman CW, Roberts JM, Moffett A. Pre-eclampsia: pathophysiology and clinical implications. BMJ. 2019 Jul;366:l2381. https://doi.org/10.1136/bmj.l2381 PMID:31307997
10. Opichka MA, Rappelt MW, Gutterman DD, Grobe JL, McIntosh JJ. Vascular Dysfunction in Preeclampsia. Cells. 2021 Nov;10(11):3055. https://doi.org/10.3390/cells10113055 PMID:34831277
11. Thilaganathan B, Kalafat E. Cardiovascular system in preeclampsia and beyond. Hypertension. 2019 Mar;73(3):522–31. https://doi.org/10.1161/HYPERTENSIONAHA.118.11191 PMID:30712425
12. Valensise H, Vasapollo B, Gagliardi G, Novelli GP. Early and late preeclampsia: two different maternal hemodynamic states in the latent phase of the disease. Hypertension. 2008 Nov;52(5):873–80. https://doi.org/10.1161/HYPERTENSIONAHA.108.117358 PMID:18824660
13. Melchiorre K, Sutherland G, Sharma R, Nanni M, Thilaganathan B. Mid-gestational maternal cardiovascular profile in preterm and term pre-eclampsia: a prospective study. BJOG. 2013 Mar;120(4):496–504. https://doi.org/10.1111/1471-0528.12068 PMID:23190437
14. Vaught AJ, Kovell LC, Szymanski LM, Mayer SA, Seifert SM, Vaidya D, et al. Acute cardiac effects of severe pre-eclampsia. J Am Coll Cardiol. 2018 Jul;72(1):1–11. https://doi.org/10.1016/j.jacc.2018.04.048 PMID:29957219
15. Russell R. Preeclampsia and the anaesthesiologist: current management. Curr Opin Anaesthesiol. 2020 Jun;33(3):305–10. https://doi.org/10.1097/ACO.0000000000000835 PMID:32049882
16. Henke VG, Bateman BT, Leffert LR. Focused review: spinal anesthesia in severe preeclampsia. Anesth Analg. 2013 Sep;117(3):686–93. https://doi.org/10.1213/ANE.0b013e31829eeef5 PMID:23868886
17. Heesen M, Rijs K, Hilber N, Ngan Kee WD, Rossaint R, van der Marel C, et al. Ephedrine versus phenylephrine as a vasopressor for spinal anaesthesia-induced hypotension in parturients undergoing high-risk caesarean section: meta-analysis, meta-regression and trial sequential analysis. Int J Obstet Anesth. 2019 Feb;37:16–28. https://doi.org/10.1016/j.ijoa.2018.10.006 PMID:30477997
18. Dyer RA, Daniels A, Vorster A, Emmanuel A, Arcache MJ, Schulein S, et al. Maternal cardiac output response to colloid preload and vasopressor therapy during spinal anaesthesia for caesarean section in patients with severe pre-eclampsia: a randomised, controlled trial. Anaesthesia. 2018 Jan;73(1):23–31. https://doi.org/10.1111/anae.14040 PMID:29086911
19. Van de Putte P, Vernieuwe L, Bouchez S. Point-of-care ultrasound in pregnancy: gastric, airway, neuraxial, cardiorespiratory. Curr Opin Anaesthesiol. 2020 Jun;33(3):277–83. https://doi.org/10.1097/ACO.0000000000000846 PMID:32324656
20. Bajwa SJ, Kurdi MS, Sutagatti JG, Bajwa SK, Theerth KA. Point-of-Care Ultrasound (POCUS) for the assessment of volume status and fluid management in patients with severe pre-eclampsia: A systematic review and meta-analysis. Indian J Anaesth. 2021 Oct;65(10):716–30. https://doi.org/10.4103/ija.ija_820_21 PMID:34898698
21. da Silva WA, Pinheiro AM, Lima PH, Malbouisson LM. Renal and cardiovascular repercussions in preeclampsia and their impact on fluid management: a literature review [English Edition]. Braz J Anesthesiol. 2021;71(4):421–8. https://doi.org/10.1016/j.bjane.2021.02.052 PMID:33845102

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution