Marissa Minutti Palacios MD.1, Gilberto Duarte Medrano MD.2, Diego Escarramán Martínez MD, MSc.3, Gerardo Alberto Solís Pérez4, Jorge Manuel Antolinez Motta5, Manuel Alberto Guerrero Gutiérrez MD6*
Recibido: 01-10-2024
Aceptado: 05-01-2025
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 3 pp. 224-232|https://doi.org/10.25237/revchilanestv54n3-02
PDF|ePub|RIS
State of the art in neuromuscular relaxation, monitoring and antagonism in the perioperative period
Abstract
Annually, more than 10 million patients will experience residual paralysis because of neuromuscular blocking in the perioperative period. Residual neuromuscular block or residual paralysis is a significant problem in anesthetic practice, defined as the presence of muscle weakness with the inability to breathe effectively and protect the airway, leading to pulmonary complications such as desaturation, pneumonia, hypoxia, and death. Currently, it is defined by a TOF ratio < 0.9. Recently, there were no clinical practice guidelines for neuromuscular block monitoring. Today, we have guidelines from the world’s leading societies in anesthesiology and perioperative medicine, published in 2023, recommending the use of quantitative neuromuscular block monitoring and pharmacological antagonism (such as sugammadex and neostigmine), as it has been shown to reduce the risk of residual paralysis and pulmonary complications. However, many anesthesiologists do not use it in their clinical practice due to a lack of understanding of the physiology of neuromuscular blockers and the available methods for measuring stimulation patterns, such as train- of-four (TOF) or post-tetanic count. We systematically searched clinical guidelines for neuromuscular block and reviewed the topic to facilitate its applicability in Spanish-speaking regions.
Resumen
Anualmente más de 10 millones de pacientes tendrán parálisis residual por el uso de bloqueadores neuromusculares en el perioperatorio. El bloqueo neuromuscular residual o parálisis residual es un problema de gran magnitud en la práctica de anestesia, se define como la presencia de debilidad muscular con incapacidad para respirar de manera efectiva y proteger la vía aérea, generando complicaciones pulmonares desde desaturación[] neumonía[] hipoxia y muerte[]. Actualmente, se define por TOF ratio < 0,9. Hasta hace poco, no existían guías de práctica clínica para la monitorización del bloqueo neuromuscular, hoy en día contamos con guías de las sociedades más importantes en anestesiología y medicina perioperatoria mundiales, donde recomiendan el uso de monitorización cuantitativa del bloqueo neuromuscular y del antagonismo farmacológico del mismo (sugammadex y neostigmina), ya que se ha demostrado que disminuye el riesgo de parálisis residual y complicaciones pulmonares. Sin embargo, muchos anestesiólogos en su práctica clínica no lo utilizan por el poco entendimiento de la fisiología de los bloquea- dores neuromusculares y de las alternativas para medir los patrones de estimulación como son el tren de cuatro (TOF) o la cuenta postetánica. Realizamos una búsqueda sistemática de guías clínicas de bloqueo neuromuscular e hicimos una revisión del tema para facilitar la aplicabilidad en habla hispana.
-
Introducción
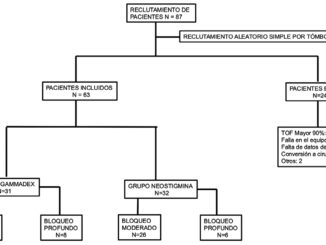
Se realizó una búsqueda sistemática de guías clínicas sobre el término MeSH “Neuromuscular Blockade” en los metabuscadores Cochrane, LILACS, Ovid y PubMed. La estrategia de búsqueda estuvo limitada a artículos publicados en español, con un enfoque en los estudios publicados desde el año 2023 hasta la fecha de la búsqueda, esto por que fue cuando salieron publicadas las nuevas guías de relajación neuromuscular y su monitorización. Se aplicaron filtros de idioma y año de publicación en cada metabuscador para asegurar la inclusión de literatura relevante en español y actualizada sobre el tema. Esta metodología tiene como objetivo identificar guías recientes y en idioma español que aborden el bloqueo neuromuscular, facilitando la consulta y aplicabilidad en contextos de habla hispana. En la Figura 1 se puede observar el PRISMA de la búsqueda realizada por pares en los buscadores.
En Estados Unidos, 30,8 millones de personas al año son llevadas a cirugía con anestesia general y bloqueo neuromuscular. Un tercio de estos pacientes (10,1 millones) tendrán bloqueo neuromuscular residual y el 0,8% de estos tendrán un evento respiratorio crítico (aproximadamente 81.000 pacientes). Extrapolando está estadística a todo el mundo aproximadamente se realizan 234,4 millones de cirugías al año y medio millón de personas tendrían un evento crítico respiratorio asociado a bloqueo neuromuscular residual[4].

Figura 1. PRISMA de la búsqueda de artículos de guías de relajación neuromuscular con la actualización 2023 en español.
-
Farmacología de los bloqueadores neuromusculares
Los bloqueadores neuromusculares se clasifican según el tipo de bloqueo neuromuscular que causan en despolarizantes y no despolarizantes. El único bloqueador despolarizante que tenemos es la succinilcolina, la cual es un agonista en los receptores nicotínicos, causando apertura en los canales iónicos dependientes de voltaje para que estos permanezcan abiertos, ocurriendo despolarización con fasciculaciones, seguida de una parálisis flácida, el efecto es de corta duración (3 a 5 minutos). Los bloqueadores no despolarizantes son antagonistas competitivos en los receptores nicotínicos postsinápticos, impidiendo la función de la acetilcolina, prolongando el bloqueo neuromuscular, se clasifican en dos grupos las benzilisoquinolonas (cisatracurio y atracurio) y los aminoesteroideos (rocuronio y vecuronio)[5] (Tabla 1).
-
Parálisis residual
El bloqueo neuromuscular residual o parálisis residual es un problema de gran magnitud en la práctica de anestesia. La parálisis residual es la presencia de debilidad muscular con incapacidad para respirar de manera efectiva y proteger la vía aérea, generando complicaciones pulmonares desde desaturación[1], neumonía[2], hipoxia y muerte[3]. Actualmente, se define por TOF ratio < 0,9[6].
En el estudio RECITE-US[7], una cohorte multicéntrica, cegada de 255 pacientes en la unidad de cuidados postanestésicos (UCPA), la incidencia de parálisis residual (TOFr < 0,9) fue de 64,7%. El estudio popular[8], realizado en Europa que incluyó más de 20 mil pacientes con diseño multicéntrico, prospectivo y observacional demostró que el uso de bloqueadores neuro- musculares en anestesia general se asocia a complicaciones pulmonares (OR 1,86, IC 95% 1,53-2,26) sin embargo, en este estudio 11.789 pacientes se extubaron con criterios clínicos y solo el 31% de los pacientes se extubaron con monitorización cuantitativa y TOFr > 0,9.
Tabla 1. Clasificación y características de los bloqueadores neuromusculares
| Benzilisoquinolonas | Cisatracurio | Atracurio | Mivacurio |
| Inicio de acción (min) | 1 – 3 | 1 – 1,5 | 2 – 4 |
| Duración (min) | 20 – 50 | 15 – 35 | 8 – 20 |
| Eliminación | Eliminación de Hoffman/Hidrólisis por colinesterasas plasmáticas | ||
| Aminosteroideos | Pancuronio | Rocuronio | Vecuronio |
| Inicio de acción (min) | 4 – 5 | 1 – 3 | 1 – 5 |
| Duración (min) | 180 | 20 – 70 | 30 – 65 |
| Eliminación | Excreción hepática y renal | ||
-
Monitorización de bloqueo neuromuscular durante anestesia general
En la actualidad la monitorización cuantitativa es el mejor y más seguro método para guiar el uso y reversión del BNM. El uso de monitorización de bloqueo neuromuscular durante anestesia general es de difícil acceso, entendimiento y poco apego dentro de los anestesiólogos. En encuestas realizadas a anestesiólogos, en Europa el 19% de los anestesiólogos no usan monitorización de BNM para guiar el uso de bloqueo neuromuscular[9], en Australia y Nueva Zelanda el 11% de los anestesiólogos consideran que no es necesario el uso de moni- torización cuantitativa de BNM[10]. En México en el año 2002, el 98% de los anestesiólogos nunca habían utilizado monitori- zación cuantitativa de BNM[11].
-
Patrones de estimulación
El tren de cuatro (TOF por sus siglas en inglés) representa cuatro estímulos supra máximos a 2 Hz cada 5 segundos.
La cuenta de TOF (TOFc) es una simple cuenta de contracciones musculares que resultan de la estimulación TOF, con un rango de 0 a 4 (0/4 hasta 4/4), y correlaciona con el porcentaje de receptores nicotínicos bloqueados por el BNM, sirve para evaluar bloqueos moderados. Una TOFc de 4 correlaciona con el 70% de los receptores nicotínicos bloqueados.
El TOFr (cociente de TOF o TOF ratio) compara la amplitud entre la cuarta y la primera respuesta al estímulo TOF, presenta desvanecimiento cuando el 4to estímulo empieza a disminuir en amplitud y el TOFr ya es menor a 1, este sirve para evaluar bloqueo residual y guiar la reversión farmacológica[4] (Figura 2).
La cuenta postetánica (CPT) es un estímulo único de 50 a 100 Hz que dura 5 segundos (estímulo tetánico, 250 impulsos) seguido de una pausa de 3 segundos y 20 estímulos consecutivos de 1 Hz, con una duración total de 23 segundos y 265 estímulos. El fenómeno de potenciación postetánica ocurre después de un estímulo tetánico, aumentando la presencia de acetilcolina en la placa neuromuscular y las contracciones subsecuentes, dura 2 a 5 minutos, esto es más útil con TOFC de 0 en bloqueos profundos. El número de respuestas postetánicas es inversamente proporcional al nivel de bloqueo, pocas contracciones indican un bloqueo más profundo[12].
Para evaluar el TOF y la CPT contamos con tres métodos convencionales: aceleromiografía, cinemiografía y electromiografía. Para entender cómo funciona cada método, primero es fundamental recordar fisiológicamente qué estamos midiendo. La electromiografía mide la respuesta eléctrica del músculo, es decir, el efecto del potencial de acción y la despolarización de la membrana muscular, mientras que la aceleromiografía y cine- miografía evalúan contracción muscular[13] (Figura 3).

Figura 2. Patrón de estimulación Train of Four (TOF).

Figura 3. Métodos para monitorizar BNM.
La aceleromiografía (AMG) es la técnica más utilizada en la actualidad, está basada en el principio de la 2a ley de Newton dónde fuerza es igual a masa por aceleración. Por medio del sensor piezoeléctrico de aceleración, que se coloca en el dedo pulgar, el nervio cubital es estimulado y mide la contracción muscular del músculo aductor del pulgar, el movimiento del pulgar genera una corriente eléctrica (voltaje) que es proporcional a la fuerza de contracción[14]. La AMG es fácil de usar, pero requiere que el pulgar este en posición adecuada para permitir que con cada contracción regrese a su posición original, y que la dirección del movimiento sea en horizontal y con la mano en supinación para eliminar el efecto de la gravedad, por lo que su función está limitada cuando el brazo y mano del paciente están aseguradas al costado del paciente durante cirugía.
El fenómeno de desvanecimiento inverso es una característica única de la AMG, en donde el TOF basal medido en ausencia de BNM puede ser mayor a 1,0[13], no se conoce la causa precisa de este fenómeno, se ha atribuido a que el pulgar no regresa a su lugar original con cada estímulo o a idiosincrasia de la tecnología. Este fenómeno puede predisponer a los usuarios de AMG a dudar si el dispositivo funciona de manera correcta, sin embargo, se ha propuesto normalizar el TOF de recuperación con el TOF basal, es decir, si el basal es 147% (1,47%), el TOF de recuperación de 0,9 se divide entre 1,47 (0,9/1,47 = 0,61), por lo tanto, el valor de 0,61 subestimaría la recuperación de parálisis de BNM, requiriendo mayor tiempo para lograr TOFr > 0,9[15].
La cinemiografía también usa un sensor piezoelectrico colocado entre el dedo pulgar e índice, al estimular el nervio cubital y contraer el aductor del pulgar, este sensor se deforma con el movimiento, y la deformación del sensor es proporcional a la fuerza de contracción del pulgar[16]. La cinemiografía tiene la ventaja de no presentar fenómeno de desvanecimiento inverso pero si depende de la impedancia y posición del pulgar[17].
La electromiografía es el método más antiguo para monito- rizar el bloqueo neuromuscular, mide la amplitud de los potenciales de acción musculares calculando intensidad de respuesta, esto refleja objetivamente la respuesta de la unión neuromuscular que es el sitio de acción de los BNM[18]. Tiene la ventaja de no depender de la posición del pulgar, no presenta desvanecimiento inverso, sin embargo, necesita electrodos especiales para su uso. Es el más cercano a la mecanomiografía, que es el estándar de oro, sin embargo, la mecanomiografía no se utiliza en la práctica clínica por ser poco práctica[13].
| Tabla 2. Fases de BNM[19] | |
| Profundidad de bloqueo | Medición cuantitativa |
| Completo (total) | CPT = 0 |
| Profundo | CPT > , TOFc = 0 |
| Moderado | TOFc 1-3 |
| Superficial | TOFr < 0,4, TOFc = 4 |
| Mínimo | TOFr 0,4 – 0,9 |
| Recuperación aceptable | TOFr > 0,9 |
BNM: Bloqueo Neuromuscular; CPT: Cuenta post tetánica; TOF: Train of four (tren de cuatro); TOFr: Train of four ratio; TOFc: Train of four cuenta
-
Fases de bloqueo neuromuscular
La profundidad del BNM se puede definir según TOFr, TOFc y CPT, y cada uno de estas evaluaciones nos ayuda a guiar el BNM en sus diferentes fases, así como la reversión farmacológica (Tabla 2).
-
Bloqueo profundo y completo: TOFc y CPT
Sin la presencia de bloqueodores neuromusculares en los receptores nicotínicos, el TOFc es igual a 4 y el TOFr es igual a 1,0. Al iniciar el efecto del BNM con dosis E95 para intubación, la relajación de los músculos de abdomen superior, la laringe y el diafragma se bloquean completamente (bloqueo completo CPT = 0 o profundo TOFc = 0 y desvanecimiento o CPT > 1) para favorecer las condiciones de ventilación e intubación endotraqueal durante la inducción anestésica. El bloqueo profundo puede mejorar las condiciones de visión del campo quirúrgico, principalmente en cirugía robótica, laparoscópica y en pacientes con obesidad[20].
Durante el bloqueo no despolarizante completo o profundo la CPT es la ideal para medir el nivel de bloqueo cuando la TOFc es 0, es decir cuando no hay respuesta al TOF. La estimulación postetánica aumenta la concentración de acetilcolina de manera transitoria en la terminación presináptica de la placa neuromuscular, por lo tanto, la intensidad de las contracciones subsecuentes aumentan en potencia por el tiempo de potenciación postetánica (2 a 5 minutos). El número de respuestas postetánicas es inversamente proporcional al nivel de bloqueo, pocas contracciones postetánicas indican un bloqueo más profundo, CPT de 0 indica bloqueo completo y > 1 bloqueo profundo. Cuando la CPT es 6 a 8, la recuperación de bloqueo (bloqueo moderado) y obtener una TOFc = 1 está próxima a suceder. Es recomendable esperar al menos un minuto después de una CPT para medir TOF[21].
-
Bloqueo moderado
Este grado se define con TOFc 1 – 3 y es suficiente para realizar la mayoría de las cirugías sin que el paciente se mueva, siempre y cuando el mantenimiento anestésico sea adecuado. Movimientos respiratorios, tos y otros inmovimientos voluntarios se pueden abordar profundizando la anestesia (con propofol, agentes inhalados u opioides), se debe confirmar la profundidad de la anestesia antes de administrar dosis adicionales de BNM para evitar el riesgo de despertar intraoperatorio[22].
-
Bloqueo superficial y mínimo
El bloqueo superficial se define como TOFr < 0,4 y el mínimo como TOFr 0,4 – 0,9, y esto ocurre al regreso del 4to estímulo en la TOFc y desapareción del desvanecimiento[23]. En este grado de bloqueo se pueden presentar diferentes signos y síntomas: con TOFr de 0,40 la capacidad vital está disminuida en promedio 26% (8% – 41%) e incluso mantienen volúmenes tidales casi normales, la capacidad de empuñar la mano está disminuída 80%. TOFr entre 0,6 – 0,8 está asociado a deficiencia para tragar con riesgo de aspiración e incapacidad para proteger vía áera. TOFr de 0,7 la fuerza de agarre de mano está disminuída más de 40% y los pacientes son incapaces para retener un depresor de lengua entre los dientes incisivos[6].
-
Recuperación aceptable de BNM
TOFr > 0,9 es el único valor aceptable para definir recuperación de BNM y disminuir el riesgo de parálisis residual y complicaciones pulmonares, siempre y cuando sea obtenido por EMG o AMG calibrada y normalizada. TOFr < 0,9 es considerado parálisis residual[17].
-
Sensibilidad muscular a los BNM y sitios para monitorizar
Los músculos del compartimento central que incluye músculos de la laringe, diafragma, abdomen superior, corrugador superciliar presentan cierta resistencia al efecto de los BNM, al recibir una gran cantidad de flujo sanguíneo confieren un inicio de acción rápido de los BNM no despolarizantes, con efecto pico limitado y recuperación rápida del efecto. En contraste, los músculos oculares, faríngeos, masetero, geniogloso, aductor del pulgar son más sensibles al efecto del BNM, tienen tiempos de recuperación más lentos. El aductor del pulgar es el sitio de elección para monitorizar de manera cuantitativa el efecto del BNM, estimulando el nervio cubital, ya que se comporta igual que los músculos de la faringe que son los músculos que presentan problemas de debilidad con parálisis residual y atribuyen riesgo de aspiración y obstrucción de la vía aérea[18] (Figura 4).
-
Reversión segura de BNM
La reversión farmacológica de BNM residual se puede hacer con neostigmina y sugammadex y debe guiarse en tiempo real con monitorización cuantitativa de BNM. El estudio REVEAL (retrospectivo, observacional) incluyó 37.882 cirugías donde se usó BNM y evaluaron factores de riesgo para reversión farmacológica. En 24.583 (64,9%) la recuperación de BNM fue espontánea y 13.299 (35,1%) con reversión farmacológica, en el análisis multivariado para reversión la obesidad fue el factor más asociado a reversión farmacológica (OR 3,33 clase II y OR 11,4 clase III), también el estado físico de la ASA (OR 1,47 para ASA III) y comorbilidades como asma, síndrome de apnea obstructiva del sueño (SAOS) y otras enfermedades respiratorias aumentaron las probabilidades de reversión farmacológica 18% (3%-35%), 19% (10%-30%) y 11% (0,1%-23%) respectivamente[24].

Figura 4. Sensibilidad de los músculos al BNM, traducido de Rodney G. Neuromuscular block management: evidence-based principles and practice BJA Education, 24(1): 13e22 (2024).
-
Sugammadex
El sugammadex es una gamma-ciclodextrina que encapsula a los BNM aminoesteroideos, en una relación 1:1 para el rocuronio (rocuronio > vecuronio), tiene poca o nula afinidad para las benzilisoquinolonas. La estructura de la molécula del sugammadex tiene cargas negativas en sus ramas exteriores las cuales atraen la carga positiva de las moléculas aminoesteroideas, facilitando la unión irreversible entre el BNM y el centro lipofílico del sugammadex. El binomio aminoesteroideo – su- gammadex es eliminado posteriormente por la orina[25]. El estudio STRONGER[26], es una cohorte de casos y controles, multicéntrica donde incluyeron a adultos en cirugía no cardíaca donde se usó BNM no despolarizante y evaluaron las complicaciones pulmonares asociadas y reversión farmacológica con sugammadex comparado con neostigmina, en sus resultados encontraron que la reversión con sugammadex se asocia a una disminución de 30% del riesgo de cualquier complicación pulmonar, 45% de neumonía y 55% de falla respiratoria comparado con neostigmina. En el estudio STIL-STRONGER hicieron un análisis secundario del estudio STRONGER en el cual evaluaron a pacientes con factores de riesgo para complicaciones pulmonares posoperatorias y reversión farmacológica de BNM comparando sugammadex vs neostigmina, también se demostró que el sugammadex está asociado a menos complicaciones pulmonares (5,9% vs 2,6%, OR 0,41)[27].
El sugammadex puede revertir cualquier profundidad de bloqueo en poco tiempo (promedio 2 minutos). El bloqueo completo (CPT = 0) se puede revertir con dosis de 16 mg/kg, bloqueo profundo (CPT 1-2) 4 – 8 mg/kg, bloqueo moderado a mínimo (TOFc > 2), 2 mg/kg. Ante un TOFr > 0,9 no es necesario revertir con fármacos. La dosis óptima de sugammadex debe guiarse con TOF en tiempo real[25].
-
Inhibidores de acetilcolinesterasa
La neostigmina es un inhibidor de acetilcolinesterasa, su mecanismo de acción causa que la acetilcolina se hidrolice más lento, aumentando la concentración de acetilcolina en la unión neuromuscular, favoreciendo la concentración de esta sobre el BNM resultando en reversión de la parálisis. Es importante recordar que la reversión farmacológica con acetilcoli- na tiene limitantes, la principal es porque fisiológicamente el bloqueo no despolarizante es competitivo por naturaleza, las moléculas de acetilcolina compiten con las moléculas de BNM para ocupar un receptor postsináptico de la unión neuromuscular. Una vez que la actividad de la acetilcolinesterasa está inhibida en su totalidad, la administración de dosis posteriores de inhibidor de acetilcolinestarasa no tendrán ningún efecto, por consiguiente, existe una concentración máxima de acetil- colina en el receptor, pero no existe límite en la concentración de BNM que puede estar presente en la unión neuromuscular si se administraron dosis grandes de paralizante, y estás moléculas de BNM pueden volver a ocupar los receptores de ace- tilcolina. Por lo tanto, la neostigmina es inefectiva a cualquier dosis durante bloqueos completos y profundos. Para que los inhibidores de acetilcolinesterasa sean efectivos se necesita dos condiciones: que la concentración de acetilcolina sea lo suficientemente alta y que las concentraciones de BNM estén suficientemente disminuidas[4]. La dosis recomendada de neostigmina para TOFr > 0,4 es de 30 mcg/kg, y el tiempo para alcanzar TOFr > 0,9 es en promedio de 10 minutos. Para TOFr < 0,4 con TOFc 1-3 se pueden adminsitrar dosis de 50 mcg/kg, requerirá más tiempo para lograr TOFr > 0,9 de recuperación y siempre debe evaluarse en tiempo real[18] (Figura 5).
Otra limitante de la neostigmina son los efectos adversos en los receptores muscarínicos, principalmente los cardíacos. Al acumularse la acetilcolina, el período refractario efectivo del músculo cardíaco auricular se acorta y el tiempo de conducción del nodo sinusal al nodo auriculoventricular se prolonga, causando bradicardia. Esto se previene con la adminsitración concomitante de anticolinérgicos como la atropina, que compite con la acetilcolina para unirse a los receptores muscarínicos, la atropina bloquea el efecto vagal en los receptores M2 en el nodo sinusal aumentando la frecuencia cardíaca[28]. No hay una recomendación de dosis exacta de atropina a adminsitrar en conjunto con neostigmina, se han descrito dosis desde 10 hasta 30 mcg/kg[29].
-
Monitoreo cualitativo vs cuantitativo y seguridad en reversión de parálisis residual
El monitoreo cualitativo es una forma de monitorización subjetiva, donde visual y táctilmente después de estimular un nervio se evalúa el grado de desvanecimiento o mantenimiento de la respuesta del músculo ante el estímulo. Otra forma de monitoreo cualitativo es por signos clínicos como levantar la cabeza o extremidad por 5 segundos, volumen tidal, fuerza de empuñamiento[30]. Ambas formas de monitoreo cualitativo son erróneas y ponen en riesgo para parálisis residual y complicaciones pulmonares. El volumen tidal normal se puede lograr con TOFr entre 0,4 y 0,8 pero los músculos de la faringe siguen con efecto de BNM y los pacientes tienen riesgo de aspiración y obstrucción de vía aérea[6]. Metaanálisis en red de estudios clínicos que incluyó 53 estudios y 12.664 pacientes concluye que la monitorización cuantitativa supera la monitorización cualitativa y no monitorizar para prevenir parálisis residual con el uso de BNM[31].
-
Guías para monitorización de bloqueadores neuromusculares y antagonismo farmacológico
En la última década estaba disponible un consenso para el uso de bloqueo neuromuscular[23] y en las guías de mo- nitorización en anestesia se comenzó a recomendar el uso de monitoreo de BNM cuantitativo vs cualitativo[32] En 2020, la Sociedad Francesa de Anestesia y Reanimación actualizó las guías que tenían publicadas anteriormente en 1999[33]. Sin embargo, fue hasta 2023 donde la American Society of Anesthesiologists (ASA)[19] y la European Society of Anesthesiology and Intensive Care Medicine (ESAIC)[20], que son los grupos de expertos más importantes en anetesiología a nivel mundial, publicaron guías basadas en la mejor y más actual evidencia para el uso de BNM, monitorización y antagonismo farmacológico. Los cuatro aspectos fundamentales de las guías se resumen en la Tabla 3 y el grado de recomendación según sistema GRADE.

Figura 5. Línea del tiempo desde que se consigue una expresión de 0/4 hasta que se obtiene una reversión de la relajación neuromuscular con un TOFr > 0,9 (o viceversa; desde que se encuentra con un TOFr > 0,9, se le aplica el RNM y se obtiene una cuenta de 0/4). TOFr; Train of Four ratio (Cociente del tren de cuatro por sus siglas en inglés). RNM: relajante neuromuscular.
-
Conclusiones
En la actualidad la evidencia es contundente para utilizar la monitorización cuantitativa de la función neuromuscular durante el uso de BNM y de sus antagonistas farmacológicos. La monitorización cualitativa como el volumen tidal, capacidad para levantar la cabeza o apretar la mano, entre otras, no se recomiendan porque no garantizan reversión completa del BNM, son evaluaciones subjetivas y se han asociado a TOFr < 0,9 y a complicaciones pulmonares. Confirmar un TOFr > 0,9 para ex- tubar de manera segura reduce las complicaciones pulmonares en el perioperatorio y puede impactar en la morbi-mortalidad de los pacientes y cuenta con un nivel de evidencia 1B. La llegada del sugammadex cambió el uso del antagonismo farmacológico, siendo una molécula que permite hacer reversión de bloqueo neuromuscular completo o profundo, sin embargo, los anestesiólogos no debemos confiarnos con solo administrar el sugammadex, la reversión farmacológica también debe ser guiada por monitorización cuantitativa y TOFr.
-
Contribuciones de los autores
MMP; se encargo de la conceptualización de la idea y redacción del manuscrito, GDM, JMAM & DEM; Se encargo de la búsqueda de artículos e información. GASP; Se encargo del diseño de las imágenes. MAGG; Se encargo de la revisión del manuscrito y envío del manuscrito.
Tabla 3. Aspectos fundamentales de las guías 2023
| ASA | ESAIC | |
| ¿Cuándo monitorizar? | Cualquier caso donde se use BNM o antagonismo farmacológico, independiente del tipo de BNM | Cualquier caso donde se use BNM o antagonismo farmacológico, independiente del tipo de BNM |
| Tipo de monitorización | Cuantitativa | Cuantitativa |
| Recomendación (1B) | No se recomienda monitorización clínica o cualitativa | No se recomienda monitorización clínica o cualitativa Recomendación IB |
| TOFr para extubación Recomendación (1B) | > 0,9 con monitorización cuantitativa | > 0,9 con monitorización cuantitativa |
| Sitio de monitorización Recomendación (1B) | Aductor del pulgar | Aductor del pulgar |
| Antagonismo farmacológico | Sugammadex TOFr < 0,4 a partir de bloqueos profundos: recomendación 1B
Neostigmina TOFr > 0,4 (bloqueo mínimo), después de 10 minutos extubar: recomendación 1C |
Sugammadex TOFr < 0,4
Neostigmina TOFr > 0,2, 10 – 15 minutos para extubar: recomendación 1C |
—-
Declaración de conflicto de intereses
Ningún autor reporta conflicto de interés.
Concideraciones éticas
No se necesitó aprobación por comité de ética e investigación al ser un estudio de revisión.
-
Referencias
1. Martinez-Ubieto J, Ortega-Lucea S, Pascual-Bellosta A, Arazo-Iglesias I, Gil-Bona J, Jimenez-Bernardó T, et al. Prospective study of residual neuromuscular block and postoperative respiratory complications in patients reversed with neostigmine versus sugammadex. Minerva Anestesiol. 2016 Jul;82(7):735–42. PMID:26472231
2. Bulka CM, Terekhov MA, Martin BJ, Dmochowski RR, Hayes RM, Ehrenfeld JM. Nondepolarizing Neuromuscular Blocking Agents, Reversal, and Risk of Postoperative Pneumonia. Anesthesiology. 2016 Oct;125(4):647–55. https://doi.org/10.1097/ALN.0000000000001279 PMID:27496656
3. Murphy GS, Brull SJ. Residual neuromuscular block: lessons unlearned. Part I: definitions, incidence, and adverse physiologic effects of residual neuromuscular block. Anesth Analg. 2010 Jul;111(1):120–8. https://doi.org/10.1213/ANE.0b013e3181da832d PMID:20442260
4. Brull SJ, Kopman AF. Current Status of Neuromuscular Reversal and Monitoring. Vol. 126, Anesthesiology. Lippincott Williams and Wilkins; 2017. p. 173–90.
5. Murray MJ, Deblock H, Erstad B, Gray A, Jacobi J, Jordan C, et al. Clinical Practice Guidelines for Sustained Neuromuscular Blockade in the Adult Critically Ill Patient. Vol. 44, Critical Care Medicine. Lippincott Williams and Wilkins; 2016. p. 2079–103. https://doi.org/10.1097/CCM.0000000000002027.
6. Donati F. Residual paralysis: a real problem or did we invent a new disease? Can J Anaesth. 2013 Jul;60(7):714–29. https://doi.org/10.1007/s12630-013-9932-8 PMID:23625545
7. Saager L, Maiese EM, Bash LD, Meyer TA, Minkowitz H, Groudine S, et al. Incidence, risk factors, and consequences of residual neuromuscular block in the United States: the prospective, observational, multicenter RECITE-US study. J Clin Anesth. 2019 Aug;55:33–41. https://doi.org/10.1016/j.jclinane.2018.12.042 PMID:30594097
8. Kirmeier E, Eriksson LI, Lewald H, Jonsson Fagerlund M, Hoeft A, Hollmann M, et al.; POPULAR Contributors. Post-anaesthesia pulmonary complications after use of muscle relaxants (POPULAR): a multicentre, prospective observational study. Lancet Respir Med. 2019 Feb;7(2):129–40. https://doi.org/10.1016/S2213-2600(18)30294-7 PMID:30224322
9. Naguib M, Kopman AF, Lien CA, Hunter JM, Lopez A, Brull SJ. A survey of current management of neuromuscular block in the United States and Europe. Vol. 111, Anesthesia and Analgesia. Lippincott Williams and Wilkins; 2010. p. 110–9. https://doi.org/10.1213/ANE.0b013e3181c07428.
10. Olesnicky BL, Lindberg A, Marroquin-Harris FB, Ren K. A survey of current management of neuromuscular block and reversal in Australia and New Zealand. Anaesth Intensive Care. 2021 Jul;49(4):309–15. https://doi.org/10.1177/0310057X21995498 PMID:34372679
11. Anesthesiology B, Nava-Ocampo AA, Ramírez-Mora JC, Moyao-García D, Garduño-Espinosa J, Salmerón J. BMC Anesthesiology Preferences of Mexican anesthesiologists for vecuronium, rocuronium, or other neuromuscular blocking agents: a survey [Internet]. 2002. Available from: http://www.biomedcentral.com/1471-2253/2/2
12. Viby-Mogensen J, Howardy-Hansen P, Chraemmer-Jørgensen B, Ording H, Engbaek J, Nielsen A. Posttetanic count (PTC): a new method of evaluating an intense nondepolarizing neuromuscular blockade. Anesthesiology. 1981 Oct;55(4):458–61. https://doi.org/10.1097/00000542-198110000-00024 PMID:7294384
13. Radkowski P, Barańska A, Mieszkowski M, Dawidowska-Fidrych J, Podhorodecka K. Methods for Clinical Monitoring of Neuromuscular Transmission in Anesthesiology – A Review. Int J Gen Med. 2024 Jan;17:9–20. https://doi.org/10.2147/IJGM.S424555 PMID:38196564
14. Warner DS, Warner MA, Claudius C, Viby-Mogensen J. Acceleromyography for Use in Scientific and Clinical Practice A Systematic Review of the Evidence. 2008; Available from: http://pubs.asahq.org/anesthesiology/article-pdf/108/6/1117/367687/0000542-200806000-00022.pdf
15. Suzuki T, Fukano N, Kitajima O, Saeki S, Ogawa S. Normalization of acceleromyographic train-of-four ratio by baseline value for detecting residual neuromuscular block. Br J Anaesth. 2006 Jan;96(1):44–7. https://doi.org/10.1093/bja/aei273 PMID:16299046
16. Khandkar C, Liang S, Phillips S, Lee CY, Stewart PA. Kinemyography and electromyography in the hand Comparison of kinemyography and electromyography during spontaneous recovery from non-depolarising neuromuscular blockade. Vol. 44. Anaesth Intensive Care. 2016;44(6):745–51. https://doi.org/10.1177/0310057X1604400618.
17. Murphy GS, Brull SJ. Quantitative Neuromuscular Monitoring and Postoperative Outcomes: A Narrative Review. Vol. 136, Anesthesiology. Lippincott Williams and Wilkins; 2022. p. 345–61.
18. Rodney G, Raju P, Brull SJ. Neuromuscular block management: evidence-based principles and practice. Vol. 24, BJA Education. Elsevier Ltd; 2024. p. 13–22.
19. Thilen SR, Weigel WA, Todd MM, Dutton RP, Lien CA, Grant SA, et al. 2023 American Society of Anesthesiologists Practice Guidelines for Monitoring and Antagonism of Neuromuscular Blockade: A Report by the American Society of Anesthesiologists Task Force on Neuromuscular Blockade. Anesthesiology. 2023 Jan;138(1):13–41. https://doi.org/10.1097/ALN.0000000000004379 PMID:36520073
20. Fuchs-Buder T, Romero CS, Lewald H, Lamperti M, Afshari A, Hristovska AM, et al. Peri-operative management of neuromuscular blockade: A guideline from the European Society of Anaesthesiology and Intensive Care. Eur J Anaesthesiol. 2023 Feb;40(2):82–94. https://doi.org/10.1097/EJA.0000000000001769 PMID:36377554
21. Hakim D, Drolet P, Donati F, Fortier LP. Performing post-tetanic count during rocuronium blockade has limited impact on subsequent twitch height or train-of-four responses. Can J Anaesth. 2016 Jul;63(7):828–33. https://doi.org/10.1007/s12630-016-0619-9 PMID:26920705
22. Pandit JJ, Andrade J, Bogod DG, Hitchman JM, Jonker WR, Lucas N, et al.; Royal College of Anaesthetists; Association of Anaesthetists of Great Britain and Ireland. 5th National Audit Project (NAP5) on accidental awareness during general anaesthesia: summary of main findings and risk factors. Br J Anaesth. 2014 Oct;113(4):549–59. https://doi.org/10.1093/bja/aeu313 PMID:25204697
23. Naguib M, Brull SJ, Kopman AF, Hunter JM, Fülesdi B, Arkes HR, et al. Consensus statement on perioperative use of neuromuscular monitoring. Anesth Analg. 2018 Jul;127(1):71–80. https://doi.org/10.1213/ANE.0000000000002670 PMID:29200077
24. Greco M, Caruso PF, Angelotti G, Aceto R, Coppalini G, Martinetti N, et al. REVersal of nEuromusculAr bLocking Agents in Patients Undergoing General Anaesthesia (REVEAL Study). J Clin Med. 2023 Jan;12(2):563. https://doi.org/10.3390/jcm12020563 PMID:36675492
25. Blum FE, Locke AR, Nathan N, Katz J, Bissing D, Minhaj M, et al. Residual Neuromuscular Block Remains a Safety Concern for Perioperative Healthcare Professionals: A Comprehensive Review. Vol. 13, Journal of Clinical Medicine. Multidisciplinary Digital Publishing Institute (MDPI); 2024. https://doi.org/10.3390/jcm13030861.
26. Kheterpal S, Vaughn MT, Dubovoy TZ, Shah NJ, Bash LD, Colquhoun DA, et al. Sugammadex versus Neostigmine for Reversal of Neuromuscular Blockade and Postoperative Pulmonary Complications (STRONGER): A Multicenter Matched Cohort Analysis. Anesthesiology. 2020 Jun;132(6):1371–81. https://doi.org/10.1097/ALN.0000000000003256 PMID:32282427
27. Colquhoun DA, Vaughn MT, Bash LD, Janda A, Shah N, Ghaferi A, et al.; Multicenter Perioperative Outcomes Group (MPOG) Perioperative Clinical Research Committee. Association between choice of reversal agent for neuromuscular block and postoperative pulmonary complications in patients at increased risk undergoing non-emergency surgery: STIL-STRONGER, a multicentre matched cohort study. Br J Anaesth. 2023 Jan;130(1):e148–59. https://doi.org/10.1016/j.bja.2022.04.023 PMID:35691703
28. Priya Nair V, Hunter JM. Anticholinesterases and anticholinergic drugs. Contin Educ Anaesth Crit Care Pain. 2004 Oct;4(5):164–8. https://doi.org/10.1093/bjaceaccp/mkh045.
29. Mirakhur RK, Dundee JW, Jones CJ, Coppel DL. J Clarke RS. Reversal of Neuromuscular Blockade: Dose Determination Studies with Atropine and Glycopyrrolate Given before or in a Mixture with Neostigmine [Internet]. Available from: http://journals.lww.com/anesthesia-analgesia
30. Naguib M, Brull SJ, Johnson KB. Conceptual and technical insights into the basis of neuromuscular monitoring. Vol. 72, Anaesthesia. Blackwell Publishing Ltd; 2017. p. 16–37. https://doi.org/10.1111/anae.13738.
31. Carvalho H, Verdonck M, Cools W, Geerts L, Forget P, Poelaert J. Forty years of neuromuscular monitoring and postoperative residual curarisation: a meta-analysis and evaluation of confidence in network meta-analysis. Vol. 125, British Journal of Anaesthesia. Elsevier Ltd; 2020. p. 466–82. https://doi.org/10.1016/j.bja.2020.05.063.
32. Klein AA, Meek T, Allcock E, Cook TM, Mincher N, Morris C, et al. Recommendations for standards of monitoring during anaesthesia and recovery 2021: Guideline from the Association of Anaesthetists. Anaesthesia. 2021 Sep;76(9):1212–23. https://doi.org/10.1111/anae.15501 PMID:34013531
33. Plaud B, Baillard C, Bourgain JL, Bouroche G, Desplanque L, Devys JM, et al. Guidelines on muscle relaxants and reversal in anaesthesia. Anaesth Crit Care Pain Med. 2020 Feb;39(1):125–42. https://doi.org/10.1016/j.accpm.2020.01.005 PMID:31926308

 ORCID
ORCID