Nicolás Palacios Calderón1*, Jorman Harvey Tejada Perdomo1, Jesús Hernán Tovar Cardozo1, Carlos Andrés Montalvo Arce2
Recibido: 09-05-2024
Aceptado: 01-09-2024
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 3 pp. 248-254|https://doi.org/10.25237/revchilanestv54n3-05
PDF|ePub|RIS
Hypothermia and anesthesia: from physiopathology to active heating mechanism
Abstract
Body heat loss occurs through radiation (60%), conduction and convection (15%), and evaporation (22%). The absence of measures to counteract this leads to the development of intraoperative hypothermia in patients, defined as a core body temperature below 36°C. Anesthesia disrupts thermoregulation, causing an unrecognized state of hypothermia for the anesthesiologist, which has implications for postoperative complications. These include prolonged effects of anesthetic drugs, impaired coagulation and platelet function leading to increased transfusion requirements, surgical site infections, and extended hospital stays, among others. Even with effective active warming mechanisms, the prevalence of intraoperative hypothermia can reach up to 70%. This article aims to discuss aspects related to central temperature regulation, explain the physiological effects of hypothermia on patients, and outline current measures for temperature management in the operating room.
Resumen
La pérdida de calor corporal es ocasionada por: radiación (60%), conducción y convección (15%) y evaporación (22%). La ausencia de medidas que la contrarresten ocasiona la génesis de la hipotermia intraoperatoria en el paciente, definida por el hallazgo de temperatura corporal menor a 36°C. La anestesia altera la termorregulación y causa un estado inadvertido de hipotermia para el anestesiólogo lo que repercute en complicaciones posoperatorias: prolonga la acción de fármacos anestésicos, la alteración de la coagulación y la función plaquetaria, aumenta el requerimiento transfusional, las infecciones de sitio operatorio y prolonga la estancia hospitalaria entre otros. Incluso con mecanismos de calentamiento activo efectivos, su prevalencia alcanza valores de hasta 70%. Este artículo tiene como objetivo exponer los aspectos relacionados con la regulación central de la temperatura, explicar los efectos fisiológicos que esta ocasiona en los pacientes, e ilustrar las medidas actuales para el control de temperatura en el quirófano.
-
Introducción
La hipotermia posoperatoria es definida como una temperatura central menor a 36°C. Su presentación de forma inadvertida es una de las complicaciones perioperatorias más comunes, con una incidencia que varía del 4% al 70% en adultos que se someten a cirugía de emergencia y electiva. La aparición de esta complicación durante el acto quirúrgico acarrea implicaciones para el paciente en la presentación de un amplio espectro de complicaciones de leves a graves destacándose entre otras: infecciones de sitio operatorio, coagulopatía, alteraciones en la farmacocinética de los medicamentos que son utilizados durante el acto quirúrgico, complicaciones miocárdicas, aumento de estancia hospitalaria y disfunción cognitiva posoperatoria[1]. El presente artículo tiene como objetivo describir la fisiopatología de la hipotermia intraoperatoria asociada a las técnicas anestésicas, además de los mecanismos actualmente disponibles para su mitigación.
-
Metodología
Se realizó una revisión no sistemática en febrero de 2024. Se realizó búsqueda en PubMed, Cochrane, Embase e incluyeron los términos de búsqueda “inadvertent hypothermia, perioperative, force air warming, complications”. Se obtuvo 46 resultados. Por conveniencia se revisaron solo 33 basados en los objetivos de la revisión.
-
Regulación normal de la temperatura
Bajo condiciones normales, la temperatura corporal central se encuentra estrictamente regulada durante el día, con variabilidades que son mayores en el transcurso de la noche. Esta variación de la temperatura corporal central es de al menos 1°C según el ciclo circadiano y en las mujeres también se encuentra influenciada por el ciclo menstrual[2]. Existen 3 componentes principales para el control de la temperatura corporal:
1. Sensación aferente.
2. Regulación central.
3. Defensas autónomas y conductuales.
La sensación aferente involucra una amplia gama de receptores y conjuntos de nervios se encuentran involucrados en la detección periférica de la temperatura. Los Receptores de Potencial Transitorio sensibles a Vallinoides (TRPV 1-4) son canales iónicos activados por el calor y el pH bajo, además de ser estimulados por sustancias como la capsaicina y anandamida; su expresión se produce en el hipotálamo y fibras nerviosas aferentes sensibles al calor. Probablemente, la administración sistémica de agonistas de TRPV1 produzca un efecto hipotérmi- co al actuar sobre las fibras periféricas sensibles al calor y/o las neuronas sensoriales hipotalámicas de orden superior dentro de la vía neural para el calentamiento de la piel.
Los Receptores de Potencial Transitorio sensibles a melas- tina (TRPM8) y el Receptor de Potencial Transitorio sensible a Anquirina (TRPA1) son los otros tipos de receptores involucrados en este proceso, estos activados por el frio; muchos de ellos también se activan por estímulos nocivos. La inhibición de los canales TRPM8 reduce significativamente la percepción del frío e inhibe la termogénesis sin escalofríos en respuesta a la disminución de la temperatura central. Sin embargo, las acciones específicas de varios receptores aún están bajo investigación[3]-[5].
La transmisión de señales termorreguladoras se realiza de forma centralizada a través de vías espinales anteriores, sin embargo, existe un fenómeno redundante en el cual múltiples vías independientes también contribuyen al control de la temperatura corporal.
El control termorregulador central está integrado por el cerebro con especial énfasis en el hipotálamo y la médula espinal. Es allí donde los estímulos de la superficie de la piel, tejidos periféricos, médula espinal e hipotálamo contribuyen de manera similar al control autónomo de la temperatura corporal. Se ha descrito que la temperatura media de la piel contribuye en un 50% a la sensación de confort, con mayor énfasis en la parte superior del tórax y la cara en comparación con otras regiones. El control termorregulador depende de la temperatura central instantánea más que de la tasa de cambio de la temperatura central[6].
Las funciones de termorregulación pueden ser divididas esquemáticamente en respuestas conductuales y respuestas autonómicas. La respuesta conductual es la primera y más poderosa respuesta; incluye acciones que van desde la colocación de ropa y posiciones protectoras hasta la construcción de refugios térmicos y aire acondicionado. Esta respuesta conductual le ha permitido históricamente al ser humano habitar una amplia variedad de entornos ambientales[7].
Por otra parte, las respuestas autonómicas principales de los seres humanos se basan en vasodilatación precapilar y sudoración, vasoconstricción arteriovenosa, y escalofríos[8]. La generación de calor sin escalofrío que es mediada por la proteína desacopladora termogenina es utilizada con preferencia en los lactantes. Esta respuesta en los adultos podría contribuir a la homeostasis energética, ofreciendo un control a largo plazo, por lo cual no es una defensa termorreguladora aguda de importancia. La vasoconstricción con objetivo termorregulador se limita en gran medida a las extremidades con énfasis en manos y pies donde hay mayor presencia de derivaciones arteriovenosas. Estos vasos distales de 100 pm de diámetro transportan 10.000 veces más sangre que los capilares de 10 pm cuando se encuentran dilatados y su valor llega casi a 0 al estar contraídos. Aunque esta respuesta es restringida a manos y pies, genera una afectación en el flujo sanguíneo entero de la extremidad, siendo un mecanismo eficaz para disipar calor cuando están abiertos y limitar la pérdida de calor central cuando están cerrados[2].
Los escalofríos pueden aumentar de forma rápida la tasa metabólica y mantener un aumento de tres veces de esta, durante 3-4 h antes de llegar a la fatiga muscular. Esta respuesta termorreguladora puede ser menos efectiva de lo esperado puesto a que gran parte de la masa muscular se encuentra en las extremidades. Por lo tanto, la respuesta vasodilatadora necesaria para oxigenar los músculos periféricos contrarresta la vasoconstricción termorreguladora y hasta cierto punto permite que el calor metabólico se desplace desde el núcleo hacia los tejidos periféricos y de allí hacia el medio externo[7].
Cada una de las respuestas termorreguladoras tiene una temperatura central desencadenante denominada umbral; el aumento en la intensidad de la respuesta que se denomina ganancia, y por último una intensidad máxima de respuesta. La sudoración y la vasodilatación precapilar generalmente se presentan con la misma temperatura central desencadenante (Figura 1). El umbral de la vasoconstricción suele estar unas décimas de grado por debajo del umbral de sudoración. El umbral de escalofríos suele ser aproximadamente 1°C por debajo del umbral de vasoconstricción. Las temperaturas centrales suelen ser ligeramente mayores en las mujeres que en los hombres y varían alrededor de 1°C según el ritmo circadiano. La termo- rregulación está bien desarrollada al nacer e incluso los bebés
prematuros regulan la temperatura mejor de lo que cabría esperar. Sin embargo, la pequeña masa corporal y la alta relación superficie-volumen hacen que los bebés sean más susceptibles a las perturbaciones ambientales que los adultos. La regulación también se mantiene relativamente bien en las personas mayores, lo que podría deberse a que la regulación conductual compensa la eficacia reducida de las respuestas autonómicas[2].
-
Medición de la temperatura
La medición de la temperatura, su exactitud y precisión son valores dependientes del tipo de instrumento utilizado como del lugar de medición. Los valores de temperatura obtenidos varían constantemente dependiendo del tipo de tejido utilizado; por lo tanto, no existe una temperatura corporal única.
La temperatura corporal central que incluye regiones anatómicas de tronco y cabeza es una zona muy perfundida con un comportamiento relativamente homogéneo. Por otra parte, las extremidades corporales hacen referencia a los compartimientos periféricos y su temperatura suele encontrarse por debajo de la temperatura corporal central. Incluso, la temperatura de la piel varía considerablemente entre regiones dependiendo de la vasoconstricción termorreguladora y su respuesta al medio ambiente expuesto.
Debido a que la temperatura corporal central influye en gran proporción al control termorregulador, se ha estimado que esta es la que mejor caracteriza el estado térmico del paciente. Existen 4 sitios de monitorización de la temperatura corporal central que son intercambiables entre sí y presentan variaciones de pocas décimas de grado. Los lugares de medición son: la arteria pulmonar, el esófago distal, la nasofaringe con la sonda insertada de 10 a 20 cm y la membrana timpánica medida con un termistor de contacto o termopar. Estos sitios acarrean una dificultad y es que en muchos pacientes ninguna de estas mediciones se encuentra disponible[9].
Por tanto, existen otros sitios de monitorización de la temperatura adecuados para uso clínico como son la ubicación sublingual, axilar, frente y medición en vejiga entre otros.
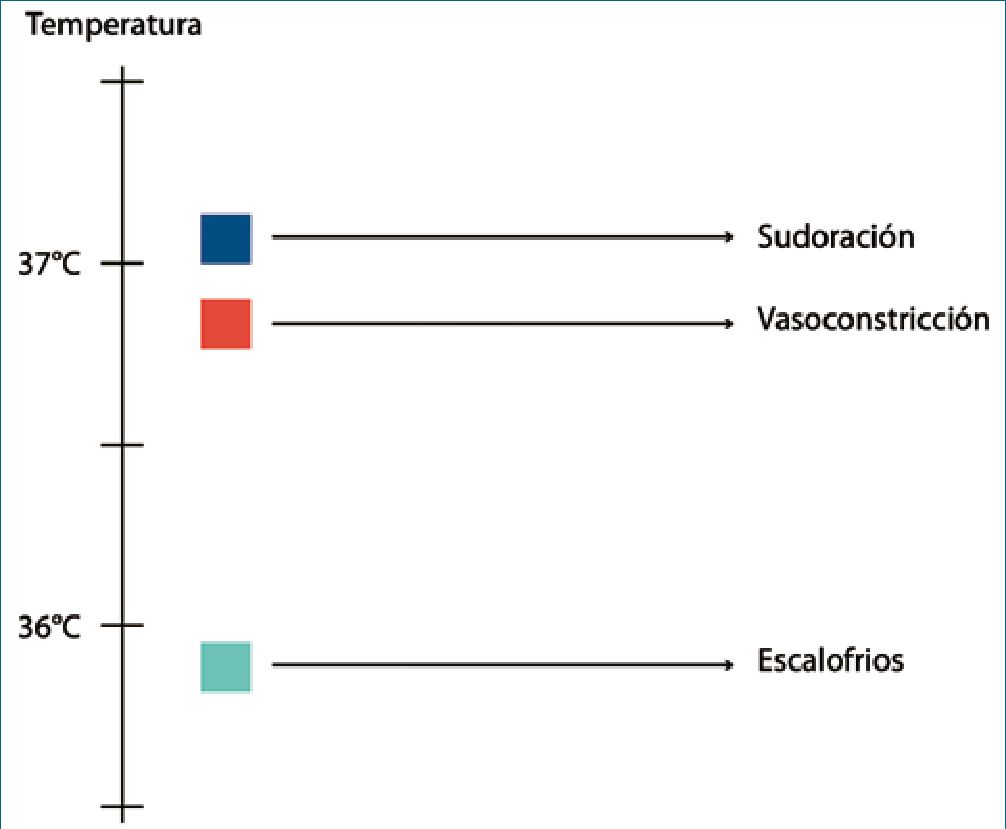
Figura 1.
La medición de la temperatura en la frente presenta menos variaciones que en otras zonas de la piel, sin embargo, es fácilmente influenciable por la temperatura ambiental por lo que puede llegar a encontrarse 5,4-7,2°C por debajo de la temperatura central. La temperatura del canal auditivo externo corresponde a una medición de temperatura cutánea, más que a una medición de la membrana timpánica, aun así, tiene una adecuada correlación con el compartimento central. La axila es un sitio común para la determinación no invasiva de la temperatura, requiere la colocación de la sonda en proximidad a la arteria axilar con el brazo en aducción y, por lo general, es 1,8°C menor que la temperatura corporal. La temperatura rectal se encuentra en desequilibrio con el núcleo y presenta retrasos, alterando la detección de anomalías rápidas, con el riesgo bajo de presentar una perforación rectal. El lugar de medición, más que el dispositivo, casi siempre determina la precisión y exactitud. En la mayoría de los casos la dificultad consiste en conseguir monitores en zonas del cuerpo que representen o estimen razonablemente la temperatura central[2].
-
Cambios fisiopatológicos secundarios a hipotermia
-
Sistema cardiovascular e hipotermia
Desde 1940, se ha estudiado el impacto de las alteraciones de la temperatura corporal en la salud humana. Los trabajos investigativos realizados han demostrado asociación entre la baja temperatura corporal y efectos cardiovasculares adversos. Se ha determinado como regla general un aumento de la mortalidad entre más baja sea una determinada temperatura[10].
Cuando se encuentra la temperatura corporal central a niveles < 36°C, se produce taquicardia y aumento de la poscarga y la resistencia vascular periférica como consecuencia de la activación del sistema nervioso simpático que desencadena niveles elevados de catecolaminas. Los efectos mencionados son transitorios e iniciales, ocasionan aumentos del gasto cardíaco y la presión arterial media; esta respuesta aumenta el consumo de oxígeno y metabólico. A medida en que la temperatura corporal central llega a valores menores de 32°C se produce una mayor depresión de la función cardiovascular. Se ha descrito un aumento en la duración del potencial de acción y especialmente una reducción en el potencial de reposo de las células del sistema His-Purkinje, lo cual reduce el umbral de arritmias auriculares y ventriculares a temperaturas menores de 32°C[11].
Las alteraciones en el automatismo de las células del nódulo sinusal generan como consecuencia una bradicardia fisiológica que es refractaria al uso de atropina, con disminuciones lineales que alcanzan el 50% a los 28°C. A estas temperaturas existe un mayor riesgo de presentación de asistolia y fibrilación ventricular debido a hipovolemia, hipoxia, alteraciones del pH o irritación mecánica[12].
En el electrocardiograma se pueden mostrar alteraciones electrocardiográficas por alteraciones de las corrientes de membrana como influencia de la temperatura sobre estos. Estos patrones consisten en ensanchamientos del complejo QRS, presencia de onda J, inversión de la onda T o prolongación del intervalo QT.
El gasto cardíaco también presenta alteraciones ocasionadas por disminución de la frecuencia cardíaca y aumento de la poscarga, con reducciones de hasta el 45% a 25°C[13]. Al alcanzarse una temperatura corporal central < 24°C, la respuesta vasoconstrictora pierde su efectividad, el paciente se vuelve poiquilotérmico, se produce una progresiva reducción en la presión arterial y una baja perfusión de órganos[14].
-
Sistema hematológico e hipotermia
Durante el proceso que lleva a la hipotermia, se produce inicialmente un desplazamiento hacia la izquierda de la curva de disociación de la oxihemoglobina, lo que expone a las células a mayores niveles de hipoxia. La viscosidad sanguínea aumenta 2% por cada descenso de 1°C en la temperatura central. En condiciones de estrés grave, se produce una respuesta que contrarresta la desviación a la izquierda de la curva de disociación de la oxihemoglobina: como primera medida el metabolismo se convierte en anaeróbico, lo que lleva a presentación de acidosis metabólica, la cual sumada a la hipercapnia que se ocasiona por la hipoventilación, tiene como resultado la desviación hacia la derecha de la curva de disociación de la oxihemoglobina, es decir, se libera mayor cantidad de oxígeno al tejido[15].
La hipotermia conlleva a inhibición de la generación de trombina, alteración plaquetaria, trombocitopenia como consecuencia del secuestro plaquetario en la circulación portal, ocasionando coagulopatía clínicamente significativa a temperaturas menores a 34°C. Por alteración de la funcionalidad enzimática que ocasiona trastornos en los factores de coagulación se produce prolongación del tiempo de protrombina y tiempo de parcial de tromboplastina[16].
-
Infecciones de sitio operatorio e hipotermia
El sistema inmune del hospedero y sus respuestas innatas y adaptativas son las encargadas de evitar la progresión a infección que pueda presentarse en una herida quirúrgica. Se han dilucidado dos mecanismos a través de los cuales la hipotermia perioperatoria altera el sistema inmune del huésped. Primero, como respuesta fisiológica a la hipotermia, se produce una respuesta vasoconstrictora que tiene por objetivo el mantenimiento de la temperatura corporal central. De forma simultánea, esto conlleva a la reducción de la perfusión a los tejidos periféricos, reduciendo al mismo tiempo la presión parcial de oxígeno en dichas regiones. La oxigenación tisular tiene un papel fundamental porque se utiliza como sustrato para la producción de radicales libres de oxígeno y muerte oxidativa de los neutrófilos. De forma secundaria la hipotermia reduce la cicatrización de los tejidos como consecuencia de disminuir la activación del sistema inmunológico y disminuir la activación de macrófagos entre otros grupos celulares[2].
-
Unidad de cuidado intensivo e hipotermia
Un estudio realizado por Kongsayreepong y cols., encontró como predictores de una mayor estancia en la Unidad de Cuidado Intensivo los siguientes:
• Cirugía de emergencia (odds ratio, 6,30; Intervalo de confianza del 95 % (IC 95%)], 2,77 – 14,31).
• Reposición de líquidos > 4.000 ml (odds ratio, 2,54; IC 95%, 1,25 – 5,18).
• No utilizar una técnica de calentamiento de aire forzado (odds ratio, 1,98; IC 95%, 1,05 – 3,72).
• Hipotermia central (temperatura corporal 35,0°C) (odds ratio, 1,63; IC 95%, 0,82 – 3,22). Once pacientes murieron en este estudio, con una tasa de mortalidad total del 6,19%. Siete pacientes (63,6%) ingresaron con temperatura corporal < 36,0°C[17]. Sin embargo, la conclusión no tuvo significancia estadística.
Anestesia e hipotermia
-
Anestesia general
El control termorregulador se encuentra alterado sustancialmente por anestésicos inhalados como sevoflurano, isoflurano, óxido nitroso, hipnóticos como el propofol y los opioides. Ninguno de estos fármacos tiene mayor efecto sobre el umbral de sudoración, pero sí reducen en gran medida y sincrónicamente los umbrales relacionados a la vasoconstricción y los es- calofríos[18],[19]. Las reducciones de los umbrales dependen de la concentración y sus relaciones varían entre fármacos. Las reducciones dependientes de la concentración son lineales para fármacos intravenosos, mientras que para los fármacos inhalados la relación es exponencial.
Con las combinaciones y dosis típicas de fármacos utilizados para la anestesia general, el umbral de vasoconstricción disminuye hasta alrededor de 34,5°C. La consecuencia es que el rango entre umbrales, que normalmente abarca sólo unas pocas décimas de grado, aumenta en un factor de 10 a 20 durante la anestesia general. Por tanto, los pacientes anestesiados son poiquilotérmicos en un amplio rango de temperaturas centrales. Pero cuando la temperatura central excede el umbral de sudoración o disminuye por debajo del umbral de vasoconstricción, los pacientes anestesiados activarán las defensas termorreguladoras.
La ganancia de vasoconstricción es reducida por los anestésicos inhalados, pero el flujo de la derivación arteriovenosa disminuye hasta valores cercanos al cero, es decir, que incluso durante la anestesia general, la respuesta vasoconstrictora termorreguladora restringe efectivamente el calor metabólico al compartimiento central. Durante la anestesia general, el patrón e intensidad máxima de los escalofríos se encuentran atenuados; con el uso de opioides la ganancia se mantiene en su patrón normal. Medicamentos como el midazolam no generan alteraciones apreciables del control termorregulador. La respuesta ocasionada por la anestesia general está entonces enfocada a umbrales reducidos de respuesta a la hipotermia más que a alteraciones propias de los mecanismos de sudoración, vasoconstricción y escalofríos[20].
-
Anestesia neuroaxial
Las técnicas de anestesia neuroaxial previenen la mayor parte de la actividad neuronal aferente y eferente hacia la parte inferior del cuerpo. Los anestésicos locales utilizados en la anestesia neuroaxial alteran el control termorregulador a través de tres mecanismos. Como primer mecanismo, la hipotermia no ocasiona tanta incomodidad térmica como se esperaría en presencia de bloqueos neuroaxiales. Es decir, los pacientes sometidos a técnicas de anestesia neuroaxial no se quejan de sensación de frío, incluso cuando tienen hipotermia[21]. No existe un argumento que aclare el panorama, pero posiblemente el centro termorregulador interpreta la falta de señales tónicas de frío de las piernas como un calor relativo. En segundo lugar, la anestesia neuroaxial altera el control termorregulador central, reduciendo los umbrales de vasoconstricción y escalofríos, aumentando así el rango entre umbrales, además de que el deterioro guarda relación lineal a mayor nivel de bloqueo. Esta alteración debida a la anestesia neuroaxial es menor que la producida por la anestesia general.
Como tercera medida, todas las respuestas termorreguladoras autónomas están mediadas principalmente de manera neural; es decir que la vasodilatación, la sudoración, la vasoconstricción y los escalofríos requieren nervios intactos. La anestesia neuroaxial no sólo bloquea las señales aferentes de dolor, sino también respuestas eferentes encargadas del control de la vasoconstricción y los escalofríos. Por lo que, en caso de ocurrir, la ganancia y la intensidad máxima de las respuestas están reducidas sustancialmente. La consecuencia es que los pacientes que reciben anestesia neuroaxial sufren tanta hipotermia como aquellos que reciben anestesia general para una operación similar[22].
Los bloqueos de nervios periféricos no ocasionan efectos termorreguladores más allá de prevenir respuestas termorreguladoras locales, todas las cuales están mediadas neuralmente[9].
-
Sistemas de calentamiento
-
Calentamiento pasivo
Las técnicas de calentamiento pasivo han sido utilizadas de forma primaria hasta la década de 1990, pasando a un segundo lugar con el auge de técnicas activas de calentamiento que utilizan agua, aire o electricidad como método principal para el calentamiento del paciente. Las técnicas de calentamiento pasivo incluyen el uso de sábanas de algodón y otro tipo de cubiertas, como mantas quirúrgicas, que actúan para minimizar la pérdida de calor corporal mediante un mayor aislamiento[23].
Catorce estudios utilizaron mantas de algodón que informaron temperaturas tan bajas como 35,2 ± 0,5°C al llegar a la unidad de cuidados postanestésicos y cambios de temperatura tan sustanciales como -1,3 ± 0,3°C[24]. En un estudio de adultos mayores, todos los sujetos que recibieron mantas de algodón sufrieron hipotermia con una temperatura inferior a 36°C y el 88% con una temperatura inferior a 35°C. Cuatro estudios evaluaron mantas o trajes reflectantes. Todos los estudios informaron bajas temperaturas, grandes descensos de temperatura o un alto porcentaje de sujetos con hipotermia intraoperatoria inadvertida con el uso de mantas/trajes reflectantes, mantas de algodón y cobertores de sistemas de calentamiento con aire caliente solos sin aire caliente forzado. Incluso en los estudios que no informaron diferencias significativas entre los resultados de calentamiento pasivo y calentamiento activo, el calentamiento pasivo no previno consistentemente la hipotermia intraoperatoria inadvertida[25].
-
Calentamiento activo
Existen dos tipos de técnicas principales de sistemas de calentamiento activo disponibles para la atención de los pacientes: dispositivos de calentamiento con aire forzado o dispositivos de calentamiento por conducción. Además de reducir la pérdida de calor, las técnicas activas de calentamiento de la piel proporcionan calor al paciente a través de diversos medios, incluidos sistemas de aire y agua.
Dispositivos de calentamiento con aire forzado
Los dispositivos de calentamiento de aire forzado fueron el tipo más común de método de calentamiento activo en 2014,
2015 y 2017, y se utilizaron en el 51,1% de los pacientes sometidos a cirugía de fusión espinal posterior en Corea del Sur[26]. Este tipo de dispositivos de calentamiento aspiran aire del entorno y lo calientan a través de bobinas eléctricas. Mediante un soplador se hace circular el aire caliente a través de una manta que calienta a los pacientes por el mecanismo de convección.
Existe información contradictoria sobre el uso de dispositivos de calentamiento con aire forzado y la incidencia de infecciones del sitio operatorio. Diversos estudios han informado que el tipo de dispositivo de calentamiento no afectó significativamente los recuentos bacterianos en ningún sitio de mues- treo en el quirófano[26]. Por otra parte, McGovern y cols.[27], informaron que el calentamiento del aire forzado interrumpe la ventilación de flujo laminar y aumenta significativamente la infección de sitio quirúrgico en pacientes sometidos a cirugías de artroplastia. Aunque las relaciones entre las tasas de infección de sitio operatorio y los dispositivos de calentamiento siguen sin estar claras, pocos estudios han comparado resultados en grandes cantidades de pacientes.
Un estudio realizado por Jun y cols., demostró que la estrategia de precalentamiento con sistemas de calentamiento activo con aire forzado durante 25 minutos se asociaba significativamente con una temperatura central más alta durante el período intraoperatorio y al llegar a la sala de recuperación[28]. Por otra parte, Horn y cols., realizaron un estudio donde alea- torizaron a 200 pacientes programados para cirugías de 30 a 90 minutos de duración bajo anestesia general a diferentes duraciones de precalentamiento. Encontraron cambios significativamente menores en la temperatura central intraoperatoria, la incidencia de hipotermia y escalofríos en las tres estrategias de precalentamiento (10, 20 o 30 minutos con una manta de aire forzado en comparación con los controles que no recibieron estrategias de calentamiento[29].
Según una revisión sistemática Cochrane de 67 ensayos clínicos aleatorios[30], que analizaron diferentes sistemas activos de mantenimiento de la temperatura, el calentamiento por aire forzado parece tener un efecto beneficioso en términos de una menor tasa de infecciones del sitio quirúrgico y complicaciones en comparación con ningún sistema de calentamiento activo.
Se ha descrito como una posible complicación relacionada a los dispositivos de calentamiento con aire forzado la interrupción del flujo de aire filtrado hacia el área de la herida, lo cual puede permitir que partículas de polvo que contienen organismos patógenos entren en contacto con la herida. Debido a que las infecciones de sitio operatorio son relativamente comunes en pacientes sometidos a fusión espinal posterior en comparación con otras cirugías[26], se recomienda que estos pacientes se sometan a calentamiento intraoperatorio con dispositivos que utilizan conducción.
Dispositivos de calentamiento por conducción
Los dispositivos que utilizan conducción implican el uso de láminas de fibras poliméricas conductoras que producen calor y calientan a los pacientes a través de la conducción[31].
Una manta activa autocalentable de un solo uso es una opción para calentar a los pacientes en el período perioperatorio[32]. La manta autocalentable consta de 12 almohadillas térmicas (10-13 cm) que contiene polvo de hierro que se oxida cuando se expone al aire y se produce calor. Las almohadillas térmicas alcanzan una temperatura promedio de 40C° en 30
minutos, con una temperatura máxima de no más de 43°C. La temperatura de las almohadillas se mantiene hasta 10 h. La manta autocalentable ofrece ventajas respecto al método calentamiento por aire forzado en ciertos aspectos importantes. Se destaca que esta no necesita equipo adicional ni corriente eléctrica, es silenciosa, no genera turbulencias de aire y está fácilmente disponible.
La superioridad de la manta autocalentable sobre la ropa hospitalaria estándar se ha informado en otros lugares[33]. Sin embargo, otros ensayos controlados aleatorios que han comparado el uso perioperatorio de la manta autocalentable con la manta calentamiento de aire forzado bajo anestesia espinal o anestesia general han arrojado resultados contradictorios.
Un estudio de no inferioridad elaborado por Lauronen y cols.[32], comparó el uso de sistemas de autocalentamiento y sistemas de calentamiento activo concluyó que ambos métodos fueron efectivos para aumentar la temperatura corporal media durante el precalentamiento. Sin embargo, aunque la manta autocalentable no fue estadísticamente inferior al método calentamiento con aire forzado, la hipotermia fue más frecuente en el grupo de manta autocalentable, lo que requirió calentamiento de rescate.
-
Conclusiones
La hipotermia intraoperatoria inadvertida es un evento perioperatorio de gran transcendencia e impacto en la morbilidad y desenlaces de los pacientes. En la actualidad se dispone de estrategias activas de calentamiento que por sí solas continúan siendo ineficientes en la mitigación de la hipotermia. Las investigaciones a futuro deben ir encaminadas a identificar la mejor estrategia combinada para el control de la hipotermia en el quirófano.
-
Referencias
1. Sun Z, Honar H, Sessler DI, Dalton JE, Yang D, Panjasawatwong K, et al. Intraoperative core temperature patterns, transfusion requirement, and hospital duration in patients warmed with forced air. Anesthesiology. 2015 Feb;122(2):276–85. https://doi.org/10.1097/ALN.0000000000000551 PMID:25603202
2. Sessler DI. Perioperative thermoregulation and heat balance [Internet]. Lancet. 2016 Jun;387(10038):2655–64. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0140673615009812 https://doi.org/10.1016/S0140-6736(15)00981-2 PMID:26775126
3. Feketa VV, Zhang Y, Cao Z, Balasubramanian A, Flores CM, Player MR, et al. Transient receptor potential melastatin 8 channel inhibition potentiates the hypothermic response to transient receptor potential vanilloid 1 activation in the conscious mouse. Crit Care Med. 2014 May;42(5):e355–63. https://doi.org/10.1097/CCM.0000000000000229 PMID:24595220
4. Tayefeh F, Plattner O, Sessler DI, Ikeda T, Marder D. Circadian changes in the sweating-to-vasoconstriction interthreshold range. Pfl gers Archiv European Journal of Physiology [Internet]. 1998 Jan 12;435(3):402–6. Available from: http://dx.doi.org/10.1007/s004240050530
5. Fealey RD. Interoception and autonomic nervous system reflexes thermoregulation. Handb Clin Neurol. 2013;117:79–88. https://doi.org/10.1016/B978-0-444-53491-0.00007-9 PMID:24095117
6. Burke WE, Mekjavić IB. Estimation of regional cutaneous cold sensitivity by analysis of the gasping response. J Appl Physiol (1985) [Internet]. 1991 Nov;71(5):1933–40. Available from: http://www.ncbi.nlm.nih.gov/pubmed/1761494
7. Schlader ZJ, Simmons SE, Stannard SR, Mündel T. The independent roles of temperature and thermal perception in the control of human thermoregulatory behavior. Physiol Behav. 2011 May;103(2):217–24. https://doi.org/10.1016/j.physbeh.2011.02.002 PMID:21315099
8. De Witte J, Sessler DI. Perioperative Shivering Physiology and Pharmacology [Internet]. Vol. 96, Anesthesiology. 2002. Available from: http://pubs.asahq.org/anesthesiology/article-pdf/96/2/467/334558/0000542-200202000-00036.pdf
9. Sessler DI. Temperature monitoring and perioperative thermoregulation. Vol. 109, Anesthesiology. Lippincott Williams and Wilkins; 2008. p. 318–38. https://doi.org/10.1097/ALN.0b013e31817f6d76.
10. Liu C, Yavar Z, Sun Q. Cardiovascular response to thermoregulatory challenges. Vol. 309, American Journal of Physiology – Heart and Circulatory Physiology. American Physiological Society; 2015. p. H1793–812. https://doi.org/10.1152/ajpheart.00199.2015.
11. Roscher R, Arlock P, Sjöberg T, Steen S, Steen S. Effects of dopamine on porcine myocardial action potentials and contractions at 37 degrees C and 32 degrees C. Acta Anaesthesiol Scand. 2001 Apr;45(4):421–6. https://doi.org/10.1034/j.1399-6576.2001.045004421.x PMID:11300379
12. Brown DJ, Brugger H, Boyd J, Paal P. Accidental hypothermia [Internet]. N Engl J Med. 2012 Nov;367(20):1930–8. Available from: http://www.nejm.org/doi/abs/10.1056/NEJMra1114208 https://doi.org/10.1056/NEJMra1114208 PMID:23150960
13. Polderman KH. Of ions and temperature: the complicated interplay of temperature, fluids, and electrolytes on myocardial function. Vol. 17. Crit Care. 2013;17(6):1018. https://doi.org/10.1186/cc13139.
14. Paal P, Gordon L, Strapazzon G, Brodmann Maeder M, Putzer G, Walpoth B, et al. Accidental hypothermia-an update : the content of this review is endorsed by the International Commission for Mountain Emergency Medicine (ICAR MEDCOM). Scand J Trauma Resusc Emerg Med. 2016 Sep;24(1):111. https://doi.org/10.1186/s13049-016-0303-7 PMID:27633781
15. Danzl DF, Pozos RS. Accidental hypothermia [Internet]. N Engl J Med. 1994 Dec;331(26):1756–60. Available from: http://www.nejm.org/doi/abs/10.1056/NEJM199412293312607 https://doi.org/10.1056/NEJM199412293312607 PMID:7984198
16. Watts DD, Trask A, Soeken K, Perdue P, Dols S, Kaufmann C. Hypothermic coagulopathy in trauma: effect of varying levels of hypothermia on enzyme speed, platelet function, and fibrinolytic activity. J Trauma. 1998 May;44(5):846–54. https://doi.org/10.1097/00005373-199805000-00017 PMID:9603087
17. Kongsayreepong S, Chaibundit C, Chadpaibool J, Komoltri C, Suraseranivongse S, Suwannanonda P, et al. Predictor of core hypothermia and the surgical intensive care unit. Anesth Analg. 2003 Mar;96(3):826–33. https://doi.org/10.1213/01.ANE.0000048822.27698.28 PMID:12598269
18. Matsukawa T, Kurz A, Sessler DI, Bjorksten AR, Merrifield B, Cheng C. Propofol linearly reduces the vasoconstriction and shivering thresholds. Anesthesiology. 1995 May;82(5):1169–80. https://doi.org/10.1097/00000542-199505000-00012 PMID:7741292
19. Kurz A, Go JC, Sessler DI, Kaer K, Larson MD, Bjorksten AR. Alfentanil slightly increases the sweating threshold and markedly reduces the vasoconstriction and shivering thresholds. Anesthesiology. 1995 Aug;83(2):293–9. https://doi.org/10.1097/00000542-199508000-00009 PMID:7631951
20. Kurz A, Sessler DI, Annadata R, Dechert M, Christensen R, Bjorksten AR. Midazolam minimally impairs thermoregulatory control. Anesth Analg. 1995 Aug;81(2):393–8. PMID:7618734
21. Leslie K, Sessler DI. Reduction in the shivering threshold is proportional to spinal block height. Anesthesiology. 1996 Jun;84(6):1327–31. https://doi.org/10.1097/00000542-199606000-00008 PMID:8669673
22. Kim JS, Ikeda T, Sessler DI, Turakhia M, Jeffrey R. Epidural anesthesia reduces the gain and maximum intensity of shivering. Anesthesiology. 1998 Apr;88(4):851–7. https://doi.org/10.1097/00000542-199804000-00002 PMID:9579491
23. Zucconi G, Marchello AM, Demarco C, Fortina E, Milano L. Health Technology Assessment for the Prevention of Peri-Operative Hypothermia: Evaluation of the Correct Use of Forced-Air Warming Systems in an Italian Hospital. Int J Environ Res Public Health. 2022 Dec;20(1):133. https://doi.org/10.3390/ijerph20010133 PMID:36612455
24. Butwick AJ, Lipman SS, Carvalho B. Intraoperative forced air-warming during cesarean delivery under spinal anesthesia does not prevent maternal hypothermia. Anesth Analg. 2007 Nov;105(5):1413–9. https://doi.org/10.1213/01.ane.0000286167.96410.27 PMID:17959975
25. Shaw CA, Steelman VM, DeBerg J, Schweizer ML. Effectiveness of active and passive warming for the prevention of inadvertent hypothermia in patients receiving neuraxial anesthesia: A systematic review and meta-analysis of randomized controlled trials. J Clin Anesth. 2017 May;38:93–104. https://doi.org/10.1016/j.jclinane.2017.01.005 PMID:28372696
26. Kim SH, Cha Y, Seok SY, Cho JH, Kim BY, Lee HJ, et al. Relationship Between Types of Warming Devices and Surgical Site Infection in Patients Who Underwent Posterior Fusion Surgery Based on National Data. Neurospine. 2023 Dec;20(4):1328–36. https://doi.org/10.14245/ns.2346846.423 PMID:38369362
27. McGovern PD, Albrecht M, Belani KG, Nachtsheim C, Partington PF, Carluke I, et al. Forced-air warming and ultra-clean ventilation do not mix: an investigation of theatre ventilation, patient warming and joint replacement infection in orthopaedics. J Bone Joint Surg Br. 2011 Nov;93(11):1537–44. https://doi.org/10.1302/0301-620X.93B11.27124 PMID:22058308
28. Jun JH, Chung MH, Kim EM, Jun IJ, Kim JH, Hyeon JS, et al. Effect of pre-warming on perioperative hypothermia during holmium laser enucleation of the prostate under spinal anesthesia: a prospective randomized controlled trial. BMC Anesthesiol. 2018 Dec;18(1):201. https://doi.org/10.1186/s12871-018-0668-4 PMID:30579334
29. Horn EP, Bein B, Böhm R, Steinfath M, Sahili N, Höcker J. The effect of short time periods of pre-operative warming in the prevention of peri-operative hypothermia. Anaesthesia. 2012 Jun;67(6):612–7. https://doi.org/10.1111/j.1365-2044.2012.07073.x PMID:22376088
30. Madrid E, Urrútia G, Roqué i Figuls M, Pardo-Hernandez H, Campos JM, Paniagua P, et al. Active body surface warming systems for preventing complications caused by inadvertent perioperative hypothermia in adults. Vol. 2016, Cochrane Database of Systematic Reviews. John Wiley and Sons Ltd; 2016. https://doi.org/10.1002/14651858.CD009016.pub2.
31. Ousey KJ, Edward KL, Lui S, Stephenson J, Duff J, Walker KN, et al. Perioperative warming therapy for preventing surgical site infection in adults undergoing surgery. Cochrane Database of Systematic Reviews. 2016 Dec 16;2016(12). https://doi.org/10.1002/14651858.CD011731.pub2.
32. Lauronen SL, Kalliovalkama J, Aho A, Mäkinen MT, Huhtala H, Yli-Hankala AM, et al. Self-warming blanket versus forced-air warming blanket during total knee arthroplasty under spinal anaesthesia: A randomised non-inferiority trial. Acta Anaesthesiol Scand. 2023 Sep;67(8):1102–9. https://doi.org/10.1111/aas.14283 PMID:37246242
33. Torossian A, Van Gerven E, Geertsen K, Horn B, Van de Velde M, Raeder J. Active perioperative patient warming using a self-warming blanket (BARRIER EasyWarm) is superior to passive thermal insulation: a multinational, multicenter, randomized trial. J Clin Anesth. 2016 Nov;34:547–54. https://doi.org/10.1016/j.jclinane.2016.06.030 PMID:27687449

 ORCID
ORCID