Ignacio Gericke2, Joel Marchant K.1 Nelson Pulgar2, José Lagos2, Italo Ciuffardi P.3
Recibido: 03-03-2025
Aceptado: 03-06-2025
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 4 pp. 402-411|https://doi.org/10.25237/revchilanestv54n4-09
PDF|ePub|RIS
Postoperative pain management in neurosurgery
Abstract
Postoperative pain is one of the undesirable effects of any surgical procedure. It is one of the humanitarian concerns that attempts have been made to regulate institutionally, highlighting the importance of adequate treatment, agreeing on protocols or recommendations based on current scientific evidence that guide multimodal pain management. Adequate control of postoperative pain in neurosurgery is a challenge for the anesthesiologist
Resumen
El dolor posoperatorio es uno de los efectos indeseables de cualquier procedimiento quirúrgico. Es una de las preocupaciones humanitarias, que se ha tratado de regular institucionalmente poniendo de relieve la importancia de tratar adecuadamente, consensuando protocolos o recomendaciones basadas en la evidencia científica actual, que guíen el manejo multimodal del dolor. El control adecuado del dolor posoperatorio en neurocirugía constituye un desafió para el anestesiólogo.
-
Introducción
Un importante desafío para el neuro anestesiólogo es el manejo del dolor en el paciente neuroquirúrgico, especialmente si se consideran los múltiples factores que caracterizan su complejidad, como son: la monitorización de la fisiología cerebral con sus diferentes variables hemodinámicas, la interpretación de las mismas, y un fino equilibrio para mantenerlas dentro de la normalidad, buscando conservar la integridad de la función cerebral, poder hacer valoraciones neurológicas precoces y frecuentes en el posoperatorio inmediato, tener las menores secuelas posibles con el fin reincorporar a la sociedad un individuo normal y productivo.
En la actualidad se dispone de medicamentos que se utilizan en aras de conseguir este balance y buen resultado, ej.: barbitúricos, opioides, benzodiacepinas, anestésicos locales, halogenados, analgésicos, y otros de reciente utilización y creciente popularidad.
Parte importante del buen desenlace del paciente neuroquirúrgico es el manejo analgésico perioperatorio. Este es un tema controvertido, en el cual se ha logrado desde cierto punto de vista mejorar pero, a pesar del mayor entendimiento que existe acerca de la fisiopatología y la modulación del dolor, su repercusión en los órganos y sistemas y los avances en el desarrollo de nuevas opciones terapéuticas analgésicas multimodales, publicación de guías y lineamientos, persiste la deficiencia en el manejo analgésico general e individualizado de este grupo de pacientes que requieren por un lado la necesidad de evaluar su función neurológica mientras se proporciona una analgesia superior con mínimos efectos secundarios. Tal es la importancia que se le está dando a este aspecto, que en muchos países la lista de verificación de seguridad quirúrgica ha incluido en su cuestionario la disponibilidad para el paciente de un protocolo analgésico antes de abandonar el quirófano. Varias clases de fármacos analgésicos están actualmente disponibles, algunos bajo investigación para su uso como adyuvantes o terapias alternativas.
El dolor, definido como “una experiencia sensorial y emocional desagradable asociada con potencial daño en los tejidos, o descrita en términos de tal daño”[1]. Esta definición reconoce el hecho de que el dolor es una experiencia humana multifactorial con discapacidad física, elementos psicosociales, culturales y religiosos. Implícito en la definición, el dolor es una experiencia subjetiva, no existe una prueba neurofisiológica o química que puedan medir el dolor, por lo tanto, el médico debe aceptar la información de dolor brindada por el paciente[2].
Los estudios de la neurofisiología de dolor han aportado una notable comprensión de la función de la nocicepción en el período perioperatorio. Es un síndrome complejo que causa angustia emocional y física, que se traduce en repercusión fisiológica adversa a varios sistemas y órganos, lo que afecta en última instancia, la recuperación del paciente y el bienestar general. Es evidente que el dolor después de procedimientos neuroquirúrgicos es más severo que lo esperado, lo cual se traduce en un tratamiento subóptimo por parte del equipo[3].
Estudios recientes describen el dolor, después de una craneotomía, de moderado a grave e inadecuadamente tratado en aproximadamente 50% de los pacientes[4].
El dolor severo puede contribuir a complicaciones tales como: disfunción de la coagulación sanguínea, fallo del sistema inmunológico, retención de líquidos, afección en el estado general y el retraso del retorno de la normalidad gástrica y la función del intestino, dolor crónico[35], delirium posoperatorio[36],[5].
Los pacientes neuroquirúrgicos muchas veces requieren frecuentes evaluaciones o exámenes neurológicos, la terapia con opioides para la analgesia posoperatoria típica puede ser inadecuada. El manejo analgésico agresivo posoperatorio puede resultar en un riesgo no deseado de producir sedación excesiva, el cual podría enmascarar nuevos déficits neurológicos. La necesidad de detectar cualquier cambio en el estado mental en el momento oportuno puede eclipsar el tratamiento oportuno de dolor.
Debemos tener en cuenta que algunos pacientes neuroquirúrgicos no pueden ser capaces de comunicar efectivamente su necesidad de analgésicos a causa de alteración del estado mental o déficit neurológico. El dolor posoperatorio mal controlado limita la movilización del paciente, compromete la función pulmonar y aumenta la morbilidad. En estos pacientes, si no se trata el dolor, se puede observar una disminución de la capacidad de participar en los primeros regímenes de rehabilitación y como resultado, un mayor riesgo para desarrollar estasis venosa debido a la inmovilidad, atelectasia, secreciones respiratorias retenidas y neumonía debido a las respiraciones superficiales.
La analgesia preventiva se ha planteado con la finalidad de evitar el desarrollo de la sensibilización central y la incidencia de dolor crónico mediante la administración de analgésicos en el periodo perioperatorio.
Esta modalidad de analgesia busca reducir el dolor posoperatorio y beneficiar la rápida rehabilitación del paciente. Sin una analgesia anticipada la mayoría de los pacientes tendrán dolor severo al despertar y su control será más difícil, como también habrá efectos adversos más frecuentes al requerirse titulaciones rápidas de analgésicos[6].
La analgesia preventiva se define como un tratamiento antinociceptivo que impide el establecimiento de una alteración en el procesamiento central de los impulsos aferentes, que amplifica el dolor posoperatorio.
Para la cirugía mayor se indican técnicas mejor desarrolladas para el control del dolor, como son la técnica epidural o intratecal, los bloqueos regionales continuos y el uso de la analgesia controlada por el paciente (PCA). Con lo anterior se logra una mayor efectividad de la analgesia y se reducen las complicaciones derivadas tanto del dolor severo, como de los efectos adversos de los fármacos analgésicos. La analgesia controlada por el paciente (PCA), es una herramienta útil para la optimización de la analgesia teniendo en cuenta que los requerimientos de opioide son variables, y se evita el retraso indebido en la administración de los mismos, obteniéndose una sensación de control y manejo de su propio dolor por parte de los pacientes[7]. Factores como la edad, el tipo de cirugía, las enfermedades coexistentes, las condiciones sociales y afectivas, modifican la respuesta de cada persona frente a estímulos dolorosos. Esta variabilidad determina que esquemas rígidos de dosis aplicadas por horario, o infusiones fijas de analgésicos, no cumplan con los requerimientos en algunos pacientes, y que estos mismos esquemas causen efectos adversos por sobredosificación en algunos de ellos[7]. El uso del sistema de PCA requiere la completa colaboración del paciente.
En nuestro centro utilizamos desde hace años los bloqueos regionales, como una forma de manejo del dolor posoperatorio y para disminuir el consumo de anestésicos en el período intraoperatorio, por ej. En craneotomías el bloqueo de cuero cabelludo, en fijaciones de columna el uso de bloqueo neuroaxial con morfina+fentanilo+bupivacaína 0,75% hiperbara asociados a Bombas de infusión continua con Ketamina y analgésicos desde inicio cirugía.
-
Alternativas farmacológicas
Debemos familiarizarnos con el uso de medicamentos comunes y de cada clase farmacológica, para usarlos de manera sinérgica siempre que se pueda con los adyuvantes, con monitoreo tanto de la analgesia como de los efectos adversos, y partiendo de un dolor bien controlado, donde se hace una titulación inicial adecuada, para posteriormente solo mantener los niveles analgésicos.
-
Opioides
Los opioides son los fármacos más efectivos para controlar el dolor posoperatorio (POP) por vía sistémica[8]. El mecanismo de acción de los opioides implica la estimulación de receptores p y k situados en el centro (tronco cerebral, el hipotálamo, sistema límbico, sustancia gelatinosa de la médula espinal) y periféricamente (tracto gastrointestinal, receptores periféricos de histamina). Algunos de los efectos secundarios causados por los opioides son mediados principalmente por los receptores situados en la periferia (náuseas, vómitos, prurito). Estos efectos secundarios son dependientes de la dosis[9].
-
Morfina
Es un agonista opioide potente, altamente efectivo en el control del dolor POP. Luego de una dosis IV, su acción inicia a los seis minutos con efecto pico a los diez a veinte minutos. Sus principales metabolitos están provistos de efectos tanto analgésicos como de sedación para el caso de la morfina 6-glucurónido (M6G), y efecto excitatorio y de neurotoxicidad para el caso de la morfina 3-glucurónido (M3G)[10].
-
Metadona
Es un opioide sintético con propiedades agonistas Mu y antagonismo NMDA, además de presentar propiedades inhibitorias de la recaptación de serotonina y noradrenalina a nivel cerebral, de vida media de eliminación prolongada (aproximadamente 24-36 h)[37],[38] con una potencia aproximadamente equivalente a la de la morfina que tras una dosis única proporciona analgesia prolongada, sin presentar una incidencia mayor de depresión respiratoria que otros opioides de menor duración[37]. Luego de una dosis IV, alcanza su efecto analgésico en 5 minutos, que con dosis bajas es de 4-6 h pero puede llegar a 35 h con dosis más altas, mientras su efecto peak de depresión respiratoria se alcanza en 8-10 minutos[38]. Además, la metadona presenta niveles relativamente estables en plasma tras una dosis única, razón por la cual se utiliza en el manejo del síndrome de abstinencia a opioides[38]. El efecto antagonista NMDA podría asociarse a una reducción en la incidencia de dolor crónico posoperatorio, sin embargo, queda por ser demostrado. Su uso es menos generalizado que el de otros opioides, en parte, por el temor que produce su vida media prolongada, aunque es una tendencia que está revirtiéndose, usándose incluso en protocolos ERAS, a medida que se acumula evidencia de que no tendría un perfil de efectos adversos mayor que el de otros opioides[39],[40].
-
Hidromorfona
Es un derivado semisintético de la morfina, con una potencia cinco veces mayor (10 mg de morfina por vía intravenosa es igual a 2 mg de hidromorfona). El comportamiento analgésico es muy similar al de la morfina en términos de calidad, con diferencias en el inicio de acción que es más rápido (cinco minutos), y su duración que es más corta (tres a cuatro horas)[11].
-
Fentanilo
Es un opioide sintético, 100 veces más potente que la morfina y con mayor afinidad que ésta última por el receptor Mu. Tiene un rápido inicio de acción y su efecto pico ocurre a los cinco minutos. Por esta razón es un opioide útil en dolor severo en recuperación postanestésica ya que la titulación puede ser más frecuente y de esta forma lograr controlar el dolor POP en un período de tiempo más corto. También puede ser utilizado en infusión continua sobre todo en unidades de cuidados intensivos[12].
-
Tramadol
Es un fármaco con diversos mecanismos de acción, con menor afinidad por los receptores opioides Mu, delta y kappa, y amplio uso en dolor posoperatorio. El tramadol es un analgésico que está infrautilizado para el manejo del dolor posoperatorio en pacientes de neurocirugía. Se ha usado muy efectivamente para el manejo del dolor posoperatorio en los pacientes después de procedimientos ortopédicos, cardiotorácica y obstétrica para varios años[13]. Ejerce sus efectos analgésicos mediante la inhibición de la recaptación de la serotonina y la norepinefrina, aunque el mecanismo exacto de su efecto analgésico no se entiende completamente. El tramadol no tiene efecto en plaquetas o la función de coagulación, por lo que es un medicamento seguro de usar para los pacientes neuroquirúrgicos después de la craneotomía. También tiene una débil interacción con los receptores opioides que puede conducir a algunos efectos secundarios similares a los de los opioides incluyendo náuseas, vómitos, sequedad de boca y mareos. Rahimi et al., describen el uso de combinaciones atípicas de analgésicos, como son: tramadol 100 mg VO cada 12 h con 1-2 tabletas de opioides – paracetamol (Percocet – oxicodona más acetaminofén) y morfina IV 1-2 mg cada 2 h, para el tratamiento del dolor post-craneotomía proporcionando un mejor control del dolor, menores efectos secundarios asociados con los analgésicos opioides, promueve la ambulación posoperatoria temprana, y reduce los costos totales de hospitalización[24]. Por lo tanto, tramadol se puede administrar con seguridad[9].
-
Oxicodona
Oxicodona (14-hidroxi-7,8-dihidrocodeinona) es un producto semisintético derivado de la tebaína (alcaloide del opio), agonista puro de receptores mu y kappa[28] y sin techo terapéutico. Autores postulan que el efecto analgésico es debido a la acción agonista sobre receptores kappa o mu[29] y otros indican que la acción analgésica se debe a la acción simultánea de ambos receptores[30],[31]. Parte de la actividad intrínseca antinociceptiva de oxicodona en la rata es mediada por los receptores opioides kappa y es reversible con naloxona[28], tal y como confirman los hallazgos de Davis y cols., en el 2003[29]. Estos hallazgos permiten plantear la hipótesis de que la administración concomitante de morfina (acción agonista mu) y oxicodona (acción agonista kappa) podría aumentar los efectos analgésicos, disminuyendo la sedación con respecto a la administración por separado de los dos fármacos. Ross y cols., demuestran esta sinergia antinociceptiva en un modelo animal con ratas[33].
Lauretti y cois., en un estudio doble-ciego, aleatorizado y cruzado con 22 pacientes, evalúan la combinación de morfina con oxicodona en formulaciones de liberación retardada, para el tratamiento del dolor oncológico comparado con la administración de morfina sola. Comprueban que la combinación es sinérgica y que tiene un perfil analgésico mejor y con menor incidencia de emesis[34].
En pacientes neuroquirúrgicos, Esposito et al., observaron un mejor control del dolor con oxicodona de liberación controlada 10 mg/12h, mayor seguridad y más fácil de administrar que Tramadol y Ketorolaco en bomba[14].
-
Medicamentos antinflamatorios no esteroideos (AINE)
Estos fármacos se pueden dividir en ácidos arilpropiónicos (ibuprofeno, naproxeno, flurbiprofeno, ketoprofeno); ácidos indol acético (indometacina, etodolaco); ácidos heteroaril acéticos (diclofenaco, ketorolaco), ácidos enólicos (piroxicam, fenilbutazona), y alcanonas (nabumetona).
Su mecanismo de acción implica la inhibición reversible, no selectiva de la ciclooxigenasa (COX) enzimas COX-1 y COX- 2. COX actúa sobre el ácido araquidónico para iniciar una cadena de reacciones que dan como resultado la síntesis de las prostaglandinas (PGD2, PGE2, PGI2 [prostaciclina], PGF2) y tromboxano. COX-1 está constitutivamente expresada en el cerebro y la médula espinal. Entre sus diversas funciones fisiológicas, protege la mucosa gástrica y proporciona hemostasia. COX-2, inducida por factores de crecimiento, citoquinas, y promotores tumorales, parece ser la fuente dominante de prostaglandinas durante la inflamación y la enfermedad crónica. La enzima COX-2 también se ha demostrado para ser constitutivamente expresada en el cerebro y la médula espinal[15].
Los AINE proporcionan analgesia adecuada para dolor leve a moderado, aunque algunos datos recientes sugieren que los AINE pueden ser más eficaces como analgésicos de lo que se creía, incluso teniendo algunos beneficios inmunomoduladores atenuando la respuesta de estrés por mecanismos distintos de la sola proporción de analgesia, lo que es de especial relevancia en la neurocirugía por sus propiedades potencialmente reductoras de neuroinflamación. Sin embargo, no están exentos de efectos deletéreos por su interferencia en los procesos de cicatrización y consolidación ósea, aunque su relevancia clínica es incierta y podría ser menor con el uso de AINES COX-2 selectivos[42].
Es posible que la expresión de la enzima COX-2 en las neuronas espinales contribuya a la plasticidad neuronal y el centro de sensibilización. Esto sugiere que los AINE deben tener más papel activo en el tratamiento del dolor después de la lesión del tejido (posoperatorio, trauma) y/o lesiones de los nervios (dolor neurogénico). Recientes revisiones sistemáticas cuantitativas sugieren que los AINE pueden ser tan eficaces como los opioides[16]. Los AINE pueden mejorar la analgesia posoperatoria, reducir las necesidades de opioides, facilitar el retorno de la funcionalidad gastrointestinal, aliviar las náuseas, disminuir la depresión respiratoria y mejorar la recuperación del paciente. Pero pequeñas dosis de AINE no son eficaces para el alivio del dolor agudo. Aunque los AINE son eficaces para proporcionar analgesia, pueden conducir a disfunción plaquetaria y aumento del tiempo de sangrado, que puede ser devastador en pacientes de neurocirugía. Su uso, también, se ha asociado a eventos cardiovasculares adversos en el contexto no perioperatorio, sin embargo, no parecen asociarse a un aumento de éstos en el contexto perioperatorio[41].
Los inhibidores COX-2 (parecoxib, rofecoxib, celecoxib, meloxicam, nimesulida), inhiben selectivamente la enzima COX- 2, el logro eficaz antiinflamatorio y los resultados analgésicos, pero ahorradores de los efectos secundarios de los inhibidores de la COX no selectivos, tales como sangrado posoperatorio prolongado y hemorragia gastrointestinal. Los AINE están asociados con un número de efectos adversos, que incluyen la disminución de la hemostasia, disfunción renal, hemorragia gastrointestinal y sobre la curación del hueso.
-
Paracetamol (acetaminofeno)
N-acetil-p-aminofenol analgésico cuyo mecanismo implica la inhibición central de las ciclooxigenasas. Sin embargo, está desprovisto de efectos secundarios comúnmente observados con el uso de los AINE excepto toxicidad hepática por sobreuso. En su formulación intravenosa resulta de enorme utilidad en la analgesia en el posoperatorio inmediato de los pacientes.
-
Metamizol
El metamizol, también conocido como dipirona, es un inhibidor no selectivo de la COX, con propiedades analgésicas, antipiréticas, espasmolíticas y antiinflamatorias débiles, que puede utilizarse en pacientes nefrópatas o con úlcera gastroduodenal, contraindicaciones frecuentes para el uso de AINEs. Por su mecanismo de acción, se podría esperar que tuviera un perfil de efectos adversos y contraindicaciones similar al de otros AINEs, sin embargo, por razones que se desconocen, esto no es así. Es una droga controversial que se ha usado poco a nivel internacional por el miedo que genera la agranulocitosis que fue reportada en los 1950s, sin embargo, los reportes son contradictorios y probablemente la incidencia de esta reacción adversa fue sobreestimada inicialmente; en Chile, se ocupa ampliamente y la incidencia de agranulocitosis no parece estar aumentada respecto de otros países[43].
-
Alfa-2 agonistas adrenérgicos
El uso de agonistas alfa-2 adrenérgicos para el tratamiento del dolor ha ganado popularidad en los últimos años. La dexmedetomidina, un potente y altamente selectivo agonista alfa-2 en las neuronas presinápticas de la asta dorsal de médula espinal, proporciona sedación y analgesia sin depresión respiratoria. Esta acción sobre los receptores noradrenérgicos espinales podría tener efectos que van más allá de la permanencia misma de la droga en el organismo, modulando procesos implicados en la sensibilización cronificación del dolor, el dolor neuropático y la alodinia[48]. Además, la dexmedetomidina reduce los requerimientos anestésicos tanto de hipnóticos como opioides, siendo una alternativa para uso en pacientes que sean beneficiados por una anestesia libre de opioides como lo son aquellos con problemas de abuso de sustancias[49]. La administración de dexmedetomidina antes de la finalización de los principales procedimientos quirúrgicos en pacientes hospitalizados disminuye las necesidades de los opioides, principalmente morfina en 60% y su uso no estaría asociado a prolongación de la estadía en la unidad de cuidados postanestésicos, aunque sí se asocia a un aumento en la incidencia de episodios de hipotensión[50]. Otro estudio ha demostrado un potencial efecto analgésico preventivo[17],[18].
-
Antagonistas del receptor de N-metil-D-aspartato
Antagonistas de N-metil-D-aspartato se administran como fármacos adyuvantes para dolor. Los receptores de N-metil-D- aspartato son iónicos activados que permiten el paso por los canales de calcio, sodio, y potasio en la célula. Estos receptores se activan por glicina y glutamato. El glutamato, un importante neurotransmisor excitatorio en el sistema nervioso central, tiene un papel importante en la modulación del dolor a nivel de la médula espinal, especialmente en la sensibilización de los nociceptores después de la exposición a los estímulos nocivos, el aumento de la magnitud y duración de las respuestas al dolor neuropático. Ejemplos de este tipo de antagonistas son la ketamina, que en dosis bajas (como un bolo IV, o infusión) y dextrometorfano por vía oral o intramuscular (IM) han sido estudiados como parte de un enfoque multimodal de manejo adyuvante del dolor. El dextrometorfano y la ketamina se encontraron que tienen importantes beneficios analgésicos inmediatos y preventivos en 67% y 58%, respectivamente[19]. La ketamina tiene un período de latencia corto, brinda un nivel anestésico estable cuando se emplea en perfusión continua y una analgesia profunda en dosis subanestésicas.
El magnesio, que cumple un rol fundamental en múltiples procesos fisiológicos y cuyo uso clínico incluye la preeclampsia, eclampsia y el manejo de arritmias, también tiene efectos antinociceptivos que estarían mediados por sus propiedades antagonistas del receptor NMDA. Su presentación más común es en forma de sulfato de magnesio 25% (2,02 mEq/mL). Para la mantención de la anestesia, presenta propiedades ahorradoras de anestésicos, potenciadoras del bloqueo neuromuscular y analgésicas que permiten el ahorro de opioides[44],[46]. Si bien no hay un esquema universalmente aceptado en su uso, una alternativa es administrar 30-50 mg/kg en bolo lento y su continuación con diferentes esquemas de infusión con diferentes duraciones hasta el posoperatorio[45].
En nuestro hospital, específicamente en cirugías como, por ejemplo, fusión lumbar usamos durante el período intraoperatorio, ketamina en el siguiente esquema: dosis de ataque de 0,5 mg/kg peso y continuar con BIC de 0,25 Mg/ kg peso/h, se excluyen aquellos pacientes en los cuales existe contraindicación de su uso.
-
Bloqueos periféricos en nervios del cuero cabelludo
Gracias a los diferentes avances en el desarrollo de dispositivos de localización de nervio periférico, la anestesia regional es una de las técnicas anestésicas más utilizadas y cada día gana más adeptos[20]-[23].
Los pacientes sometidos a bloqueos periféricos presentan menor índice de complicaciones frente a otras técnicas, lo que permite su expansión a diferentes escenarios, como anestesia y analgesia multimodal, manejo del dolor agudo posoperatorio y crónico.
Factores asociados, como sedación, conocimientos anatómicos, adecuada elección de la técnica a emplear y del anestésico local, permiten su buena práctica[20],[21],[22],[23].
Los nervios del cuero cabelludo a bloquear como técnica anestésica – analgésica en neurocirugía son los nervios supratroclear, supraorbitario ramo lateral y medial, zigomático- temporal, aurículo – temporal, occipital mayor, occipital menor, el área marcada donde se realizará la craniectomía y el sitio donde se insertarán los pines del fijador.
En la actualidad se han desarrollado diferentes dispositivos tecnológicos para orientar la búsqueda de estructuras nerviosas, que aumentan el porcentaje de éxito y efectividad[20]-[22].
La localización de los troncos por bloquear puede ser guiada por neuroestimulador de nervio periférico o por guía ultrasonográfica, hecho que se asocia con disminución en el volumen y requerimientos de anestésico local, lo cual mejora el porcentaje de éxito y eficacia de los bloqueos[21],[22].
-
Cuando se realiza la incisión sin anestésico local en el
cuero cabelludo y el periostio, se estimulan las terminaciones nerviosas generando cambios en la presión arterial y aumento del ritmo cardíaco. Estos efectos pueden poner en peligro al paciente, en particular en la presencia de malformaciones vasculares en el cerebro, tumores vasculares, o aumento de presión intracraneal, o producir hemorragia intracraneal como ha sido descrito en niños con tumor cerebral. Al infiltrarse el cuero cabelludo con un anestésico local las terminaciones nerviosas se bloquean y con esto podemos anticiparnos a que esta respuesta hemodinámica se evite o disminuya. En los adultos, la bupivacaína (0,5% sin epinefrina), se ha demostrado que disminuye significativamente la esperada respuesta hemodinámica a la incisión del cuero cabelludo. Esto no ha sido previamente demostrado en los niños. Actualmente, no hay suficientes estudios clínicos que demuestren superioridad de un instrumento de localización frente a otro[20].
Los bloqueos periféricos de nervios consisten en administrar un anestésico local en cercanía a un nervio o tronco nervioso periférico, que inhibe el potencial de acción transmembrana excitatorio, que transmite un estímulo nociceptivo por diferentes fibras nerviosas, hacia el sistema nervioso central, lo cual modula la percepción del dolor[21],[22].
La elección del anestésico local depende del bloqueo por realizar, procedimiento quirúrgico, estatus fisiológico del paciente y características farmacológicas. En nuestro medio se cuenta con diversos anestésicos locales: lidocaína al 1% y 2%, bupivacaína al 0,5% y levobupivacaína al 0,5%-0,75%, con los cuales se pueden preparar diferentes tipos de soluciones, como lidocaína al 0,5%-1%, más bupivacaína al 0,25%-0,5%, etc.
Debe tenerse en consideración que cuando se mezcla dos anestésicos locales diferentes la concentración de cada uno disminuye, lo que conlleva una menor penetración de anestésico local en el nervio para unirse al canal de sodio, además de modificar el pH y, de esa forma, la concentración no ionizada o activa del fármaco. Así, por ejemplo, la lidocaína, que es el más ácido de los anestésicos locales, con bupivacaina, reducirá la proporción no ionizada y aumentará la latencia del efecto, ocurriendo lo mismo con la bupivacaina, reduciendo la duración de su acción. De esta forma, la combinación de dos drogas diferentes tiene un comportamiento que no necesariamente es predecible y podría aumentar el riesgo de toxicidad sistémica[47]. En la actualidad, no hay estudios con poder estadístico significativo respecto al inicio, duración y mejoría en la calidad de los bloqueos tras la adición de diferentes sustancias a las soluciones empleadas en la realización de bloqueos de nervio periférico[20],[21].
Se pueden usar fármacos, como midazolam, fentanilo, remifentanil, dexmedetomidina y/o propofol; con dosis que logren concentraciones en sitio efectivo, adecuadas para sedoanalgesia.
El tratamiento del dolor posoperatorio en los pacientes sometidos a craneotomía por diferentes problemas neurológicos ha sido escasamente estudiado. Resulta difícil conocer la incidencia, intensidad y duración del dolor posoperatorio en pacientes neuroquirúrgicos debido a la falta de estudios clínicos y epidemiológicos bien estructurados. Diferentes estudios prospectivos, han observado que más de 60% de los pacientes experimentan dolor de moderada a severa intensidad tras cirugía intracraneal. Algunos autores han demostrado que el tratamiento inadecuado del dolor posoperatorio en el paciente neuroquirúrgico puede ocasionar alteraciones hemodinámicas y metabólicas cerebrales significativas responsables de la aparición de complicaciones neurológicas. Asimismo, diferentes modalidades de tratamiento del dolor posoperatorio han sido utilizadas en pacientes sometidos a craneotomía con resultados discordantes, como la asociación de fosfato de codeína y paracetamol, analgesia controlada por el paciente con morfina, fármacos antiinflamatorios no esteroideos y la infiltración de la herida quirúrgica con anestésicos locales. Por otra parte, el bloqueo craneal ha sido raramente utilizado para analgesia posoperatoria en pacientes neuroquirúrgicos, siendo el único estudio clínico publicado hasta la fecha el realizado por Nguyen et al., que observaron una disminución del dolor posoperatorio tras el bloqueo craneal con ropivacaína en pacientes sometidos a craneotomía electiva. Sin embargo, no existen estudios prospectivos en la bibliografía revisada que valoren la eficacia del bloqueo craneal con bupivacaína para el tratamiento del dolor posoperatorio tras craneotomía supratentorial. Hay resultados obtenidos que demuestran la eficacia analgésica y tolerancia del bloqueo craneal con bupivacaína al 0,25% en el período posoperatorio en pacientes sometidos a craneotomía supratentorial electiva. La eficacia analgésica de la infiltración con bupivacaína ha quedado manifiesta por los valores bajos de la Escala Analógica Visual (EAV, puntuando de 0 a 10 (0 = sin dolor y 10 = máximo dolor imaginable) y el alivio del dolor por medio de una escala descriptiva simple (0 = no alivio; 1 = alivio ligero; 2 = alivio moderado; 3 = alivio completo). Así como por la escasa necesidad de analgesia de rescate en las primeras 24 h del posoperatorio. Asimismo, se demuestra un efecto temprano del bloqueo craneal con bupivacaína, ya que el consumo de morfina es nulo durante las primeras 4 h del posoperatorio, siendo particularmente importante, ya que se ha publicado que el dolor posoperatorio después de craneotomía disminuye considerablemente 2 h después de la cirugía.
Se puede observar dolor de intensidad moderada a severa durante las primeras horas del posoperatorio de craneotomía, reflejado por la dosis de morfina requerida por los pacientes del grupo control (1,73 ± 0,88 mg h-1) durante las 2 primeras horas del posoperatorio y por la aparición de dolor de intensidad moderada. El dolor posoperatorio de la craneotomía supratentorial ha sido descrito por la mayoría de los pacientes como predominantemente superficial, sugiriendo un origen somático más que visceral, en el que estarían implicados principalmente los músculos pericraneales y tejidos blandos de la cabeza por lo que el bloqueo craneal sería una técnica analgésica adecuada en el posoperatorio de craneotomía. Sin embargo, los estudios sobre la eficacia de la anestesia regional en el tratamiento del dolor posoperatorio en craneotomía supratentorial son escasos. Nijima y Malis demostraron que el bloqueo del plexo cervical superficial proporciona un buen control del dolor posoperatorio en cirugía intracraneal. Asimismo, la infiltración de la herida quirúrgica con anestésico local se ha utilizado para tratamiento del dolor posoperatorio tras craneotomía. Bloomfield et al., evidenciaron que la infiltración de la herida quirúrgica con bupivacaína al 0,25% es efectivo para reducir el dolor posoperatorio en pacientes sometidos a craneotomía supratentorial electiva, aunque el período de estudio fue limitado a la primera hora del posoperatorio. Es importante mencionar que el bloqueo craneal con bupivacaína al 0,25% con epinefrina 1:200.000 una vez finalizada la craneotomía para exéresis de tumor supratentorial es eficaz en el control del dolor y durante las primeras 24 h del posoperatorio. Hay efectos secundarios que se pueden producir por realizar bloqueos periféricos y el más frecuente es el dolor local luego de la punción, que desaparece en pocos minutos u horas. La complicación más observada es la aparición ocasional de pequeños hematomas locales. Muy rara vez puede haber descarga vasovagal que cede espontáneamente o, si es necesario, con la aplicación de atropina[24].
Nosotros utilizamos bupivacaína 0,25%, en volumen de 2,5 cc por cada punto a bloquear (Figura 1) con doble finalidad, primero disminuir el consumo de anestésicos y segundo otorgar analgesia posoperatoria.
Si bien es necesario un buen manejo del dolor posoperatorio para la prevención de las complicaciones ya mencionadas, existen riesgos asociados a este manejo que se describen a continuación[25].
-
Cambios en el estado mental
Chequeos frecuentes en el posoperatorio inmediato son parte del manejo de estos pacientes. Si el tratamiento para el dolor interfiere con el estado mental, se podría perder el beneficio de la analgesia. Es por esto por lo que debe ser abordado con el resto del equipo y evaluar el riesgo beneficio de la intervención.
-
Elevación del dióxido de carbono
Pacientes con variaciones importantes en la PIC pueden ser perjudicados con una excesiva sedación, es por esto por lo que en algunos pacientes es recomendable medir el CO2 en sangre arterial para definir bien el tipo de sedación y no aumentar la PIC.

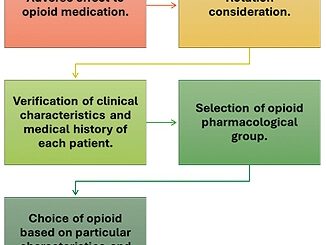
Figura 1. Importancia del adecuado del manejo del dolor.
-
Reducción del oxígeno arterial
La hipoxemia puede ser perjudicial para algunos pacientes neuroquirúrgicos produciendo un bajo aporte de ATP y por tanto la muerte celular. El uso de oxígeno suplementario es fundamental para este tipo de pacientes.
-
Hipotensión
En algunos pacientes con trauma espinal, el uso de anestesia regional puede ser útil para el manejo del dolor y el estrés, sin embargo, esto puede provocar en el período posoperatorio hipotensión e hipoperfusión sistémica con sus consecuencias.
-
Pérdida de líquido cefalorraquídeo
La punción del espacio subaracnoideo en concomitancia con algún proceso expansivo intracraneal (ej: hematoma subdural) puede provocar herniación. Sin embargo, en algunas ocasiones la colocación de un catéter en el intraoperatorio puede ser útil.
-
Daño nervioso
Cuando usamos técnicas regionales en pacientes con daño neurológico previo, aumenta el riesgo de causar una neuropatía. Lo mismo para pacientes con una sedación importante.
-
Infecciones
Se debe tener cuidado con el estado de sedación que pueda poner en riesgo de aspiración al paciente, también los bloqueos pueden causar infecciones a nivel cutáneo.
-
Manejo del dolor en situaciones específicas en neurocirugía
En neurocirugía los procedimientos que más se asocian a dolor posoperaratorio son craneotomía y la columna instrumentalizada.
-
Craneotomía
La craneotomía tiene pasos quirúrgicos dolorosos como lo son: la instalación del Mayfield, incisión del cráneo y la duramadre[26].
-
Colocación de Mayfield
La cabeza suele ser inmovilizada por el Mayfield a través de pinchos metálicos que rompen piel y cráneo. Los pinchos son un estímulo agresivo, repentino y muy doloroso que al igual que una laringoscopía desencadena hipertensión y taquicardia.
Para atenuar esta respuesta se recomienda el uso, un minuto antes de la colocación, de bolos de fentanyl 100 ug, propofol 20 a 50 mg, esmolol 0,5 – 1 mg/kg y/o lidocaína 1 mg/ kg. También puede usarse la infiltración previa con anestésico local del cuero cabelludo.
-
Preparación pre-incisional
Bajo nivel anestesia.
-
Incisión, elevación cuero cabelludo y cráneo
El nivel de profundidad anestésica debe ser aumentado ya que el estímulo es alto.
-
Apertura de la duramadre
La duramadre parietal es rica en fibras dolorosas por lo que la profundidad anestésica debe mantenerse alta.
-
Procedimiento intracraneal
Dependiendo del lugar del procedimiento, en general se requiere un nivel más superficial. El tejido cerebral no posee receptores de dolor.
-
Cierre de herida
Después del procedimiento intracraneal viene la hemostasia, cierre de la duramadre, reemplazo del hueso y cierre del cráneo. La etapa puede durar hasta una hora o más y puede ser tan dolorosa como la incisión. Opiodes, paracetamol o antihipertensivos pueden ser requeridos previo al despertar.
-
Posoperatorio
La idea es mantener el manejo multimodal que se inició previo a la cirugía, en craneotomías grandes, se puede utilizar PCA si el paciente colabora o bombas infusión continua más morfina rescate o por horario.
Hay pocos estudios sobre bloqueos en cuero cabelludos, sin embargo, los pocos que hay apoyarían su uso durante o después de la cirugía.
-
Cirugía columna
-
Elección de técnica quirúrgica
La anestesia general es la anestesia más común en cirugía de columna, sin embargo, el uso de anestesia regional es posible en algunos casos como son laminectomías o cirugías de disco de uno o dos segmentos.
Estudios randomizados en microlaminectomía o laminectomía no demuestran diferencias significativas en morbilidad ni mortalidad entre la anestesia general y la regional, incluso 11 estudios comparativos que mostraron menos hipertensión y taquicardia e incluso disminuiría levemente el dolor post operatorio, las náuseas y vómitos posoperatorios[27].
-
Analgesia para cirugía de columna
Cirugías descompresivas de columna de uno o dos segmentos, son en general bien tolerados con escasa cantidad de opioides y otros analgésicos, por otro lado, cirugías más grandes requieren manejos más agresivos en el posoperatorio para controlar el dolor. Asociado a esto, muchas veces en estos pacientes existe tolerancia a los analgésicos y opioides, por lo que resulta un desafío. Por esto se recomienda una aproximación multimodal.
En este sentido, junto con los opioides intravenosos para el manejo multimodal se recomiendan los siguientes fármacos:
La ketamina ayuda a disminuir el consumo de opioides en
el perioperatorio. Para pacientes de artrodesis de columna con tolerancia a los opioides se pueden utilizar bolos de 0,5 mg/kg seguido de una infusión de 10 ug/kg/min. Un estudio con 102 pacientes con tolerancia a los opioides mostró una reducción del uso de opioides en el corto y el mediano plazo (6 semanas).
Reducen el consumo de opioides posoperatorio y sus efectos adversos si se usan en el preoperatorio junto con analgésicos.
La utilización de 600 mg de gabapentina 2 h antes de la cirugía, tiene efectos beneficiosos, sin embargo, con dosis mayores de 900 a 1.500 mg (pregabalina 150 mg vs 75 mg) son aún más efectivas, aunque se asocian a mayor sedación posoperatoria. El uso mantenido de estos medicamentos en el posoperatorio es más efectivo que la dosis única.
El uso de paracetamol oral o parenteral demuestra una disminución del uso de morfina en el posoperatorio. Se recomienda usar en el preoperatorio y mantenerlo en régimen de 650 mg c 4 h o 1g c 6 h sin exceder los 4 g día.
Se recomienda la utilización de ketorolaco u otro AINE durante las 48 h previas a la cirugía de artrodesis de columna si la función renal del paciente lo tolera y disminuyendo su dosis en mayores de 65 años.
Morfina intratecal inoculada en el preoperatorio o intraoperatorio ha dosis de menos de 20 ug/kg en pediatría o 0,4 mg adulto y ha mostrado segura y eficaz para disminuir el puntaje EVA durante las primeras 24 h postcirugía. También puede utilizarse la hidromorfona. En nuestro centro al finalizar la cirugía de estabilización lumbar realizamos un bloqueo neuroaxial en prono con una mezcla de morfina, anestésico local hiperbárico y fentanilo; con la finalidad de no alterar los potenciales evocados, si se desea usar bloqueo neuroaxial antes de inicio de cirugía lo hacemos con morfina intratecal sola. Para analgesia en cirugía de hernia de núcleo pulposo o de liberación radicular usamos bloqueo del erector lumbar.
La anestesia peridural continua ha demostrado un mejor manejo del dolor posoperatorio que los medicamentos endovenosos, no existe una dosis de infusión establecida, pero se recomienda tener cuidado con la afectación motora para no perder la monitorización de este aspecto en este tipo de cirugía.
Cualquiera de las técnicas a utilizar debe considerar la neuromonitorización para evitar que ésta se afecte. De ahí la importancia de coordinar con el cirujano según los objetivos del procedimiento.
-
Conclusiones
El conocimiento de la importancia del manejo adecuado del dolor posoperatorio en cualquier tipo de cirugía constituye un desafío para el anestesiólogo. Sin embargo, en el caso de la neurocirugía no existen grandes estudios que puedan fundamentar o proponer esquemas reglados que demuestren beneficios. Si tomamos en consideración las características especiales de los pacientes neuroquirúrgicos y sus patologías, es posible formular esquemas de tratamiento del dolor que podrían beneficiarlos significativamente. El manejo del dolor posoperatorio en neurocirugía debe estar enfocado a evitar una excesiva sedación que puede determinar una depresión respiratoria, hipercapnia, náuseas, vómitos con el consecuente aumento de la PIC y daño en el paciente. También se deben considerar la influencia de factores propios del paciente para el control del dolor posoperatorio. Es así como, se debe tener presente factores predictores del control deficiente del dolor informados por los pacientes que incluyen: edad, sexo femenino, tabaquismo, antecedentes de depresión o ansiedad, dificultades del sueño preoperatorio, IMC más alto, presencia de dolor preoperatorio, uso de analgesia opioide durante el preoperatorio, estado clínico.
Existe en la actualidad una tendencia a la analgesia sin opioides, por parte nuestra, creemos, que es un terreno fértil para explorar buscando siempre otorgar un manejo eficiente, seguro y eficaz en este tipo de pacientes.
-
Referencias
1. American Pain Society. Principles of Analgesic Use in the Treatment of Acute Pain and Cancer Pain. 5th ed. Glenview (IL): American Pain Society; 2003.
2. Ang P, Knight H, Matadial C, Pagan A, Curty R, Nieves CS, et al. Managing acute postoperative pain: is 3 hours too long? J Perianesth Nurs. 2004 Oct;19(5):312–30. https://doi.org/10.1016/S1089-9472(04)00184-4 PMID:15472881
3. Rahimi SY, Vender JR, Macomson SD, French A, Smith JR, Alleyne CH Jr. Postoperative pain management after craniotomy: evaluation and cost analysis. Neurosurgery. 2006 Oct;59(4):852–7. https://doi.org/10.1227/01.NEU.0000232646.35678.D8 PMID:17038949
4. Verchère E, Grenier B, Mesli A, Siao D, Sesay M, Maurette P. Postoperative pain management after supratentorial craniotomy. J Neurosurg Anesthesiol. 2002 Apr;14(2):96–101. https://doi.org/10.1097/00008506-200204000-00002 PMID:11907388
5. Kissin I, Weiskopf RB. Preemptive analgesia. Anesthesiology. 2000 Oct;93(4):1138–43. https://doi.org/10.1097/00000542-200010000-00040 PMID:11020772
6. American Society of Anesthesiologists. Practice guidelines for acute pain management in the perioperative setting. An updated report by the task force on acute pain management. Anesthesiology. 2004;100(6):1573–81. https://doi.org/10.1097/00000542-200406000-00033 PMID:15166580
7. Klepstad P, Dale O, Skorpen F, Borchgrevink PC, Kaasa S. Genetic variability and clinical efficacy of morphine. Acta Anaesthesiol Scand. 2005 Aug;49(7):902–8. https://doi.org/10.1111/j.1399-6576.2005.00772.x PMID:16045647
8. Cohen MJ, Schecter WP. Perioperative pain control: a strategy for management. Surg Clin North Am. 2005 Dec;85(6):1243–57. https://doi.org/10.1016/j.suc.2005.09.009 PMID:16326205
9. Stein C. The control of pain in peripheral tissue by opioids. N Engl J Med. 1995 Jun;332(25):1685–90. https://doi.org/10.1056/NEJM199506223322506 PMID:7760870
10. Mazoit JX, Butscher K, Samii K. Morphine in postoperative patients: pharmacokinetics and pharmacodynamics of metabolites. Anesth Analg. 2007 Jul;105(1):70–8. https://doi.org/10.1213/01.ane.0000265557.73688.32 PMID:17578959
11. Murray A, Hagen NA. Hydromorphone. J Pain Symptom Manage. 2005 May;29(5 Suppl):S57–66. https://doi.org/10.1016/j.jpainsymman.2005.01.007 PMID:15907647
12. Peng PW, Sandler AN, Alan NA. A review of the use of fentanyl analgesia in the management of acute pain in adults. Anesthesiology. 1999 Feb;90(2):576–99. https://doi.org/10.1097/00000542-199902000-00034 PMID:9952166
13. Bourne MH, Rosenthal NR, Xiang J, Jordan D, Kamin M. Tramadol/acetaminophen tablets in the treatment of postsurgical orthopedic pain. Am J Orthop. 2005 Dec;34(12):592–7. PMID:16450688
14. Esposito M, Maucione G, Esposito I, Maresca L, Aronne F, Aglialoro E, et al. Acute postoperative pain in neurosurgical patients: oxycodone cpr versus ketorolac + tramadol. 5th International Meeting – Dialogues on anaesthesia and intensive care (Napoli, 18-19 november 2011)
15. Svensson CI, Yaksh TL. The spinal phospholipase-cyclooxygenase-prostanoid cascade in nociceptive processing. Annu Rev Pharmacol Toxicol. 2002;42(1):553–83. https://doi.org/10.1146/annurev.pharmtox.42.092401.143905 PMID:11807183
16. Brown AK, Christo PJ, Wu CL. Strategies for postoperative pain management. Best Pract Res Clin Anaesthesiol. 2004 Dec;18(4):703–17. https://doi.org/10.1016/j.bpa.2004.05.004 PMID:15460554
17. Arain SR, Ruehlow RM, Uhrich TD, Ebert TJ. The efficacy of dexmedetomidine versus morphine for postoperative analgesia after major inpatient surgery. Anesth Analg. 2004 Jan;98(1):153–8. https://doi.org/10.1213/01.ANE.0000093225.39866.75 PMID:14693611
18. Unlugenc H, Gunduz M, Guler T, Yagmur O, Isik G. The effect of pre-anaesthetic administration of intravenous dexmedetomidine on postoperative pain in patients receiving patient-controlled morphine. Eur J Anaesthesiol. 2005 May;22(5):386–91. https://doi.org/10.1017/S0265021505000669 PMID:15918389
19. Helmy SA, Bali A. The effect of the preemptive use of the NMDA receptor antagonist dextromethorphan on postoperative analgesic requirements. Anesth Analg. 2001 Mar;92(3):739–44. https://doi.org/10.1213/00000539-200103000-00035 PMID:11226111
20. Wedel D. Wedel J. Anesthesia management; nerve blocks. In: Miller R, Lars MD, Eriksson I, et al., editors. Miller’s Anesthesia. 7th ed. Philadelphia: Elsevier; 2009. pp. 52–60.
21. Berde C, Strichartz G. Anesthetic pharmacologic, local anesthetics. In: Miller R, Lars MD, Eriksson I, et al., editors. Miller’s Anesthesia. 7th ed. Philadelphia: Elsevier; 2009. pp. 30–5.
22. De Andrés J, Alonso-Iñigo JM, Sala-Blanch X, Reina MA. Nerve stimulation in regional anesthesia: theory and practice. Best Pract Res Clin Anaesthesiol. 2005 Jun;19(2):153–74. https://doi.org/10.1016/j.bpa.2004.11.002 PMID:15966491
23. De Franco C. Applied anatomy of the lower extremity. En: de León-Casasola O. Techniques in regional anesthesia and pain management. Philadelphia: Elsevier; 2008. p. 140-145. https://doi.org/10.1053/j.trap.2008.02.003.
24. Morad A, Winters B, Stevens R, White E, Weingart J, Yaster M, et al. The efficacy of intravenous patient-controlled analgesia after intracranial surgery of the posterior fossa: a prospective, randomized controlled trial. Anesth Analg. 2012 Feb;114(2):416–23. https://doi.org/10.1213/ANE.0b013e31823f0c5a PMID:22156333
25. Neuroanesthesia. 6th ed. Cottrel and Patel’s; 2017.
26. Anesthesia for craniotomy. Authors: Chanannait Paisansathan, MD Mehmet S Ozcan, MD, FCCP. Literature review current through: Oct 2016
27. Anesthesia for elective spine surgery in adults. Michael J Brown, MD. Literature review current through: Nov 2016.
28. Ross FB, Smith MT. The intrinsic antinociceptive effects of oxycodone appear to be kappa-opioid receptor mediated. Pain. 1997 Nov;73(2):151–7. https://doi.org/10.1016/S0304-3959(97)00093-6 PMID:9415500
29. Saarialho-Kere U, Mattila MJ, Seppälä T. Psychomotor, respiratory and neuroendocrinological effects of a mu-opioid receptor agonist (oxycodone) in healthy volunteers. Pharmacol Toxicol. 1989 Oct;65(4):252–7. https://doi.org/10.1111/j.1600-0773.1989.tb01168.x PMID:2555803
30. Shad SH, Hardy J. Oxycodone: a review of the literature. Eur J Palliat Care. 2001;8:93–6.
31. Ripamonti C, Dickerson ED. Strategies for the treatment of cancer pain in the new millennium. Drugs. 2001;61(7):955–77. https://doi.org/10.2165/00003495-200161070-00005 PMID:11434451
32. Davis MP, Varga J, Dickerson D, Walsh D, LeGrand SB, Lagman R. Normal-release and controlled-release oxycodone: pharmacokinetics, pharmacodynamics, and controversy. Support Care Cancer. 2003 Feb;11(2):84–92. https://doi.org/10.1007/s00520-002-0385-9 PMID:12560936
33. Ross FB, Wallis SC, Smith MT. Co-administration of sub-antinociceptive doses of oxycodone and morphine produces marked antinociceptive synergy with reduced CNS side-effects in rats. Pain. 2000 Feb;84(2-3):421–8. https://doi.org/10.1016/S0304-3959(99)00230-4 PMID:10666549
34. Lauretti GR, Oliveira GM, Pereira NL. Comparison of sustained-release morphine with sustained-release oxycodone in advanced cancer patients. Br J Cancer. 2003 Dec;89(11):2027–30. https://doi.org/10.1038/sj.bjc.6601365 PMID:14647133
35. Clark JD. Chronic Postoperative Pain: Preventable or Inevitable? Vol. 135, Anesthesiology. Lippincott Williams and Wilkins; 2021. p. 215–7.
36. Swarbrick CJ, Partridge JS. Evidence-based strategies to reduce the incidence of postoperative delirium: a narrative review. Vol. 77, Anaesthesia. John Wiley and Sons Inc; 2022. p. 92–101. https://doi.org/10.1111/anae.15607
37. Kharasch ED. Intraoperative methadone: Rediscovery, reappraisal, and reinvigoration? Vol. 112, Anesthesia and Analgesia. Lippincott Williams and Wilkins; 2011. p. 13–6.
38. Murphy GS, Szokol JW. Intraoperative Methadone in Surgical Patients: A Review of Clinical Investigations. Vol. 131, Anesthesiology. NLM (Medline); 2019. p. 678–92. https://doi.org/10.1097/ALN.0000000000002755.
39. Ramaiah VK, Kharasch ED. Methadone and Enhanced Recovery After Surgery: concepts and Protocols. Anesth Analg. 2024 Sep;139(3):670–4. https://doi.org/10.1213/ANE.0000000000006790 PMID:38295148
40. Pan S, Anderson TA. Perioperative Methadone: Perilous or Pain Panacea? Vol. 137, Anesthesia and Analgesia. Lippincott Williams and Wilkins; 2023. p. 72–5. https://doi.org/10.1213/ANE.0000000000006332
41. Komatsu R, Singleton MD, Dinges EM, Wu J, Bollag LA. Association between perioperative non-steroidal anti-inflammatory drug use and cardiovascular complications after non-cardiac surgery in older adult patients. JA Clin Rep. 2024 Apr;10(1):29. https://doi.org/10.1186/s40981-024-00712-5 PMID:38687413
42. Bosch DJ, Nieuwenhuijs-Moeke GJ, van Meurs M, Abdulahad WH, Struys MM. Immune Modulatory Effects of Nonsteroidal Anti-inflammatory Drugs in the Perioperative Period and Their Consequence on Postoperative Outcome. Vol. 136, Anesthesiology. Lippincott Williams and Wilkins; 2022. p. 843–60. https://doi.org/10.1097/ALN.0000000000004141.
43. Konijnenbelt-Peters J, van der Heijden C, Ekhart C, Bos J, Bruhn J, Kramers C. Metamizole (Dipyrone) as an Alternative Agent in Postoperative Analgesia in Patients with Contraindications for Nonsteroidal Anti-Inflammatory Drugs. Pain Pract. 2017 Mar;17(3):402–8. https://doi.org/10.1111/papr.12467 PMID:27346584
44. Warner DS, Herroeder S, Schö ME, De Hert SG, Hollmann MW. Magnesium-Essentials for Anesthesiologists [Internet]. 2011. Available from: http://pubs.asahq.org/anesthesiology/article-pdf/114/4/971/253401/0000542-201104000-00037.pdf
45. Soleimanpour H, Imani F, Dolati S, Soleimanpour M, Shahsavarinia K. Management of pain using magnesium sulphate: a narrative review. Vol. 134, Postgraduate Medicine. Taylor and Francis Ltd.; 2022. p. 260–6. https://doi.org/10.1080/00325481.2022.2035092
46. Choi GJ, Kim Y Il, Koo YH, Oh HC, Kang H. Perioperative magnesium for postoperative analgesia: An umbrella review of systematic reviews and updated meta-analysis of randomized controlled trials. Vol. 11, Journal of Personalized Medicine. MDPI; 2021. https://doi.org/10.3390/jpm11121273
47. Nestor CC, Ng C, Sepulveda P, Irwin MG. Pharmacological and clinical implications of local anaesthetic mixtures: a narrative review. Vol. 77, Anaesthesia. John Wiley and Sons Inc; 2022. p. 339–50. https://doi.org/10.1111/anae.15641
48. Bahari Z. Gholam |, Meftahi H. Spinal – 2-adrenoceptors and neuropathic pain modulation; therapeutic target. 2019; Available from: http://onlinelibrary.wiley.com/doi/10.1111/bph.v176.14/issuetoc
49. Crowe G, Atterton B, Moran L. Perioperative Applications of Dexmedetomidine [Internet]. Available from: https://resources.wfsahq.org/anaesthesia-tutorial-of-the-week/
50. Sin JC, Tabah A, Campher MJ, Laupland KB, Eley VA. The Effect of Dexmedetomidine on Postanesthesia Care Unit Discharge and Recovery: A Systematic Review and Meta-Analysis. Anesth Analg. 2022 Jun;134(6):1229–44. https://doi.org/10.1213/ANE.0000000000005843 PMID:35085107

 ORCID
ORCID