Raul Bustos B.1,2,3*, Carolina Solís G.1,2
Recibido: 10-06-2025
Aceptado: 14-07-2025
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 5 pp. 505-512|https://doi.org/10.25237/revchilanestv54n5-04
PDF|ePub|RIS
New developements in pediatric intensive care
Abstract
In recent years, pediatric intensive care medicine has been a rapidly developing field. The most relevant advances include new definitions and guidelines for pediatric ARDS and weaning from mechanical ventilation. A definition of pediatric sepsis and septic shock based on the new Phoenix criteria has been suggested. Sedation practices and guidelines have been updated, focusing on minimizing delirium and facilitating early mobility.The ABCDEF bundle of measures for ICU liberation to minimize the sequelae of critical illness has begun to be implemented in children. The use of POCUS has become widespread in the pediatric ICU and emergency. Guidelines for brain death in children have also been updated. Finally, in our continent, a multicenter collaborative network of different PICU has generated new clinical evidence. In this review, we highlight some of the most recent advances and updates of this pediatric subspecialty.
Resumen
En años recientes, la medicina intensiva pediátrica se ha transformado en un área de rápido desarrollo. Los progresos más relevantes incluyen nuevas definiciones y guías del ARDS pediátrico y liberación de la ventilación mecánica. Una definición de sepsis y shock séptico pediátrico basada en los nuevos criterios de Phoenix ha sido sugerida. Las prácticas de sedación también han sido actualizadas poniendo énfasis en la prevención del delirio y en la movilización temprana. El paquete de medidas ABCDEF en la liberación de la UCI para minimizar las secuelas de las enfermedades críticas ha comenzado a ser implementado en niños. El uso del POCUS se ha extendido en unidades críticas y de emergencia pediátrica. Las guías de muerte encefálica en niños también han sido actualizadas. Por último, las apariciones de redes colaborativas de investigación en nuestro continente han permitido generar nueva evidencia local. En esta revisión destacamos algunos de los avances más recientes en esta subespecialidad de la pediatría.
-
Novedades en el distress respiratorio agudo pediátrico (PARDS)
La segunda conferencia de consenso sobre lesión pulmonar aguda pediátrica (PALICC-2), publicada en el 2023, actualizó la definición de PARDS sugiriendo nuevas guías para el manejo de esta condición (Figura 1). Se realizaron revisiones sistemáticas que abordaron 11 áreas temáticas: 1) definición, incidencia y epidemiología; 2) fisiopatología, gravedad y estratificación del riesgo; 3) soporte ventilatorio; 4) tratamiento auxiliar específico pulmonar; 5) tratamiento no pulmonar; 6) monitoreo; 7) soporte respiratorio no invasivo; 8) soporte extracorpóreo; 9) morbilidad y resultados a largo plazo; 10) informática clínica y ciencia de datos; y 11) entornos de recursos limitados. Respecto a la edad, todos los pacientes menores de 18 años sin enfermedad pulmonar perinatal podrían ser diagnosticados con PARDS según criterios PALICC -2, la definición propuesta aparece en la Tabla 1. Los grupos de gravedad de PARDS se han simplificado para clasificar a los pacientes en uno de los cuatro grupos de gravedad basados en el tipo de ventilación (invasiva vs no invasiva) y la gravedad de la oxigenación (leve/moderada vs grave). También establece una nueva categoría de “posible PARDS”, para aquellos pacientes con una alta probabilidad de cumplir con los criterios de PARDS mientras reciben cánula nasal de alto flujo (CNAF) y para aquellos que son difíciles de diagnosticar formalmente en entornos con recursos limitados. Las guías sugieren el uso de volúmenes corrientes (Vt) entre 6 y 8 ml/kg. Los Vt < a 6 ml/kg pueden ser necesarios para mantenerse por debajo de la meseta y los límites de presión de conducción. En ausencia de mediciones de presión transpulmonar, la presión de meseta inspiratoria sugerida es < a 28 cm de H2O. La presión de la meseta puede ser más alta (29-32 cm de H2O) para pacientes con una compliance reducida de la pared torácica. Se sugiere limitar la presión de conducción “driving“ a 15 cm de H2O. También se sugiere que los niveles de PEEP se mantengan al nivel o por encima de la tabla PEEP inferior/FiO2 superior del protocolo del ARDS network. Las guías PALICC- 2 son ambiguas respecto al uso de maniobras de reclutamiento, ventilación oscilatoria de alta frecuencia (VAFO) y óxido nítrico inhalado (iNO). El iNO podría ser beneficioso en algunos fenotipos de PARDS, como pacientes con hipertensión pulmonar documentada o disfunción ventricular derecha grave. Además, el uso de iNO puede considerarse como rescate o puente hacia el soporte vital extracorpóreo[1]. Los resultados del estudio Prone and Oscillation Pediatric Clinical (PROSpect), actualmente en curso, nos permitiría abordar el manejo óptimo de la VAFO en el PARDS. En este ensayo, se aleatoriza a pacientes con PARDS moderado a grave (IO > 12) para evaluar la hipótesis de que la posición en prono vs supino, y la VAFO vs la ventilación mecánica convencional producirán una mejora en los días libres de VM[2].
Tabla 1. Definición de distress respiratorio pediátrico según guías PALICC -2. Año 2023
| Variable | Definición |
| Edad | Excluir pacientes con enfermedad pulmonar perinatal |
| Tiempo | Dentro de 7 días del insulto conocido |
| Origen del edema pulmonar | No explicado por falla cardíaca o sobrecarga de fluidos |
| Imagen de tórax | Nuevas opacidades (uni o bilaterales) consistentes con enfermedad aguda del parénquima pulmonar no causadas por atelectasia o derrame pleural |
| Oxigenación | VMI: IO > 4 o OSI > 5
VNI: PaO2 /FiO2 < 300 o SO2/FiO2 < 250 Estratificación de gravedad PARDS: Aplicar > 4 h del diagnóstico de PARDS VMI Leve/moderado IO < 16 o OSI < 12 Grave IO > 16 o OSI > 12 VNI Leve/moderado PaO2/FiO2 >100. Grave PaO2/FiO2 < 100 |
| Poblaciones especiales: Cardiopatías cianóticas Daño pulmonar crónico | Criterios anteriores más:
Deterioro en oxigenación no explicado por patología cardíaca Deterioro en oxigenación desde basal |
VMI = ventilaciónón meánica invasiva; VNI = ventilaciónón no invasiva; IO = índice de oxigenación; OSI = Índice Oxigeno saturaciónón.
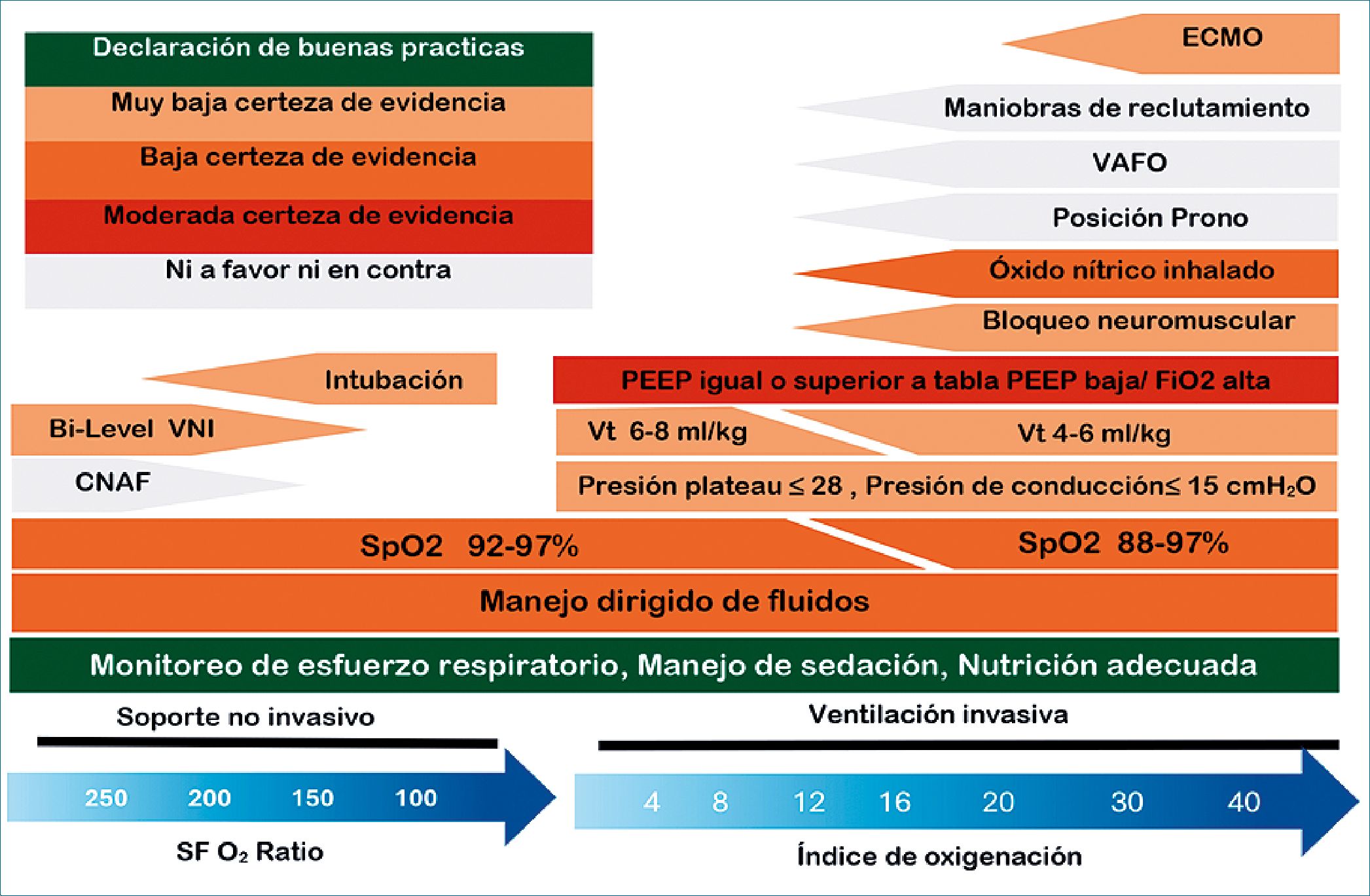
Figura 1. Resumen esquemático de las estrategias de manejo en el síndrome de PARDS basado en las recomendaciones y de la Segunda Conferencia de Consenso e Lesiones Pulmonares Agudas Pediátricas. (PALICC -2).
-
Liberación de la ventilación
En comparación con lo que ya se ha publicado sobre la liberación del respirador en adultos, la información en niños es escasa. El año 2023, la red Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) publicó las primeras guías de práctica clínica para pediatría sobre liberación del respirador[3]. Estas pautas se centraron en los niños hospitalizados de forma aguda que reciben ventilación mecánica invasiva (VMI) durante más de 24 h. Sugieren que debe realizarse una evaluación diaria de la preparación para la extubación, para así evaluar objetivamente la capacidad del paciente para mantener de forma independiente una ventilación minuto adecuada y un intercambio de gases sin esfuerzo respiratorio excesivo, una vez liberado de la VMI. Esta evaluación se realiza a través de una prueba de respiración espontánea (PVE). El mejor soporte para utilizar durante una PVE es un tema de debate. Varios estudios han demostrado que la presión de soporte (PS) con presión positiva continua en la vía aérea (CPAP) durante una PVE permite un menor trabajo respiratorio. La duración de una PVE tiene un impacto en el potencial de los pacientes para aprobar o reprobar. En aquellos pacientes con un mayor riesgo de fracaso de la extubación [VMI prolongada ( > 14 días), enfermedad pulmonar crónica, enfermedad crítica crónica, uso preexistente de CPAP/VNI, disfunción miocárdica, deterioro neurológico, enfermedad neuromuscular, anomalías de las vías respiratorias superiores/intervenciones quirúrgicas, trisomía 21 y otros síndromes genéticos, extubación fallida previa y paso de PVE en el límite] se podría realizar una PVE más exigente para evaluar mejor el potencial de liberación del respirador. En este contexto, se sugiere una PVE más prolongada (es decir, 60-120 min frente a 30 min) de CPAP sin aumento de PS. En este grupo de niños, las guías sugieren uso de soporte no invasivo después de la extubación.
-
¿Qué hay de nuevo en la sepsis pediátrica?
-
Criterios diagnósticos Phoenix de sepsis pediátrica
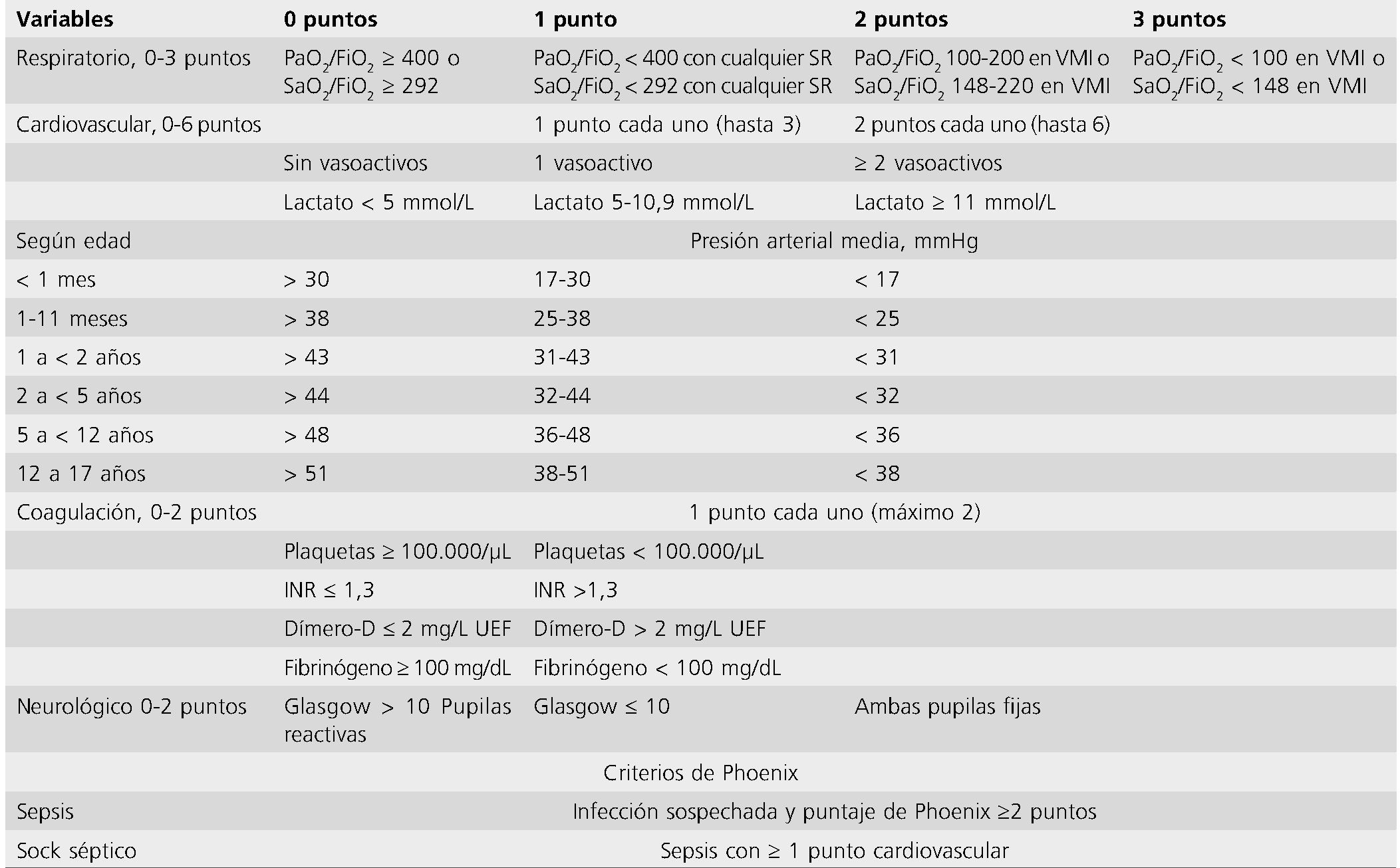
La sepsis sigue siendo una de las principales causas de morbilidad y mortalidad en niños en todo el mundo. La mayoría de los niños que mueren por sepsis sufren un shock refractario o disfunción orgánica múltiple (MODS). La mortalidad de los niños con sepsis varía entre el 5% y el 50%, según la gravedad de la enfermedad, los factores de riesgo y la ubicación geográfica. La identificación temprana y el tratamiento adecuado son cruciales para optimizar los resultados de los niños con sepsis. Las primeras definiciones y criterios para sepsis, sepsis grave y shock séptico basada en opinión de expertos fueron publicadas en 2005. En 2016, se publicaron nuevas definiciones y criterios para sepsis (Sepsis-3), pero esta definición excluyo la población pediátrica. Clásicamente, los pediatras hemos utilizado los criterios del síndrome de respuesta inflamatoria sistémica (SRIS), pero estos carecen de sensibilidad y especificidad. Schlapbach et al. 2024, publicaron los nuevos criterios Phoenix para definir la sepsis (PSS) que fueron derivados y validados usando una base de datos internacional que incluyo países de bajos ingresos, revisión sistemática y metanálisis. Este grupo define la sepsis como disfunción de órganos potencialmente mortal de los sistemas respiratorio, cardiovascular, de coagulación o neurológico, demostrado por un puntaje PSS de al menos 2 puntos en el contexto de infección confirmada o sospechada. El shock séptico fue definido como sepsis con al menos 1 punto en la categoría cardiovascular del PSS (hipotensión para la edad, lactato > 5 mmol/L o uso de drogas vaso activas) La definición y puntaje de sepsis según PSS aparece en la Tabla 2.
Estos criterios son aplicables en niños < 18 años excluyéndose recién nacidos o neonatos < de 37 semanas[4],[5],[6].
Creemos que por primera vez, la comunidad pediátrica cuenta con criterios sólidos, estandarizados internacionalmente, de alto rendimiento y basados en datos, disponibles para el diagnóstico y la medición de la sepsis y el shock séptico en niños con sospecha de infección. Estos criterios también permiten la investigación y el desarrollo de herramientas de reconocimiento temprano basadas en la evidencia para la sepsis pediátrica. Inevitablemente, estos criterios no están exentos de controversias, ya que simplifican un síndrome complejo, altamente dependiente del tiempo y heterogéneo.
-
Aspectos relevantes del tratamiento de la sepsis pediátrica
En 2020, se publicaron las “Directrices internacionales de la Campaña de supervivencia a la sepsis para el tratamiento del choque séptico y la disfunción orgánica asociada a la sepsis en niños”[7]. La sospecha de la sepsis se basa principalmente en el criterio clínico, los exámenes de laboratorio se consideran auxiliares y no deben retrasar el inicio del tratamiento. Algunos de ellos serán de utilidad para evidenciar la respuesta inflamatoria, como recuento de leucocitos, proteína C reactiva, procalcitonina, ferritina, mientras otros definen la magnitud de la disfunción orgánica (función renal, hepática, coagulación). También están indicados estudios microbiológicos para aislamiento y/o detección de agente etiológico.
Tabla 2. Definición y puntaje de sepsis según criterios Phoenix año 2024
Si se evidencia hipoxemia se debe instaurar aporte de O2 y ante una insuficiencia respiratoria se debe considerar la utilización de sistemas no invasivo, como CPAP o VNI (de acuerdo con disponibilidad y experiencia en su uso) antes de definir la intubación traqueal y la ventilación invasiva. De ser necesaria esta última, se debe garantizar una adecuada reanimación hídrica y considerar el inicio previo de fármacos vasoactivos/ inotrópicos para evitar mayor deterioro hemodinámico durante el procedimiento.
Respecto a la reanimación con volumen y a diferencia de recomendaciones previas, se sugiere una administración de fluidos que debe ser menos agresiva, con el fin de evitar sobrecarga que empeore las disfunciones orgánicas. En escenarios sin disponibilidad de cuidados intensivos y en ausencia de hipotensión arterial, se deberían evitar los bolos y sólo dejar líquidos de mantenimiento. Si hay hipotensión, pueden usarse bolos de 10 ml/kg (máximo 40 ml/kg) para mejorar la perfusión, vigilando estrechamente signos de sobrecarga. En caso de disfunción miocárdica o lesión pulmonar grave, se debe limitar el volumen de cada bolo a 5-10 ml/kg. Respecto al tipo de fluidos a utilizar en la reanimación inicial, en adultos existe abundante literatura que apoya el uso de cristaloides balanceados (CB) por sobre el uso de sol fisiológica (SF). En un metaanálisis de ensayos clínicos con 3.500 niños ingresados en urgencias y UCIP con sepsis y shock séptico, que requirieron reanimación con fluidos, no se encontraron diferencias significativas en la tasa de mortalidad entre los grupos que compararon CB vs SF, coloides vs SF, bolo de líquidos restringido vs Liberal y administración de bolo de líquidos lento vs rápido. El riesgo de falla renal aguda fue significativamente menor en el grupo de CB en comparación con el grupo de SF. La certeza de la evidencia sobre mortalidad fue de “moderada” en el grupo de BC de “certeza muy baja” en los otros dos grupos[8].
A diferencia de recomendaciones previas donde la dopamina y dobutamina aparecían como las drogas vasoactiva de primera línea, actualmente se recomienda la adrenalina (adr) como medicamento de primera elección en presencia de disfunción miocárdica y la noradrenalina (nor) en presencia de baja resistencia vascular periférica. Cada vez hay más evidencia respecto a la seguridad de estos medicamentos administrados por vía periférica o intraósea, por lo que podrían utilizarse fuera de la UCI. Un estudio retrospectivo reciente que comparó la administración de adr vs nor como primer vasoactivo en niños con shock séptico sin disfunción cardíaca conocida, en ese estudio, los pacientes que recibieron adr presentaron una mortalidad mayor a los 30 días, lo anterior debería confirmarse en estudios prospectivos[10].
La terapia antimicrobiana debe ser adecuada y precoz, esto último es en la primera hora si hay shock séptico o en las primeras tres horas en los casos de sepsis. De manera adicional, es fundamental realizar control de foco infeccioso. Esto implica realizar el drenaje de colecciones (abscesos, empiemas, artritis sépticas), el desbridamiento de tejidos necrosados y el retiro de dispositivos invasivos que sean el origen de la infección.
Respecto al uso de corticosteroides las recomendaciones siguen siendo ambiguas. No existe un consenso actual sobre el uso de hidrocortisona intravenosa como terapia adicional para el choque séptico pediátrico Debe tenerse consideración especial para su uso en aquellos pacientes con exposición crónica a corticosteroides, trastornos del eje hipotalámico- pituitario-suprarrenal, hiperplasia suprarrenal congénita u otras endocrinopatías relacionadas con corticosteroides.
En cuanto a las transfusiones de hemoderivados, las nuevas guías son restrictivas, usando un umbral de hemoglobina (Hb) más bajo. Si ya se ha logrado una estabilidad hemodinámica, no se recomienda la transfusión de eritrocitos si se tiene una Hb > 7 g/dL. En presencia de inestabilidad hemodinámica no hay una recomendación contundente de valores a partir de los cuales se deba considerar la transfusión y será el juicio clínico del médico tratante lo que lo determine. No se recomienda el uso profiláctico de plaquetas y su reposición dependerá de la presencia de hemorragia o recuentos < 10.000 céls/mm3 Recomendación similar existe con el uso de plasma fresco congelado, no se debe usar en forma profiláctica ni como expansor de volumen.
En las guías 2020, no hay recomendaciones respecto al empleo de “reanimación metabólica“ en base a vitamina C, tiamina e hidrocortisona en niños con sepsis. Hasta ahora, solo se han publicado datos observacionales sobre la combinación de vitamina C, hidrocortisona y tiamina en pacientes pediátricos. El estudio multicéntrico aleatorizado internacional RESPOND, que evalúa el uso de vitamina C e hidrocortisona en niños con shock séptico actualmente en curso, podría entregarnos mayor información respecto a la efectividad de la reanimación metabólica en sepsis pediátrica. Por otro lado, un estudio piloto con 60 niños que comparó reanimación metabólica con hidrocortisona, tiamina y vitamina C vs tratamiento estándar, si bien, no demostró efectos clínicos, permitió evaluar la factibilidad de realizar este ensayo en un grupo mayor de pacientes[11],[12].
-
Nuevos conocimientos sobre las prácticas de sedación y analgesia
Durante su estadía en la UCIP, los niños gravemente enfermos están expuestos a una variedad de eventos dolorosos y estresantes. Debido a que estos eventos generalmente se tratan con analgésicos y sedantes, la administración de estos agentes se considera una práctica de rutina. El dolor, la agitación y el delirio están vinculados entre sí y también lo está su manejo. El dolor no tratado tiene consecuencias físicas y psicológicas adversas que evocan una respuesta de estrés y pueden contribuir a complicaciones en pacientes posoperatorios. Los niños gravemente enfermos deben recibir primero una analgesia adecuada independientemente de su necesidad de sedación. En 2022, la SCCM publicó The Pain, Agitation, Neuromuscular Blockade, and Delirium in critically ill pediatric patients with consider of the PICU Environment and Early Mobility (PANDEM) guideline[13]. El estándar de oro de la evaluación del dolor es el autoinforme y se puede utilizar a partir de los 6 años. La escala analógica visual (VAS) o la escala de calificación numérica (NRS) son las más utilizadas. Para los niños menores de 6 años o los niños no verbales, se utiliza una escala de calificación observacional. La escala Faces, Legs, Activity, Cry and Consolability (FLACC) o la escala COMFORT-Behavior (COMFORT-B) están validadas para evaluar el dolor y la angustia en niños con enfermedades graves. La participación de los padres en la evaluación del dolor es un tema para futuras investigaciones. El manejo del dolor en niños con enfermedades graves implica tanto agentes no farmacológicos como farmacológicos. Los factores ambientales (temperatura, ruido), la relajación, la distracción y la facilitación del sueño tienen un impacto significativo en el confort. Además, el uso de succión no nutritiva con sacarosa oral antes de realizar procedimientos (no) invasivos en neonatos y lactantes (< 12 meses de edad) es un hecho bien conocido. Los opioides siguen siendo el analgésico de elección para tratar el dolor quirúrgico y médico agudo en pacientes pediátricos gravemente enfermos, incluido el dolor asociado con la ventilación mecánica. La morfina y el fentanilo son los dos opioides más utilizados. Es necesario conocer la farmacocinética y la farmacodinamia del agente de elección y la adaptación a la edad y la enfermedad crítica. El uso de medicamentos antiinflamatorios no esteroideos (AINE) complementarios o paracetamol en el período posoperatorio inmediato se asocia con puntuaciones de dolor reducidas y consumo de opioides sin aumento de eventos adversos. En niños sometidos a ventilación mecánica necesitarán recibir sedación para reducir la ansiedad y apoyar la ventilación. Establecer la profundidad objetivo de sedación y encontrar el equilibrio adecuado entre sedación excesiva e insuficiente es primordial. La sedación insuficiente conducirá a la extracción inadvertida de dispositivos (tubo endotraqueal, catéteres centrales, sondas) y al aumento de la ansiedad. La sedación excesiva se asocia con ventilación mecánica prolongada, delirio, estadía prolongada en la UCIP y desarrollo de tolerancia y abstinencia iatrogénica. Se recomienda la evaluación de la profundidad de la sedación y la sedación protocolizada. Las escala COMFORT- B o la State Behavior Scale (SBS) están validadas y son confiables para su uso en niños en VM.
Hoy en día los protocolos de analgosedación en la UCIP recomiendan como primera línea el uso inicial de opiodes asociados a un alfa agonista -si el objetivo de analgosedación no es alcanzado se pueden adicionar benzodiacepinas en bolo o en administración continua y ketamina o propofol si el paciente mantiene dificultad en la sedación. Siempre se debe considerar el delirio, el ciclo sueño vigilia y la deprivación[14].
Un diagrama simplificado de la estrategia de analgo sedación recomendada en la UCIP aparece en la Figura 2.
El delirio definido como disfunción cerebral aguda caracterizada por inatención y estado metal fluctuante. Entre los factores precipitantes se encuentran la profundidad de la sedación, el uso de benzodiacepinas, la ventilación mecánica y edad menor de 1 año.
En la prevención del delirio se recomienda su reconocimiento a través de la escalas validadas, en el contexto de UCIP la escala Cornell, es la herramienta más utilizada. Esta escala debe aplicarse de manera periódica desde la admisión en UCI. A fin de disminuir la severidad y duración del deliro también se recomiendan medidas no farmacológicas como la promoción de la higiene del sueño, involucrar a la familia en las visitas y el cuidado directo del niño.
-
Estrategias de liberación de la UCI en niños críticos, el paquete ABCDEF
La sobrevida de las enfermedades graves en niños ha mejorado con el tiempo, con tasas de mortalidad actuales inferiores al 5% en las UCIP de países desarrollados. A pesar de estos avances, más de la mitad de los niños críticamente enfermos desarrollaran una morbilidad adquirida en la UCIP. El paquete de liberación de la UCI o “bundle ABCDEF “es una guía interprofesional incorporado al cuidado diario a fin de mitigar las secuelas de la enfermedad critica en niños. Este concepto incluye seis elementos interrelacionados A. assess -evaluar prevenir y tratar el dolor; B. breathing ensayos de ventilación espontanea; C. choice elección de la analgesia y sedación; D. delirium evaluar prevenir y tartar el delirio; E. early movilización precoz y ejercicio; F. family compromiso y empoderamiento de la familia. En adultos la adherencia al paquete ABCDEF se ha asociado a una disminución del delirio y los días de ventilación mecánica. En un estudio pediátrico, cada 10% de aumento a la adherencia al paquete se asoció con 34% de reducción en la posibilidad de fallecer .Sin embargo, no se encontró asociación entre el uso del bundle y la disminución de días en UCI, duración de ventilación mecánica o delirio[15].
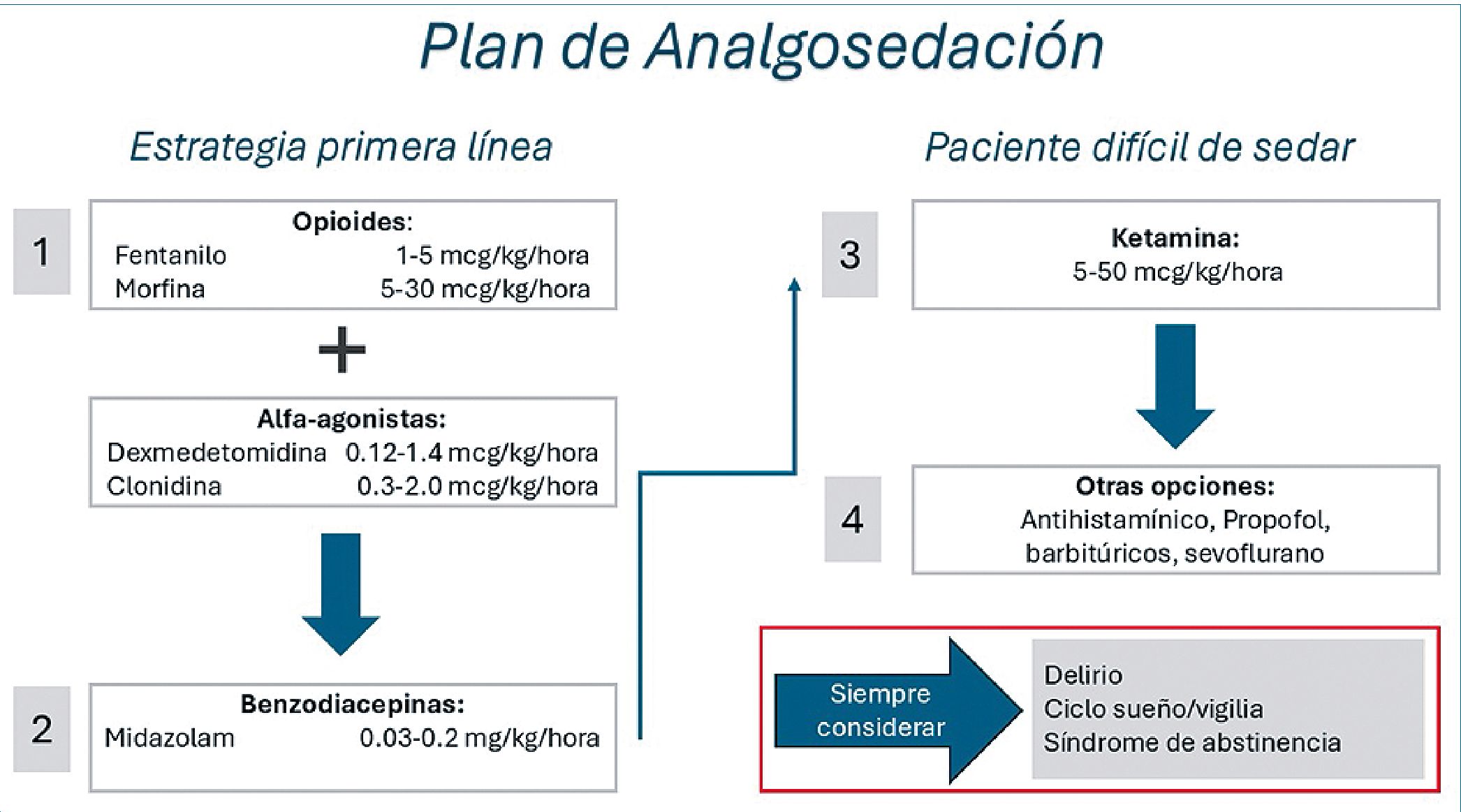
Figura 2. Estrategia optima de analgo sedación en niños críticamente enfermos. Adaptado de referencia 14.
-
POCUS o ecografía al pie de la cama
El ultrasonido en el punto de atención (POCUS) se ha consolidado como una herramienta diagnóstica esencial en pediatría crítica y de urgencias. Es una tecnología accesible que permite identificar y tratar patologías en tiempo real sin exponer a los niños a radiación ionizante. Destacan sus aplicaciones en el área cardiológica, vía aérea, pulmón y evaluación abdominal. Sin embargo, actualmente aún esta rezagada respecto a otras tecnologías ya que carece de un proceso estandarizado de capacitación y certificación, presenta una gran variabilidad en la competencia, la aplicación y protocolos utilizados en unidades criticas pediátricas. El grupo de trabajo POCUS de la European Society of Paediatric and Neonatal Intensive Care (ESPNIC) genero un documento de consenso y guías para la implentacion de POCUS Estas guías abarcan 41 recomendaciones para el uso de POCUS en unidades neonatales y UCIP, con énfasis en las aplicaciones cardíacas, pulmonares, vasculares, cerebrales y abdominales. Recomiendan encarecidamente el uso de la ecografía en la monitorización hemodinámica de niños en estado crítico. Destaca la necesidad de formación avanzada para ciertas aplicaciones, como el diagnóstico de cardiopatías congénitas. La mayoría de las recomendaciones se basan en evidencia de calidad moderada[16].
-
Procedimientos con POCUS
En la unidad de cuidados intensivos es útil para algunos procedimientos como accesos vasculares venosos y arteriales, siendo el estándar en la inserción de catéter en vena yugular interna,la evidencia no es tan sólida para el acceso subclavio o femoral. En cambio, la evidencia es robusta en la canulación arterial, existiendo 5 estudios controlados aleatorizados que favorecen el empleo de la ecografía.
El ultrasonido también ha permitido mejorar el éxito en punciones lumbares disminuyendo las punciones fallidas en recién nacidos y lactantes.
-
Evaluación cardiovascular
En general las mediciones de (POCUS) estáticas o dinámicas, tomadas de forma aislada, podrían no proporcionar un diagnóstico definitivo del estado de la volemia ni de la respuesta a fluidos. Sin embargo, combinadas con otras mediciones clínicas e invasivas, podrían facilitar la toma de decisiones del clínico. Por ejemplo, en un estudio, el manejo de líquidos guiado clínicamente, al complementarse con la evaluación mediante ecografía de la colapsibilidad/distensibilidad de la VCI, la fracción de eyección del ventrículo izquierdo y la ecografíaía pulmonar, redujo la cantidad total de fluidos administrado, la probabilidad de sobrecarga hídrica y el uso de diuréticos sin modificar el tiempo total de reversión del shock ni el score de infusión de drogas vasoactivas[14].
-
POCUS para la evaluación respiratoria
La utilización de POCUS es un avance significativo en la atención crítica respiratoria. La ecografía pulmonar proporciona visualización en tiempo real del parénquima pulmonary la pleura, lo que permite evaluar patologías pulmonares como neumonía, atelectasia, neumotórax y bronquiolitis de forma precisa y no invasiva. Recientemente, la ESPNIC y la ESCIM generaron un consenso internacional de expertos sobre los aspectos técnicos y las aplicaciones clínicas de la ecografía pulmonar cuantitativa en cuidados intensivos de adultos, niños y neonatos.
-
Guías de muerte encefálica por criterio neurológico en niños
Las guías para determinación de muerte encefálica (ME) fueron revisadas por la American Academy of Neurology el año 2023. La nuevas guías para adultos y niños han sido agrupadas en un documento único, con la mayoría de la guía es aplicable independiente de la edad de los pacientes. Los prerrequisitos para para la evaluación por ME incluyen conocer la causa del daño cerebral, y que esta sea permanente y sin posibilidad de recuperación. El período de observación antes de la evaluación en niños de < de 2 años debería ser > a 48 h independiente de la etiología y en > de 2 años > a 24 h después de una encefalopatía hipóxico isquémica[20]. En general, antes de iniciar una evaluación de ME, es razonable observar a los pacientes para detectar evidencia de recuperación de la función cerebral durante al menos 24 h tras la finalización de una intervención neuroprotectora, normalización de la presión arterial o la temperatura, o la eliminación de un factor metabólico o una toxina/medicación. Sin embargo, este tiempo debe individualizarse en función del mecanismo de la lesión cerebral. La temperatura debe ser mayor o igual a 36°C y la presión arterial sistólica y media > al percentil 5 para la edad. Es esencial garantizar que se excluyan los factores tóxicos y metabólicos que pueden inhibir la función cerebral y dar lugar a una determinación de ME falsamente positiva.
Similar a las guías de 2011, se requieren dos exámenes con test de apnea realizados por dos diferentes examinadores. El período de observación entre los dos exámenes se ha cambiado a un mínimo de 12 h independiente de la edad.
En algunas ocasiones, cuando la determinación clínica de ME no puede ser completada, las guías 2023 sugieren exámenes complementarios; el electroencefalograma no se recomienda como un test aceptable para niños y adultos (no evalúa el tronco encefálico, pacientes con encefalopatía metabólica severa podría presentar un EEG isoeléctrico). La angiografía cerebral de 4 vasos o el estudio isotópico cerebral permanecen como test auxiliares aceptables en niños.
-
Redes colaborativas para la mejora del cuidado e investigación en UCI pediátrica
El ingreso de un niño en UCI es un evento poco habitual, por lo que usualmente una UCIP de un solo centro no tendrá el suficiente volumen de pacientes para obtener información acerca de un grupo homogéneo de niños y así lograr una investigación de buena calidad. Al mismo tiempo la variabilidad en la práctica clínica puede ser muy amplia entre diferentes centros lo que se acompaña de un uso inadecuado de intervenciones terapéuticas o diagnósticas, por lo que el trabajo en redes permite una mejora en los procesos[21]. En Sud América, se han hecho esfuerzos para crear redes de investigación colaborativas de cuidado intensivo pediátrico. Entre estas, destaca “LaRed Network” que incluye UCIP de diversos países de nuestro continente (Argentina, Uruguay, Brasil, Bolivia, Colombia, Chile, Costa Rica, Ecuador, Perú, Puerto Rico y Honduras). El objetivo de esta organización sin fines de lucro es mejorar la calidad y seguridad de la atención en los centros participantes identificando -a través de la investigación clínica -las mejores intervenciones y las circunstancias óptimas para aplicarlas. Hasta la fecha, LaRed Network ha producido cerca de un centenar publicaciones en revistas de alto impacto en áreas como respiratorio, sepsis y neuro crítico.
-
Referencias
1. Emeriaud G, López-Fernández YM, Iyer NP, Bembea MM, Agulnik A, Barbaro RP, et al.; Second Pediatric Acute Lung Injury Consensus Conference (PALICC-2) Group on behalf of the Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) Network. Executive summary of the second international guidelines for the diagnosis and management of pediatric acute respiratory distress syndrome (PALICC-2). Pediatr Crit Care Med. 2023 Feb;24(2):143–68. https://doi.org/10.1097/PCC.0000000000003147 PMID:36661420
2. Kneyber MC, Cheifetz IM, Asaro LA, Graves TL, Viele K, Natarajan A, et al.; Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) Network. Protocol for the Prone and Oscillation Pediatric Clinical Trial ( PROSpect ). Pediatr Crit Care Med. 2024 Sep;25(9):e385–96. https://doi.org/10.1097/PCC.0000000000003541 PMID:38801306
3. Abu-Sultaneh S, Iyer NP, Fernández A, Gaies M, González-Dambrauskas S, Hotz JC, et al. Executive Summary: International Clinical Practice Guidelines for Pediatric Ventilator Liberation, A Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) Network Document. Am J Respir Crit Care Med. 2023 Jan;207(1):17–28. https://doi.org/10.1164/rccm.202204-0795SO PMID:36583619
4. Schlapbach LJ, Watson RS, Sorce LR, Argent AC, Menon K, Hall MW, et al.; Society of Critical Care Medicine Pediatric Sepsis Definition Task Force. International Consensus Criteria for Pediatric Sepsis and Septic Shock. JAMA. 2024 Feb;331(8):665–74. https://doi.org/10.1001/jama.2024.0179 PMID:38245889
5. Long E, Borland ML, George S, Jani S, Tan E, Phillips N, et al.; Paediatric Research in Emergency Departments International Collaborative (PREDICT) Network. External Validation of the Phoenix Sepsis Score in Children With Suspected Community-Acquired Sepsis. JAMA Netw Open. 2025 Mar;8(3):e251412. https://doi.org/10.1001/jamanetworkopen.2025.1412 PMID:40116825
6. Sánchez-Pinto LN, Daniels LA, Atreya M, Faustino EV, Farris RW, Geva A, et al. Phoenix Sepsis Criteria in Critically Ill Children: Retrospective Validation Using a United States Nine-Center Dataset, 2012-2018. Pediatr Crit Care Med. 2025 Feb;26(2):e155–65. https://doi.org/10.1097/PCC.0000000000003675 PMID:39982153
7. Weiss SL, Peters MJ, Alhazzani W, Agus MS, Flori HR, Inwald DP, et al. Surviving Sepsis Campaign International Guidelines for the Management of Septic Shock and Sepsis-Associated Organ Dysfunction in Children. Pediatr Crit Care Med. 2020 Feb;21(2):e52–106. https://doi.org/10.1097/PCC.0000000000002198 PMID:32032273
8. Sankar J, Das RR, Banothu KK. Fluid resuscitation in children with severe infection and septic shock: a systematic review and meta-analysis. Eur J Pediatr. 2024 Sep;183(9):3925–32. https://doi.org/10.1007/s00431-024-05653-w PMID:38916738
9. Parker MJ, Foster G, Fox-Robichaud A, Choong K, Mbuagbaw L, Thabane L; With the SQUEEZE Trial Steering Committee and on behalf of the SQUEEZE Trial Investigators, the Canadian Critical Care Trials Group, Pediatric Emergency Research Canada, and the Canadian Critical Care Translational Biology Group. Statistical analysis plan for the SQUEEZE trial: A trial to determine whether septic shock reversal is quicker in pediatric patients randomized to an early goal-directed fluid-sparing strategy vs. usual care (SQUEEZE). Crit Care Resusc. 2024 Jun;26(2):123–34. https://doi.org/10.1016/j.ccrj.2024.02.002 PMID:39072232
10. Harley A, George S, Phillips N, King M, Long D, Keijzers G, et al.; Resuscitation in Paediatric Sepsis Randomized Controlled Pilot Platform Study in the Emergency Department (RESPOND ED) Study Group. Resuscitation With Early Adrenaline Infusion for Children With Septic Shock: A Randomized Pilot Trial. Pediatr Crit Care Med. 2024 Feb;25(2):106–17. https://doi.org/10.1097/PCC.0000000000003351 PMID:38240535
11. Schlapbach LJ, Raman S, Buckley D, George S, King M, Ridolfi R, et al.; Resuscitation in Paediatric Sepsis Randomized Controlled Pilot Platform in the Paediatric Intensive Care Unit (RESPOND PICU) Study Investigators and the Australian and New Zealand Intensive Care Society Paediatric Study Group. Resuscitation With Vitamin C, Hydrocortisone, and Thiamin in Children With Septic Shock: A Multicenter Randomized Pilot Study. Pediatr Crit Care Med. 2024 Feb;25(2):159–70. https://doi.org/10.1097/PCC.0000000000003346 PMID:38240537
12. Raman S, Gibbons KS, Jayashree M, Lalitha AV, Bellomo R, Blythe R, et al.; Resuscitation in Paediatric Septic Shock using Vitamin C and Hydrocortisone (RESPOND) Study Group and the Australian and New Zealand Intensive Care Society Paediatric Study Group (ANZICS PSG). Resuscitation in Paediatric Septic Shock Using Vitamin C and Hydrocortisone (RESPOND): The RESPOND Randomized Controlled Trial Protocol. Pediatr Crit Care Med. 2025 Mar;26(3):e374–85. https://doi.org/10.1097/PCC.0000000000003674 PMID:39724024
13. Smith HA, Besunder JB, Betters KA, Johnson PN, Srinivasan V, Stormorken A, et al. Society of critical care medicine clinical practice guidelines on prevention and management of pain, agitation, neuromuscular blockade, and delirium in critically ill pediatric patients with consideration of the ICU environment and early mobility. Pediatr Crit Care Med. 2022 Feb;23(2):e74–110. https://doi.org/10.1097/PCC.0000000000002873 PMID:35119438
14. Mondardini MC, Sperotto F, Daverio M, Amigoni A. Analgesia and sedation in critically ill pediatric patients: an update from the recent guidelines and point of view. Eur J Pediatr. 2023 May;182(5):2013–26. https://doi.org/10.1007/s00431-023-04905-5 PMID:36892607
15. Lin JC, Srivastava A, Malone S, Jennison S, Simino M, Traube C, et al.; Society of Critical Care Medicine’s Pediatric ICU Liberation Campaign Collaborative. Caring for Critically Ill Children With the ICU Liberation Bundle (ABCDEF): Results of the Pediatric Collaborative. Pediatr Crit Care Med. 2023 Aug;24(8):636–51. https://doi.org/10.1097/PCC.0000000000003262 PMID:37125798
16. Singh Y, Tissot C, Fraga MV, Yousef N, Cortes RG, Lopez J, et al. International evidence-based guidelines on Point of Care Ultrasound (POCUS) for critically ill neonates and children issued by the POCUS Working Group of the European Society of Paediatric and Neonatal Intensive Care (ESPNIC). Crit Care. 2020 Feb;24(1):65. https://doi.org/10.1186/s13054-020-2787-9 PMID:32093763
17. Persson JN, Kim JS, Good RJ. Diagnostic Utility of Point-of-Care Ultrasound in the Pediatric Cardiac Intensive Care Unit. Curr Treat Options Pediatr. 2022;8(3):151–73. https://doi.org/10.1007/s40746-022-00250-1 PMID:36277259
18. Kaiser RS, Sarkar M, Raut SK, Mahapatra MK, Zaman MA, Roy O, et al. A study to compare ultrasound-guided and clinically guided fluid management in children with septic shock. Indian J Crit Care Med. 2023 Feb;27(2):139–46. https://doi.org/10.5005/jp-journals-10071-24410 PMID:36865513
19. Chidini G, Raimondi F. Lung ultrasound for the sick child: less harm and more information than a radiograph. Eur J Pediatr. 2024 Mar;183(3):1079–89. https://doi.org/10.1007/s00431-023-05377-3 PMID:38127086
20. Greer DM, Kirschen MP, Lewis A, et al. Pediatric and Adult Brain Death/Death by Neurologic Criteria Consensus Guideline Neurology. 2024 13;102(3):e208108.
21. González-Dambrauskas S, Jaramillo-Bustamante JC, Díaz F. No one is better than all together: the role of networks in pediatric intensive care. Rev Bras Ter Intensiva. 2019 Oct;31(3):277–81. https://doi.org/10.5935/0103-507X.20190043 PMID:31618344

 ORCID
ORCID