Gerardo Alberto Solís Pérez1*, Tomás Segura Fernández2, Luz Elena Carpio Domínguez2, Diego Escarramán Martínez3, Manuel Alberto Guerrero Gutiérrez4, David Pascual Rojas Flores5
Recibido: 01-08-2025
Aceptado: 02-09-2025
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 5 pp. 513-522|https://doi.org/10.25237/revchilanestv54n5-05
PDF|ePub|RIS
Ventilator programming in pediatric single-lung ventilation
Abstract
Objective: To provide evidence-based guidance for appropriate ventilator programming in pediatric patients undergoing one-lung ventilation. Method: A non-systematic literature search was conducted using the PubMed and Cochrane metasearch engines on pediatric one-lung ventilation and pediatric thoracic surgery, using the following terms as reference: tidal volume, respiratory rate, inspiration-expiration ratio, positive end-expiratory pressure, fraction of inspired oxygen, and ventilatory mode. Conclusion: One-lung ventilation in pediatrics is challenging. The anatomical and physiological characteristics of pediatric patients make this type of ventilation an art form, designed to achieve optimal surgical and anesthetic conditions and obtain the best patient outcomes.
Resumen
Objetivo: Proporcionar una guía basada en la mejor evidencia para la programación adecuada del ventilador en paciente pediátricos sometidos a ventilación unipulmonar. Método: Se realizó una búsqueda no sistemática de la literatura en los metabuscadores PubMed y Cochrane sobre la ventilación unipulmonar pediátrica y cirugía torácica pediátrica tomando como referencia los siguientes términos: volumen corriente, frecuencia respiratoria, relación inspiración espiración, presión positiva al final de la espiración, fracción inspirada de oxígeno y modo ventilatorio. Conclusión: La ventilación unipulmonar en pediatría es un reto. Las características anatómicas y fisiológicas de los pacientes pediátricos condicionan que este tipo de ventilación sea un arte para lograr las mejores condiciones quirúrgicas y anestésicas obteniendo los mejores resultados para el paciente.
Introducción
La cirugía torácica y la anestesia para cirugía torácica pediátrica han cambiado drásticamente durante los últimos 15 años con la llegada de la cirugía toracoscópica videoasistida (VATS) y la cirugía robótica (RATS). Aunque la cirugía VATS ha ganado popularidad, la toracotomía sigue siendo un procedimiento quirúrgico relativamente frecuente, especialmente en lactantes muy pequeños, en quienes el equipo toracoscó- pico suele ser demasiado grande para realizar procedimientos complejos. La cirugía toracoscópica videoasistida ha reducido significativamente el número de días de hospitalización tras procedimientos torácicos complejos[1].
En el contexto de cirugía torácica pediátrica, podemos reducir las indicaciones de ventilación unipulmonar (VUP) a 3[2]:
1. Controlar la distribución de la ventilación: fístulas broncopleurales, quistes pulmonares unilaterales gigantes o bullas y ventilación pulmonar diferencial.
2. Evitar contaminación: infección, hemorragia y lavado pulmonar unilateral.
3. Proporcionar campo quirúrgico: toracoscopia, toracotomía y cirugía torácica no pulmonar.
Diferencias en la ventilación y perfusión: Adultos vs Niños
La ventilación, por lo general, se dirige preferentemente a las regiones declives del pulmón, generando un gradiente que aumenta desde las zonas menos dependientes hacia las más dependientes. A causa de la gravedad, la perfusión suele presentar un patrón semejante, con mayor flujo sanguíneo en los segmentos declives, lo que permite un buen equilibrio entre ventilación y perfusión (V/Q). En el caso de los lactantes, la ventilación se orienta principalmente hacia las áreas no declives, mientras que la perfusión se distribuye de forma más homogénea debido a la menor distancia anteroposterior de su tórax, lo que reduce el impacto de la gravedad. Esta combinación da lugar a un mayor desequilibrio en la relación V/Q.
Durante la cirugía torácica, diversos factores incrementan el desajuste en la relación ventilación/perfusión (V/Q). La anestesia general, el uso de bloqueadores neuromusculares y la ventilación mecánica reducen la capacidad residual funcional de ambos pulmones. Además, la compresión del pulmón dependiente en decúbito lateral puede inducir atelectasia, mientras que la retracción quirúrgica o la ventilación de un solo pulmón provocan el colapso del pulmón intervenido. La vasoconstricción pulmonar hipóxica, que ayuda a redirigir el flujo sanguíneo alejándolo de áreas mal ventiladas para limitar el desajuste V/Q, puede verse inhibida por anestésicos inhalatorios y fármacos vasodilatadores. Estos mecanismos se observan tanto en bebés como en niños y adultos. Sin embargo, el impacto del decúbito lateral sobre la relación V/Q difiere entre lactantes y pacientes mayores. En adultos con una enfermedad pulmonar unilateral, la oxigenación es mejor si el pulmón sano está en posición dependiente (abajo) y el afectado no dependiente (arriba), gracias al mayor flujo sanguíneo hacia el pulmón funcional y menor hacia el dañado, favorecido por el gradiente gravitacional. Esto mejora la correspondencia V/Q en la cirugía torácica en decúbito lateral[3].
En cambio, en lactantes con patología pulmonar unilateral, la oxigenación mejora cuando el pulmón sano está arriba[4],[5]. Esto se debe a varias particularidades: la caja torácica blanda de los lactantes no sostiene adecuadamente el pulmón dependiente, lo que reduce la capacidad residual funcional hasta acercarla al volumen residual y facilita el cierre de vías aéreas incluso durante la respiración normal[6]. Además, a diferencia de los adultos, el diafragma dependiente en los lactantes no obtiene ventaja funcional significativa, ya que el gradiente de presión abdominal es menor. También, el reducido tamaño corporal de los lactantes disminuye el gradiente hidrostático entre ambos pulmones, limitando el aumento de perfusión hacia el pulmón dependiente.
Comprender el desarrollo pulmonar tras el nacimiento es clave para anticipar la función respiratoria después de una resección pulmonar en niños. El número de alvéolos crece de unos 20 millones al nacer a cerca de 300 millones hacia los 8 años, con el crecimiento más rápido en los primeros tres años. A partir de los 8 años, el número se estabiliza, y el aumento del volumen pulmonar hasta los 25 años se debe al crecimiento de los alvéolos. Finalmente, el mayor consumo de oxígeno de los lactantes (6-8 ml O2/kg/min frente a 2-3 ml O2/kg/min en adultos), sumado a su menor capacidad residual funcional, los hace más susceptibles a hipoxemia y desaturación durante la cirugía en decúbito lateral.
Programación del ventilador paso a paso
Volumen corriente
La ventilación mecánica en cirugía torácica tiene dos tiempos. La ventilación bipulmonar (VBP) y la ventilación unipul- monar (VUP). Debemos recordar que cuando se requiere VUP, ya sea en adultos o niños, nuestro pulmón se debe considerar “enfermo” por lo cual el volumen corriente se calculara con el Peso Predicho (PP)[7] para pacientes mayores de 30 kg y si es menor de ese peso, según el Second Pediatric Acute Lung Injury Consensus Conference (PALICC-2) se deberá tomar en cuenta el peso menor entre el real y el percentilado[8].
El último estudio publicado en el 2024 por Zhu et al., incluyo 213 niños menores de 6 años para resección pulmonar. Se dividieron en tres grupos: Ventilación Convencional (sin presión positiva al final de la espiración (PEEP)) y Protección pulmonar (que se dividió a su vez en dos grupos: con maniobra de reclutamiento y con 5 cmH2O de PEEP) donde el volumen corriente (VT) se calculó a 10-8 mL/kg peso real para la VBP y a 6 mL/kg peso real para la VUP. No se encontró diferencia en la aparición de complicaciones pulmonares posoperatorias (CPP) a los 7 días; 16,9% para el grupo de intervención y el grupo control 21,1% (p = 0,45)[9].
El estudio de Lee et al., publicado en 2019, que incluyo 110 niños menores de 5 años programados para resección pulmonar, se asignaron a los pacientes a dos grupos: protección pulmonar (VBP con VT de 6 mL/kg peso real y VUP 4 mL/kg peso real) y grupo control (VBP con VT de 10 mL/kg peso real y VUP 8 mL/kg peso real). Las CPP a los 7 días fueron de 9,1% en el grupo de protección pulmonar respecto al 25,5% en el grupo control (OR = 0,29 [0,10-0,88]; p = 0,02)[10].
Conclusión: con la evidencia actual se recomienda programar el volumen corriente en ventilación bipulmonar a 8-10 mL/ kg al menor de los dos pesos y en ventilación unipulmonar a 5-6 mL/kg al menor de los dos pesos. La disminución de la dis- tensibilidad pulmonar en niños pequeños hace que en ocasiones no se puede elevar el VT por arriba de 6 ml/kg.
Frecuencia respiratoria
Debemos recordar que el dióxido de carbono (CO2) y frecuencia respiratoria (FR) están relacionados. Es de vital importancia tener en cuenta el rango de frecuencia respiratoria por grupo etario (Tabla 1)[11],[12].
Los niveles normales de CO2 para México se pueden obtener del estudio de Padilla et al., aunque hay que señalar que son valores estimados por fórmulas[13].
Durante la VUP, al disminuir el volumen corriente por debajo de 5 mL/kg se presenta un aumento en el CO2. Esto es debido a que disminuye el volumen minuto. Un aumento moderado de la PaCO2 puede ser beneficioso en niños durante los procedimientos toracoscópicos. En un estudio con 12 niños sometidos a cirugía toracoscópica videoasistida para el cierre del conducto arterioso persistente, la hipercapnia con valores de PaCO2 entre 50 y 70 mmHg aumentó el gasto cardíaco y la tensión arterial y venosa central de oxígeno[14]. Como media se ha establecido el valor de 60 mmHg como punto de cohorte donde el CO2 puede autorregularse[15].
Aquí yace uno de los principales problemas en la VUP pe- diátrica[16]: establecer los límites permitidos de hipercapnia. Esto se debe a los posibles efectos perjudiciales de la hipercap- nia sobre el sistema inmunitario, el sistema nervioso central, los pulmones, el corazón, el hígado y los riñones[17]. Según el consenso PALICC-2 mientras el pH no baje de 7,2 es permitida la hipercapnia[8].
Conclusión: programar la frecuencia respiratoria en función al grupo etario y al nivel de CO2, si es posible guiarlo acorde a la altitud. El límite para suspender una VUP es cuando nuestro CO2 se eleva más allá de 60 mmHg o tener un pH menor de 7,2.
Presión positiva al final de la espiración (PEEP)
El uso de PEEP en cirugía torácica es esencial para mantener una adecuada ventilación y disminuir el riesgo de hipoxia y atelectasias. La posición de decúbito lateral, dependiendo el lado a operar, juega un papel primordial en la perdida de aérea que es posible ventilar; del lado derecho se pierde aproximadamente 2,1% del aérea del pulmón por la posición del corazón y del lado izquierdo 7,4%, lo cual mejora con la aplicación de PEEP[18]. En niños pequeños, el uso de VT y PEEP bajos se ha considerado un estándar al momento de la VUP[19], aunque la definición de ventilación protectora en cirugía de tórax y VUP no esta de todo claro en la población pediátrica[20].
| Tabla 1. Frecuencias respiratorias medias, por edad | |
| Edad | Frecuencia respiratoria (ventilaciones/minuto) |
| Prematuro | 40-70 |
| 0-3 meses | 35-55 |
| 3-6 meses | 30-45 |
| 6-12 meses | 25-45 |
| 1-3 años | 20-30 |
| 3-6 años | 20-25 |
| 6-12 años | 14-22 |
| Adulto | 12-18 |
Fuente: Fleming S, Thompson M, Stevens R, Heneghan C, Pluddemann A, Maconochie I, Tarassenko L, Mant D. Normal ranges of heart rate and respiratory rate in children from birth to 18 years of age: a systematic review of observational studies. Lancet. 2011 Mar 19;377(9770):1011-8. doi: 10.1016/S0140-6736(10)62226-X. PMID: 21411136; PMCID: PMC3789232.
Durante la VBP el uso de PEEP puede calcularse acorde al consenso PALICC-2 con valores de 3-5-8 cmH2O con un acuerdo fuerte para su aplicación. En el momento de realizar VUP el estudio de Lee et al., se observó que el uso de volúmenes corrientes de 4 ml/kg combinados con 6 cm de H2O de PEEP durante la VUP redujo el riesgo de CPP[10]. Zhu et al., informó que la presión de distensión fue menor con PEEP de 5 cmH2O que al estandarizar el PEEP con maniobra de reclutamiento (17 cmH2O)[9].
Conclusión: el uso de PEEP es esencial para prevenir la hi- poxia durante la VUP en cirugía torácica pediátrica. Con la evidencia actual y debido a las limitaciones del pulmón pediátrico el uso de PEEP debe oscilar entre 5-6 cmH2O durante la VUP. En VBP y acorde a la dinámica ventilatoria titular el PEEP acorde al consenso PALICC-2 (3-5-8 cmH2O).
Relación Inspiración/Espiración (RIE)
En la población adulta la RIE siempre es 1:2 bajo ventilación mecánica a dos pulmones[21] excepto en algunas patologías como el broncoespasmo[22]. Para pacientes adultos durante la VUP una RIE de 1:1 parece tener ciertos beneficios. Lee et al., en un estudio que incluyo 100 paciente para VUP, encontró que la presión parcial de oxígeno arterial (PaO2) después de 60 min de VUP fue significativamente menor con una RI:E 1:2 en comparación con RI:E 1:1 (207,76 frente a 264,02 mmHg, res- pectivamente)[23].
Para la población pediátrica no hay mucha evidencia al respecto. El único artículo que habla sobre la modificación de la RIE es de 2024 con población neonatal de 1 a 10 días de nacidos sometidos a VUP para reparación de fistula traqueoeso- fágica abierta. Se incluyeron 40 neonatos a término sometidos a toracotomía derecha. Se asignaron a dos grupos: ventilación de relación inversa RI:E 2:1 y relación convencional RI:E 1:2. Se reporto una tendencia a la reducción en la incidencia de desaturaciones graves (15% con RI:E 2:1 vs 35% con RI:E 1:2 con un RR de 0,429 (0,129-1,426) IC del 95%. Se redujo la incidencia de todas las desaturaciones 40% con RI:E 2:1 vs 75% con RI:E 1:2 con un RR de 0,533 (0,295-0,965) lo que llevo a una disminución en el tiempo de cirugía[24].
Conclusión: la programación de la RIE debe estar guiada acorde a la mecánica ventilatoria. La evidencia sugiere que en paciente mayores una RIE 1:1 parece ser beneficiosa para disminuir el espacio muerto, aumentar la oxigenación y disminuir la presión meseta. Para población neonatal una RIE 2:1 disminuye los eventos de desaturación.
Fracción inspirada de oxígeno (FiO2)
Tradicionalmente, durante la VUP en la población pediátrica se ha usado una FiO2 por arriba del 90% para evitar la hi- poxia[19]. Sin embargo, muchos estudios han demostrado que el uso de una FiO2 alta puede estar asociado con daño oxidativo en diversos tejidos y complicaciones pulmonares[25],[26]. Estos riesgos pueden ser aún mayores en pacientes jóvenes[27]. Se recomienda ajustar la FiO2 acorde a los valores de la Saturación Periférica de Oxígeno (SpO2) para mantenerla entre 95%-98% para la población pediátrica[28] y en población mayor entre 92%-96%[29],[30]. La titulación de la FiO2 en cirugía de tórax está regida por tres tiempos: el inicio de la ventilación bipulmonar, el inicio de la ventilación unipulmonar y la reexpansión del pulmón[31].
Debido a la falta de evidencia en este rubro, podemos guiarnos y tomar como referencia los niveles de SPO2 acorde al PEEP que programamos con base al conceso PALICC-2 para los pacientes pediátricos sometidos VBP: PEEP < 10 cmH2O para una SpO2 92-97% y si PEEP > 10 cmH2O una SPO2 de 88%-92%[8].
Conclusión: titular la FiO2 acorde a la SpO2. Una SpO2 entre 95% y 98% parece ser ideal. En caso de ser necesario, guiarse por gasometría para obtener una PaO2 entre 60 y 100 mmHg.
Modo ventilatorio
La selección del modo ventilatorio en anestesia pediátrica sigue en discusión. No hay un conceso respecto a cuál usar. El Paediatric Mechanical Ventilation Consensus Conference (PEMVECC) sobre la ventilación mecánica en niños críticos nos indica que no hay recomendación respecto a que modo ventila- torio usar (Controlado por Volumen o Controlado por Presión) con un acuerdo fuerte[32].
El modo de ventilación adecuado para la VUP en pacientes pediátricos sometidos a cirugía torácica; sea abierta o VATS, sigue siendo controvertido. Sin embargo, la VUP no es fisiológica y puede causar efectos adversos en el sistema respiratorio, lo que resulta en un desequilibrio en la relación ventilación/flujo sanguíneo, un aumento del shunt intrapulmonar (Qs/Qt) y una disminución de la PaO2[33].
Kaimin et al., analizaron 74 paciente pediátricos de manera retrospectiva entre 1 y 7 días de nacidos sometidos a cirugía torácica con VUP. Se compararon dos modos ventilatorios Control Volumen (VCV) y Control Presión con Volumen Garantizado (PCV-VG). Se encontró que el modo PCV-VG proporcionaba menos presiones de la vía aérea a lo largo del tiempo: presión meseta 18,78 vs 16,27 cmH2O, presión pico 22,59 vs 20,95 cmH2O y la distensibilidad dinámica mejora: 13,19 vs 16,70 ml/ cmH2O. En el posoperatorio, el modo PCV-VG se asoció con una menor duración de la ventilación mecánica, la estancia en la UCI y la estancia hospitalaria (p < 0,05)[34].
Para niños entre 1 mes y 1 año, Wang et al., comparo VCV y PCV-VG para cirugía torácica por VATS y VUP. Los niños manejados con PCV-VG presentaron presiones de la vía aérea (presión pico y presión media) relativamente menores a las 2 h de VUP. La distensibilidad dinámica fue mayor a las 2 h. Sin embargo, ninguno de los indicadores mostró diferencias significativas entre estos dos grupos a la primera hora en comparación con la tercera (p > 0,05 en todos los casos). La incidencia de hipoxemia fue significativamente mayor en el manejado por VCV que en el grupo PCV-VG (p < 0,05)[35].
Para pacientes adolescentes se pueden manejar con parámetros de adultos. Tan et al., compararon los modos VCV contra PCV. Sesenta pacientes adultos sometidos a VUP. Se midieron las presiones de la vía aérea a lo largo del tiempo y la producción de factores proinflamatorios. La resistencia de la vía aérea (Raw) fue significativamente menor en el grupo PCV en comparación con el grupo VCV en T2 (26,0 ± 3,8 frente a 29,9 ± 7,3 cmH2O/L/s), T3 (26,0 ± 3,7 frente a 30,2 ± 7,7 cmH2O/L/s) y T4 (25,8 ± 4,1 frente a 29,6 ± 6,7 cmH2O/L/s). Se observaron tendencias similares para la presión pico (Ppico) y la presión meseta (Pplat). La presión media (Pmedia) fue similar en ambos grupos. En comparación con el grupo PCV, los niveles de TNF-a e interleucina 6 en el grupo VCV aumentaron significativamente (p < 0,05 en todos los casos)[36].
Conclusión: no hay consenso de qué modo ventilatorio usar. Para pulmones sanos en la población pediátrica no hay una recomendación de qué modo usar. Para la VUP con la evidencia actual el modo PCV-VG parece tener beneficios en los niños menos de 5 años. Para pacientes mayores el modo PCV tiende a mostrar beneficios.
Programar para obtener metas
La programación de los parámetros ventilatorios tiene como fin lograr metas de protección pulmonar. En el ámbito de la cirugía torácica pediátrica y VUP todavía no hay pautas claras sobre que metas obtener es por tal motivo que mencionaremos las metas más aceptadas para la población adulta. Podemos transpolar las características del pulmón ventilado como si fuera una entidad que se comportara como síndrome de Distrés Respiratorio Pediátrico (PARDS por sus siglas en inglés) para así guiar nuestra ventilación en este escenario.
Presión pico
Idealmente se debe mantener lo más baja posible. Debemos recordar que la posición en decúbito lateral incrementa el valor de esta presión debido a los puntos de fijación[37]. En personas adultas el simple cambio de posición incrementa el valor de la presión pico hasta en 55,1%[38]. Para la población pediátrica el máximo de presión pico seria < 32 cmH2O[32].
Presión meseta
Es la presión generada por la distribución del aire dentro del pulmón, con el fin de vencer el retroceso elástico del pulmón. En adultos se incrementa con el cambio de posición hasta un 42%[38]. Un punto aceptable para los niños mayores es < 25 cmH2O[39] pero para los niños más pequeños < 32 cmH2O[32].
Presión de distensión
Depende de la relación entre la distensibilidad pulmonar (Cst), PEEP y el volumen corriente inspirado (VT). En cirugía torácica para personas adultas se ha establecido un punto de cohorte de < 12 cmH2O, pero depende de varios factores como grado de la enfermedad y capacidad pulmonar basal[40]. En el escenario de cirugía torácica pediátrica y VUP un punto de cohorte aceptable es <15 cmH2O[32].
Poder mecánico
Es la fuerza medida de Joules (J) ejercida por el ventilador mecánico. En la población adulta se sabe que la posición de decúbito lateral incrementa su valor[41]. En el 2024 Yoon et al., encontraron en 1.055 pacientes sometidos a VUP que si el valor basal del poder mecánico incrementa con el tiempo hay mayor riesgo de complicaciones[42]. Para la población pediátrica lo único que hay descrito es que si hay un aumento de 0,1 J respecto al basal hay un incremento en la mortalidad con un OR de 0,93%[43].
¿Qué hacer en caso de hipoxemia?
La hipoxemia durante la VUP se debe a la mezcla venosa a través de shunts y áreas con unidades de intercambio de gases con baja V/Q[44]. La hipoxemia grave es relativamente frecuente en niños sometidos a VUP según una cohorte retrospectiva de Templeton et al., con una frecuencia del 18%[45].
Los factores de riesgo asociados con mayor frecuencia a este evento son cirugías del lado derecho y el uso de ventilación no diferencial en niños donde el uso de bloqueador bronquial esta indicado[45]. En la posición lateral, el menor gradiente hi- drostático presente en niños reduce la perfusión preferencial del pulmón ventilado en comparación con los adultos, lo que provoca una derivación adicional incrementando la hipoxe- mia[3],[5].
El uso de bloqueador bronquial y la presencia de menos hipoxemia parece contraintuitivo, pero quedo demostrado por Yan et al., donde la intubación endobronquial se utilizó casi el doble que los bloqueadores bronquiales para instaurar la VUP en esta cohorte de pacientes, tanto de centros privados como académicos. Se especula que esto probablemente se relacione con una mayor facilidad técnica en términos de ejecución. La profundidad precisa de la colocación de un tubo endotraqueal puede ser difícil en niños pequeños y lactantes, incluso con el uso de un broncoscopio de fibra óptica flexible[46].
Revisando la literatura disponible, nos dimos a la tarea de desarrollar una serie de pasos y un algoritmo para realizar acciones correctivas en caso de hipoxemia durante la VUP en cirugía torácica pediátrica.
1. Seleccionar el mejor dispositivo: Las características anatómicas y fisiológicas de la población pediátrica hace que la VUP y la correcta exclusión pulmonar sea un reto. Se debe practicar las diferentes competencias necesarias para una adecuada exclusión pulmonar (colocación de bloqueadores bronquiales, uso de fibrobroncoscopio, colocación de sondas de doble luz y exclusión pulmonar con tubos de una sola luz). En la Figura 1 se observa el mejor método de exclusión pulmonar por grupo etario.
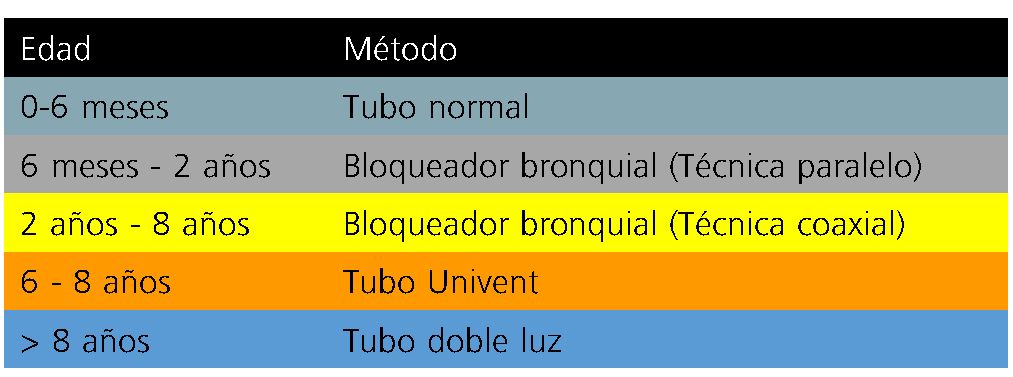
Figura 1. Tomado y modificado de: Letal M, Theam M. Paediatric lung isolation. BJA Educ. 2017;17(2):57-62.
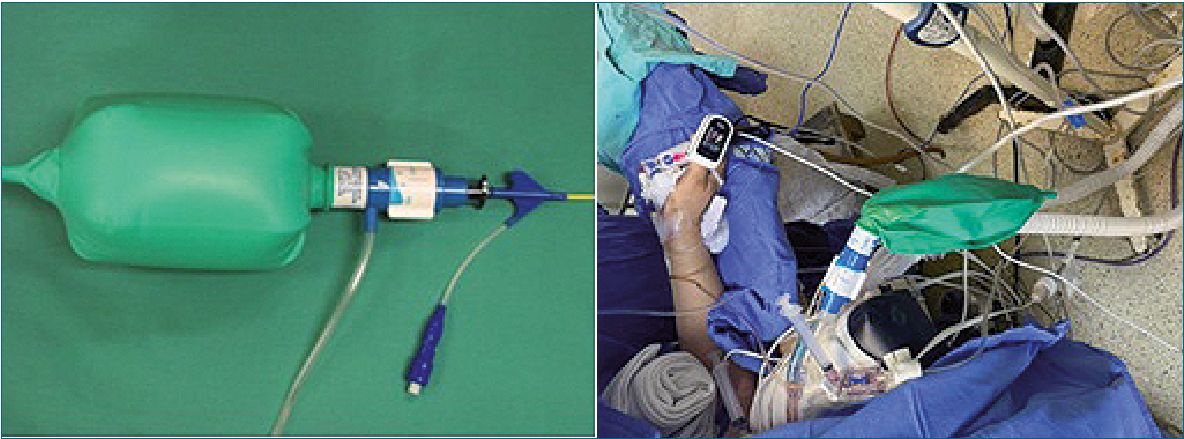
Figura 2. Fuente: imagen del autor.
2. Verificar la adecuada colocación del dispositivo: En las intubaciones endobronquiales derechas, con frecuencia la derivación del lóbulo superior derecho se encuentra a menos de 1 cm de la carina, lo que reduce considerablemente el margen de error para una colocación correcta y aumenta considerablemente la probabilidad de excluir todo el lóbulo superior derecho[47]. Además, durante la intubación endo- bronquial, el sellado a nivel del bronquio es incompleto, lo que puede provocar la fuga de secreciones, sangre y moco del lado operatorio al pulmón declive. Por ende, se debe verificar la adecuada colocación del dispositivo con fibro- broncoscopio o videotubo de doble luz.
3. Aspiración: En caso de detectar secreciones, tener el mate-
rial necesario para la succión, con cánulas de diferente calibre y un aspirador funcional y con la presión correspondiente. Se recomienda una presión negativa de 120-150 mmHg en adultos, 80-120 mmHg en adolescentes, 80-100 mmHg en niños y 60-80 mmHg en neonatos[48].
4. Incrementar FiO2: En caso de tener mezcla de oxígeno se debe elevar la FiO2 al 100%. Hay que recordar que entre más pequeño sea el paciente hay más riesgo de toxicidad por oxigeno[27].
5. Si hay uso de sonda de doble luz, usar Presión Positiva Continua en la vía respiratoria (CPAP) en el pulmón no dependiente: La aplicación de CPAP al pulmón no ventilado durante la VUP para cirugía torácica fue descrita por primera vez por Capan[49]. Se cree que la CPAP mejora la oxigenación mediante un mecanismo pasivo (captación de oxígeno por los alvéolos con administración continua de oxígeno). Se recomienda comenzar con CPAP de 5 cmH2O y aumentar progresivamente hasta no más de 10 cmH2O. Para el CPAP funcione, debe aplicarse a un pulmón al menos parcialmente reexpandido antes de ajustarlo al volumen deseado Figura 2[50].
6. Retorno a la ventilación bipulmonar: Como última maniobra se debe regresar a la ventilación bipulmonar. Si nuestro colapso pulmonar es con un dispositivo que evita la reexpansión a discreción, como por ejemplo bloqueador bronquial o tubo de una luz, se debe avisar al cirujano, ya que, si no se cuenta con fibrobroncoscopio adecuado, la ventilación unipulmonar será imposible Figura 3.
7. Misceláneos: Se ha reportado el uso de medicamentos para mejorar la oxigenación durante la VUP en cirugía torácica pediátrica. La almitrina es el medicamento mejor estudiado, desafortunadamente no se encuentra disponible en Méxi- co[51]. La fenilefrina se ha reportado como una opción para mejorar la oxigenación y la vasoconstricción pulmonar hipó- xica durante la VUP[52]. Aunque un estudio publicado en el 2018 parece indicar que no hay ningún beneficio[53].
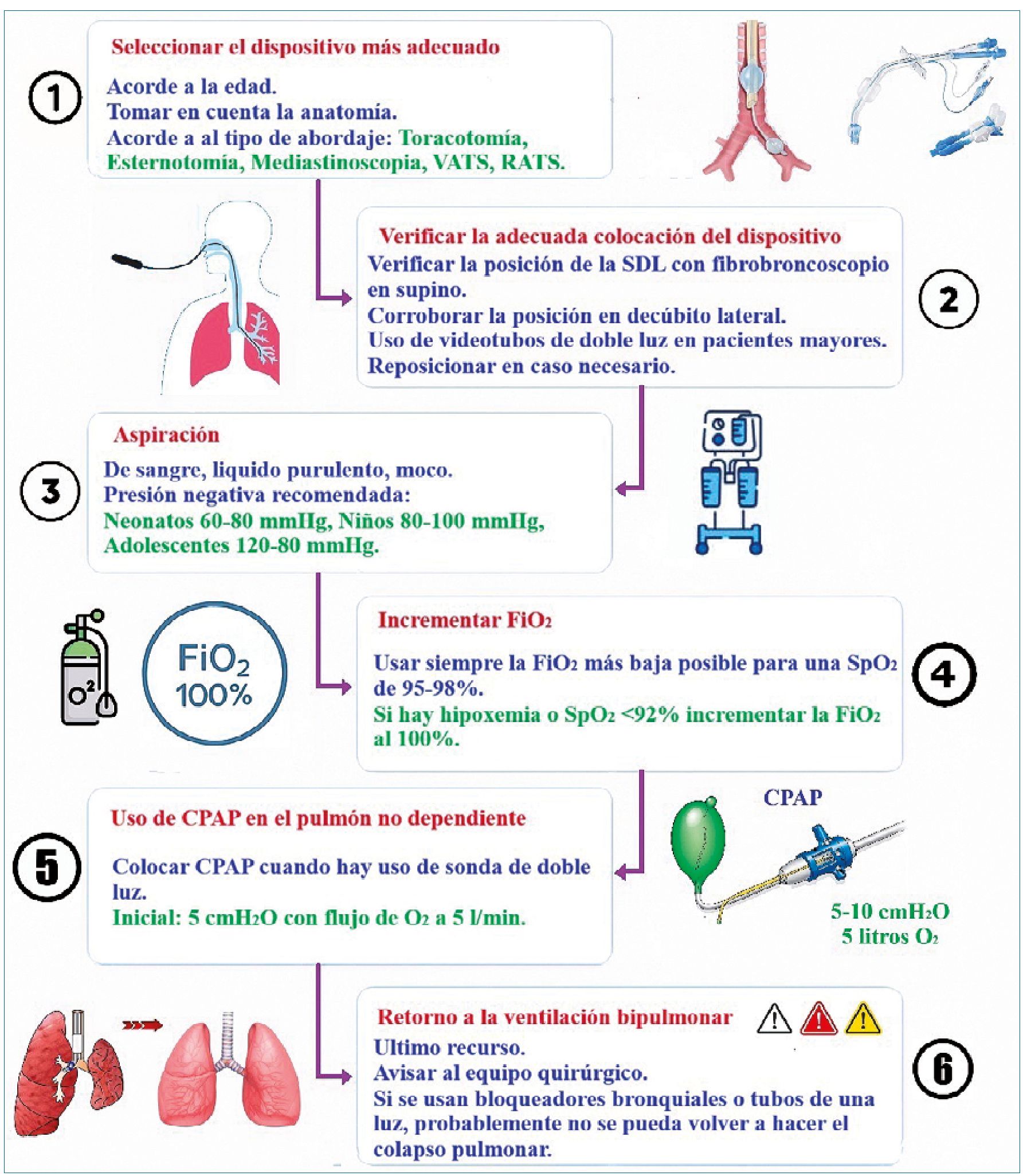
Figura 3. Tomado y modificado de: Lazar A, Chatterjee D, Templeton TW. Error traps in pediatric one-lung ventilation. Paediatr Anaesth. 2022 Feb;32(2):346-353. doi: 10.1111/pan.14333. Epub 2021 Nov 21. PMID: 34767676. Imagen diseñada por SPGA.
Conclusión
En la Tabla 2 mostramos un resumen visual de la programación parámetro a parámetro con la evidencia actual. Es necesario seguir realizando estudios en la población pediátrica, ya que el advenimiento de nuevas tecnologías para lograr el colapso pulmonar a edades cada vez menores hace que la ventilación mecánica a un solo pulmón sea todo un reto para el anestesiólogo. Tabla 2. Parámetros ventilatorios en el paciente pediátrico para cirugía de tórax

GASP; se encargó de la conceptualización de la idea y redacción del manuscrito, TSF; se encargó de la redacción del manuscrito, LECD se encargó de la búsqueda de artículos y diseño de imágenes, DEM y MAGG se encargaron de la edición y corrección estadística y DPRF se encargó de la revisión y corrección del manuscrito.
Referencias
1. da Nobrega Oliveira RE, de Andrade Pontual Peres C, Oliveira AC, Onyeji P, Kemczenski F. Comparative outcomes of video-assisted thoracic surgery versus open thoracic surgery in pediatric pulmonary metastasectomy: a systematic review and meta-analysis. Pediatr Surg Int. 2024 Dec;41(1):34. https://doi.org/10.1007/s00383-024-05934-3 PMID:39699640
2. Body SC, Hartigan PM. Applied thoracic physiology. In: Hemmings HC Jr, Hopkins PM, editors. Foundations of Anesthesia, Basic and Clinical Sciences. London: Harcourt; 2000. pp. 515–24.
3. Remolina C, Khan AU, Santiago TV, Edelman NH. Positional hypoxemia in unilateral lung disease. N Engl J Med. 1981 Feb;304(9):523–5. https://doi.org/10.1056/NEJM198102263040906 PMID:6779161
4. Murray-Torres TM, Winch PD, Naguib AN, Tobias JD. Anesthesia for thoracic surgery in infants and children. Saudi J Anaesth. 2021;15(3):283–99. https://doi.org/10.4103/sja.SJA_350_20 PMID:34764836
5. Heaf DP, Helms P, Gordon I, Turner HM. Postural effects on gas exchange in infants. N Engl J Med. 1983 Jun;308(25):1505–8. https://doi.org/10.1056/NEJM198306233082505 PMID:6406888
6. Mansell A, Bryan C, Levison H. Airway closure in children. J Appl Physiol. 1972 Dec;33(6):711–4. https://doi.org/10.1152/jappl.1972.33.6.711 PMID:4643846
7. Brower RG, Matthay MA, Morris A, Schoenfeld D, Thompson BT, Wheeler A; Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med. 2000 May;342(18):1301–8. https://doi.org/10.1056/NEJM200005043421801 PMID:10793162
8. Bhalla A, Baudin F, Takeuchi M, Cruces P; Second Pediatric Acute Lung Injury Consensus Conference (PALICC-2) of the Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) Network. Monitoring in Pediatric Acute Respiratory Distress Syndrome: From the Second Pediatric Acute Lung Injury Consensus Conference. Pediatr Crit Care Med. 2023 Feb;24(12 Suppl 2):S112–23. https://doi.org/10.1097/PCC.0000000000003163 PMID:36661440
9. Zhu C, Zhang M, Zhang S, Zhang R, Wei R. Lung-protective ventilation and postoperative pulmonary complications during pulmonary resection in children: A prospective, single-centre, randomised controlled trial. Eur J Anaesthesiol. 2024 Dec;41(12):889–97. https://doi.org/10.1097/EJA.0000000000002063 PMID:39238348
10. Lee JH, Bae JI, Jang YE, Kim EH, Kim HS, Kim JT. Lung protective ventilation during pulmonary resection in children: a prospective, single-centre, randomised controlled trial. Br J Anaesth. 2019 May;122(5):692–701. https://doi.org/10.1016/j.bja.2019.02.013 PMID:30916035
11. Smith R, Cable B. Laryngeal Disorders. In: McMillan J, Feigin R, De Angelis C, et al., editors. Oski’s Pediatrics: Principles and Practice. Philadelphia: Lippincott Williams & Wilkins; 2006. pp. 1411–21.
12. Fleming S, Thompson M, Stevens R, Heneghan C, Plüddemann A, Maconochie I, et al. Normal ranges of heart rate and respiratory rate in children from birth to 18 years of age: a systematic review of observational studies. Lancet. 2011 Mar;377(9770):1011–8. https://doi.org/10.1016/S0140-6736(10)62226-X PMID:21411136
13. Vázquez GJ, Pérez PR. Valores gasométricos estimados para las principales poblaciones y sitios a mayor altitud en México. Rev Inst Nal Enf Resp Mex. 2000;13(1):6–13.
14. Mukhtar AM, Obayah GM, Elmasry A, Dessouky NM. The therapeutic potential of intraoperative hypercapnia during video-assisted thoracoscopy in pediatric patients. Anesth Analg. 2008 Jan;106(1):84-8, table of contents. https://doi.org/10.1213/01.ane.0000297419.02643.d7.. PMID: 18165558.
15. Repessé X, Charron C, Vieillard-Baron A. Acute respiratory distress syndrome: the heart side of the moon. Curr Opin Crit Care. 2016 Feb;22(1):38–44. https://doi.org/10.1097/MCC.0000000000000267 PMID:26627538
16. Goonasekera C, Mathew M, Kurup M, James S. When to abandon single-lung anesthesia during video-assisted thoracoscopic surgery (VATS) in infants and young children: A case-based review. Saudi J Anaesth. 2021;15(4):424–7. https://doi.org/10.4103/sja.sja_171_21 PMID:34658730
17. Silvestre C, Vyas H. Is permissive hypercapnia helpful or harmful? Paediatr Child Health (Oxford). 2015;25(4):192–5. https://doi.org/10.1016/j.paed.2014.10.014.
18. Mase K, Noguchi T, Tagami M, Imura S, Tomita K, Monma M, et al. Compression of the lungs by the heart in supine, side-lying, semi-prone positions. J Phys Ther Sci. 2016 Sep;28(9):2470–3. https://doi.org/10.1589/jpts.28.2470 PMID:27799672
19. Lazar A, Chatterjee D, Templeton TW. Error traps in pediatric one-lung ventilation. Paediatr Anaesth. 2022 Feb;32(2):346–53. https://doi.org/10.1111/pan.14333 PMID:34767676
20. Feldman JM. Optimal ventilation of the anesthetized pediatric patient. Anesth Analg. 2015 Jan;120(1):165–75. https://doi.org/10.1213/ANE.0000000000000472 PMID:25625261
21. Silva PL, Ball L, Rocco PR, Pelosi P. Physiological and Pathophysiological Consequences of Mechanical Ventilation. Semin Respir Crit Care Med. 2022 Jun;43(3):321–34. https://doi.org/10.1055/s-0042-1744447 PMID:35439832
22. Oddo M, Feihl F, Schaller MD, Perret C. Management of mechanical ventilation in acute severe asthma: practical aspects. Intensive Care Med. 2006 Apr;32(4):501–10. https://doi.org/10.1007/s00134-005-0045-x PMID:16552615
23. Lee SM, Kim WH, Ahn HJ, Kim JA, Yang MK, Lee CH, et al. The effects of prolonged inspiratory time during one-lung ventilation: a randomised controlled trial. Anaesthesia. 2013 Sep;68(9):908–16. https://doi.org/10.1111/anae.12318 PMID:23789714
24. Youssef AM, El-Ozairy HS, El-Hennawy AM, Amer AM. Inverse ratio ventilation versus conventional ratio ventilation during one lung ventilation in neonatal open repair of esophageal atresia/tracheoesophageal fistula: A randomized clinical trial. Paediatr Anaesth. 2024 Apr;34(4):332–9. https://doi.org/10.1111/pan.14836 PMID:38189583
25. Singer M, Young PJ, Laffey JG, Asfar P, Taccone FS, Skrifvars MB, et al. Dangers of hyperoxia. Crit Care. 2021 Dec;25(1):440. https://doi.org/10.1186/s13054-021-03815-y PMID:34924022
26. Wemple ML, Swenson KE, Swenson ER. Oxygen Therapy Part 2 – Indications and Toxicity. NEJM Evid. 2023 Jul;2(7):EVIDra2300111. https://doi.org/10.1056/EVIDra2300111.. Epub 2023 Jun 27. PMID: 38320167.
27. Habre W, Peták F. Perioperative use of oxygen: variabilities across age. Br J Anaesth. 2014 Dec;113 Suppl 2:ii26–36. https://doi.org/10.1093/bja/aeu380 PMID:25498579
28. Walsh BK, Smallwood CD. Pediatric Oxygen Therapy: A Review and Update. Respir Care. 2017 Jun;62(6):645–61. https://doi.org/10.4187/respcare.05245 PMID:28546370
29. Gottlieb J, Capetian P, Hamsen U, Janssens U, Karagiannidis C, Kluge S, et al. German S3 Guideline: Oxygen Therapy in the Acute Care of Adult Patients. Respiration. 2022;101(2):214–52. https://doi.org/10.1159/000520294 PMID:34933311
30. Cumpstey AF, Oldman AH, Martin DS, Smith A, Grocott MP. Oxygen Targets During Mechanical Ventilation in the ICU: A Systematic Review and Meta-Analysis. Crit Care Explor. 2022 Mar;4(4):e0652. https://doi.org/10.1097/CCE.0000000000000652 PMID:35506014
31. Ko R, McRae K, Darling G, Waddell TK, McGlade D, Cheung K, et al. The use of air in the inspired gas mixture during two-lung ventilation delays lung collapse during one-lung ventilation. Anesth Analg. 2009 Apr;108(4):1092–6. https://doi.org/10.1213/ane.0b013e318195415f PMID:19299766
32. Kneyber MC, de Luca D, Calderini E, Jarreau PH, Javouhey E, Lopez-Herce J, et al.; section Respiratory Failure of the European Society for Paediatric and Neonatal Intensive Care. Recommendations for mechanical ventilation of critically ill children from the Paediatric Mechanical Ventilation Consensus Conference (PEMVECC). Intensive Care Med. 2017 Dec;43(12):1764–80. https://doi.org/10.1007/s00134-017-4920-z PMID:28936698
33. Karzai W, Schwarzkopf K. Hypoxemia during one-lung ventilation: prediction, prevention, and treatment. Anesthesiology. 2009 Jun;110(6):1402–11. https://doi.org/10.1097/ALN.0b013e31819fb15d PMID:19417615
34. Kaimin L, Bijun L, Cheng L, Xiaoxia W. Pressure controlled ventilation with volume guarantee improves outcomes in neonatal thoracoscopic esophageal atresia surgery. Front Pediatr. 2025 May;13:1524883. https://doi.org/10.3389/fped.2025.1524883 PMID:40458451
35. Wang YP, Wei Y, Chen XY, Zhang LX, Zhou M, Wang J. Comparison between pressure-controlled ventilation with volume-guaranteed mode and volume-controlled mode in one-lung ventilation in infants undergoing video-assisted thoracoscopic surgery. Transl Pediatr. 2021 Oct;10(10):2514–20. https://doi.org/10.21037/tp-21-421 PMID:34765475
36. Tan J, Song Z, Bian Q, Li P, Gu L. Effects of volume-controlled ventilation vs. pressure-controlled ventilation on respiratory function and inflammatory factors in patients undergoing video-assisted thoracoscopic radical resection of pulmonary carcinoma. J Thorac Dis. 2018 Mar;10(3):1483–9. https://doi.org/10.21037/jtd.2018.03.03 PMID:29707298
37. Álvarez-Cruz E . Importancia de la fisiología pulmonar en la ventilación mecánica a un solo pulmón. Rev Mex Anest. 2017;40(Suppl: 1):135-137.
38. Szegedi LL, Bardoczky GI, Engelman EE, d’Hollander AA. Airway pressure changes during one-lung ventilation. Anesth Analg. 1997 May;84(5):1034–7. https://doi.org/10.1213/00000539-199705000-00015 PMID:9141927
39. Licker M, Diaper J, Villiger Y, Spiliopoulos A, Licker V, Robert J, et al. Impact of intraoperative lung-protective interventions in patients undergoing lung cancer surgery. Crit Care. 2009;13(2):R41. https://doi.org/10.1186/cc7762 PMID:19317902
40. Park M, Ahn HJ, Kim JA, Yang M, Heo BY, Choi JW, et al. Driving Pressure during Thoracic Surgery: A Randomized Clinical Trial. Anesthesiology. 2019 Mar;130(3):385–93. https://doi.org/10.1097/ALN.0000000000002600 PMID:30664548
41. Chiumello D, Formenti P, Bolgiaghi L, Mistraletti G, Gotti M, Vetrone F, et al. Body Position Alters Mechanical Power and Respiratory Mechanics During Thoracic Surgery. Anesth Analg. 2020 Feb;130(2):391–401. https://doi.org/10.1213/ANE.0000000000004192 PMID:31935205
42. Yoon S, Nam JS, Blank RS, Ahn HJ, Park M, Kim H, et al. Association of Mechanical Energy and Power with Postoperative Pulmonary Complications in Lung Resection Surgery: A Post Hoc Analysis of Randomized Clinical Trial Data. Anesthesiology. 2024 May;140(5):920–34. https://doi.org/10.1097/ALN.0000000000004879 PMID:38109657
43. Bhalla, A. K., Klein, M. J., Modesto I Alapont, V., Emeriaud, G., Kneyber, M. C. J., Medina, A., Cruces, P., Diaz, F., Takeuchi, M., Maddux, A. B., Mourani, P. M., Camilo, C., White, B. R., Yehya, N., Pappachan, J., Di Nardo, M., Shein, S., Newth, C., Khemani, R., & Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) Network (2022). Mechanical power in pediatric acute respiratory distress syndrome: a PARDIE study. Critical care (London, England), 26(1), 2. https://doi.org/10.1186/s13054-021-03853-6.
44. Campos JH, Feider A. Hypoxia During One-Lung Ventilation-A Review and Update. J Cardiothorac Vasc Anesth. 2018 Oct;32(5):2330–8. https://doi.org/10.1053/j.jvca.2017.12.026 PMID:29361458
45. Templeton TW, Miller SA, Lee LK, Kheterpal S, Mathis MR, Goenaga-Díaz EJ, et al.; Multicenter Perioperative Outcomes Group Investigators. Hypoxemia in Young Children Undergoing One-lung Ventilation: A Retrospective Cohort Study. Anesthesiology. 2021 Nov;135(5):842–53. https://doi.org/10.1097/ALN.0000000000003971 PMID:34543405
46. Yan J, Rufang Z, Rong W, Wangping Z. Extraluminal Placement of the Bronchial Blocker in Infants Undergoing Thoracoscopic Surgery: A Randomized Controlled Study. J Cardiothorac Vasc Anesth. 2020 Sep;34(9):2435–9. https://doi.org/10.1053/j.jvca.2020.02.006 PMID:32178953
47. Downard MG, Lee AJ, Heald CJ, Anthony EY, Singh J, Templeton TW. A Retrospective Evaluation of Airway Anatomy in Young Children and Implications for One-Lung Ventilation. J Cardiothorac Vasc Anesth. 2021 May;35(5):1381–7. https://doi.org/10.1053/j.jvca.2020.08.015 PMID:32921610
48. Ireton J. Tracheostomy suction: a protocol for practice. Paediatr Nurs. 2007 Dec;19(10):14–8. PMID:18196852
49. Capan LM, Turndorf H, Patel C, Ramanathan S, Acinapura A, Chalon J. Optimization of arterial oxygenation during one-lung anesthesia. Anesth Analg. 1980 Nov;59(11):847–51. https://doi.org/10.1213/00000539-198011000-00007 PMID:6999948
50. Campos JH, Peacher D. Application of Continuous Positive Airway Pressure During Video-Assisted Thoracoscopic Surgery. Curr Anesthesiol Rep. 2021;11(4):446–56. https://doi.org/10.1007/s40140-021-00479-w PMID:34393664
51. Bermejo S, Gallart L, Silva-Costa-Gomes T, Vallès J, Aguiló R, Puig MM. Almitrine fails to improve oxygenation during one-lung ventilation with sevoflurane anesthesia. J Cardiothorac Vasc Anesth. 2014 Aug;28(4):919–24. https://doi.org/10.1053/j.jvca.2013.03.019 PMID:24016684
52. Schloss B, Martin D, Beebe A, Klamar J, Tobias JD. Phenylephrine to Treat Hypoxemia during One-Lung Ventilation in a Pediatric Patient. Thorac Cardiovasc Surg Rep. 2013 Dec;2(1):16–8. https://doi.org/10.1055/s-0033-1343734 PMID:25360404
53. Godai K, Hasegawa-Moriyama M, Matsunaga A, Kanmura Y. Phenylephrine does not improve oxygenation during one-lung ventilation: A randomized, double-blind, cross-over study. PLoS One. 2018 Apr;13(4):e0195576. https://doi.org/10.1371/journal.pone.0195576 PMID:29630639

 ORCID
ORCID