José Miguel Lizama1, Mauricio Ibacache1, Antonia Cardenas1*
Recibido: 19-08-2025
Aceptado: 18-09-2025
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 5 pp. 611-620|https://doi.org/10.25237/revchilanestv54n5-17
PDF|ePub|RIS
Total intravenous anesthesia in neonates: Considerations for safe practice
Abstract
Total intravenous anesthesia (TIVA) is well established in adults and its use has increased in pediatrics. However, in neonates it remains limited and challenging. Pharmacokinetic and pharmacodynamic differences due to organ immaturity, variations in body composition, and rapid neurodevelopment result in greater sensitivity to anesthetics, reduced clearance, and prolonged half-lives, leading to risks of overdosing and adverse events such as bradycardia and hypotension. This article reviews the physiological and pharmacological foundations of propofol and remifentanil use in neonates, as well as available pharmacokinetic models. It also provides practical recommendations for the safe use of TIVA in this population: drug concentrations, choice of equipment, infusion programming, EEG-based monitoring, and analgesic strategies. Despite the limited evidence available, TIVA in neonates may be considered a valid and safe alternative in selected scenarios, provided that appropriate technical and monitoring considerations are observed.
Resumen
La anestesia total intravenosa (TIVA) está establecida en adultos y ha aumentado en pediatría. Sin embargo, en neonatos sigue siendo limitada y desafiante. Las diferencias en farmacocinética y farmacodinamia derivadas de la inmadurez orgánica, variaciones en composición corporal y rápido neurodesarrollo determinan una mayor sensibilidad a los anestésicos, clearance reducido y tiempos de vida medio prolongados, generando riesgos de sobredosificación y eventos adversos como bradicardia e hipotensión. Este artículo revisa las bases fisiológicas y farmacológicas del uso de propofol y remifentanilo en neonatos y los modelos farmacocinéticos existentes. Asimismo, se entregan recomendaciones prácticas para el uso seguro de TIVA en esta población: concentraciones de drogas, selección de insumos, programación de infusiones, monitorización basada en electroencefalografía y estrategias analgésicas. A pesar de la escasa evidencia disponible, la TIVA en neonatos puede ser considerada una alternativa válida y segura en escenarios seleccionados, si se respetan las consideraciones técnicas y de monitorización adecuadas.
-
Introducción
La anestesia total intravenosa (TIVA por sus siglas en inglés para total intravenous anesthesia) corresponde a la mantención de la anestesia general sin uso de hipnóticos inhalados. Conocidos son sus beneficios e indicaciones (Tabla 1). El uso de TIVA basada en la administración de propofol y un opioide como remifentanilo, es común en adultos y en los últimos años su uso en población pediátrica ha ido en aumento. Sin embargo, el uso de TIVA en la población neonatal es poco frecuente y sigue siendo un desafío. Algunos efectos adversos pueden ser mayores en este grupo etario (por ej. hipotensión y bradicardia)[1],[2]. La evidencia sobre las características far- macocinéticas (PK) y farmacodinámicas (PD) de los fármacos intravenosos en este grupo en particular es limitada. Cambios en los tamaños del compartimento central y volúmenes de distribución y la inmadurez de los sistemas de enzimas metaboli- zadoras, entre otros, dan cuenta de una marcada variabilidad farmacocinética entre estos pacientes[1]-[5]. Además, la inexistencia de formas adecuadas de monitorizar los efectos anestésicos en neonatos, dificultan la administración de una TIVA en esta población[1],[5].
En este documento revisaremos las características fisiológicas fundamentales, propias de los recién nacidos, que determinan diferencias farmacocinéticas y farmacodinámicas respecto de otras poblaciones. Además, revisaremos una serie de consideraciones acerca de las indicaciones de la TIVA en la población neonatal, cómo realizarla en forma segura (uso seguro de infusiones y elección de velocidades de infusión), y cómo monitori- zar a un paciente neonato durante una TIVA.
Tabla 1. Indicaciones para uso de TIVA
| Absoluta: |
| • Riesgo de hipertermia maligna |
| Por beneficio: |
| • Menos riesgo de nauseas y vómitos en posoperatorio |
| • Menos riesgo de delirium al despertar |
| • Menor reactividad de vía aérea, riesgo de laringoespasmo y broncoespasmo |
| • Interfiere en menor medida monitoreo de potenciales evocados |
| • Menor contaminación ambiental |
| • Se puede administrar en lugares remotos (lugares sin acceso a halogenados/máquina de anestesia) |
| • Permite transporte de pacientes |
| • Permite administración de anestesia en forma segura en procedimientos de vía aérea |
-
Farmacología clínica en el paciente neonatal
-
Farmacocinética
Durante los últimos meses de vida intrauterina y los primeros meses del recién nacido hay múltiples cambios en tamaño, composición corporal, función orgánica y maduración de sistemas enzimáticos y metabólicos, que serán determinantes en la farmacocinética del recién nacido[6]. La velocidad de crecimiento está muy aumentada, y los individuos van duplicando su peso y tamaño en pocas semanas. Por lo tanto, hay recién nacidos de 0,5 kg y otros de 5 kg, con diferentes niveles de maduración en sus sistemas. Esto determina que la farmacocinética se comportará diferente en cada recién nacido, y probablemente
en el mismo recién nacido en la medida que va creciendo y su función orgánica va madurando. Todo esto se hace más complejo cuando se le agregan diversos procesos patológicos que los pueden afectar; restricciones de crecimiento, cardiopatías congénitas, sepsis, falla respiratoria, hipertensión pulmonar u otros, y sus tratamientos específicos (multifarmacia, ECMO, cirugías, transfusión de hemoderivados)[6].
-
Volumen de distribución
La composición y proporciones corporales determina cambios importantes en los volúmenes de distribución durante los primeros meses de vida. El agua corporal total de un recién nacido pretérmino (RNPT) es de 85%, disminuyendo a 60% a los 6 meses. El líquido extracelular de un recién nacido (RN) corresponde al 45% del peso, disminuyendo a 26% al año de vida. La grasa total en un RNPT de 1,5 kg es de 3%, siendo 12% en un recién nacido de término (RNT), duplicándose a los 5 meses. Todos estos cambios, determinan que los RN tengan volúmenes de distribución menores respecto de lactantes y niños pequeños[7]. En un modelo farmacocinético, un volumen de distribución menor determinará menores bolos de inducción, lo que es aplicable para propofol y remifentanilo.
-
Clearance (o aclaramiento)
Si bien el clearance está fuertemente influenciado por el tamaño corporal (principalmente el peso), en los recién nacidos la maduración de los sistemas enzimáticos, o más bien, su inmadurez, adquiere un rol fundamental. Estos sistemas son responsables del metabolismo de los fármacos y, en esta población, su grado de desarrollo resulta tan determinante como el tamaño al momento de estimar y predecir el clearance[8].
La nefrogénesis comienza entre las semanas postconceptuales 5 y 9, completándose a las 36 semanas. En un recién nacido sano, la velocidad de filtración glomerular (VFG) es 30% de la de un adulto, alcanzando niveles adultos entre los 8 y 12 meses. La función tubular madura más lentamente, alcanzando niveles adultos entre los 12 y 18 meses[8].
En el caso de la función hepática, encontramos diferentes sistemas enzimáticos inmaduros al nacer, mejorando su expresión y función en los primeros meses de vida[8], En el caso del propofol, los sistemas enzimáticos encargados de su metabolización llegan a 92% de la función adulta a los 6 meses de edad[9].
En un modelo farmacocinético, un clearance disminuido se traduce en menores velocidades de infusión. Esto es aplicable para el propofol, pero no lo sería para el remifentanilo, puesto que es hidrolizado por esterasas plasmáticas inespecíficas presentes y funcionales desde antes del nacimiento.
-
Tiempos de vida media contextual
El tiempo de recuperación de conciencia depende de la dosis (Concentración plasmática o Cp en estado estacionario en una infusión), la Cp o Concentración en sitio efecto (Ce) en que el individuo recupera conciencia (que a su vez está determinada por edad, tamaño, uso de otras drogas y comorbilidades) y los tiempos de vida media contextual. El tiempo de vida contextual corresponde al tiempo necesario para que la Cp de un medicamento disminuya en 50%, es un marcador indirecto del tiempo que demorará un paciente en recuperar la conciencia y depende del clearance y de la duración de la infusión. Infusiones muy prolongadas determinan mayor redistribución de la droga a compartimentos periféricos, aumentando los tiempos de vida media[9].
Como se dijo previamente, el clearance en el neonato esta disminuido por inmadurez de sus sistemas enzimáticos y metabólicos[7]. Esto determina que en el caso del propofol, cuyos sistemas metabolizadores enzimáticos maduran cercano a los 6 meses, el neonato tenga tiempos de vida contextual mayores a los de un lactante de 6 meses o niños pequeños, haciéndose muy largos comparado con niños y adultos cuando las infusiones se prolongan más de 2 h[9].
Esto también se puede expresar como el tiempo decremental entre la concentración en estado estacionario (Css) para mantener anestesia y la Ce para recuperar conciencia (descrita en 2 mcg/mL para movimiento espontáneo). En su trabajo de 2021 Morse et al., grafican este tiempo decremental específico para diferentes Css en diferentes edades, evidenciando mucho mayores tiempos decrementales específicos para propofol en neonatos, siendo crítica la diferencia con Css de 6 mcg/mL[9].
-
Farmacodinamia
El crecimiento y desarrollo del sistema nervioso en el feto y el neonato es un proceso evolutivo, rápidamente cambiante. La neurogénesis comienza en las primeras semanas de la gestación, asociada a procesos de migración neuronal entre las semanas 12 y 20. Desde la semana 24 y hasta después del nacimiento, ocurren fenómenos apoptóticos, que disminuyen el número de neuronas. Unido a lo anterior, una marcada proliferación de sinapsis neuronales comienza alrededor de la semana 20 de gestación, alcanzado un máximo alrededor de 1-2 años de vida. Posteriormente, algunas sinapsis sufren un proceso de poda, disminuyendo las conexiones sinápticas. Finalmente, la mielinización comienza al final del segundo trimestre, continuando a un ritmo más lento durante la infancia. La actividad de los sistemas de neurotransmisores y receptores de ácido Y-aminobutírico (GABA) y glutamato no sólo son fundamentales para la sinaptogénesis, sino que también están involucrados en la inducción de la neuroapoptosis. Ambos procesos alcanzan su punto máximo durante el segundo y tercer trimestre de gestación, desacelerándose hacia el término del embarazo[10]. De esta forma, los recién nacidos tienen escaso o nulo desarrollo de tractos corticotalámicos y talamocorticales, que se desarrollan robustamente sólo a partir del décimo mes de vida. El cuerpo calloso presenta un desarrollo similar al adulto, a partir de los 9 meses[11],[12]. Las características descritas del neuro- desarrollo determinan que la actividad electroencefalográfica de recién nacidos sea distinta de niños mayores y adultos.
El electroencefalograma (EEG) de recién nacidos es evolutivo. Los prematuros se caracterizan por presentar frecuentes períodos isoeléctricos o de discontinuidad electroencefalográfica, intercalado de períodos de actividad espontánea, continua, indeterminada y transitoria. Los recién nacidos de término expresan mayoritariamente ciclos ultradianos cortos que oscilan entre dos tipos de sueño. Uno activo de actividad eléctrica continua con predominancia de ondas lentas y deltas coherentes, y un sueño tranquilo, caracterizado por una actividad eléctrica discontinua que presenta períodos de actividad de transición asociado a períodos isoeléctricos esporádicos[13],[14].
Los fenómenos descritos del neurodesarrollo afectan la farmacodinamia de los agentes anestésicos, provocando que el cerebro de neonatos sea particularmente sensible a los efectos de estos fármacos, independiente de la concentración o la exposición a estas[6]. Los efectos anestésicos en el cerebro neonatal están poco caracterizados y menos comprendidos en comparación con otras poblaciones[15]. En adultos y niños los GABAérgicos aumentan la potencia espectral dentro de bandas de frecuencia lenta/delta (0,1-4 Hz) y/o alfa (8-12 Hz), patrón del EEG que comúnmente se considera indicador de inconsciencia inducida por anestésicos[16]-[18]. En el cerebro en desarrollo de neonatos, el aumento en la potencia lenta/delta también es típica después de la administración de GABAérgicos, pero con ausencia de oscilaciones alfa frontales hasta el cuarto mes de vida[11],[12]. Además, estudios previos han demostrado que la administración de propofol o sevoflurano a recién nacidos se asocia a la aparición o aumento de una actividad discontinua del EEG y/o eventos isoeléctricos, que carecen de una definición en términos de duración y amplitud de voltaje[19]-[22]. Las implicancias clínicas de la isoelectricidad intraoperatoria en el EEG de neonatos varían según los estudios, pero se cree se asocian a un efecto anestésico excesivo. Un ensayo multicéntrico con pacientes menores de 36 meses mostró que una mayor incidencia de eventos isoeléctricos se asoció al uso de dosis más altas de sevoflurano, la ocurrencia de episodios de hipotensión intraoperatoria y se relacionó con una peor calidad de vida[23]. Sin embargo, no se ha establecido su asociación con deterioro neurológico a largo plazo, ni con el aumento de la morbimortalidad[20],[23]-[26]. Otro estudio realizado en neonatos, críticamente enfermos, intubados y sedados con fentanilo/loraze- pam, mostró que la administración de propofol para anestesia, aumentó los eventos isoeléctricos, disminuyendo la amplitud espectral durante estados de bajo voltaje del EEG[27]. En resumen, lo que se considera característico de la dinámica anestésica del EEG en adultos y niños mayores no puede transferirse directamente a neonatos y lactantes pequeños.
Las mediciones de pEEG/BIS no han mostrado ser consistentes en lactantes y neonatos, posiblemente debido a la inmadurez del cerebro en desarrollo y su efecto en el EEG y su uso en esta población no está recomendado[28],[29]. En general, los neonatos muestran una sensibilidad aumentada al propofol con relaciones farmacocinéticas-farmacodinámicas que no se han esclarecido. Por tanto, al usar dosis habituales de niños o adolescentes (Ce objetivo de 3 mcg/mL) que permiten hipnosis adecuada en ese grupo, podría ser excesiva en el neonato por su cerebro inmaduro[30].
-
Formas de infusión
-
Modelos farmacocinéticos de propofol en neonatos
Los modelos farmacocinéticos utilizados habitualmente en pediatría, Paedfusor y Kataria no deben usarse en recién nacidos ya que en su desarrollo no utilizaron datos de recién nacidos. Para Paedfusor el límite inferior de edad y peso es de 1 año y 5 kg, mientras que para Kataria es de 5 años y 15 kg[3],[4]. Estos modelos no contemplan las particularidades de los recién nacidos en cuanto a tamaño, composición corporal ni grado de maduración, y escalan de manera lineal por peso la mayoría de sus parámetros farmacocinéticos. Como resultado, en esta población tienden a sobredosificar, alcanzando concentraciones plasmáticas superiores a las previstas. Esto se debe, principalmente, a que no consideran la influencia de la inmadurez de los sistemas enzimáticos metabolizadores a esta edad. Sumado a la mayor sensibilidad a propofol en este grupo de pacientes, aumenta considerablemente el riesgo de efectos adversos como bradicardia e hipotensión, entre otros[3].
-
Modelo eleveld para propofol
Es un modelo farmacocinético y farmacodinámico (PK/PD) tricompartimental universal para propofol, desarrollado para uso desde neonatos a adultos mayores y obesos. Se usaron bases de datos utilizadas previamente para el desarrollo de modelos farmacocinéticos y farmacocinéticos/farmacodinámicos. Un total de 30 estudios fueron incluidos, con 1.033 individuos, 15.433 concentraciones de propofol observadas y 28.639 mediciones de BIS observadas. Incluyó RN desde 27 semanas hasta adultos mayores de 88 años, con pesos entre 680 g y 160 kg. El modelo utilizó como covariables la edad, la edad postconceptual, peso, talla, sexo y uso concomitante de otras drogas[31].
La inclusión la edad postconceptual como covariable y el uso de escalamiento alométrico normalizado para clearance, entre otros, permite predecir mejor las concentraciones de propofol en plasma en RN en comparación con los modelos pediátricos previamente descritos (Figura 1 A). Esto sumado al análisis e inclusión de datos de BIS, permite predecir concentraciones en sitio efector[31]. Sin embargo, estas últimas podrían estar sesgadas, dado que no se utilizaron datos farmacodinámicos de este grupo de pacientes para lograr esa estimación.
-
Regímenes de infusiones manuales de propofol
Steur et al., describió un régimen de infusión manual de propofol para menores de 3 años[2]. Si bien reportaba qué dosis eran suficientes para anestesia y tenía tiempos de recuperación de conciencia adecuados, no describía concentraciones plasmáticas esperadas y el bolo de inducción era más bien elevado (3 a 5 mg/kg). Estudios recientes han descrito las Cp esperadas con este régimen de infusión en neonatos utilizando el modelo PK/PD de Eleveld, mostrando Cp entre 6 y 8 mcg/mL durante los primeros 60 minutos, y luego cayendo bajo 3 mcg/ mL a los 100 minutos[30].
Recientemente, Morse et al., describieron un régimen de infusión manual utilizando bases de datos de 5 estudios diferentes, con pacientes pediátricos entre 27 semanas postconceptuales y 11 años. En total fueron 161 individuos con 1.912 observaciones, siendo esta la base de datos pediátrica más grande generada (incluye más neonatos que la utilizada por Eleveld). Se describió un modelo tricompartimental para propofol con escalamiento alométrico para los parámetros farmaco- cinéticos determinados por tamaño[30]. Describen regímenes de infusión para Cp de 2 y 3 mcg/mL para diferentes edades gestacionales (27-44 semanas y 44-52 semanas), lactantes entre 3 y 12 meses y niños entre 1 y 3 años. A diferencia de Steur, el bolo inicial y las velocidades de infusión descritas por Morse son mucho menores en la primera hora, aumentando respecto a Steur desde los 60 minutos (Tabla 1)[2],[30].
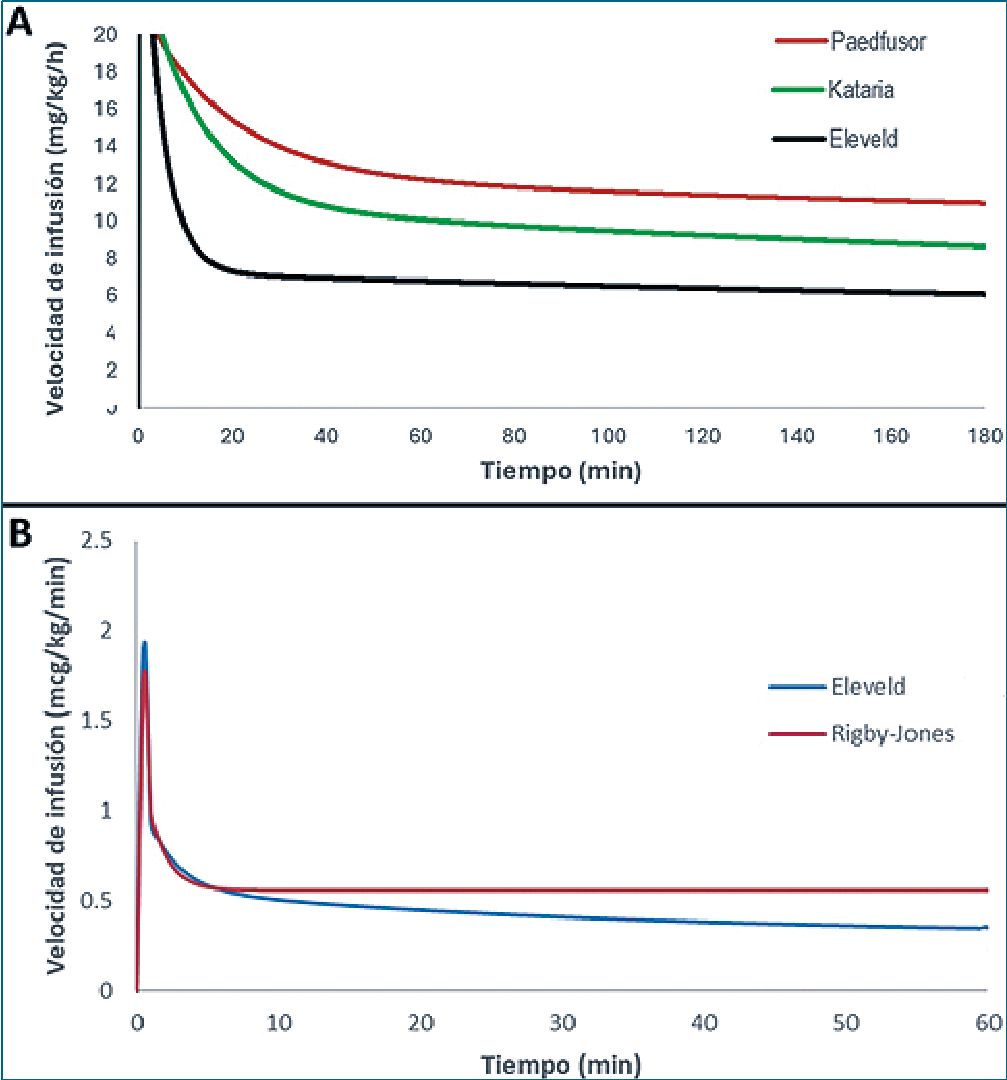
Figura 1. Comparación modelos farmacocinéticos de propofol y remi- fentanilo en RNT de 3 kg. A. Modelos de propofol para Ce de 3 mcg/ mL en infusión de 180 minutos; B. Modelos de remifentanilo para Cp de 6 ng/mL en infusión de 60 minutos.
-
Infusiones de remifentanilo
El remifentanilo es un opioide sintético potente con alta afinidad por receptores Mu que incluye en su estructura molecular un anillo con un grupo metil ester, que le permite ser hidrolizado por esterasas plasmáticas y tisulares no específicas. Tiene un tiempo de vida media contextual muy corta, con rápida eliminación. Estas características permiten un inicio rápido de acción, entregando analgesia potente, permitiendo la titulación de su efecto mediante infusiones continuas y recuperación rápida independiente de la dosis y duración de la infusión. Estas características se mantienen a lo largo de todos los grupos etarios, incluyendo los neonatos[32]. Sus características PK/PD permiten que infusiones continuas se relacionen con concentraciones plasmáticas o en sitio efector deseadas. Se ha descrito su uso en velocidades de infusión entre 0,05 y 0,75 mcg/ kg/min[32]. También se ha descrito el uso de bolo inicial de 1 – 5 mcg/kg en 1-2 minutos, pero sugerimos evitarlo por sus efectos hemodinámicos dosis dependientes[32],[33]. Al utilizar infusiones sin bolo inicial, sugerimos esperar al menos 10 minutos entre el inicio de la infusión y el inicio de la cirugía, para obtener Cp de remifentanilo adecuadas y estables[34]. Se debe tener en cuenta que velocidades de infusión pequeñas (ej. < a 0,5 mL/h) podrían no permitir la llegada de la droga al paciente en el tiempo correcto, lo que hace más importante aún el inicio precoz de la infusión antes de la cirugía.
El modelo Rigby-Jones es un modelo farmacocinético de remifentanilo de 2 compartimentos. Utilizó datos de 25 pacientes, desde 1 mes a 9 años (mediana 1,77 años) y 3,1 a 39,8 kg (mediana 10,5 kg), sometidos a cirugía cardíaca, con o sin bypass cardiopulmonar (BCP), donde se utilizó remifentanilo en el posoperatorio para sedación. Se caracteriza por escalar alométricamente sus parámetros farmacocinéticos estructurales según peso y excluye como covariables la edad y la presencia o ausencia de BCP[34].
El modelo de Eleveld para remifentanilo es un modelo PK/PD universal. Se utilizaron 3 bases de datos conocidas (Minto, Ross y Mertens) de 131 voluntarios sanos y pacientes, incluyendo 18 menores entre 5 días y 3 años. Solo datos de Minto entregaron mediciones de EEG procesado (frecuencia de límite espectral), ninguno de ellos pediátrico, por tanto, su desempeño en sitio efector en la población neonatal podría estar sesgado. Se describe como un modelo tricompartamental con escalamiento alométrico. Usa como covariables: sexo, edad, peso y talla. A diferencia de su versión para propofol, no utiliza edad gesta- cional para predecir maduración (y por tanto clearance), sino el peso total, estimando 50% de maduración a los 3,6 kg (peso de nacimiento promedio). Esto no descarta que individuos más pequeños podrían tener otras condiciones que determinar un clearance menor aún[35].
Ambos modelos descritos podrían utilizarse en neonatos, puesto que tienen un desempeño similar (Figura 1 B), sin embargo, sugerimos una titulación cuidadosa dado que el bolo inicial entregado por el modelo podría tener efectos no deseados sobre el neonato (bradicardia, hipotensión).
-
Indicaciones de uso de TIVA en población neonatal
Son conocidas las ventajas y desventajas del uso de anestesia total intravenosa en la población general. Sin embargo, podemos dividir en tres las razones para utilizar TIVA basada en propofol en la población pediátrica: Necesidad, Beneficio, Elección[1].
– Necesidad: la única indicación absoluta para utilizar TIVA en niños es que exista una susceptibilidad para hipertermia maligna[1].
– Beneficio: los principales beneficios de utilizar TIVA incluyen reducción de náuseas y vómitos posoperatorios, rápida y mejor recuperación (menos delirium al despertar), reducción de la reactividad de las vías respiratorias, interfiere en menor medida con neuromonitoreo (por ej. instrumenta- lización de columna, implantes cocleares), menor contaminación ambiental. Además, permite la administración segura de anestesia en ubicaciones remotas del hospital (falta de acceso a halogenados) y cuando hay necesidad de transporte de pacientes durante al acto anestésico[1],[4]. Por último, es una excelente alternativa cuando la administración de halogenados podría ser interferida durante el acto quirúrgico (por ejemplo, durante una revisión de vía aérea), permitiendo una administración segura de anestesia por vía endovenosa.
– Elección: El uso ocasional de TIVA mantiene habilidades para aquellas ocasiones en las que se requiere utilizar la técnica[1].
Al aplicar estos conceptos a la población neonatal, encontramos dos escenarios fundamentales para la utilización de TIVA basada en propofol. El primero, que el paciente neonatal tengas antecedentes familiares o alguna condición que lo haga susceptible a hipertermia maligna, por tanto, debe evitarse a toda costa el uso de halogenados. El segundo, que la cirugía se realice en un lugar remoto sin acceso a halogenados. Esto sucede principalmente en cirugías realizadas en unidades de neona- tología sin acceso a uso de máquinas de anestesia convencionales ni métodos de administración de halogenados. Creemos que, en este grupo de pacientes, el uso de TIVA basada en infusión de propofol permite mantener niveles de profundidad anestésica más estables y confiables, en comparación al uso de bolos intermitentes de otros hipnóticos (benzodiacepinas, ketamina, etc).
A pesar de que la evidencia actual sobre las ventajas del uso de TIVA en la población neonatal es escasa, creemos que su uso está lejos de estar contraindicado en este grupo de pacientes y que estos podrían beneficiarse tal como lo hacen otros pacientes pediátricos. Planteamos, sin embargo, qué para ser usada en forma segura, deben tenerse en cuenta siempre las consideraciones planteadas en este texto.
-
Consideraciones prácticas para uso seguro
Para administrar una TIVA en forma segura, es fundamental revisar una serie de pasos a seguir que van desde la elección de la droga y su concentración, hasta la elección del acceso venoso a utilizar y la posterior conexión e inicio de la infusión. Esta serie de acciones a seguir incluye la elección de jeringas y líneas de infusión, elección de bombas de infusión y su programación, la elección del modelo PK/PD a utilizar (cuando lo amerite) y la correcta programación de velocidades de infusión. Cada uno de estos pasos es una posibilidad para equivocarse y cometer un error, por lo que es fundamental chequearlos a conciencia antes de iniciar una TIVA.
Paso 1. Elección correcta de la droga y su concentración
Hay que considerar que, mientras más diluida una droga en infusión, más rápido se moverá una jeringa y más precisa será la respuesta a un cambio en la velocidad de infusión de la droga[1]. Infusiones menores a 0,5 mL/h no son confiables, por tanto, deben preferirse concentraciones menores para tener velocidades de infusión mayores[4]. Por otro lado, la masa de droga en líneas de infusión disminuye cuando se usan menores concentraciones de drogas, lo que protege contra administración inadvertida de las drogas usadas en TIVA cuando se comparte la línea de infusión con drogas administradas en bolo.
En el caso del propofol, hay disponibles concentraciones al 1% (10 mg/mL) y 2% (20 mg/mL). En neonatos se debe preferir el propofol 1%, dado que permite una velocidad de infusión más precisa y segura. Se debe estandarizar el uso local de un solo tipo de concentración para evitar errores (Tabla 2).
El remifentanilo es comúnmente usado en concentraciones de 50 mcg/mL en adultos, sin embargo, esta concentración en neonatos podría ser un problema. Por ejemplo, para darle 0,15 mcg/kg/min (que podría considerarse una velocidad de infusión adecuada durante una TIVA) a un neonato de 3 kg, deben administrarse 27 mcg/h lo que en la concentración estándar de 50 mcg/mL equivale a 0,54 mL/h, lo que sería una velocidad baja y poco confiable. Además, este flujo lento hace que en estado estacionario para pacientes así de pequeños, el alargador venoso contenga masas de drogas muy superiores a dosis de carga de remifentanilo, que podrían ser deletéreas si se administra un bolo inadvertido. Una concentración de remifentanilo más segura para este grupo de pacientes sería de 20 mcg/mL (aunque también podría usarse de 10 mcg/mL o 5 mcg/mL). Se debe estandarizar el uso local de un solo tipo de concentración para evitar errores.
No es recomendable mezclar fármacos en una misma jeringa. En el caso de propofol y remifentanilo, existen una serie de desventajas al intentar hacer esto[1],[5]:
1. No es posible titular en forma separada el efecto analgésico y el efecto hipnótico de las drogas.
2. Al dar dosis de inducción o cambios en las dianas de propofol se darán bolos muy grandes de remifentanilo.
3. Si se intenta diluir más el remifentanilo (< 5 mcg/mL) para evitar bolos grandes este se hace inestable y puede romperse la molécula.
4. Al mezclarse con propofol el remifentanilo puede cristalizarse, pudiendo alcanzar concentraciones diferentes en diferentes partes de una misma jeringa.
Paso 2. Elección de jeringas, líneas de infusión y alargador venoso
Respecto a las jeringas, diferentes marcas para jeringas de la misma capacidad pueden tener diferentes dimensiones tanto en diámetro como en largo, lo que hace que tengan diferentes velocidades de infusión reales para una misma velocidad de infusión programada. Esto hace imperativo que la bomba de infusión utilizada incluya en su programación la marca y modelo de jeringa a utilizar. Se debe preferir una sola marca de jeringa en cada centro e idealmente deben tener sistema Luer- Lock para disminuir el riesgo de desconexión accidental[5]. En cuanto a la capacidad de las jeringas, recomendamos no utilizar jeringas mayores a 20 mL, puesto que ante una programación incorrecta el vaciado no deseado de una jeringa mayor puede ser mucho más peligroso en este grupo de pacientes.
Se recomienda que la línea de infusión desde la jeringa hasta el alargador venoso del paciente tenga válvula antireflujo y sea compatible con sistema Luer-Lock. Ésta debe conectarse lo más cercano posible al paciente[4],[5], siendo lo ideal la conexión directa al catéter venoso: disminuyendo el espacio muerto, la masa de droga en el alargador venoso y los sitios potenciales de fuga[5]. Cuando la conexión directa al catéter venoso no es posible, puede conectarse directamente una llave de 3 pasos al catéter venoso o en su defecto el alargador venoso con menor volumen disponible. Se debe preferir el uso de sets de administración diseñados específicamente para TIVA, puesto que traen todos los elementos descritos anteriormente[5], incluida una llave de 3 pasos resistente a la corrosión por propofol.
Tabla 2. Velocidades de infusión de propofol descritas para neonatos
| Steur et al | ||||||
| Edad | 0 – 10 min | 10 – 20 min | 20 – 30 min | 30 – 40 min | 40 – 100 min | > 100 min |
| < 3 meses | 25 | 20 | 15 | 10 | 5 | 2,5 |
| Morse et al | ||||||
| Edad | Dosis de inducción
(mg/kg) |
0 – 15 min | 15 – 30 min | 30 – 60 min | 60 – 120 min | |
| Cp objetivo: 2 mcg/mL | ||||||
| 27 – 44 sem | 1,5 | 6 | 5 | 4 | 3 | |
| 44 – 52 sem | 1,5 | 8 | 7 | 6 | 6 | |
| Cp objetivo: 2 mcg/mL | ||||||
| 27 – 44 sem | 2 | 9 | 7 | 6 | 5 | |
| 44 – 52 sem | 2,5 | 11 | 10 | 9 | 8 | |
Morse et al., describieron velocidades de infusión para Cp objetivo de 2 mcg/mL y 3 mcg/mL. Las velocidades de infusión están expresadas en mg/kg/h. Adaptado de Steur et al[2] y Morse et al[30].
Paso 3. Elección de bombas de infusión
Es imprescindible estar familiarizado con las bombas a utilizar, y se recomienda tener un solo modelo de bomba para hacer TIVA en cada centro. Para hacer TIVA en forma segura en neonatos, se recomiendan bombas que permitan el uso de modelos TCI adecuados para este grupo de pacientes (por ej. eleveld para propofol), pero que además permitan el uso de infusiones manuales con distintas velocidades de infusión sin modelos TCI[5].
Al momento de programar la bomba, esta debiera incluir únicamente los modelos aprobados localmente, las concentraciones estandarizadas para cada fármaco, y la marca y modelo de jeringa utilizada en cada centro. Esto permite evitar errores en la elección del modelo, concentración del fármaco y tipo de jeringa[5].
La bomba debe incluir alarmas para presión alta, infusión detenida, vació de jeringa, desconexión de red eléctrica y batería baja. Algunas bombas incluyen alarma de presión baja que puede indicar desconexión de la vía. Además, la bomba debe incluir un indicador visual de que la infusión esta activa[5].
El uso seguro y correcto de estas bombas conlleva una serie de medidas que deben practicarse siempre en cualquier infusión para cualquier paciente:
1. Comprobar el correcto funcionamiento de la bomba previo al caso[4]. Esto incluye comprobar una adecuada y reciente mantención por el proveedor.
2. La bomba debe estar preferentemente conectada a la red eléctrica. De no ser posible, asegurarse que su batería este cargada[5].
3. La bomba debe estar programada para el paciente correcto (sexo, peso, talla, edad)[4].
4. Chequear que jeringa montada en la bomba contenga la droga correcta[4]. La programación de la bomba solo debe ocurrir posterior a montar la jeringa. El orden en que se colocan las jeringas debiera estandarizarse para reducir el error (por ej. propofol arriba)[5].
5. La bomba debe estar programada para la droga correcta. Esto incluye concentración del fármaco, y tipo y velocidad de infusión, que deben ser adecuadas para la dosificación basada en el peso del paciente[4].
6. Comprobar el adecuado funcionamiento de alarmas de la bomba[4].
7. Al iniciar infusión, asegurarse que indicador visual de infusión este activado[5].
8. La bomba de infusión debe estar visible en todo momento para advertir problemas e inconsistencias en la administración de fármacos[5].
Paso 4. Programación de la bomba y elección de velocidad de infusión
Una vez elegidas y preparadas las drogas a utilizar, en su correcta jeringa y concentración, elegida la bomba a utilizar y elegida la forma de administración (infusión manual o según modelo PK/PD), se monta la jeringa y se programa la bomba con las características del paciente (habitualmente edad, sexo, peso y talla) y se elige la forma de infusión para cada droga (infusión manual o TCI). Solo luego de la correcta programación de la bomba, debe conectarse la línea de infusión al paciente.
Paso 5. Elección y conexión a acceso venoso
El acceso venoso a utilizar se debe comprobar previo al inicio de la TIVA y no puede haber dudas acerca de su funcionamiento. Lo ideal es que el acceso elegido sea de uso exclusivo para la TIVA, dejando otro acceso para la administración del resto de las drogas utilizadas durante el procedimiento (bloqueadores neuromusculares, antibióticos, analgésicos, etc). Siempre que sea posible y práctico, este debe ser visible y de fácil inspección. En casos donde la respuesta del paciente es diferente a la esperada, debe inspeccionarse rápidamente el sitio de inserción con alta sospecha de extravasación, desconexión u obstrucción de la infusión[4],[5].
Paso 6: Conducta de TIVA
Una vez iniciada la TIVA, hay que asegurarse que el indicador visual de infusión este activado. Durante la TIVA, la bomba de infusión debe estar visible en todo momento para advertir problemas, activación de alarma e inconsistencias en todo momento[5]. Al utilizar modelos PK/PD, recomendamos revisar periódicamente la velocidad de infusión (ej. en propofol aparece en mg/kg/h). Si la velocidad de infusión detectada es muy diferente a la esperada siguiendo un régimen de infusión manual (ej. la infusión basada en el modelo indica 15 mg/kg/h, y según un modelo de infusión manual a ese mismo tiempo debiera estar en 6 mg/kg/h), hay que sospechar algún error de programación. Si la respuesta clínica del paciente a los fármacos infundidos es diferente a lo esperado, debe inspeccionarse inmediatamente bomba de infusión y su programación, líneas de infusión y sitio de inserción de la vía venosa del paciente.
Paso 7: Desconexión de infusión
Al final de cada procedimiento, las líneas de infusión deben ser desconectadas y la vía venosa utilizada debe ser lavada para que no queden restos de las drogas utilizadas en los alargadores venosos[4]. De esta forma se evita la administración inadvertida de fármacos anestésicos posterior al procedimiento. En casos donde el lavado no sea posible, es planteable el retiro del acceso venoso para evitar la administración inadvertida de drogas.
-
Monitorización electroencefalográfica (EEG)
Para monitorizar del efecto anestésico en neonatos, no se deben utilizar índices derivados del procesamiento del EEG. Pocos estudios han caracterizado la variación de los índices con la edad en niños, y si bien parecieran tener un buen desempeño en niños mayores de 1 año, no existen algoritmos que incluyan la dinámica EEG de recién nacidos[28],[29].
La evidencia muestra que observar la onda bruta del EEG, pero especialmente utilizar la matriz de densidad espectral (espectrograma) y el SEF (ojalá obtenidas de ambos hemisferios cerebrales, por la escasa coherencia que existe a esta edad) ayudaría a titular los requerimientos anestésicos de los recién nacidos. Observar un aumento del poder de ondas lentas/delta al iniciar la anestesia, podría ser una expresión de algún nivel anestésico. Un SEF < 10 Hz indicaría una anestesia profunda, un SEF entre 10-15 Hz indicaría una anestesia adecuada y un SEF > 15 Hz un nivel nivel de sedación o de despertar. Se debe tener en cuenta que, si bien en recién nacidos prematuros puede ser un hallazgo frecuente, la aparición de períodos isoeléctricos frecuentes o prolongados en niños de término, que pueden visualizarse como supresión en la matriz espectral, indicaría un exceso de anestesia y por lo tanto, se debe intentar mantenerlos al mínimo[36],[37].
-
Analgesia posoperatoria
Cuando se planifica utilizar TIVA con propofol y remifenta- nilo en neonatos es imprescindible establecer un plan analgésico para el perioperatorio. El remifentanilo es un opioide de duración ultracorta, metabolizado por esterasas plasmáticas, muy útil para el período intraoperatorio, que permite un despertar y recuperación precoces sin embargo, no proveerá analgesia posterior. Se debe priorizar una estrategia analgésica multimodal, sin embargo, los opioides se mantienen como uno de los pilares para el manejo del dolor postoperatorio severo[38]. Los recién nacidos tienen requerimientos menores de opioides que lactantes y niños mayores, lo cual está determinado por factores farmacocinéticos, metabólicos y de desarrollo neurológico[39]. Esto les confiere un mayor riesgo de efectos adversos que los otros grupos etarios, en particular aquellos que no han sido expuestos previamente a estas drogas. En la Tabla 3, se detallan las dosis analgésicas y efectos adversos del fentanilo y la morfina, que son los opioides más comúnmente usados en población neonatal.
-
Morfina
Opioide más utilizado en analgesia neonatal y suele administrarse como infusión continua o bolos intermitentes. Tiene efectos adversos en el recién nacido de pretérmino, pudiendo o no alterar desenlaces cognitivos y conductuales a largo plazo[38]. A menor edad gestacional y peso deben considerarse dosis inferiores[39].
-
Fentanilo
Provee una rápida analgesia con efectos mínimos hemo- dinámicos. Se suele utilizar como analgésico previo a procedimientos dolorosos[39]. Si se compara con morfina presenta menos efectos adversos, pero los pacientes presentan mayor tolerancia y síntomas de privación[38].
-
Metadona
A pesar de ser un agonista opioide con beneficios potenciales en contextos específicos, el uso de metadona en la población neonatal sigue siendo limitado debido a la escasez de evi- dencia[40],[41]. Son necesarios más estudios para determinar la seguridad y eficacia en esta población.
-
Técnicas de analgesia regional
Las técnicas regionales complementan la analgesia multimodal y ofrecen múltiples beneficios en el período neonatal, por lo que deben ser consideradas al momento de establecer el plan de manejo del dolor perioperatorio. Su aplicación previa a la incisión quirúrgica contribuye a reducir la respuestas hormonal al estrés quirúrgico, disminuyen los requerimientos de opioides y pueden facilitar la extubación temprana en determinadas cirugías[42]. Al momento de elegir la técnica de analgesia regional se deben considerar:
1. El procedimiento al que se someterá el paciente.
2. Las diferencias de la farmacocinética de los anestésicos locales en el período neonatal.
3. Las diferencias anatómicas en este grupo etario.
Algunos procedimientos útiles para el manejo analgésico son: analgesia epidural y caudal, bloqueos de nervio periférico y plexo, bloqueos de planos faciales y la infiltración de herida operatoria[42],[43].
Tabla 3. Uso de opioides para el de manejo del dolor perioperatorio en neonatos
| Droga | Dosis | Efectos adversos |
| Morfina | Bolo endovenoso:
< 37 semanas 25 mcg/kg c/6 h > 37 semanas 50-100 mcg/kg c/6 h Infusión continua: 5 – 20 mcg/kg/h |
Hipotensión, depresión respiratoria, tolerancia y dependencia, abstinencia |
| Fentanilo | Bolo endovenoso: 0,5 – 2 mcg/kg c/2- 4 h Infusión continua: 0,25 – 2 mckg/kg/h
*En < 32sem reducir a 50% dosis |
Depresión respiratoria, rigidez torácica, tolerancia y abstinencia, disminución de tránsito intestinal |
| Metadona | Pendiente mayores estudios para definir dosis óptimas en seguridad y eficacia. | |
(Adaptada de Mencía et al[44] y Masters et al[39].
-
Conclusión
La anestesia total intravenosa en neonatos constituye una alternativa posible y segura en contextos seleccionados, especialmente cuando los agentes halogenados están contraindicados o no se encuentran disponibles. Su seguridad depende de reconocer las particularidades farmacocinéticas y farmacodi- námicas de esta población, así como de considerar sus riesgos específicos.
El uso prudente de propofol y remifentanilo, junto con una monitorización adecuada y un plan analgésico multimodal, permite optimizar la efectividad del procedimiento y minimizar complicaciones relacionadas con la inmadurez metabólica y la mayor sensibilidad neurológica de los recién nacidos.
Se recomienda establecer protocolos institucionales que estandaricen la técnica y reduzcan riesgos innecesarios.
Declración de originalidad: Los autores declaran no haber enviado este artículo a otra revista científica para revisión.
Finunciamiento: No se obtuvo financiamiento externo. No existen conflicto de intereses de los autores.
Declaración de derechos: Se ceden los derechos de propiedad intelectual del artículo a la Revista Chilena de Anestesiología.
-
Referencias
1. Anderson BJ, Bagshaw O. Practicalities of Total Intravenous Anesthesia and Target-controlled Infusion in Children. Vol. 131, Anesthesiology. Lippincott Williams and Wilkins; 2019. p. 164–85. https://doi.org/10.1097/ALN.0000000000002657.
2. Steur RJ, Perez RSGM, De Lange JJ. Dosage scheme for propofol in children under 3 years of age. https://doi.org/10.1111/j.1460-9592.2004.01238.x.
3. Zeeni C, Karam CJ, Kaddoum RN, Aouad MT. Propofol use in children: Updates and controversies. Volume 86. Minerva Anestesiologica. Edizioni Minerva Medica; 2020. pp. 433–44.
4. Chan V, Skowno J. A Practical Approach to Propofol-Based Total Intravenous Anaesthesia (TIVA) in Children [Internet]. 2018. Available from: www.wfsahq.org/resources/anaesthesia-tutorial-of-the-week
5. Nimmo AF, Absalom AR, Bagshaw O, Biswas A, Cook TM, Costello A, et al. Guidelines for the safe practice of total intravenous anaesthesia (TIVA): Joint Guidelines from the Association of Anaesthetists and the Society for Intravenous Anaesthesia. Vol. 74, Anaesthesia. Blackwell Publishing Ltd; 2019. p. 211–24.
6. Allegaert K, van de Velde M, van den Anker J. Neonatal clinical pharmacology. Paediatr Anaesth. 2014 Jan;24(1):30–8. https://doi.org/10.1111/pan.12176 PMID:23617305
7. Anderson BJ, Holford NH. Mechanism-based concepts of size and maturity in pharmacokinetics. Annu Rev Pharmacol Toxicol. 2008;48(1):303–32. https://doi.org/10.1146/annurev.pharmtox.48.113006.094708 PMID:17914927
8. Tofovic SP (Davis PJ, Cladis FP, editors). Developmental Pharmacology. 10th ed. Philadelphia: Elsevier; 2022. 178 pp.
9. Morse JD, Cortinez LI, Meneely S, Anderson BJ. Propofol context-sensitive decrement times in children. Vol. 32, Paediatric Anaesthesia. John Wiley and Sons Inc; 2022. p. 396–403. https://doi.org/10.1111/pan.14391.
10. Andropoulos DB. Effect of anesthesia on the developing brain: Infant and fetus. Vol. 43, Fetal Diagnosis and Therapy. S. Karger AG; 2018. p. 1–11.
11. Lee JM, Akeju O, Terzakis K, Pavone KJ, Deng H, Houle TT, et al. A prospective study of age-dependent changes in propofol-induced electroencephalogram oscillations in children. Anesthesiology. 2017 Aug;127(2):293–306. https://doi.org/10.1097/ALN.0000000000001717 PMID:28657957
12. Cornelissen L, Kim SE, Lee JM, Brown EN, Purdon PL, Berde CB. Electroencephalographic markers of brain development during sevoflurane anaesthesia in children up to 3 years old. Br J Anaesth. 2018 Jun;120(6):1274–86. https://doi.org/10.1016/j.bja.2018.01.037 PMID:29793594
13. O’Toole JM, Boylan GB, Vanhatalo S, Stevenson NJ. Estimating functional brain maturity in very and extremely preterm neonates using automated analysis of the electroencephalogram. Clin Neurophysiol. 2016 Aug;127(8):2910–8. https://doi.org/10.1016/j.clinph.2016.02.024 PMID:27177813
14. Dereymaeker A, Pillay K, Vervisch J, De Vos M, Van Huffel S, Jansen K, et al. Review of sleep-EEG in preterm and term neonates. Early Hum Dev. 2017 Oct;113:87–103. https://doi.org/10.1016/j.earlhumdev.2017.07.003 PMID:28711233
15. Corlette SJ, Walker SM, Cornelissen L, Brasher C, Bower J, Davidson AJ. Changes in the Term Neonatal Electroencephalogram with General Anesthesia: A Systematic Review with Narrative Synthesis. Anesthesiology. 2024 Oct;141(4):670–80. https://doi.org/10.1097/ALN.0000000000005088 PMID:38775960
16. Brandt SP, Walsh EC, Cornelissen L, Lee JM, Berde C, Shank ES, et al. Case Studies Using the Electroencephalogram to Monitor Anesthesia-Induced Brain States in Children. Vol. 131, Anesthesia and Analgesia. Lippincott Williams and Wilkins; 2020. p. 1043–56. https://doi.org/10.1213/ANE.0000000000004817.
17. Purdon PL, Sampson A, Pavone KJ, Brown EN. Clinical electroencephalography for anesthesiologists. Vol. 123, Anesthesiology. Lippincott Williams and Wilkins; 2015. p. 937–60. https://doi.org/10.1097/ALN.0000000000000841.
18. Ching S, Cimenser A, Purdon PL, Brown EN, Kopell NJ. Thalamocortical model for a propofol-induced α-rhythm associated with loss of consciousness. Proc Natl Acad Sci USA. 2010 Dec;107(52):22665–70. https://doi.org/10.1073/pnas.1017069108 PMID:21149695
19. Davidson AJ, Sale SM, Wong C, McKeever S, Sheppard S, Chan Z, et al. The electroencephalograph during anesthesia and emergence in infants and children. Paediatr Anaesth. 2008 Jan;18(1):60–70. https://doi.org/10.1111/j.1460-9592.2007.02359.x PMID:18095968
20. Cornelissen L, Bergin AM, Lobo K, Donado C, Soul JS, Berde CB. Electroencephalographic discontinuity during sevoflurane anesthesia in infants and children. Paediatr Anaesth. 2017 Mar;27(3):251–62. https://doi.org/10.1111/pan.13061 PMID:28177176
21. Agrawal U, Berde CB, Cornelissen L. Electroencephalographic features of discontinuous activity in anesthetized infants and children. PLoS One. 2019 Oct;14(10):e0223324. https://doi.org/10.1371/journal.pone.0223324 PMID:31581269
22. Chao JY, Gutiérrez R, Legatt AD, Yozawitz EG, Lo Y, Adams DC, et al. Decreased Electroencephalographic Alpha Power During Anesthesia Induction Is Associated With EEG Discontinuity in Human Infants. Anesth Analg. 2022 Dec;135(6):1207–16. https://doi.org/10.1213/ANE.0000000000005864 PMID:35041633
23. Yuan I, Xu T, Skowno J, Zhang B, Davidson A, von Ungern-Sternberg BS, et al.; BRAIN Collaborative Investigators. Isoelectric Electroencephalography in Infants and Toddlers during Anesthesia for Surgery: An International Observational Study. Anesthesiology. 2022 Aug;137(2):187–200. https://doi.org/10.1097/ALN.0000000000004262 PMID:35503999
24. Ching S, Purdon PL, Vijayan S, Kopell NJ, Brown EN. A neurophysiological-metabolic model for burst suppression. Proc Natl Acad Sci USA. 2012 Feb;109(8):3095–100. https://doi.org/10.1073/pnas.1121461109 PMID:22323592
25. Yuan I, Landis WP, Topjian AA, Abend NS, Lang SS, Huh JW, et al. Prevalence of Isoelectric Electroencephalography Events in Infants and Young Children Undergoing General Anesthesia. Anesth Analg. 2020 Feb;130(2):462–71. https://doi.org/10.1213/ANE.0000000000004221 PMID:31107263
26. Davidson A, Skowno J. Neuromonitoring in paediatric anaesthesia. Vol. 32, Current Opinion in Anaesthesiology. Lippincott Williams and Wilkins; 2019. p. 370–6. https://doi.org/10.1097/ACO.0000000000000732.
27. Boncompte G, Cortínez LI, Toso A, Giordano A, Cruzat F, Fuentes R, et al. Differential effects of propofol anaesthesia across three amplitude-defined electroencephalographic states in sedated critically ill term neonates: an observational study. Eur J Anaesthesiol. 2025 Oct;42(10):889–98. https://doi.org/10.1097/EJA.0000000000002208 PMID:40420743
28. Sciusco A, Standing JF, Sheng Y, Raimondo P, Cinnella G, Dambrosio M. Effect of age on the performance of bispectral and entropy indices during sevoflurane pediatric anesthesia: a pharmacometric study. Paediatr Anaesth. 2017 Apr;27(4):399–408. https://doi.org/10.1111/pan.13086 PMID:28211134
29. Dennhardt N, Arndt S, Beck C, Boethig D, Heiderich S, Schultz B, et al. Effect of age on Narcotrend Index monitoring during sevoflurane anesthesia in children below 2 years of age. Paediatr Anaesth. 2018 Feb;28(2):112–9. https://doi.org/10.1111/pan.13306 PMID:29274102
30. Morse J, Hannam JA, Cortinez LI, Allegaert K, Anderson BJ. A manual propofol infusion regimen for neonates and infants. Paediatr Anaesth. 2019 Sep;29(9):907–14. https://doi.org/10.1111/pan.13706 PMID:31325395
31. Eleveld DJ, Colin P, Absalom AR, Struys MMRF. Pharmacokinetic-pharmacodynamic model for propofol for broad application in anaesthesia and sedation. Vol. 120, British Journal of Anaesthesia. Elsevier Ltd; 2018. p. 942–59. https://doi.org/10.1016/j.bja.2018.01.018.
32. Kamata M, Tobias JD. Remifentanil: applications in neonates. Vol. 30, Journal of Anesthesia. Springer Tokyo; 2016. p. 449–60. https://doi.org/10.1007/s00540-015-2134-5.
33. Soontrakom T, Kamata M, Kuratani N. Use of remifentanil in general anesthesia for neonatal non-cardiac surgery: a case series. JA Clin Rep. 2018 Dec;4(1):81. https://doi.org/10.1186/s40981-018-0218-6 PMID:32026049
34. Rigby-Jones AE, Priston MJ, Sneyd JR, McCabe AP, Davis GI, Tooley MA, et al. Remifentanil-midazolam sedation for paediatric patients receiving mechanical ventilation after cardiac surgery. Br J Anaesth. 2007 Aug;99(2):252–61. https://doi.org/10.1093/bja/aem135 PMID:17578905
35. Eleveld DJ, Proost JH, Vereecke H, Absalom AR, Olofsen E, Vuyk J, et al. An allometric model of remifentanil pharmacokinetics and pharmacodynamics. Anesthesiology. 2017 Jun;126(6):1005–18. https://doi.org/10.1097/ALN.0000000000001634 PMID:28509794
36. Yuan I, Xu T, Kurth CD. Using Electroencephalography (EEG) to Guide Propofol and Sevoflurane Dosing in Pediatric Anesthesia. Vol. 38, Anesthesiology Clinics. W.B. Saunders; 2020. p. 709–25.
37. Xu T, Kurth CD, Yuan I, Vutskits L, Zhu T. An approach to using pharmacokinetics and electroencephalography for propofol anesthesia for surgery in infants. Paediatr Anaesth. 2020 Dec;30(12):1299–307. https://doi.org/10.1111/pan.14021 PMID:32965066
38. Hall RW, Anand KJ. Pain management in newborns. Vol. 41, Clinics in Perinatology. W.B. Saunders; 2014. p. 895–924. https://doi.org/10.1016/j.clp.2014.08.010.
39. Masters J, Arnold P, Diwan R. Acute pain management in the neonate. https://doi.org/10.1016/j.mpaic.2022.12.012.
40. Barnett AM, Machovec KA, Ames WA, Homi HM, Turi JL, Koo J, et al. The effect of intraoperative methadone during pediatric cardiac surgery on postoperative opioid requirements. Paediatr Anaesth. 2020 Jul;30(7):773–9. https://doi.org/10.1111/pan.13903 PMID:32365412
41. van den Hoogen NJ, de Geus TJ, Patijn J, Tibboel D, Joosten EA. Methadone effectively attenuates acute and long-term consequences of neonatal repetitive procedural pain in a rat model. Pediatr Res. 2021 May;89(7):1681–6. https://doi.org/10.1038/s41390-020-01353-x PMID:33504957
42. E. B. Laurent F. T, Halty F. C. The Role of Regional Anesthesia in Neonatal Care: A Review [Internet]. Med Res Arch. 2024;12(10): Available from: https://esmed.org/MRA/mra/article/view/5927
43. Ponde VC, Rath A, Singh N. Expert’s tips on regional blocks in neonates and infants. Vol. 19supll1, Anesthesia and Pain Medicine. Korean Society of Anesthesiologists; 2024. pp. S73–86.
44. Mencía S, Alonso C, Pallás-Alonso C, López-Herce J. Evaluation and Treatment of Pain in Fetuses, Neonates and Children. Vol. 9, Children. Multidisciplinary Digital Publishing Institute (MDPI); 2022.

 ORCID
ORCID