Rosina Alcaraz R.1*, Tomas González M.2
Recibido: 08-01-2025
Aceptado: 27-04-2025
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 5 pp. 687-694|https://doi.org/10.25237/revchilanestv54n5-26
PDF|ePub|RIS
Abstract
Introduction: Recent advances in anesthetic and surgical techniques, as well as in the refinement of equipment, have led to an increase in laparoscopic surgery in children of all ages, reporting great benefits already known[],[]. Postoperative residual paralysis is present in children with a variable incidence of up to 28.1%[], therefore there is greater postoperative morbidity. Objectives: To compare certainty and effectiveness of sugammadex and neostigmine for the reversal of neuromuscular blockade in laparoscopic surgery. Material and Methods: Prospective, randomized, single-blind clinical trial in children from 1 month to 17 years of age. Statistical analysis was performed with Student’s t test for the efficacy variable and Pearson’s Chi square for the safety variable to compare differences between groups, the level of significance was valued with p less than 0.05. Results: A total of 63 patients, 31 for the sugammdex group (group A) and 32 for the neostigmine group (group B), for the efficacy variable, an average reversion time to TOF 90 of 2.06 minutes was found for sugammadex and 4.34 for neostigmine. minutes. For the side effects result, a percentage of 3.2% was found for sugammadex and 23.8% for the neostigmine group, the most frequent being bradycardia. For the variable adverse effects, transient ventricular tachycardia with hemodynamic stability occurred in the sugammadex group with 1.6%. Conclusions: Sugammadex is effective and safe for the reversal of the neuromuscular relaxant rocuronium in laparoscopic surgery in children.
Resumen
Introducción: Los avances recientes en las técnicas anestésicas y quirúrgicas, así como en el refinamiento de equipos han llevado a un incremento de la cirugía laparoscópica en niños de todas las edades reportándose grandes beneficios ya conocidos[],[]. La parálisis residual posoperatoria está presente en los niños con una incidencia variable hasta de 28,1%[], como consecuencia existe una mayor morbilidad posoperatoria. Objetivos: Comparar la seguridad y efectividad de sugammadex y neostigmina para la reversión del bloqueo neuromuscular en cirugía laparoscópica. Material y Métodos: Ensayo clínico prospectivo, aleatorizado a un ciego, en niños de 1 mes a 17 años, se realizó análisis estadístico con prueba t de Student para la variable eficacia y Chi cuadrada de Pearson para la variable seguridad para comprar diferencias entre grupos, el nivel de significancia fue dada por una p menor de ,05. Resultados: Un total de 63 pacientes, 31 para grupo sugammadex (grupo A) y 32 para grupo neostigmina (grupo B), para la variable eficacia se encontró para sugammadex un tiempo promedio de reversión a TOF 90 de 2,06 minutos (min) y para neostigmina de 4,34 minutos. Para el resultado efectos secundarios se encontró un porcentaje del 3,2% para sugammadex y 23,8% para el grupo neostigmina, siendo la más frecuente bradicardia. Para la variable efectos adversos se presentó en el grupo sugammadex taquicardia sinusal transitoria con estabilidad hemodinámica con el 1,6%. Conclusiones: Sugammadex es eficaz y seguro para la reversión de relajante neuromuscular rocuronio en cirugía laparoscópica en niños.
-
Introducción
La administración de relajantes neuromusculares es una práctica habitual durante los procedimientos anestésicos en los que se realiza intubación orotraqueal y cirugía laparoscópica, para obtener objetivos anestésicos-quirúrgicos como el disminuir los efectos generados por el aumento de la presión intrabdominal, mejorar la visualización del campo quirúrgico para el cirujano, y tener una mecánica ventilatoria adaptada al paciente pediátrico sin daño pulmonar[3],[4].
Al término de estos procedimientos es común tener algún grado de parálisis residual posoperatoria (PRPO), más acentuada en poblaciones como neonatos y lactantes menores, los cuales deben ser tratados con fármacos que revierten a los relajantes neuromusculares (RNM). Neostigmina es el fármaco convencional, el cual tiene una gran cantidad de efectos secundarios y adversos que generan morbilidad, prefieriendo evitarlos en grupos de poblaciones pequeñas como lactantes menores y neonatos[3].
Sugammadex es un agente farmacológico el cual ha comprobado su eficacia y seguridad en pacientes adultos y autorizado por la Food and Drug Administration (FDA) en el 2021 para niños mayores de 2 años de edad para la reversión del bloqueo neuromuscular inducido por rocuronio en distintos escenarios clínicos, comparado con la terapia de reversión convencional con neostigmina[5], pero ninguno de estos se ha llevado a cabo en niños sometidos a cirugía laparoscópica y en población mexicana. El objetivo es comparar la eficacia y seguridad del sugammadex contra neostigmina, para la reversión de rocuronio en la población pediátrica para cirugía laparoscópica en una población del noreste de México.
-
Material y métodos
Se realizó un ensayo clínico, prospectivo a un ciego, en el Hospital Infantil de Tamaulipas en Cd. Victoria Tamaulipas, en un período comprendido entre febrero de 2018 a enero de 2022, con registro número HIT-INV-2018-01 por el comité de investigación de dicho hospital y registro por el comité de investigación, ética en investigación y de bioseguridad del Hospital Regional de Alta Especialidad IMSS Bienestar, con número de registro HRAEV-IC-004-18.
El tamaño de la muestra se realizó para dos proporciones, con un nivel de confianza de 0,05 y un poder estadístico del 80%. La selección de la muestra se realizó por muestreo probabilístico, aleatorio simple, por medio de tómbola hasta completar el tamaño de la muestra.
Los criterios de inclusión fueron pacientes de 1 mes de edad hasta los 17 años, estado físico ASA I y II programados para cirugía laparoscópica electiva o urgente, se excluyeron a pacientes con enfermedades cardíacas, hepáticas, renales, enfermedades neuromusculares y reacciones de hipersensibilidad a las fórmulas sugammadex o neostigmina, los pacientes seleccionados como cirugía urgente todos contaban con ayuno completo de acuerdo a su edad. Los criterios de eliminación fueron pacientes que al término del procedimiento tuvieron TOF mayor a 90%, falla en el equipo de monitoreo de la relajación y pacientes con datos incompletos en la hoja de registro (Figura 1).
Una vez que el familiar o tutor aceptó participar en el proyecto, se realizó la selección y se asignó al grupo A o B, en donde solo el investigador se enteró del fármaco seleccionado. Durante el período de registro de datos dentro del quirófano el investigador estuvo presente desde el inicio de la reversión hasta la extubación, una vez extubado el paciente ingresó a la unidad de cuidados posoperatorios (UCPA).
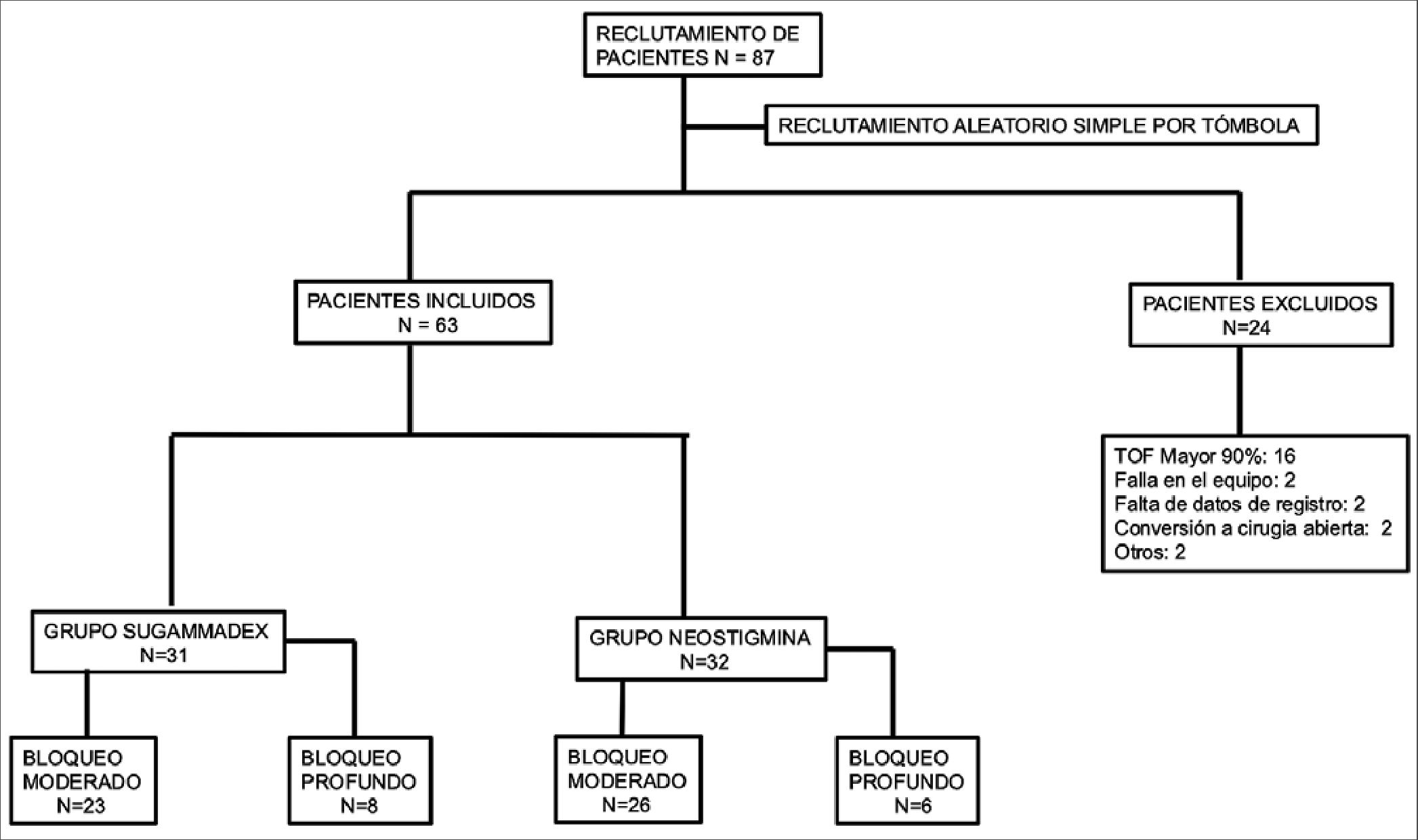
Figura 1.
El análisis estadístico se realizó en programa IBM SPSS estatistics 25. Se utilizó estadística descriptiva para determinar media y desviación estándar para la variables efectividad se utilizó estadística inferencial con t de Student cuando la distribución fue anormal y U de Mann-Whitney cuando la distribución fue normal. Para la variable seguridad se utilizó Chi cuadrada con prueba exacta de fisher. El nivel de significancia se dio cuando p resultó menor de 0,05.
Descripción: una vez seleccionado al grupo correspondiente, se administró premedicación con midazolam intravenoso a dosis de 0,1 mg^kg, se realizó monitoreo no invasivo para presión arterial no invasiva (PANI), saturación de oxígeno (SPO2), electrocardiograma (ECG), frecuencia cardíaca (FC), frecuencia respiratoria (FR), temperatura corporal (T) y monitoreo de la relajación neuromuscular con monitor TOF watch serie 122007087.
Se realizó la monitorización de TOF watch en el miembro torácico superior libre, en la región anterior del brazo en el nervio cubital, se colocaron dos electrodos con una separación de 2-3 cm, y el trasductor en su lado plano en el dedo pulgar con cinta adhesiva. Una vez instalado se administró sedación, se realizó la calibración automática, y se tomo el tiempo 0, posteriormente, inició la inducción anestésica convencional. La inducción fue con fentanil 3 mcg^kg, propofol 2-3 mg^kg y rocuronio a 0,6 mg^kg, se monitorizó la relajación neuromuscular cada minuto y al obtener TOF 0 se realizó la intubación orotraqueal de acuerdo a los estandares establecido para cálculo de número de tubo orotraqueal.
Todos los pacientes se mantuvieron en relajación moderada a profunda durante el procedimiento quirúrgico, midiendo TOF watch cada 10 minutos, las dosis subsecuentes se administraron a 0,1 mg^kg cada 30 a 40 minutos o antes si el ventilador marcaba ventilación espontánea. El mantenimiento anestésico se mantuvo con sevoflurane y fentanilo a juicio del anestesiólo- go encargado del procedimiento.
Una vez terminado el procedimiento y si el TOF indicaba por abajo del 90% se inició la reversión del RNM de acuerdo al fármaco seleccionado, midiendo el basal tiempo 0 y cada minuto hasta tener el TOF 90% y posteriormente la extubación.
Los fármacos fueron preparados por el anestesiólogo encargado del proyecto para grupo A: 2 mg^kg y para grupo B: 40 mcg^kg más atropina 20 mcg^kg^peso, ambos diluidos en 5 ml de solución salina 0,9%, la velocidad de administración fue en 1 minuto y una vez terminada, se inició el cronómetro midiendo cada minuto el porcentaje de TOF hasta llegar a los 10 minutos, al alcanzar TOF 90% se concluye la medición y posterior extubación.
Medidas de seguridad: para la administración de neostigmina solo se administró cuando el TOF marco el 50% o más, o
cuando habían pasado al menos 30 minutos de la última dosis administrada de relajante neuromuscular, una segunda medida de seguridad fue en los casos en los que no se obtuvo reversión del relajante medido con TOF > 90%, después de los 10 minutos para ambos fármacos se administró una segunda dosis igual.
El registro del grado de relajación neuromuscular se identificó de acuerdo a los indicadores de TOF wantch: Relajación moderada: registro de TOF 90% o menos. Relajación profunda: registro de TOF 0 y cuenta postetánica en 1 o mayor. Relajación profunda: cuenta postetánica en 0.
Se realizó medición de signos vitales cada dos minutos hasta los 20 minutos, así como el registro de efectos secundarios y eventos adversos en la unidad de cuidados postoperatorios.
Tabla 1. Datos demográficos de los participantes en ambos grupos
| Grupos | Edad promedio en años (DE) | Peso promedio en kg (DE) | Talla en cm (DE) |
| Sugammadex | 6,5 (6,08) | 27,49 (20,10) | 1 15,1 (39,28) |
| Neostigmina | 7,7 (5,1) | 32,71 (22,90) | 122 (31,63) |
-
Resultados
Un total de 63 pacientes se incluyeron en el estudio, para el grupo grupo A fueron 31 pacientes y para el grupo B 32 pacientes, los datos de reclutamiento de pacientes se encuentran en la Figura 1, y los datos demográficos se observan en la Tabla 1.
En la Tabla 2 se observa la totalidad de cirugías realizadas, siendo la más común apendicectomía en 33,33%, seguido de laparoscopía diagnóstica con 19,02%.
Para la variable relajación neuromuscular encontramos grados moderado y profundo de acuerdo con medición de TOF, se descartó el grado intenso midiendo cuenta postetánica. El grado de relajación moderado fue el más frecuente para ambos grupos en 77,8% siendo para el grupo A de 36,5% y grupo B el 41,3% (Tabla 3).
Para la variable tiempo de reversión del RNM encontramos para grupo A una media de 2,06 minutos y para el grupo B el doble de tiempo con una p significativa del ,000, con un IC95 de -2,30 a 11,12, para esta variable utilizamos estadística inferencial t Student y significancia estadística con p menor a ,05 (Tabla 4).
En la variable tiempo de extubación, se encontró para el grupo sugammadex una media de 4,38 minutos, DE 4,60, y para grupo neostigmina una media de 5,31 minutos con una DE de 3,31, calculando esta diferencia con t Student, y un IC 95 de (-4,33 A -2,36) con significancia estadística para sugammadex, (Tabla 5).
Para la evaluación de la variable efectos secundarios de los fármacos fueron analizadas mediante frecuencias y estadística inferencial con Chi cuadrada de Pearson, registrándose un total de n:17 (27%) para el total de la población, para el grupo A con 3,2% y en el grupo B un porcentaje del 23,8%. Se encontró una diferencia significativa en la ocurrencia de estos entre los dos fármacos con una p de 0,02, para las varibles bradicardia, hipertensión arterial sistémica y taquicardia se realizó el diagnóstico de acuerdo a las percentilas para su edad (Tabla 6).
Los eventos adversos se clasificaron en dos grupos tipo A y tipo B, los cuales se presentaron solo en el 1,6% el tipo B, definido como aquellos eventos adversos serios, reacciones raras, que pueden ser graves y este ocurrió en 1 paciente del grupo sugammadex (1,6%) caracterizado como taquicardia sinusal sin inestabilidad hemodinámica, que ameritó hospitalización en unidad de terapia intensiva pediátrica solo para vigilancia y no requirió manejo médico ya que fue transitoria, con una p 0,30
Tabla 2. Cirugías laparoscópicas realizadas en ambos grupos
| Tipo de cirugía | Número | Porcentaje (%) |
| Apendicectomia | 21 | 33,33% |
| Laparoscópia diagnóstica | 12 | 19,02% |
| Colecistectomia | 3 | 4,77% |
| Hernioplastía inguinal (derecha, izquierda, bilateral) | 6 | 9,52% |
| Nefrectomia | 3 | 4,77% |
| Toma de biopsia ovario, hepática, mediastial | 4 | 6,34% |
| Orquidopexia (derecha, izquierda) | 7 | 11,11% |
| Derivación urinaria | 1 | 1,60% |
| Reimplante vesicorureteral | 2 | 3,17% |
| Pieloplastia | 2 | 3,17% |
| Funduplicatura de Nissen | 1 | 1,60% |
| Varicocelectomia | 1 | 1,60% |
| Total | 63 | 100% |
Tabla 3. Grados de relajación neuromuscular en porcentaje
| Moderado (n) | Profundo (n) | Total (n) | |
| Sugammadex | 36,5% (23) | 12,7% (8) | 49,2% (31) |
| Neostigmina | 41,3% (26) | 9,5% (6) | 50,8% (32) |
| Total | 77,8% (49) | 22,2% (14) | 100% (63) |
Tabla 4. Tiempo de reversión de TOF 90%
| Sugammadex (DE) | Prostigmina (DE) | P | |
| Minutos TOF 90% | 2,06 (1,63) | 4,34 (2,77) | 0,000 |
Tabla 5. Tiempo de extubación en minutos
| Sugammadex | Neostigmina | P | |
| Tiempo extubación | 4,38 | 5,31 | 0,000 |
| DE | 4,60 | 3,13 |
-
Discusión
Para la reversión neuromuscular se recomienda tener mo- nitorización de la relajación nueromuscular con dispositivos adecuados como TOF watch, en donde de acuerdo a estas mediciones se revertirá el bloqueo neuromuscular de acuerdo al grado de relajación que se obtenga con las siguientes dosis recomendadas en la literatura mundial en adultos: para bloqueo moderado en TOF watch a dosis de 2 mg^kg; para bloqueo profundo medido en TOF 0, y al menos una contracción en el conteo postetánico a dosis de 4 mg^kg de peso y por último a 16 mg^kg de peso para bloqueo intenso medido en cero en el conteo postetánico y TOF, o para la reversión inmediata en escenarios clínicos de “no puedo ventilar” “no puedo intubar”[6],[7].
No existe aún en la literatura dosis estandarizadas de acuerdo a las edades pediátricas y el grado de bloqueo neuromuscular guiado por TOF que sean diferentes a los adultos para la reversión neuromuscular con sugammadex, el cual es un tema aún en investigación; como lo reportado por Sasioglu y cols., donde investigaron a una dosis estandarizada de 2 mg^kg de sugammadex para revertir un TOF de 25% (relajación moderada) con edades de 2 a 4 años y otro grupo de 5 a 10 años comparando con diferentes gases anestésicos sevoflurane y desflurane, encontrando tiempos de reversión similares en menos de 1 minuto para alcanzar TOF 90%; pero si observaron una reversión más rapida en el grupo de 2 a 4 años con una p de 0,03 cuando se utilizó gas anestésico sevoflurane[8].
Matsui y cols., investigaron dosis de sugammdex para revertir el bloqueo profundo a 3 diferentes dosis en niños de 2 a 10 años con dosis de 1 mg, 2 mg y 4 mg^kg^peso, encontrando que una dosis de 1 mg^kg^peso es más prolongado el tiempo de reversión, comparado con 2 y 4 mg en estas últimas dosis el tiempo fue muy similar 70,3 y 68,2 segundos respectivamente, estos autores dan la pauta que a un bloqueo profundo una dosis de 2 mg^kg^peso podría ser suficiente para la reversión profunda, pero sus estudios no son concluyentes[9].
Con respecto a la reversión del bloqueo profundo Ji y cols., investigaron con un modelo farmacológico para revertir el bloqueo profundo con sugammadex a diferentes dosis 2 mg, 4 mg y 8 mg^kg^peso en niños de 2 a 17 años, encontrando que a dosis de 8 mg^kg podría ser adecuada para revertirlo en menos de 3 minutos muy similar a los adultos, pero sin ser un dato concluyente ya que se requieren más estudios a 16 mg^kg así como más modelos farmacocinéticos y farmacodinámicos en otros escenarios de reversión[10].
En este estudio se obtuvieron 14 pacientes con bloqueo profundo n = 8 para sugammadex y n = 6 para neostigmina los cuales se obtuvo adecuada reversión a dosis de 2 mg^kg^peso cuando se revirtió con sugammadex, cabe señalar que la línea de investigación fue diferente, pero encontramos un dato similar a Matsui.
Tabla 6. Frecuencia de efectos secundarios
| Sugammadex n (%) | Neostigmina n (%) | Total | |
| n (%) | |||
| Sialorrea | 0 (0%) | 3 (4,8%) | 3 (4,8%) |
| Taquicardia | 1 (1,6%) | 1 (1,6%) | 2 (3,2%) |
| Bradicardia | 0 (0%) | 4 (6,3%) | 4 (6,3%) |
| Laringoespasmo | 0 (0%) | 1 (1,6%) | 1 (1,6%) |
| HAS | 0 (0%) | 1 (1,6%) | 1 (1,6%) |
| 2 o más efectos | 1 (1,6%) | 5 (7,9%) | 6 (9,5%) |
| Ninguno | 29 (46%) | 17 (27%) | 46 (73%) |
Existe un gran número de investigaciónes con respecto a la eficacia y efectos adversos de sugammadex en adultos, y es una línea aún en investigación en niños de diferentes edades. Un metaanálisis reportado por Chhabra y cols., investigaron la eficacia de sugammadex comparado con neostigmina en niños y adultos, investigando el tiempo de reversión con ambos fármacos hasta encontrar el TOF mayor a 90% en donde se incluyeron 4 artículos con un total de 120 niños en cada grupo encontrando un tiempo menor de reversión para sugammadex versus neoastigmina. MD = -26,36 minutos para sugammadex, 95% IC (-40,16, – 12,57) p < 0,0111.
Por otro lado, Franz reportó una serie de cohorte retrospectivo comparando la eficacia y eventos adversos de neostigmina y sugammadex, en niños menores de 2 años, analizaron 331 expedientes en donde se valoró el tiempo de la última dosis de RNM y el tiempo de reversión encontrando tiempos menores con sugammadex con un promedio de 84 minutos y para neostigmina de 19,6 minutos (diferencia media de 19 minutos y una p de 0,001), por otro lado, no se reportaron efectos adverso graves atribuidos a sugammadex, concluyendo que este es un paso para realizar nueva línea de investigación en este grupo de pacientes, ya que está investigación tuvo varias limitaciones al ser un estudio retrospectivo[12].
En un metaanálisis publicado por Liu G. y cols., revisaron 10 estudios pediátricos en donde se incluyeron a 575 pacientes en total, comparando sugammadex contra neostigmina o placebo encontrando como resultado principal que sugammadex fue significativamente más eficaz que el grupo control de neostig- mina o placebo para la reversión del bloqueo neuromuscular a TOF 90 en pacientes pediátricos, utilizando dosis de sugammadex a 2 mg o 4 mg^kg^peso con un IC de -11,32 a -5,71 una I2 del 98,3% y una p 0,000[13].
Zhou y cols., en 2023, evaluaron 18 ensayos clínicos (EC) en donde analizaron eficacia, extubación, efectos adversos y efectos secundarios de sugammadex comparado con neostigmina, piridostigmina o placebo, con dosis de sugammadex de 2, 4 y 8 mg^kg^peso, en los 3 grupos se obtuvo un tiempo menor para obtener TOF 90 con significancia estadística: para 2 mg una I2 de 94,3%, IC 95 -3,75 -2,04 y p 0,001, grupo 4 mg I2 95,8% IC 95 -4,79, -1,84 y p 0,000, y para el grupo 8 mg un I2 de 94,8%, IC -3,26, -1,02 y una p 0,000[14].
Lang y cols., investigaron la eficacia y seguridad de sugam- madex comparado con neostigmina para el tiempo de reversión a TOF 90% encontraron un total de 17 estudios con 995 pacientes pediátricos en donde hay un tiempo más corto de reversión para sugammadex en compración con neostigmina o placebo con una I2 del 99% una IC 95 -14,4 (-17,8 a -11,75), p significativa de 0,00001[15].
Voss comparó la eficacia de sugammadex a diferentes dosis 2 y 4 mg para reversión de rocuronio o vecuronio comparado con neostigmina 50 mcg^kg, así como los eventos adversos del sugammadex a diferentes edades pediátricas separandolos en 3 grupos de edad 2 años a < 6 años, 6 años a < 12 años y 12 a < 17 años, encontrando el tiempo promedio de reversión para ve- curonio y rocuronio más rápida a TOF 90% con sugammadex a 2 mg^kg (1,6 min IC95% 1,3-2) y neostigmina (7,5 min IC95% 5,6-19) con una p < 0,000. Para la reversión a 4 mg^kg para el bloqueo profundo el tiempo promedio para vecuronio y rocuronio fue de 2 minutos (IC95% 1,8-2,3), en este último no se utilizó neostigmina; además, no se encontraron efectos secundarios importantes en ambos fármacos[16].
Con respecto a la eficacia de la neostigmina solo es útil para revertir el bloqueo neuromuscular moderado, en donde ya hay un grado de recuperación espontánea[17]; para que los inhibidores de la acetilcolinesterasa sean eficaces para revertir el bloqueo competitivo de la transmisión neuromuscular la concentración del relajante en la hendidura neurmomuscuar debe de ser relativamente baja[18]. Las recomendaciones en la literatura para la reversión con neostigmina son solo si se establece una recuperación parcial y se conoce la profundidad relativa del bloqueo o al menos tener 2 respuestas de TOF antes de revertir[19]. Existen reportes de neostigmina la cual no se recomienda su administración para bloqueos profundos ya que resultaria ineficaz[20].
A diferencia de estos estudios, estandarizamos la dosis a 40 mcg^kg^peso para neostigmina independientemente del grado de relajación neuromuscular moderado o profundo, encontrando una adecuada reversión a TOF 90 en el doble de tiempo 4,34 minutos que sugammadex sin presentar recurarización posoperatoria, en ningún caso de los 6 pacientes con bloqueo profundo que se revirtieron con neostigmina se necesitó una dosis adicional, aunque este número de pacientes es una muestra muy pequeña demostró ser eficaz.
Yang L. y cols., realizaron una búsqueda sistemática sobre el uso de neostigmina para revertir el relajante neuromuscular en pacientes pediátricos, sin encontrar al menos un ensayo clínico con alto grado de evidencia que reporte la eficacia y seguridad de este fármaco en el paciente pediátrico, llegando a las conclusiones de que se necesitan ensayos clínicos sobre el uso de neostigmina en pacientes pediátricos que incluyan en su busqueda el riesgo de bloqueo residual posoperatorio, efectos adversos y monitorización de la relajación[21].
-
Tiempo de extubación
Para el tiempo de extubación en pacientes pediátricos lo reportado por Turhan Kara para el grupo sugamadex fue de 1,15 min y neostigmina de 3,25 min (p = 0,002)[22]. Ammar reportó un tiempo de 2,0 min contra 4,3 min con una p significativa de 0,005[23], comparado con los resultados encontrados de este estudio fue de sugammadex 4,38 y 5,31 respectivamente, con p significativa 0,000; Zhou y cols., en 2023, en un metaanálisis reportaron en 10 estudios el tiempo de extubación comprando sugammadex con neostigmina, priridostigmina o placebo a 2 mg^kg^peso encontrando el tiempo menor para extubación con sugammadex con una I2 de 95,9%, IC de -4,04, -1,85 y una p significativa de 0,000 y para 4 mg^kg^peso con una I2 95%, IC de -1,90, -1,23 y una p 0,000[14].
Un último metaanálisis reportado por Lang para el tiempo de extubación en donde favorece a sugammadex con una I2 99%, un IC 95 del 16,70, -11,26, y una p 0,00005; además, analizaron el nivel de evidencia con la escala GRADE encon- trandose como baja, al parecer por la alta heterogeneidad I2 y el sesgo de publicación bajo como factores principales[15]. Por otro lado los tiempos de extubación pueden estar afectados por otros factores como la dosis de opiode administrada, temperatura del paciente y comorbilidades asociadas, que en este estudio no fueron variables de medición.
-
Seguridad de sugammadex
Sugammadex se sintetizó en 1999 por primera vez, fue aprobado en la unión europea en adultos en el 2008, y autorizada en los niños de 2-17. En EEUU, la FDA aprobó su uso en adultos en el 2015, y en 2021 se aprobó en niños mayores de 2 años[5],[6].
Los efectos secundarios encontrados en este estudio son para sugammadex del 3,2% (n = 2) y para neostigmina 23,8% (n = 15) los más frecuentes fueron sialorrea, bradicardia, la- ringoespasmo, hipertensión arterial y taquicardia, comparados con Shields y cols., reportaron una incidencia de efectos adversos de 17% (n = 5) para sugammadex, como náusea, vómito, boca seca, pirosis, disnea, insuficiencia respiratoria y fibrilación auricular en un paciente[24]. Ammar no reporta efectos secundarios serios[23], Zhou y cols., en 2023 en un metaanálisis encontraron una menor incidencia en el grupo de sugammadex que el grupo control con un RR 0,44 y un IC 95 de 0,24-0,82, una I2 de 74,9% y p 0,001, dentro de los efectos presentados fueron náusea y vómito, boca seca, inquietud y fiebre[14].
Lang reporta en su metaánalisis los efectos adversos más frecuentes y con significancia estadística para sugammadex fueron náuseas y vómitos postoperatorios (p 0,00001), bradicardia (p 0,004), sequedad de boca (0,0001), dolor, espasmos, apnea y desaturación los cuales no tuvieron significancia estadistica[15]. En un estudio retrospectivo publicado por Gaver comparando seguridad de sugammaex con neostigmina se encontró que para el caso de bradicardia fue el doble para neostigmina con 150 pacientes y 71 para sugammadex con significancia estadística con una p de 0,001, para el resto de los efectos secundarios como hipotensión, broncoespasmo, nausea y vómito no hubo significancia estadística entre grupos[25]. Ozgün C. y cois., compararon los efectos adversos de sugammadex y neostigmina en pacientes pediátricos evaluando variabilidad en frecuencia cardíaca, presión arterial media, elevación de la cabeza, estado de conciencia, fuerza muscular, náuseas, vómitos, encontrando una disminución de la FC para grupo sugammadex y elevación de FC para grupo neostigmina (p 0,001), además con diferencias significativas en la fuerza muscular entre grupos (p 0,001) y estado de conciencia siendo favorecido sugammadex (p ,001)[26].
Las desventajas del uso de neostigmina están descritas por sus efectos secundarios los cuales están asociados a sus efectos murcarínicos como efectos cardiovasculares gastrointestinales y respiratorios como bradicardia, disminución en la conducción del nodo AV, vasodilatación e hipotensión arterial sistémica, efectos respiratorios como broncocostricción del músculo liso bronquial, incremento de la actividad de las glándulas secretoras que incluye las bronquiales, lagrimales y salivales entre otras[11].
Con respecto a los efectos secundarios que se reportan como más frecuentes, en este artículo se determinó por los investigadores la administración de antihemético para prevención de náuseas y vómitos a dosis estandarizadas 0,15 mg^kg de ondansetron para ambos grupos y administración de atropina a 20 mcg por kg en el grupo de neostigmina, por lo que estas variables no se registraron como efectos secundarios.
Existen reportes del fabricante de la presencia de una gran variedad de arritmias cardíacas con sugammadex como fibrilación auricular o ventricular, cambios auriculo ventriculares
o del segmento ST; en esta investigación dentro de los efectos encontrados se presentó para sugammadex en 1 paciente (1,6%) de la población, presentando una taquicardia sinusal sin repercusión hemodinámica, el cual se mantuvo en vigilancia durante 24 h en la unidad de cuidados intensivos pediátricos sin mayor complicaciones[7]. Abrishami compara en pacientes adultos la seguridad de sugammadex con placebo o neostigmina reportando como eventos adversos graves el 0,7% (n = 7) con una población de 1.022 casos que recibieron sugammadex, lo encontrado fue prologación del QT en 2 pacientes, 2 eventos de broncoespasmo, hipotensión intraoperatoria y fibrilación auricular e insuficiencia respiratoria[27].
Dentro de los efectos adversos serios se publicó en un estudio retrospectivo un caso de anafilaxia para neostigmina, tratada con epinefrina, con una incidencia de 0,1% sin especificar mas detalles[25]. Lyu y cols., publicaron un estudio retrospectivo obteniendo información en la base de datos más grande de farmacovigilancia a nivel mundial de la World Health Organization (OMS) atraves de VigiBase y el centro Upssala Monitoring Centre (UMC), en donde investigaron la asociación entre sugammadex y sospecha de efecto adversos al fármaco valorando como un IC025 mayor de 3 como alta sospecha y definido como una señal alta. De las complicaciones reportadas como altas se encuentran recurrencia en bloqueo neurmomuscular (n = 54) IC025 de 6,33, laringoespasmo (n = 53) IC025 de 5,64, broncoespasmo (n = 119) IC025 de 5,36 y bradicardia (n = 169) con una IC025 de 4,90, con respecto a la relación entre sugammadex y edad del paciente se reportó que el grupo de edad pediátrico 0-17 años tuvo la mayor intensidad de señal a nivel global con una p significativa 0,0128.
Con respecto a la seguridad de la neostigmina Yang L., realizó una metaanálisis en la búsqueda de información en ensayos clínicos del uso de la neostigmina en paciente pediátrico para prevenir el bloqueo residual posoperatorio buscando mortalidad, uso de asistencia ventilatoria, efectos adversos, hipoxia, tiempo de recuperación del TOF 0,9, mayor estancia en unidad de cuidados posanestésicos (UCPA), no encontrando un solo artículo al respecto, toda la información se ha centrado en la compración de la eficacia con sugammadex, llegando a la conclusión que se necesitan ensayos clínicos del uso de neostigmina en esta población[21].
Como último punto, se han abierto nuevas líneas de investigación acerca del comportamiento farmacológico del sugammadex en niños mayores de 2 años, de diferentes edades con variables de estudio como dosis de acuerdo al peso corporal[29]; así como concentración plasmática máxima, volumen aparente de distribución, aclaramiento, vida media y eliminación; dejando la pauta para nuevas investigaciones en está población[16].
-
Conclusiones
Sugamadex resultó ser más eficaz y seguro que neostigmina, con una eficacia prácticamente el doble que el grupo control y con menores efectos secundarios, de igual manera mejora el tiempo de extubación, por otro lado, se encontró que neostigmina puede revertir bloqueo profundo a dosis de 40 mcg por kg en 6 de los pacientes estudiados sin tener recurarización posoperatoria, este punto en específico requiere mayor investigación.
Es claro que este fármaco llego a desplazar a la neostigmina, pero aun se necesitan mayores investigaciones con respecto a la farmacocinética del fármaco en diferentes grupos de población como neonatos, lactantes menores de 2 años y el resto de la población pediátrica, al igual si las dosis utilizadas deberían ser equiparables a las del adulto.
-
Limitaciones
Dentro de las limitaciones del estudio fue nuestro número pequeño de la muestra por diferentes situaciones: el tiempo de recolección de datos fue prolongado ya que empezamos el proyecto previo a la pandemia de coronavirus, limitando por aproximadamente un año las cirugías electivas, además se tuvo escasez de neostigmina en una temporada en México y se utilizaron diferentes marcas farmacéuticas de rocuronio con respecto al inicial que fue norcuron.
Agradecimientos: Dra. Arani Casillas Ramírez, directora del departamento de Investigación del Hospital Regional de Alta Especialidad Bicentenario 2010, IMSS bienestar por el apoyo para financiar esta investigación.
Financiación: El presente trabajo ha sido financiado por el departamento de Investigación del Hospital Regional de alta especialidad Bicentenario 2010 IMSS bienestar de Ciudad Victoria Tamaulipas, en la compra del monitor TOF watch y sugammadex.
-
Referencias
1. Garg J, Kale S, Sabharwal N, Bagga D, Gogia AR. Hemodynamic, airway pressure, and capnometric changes and perioperative outcome in pediatric laparoscopic inguinal herniorrhaphy: a comparison with open inguinal herniorrhaphy. Anesth Essays Res. 2018;12(1):165–9. https://doi.org/10.4103/aer.AER_112_17 PMID:29628575
2. Wedgewood J, Doyle E. Anaesthesia and laparoscopic surgery in children. Paediatr Anaesth. 2001 Jul;11(4):391–9. https://doi.org/10.1046/j.1460-9592.2001.00519.x PMID:11442854
3. Ledowoski T, O’Dea B, Meyerkort L, Hegarty M, Ungern-Sternberg BS. Postoperative residual neuromuscular paralysis at an Australian Tertiary Children’s Hospital. Anesthesiol Res Pract. 2015;1-4:1–4. https://doi.org/10.1155/2015/410248.
4. Shehata S. Pediatric Surgical Procedures-an Update Guide-Volumen I. IntechOpen. 1ra Ed. London, United Kingdom. 2025. pp 3-14 https://doi.org/10.5772/intechopen.111130.
5. Wang A, Tsivitis A, Ma S, Jin Z, Al Bizri E, Moore R. The safety and efficacy of sugammadex for reversing neuromuscular blockade in younger children and infants. Expert Opin Drug Saf. 2024 Jul;23(7):845–53. https://doi.org/10.1080/14740338.2024.2373906 PMID:38938223
6. Grigg E. Sugammadex and neuromuscular reversal: special focus on neonatal and infant populations. Curr Opin Anaesthesiol. 2020 Jun;33(3):374–80. https://doi.org/10.1097/ACO.0000000000000847 PMID:32324657
7. Honing G, Martini CH, Bom A, van Velzen M, Niesters M, Aarts L, et al. Safety of sugammadex for reversal of neuromuscular block. Expert Opin Drug Saf. 2019 Oct;18(10):883–91. https://doi.org/10.1080/14740338.2019.1649393 PMID:31359807
8. Pirinç Şaşıoğlu G, Kendigelen P, Tütüncü AC, Kaya G. Reversal of rocuronium-induced neuromuscular blockade by sugammadex under sevoflurane and desflurane anesthesia in children. Eurasian J Med. 2023 Oct;55(3):173–7. https://doi.org/10.5152/eurasianjmed.2022.22090 PMID:37909186
9. Matsui M, Konishi J, Suzuki T, Sekijima C, Miyazawa N, Yamamoto S. Reversibility of rocuronium-Induced deep neuromuscular block with sugammadex in infants and children-A randomized study. Biol Pharm Bull. 2019 Oct;42(10):1637–40. https://doi.org/10.1248/bpb.b19-00044 PMID:31406051
10. Ji SH, Huh KY, Oh J, Jeong HJ, Jang YE, Kim EH, et al. Reversal of rocuronium-induced intense neuromuscular blockade by sugammadex in Korean children: A pharmacokinetic and pharmacodynamic analysis. Clin Transl Sci. 2023 Jan;16(1):92–103. https://doi.org/10.1111/cts.13429 PMID:36181377
11. Chhabra R, Gupta R, Gupta LK. Sugammadex versus Noestigmine for reversal of neuromuscular blockade in adults and children: a systematic review and meta-analysis of randomized controlled trials. Curr Drug Saf. 2024;19(1):33–43. https://doi.org/10.2174/1574886318666230302124634 PMID:36861797
12. Franz AM, Chiem J, Martin LD, Rampersad S, Phillips J, Grigg EB. Case series of 331 cases of sugammadex compared to neostigmine in patients under 2 years of age. Paediatr Anaesth. 2019 Jun;29(6):591–6. https://doi.org/10.1111/pan.13643 PMID:30934160
13. Liu G, Wang R, Yan Y, Fan L, Xue J, Wang T. The efficacy and safety of sugammadex for reversing postoperative residual neuromuscular blockade in pediatric patients: A systematic review. Sci Reports. 2017. 18;7(1)5724 1-9 https://doi.org/10.1038/s41598-017-06159-2.
14. Zhou S, Hu H, Ru J. Efficacy and safety of sugammadex sodium in reversing rocuronium-induced neuromuscular blockade in children: an update systematic review and meta-analysis. Heliyon. 2023, 9(8)e18356:1-11. https://doi.org/10.1016/j.heliyon.2023.e18356.
15. Lang B, Han L, Zeng L, Zhang Q, Chen S, Huang L y cols, Efficacy and safety of sugammadex for neuromuscular blockade reversal in pediatric patients: an updated meta-analysis of randomized controlled trials with trial sequential analysis. MBC Pediatr. 2022. 22(1)295:1-12. https://doi.org/10.1186/s12887-022-03288-0.
16. Voss T, Wang A, DeAngelis M, Speek M, Saldien V, Hammer GB, et al. Sugammadex for reversal of neuromuscular blockade in pediatric patients: results from a phase IV randomized study. Paediatr Anaesth. 2022 Mar;32(3):436–45. https://doi.org/10.1111/pan.14370 PMID:34878707
17. Geldner G, Niskanen M, Laurila P, Mizikov V, Hübler M, Beck G, et al. A randomised controlled trial comparing sugammadex and neostigmine at different depths of neuromuscular blockade in patients undergoing laparoscopic surgery. Anaesthesia. 2012 Sep;67(9):991–8. https://doi.org/10.1111/j.1365-2044.2012.07197.x PMID:22698066
18. Tobias JD. Current evidence for the use of sugammadex in children. Paediatr Anaesth. 2017 Feb;27(2):118–25. https://doi.org/10.1111/pan.13050 PMID:27859917
19. Sasaki N, Meyer MJ, Malviya SA, Stanislaus AB, MacDonald T, Doran ME, et al. Effects of neostigmine reversal of nondepolarizing neuromuscular blocking agents on postoperative respiratory outcomes: a prospective study. Anesthesiology. 2014 Nov;121(5):959–68. https://doi.org/10.1097/ALN.0000000000000440 PMID:25225821
20. Lee C, Katz RL. Clinical implications of new neuromuscular concepts and agents: so long, neostigmine! So long, sux! J Crit Care. 2009 Mar;24(1):43–9. https://doi.org/10.1016/j.jcrc.2008.08.009 PMID:19272538
21. Yang L, Yang D, Li Q, Zuo Y, Lu D. Neostigmine for reversal of neuromuscular block in paediatric patients. Cochrane Database Syst Rev. 2014 May;2014(5):CD010110. https://doi.org/10.1002/14651858.CD010110.pub2 PMID:24793636
22. Kara T, Ozbagriacik O, Turk HS, Isil CT, Gokuc O, Unsal O, et al. [Sugammadex versus neostigmine in pediatric patients: a prospective randomized study]. Rev Bras Anestesiol. 2014;64(6):400–5. https://doi.org/10.1016/j.bjan.2014.03.001 PMID:25437696
23. Ammar AS, Mahmoud KM, Kasemy ZA. A comparison of sugammadex and neostigmine for reversal of rocuronium-induced neuromuscular blockade in children. Acta Anaesthesiol Scand. 2017 Apr;61(4):374–80. https://doi.org/10.1111/aas.12868 PMID:28185260
24. Shields M, Giovannelli M, Mirakhur RK, Moppett I, Adams J, Hermens Y. Org 25969 (sugammadex), a selective relaxant binding agent for antagonism of prolonged rocuronium-induced neuromuscular block. Br J Anaesth. 2006 Jan;96(1):36–43. https://doi.org/10.1093/bja/aei314 PMID:16357116
25. Gaver RS, Brenn BR, Gartley A, Donahue BS. Retrospective analysis of the safety and efficacy of sugammadex versus neostigmine for the reversal of neuromusucular blockeade in children. Anesth Analg. 2019 Oct;129(4):1124–9. https://doi.org/10.1213/ANE.0000000000004207 PMID:31584918
26. Ozgün C, Çakan T, Baltic B, Başar H. Comparison of reversal and adverse effects of sugammadex and combination of – Anticholinergic-Anticholinesterase agents in pediatric patients. J Res Med Sci. 2014 Aug;19(8):762–8. PMID:25422663
27. Abrishami A, Ho J, Wong J, Yin L, Chung F. Sugammadex, a selective reversal medication for preventing postoperative residual neuromuscular blockade. Cochrane Database Syst Rev. 2009. 7(4):CD007362:1-42. https://doi.org/10.1002/14651858.CD007362.pub2.
28. Lyu Q, Ye P, Zhang H, Ye X, Zheng Y, Xu J, et al. Safety of sugammadex for reversal of neuromuscular block: A postmarketing study based on the World Health Organization pharmacovigilance database. Br J Clin Pharmacol. 2023 Feb;89(2):449–57. https://doi.org/10.1111/bcp.15417 PMID:35607986
29. Grześkowiak M, Bienert A, Wiczling P, Malec M, Grzelak J, Jarosz K, et al. Jarosz K y cols. Population Pharmacokinetic-Pharmacodynamic modeling and propability of target attainment analysis of rocuronium and sugammadex in children undergoing surgery. Eur J Drug Metab Pharmacokinet. 2023 Jan;48(1):101–14. https://doi.org/10.1007/s13318-022-00809-1 PMID:36477706

 ORCID
ORCID