Ricardo Fuentealba Ramírez1,2,3, María Jesús Alvarado Darritchon3,4, Valeria Machuca Medina3,5, Isidora Moreno Fonseca4, Camila Riquelme Bahamondes3,6
Recibido: 20-04-2025
Aceptado: 22-06-2025
©2026 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 55 Núm. 1 pp. 106-118|https://doi.org/10.25237/revchilanestv55n1-16
PDF|ePub|RIS
Use of lipid emulsion for the treatment of organophosphate poisoning. Integrative mixed review (Narrative-Systematic)
Abstract
Organophosphate poisoning represents a public health issue, particularly in countries with agricultural industries. Lipid emulsions (LEs) have emerged as a new therapeutic alternative for managing these poisonings due to their multiple mechanisms of action. This study aims to systematize the evidence in the literature regarding the efficacy and safety of using lipid emulsions as an adjunct therapy in cases of organophosphate poisoning. A mixed integrative review (systematic and narrative) was conducted, including articles published from 2013 until January 16, 2025. The systematic review was performed following the guidelines of the Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA), utilizing keywords related to organophosphate poisoning and lipid emulsion. The results indicate that the evidence is scarce, variable and emerging, but clinical improvements are highlighted in the majority of documented cases, as well as benefits in animal experimental models, such as reduced liver damage and improved prognosis, or, alternatively, no significant alteration, without worsening the course of the intoxication. The findings are promising, but the limited clinical evidence available highlights the need for further research to evaluate efficacy, optimal dosage, and safety. This therapeutic approach could offer an alternative in managing these poisonings, but its implementation requires a more robust scientific evidence base.
Resumen
La intoxicación por organofosforados representa un problema de salud pública, especialmente en países con industrias agrícolas. Las emulsiones lipídicas (EL) han emergido como una nueva alternativa terapéutica para manejar estas intoxicaciones debido a sus múltiples mecanismos de acción. En este trabajo, se sistematiza la evidencia en literatura referente a la eficacia y seguridad del uso de emulsiones lipídicas como terapia adyuvante en casos de intoxicación por organofosforados. Se realizó revisión mixta integrativa (sistèmica y narrativa), contemplando artículos desde el año 2013 hasta el 29 de noviembre del año 2024, Con respecto a la revisión sistemática se llevó a cabo siguiendo las normas de los Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA), ocupando palabras claves referentes a intoxicación por organofosforados y emulsión lipídica. Los resultados indican que la evidencia es escasa ,variable e incipiente, pero se destaca mejoras clínicas en la mayoría de los casos documentados y beneficios en modelos experimentales en animales, como reducción de daño hepático y mejor pronóstico, o bien, no presenta alteración significativa, sin empeorar el curso de la intoxicación. Los hallazgos son prometedores, la limitada evidencia clínica disponible remarca la necesidad de más investigaciones que evalúen su eficacia, dosis óptima y seguridad. Este enfoque terapéutico podría ofrecer una alternativa en el manejo de estas intoxicaciones, pero su implementación requiere una mayor base de evidencia científica.
-
Introducción
Durante el siglo pasado, en los años sesenta, la emulsión lipídica (EL) se utilizó principalmente, para soporte nutricional parenteral en pacientes en estado crítico[1]. Sin embargo, un avance significativo ocurrió en 1998, cuando Weinberg demostró por primera vez su eficacia en la reanimación cardiovascular avanzada en casos de colapso circulatorio causado por sobredosis de bupivacaína en roedores bajo condiciones experimentales[2]. Más tarde, ya en el siglo 21, Rosenblatt, reportó los primeros casos de éxito en humanos con paro cardiorrespiratorio debido a intoxicación con anestésicos locales[3].
Además de su uso en reanimación cardiovascular, la EL se ha utilizado como un transportador eficaz de fármacos li- posolubles, siendo útil para la administración de medicamentos como propofol, etomidato, diazepam y anfotericina B. En tiempos recientes, también se está explorando su aplicación en sistemas de administración más eficientes y específicos para la terapia del cáncer[4].
Cuando nos enfocamos en el tratamiento de intoxicaciones medicamentosas, este se basa en el soporte orgánico para mantener la función metabólica y facilitar la eliminación del tóxico. La descontaminación gastrointestinal puede ayudar a reducir la absorción si se realiza tempranamente, aunque su efectividad disminuye considerablemente si se hace después de 2 h de la ingesta. Las técnicas extracorpóreas, como la terapia de reemplazo renal, muestran resultados inciertos, especialmente con fármacos o toxinas que tienen un gran volumen de distribución y alta afinidad por las proteínas plasmáticas. Esto destaca la necesidad de un antídoto o reversor, que pueda mejorar la supervivencia y los resultados en pacientes expuestos a dosis letales de toxinas, independientemente del mecanismo de acción o la familia farmacológica, además, que tenga un perfil de seguridad aceptable y disponibilidad en servicios de urgencia y cuidados críticos[4].
Otro uso, aparte de las intoxicaciones por fármacos, ocurre en países que la agricultura tiene un rol importante en el desarrollo económico, en donde se presentan intoxicaciones por plaguicidas de la familia de los organofosforados, con importantes efectos a nivel fisiológico, especialmente de tipo colinér- gico, siendo el manejo solo sintomático y de sostén vital.
Los expertos estiman que las intoxicaciones con estos pesticidas causan más muertes al compararse con otras clases de drogas o químicos, estimándose una tasa de letalidad del 10% al 20%, y aquellos pacientes sobrevivientes presentan una morbilidad de difícil manejo[5].
El objetivo de esta revisión mixta narrativa – sistemática, es agrupar la escasa evidencia que describa el uso de emulsión lipídica para tratamiento de intoxicación por organofosforados y así poder disponer de una herramienta terapéutica más en el manejo de estos pacientes.
-
Fundamento del tratamiento con emulsión lipídica
Las emulsiones lipídicas están compuestas por pequeñas gotitas estériles (entre 200 y 600 nm) de aceites en agua, estabilizadas por un emulsionante para separar la fase lipídica interna de la fase acuosa externa. Estas emulsiones tienen un pH entre 6,9 y 9,0 y una osmolalidad de aproximadamente 270-350 mOsm/kg[4]. Su composición incluye aceites con triglicéridos, un emulsionante fosfolipídico y glicerina. La emulsión de aceite de soja puro, la primera disponible comercialmente, sigue siendo la fuente predominante de lípidos en nutrición parenteral. También, existen emulsiones lipídicas mixtas que combinan aceite de soja, triglicéridos de cadena media, aceite de oliva y aceite de pescado, además de emulsiones puras de aceite de pescado, como la SMOFlipid® 20%, que se ha utilizado en el tratamiento de intoxicaciones medicamentosas[6].
El emulsionante comúnmente utilizado es un fosfolípido de yema de huevo al 1%, que asegura la estabilidad de la fase lipídica mediante la creación de una barrera electromecánica. Esta interfaz aceite – agua, cargada negativamente, provoca una repulsión electrostática entre las gotitas de aceite dispersas, evitando su coalescencia y el aumento de tamaño[7].
Cuando se administra por vía intravenosa, la emulsión lipídica forma una fase lipídica expandida en la sangre. La incorporación de sustancias lipofílicas, como anestésicos locales u otra familia de fármacos, dentro de esta fase lipídica, reduce su concentración en plasma, lo que crea una diferencia gradual en la concentración entre los tejidos objetivo y la fase acuosa plasmática. Esto resulta en la redistribución de la sustancia hacia el plasma y, eventualmente, hacia la fase lipídica plasmática, lo que constituye el fenómeno conocido como “sumidero lipídico”. Este es el mecanismo clave, para su uso como antídoto en casos de toxicidad farmacológica[8].
-
Intoxicación por organofosforados
A diferencia de los fármacos lipofílicos, los organofosfora- dos (OF), que se encuentran en pesticidas y productos químicos y agropecuarios, tienen propiedades químicas distintas y podrían no responder de la misma manera a la emulsión lipídica. En América Latina, donde los organofosforados son comunes debido a su uso extendido en la agricultura, es crucial investigar si la EL puede ser efectiva en el tratamiento de intoxicaciones por estos compuestos y ajustar los tratamientos según las características y prevalencia propia de cada región.
Los organofosforados, tales como el malation o paration, tienen acción colinérgica indirecta, es decir, actúa sobre la acetilcolinesterasa (ACh-E) inhibiendo su acción (hidrólisis de la ACh en colina y acetato), y, en consecuencia, aumentando la concentración de ACh en el espacio presináptico. Los OF fosforilan la ACh-E, provocando una unión covalente, la cual es irreversible tras 12 h de formada la unión.
El aumento de ACh en el espacio presináptico provocará diferentes efectos dependiendo del receptor estimulado y el órgano. Al estimular el receptor muscarínico habrá miosis, visión borrosa, sialorrea, broncorrea, bradicardia sinusal, náuseas, vómitos, entre otros. Por otra parte, al estimular el receptor nicotínico, habrá fasciculaciones, debilidad muscular, parálisis completa (incluyendo el diafragma), taquicardia, hipertensión arterial. Es decir, genera una activación colinérgica generalizada. En la Tabla 1 se presentan los diferentes efectos colinérgicos de los organofosforados[9].
Actualmente, el manejo para la intoxicación con organofosforados es atropina y pralidoxima (2-PAM). La administración endovenosa de la atropina tiene el fin de evitar efectos muy marcados producto del aumento brusco de acetilcolina, por lo tanto, corresponde a un tratamiento sintomático. Por otro lado, la administración endovenosa de pralidoxima compite con el OF, con el objetivo de reactivar la acción de la ACh-E. Sin embargo, la acción de este último se encuentra limitado a las primeras 12 h de ocurrida la intoxicación, después de esto, su acción baja considerablemente y la unión OF – ACh-E es irreversible[9].
Tabla 1. Efectos colinérgicos de los organofosforados. Se presentan los principales efectos colinérgicos indirectos del grupo organofosforados
Esta revisión mixta integrativa sistematiza la información disponible sobre la emulsión lipídica y sus aplicaciones en toxicología de los organofosforados, haciendo énfasis en la importancia de explorar su eficacia en el tratamiento de esta intoxicación específica.
-
Farmacología de la acción de la EL[7]
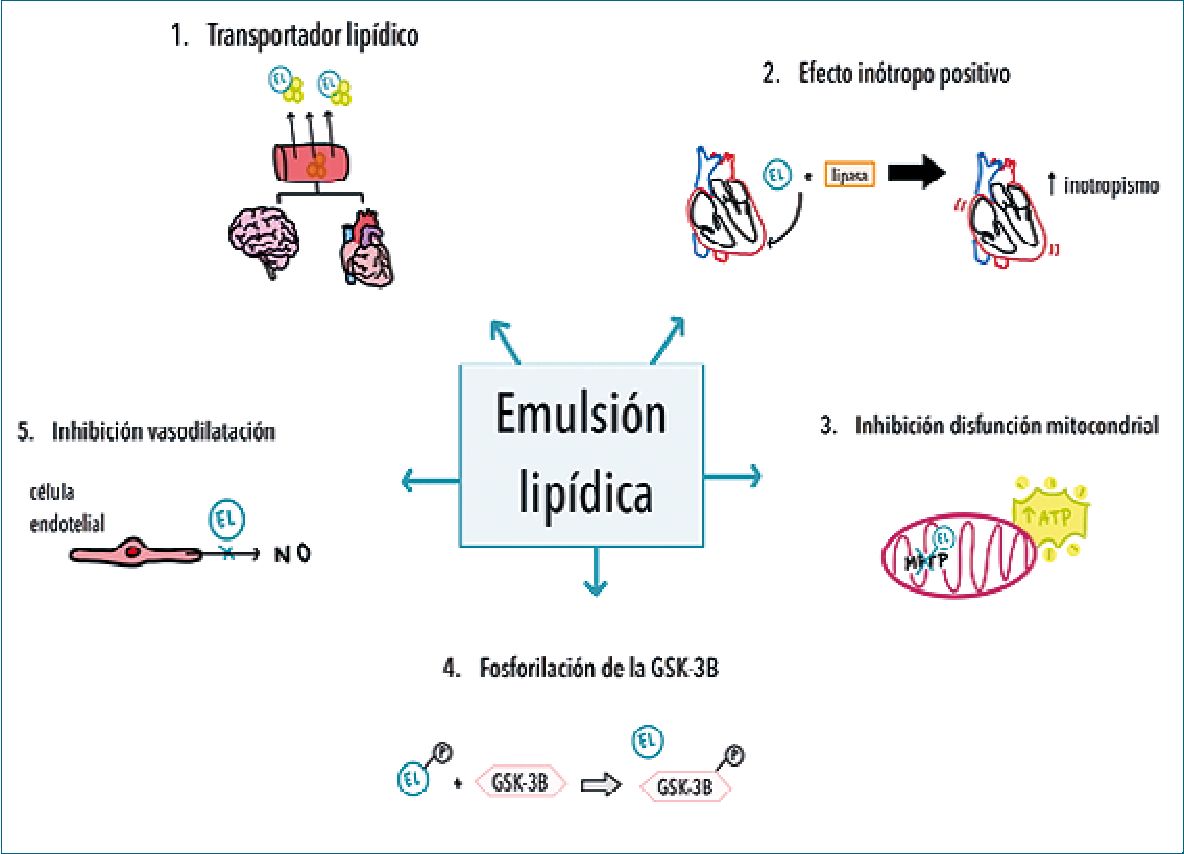
Los mecanismos responsables de la desintoxicación basada en EL, siguen siendo controvertidos, se han postulado mecanismos tanto de PK (farmacocinética) como de PD (farmacodinamia) para explicar la posible acción de la EL; sin embargo, la contribución relativa de cada mecanismo sigue siendo incierta y aún en proceso de estudio farmacológico. Aunque la evidencia es aún incierta, es altamente probable que su acción se explique por una hipotética sinergia multimodal entre los mecanismos propuestos. Dependiendo del fármaco o toxina, de las condiciones del paciente y del retraso en el inicio, estos mecanismos pueden contribuir de forma variable a la mejoría clínicamente observada. Se han hipotetizado cinco mecanismos:
-
EL como transportador lipídico
Como se mencionó anteriormente, la EL genera una fase lipídica que tiene la capacidad de captar fármacos según su grado de liposolubilidad. A través de este mecanismo, la EL capta estas moléculas lipofílicas desde los órganos con mayor flujo sanguíneo, y en consecuencia reduce su concentración plasmática y aumenta la redistribución de estas moléculas a los órganos almacenadores y detoxificadores. French y cols., describieron que el efecto en la reducción de la concentración de un fármaco o droga depende principalmente de su liposolubilidad (Log P 75%) y parcialmente de su volumen de distribución. Ambas características permiten predecir la eficacia clínica de la EL para revertir la toxicidad.[4],[10],[11],[12].
-
Efecto inotropo positivo de la EL
Desde que se estableció que los lípidos son la fuente principal de energía para los cardiomiocitos, se ha investigado su rol en el metabolismo del corazón, descubriendo sus efectos cardioprotectores y la capacidad de inducir hipertrofia cardíaca. Sin embargo, su efecto en variables hemodinámicas, era desconocido hasta que Fettilace y cols., en 2013, publicaron sobre los efectos hemodinámicos agudos de la EL para revertir la toxicidad cardíaca inducida por fármacos[13]. Dentro de sus principales hallazgos, se demostró aumento en el flujo sanguíneo aórtico, presión sistólica y efectos cardiotónicos positivos.
| Sistema | Efecto | |
| Digestivo | Aumento de la motilidad intestinal, náuseas, vómitos, diarrea, cólico intestinal, incontinencia fecal | |
| Respiratorio | Broncorrea, broncoconstricción, tos, disnea | |
| Receptor muscarínico | Cardiovascular | Bradicardia sinusal, hipotensión |
| Urinario | Incontinencia urinaria | |
| Glándulas | Hiperhidrosis (sudoración excesiva), sialorrea (hipersecreción salival), lagrimeo | |
| Ojos | Miosis (pupilas contraídas), visión borrosa, lagrimeo | |
| Receptor nicotínico | Autónomo | Hipertensión, taquicardia (por estimulación simpática inicial) |
| Muscular esquelético | Fasciculaciones, debilidad muscular, parálisis completa (incluyendo músculos respiratorios) | |
| SNC | Cefalea, confusión, ansiedad, agitación, convulsiones, coma |
Estos efectos se explican por la interacción que se genera entre las gotas de lípidos de la EL y la lipasa endotelial que genera ácidos grasos libres en plasma. Estos actúan como un sustrato metabólico adicional para la fosforilación oxidativa del músculo cardíaco lo que se traduce en efectos inotrópicos y lusitrópicos positivos. Una característica particularmente relevante es la rapidez con la que se producen estos efectos y, por lo tanto, la reversión de los efectos cardiotóxicos de las intoxi- caciones[4],[12].
-
Inhibición de la disfunción mitocondrial
La EL mejora la función mitocondrial a través de dos vías principales. Por un lado, contrarresta la inhibición de la carnitina-acilcarnitina translocasa, causada por la intoxicación con bupivacaína y, por otro lado, inhibe la producción de especies reactivas de oxígeno. Además, aporta y previene la oxidación de ácidos grasos, inhibe la apertura del poro de transición mitocondrial (MPTP) y produce ATP. De esta forma, la EL ofrece una protección significativa contra los efectos cardíacos de las dosis tóxicas de los anestésicos locales y otros fármacos como la cloroquina, propranolol, entre otros[4],[11].
-
Fosforilación de la GSK-3B
La EL produce la fosforilación de la glucógeno sintasa qui- nasa-3B que permite la inhibición de la apertura del MPTP y, de esta forma, disminuye la apoptosis del músculo cardíaco. Asimismo, protege contra las lesiones secundarias a isquemia-re- perfusión por las vías mediadas por el fosfoinositol-3 kinasa, Akt y la propia GSK-3B, las cuales son particularmente importantes en la cardiotoxicidad de algunos fármacos, como amlodipino, verapamilo, bupivacaína, doxorrubicina, entre otros[4],[11].
-
Inhibición de la vasodilatación inducida por NO
La EL disminuye la liberación de NO, lo cual tiene un efecto vasoconstrictor que se traduce en un aumento de la PA y resistencia vascular. Este efecto es particularmente importante en la macrohemodinamia de un paciente durante una intoxicación medicamentosa y potencialmente por organofosforados[4],[10].
En la Figura 1 se presenta un esquema de los cinco principales mecanismos mediante los cuales la EL tiene un efecto detoxificador.
Dado estos múltiples mecanismos de acción, la emulsión lipídica podría ser beneficiosa en el tratamiento de la intoxicación por organofosforados. A través de la extracción de toxinas lipofílicas, la modulación de la inflamación, la protección cardíaca y mitocondrial, así como el control de convulsiones, la EL se perfila como un candidato prometedor para el manejo de estas intoxicaciones. Sin embargo, se necesita más investigación para optimizar su uso y comprender completamente sus mecanismos en el contexto de los OP[8].
Figura 1. Mecanismos de acción de la resucitación lipídica.
-
Metodología
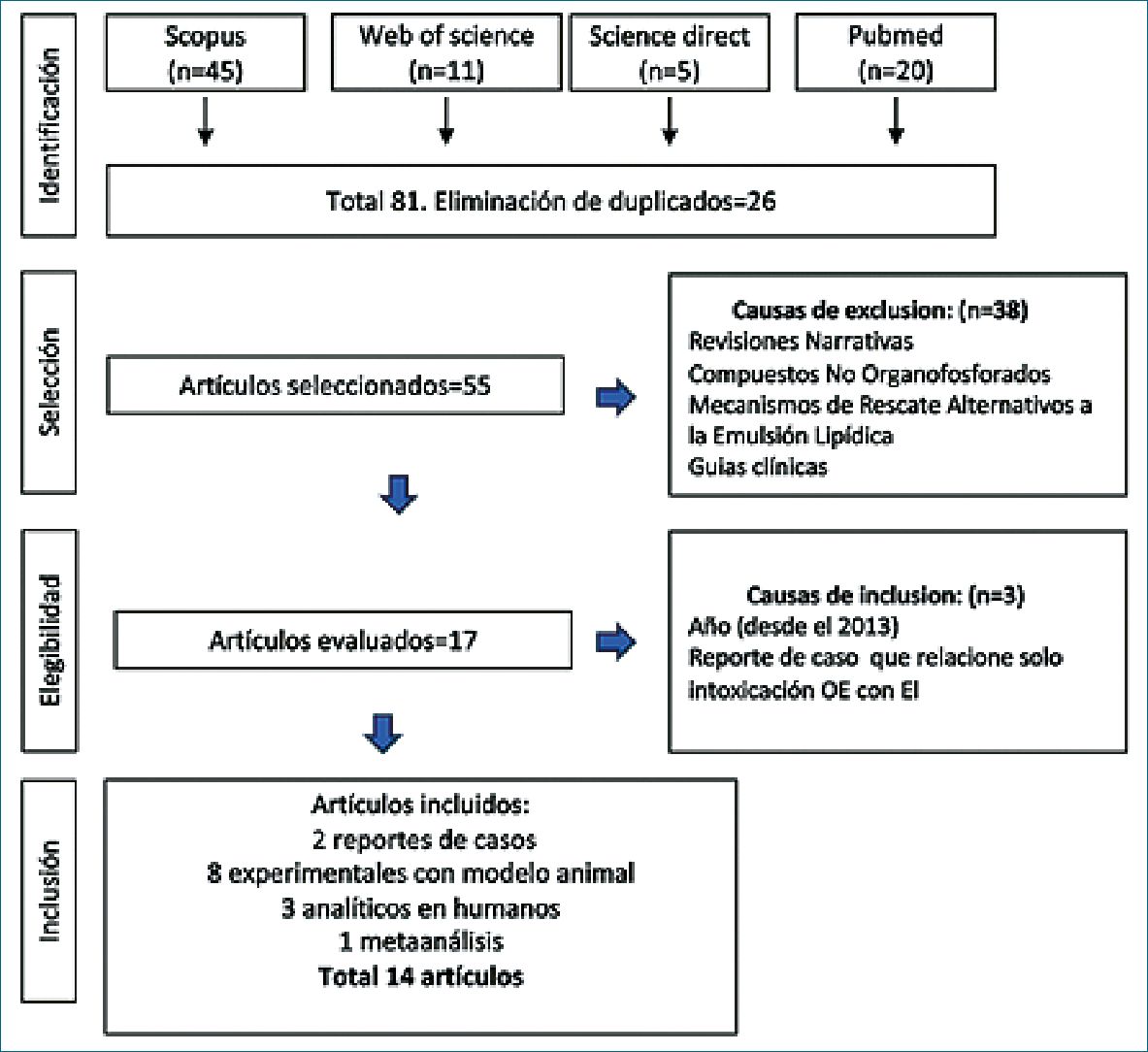
Para esta revisión mixta integrativa, se realizó una búsqueda exhaustiva en diversas bases de datos utilizando términos específicos relacionados con emulsión lipídica e intoxicación por organofosforados. La recolección de datos se llevó a cabo entre el 1 y el 29 de noviembre de 2024. A continuación, se detallan los métodos utilizados.
Se desarrollaron estrategias de búsqueda adaptadas a cada base de datos, combinando términos clave relacionados con los temas de interés. La búsqueda se limitó a artículos disponibles hasta el 29 de noviembre de 2024. Los resultados obtenidos se documentaron en la Tabla 2, que incluye los términos utilizados en cada plataforma. Posteriormente, se exportaron los resultados a RAYYAN, una plataforma de gestión de referencias.
El proceso de selección de estudios se llevó a cabo siguiendo las directrices de la normativa PRISMA 4.0. Sin embargo, se observó una disponibilidad limitada de artículos analíticos y exploratorios. Como criterios de inclusión, se decidieron considerar estudios cuantitativos y cualitativos, que incluyeron reportes de casos y una revisión sistemática que se consideró relevante para el objetivo del estudio. Se excluyeron las revisiones narrativas.
Se eliminan las duplicaciones encontradas, y se evaluó la relevancia y contribución de los estudios seleccionados al tema de interés. Se excluyeron los reportes de caso en los que el resultado principal no fuera la emulsión lipídica en la intoxicación por organofosforados (OE) y aquellos publicados antes de 2013 (Figura 2).
Una vez seleccionados los estudios pertinentes, se realizó la extracción de datos siguiendo un formato estandarizado. Esto incluyó información sobre el autor, el año de publicación, los objetivo del estudio, instrumentos, participantes y diseño, y los resultados. La extracción de datos fue realizada de forma independiente por dos revisores, quienes se reunieron posteriormente para discutir y resolver cualquier discrepancia.
Para asegurar la calidad y rigurosidad de la revisión, se imple- mentó un proceso de revisión por pares. Se evaluó el riesgo de sesgo y la calidad metodológica mediante la escala de Newcastle-Ottawa (NOS) para estudios observacionales, las herramientas del NIH para estudios observacionales y pre-post, y la Cochrane RoB2 Tool para ensayos aleatorizados. Solo se consideraron aquellos estudios que mostraron una calidad metodológica de moderada a alta. No se llevó a cabo este análisis en los reportes de caso y en las revisiones sistemáticas. Dos expertos en el tema revisaron la metodología y los resultados de la revisión.
Adicionalmente, para la revisión narrativa, se analizaron artículos que no correspondían a reportes de caso ni a artículos de investigación. Se utilizó como referencia principal un artículo que contenía literatura actualizada, así como libros relevantes seleccionados debido a su uso en la Escuela de Medicina de la Universidad San Sebastián[9],[14].
-
Resultados
Se encontraron 2 artículos de reporte de caso, 3 artículos de diseños analíticos en humanos y 8 en modelos animales (Tabla 9). Según la literatura, el uso de EL en el tratamiento de la intoxicación por OF tuvo resultados positivos tanto en Joson M[15] y Kenan Ahmet Turkdogan[16]. Con respectos a los estudios analíticos humanos, en el estudio de Xie y LI[17] (Tabla 4), se comparó el tratamiento convencional con cloruro de pralidoxima, penehiciclidina y glutatión reducido, con los pacientes tratados con EL al 20% y hemoperfusión, y se obtuvo que la EL tuvo eficacia clínica significativa en la evolución de los pacientes, contrario a lo encontrado por Pannu 2022[18], donde no se encontró diferencia significativa con grupo tratado con EL. Por otro lado, el estudio de Bharath A. Chhabria[19], no encontró diferencias en la mortalidad pero sí en los síntomas respiratorios y en los días de hospitalización a favor de EL en pacientes observados.
El estudio de M. Esen y cols.[20], realizado en ratas concluyó que el uso de EL en la intoxicación por malatión disminuye el daño hepático. Estos resultados significativamente positivos a favor de la utilidad de emulsión lipídica para intoxicación por organofosforados se repite en Tuzcu Kasim de 2013[21], Kris- hnan[22] y Ozso[23]. Por otro lado, Celike[24], obtuvo que el uso Emulsion Lipidica no disminuye mortalidad del 100% de las ratas intoxicadas con OE, lo que coincide con los estudios de Tas U[25], y Moshiri[26], en modelos animales, los cuales no encontraron diferencias significativas en los grupos que recibieron EL. En el caso de Basarslan[27], se encontró que en algunas de las condiciones estudiadas la EL tuvo beneficios por sobre el grupo control.
Tabla 2. Estrategia de búsqueda y descriptores utilizados para análisis cuantitativo
| Base de datos | Estrategia de búsqueda | Resultados |
| SCOPUS | TITLE-ABS-KEY ((“organophosphate” OR “organophosphorus compounds” OR “malathion” OR “chlorpyrifos” OR “parathion” OR “diazinon” OR “acephate” OR “pesticides”) AND (“lipid emulsion” OR “lipid emulsions” OR “oily emulsions” OR “lipid solutions” OR “lipid dispersions”)) AND (EXCLUDE (DOCTYPE, “le”) OR EXCLUDE (DOCTYPE , “ch”) OR EXCLUDE (DOCTYPE , “er”) OR EXCLUDE (DOCTYPE, “re”)) | 45 |
| Web of Science | (“organophosphate” OR “organophosphorus compounds” OR “malathion” OR “chlorpyrifos” OR “parathion” OR “diazinon” OR “acephate” OR “pesticides”) AND (“lipid emulsion” OR “lipid emulsions” OR “oily emulsions” OR “lipid solutions” OR “lipid dispersions”) | 11 |
| Science Direct | (“organophosphate” OR “organophosphorus compounds” OR “malathion” OR “chlorpyrifos” OR “parathion” OR “diazinon” OR “acephate” OR “pesticides”) AND (“lipid emulsion”) | 5 |
| PuBMed | (“organophosphate” OR “organophosphorus compounds” OR “malathion” OR “chlorpyrifos” OR “parathion” OR “diazinon” OR “acephate” OR “pesticides”) AND (“lipid emulsion” ) Filters: Abstract((“organophosphate”[All Fields] OR “organophosphorus compounds”[All Fields] OR “malathion”[All Fields] OR “chlorpyrifos”[All Fields] OR “parathion”[All Fields] OR “diazinon”[All Fields] OR “acephate”[All Fields] OR “pesticides”[All Fields]) AND “lipid emulsion”[All Fields]) AND (fha[Filter]) | 20 |
Figura 2. Diagrama de flujo de la revisión sistemática.
Tabla 3. Sistematización reporte de casos (Estudios cualitativos)
| Autor, año, país | Edad (años), Sexo | Ingreso | Síntomas principales | Tratamiento | Resultado | Diagnóstico final | Complicaciones |
| Joson, M., (Filipinas, 2022) | 3, F | Deterioro rápido del estado clínico minutos después de ingerir un líquido de color naranja contenido en una botella de gaseosa (H o m eTre k, clorpirifos) | Pupilas mióticas, secreciones orales abundantes, crepitaciones en la auscultación pulmonar, ruidos intestinales hiperactivos, signos inminentes de insuficiencia respiratoria, deterioro sensorial | Reanimación, administración de atropina, emulsión lipídica intravenosa al 20% | Resultado favorable, alta después de 11 días. Niveles de colinesterasa en glóbulos rojos 4 5 % y 17 % por debajo de lo normal, medidos el día 10 y el día 35 después de la ingestión, respectivamente | Toxicidad grave por organofosforados (OP) | Toxicidad por atropina. No mostró signos de síndrome intermedio ni de polineuropatía tardía |
| Kenan Ahmet Turkdogan, 2017 | 18, M | Referido al hospital estatal del distrito 30 min después de la autoadministración intravenosa de 2 ml de monocrotofos (Hukron) para cometer suicidio. Llegó al hospital en la segunda hora post administración | P A 13 0/110 mmHg, pulso de 80/min, frecuencia respiratoria de 23 rpm, GKS de 1 5, hiperhidrosis, salivación aumentada, miosis en las pupilas, rales en la región basal pulmonar | UCI emergencia, atropina 2 mg IV push seguido de 12 mg/h en infusión IV, emulsión lipídica (Clinoleic 20%) 75 ml IV inicial seguido de 80 ml/h en infusión continua, plasmaféresis iniciada en la sexta hora (segunda sesión en la hora 17), seguimiento de colinesterasa sérica, EMG en el día 8 | Alta al noveno día de seguimiento, sin quejas o hallazgos en el examen, niveles de colinesterasa: 344 unidades (referencia 5.000-9.000 unidades) en la 10a h, 1.045 unidades en el sexto día, 6.448 unidades en el día 14 | Toxicidad grave por organofosforados (OP) | Aumento de amilasa (184218 U/L) y lipasa en el cuarto día de seguimiento en cuidados intensivos |
-
Discusión
La intoxicación por organofosforados representa un grave problema de salud pública debido a sus efectos adversos y potencialmente mortales. Mundialmente se estima que tres millones de personas están expuestas anualmente a estas sustancias, de las cuales un millón por causas accidentales y dos millones por envenenamiento suicida con un aproximado de trescientas mil muertes. En Estados Unidos, se reportaron ocho mil exposiciones y de estos quince fallecimientos. En la India, se reportaron veinte cinco mil doscientos ochenta y ocho casos de muertes por suicidio por su utilización. Asimismo, la Organización Mundial de la Salud (OMS) reporta anualmente veinte seis millones muertes en países del sudeste asiático, China y el pacífico occidental[5]. En este contexto, las emulsiones lipídicas (EL) han emergido como una estrategia terapéutica atractiva en el manejo de estas intoxicaciones.
Reportes de casos como los de Joson et al.[15] y Turkdogan[16], proporcionan evidencia clínica de la eficacia de la EL, mostrando que su administración mejora los parámetros clínicos y reduce la mortalidad asociada a la intoxicación.
En esta revisión se identificaron solo tres estudios analíticos; entre ellos, los realizados por Xie y Lie[17] y Chabria[19] encontraron evidencia favorable respecto al uso de la EL en la intoxicación por organofosforados (OE). Además, se destaca una revisión sistemática y un metaanálisis realizados en China[28], que también sistematiza información favorable al uso de EL. Por lo tanto, se recalca la necesidad de realizar más estudios clínicos controlados, que evalúen diferentes dosis y combinaciones de tratamientos. Asimismo, es importante investigar la interacción de las emulsiones lipídicas con otras terapias habituales, como la pralidoxima y la atropina, con el fin de comprender mejor su papel en la gestión de la toxicidad por organofosforados. El objetivo de esta búsqueda no era establecer recomendaciones específicas sobre la dosis de emulsión lipídica (EL) para la intoxicación por organofosforados (OE); por lo tanto, se sugiere utilizar las dosis publicadas en la literatura. Un estudio publicado en 2024[14], propone emplear dosis similares a las utilizadas en intoxicaciones por anestésicos locales, sugiriendo seguir los mismos esquemas de tratamiento. Actualmente, la Sociedad Americana de Anestesia Regional y Medicina del Dolor (ASRA) recomienda una dosis inicial de 1,5 ml/kg en bolo intravenoso, seguida de una infusión rápida a 0,25 ml/kg/min durante 3 minutos, y luego una infusión lenta a 0,025 ml/kg/min durante 6-12 h de emulsión lipídica al 20% en pacientes hemodinámicamente inestables. Se considera como dosis máxima 3 g/ kg/24h en pacientes pediátricos y 2,5 g/kg/24h en adultos. Por su parte, las guías del European Resuscitation Council (ERC) del año 2015 sugieren iniciar con 1,5 ml/kg por vía intravenosa durante 1 minuto, seguido de una infusión continua de 15 ml/ kg/h. En caso de que persista el colapso cardiovascular, se recomienda repetir el bolo dos veces más con intervalos de 5 minutos, manteniendo la infusión continua hasta la recuperación hemodinámica o hasta alcanzar la dosis máxima de 12 ml/kg. El resto de la reanimación debe seguir los lineamientos del Soporte Vital Avanzado (ACLS). Es relevante tener en cuenta que el uso de EL puede alterar la vida media de otras drogas lipofílicas utilizadas durante la reanimación, requiriendo el paciente monitorización estrecha en una unidad de paciente crítico por un equipo multidisciplinario.
Con respecto a lo anterior y debido a la poca evidencia clínica, se decidió contemplar los estudios realizados en modelos animales[20]-[27] que han demostrado, en su mayoría, beneficios en el uso de emulsiones lipídicas, lo que sugiere que esta terapia puede ofrecer ventajas potenciales, especialmente en pacientes con perfiles desfavorables que podrían no responder adecuadamente a los tratamientos convencionales.
-
Conclusiones
La intoxicación por organofosforados es un problema de salud significativo, particularmente en países de industria agropecuaria, y la búsqueda de tratamientos efectivos es crucial para mejorar los resultados en pacientes afectados. El uso de emulsiones lipídicas, en este escenario, aparece como una terapia de rescate prometedora, pero de evidencia incipiente por la limitada experiencia clínica, aun cuando su sustento fisiopatológico respalda su aplicación.
A pesar de los efectos favorables observados en estudios experimentales en animales y reporte de casos, es fundamental continuar la investigación y la recopilación de datos clínicos que fortalezcan la base de evidencia sobre la eficacia y seguridad de las emulsiones lipídicas en este contexto. La falta de estudios clínicos robustos limita el conocimiento, difusión y uso de esta terapia de manera generalizada.
Se invita a reportar experiencias y resultados en el uso de emulsiones lipídicas para la intoxicación por organofosforados. Este intercambio de información no solo contribuirá a una mejor comprensión de la terapia, sino que también facilitará la optimización de su uso en situaciones críticas, mejorando así los resultados clínicos para los pacientes afectados.
En conclusión, las emulsiones lipídicas se perfilan como un enfoque terapéutico innovador en la intoxicación por organofosforados, con múltiples mecanismos de acción que pueden mejorar significativamente los resultados clínicos, sin embargo, no reemplaza la terapia tradicional.
-
Referencisas
1. Vanek VW, Seidner DL, Allen P, Bistrian B, Collier S, Gura K, et al.; Novel Nutrient Task Force, Intravenous Fat Emulsions Workgroup; American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.) Board of Directors. A.S.P.E.N. position paper: clinical role for alternative intravenous fat emulsions. Nutr Clin Pract. 2012 Apr;27(2):150–92. https://doi.org/10.1177/0884533612439896 PMID:22378798
2. Weinberg GL, VadeBoncouer T, Ramaraju GA, Garcia-Amaro MF, Cwik MJ. Pretreatment or resuscitation with a lipid infusion shifts the dose-response to bupivacaine-induced asystole in rats. Anesthesiology. 1998 Apr;88(4):1071–5. https://doi. org/https://doi.org/10.1097/00000542-199804000-00028. PMID:9579517 229 Artículo de Revisión
3. Rosenblatt MA, Abel M, Fischer GW, Itzkovich CJ, Eisenkraft JB. Successful use of a 20% lipid emulsion to resuscitate a patient after a presumed bupivacaine-related cardiac arrest. Anesthesiology. 2006 Jul;105(1):217–8. https://doi.org/10.1097/00000542-200607000-00033 PMID:16810015
4. Jaffal K, Chevillard L, Mégarbane B. Lipid emulsion to treat acute poisonings: mechanisms of action, indications, and controversies. Pharmaceutics. 2023 May;15(5):1396. https://doi.org/10.3390/pharmaceutics15051396PMID:37242638
5. Saborío Cervantes IE, Mora Valverde M, Durán Monge MD. (2019). Intoxicación por organofosforados. Medicina Legal de Costa Rica, 36(1), 110-117. Available from:<http://www.scielo.sa.cr/scielo.php?script=sci_arttext&pid=S1409-00152019000100110&lng=en&nrm=iso>. ISSN 2215-5287.
6. Fell GL, Nandivada P, Gura KM, Puder M. Intravenous lipid emulsions in parenteral nutrition. Adv Nutr. 2015 Sep;6(5):600–10. https://doi.org/10.3945/an.115.009084 PMID:26374182
7. Mirtallo JM, Dasta JF, Kleinschmidt KC, Varon J. State of the art review: Intravenous fat emulsions: Current applications, safety profile, and clinical implications. Ann Pharmacother. 2010 Apr;44(4):688–700. https://doi.org/10.1345/aph.1M626 PMID:20332339
8. Tampakis K, Vogiatzakis N, Kontogiannis C, Spartalis M, Ntalianis A, Spartalis E, et al. Intravenous lipid emulsion as an antidote in clinical toxicology: a systematic review. Eur Rev Med Pharmacol Sci. 2020 Jun;24(12):7138–48. https://doi.org/10.26355/eurrev_202006_21708 PMID:32633409
9. Empendium. (2024/25). Síndrome colinérgico, agudo. Empendium. Consultado el 31 de diciembre de 2024, de https://empendium.com/manualmibe/compendio/chapter/B34.II.20.12.#google_vignett
10. Lee SH, Kim S, Sohn JT. Lipid emulsion treatment for drug toxicity caused by nonlocal anesthetic drugs in pediatric patients. Pediatr Emerg Care. 2023 Jan;39(1):53–9. https://doi.org/10.1097/PEC.0000000000002828 PMID:35981328
11. Cave G, Harvey M. Intravenous lipid emulsion as antidote beyond local anesthetic toxicity: a systematic review. Acad Emerg Med. 2009 Sep;16(9):815–24. https://doi.org/10.1111/j.1553-2712.2009.00499.x PMID:19845549
12. Fettiplace MR, Ripper R, Lis K, Lin B, Lang J, Zider B, et al. Rapid cardiotonic effects of lipid emulsion infusion. Crit Care Med. 2013 Aug;41(8):e156–62. https://doi.org/10.1097/CCM.0b013e318287f874 PMID:23531591
13. Neal JM, Barrington MJ, Fettiplace MR, Gitman M, Memtsoudis SG, Mörwald EE, et al. The Third American Society of Regional Anesthesia and Pain Medicine Practice Advisory on Local Anesthetic Systemic Toxicity: executive Summary 2017. Reg Anesth Pain Med. 2018 Feb;43(2):113–23. https://doi.org/10.1097/AAP.0000000000000720 PMID:29356773
14. Fuentealba RF, Bravo L, Toledo CT, López SG. Uso de emulsión lipídica para tratamiento de intoxicación por fármacos lipofílicos, no anestésicos locales. De la teoría a la práctica. Rev. Chil. Anest. 2024;53(3):224–9. https://doi.org/10.25237/revchilanestv53n3-04.
15. Joson MV, Castor FR, Micu-Oblefias CV. Role of intravenous lipid emulsion therapy and packed red blood cell transfusion as adjuvant treatment in the management of a child with severe organophosphate poisoning (chlorpyrifos). BMJ Case Rep. 2022 Apr;15(4):e246381. https://doi.org/10.1136/bcr-2021-246381 PMID:35396244
16. Turkdogan KA, Duman A, Avcil M, Akoz A, Canakcı SE, Kantekin B. Treatment methods following suicidal self-administration of IV organophosphate: What can additional lipid administration change?The American Journal of Emergency Medicine,Volume 35, Issue 9,2017,Pages 1388.e3-1388.e5,ISSN 0735-6757,https://doi.org/10.1016/j.ajem.2017.06.058..(https://www.sciencedirect.com/science/article/pii/S0735675717305508)
17. Xie Jq, Li W. Clinical efficacy of hemoperfusion combined with 20% lipid emulsion in the treatment of organophosphorus pesticide poisoning. Acta Med Mediter. 2021;37(3):1869–74. Available from: https://www.cabidigitallibrary.org/doi/full/10.5555/20230505988
18. Pannu AK, Garg S, Bhalla A, Dhibar DP, Sharma N. Lipid emulsion for the treatment of acute organophosphate poisoning: an Open-Label randomized trial. Clin Toxicol (Phila). 2022 May;60(5):602–8. https://doi.org/10.1080/15563650.2021.2013496 PMID:34928182
19. Chhabria BA, Bhalla A, Shafiq N, Kumar S, Dhibar DP, Sharma N. Lipid emulsion for acute organophosphate insecticide poisoning – a pilot observational safety study. Clin Toxicol (Phila). 2019 May;57(5):318–24. https://doi.org/10.1080/15563650.2018.1520997 PMID:30307350
20. Esen, M., & Uysal, M. (2018). Protective effects of intravenous lipid emulsion on malathion-induced hepatotoxicity. Bratislavske lekarske listy, 119(6), 373–378. doiI: https://doi.org/10.4149/BLL_2018_069.
21. Tuzcu K, Alp H, Ozgur T, Karcioglu M, Davarci I, Evliyaoglu O, et al. Oral intralipid emulsion use: a novel therapeutic approach to pancreatic β-cell injury caused by malathion toxicity in rats. Drug Chem Toxicol. 2014 Jul;37(3):261–7. https://doi.org/10.3109/01480545.2013.838780 PMID:24180244
22. Krishnan JK, Moffett JR, Puthillathu N, Johnson EA, Namboodiri AM. Isoflurane-lipid emulsion injection as an anticonvulsant and neuroprotectant treatment for nerve agent exposure. Front Pharmacol. 2024 Oct;15:1466351. https://doi.org/10.3389/fphar.2024.1466351 PMID:39415842
23. Ozsoy AZ, Nursal AF, Karsli MF, Uysal M, Alici O, Butun I, et al. (2016). Protective effect of intravenous lipid emulsion treatment on malathion-induced ovarian toxicity in female rats. European Review for Medical & Pharmacological Sciences, 20(11). PMID: https://pubmed.ncbi.nlm.nih.gov/27338071/
24. Celikel E, Arslan E, Yilmaz F, Unal M, Turhan T, Turhan N, et al. Evaluation of the effect of lipid emulsion therapy on the rat model in organophosphate intoxication and tissue pathologies. Acta Med Mediter. 2014;30(6).
25. Tas U, Ayan M, Dogru S, Sogut E, et al. Effect of Intravenous Lipid Emulsion Therapy on Serum Pseudocholinesterase in Experimental Model of Diazinon Intoxication. Eur J Gen Med. 2014;11(4): https://doi.org/10.15197/sabad.1.11.84.
26. Moshiri M, Vahabzadeh M, Etemad L, Hosseinzadeh H. Failure of Intravenous Lipid Emulsion to Reduce Diazinon-induced Acute Toxicity: a Pilot Study in Rats. Iran J Pharm Res. 2013;12(4):897–902. PMID:24523769
27. Basarslan SK, Alp H, Senol S, Evliyaoglu O, Ozkan U. Is intralipid fat emulsion a promising therapeutic strategy on neurotoxicity induced by malathion in rats? Eur Rev Med Pharmacol Sci. 2014;18(4):471–6. PMID:24610612
28. Yu S, Yu S, Zhang L, Gao Y, Walline J, Lu X, et al. Efficacy and outcomes of lipid resuscitation on organophosphate poisoning patients: A systematic review and meta-analysis. Am J Emerg Med. 2019 Sep;37(9):1611–7. https://doi.org/10.1016/j.ajem.2018.11.022 PMID:30527914

 ORCID
ORCID