Ricardo Bustamante B. 1
Rev Chil Anest Vol. 40 Núm. 1 pp. 52-65|doi:
PDF|ePub|RIS
El sugammadex (Bridion®) fue aprobado por el Instituto de Salud Pública el 18 de agosto de 2009 y lleva ya más de un año comercializándose en Chile. Se trata de un oligosacárido cíclico (ciclodextrina), cuyas fuentes naturales se encuentran en los lugares donde hay almidón, bacterias y condiciones ambientales adecuadas, que fue químicamente manipulado hasta llegar a la molécula de sugammadex, una verdadera “rosca”, cuyo orificio interno es la llave de la cerradura de los bloqueadores neuromusculares (BNM) del grupo aminoesteroide 1 ,2 .
A pesar de su eficacia ampliamente demostrada, no ha entrado en el mercado chileno con la fuerza que los anestesiólogos hubiéramos deseado. La razón es una sola: la relación costo/beneficio. El beneficio es grande, pero el costo es muy alto y no parece tan fácil desplazar la ecuación. Los productores han optado por mantener precios internacionales en países donde hay otras necesidades prioritarias en salud.
Esta actitud puede ser comprensible, debido al gran lugar que han ido tomando los fármacos genéricos, con lo que las industrias que desarrollan investigación y nuevas moléculas, no recuperan sus inversiones durante el período de vigencia de las patentes, o no recuperan todo lo que ellas quisieran. Esto produce un enlentecimiento del desarrollo de nuevos agentes.
El Bridion® se presenta en frasco ampollas de 2 y 5 ml, en una solución inyectable de 100 mg/ml. La solución es clara, incolora a ligeramente amarilla, con un pH estabilizado entre 7 y 8 con ácido clorhídrico y/o hidróxido de sodio, con una osmolaridad entre 300 y 500 mOsm/kg. Cada ml contiene 9,7 mg de sodio. En niños puede ser diluido con solución fisiológica a 10 mg/ml, pero también es compatible con soluciones glucosadas, glucosalinas y Ringer lactato 3 .
El sugammadex es una droga innovadora, que con un enfoque farmacológico revolucionario en lo que respecta a la reversión de los bloqueadores neuromusculares no despolarizantes (BNMND), puede incluso llegar a cambiar arraigadas conductas anestésicas, en la medida en que su costo no sea demasiado desproporcionado en relación a sus ventajas.
Farmacocinética
La farmacocinética del sugammadex muestra una relación lineal con dosis entre 0,1-8 mg·kg-1. 4 . Tanto el sugammadex como el rocuronio tienen una cinética tri-compartamental, que puede ser explicada con un modelo que asume que la farmacocinética del sugammadex no conjugado es idéntica a la del complejo sugammadex-rocuronio, y que la formación de complejos tiene lugar sólo en el compartimento central.
Así calculados, el volumen de distribución en estado estacionario del sugammadex es similar al volumen del líquido extracelular: 12 a 15 litros. La vida media de eliminación es de 2,2 horas, mucho mayor que los 20 a 30 minutos de vida media de los anticolinesterásicos. La depuración plasmática es de 90 a 100 ml·min-1. En los ancianos es de 80 ml·min-1, y en los pacientes con deterioro renal de 30 ml·min-1.
El novedoso mecanismo de acción del sugammadex produce una rápida disminución de la concentración de (BNMND) aminoesteroide “libre” en el plasma, pero un aumento de la concentración “total” de BNMND aminoesteroide (libre + encapsulado por el sugammadex) 4 . El complejo encapsulado pasa libremente a través del glomérulo y se elimina por la orina, siendo su depuración plasmática similar a la filtración glomerular.
La principal diferencia entre el perfil farmacocinético del sugammadex y el rocuronio es que la depuración del sugammadex es aproximadamente 3 veces más lenta que la del rocuronio (Figura 1). Esta depuración más lenta, implica que la eliminación del rocuronio está retardada por la administración de sugammadex. En ausencia de sugammadex, el rocuronio se elimina principalmente por la bilis y por las heces, en presencia de sugammadex, sin embargo, la excreción urinaria del complejo sugammadex-rocuronio pasa a ser la principal vía de eliminación del rocuronio 5 .
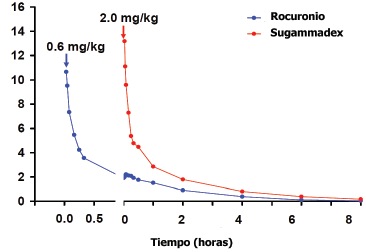
Figura 1 Perfil de las concentraciones plasmáticas (µM) en el tiempo (h) de una dosis de 0,6 mg·kg-1 de rocuronio y de 2 mg·kg-1 de sugammadex después de haber aparecido la segunda respuesta al tren de 4 estímulos.
El sugammadex tiene una muy baja unión a proteínas plasmáticas y un bajo paso por la barrera hematoencefálica (< de 3% en ratas) y placentaria (< de 2-6% en ratas y conejos) 6 . No es metabolizado o es mínimamente metabolizado por el organismo. El 70% es excretado sin cambio por la orina en las 6 primeras horas después de administrado, en forma libre o conjugada con rocuronio o vecuronio y el 90% en las primeras 24 horas 8 .
Efectos clínicos
Puesto que el sugammadex se desarrolló específicamente para antagonizar el efecto del rocuronio, la gran mayoría de los estudios clínicos se han efectuado para evaluar este BNM, en dosis que van desde 0,5 mg·kg-1 hasta 16 mg·kg-1 en bloqueos inducidos con diferentes dosis de rocuronio, partiendo desde diferentes niveles de bloqueo, existiendo en todos ellos una clara relación dosis-respuesta. Un número menor de estudios se ha efectuado para la evaluación del bloqueo inducido por vecuronio y un solo estudio para el de pancuronio.
Debe hacerse presente que la gran mayoría de la literatura publicada tiene de una u otra forma el auspicio del laboratorio Organon en un principio, Schering-Plough después y tras una nueva fusión, Merck Sharp & Dohme. En todo caso, los autores no tienen ningún reparo en reconocerlo en su declaración de conflictos de intereses.
-
1. Sugammadex para antagonizar bloqueos moderados de rocuronio:
Si se administra sugammadex después de aparecer 2 respuestas al tren de 4 estímulos (TOF), se produce una disminución del tiempo de recuperación a T4/T1 = 0,9, que es proporcional a la dosis. A mayor dosis la respuesta es más rápida: con 0,5 mg·kg–1 es de 4,3 minutos, en tanto que con 4 mg·kg-1 es de 1,1 minuto. El placebo demora 21 minutos (recuperación espontánea). La curva dosis respuesta alcanza un plateau a los 2 mg·kg-1, por encima del cual la recuperación no es significativamente más rápida.
Varios estudios llevados a cabo después de un bloqueo moderado, recomiendan una dosis de 2 mg·kg-1 de sugammadex, pues se gana muy poco tiempo aumentando esta dosis y la recuperación total ocurre en todos los pacientes en menos de 3 minutos (Tabla 1) 8 ,9,10,11,12,. Además, todos los estudios han demostrado que una vez que el bloqueo se ha revertido, no ocurre recurarización. La eficacia de la reversión es independiente del tipo de anestesia (tanto con anestesia total endovenosa como con anestesia inhalatoria con sevofluorano el tiempo de recuperación es de 1,8 minutos) 13 , 14 , de la duración de la cirugía y de la forma de administración (dosis única, dosis de repetición, infusión) 15 .
Tabla 1 Tiempo de recuperación en minutos después de la aparición de 1 a 2 respuestas al TOF (bloqueo moderado), hasta una relación T4/T1 = 0,9, con dosis crecientes de sugammadex. Dosis recomendada para revertir bloqueo moderado de rocuronio: 2 mg•kg-1 de sugammadex
| Dosis Sugammadex |
0,5 mg•kg-1 |
1 mg•kg-1 |
2 mg•kg-1 |
3 mg•kg-1 |
4 mg•kg-1 |
6 mg•kg-1 |
| Sorgenfrei, 2006 |
3,7 |
2,3 |
1,7 |
1,9 |
1,1 |
– |
| Suy, 2007 |
4,3 |
3,3 |
1,3 |
1,2 |
1,1 |
– |
| Shields, 2007 |
5 |
2 |
1 |
– |
1 |
2 |
| Püringer, 2007 |
16,3 |
4,6 |
1,4 |
– |
1,5 |
– |
| Plaud, 2007 |
4,2 |
1,7 |
1,4 |
– |
1,2 |
2 |
Hay reportes de recurarización después de dosis insuficientes de sugammadex. Administrando pequeñas dosis de sugammadex (0,5 mg·kg-1), se obtiene recuperaciones inicialmente exitosas, pero después de un tiempo el bloqueo reaparece 17 . Con las dosis recomendadas (2 mg·kg-1), nunca se ha reportado recurarización.
-
2. Sugammadex para antagonizar bloqueos profundos con rocuronio:
Si se administra sugammadex después de aparecer 1 a 2 respuestas al conteo postetánico (PTC), algo que es imposible reproducir con anticolinesterásicos, también se produce una disminución del tiempo de recuperación a T4/T1 = 0,9: la velocidad de recuperación aumenta en forma proporcional a la dosis y la variabilidad disminuye. Lo natural es que en esta situación se requiera de una mayor dosis de sugammadex, pues éste se une al rocuronio molécula a molécula.
Varios estudios dosis-respuesta llevados a cabo después de un bloqueo profundo, confirman que se necesitan 4 mg·kg-1 de sugammadex para lograr una recuperación total entre 1,6 y 3,3 minutos y 8 mg·kg-1 para lograrla en 1,1 a 1,5 minutos. La poca diferencia lograda con la duplicación de la dosis, hace recomendable el uso de sólo 4 mg·kg-1 en esta situación clínica (Tabla 2) 17 ,18,19 . Con esta dosis, todos los estudios han demostrado que una vez que el bloqueo se ha revertido, no ocurre recurarización.
Tabla 2 Tiempo de recuperación en minutos después de la aparición de 1 a 2 respuestas al conteo postetánico (bloqueo profundo), hasta una relación T4/T1 = 0,9, con dosis crecientes de sugammadex. Dosis recomendada para revertir bloqueo profundo de rocuronio: 4 mg•kg-1 de sugammadex
| Dosis
Sugammadex |
0,5 mg•kg-1 |
1 mg•kg-1 |
2 mg•kg-1 |
4 mg•kg-1 |
6 mg•kg-1 |
8 mg•kg-1 |
| Groudine, 2007 |
44,2 |
19,1 |
5,4 |
3,3 |
– |
1,5 |
| Sparr, 2007 |
– |
6,5 |
2,7 |
2,1 |
2,1 |
1,4 |
| Duvaldestin, 2007 |
79,8 |
28 |
3,2 |
1,6 |
– |
1,1 |
Nuestra experiencia antagonizando un bloqueo profundo después de una dosis de 0,6 mg·kg-1 de rocuronio, y dosis de repetición de 0,15 mg·kg-1 en caso necesario se muestra en la Tabla 3. Una vez aparecida la primera respuesta al PTC, se administró 4 mg·kg-1 de Bridion® en 10 pacientes ASA I-II. Todos los pacientes recibieron anestesia inhalatoria con isofluorano. Dos pacientes tuvieron un IMC levemente superior a 30 y los tiempos quirúrgicos variaron entre 30 minutos y 2 horas 30 minutos; se necesitaron de 0 a 6 dosis de repetición. El tiempo transcurrido entre la administración de sugammadex y la aparición de la segunda respuesta al TOF (momento en que recién se podría iniciar la reversión con anticolinesterásicos), fue de 37 segundos (20 a 70); el tiempo hasta la recuperación T4/T1 ≥ 0,9 fue de 3,06 minutos (57 segundos a 5 minutos 10 segundos) 20 .
Tabla 3 Resumen primer estudio realizado en Chile a partir de un bloqueo profundo de rocuronio (1 respuesta al conteo postetánico) en 10 pacientes ASA I-II, con 4 mg•kg-1 de Bridion™; el tiempo promedio de recuperación a T4/T1 ≥ 0,9 fue de 3,06 minutos
|
N |
Cirugía |
ASA |
Edad |
Peso |
Estatura |
IMC |
Duración |
Repetición |
PTC |
T2 |
T4/T1 ≥ 90% |
| 1 | Colecistectomía
convencional |
II |
47 |
44 |
1,48 |
20,0 |
1:15 |
2 |
1 |
40 |
2:56 |
| 2 | Colecistectomía laparoscópica |
I |
52 |
75 |
1,67 |
26,9 |
1:45 |
4 |
0 |
70 |
5:10 |
| 3 | Mastectomía radical |
II |
79 |
67 |
1,55 |
27,9 |
1:00 |
1 |
1 |
40 |
2:56 |
| 4 | Biopsia ganglio cervical |
I |
59 |
89 |
1,78 |
28,1 |
0:30 |
0 |
1 |
50 |
1:50 |
| 5 | Mastectomía + axila |
I |
51 |
70 |
1,50 |
31,1 |
1:15 |
1 |
1 |
30 |
1:40 |
| 6 | Tiroidectomía |
I |
38 |
63 |
1,56 |
25,9 |
1:30 |
3 |
1 |
30 |
3:30 |
| 7 | Tiroidectomía |
I |
49 |
74 |
1,72 |
25,0 |
1:15 |
2 |
20 |
0:57 |
|
| 8 | Mastectomía radical |
II |
36 |
85 |
1,66 |
30,8 |
1:00 |
1 |
1 |
30 |
2:15 |
| 9 | Mastectomía + ganglio centinela |
I |
53 |
51 |
1,56 |
20,9 |
1:05 |
2 |
1 |
30 |
1:15 |
| 10 | Reconstrucción mamaria |
I |
43 |
68 |
1,70 |
23,5 |
2:30 |
6 |
1 |
30 |
2:10 |
- 3. Sugammadex para reversión del bloqueo con vecuronio:
Aunque el sugammadex fue diseñado específicamente para revertir el bloqueo inducido por rocuronio, tiene una gran eficacia en la reversión del vecuronio. La recuperación del vecuronio es algo más lenta que si se usa la misma dosis de sugammadex para revertir un bloqueo de rocuronio a partir de la misma profundidad. Aunque lo lógico sería aumentar la dosis, la diferencia es tan insignificante, que se recomienda mantener la misma dosis que con rocuronio tanto en bloqueos moderados (2 mg·kg-1), como profundos (4 mg·kg-1).
Tanto con rocuronio como con vecuronio, las velocidades de recuperación son significativamente menores con sugammadex que con neostigmina partiendo del mismo nivel de bloqueo, y los rangos son mucho más estrechos. El sugammadex no sólo es capaz de revertir el vecuronio, sino también el 3-desacetil metabolito, responsable de su acumulación 21 .
Después de un bloqueo moderado, los tiempos de recuperación son de 1,4 minutos con 2 mg·kg-1 de sugammadex vs 17,6 minutos con 0,05 mg·kg-1 de neostigmina para el rocuronio y 2,1 minutos versus 18,9 para el vecuronio respectivamente. Después de un bloqueo profundo, los tiempos de recuperación son de 2,9 minutos con 4 mg·kg-1 de sugammadex vs 50,4 minutos con 0,07 mg·kg-1 de neostigmina para el rocuronio y 4,5 minutos vs 66,2 para el vecuronio respectivamente (Tabla 4) 22 ,23,24,25 .
Tabla 4 Tiempo de recuperación en minutos después de la aparición de bloqueos moderados y profundos con rocuronio y vecuronio hasta una relación T4/T1 = 0,9. Comparación con los tiempos de recuperación de la neostigmina. Dosis recomendada para revertir bloqueo moderado de vecuronio; 2 mg•kg-1 de sugammadex. Dosis recomendada para revertir bloqueo profundo de vecuronio 4 mg•kg-1 de sugammadex
|
Sugammadex 2 mg•kg-1 |
Neostigmina 0,05 mg•kg-1 |
|
| Bloqueo moderado rocuronio |
1,4 min1 |
17,6 min1 |
| Bloqueo moderado vecuronio |
2,1 min1 |
18,9 min1 |
|
Sugammadex 4 mg•kg-1 |
Neostigmina 0,07 mg•kg-1 |
|
| Bloqueo profundo rocuronio |
2,9 min2 |
50,4 min2 |
| Bloqueo profundo vecuronio |
4,5 min2 |
66,2 min2 |
| 1 Medianas.
2 Promedios geométricos. |
||
-
4. Sugammadex para reversión del bloqueo con pancuronio:
La constante de asociación (K a ) del rocuronio es de alrededor de 25 megaM-1, la del vecuronio de 10 megaM-1 y la del pancuronio de 2,6 megaM-1. Esto hace que la afinidad del sugammadex sea decreciente para el rocuronio, el vecuronio y el pancuronio (rocuronio > vecuronio >> pancuronio).
La única publicación que ha estudiado la efectividad del sugammadex en revertir el bloqueo con pancuronio fue realizado en pocos pacientes y aunque demuestra que disminuye el tiempo de recuperación total de un bloqueo moderado (2 respuestas al TOF), no logra determinar una significativa relación dosis respuesta 26 .
Parece lógico que una droga tan sofisticada como el sugammadex, no sea estudiada para revertir un agente que prácticamente ha dejado de comercializarse. Más aún, las dosis necesarias para obtener tiempos de recuperación total de 3 minutos a partir de un bloqueo moderado con pancuronio, son similares a las dosis necesarias para revertir un bloqueo profundo con rocuronio (4 mg·kg-1). El costo de una dosis de pancuronio no justifica el costo de una dosis tan alta de sugammadex.
-
5. Sugammadex para reversión inmediata de rescate:
Desde sus inicios, el rocuronio se ha planteado como una alternativa viable a la succinilcolina en la inducción en secuencia rápida. La limitación siempre ha sido el tiempo de duración del rocuronio, que no permite una recuperación rápida de la ventilación. Es por esto que la succinilcolina ha mantenido margen de indicaciones, especialmente en inducción en secuencia rápida cuando se prevé una intubación difícil; el caso típico es la intubación para anestesia general en operación cesárea.
Se han efectuado por lo menos 3 estudios de dosis respuesta para establecer la dosis de sugammadex necesaria para revertir una dosis de intubación de rocuronio recién administrada. En estas situaciones, en que un bloqueo profundo necesita ser revertido rápidamente y con la menor variabilidad, la dosis recomendada es de 16 mg·kg-1 (Tabla 5) 27 ,28 .
Tabla 5 Tiempo de recuperación en minutos después de la administración de una dosis de intubación de rocuronio recién administrada, hasta una relación T4/T1 = 0,9, con dosis crecientes de sugammadex. Dosis recomendada para revertir el bloqueo de una dosis de intubación de rocuronio en forma inmediata: 16 mg•kg-1 de sugammadex
| Dosis de
Sugammadex |
2 mg•kg-1 |
4 mg•kg-1 |
8 mg•kg-1 |
12 mg•kg-1 |
16 mg•kg-1 |
| de Boer, 20071 |
55,3 |
12,3 |
2,5 |
1,3 |
1,3 |
| Pühringer, 20081 |
63,3 |
11,3 |
3,6 |
1,9 |
1,3 |
| Pühringer, 20082 |
34,4 |
6,8 |
2,2 |
1,4 |
1,3 |
| 1 1,2 mg•kg-1 de rocuronio 2 1,0 mg•kg-1 de rocuronio | |||||
En un trabajo metodológicamente muy bien realizado, Lee y colaboradores, estudiaron 110 pacientes inducidos y mantenidos con propofol y opioides, que fueron asignados a 2 grupos: uno recibió 1,2 mg·kg-1 de rocuronio seguidos luego de 3 minutos de una dosis de 16 mg·kg-1 de sugammadex y el otro 1 mg·kg-1 de succinilcolina dejado evolucionar a recuperación espontánea. La recuperación del 90% de la primera respuesta al TOF fue significativamente más rápida en el grupo de rocuronio-sugammadex (6,2 ± 1,8 min vs 10,9 ± 2,4 min) (Tabla 6/Figura 2) 29 . Los autores modestamente insinúan que, de acuerdo a estos resultados, la mezcla podría ser útil para ampliar el margen de uso actual de rocuronio en inducción en secuencia rápida, que hoy por hoy es de sólo un 25% 30 ,31 .
Tabla 6 Resultados del estudio de Lee, comparando el tiempo de recuperación al 90% de la primera respuesta al TOF de 1,2 mg•kg-1 rocuronio vs 1 mg•kg-1 de succinilcolina 29
|
Rocuronio-SGM n = 55 (min) |
Succinilcolina n = 55 (min) |
|
| Recuperación T1 90% |
6,2 ± 1,8 |
10,9 ± 2,4 |
| Rango |
4,2 – 13,6 |
5,0 – 16,2 |
| P < 0,001 | ||
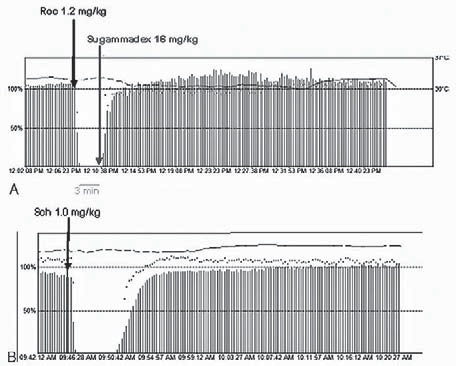
Figura 2 Protocolo del estudio de Lee y colaboradores, apreciándose la rápida recuperación del rocuronio después de una dosis de 1,2 mg•kg-1 de rocuronio (arriba), con la más tardía y mayor pendiente de recuperación de 1 mg•kg-1 de succinilcolina dejado evolucionar espontáneamente (abajo) 29 .
La dosis de intubación de rocuronio que es recomendable para inducción en secuencia rápida y que produce tiempos de inicio de acción similares a la succinilcolina (1 minuto) es 1,2 mg·kg-1, 32 . Sin embargo, con estas dosis el rocuronio se transforma en un BNM de larga duración (73 minutos) y ocasiona una situación difícil de manejar en caso de no-poder-ventilar-no-poder-intubar. Si con una dosis alta de sugammadex, se logra que esta dosis de rocuronio se recupere antes que una dosis habitual de intubación de succinilcolina en forma espontánea, se está efectuando con 2 agentes lo que se ha buscado por más de 20 años de investigación clínica: un bloqueo neuromuscular de inicio corto y corta duración, que permita que el paciente retorne a su ventilación espontánea rápidamente y sin hacer hipoxemia ante el fracaso de la intubación. De esta manera, la duración de acción del rocuronio puede cambiarse de intermedia a ultracorta 33 .
El estudio de Lee, de este modo, puede cambiar algunos paradigmas de la anestesiología, pero debe esperarse que la idea decante y que surjan nuevos estudios. El modelo permitiría ampliar el uso de rocuronio en inducción en secuencia rápida y usar altas dosis de sugammadex como rescate en situaciones de no-poder-ventilar-no-poder-intubar 34 . Esto es refrendado por estudios en animales que demuestran que el sugammadex no sólo revierte rápidamente el bloqueo inducido con rocuronio, sino que restablece también rápidamente la ventilación espontánea 35 . Ya hay algunos reportes de buenos resultados 36 , sin embargo, en un estudio de simulación realizado en maniquíes, no pudo demostrarse su efectividad 37 .
Se ha usado sugammadex en dosis de rescate (16 mg·kg-1), en terapia electroconvulsiva después de 0,6 mg·kg-1 de rocuronio, demostrándose una diferencia de tiempo a la recuperación total de sólo 40 segundos (no significativa) y una duración más corta de las convulsiones con succinilcolina que con rocuronio (33 vs 39 segundos respectivamente). El potencial beneficio del uso de la combinación rocuronio-sugammadex podría hacer abandonar el uso de la succinilcolina en el campo de la terapia electroconvulsiva 38 .
El eventual uso de rocuronio como BNMND en anestesia general en obstetricia debe ser reevaluado 39 . En esta situación, el rocuronio es menos utilizado como parte de la inducción en secuencia rápida, pues la duración de una dosis de intubación excede la mayoría de los procedimientos obstétricos y la intubación difícil es una situación más probable en este grupo de pacientes. Ya hay publicaciones que avalan esta técnica 40 ,41 . Sin embargo, no se dispone de datos clínicos sobre su uso durante el embarazo, por lo que, el fabricante recomienda precaución en estos casos, aunque los estudios en animales no indican efectos nocivos directos o indirectos sobre el embarazo o el desarrollo del embrión 3 .
-
6. Sugammadex en poblaciones especiales:
Se ha llevado a cabo una serie de estudios en fase III y IV en poblaciones especiales; ninguno de ellos tiene un número suficiente de casos como para sacar conclusiones definitivas, pero en principio demuestran que el sugammadex es más rápido que la neostigmina y que una dosis de 2 mg·kg-1 es adecuada en todos los grupos de edad para revertir un bloqueo moderado.
-
Niños:
Se ha estudiado el efecto de sugammadex después de un bloqueo moderado con rocuronio en niños, revertidos con 2 mg·kg-1 de sugammadex, demostrándose que la efectividad del sugammadex y la rápida reversión del bloqueo es similar en niños (lactantes, preescolares y adolescentes) que en adultos. El tiempo de recuperación a T4/T1 = 0,9 se logró a los 0,6, 1,2, 1,1 y 1,2 minutos en lactantes, preescolares, adolescentes y adultos respectivamente. Cuando se usa en base al peso corporal, los niveles plasmáticos de sugammadex alcanzados entre dosis de 0,5 a 4 mg·kg-1 son similares en los diferentes grupos de edad estudiados 42 . No se ha estudiado su efecto en neonatos, y el número de lactantes estudiados es insuficiente (n = 8), por lo que, se recomienda por el momento su uso a partir de los 2 años 3 .
-
Ancianos:
Se comparó el tiempo hasta la recuperación de T4/T1 = 0,9 en 3 grupos de adultos: entre 18 y 64 años, entre 65 y 75, y mayores de 75 años. La recuperación total con 2 mg·kg-1 de sugammadex después de un bloqueo inducido con rocuronio fue estadísticamente significativa sólo entre el primer (2,3 minutos) y el tercer grupo (3,6 minutos). La diferencia entre el primer grupo (adultos jóvenes) y la suma de los otros grupos fue de sólo 36 segundos, pero tuvo también significación estadística 43 . La diferencia se explicaría por el menor débito cardíaco de los pacientes más ancianos.
-
Pacientes con insuficiencia renal crónica
Se ha comparado la eficacia de la reversión con sugammadex después de un bloqueo moderado con rocuronio en pacientes con insuficiencia renal (depuración de creatinina < 30 ml·min-1), con pacientes con función renal normal. Los tiempos de recuperación a T4/T1 = 0,9 en paciente con falla renal (2,0 ± 0,7 minutos) y en pacientes sanos (1,7 ± 0,6 minutos) no fueron significativamente diferentes; la diferencia media absoluta estimada entre ambos grupos en tiempo, desde la administración de sugammadex a una recuperación de T4/T1 = 0,9 fue de 20,1 segundos (95% CI: -12,1. a + 52,3 segundos) 44 . Desde el punto de vista farmacocinético se observan grandes diferencias entre pacientes con insuficiencia renal y voluntarios sanos. Las concentraciones plasmáticas de sugammadex disminuyen mucho más lentamente en los pacientes con insuficiencia renal; la depuración es 17 veces más lenta (5 ml·min-1 vs 95 ml·min-1) y la vida media de eliminación 16 veces mayor que en los voluntarios sanos. El efecto del daño renal sobre la depuración renal del rocuronio es mucho menor (42 ml·min-1 vs 117 ml·min-1), lo que brinda cierto margen de seguridad y no se observan signos de recurarización en ninguno de los dos grupos 45 .
Pacientes con patología cardíaca
Se ha estudiado el efecto de sugammadex en pacientes con patología cardíaca (enfermedad coronaria, insuficiencia cardíaca o arritmia), ASA II-III demostrándose que el tiempo de recuperación a una relación T4/T1 = 0,9 era de 1,7 minutos, 2 minutos y 34,3 minutos con una dosis de 4 mg·kg-1, 2 mg·kg-1 de sugammadex y placebo respectivamente, administrados al aparecer la segunda respuesta al TOF 46 . El estudio incluyó específicamente la medición del espacio QT del ECG, demostrando que no hubo significativa prolongación del intervalo QT corregido en relación al grupo control. Se concluye que el sugammadex puede ser administrado en forma segura en pacientes cardiópatas sometidos a cirugía no cardíaca.
-
Pacientes con patología pulmonar
Se ha usado 2 y 4 mg·kg-1 de sugammadex en 86 pacientes con patología pulmonar, ASA II-III, reportándose 2 incidentes de broncoespasmo, ambos con 4 mg·kg-1 en sujetos con historia de hipereactividad bronquial. Los episodios fueron catalogados como graves pero duraron menos de 5 minutos y revirtieron con la administración de salbutamol/terbutalina. El tiempo de recuperación a T4/T1 = 0,9 fue de 1,8 y 2,1 minutos con 4 y 2 mg·kg-1 de sugammadex respectivamente. Aunque no hay evidencia que el broncoespasmo estuviera directamente relacionado con sugammadex (1 caso ocurrió 55 minutos después de su administración) y los autores recomiendan el uso de sugammadex en este grupo de pacientes, parece recomendable limitarlo a las dosis de reversión de bloqueo moderado (2 mg·kg-1) y esperar estudios comparativos con anticolinesterásicos 47 .
-
Pacientes obesos
Aunque el Folleto de Información al Profesional 3 del producto recomienda que la dosis de sugammadex en pacientes obesos debe basarse en el peso corporal real, un estudio hecho en Chile calculó la dosis de acuerdo al peso ideal corregido. En pacientes con peso real promedio de 106 kg, se logró tiempos de recuperación de 1,9 minutos a partir de un bloqueo moderado de rocuronio. Se plantea que existe una tendencia que indicaría que en obesos mórbidos se podría plantear el uso de dosis de sugammadex por peso ideal corregido y no por peso real como recomienda el fabricante, sin embargo, el número de pacientes estudiados es muy pequeño 48 .
-
Pacientes con insuficiencia hepática
Aunque no hay estudios en pacientes con patología hepática, se ha efectuado un modelo de simulación farmacocinético-farmacodinámico de sugammadex, revirtiendo un bloqueo de rocuronio en pacientes con daño hepático. En el peor escenario, asumiendo que el sugammadex fuera afectado por el daño hepático, la reversión con 4 mg·kg-1 de sugammadex después de 15 minutos de haber administrado 1,2 mg·kg-1 de rocuronio (4 DE95) tomaría 4,12 minutos más que en un paciente con función hepática normal, y prácticamente no tendría repercusión al ser usado como rescate (16 mg·kg-1 de sugammadex), 3 minutos después de administrado el rocuronio. Puede especularse de este modo, que en este grupo de pacientes, la recuperación sería más rápida que con neostigmina, pero no tan rápida como en pacientes sanos 6 .
-
7. Sugammadex en el tratamiento de la anafilaxia al rocuronio y vecuronio:
Forma parte del tratamiento primario de una anafilaxia, la pronta discontinuación de la droga posiblemente incriminada, para evitar lo antes posible la exposición al agente. En el caso de los BNM, la única alternativa para evitar lo antes posible la exposición al agente desencadenante es la suspensión de infusiones, sin embargo, la forma de administración habitual de los BNMND es en bolos de carga y repetición, por lo que el agente mantiene la respuesta anafiláctica hasta que sea eliminado del organismo.
En el caso del rocuronio, uno de los agentes supuestamente más implicados en anafilaxia alérgica, se planteó desde el punto de vista teórico la posibilidad de “remover” el rocuronio libre de la circulación mediante la administración de sugammadex 49 . Esta especulación presuponía que el complejo rocuronio-sugammadex no se unía a los anticuerpos específicos de la membrana de los mastocitos. El grupo amonio del rocuronio no queda totalmente encapsulado por la molécula de sugammadex, por lo que, el epítope podría seguir quedando expuesto al antígeno. Además, el sugammadex podría unirse a otros esteroides universalmente usados en el tratamiento de la anafilaxia. Aunque la importancia clínica de esta interacción es desconocida, la afinidad del sugammadex por otros esteroides como la aldosterona, cortisona e hidrocortisona es 120 veces menor que con el rocuronio.
El primer caso de anafilaxia a rocuronio que después de 20 minutos de tratamiento convencional con adrenalina, volumen y maniobras de resucitación sin éxito, se administró un frasco ampolla de 500 mg de sugammadex (6,6 mg·kg-1) fue publicado en el BJA en 2011 50 . El resultado fue que 45 segundos después de su administración, mientras aún se efectuaban maniobras de compresión torácica, la paciente abrió los ojos, intentó extubarse y hubo una mejoría significativa de las condiciones hemodinámicas.
La incidencia de la complicación es tan baja, que mientras no haya mayor evidencia, hay suficiente base farmacológica y fisiopatológica, que hace razonable recomendar la administración de sugammadex cuando se sospecha anafilaxia a rocuronio o vecuronio, que no ha respondido al tratamiento tradicional. Puesto que el objetivo de la administración de sugammadex en este contexto sería la quelación de todas las moléculas de rocuronio circulante, y teniendo en cuenta que ocurre recién administrado, la dosis de sugammadex debería ser aquella que se usa como rescate en situación de no-poder-ventilar-no-poder-intubar: 16 mg·kg-1.
Efectos secundarios
Se ha usado sugammadex en seres humanos en dosis que van desde 0,5 a hasta 96 mg·kg-151 . Por el momento tiene una tolerancia totalmente aceptable y concordante con el concepto teórico de que las ciclodextrinas son azúcares solubles muy bien toleradas en los seres humanos, sin embargo, es muy pronto para saber la completa magnitud de sus efectos secundarios.
Entre los efectos secundarios reportados en las más de 2.000 administraciones publicadas en la literatura están: superficialización de la anestesia (tos, movimiento), sensación de gusto metálico, hipotensión, hipertensión, náuseas y vómitos, constipación, aumento de niveles de N-acetil-glucosamida, prolongación del espacio QT del ECG, etc. 6 . Es difícil separar aquellos efectos que son producto de la droga en estudio, de efectos derivados de otras drogas o de efecto placebo. Además, hay efectos que sólo se observan en voluntarios despiertos (como la disgeusia). Es bastante obvio que si no hay una profundidad anestésica adecuada y se revierte el bloqueo muscular bruscamente, el paciente se mueva o rechace el tubo endotraqueal.
Se ha reportado un aumento de la concentración de N-acetil-glucosamidasa en la orina (un indicador de daño tubular proximal) en los pacientes que han recibido sugammadex 8 ,45,52 . Sin embargo, la diferencia entre los niveles pre y postoperatorios no es significativa y los niveles retornan a los valores normales a las 24 horas, por lo que, no parece tener relevancia clínica.
En varios estudios se ha descartado el efecto sobre el espacio QT. Se ha demostrado que ni el sugammadex solo, en dosis hasta 32 mg·kg-1, ni combinado con rocuronio o vecuronio, están asociados a una prolongación de espacio QT corregido 53 .
Como todo fármaco, es susceptible de producir anafilaxia. Se han reportado varias posibles reacciones alérgicas, algunas de las cuales se han demostrado con test cutáneo. En general se trata de manifestaciones cutáneas y taquicardia, de evolución auto limitada, pero también en algún caso broncoconstricción. No hay reportes de shock anafiláctico o paro cardíaco como manifestación de anafilaxia al sugammadex 54 .
El sugammadex es eliminado rápidamente de la mayoría de los órganos, pero se ha reportado cierta retención ósea y dental en ratas. La presencia de rocuronio o vecuronio previene esta retención. El componente probablemente involucrado en la unión es la hidroxiapatita. Aunque esta retención no afecta de manera adversa el color, la calidad, la estructura, el recambio y el desarrollo óseo, en las ratas jóvenes se observó decoloración blancuzca de los incisivos y alteración de la amelogénesis con dosis acumuladas durante 4 semanas de sugammadex equivalentes a 48-480 veces la dosis usada para revertir un bloqueo profundo (4 mg·kg-1) 3 . Los estudios realizados en ratas demuestran un margen de seguridad mayor de 1.000 para que no haya efectos adversos sobre parámetros óseos en la población pediátrica y un margen de seguridad 48-480 sobre la dentadura, lo que definitivamente no representa riesgo alguno 3 .
Por el momento, el fármaco ha sido utilizado sólo en pacientes ASA I-III. La tolerancia puede ser distinta en pacientes con patología agregada grave y las curvas dosis respuesta pueden ser muy distintas. Es demasiado pronto para saber la verdadera extensión de los posibles efectos colaterales del sugammadex y por el momento, su gran limitación es el costo.
Interacciones
Hasta ahora no ha habido reporte de interacciones de sugammadex con otros agentes, sin embargo, desde el punto de vista teórico pueden ocurrir 2 tipos de interacciones:
-
Interacción por desplazamiento (en que otro agente puede unirse al sugammadex, desplazando al BNMND aminoesteroide).
-
Interacción por captura (en que el sugammadex se une a otro agente, y deja de estar disponible para interactuar con el rocuronio o vecuronio).
La primera puede resultar en una potencial recurrencia del bloqueo y la segunda puede resultar en una disminución de las concentraciones plasmáticas de sugammadex y disminuir la eficacia de la droga. Si llegara a ocurrir una interacción por desplazamiento, se debe ventilar al paciente y en caso de una infusión, interrumpir la administración del producto que ocasionó el desplazamiento. Si llegara a ocurrir una interacción por captura, sería recomendable volver a administrar el fármaco, o usar un agente terapéuticamente equivalente, en lo posible de otro grupo químico.
La afinidad de sugammadex por otros agentes es muy baja (120-700 veces menos que con el rocuronio) 55 . Los esteroides endógenos no tienen nitrógeno cuaternario y habitualmente están unidos a proteínas, por lo que no son un problema.
Se ha medido la constante de afinidad para más de 300 productos. Entre las drogas utilizadas en anestesia, la mayor constante de afinidad (K a ) encontrada fue para el remifentanil, equivalente sólo al 0,2% de la constante de afinidad del rocuronio. Entre drogas y hormonas con núcleos esteroidales, drogas que actúan sobre receptores esteroidales y drogas más comúnmente prescritas, las con mayor K a son los progestágenos y estrógenos, equivalente al 2-22% de la afinidad con el rocuronio 6 .
No se prevén interacciones farmacodinámicas significativas con otros fármacos, excepto el toremifeno, la flucloxaciclina y el ácido fusídico 56 . La recuperación total podría demorarse en pacientes que hayan recibido toremifeno el mismo día de la cirugía. La administración de flucloxaciclina en dosis de 500 mg o más, podría causar cierto desplazamiento del rocuronio o del vecuronio del sugammadex.
En relación a los anticonceptivos hormonales, se prevé que la interacción de 4 mg·kg-1 de sugammadex con un progestágeno puede disminuir la exposición al progestágeno; en caso de los estrógenos el efecto es menor. De este modo, se considera con fines prácticos que la administración de una dosis en bolo de sugammadex es equivalente a la omisión de una dosis diaria de anticonceptivos orales, y debe usarse las recomendaciones para dosis omitidas de cada anticonceptivo oral. En el caso de anticonceptivos no orales, se debe usar un método no hormonal durante los 7 días siguientes a la administración de sugammadex 3 .
Bloqueo después de reversión con sugammadex
No es una situación común, pero a veces un paciente puede requerir ser reintervenido en el postoperatorio inmediato. El uso de un BNMND debe ser considerado en tales casos, ya sea si se haya efectuado una reversión con anticolinesterásicos o con sugammadex.
Los anticolinesterásicos producen una profunda inhibición de la colinesterasa plasmática, que ocasiona una prolongación del efecto de la succinilcolina y los BNMND un bloqueo competitivo que se desplazará hacia un lado u otro dependiendo de la dosis. El resultado del uso de BNMND es incierto si se necesita relajación después de la reversión. Lo que está claro es que en la medida en que exista un exceso de acetilcolina en la unión neuromuscular, ni los bloqueadores neuronales despolarizados ni los no despolarizantes funcionarán normalmente.
Después de una reversión con sugammadex, el rocuronio y el vecuronio pueden producir bloqueo, pero su eficacia disminuye significativamente a menos que se usen muy altas dosis 57 . Después de haber administrado 4 mg·kg-1 de sugammadex, se necesitaría una dosis de 1,3 mg·kg-1 de rocuronio para producir un bloqueo equivalente al de 0,6 mg·kg-1 sin haber usado sugammadex 58 .
Se ha realizado una serie de modelos computacionales, cálculos 58 y estudios en animales 59 para encontrar la dosis necesaria para bloquear con rocuronio a los pacientes que han sido revertidos con sugammadex, cuando lo más obvio parece ser utilizar un BNMND del grupo de las bencilisoquinolinas o succinilcolina. Estudios en animales demuestran que mientras el rocuronio produce bloqueos bastante impredecibles después de administrar sugammadex, la succinilcolina o el cisatracurio no son afectados 60 .
El propio Folleto de Información al Profesional de Bridion®, sugiere que si se requiere volver a administrar rocuronio o vecuronio, se recomienda un tiempo de espera de 24 horas y si fuera necesario volver a bloquear a un paciente antes de este tiempo, se recomienda utilizar un BNMND no esteroidal o succinilcolina 3 .
Cambios de conducta clínica
El novedoso mecanismo de acción de sugammadex ha hecho especular a varios autores sobre la posibilidad de que la incorporación del fármaco al arsenal anestesiológico se traduzca en cambios en algunas conductas clínicas muy arraigadas, como ocurrió hace 30 años con la introducción de los BNMND de duración intermedia o como ocurrió hace 20 años con la introducción del propofol 61 ,62 .
-
1. El tipo de BNMND utilizado:
Parece lógico pensar que si se cuenta con un mejor antagonista para los BNMND del grupo aminoesteroide, la tendencia sea que los anestesiólogos utilicen con mayor frecuencia este tipo de relajantes. Por lo demás, el rocuronio es lejos el BNMND más utilizado en los Estados Unidos.
Según Kopman la medida en que el sugammadex remplace a los anticolinesterásicos, y por lo tanto, los BNMND aminoesteroides desplacen a las bencilisoquinolinas, dependerá por lo menos en parte de consideraciones económicas 63 . Eso puede ser cierto en Estados Unidos y Europa, pero en países como el nuestro dependerá en gran medida de consideraciones fármaco-económicas. En ambos casos influirá la aparición de eventuales efectos colaterales.
La estrategia de la empresa que posee los derechos de la droga, ha optado por sacarla al mercado con precios excesivos para la práctica privada y prohibitivos para la práctica pública. Es difícil cuantificar el posible beneficio económico que significa el uso de sugammadex (disminución del tiempo del paciente en pabellón y en sala de recuperación) 64 , pero es imposible pensar que una droga que reemplaza a otra con una diferencia de precio de 1 a 1.000, pueda entrar fácilmente en el mercado. Tal vez una diferencia de 1 a 100 habría producido el consumo masivo de una droga con características tan revolucionarias, y la mayoría de los anestesistas que usaban agentes de otro grupo químico, habrían preferido los aminoesteroides, fabricados por lo demás por la misma compañía.
En estas condiciones, probablemente, habrá que usar sugammadex sólo con indicaciones precisas (situaciones de no-poder-ventilar-no-poder-intubar, anafilaxia al rocuronio o bloqueos profundos con aminoesteroides que no pudieron ser revertidos con anticolinesterásicos). Una forma de ahorrar droga puede ser titularla con una monitorización objetiva (aceleromiografía).
Además, si se requiere relajación muscular después de la administración de sugammadex, los BNMND bencilisoquinolínicos son la mejor alternativa. El sugammadex no tiene la capacidad de revertir los relajantes bencilisiquinolínicos, por lo que los anticolinesterásicos también deberán seguir formando parte del arsenal anestesiológico.
-
2. El manejo de la vía aérea:
Durante los últimos 20 años se ha puesto un gran énfasis en encontrar un BNMND de efecto rápido y corta duración. El efecto rápido se logró con el rocuronio y la corta duración se vio frustrada con el rapacuronio, pero tal vez una asociación de rocuronio con sugammadex sea un excelente hallazgo.
Idealmente una droga para el manejo de la vía aérea debe tener una recuperación tan rápida que si llegara a ocurrir la situación no-poder-ventilar-no-poder-intubar, no se pusiera en riesgo la vida de un paciente que haya sido adecuadamente preoxigenado. Si se demuestra que el uso de rocuronio seguido de sugammadex, tiene una recuperación más rápida: ¿Para qué seguir usando succinilcolina? Indudablemente que para responder esta pregunta se requiere de mayores estudios. Incluso si esto ocurriera, la succinilcolina deberá permanecer en nuestros cajones, aunque sea sólo para relajar a pacientes que ya han recibido sugammadex.
Un metaanálisis realizado por Karcioglu y colaboradores ha mostrado que la succinilcolina es mejor que altas dosis de rocuronio para producir condiciones de intubación excelentes y evitar condiciones de intubación inaceptables en situaciones de emergencia. Sin embargo, el estudio incluye dosis de succinilcolina entre 1 y 1,5 mg·kg-1 y de rocuronio entre 0,6 y 1,2 mg·kg-1, por lo que, no son condiciones clínicas comparables 65 . Por lo demás, existe evidencia que la presunción acerca de la seguridad de la rápida reversión de un bloqueo con una dosis de intubación de succinilcolina es incorrecta; ocurre una desaturación de hemoglobina significativa, que pone en riesgo la vida, antes de la recuperación de la ventilación espontánea 66 y con cierta frecuencia (11%) los pacientes hacen hipoxemia durante una inducción en secuencia rápida, independientemente de la técnica de preoxigenación 67 .
Finalmente, en quemados, pacientes con hiperkalemia o todos aquellos casos en que está contraindicada la succinilcolina, cuando es importante que la ventilación se establezca rápidamente, el uso de rocuronio-sugammadex, puede ser la mejor opción.
-
3. Monitorización:
Algunos autores se han atrevido a plantear que al contarse con un antagonista completamente predecible como el sugammadex, la necesidad de monitorización del bloqueo ya no sería necesaria, o por lo menos no obligatoria. Esto causó la desaprobación de varios expertos, que sin embargo olvidan que en la práctica clínica diaria la monitorización del bloqueo neuromuscular es una excepción más que una regla 68 , 69 .
Lo más probable es que los estimuladores de nervio periférico convencionales tendrán siempre su lugar en la determinación de la dosis de sugammadex, dependiendo de la profundidad inicial del bloqueo. Si la droga es muy cara, en la práctica diaria se podrá titular la dosis hasta que la relación T4/T1 sea 1 con aceleromiografía, deteniendo allí su administración 33 .
-
4. Bloqueo profundo:
La tendencia en los últimos años ha sido usar la menor cantidad de BNMND, y si es posible, no utilizarlos. Sin embargo, en algunas cirugías se requiere de un bloqueo profundo, ya sea para facilitar los accesos quirúrgicos o porque pequeños movimientos del paciente pueden ser fatales en el resultado final de la cirugía. En tales casos, el anestesiólogo debe estar pendiente de no caer en la sobredosificación, para poder revertir exitosamente el bloqueo residual con neostigmina al final de la operación. Ante esta situación, el sugammadex permite revertir rápidamente un bloqueo profundo inducido con rocuronio o vecuronio.
Otro escenario en que puede haber bloqueo profundo no deseado, es en cirugía de cáncer, cuando, con el abdomen abierto, el cirujano decide que un tumor es irresecable y se necesita revertir el bloqueo. Si el sugammadex demuestra ser una droga segura, podrá mantenerse un bloqueo profundo con BNMND aminoesteroides y tener asegurada la reversión al término de la operación.
-
5. Uso en cirugía ambulatoria:
La tendencia en pacientes ambulatorios ha sido a no usar BNMND o usar el de cinética más breve (mivacurio). Sin embargo, la existencia de una droga como el sugammadex, con un gran margen de seguridad para revertir bloqueos residuales, podría hacer que los anestesiólogos usaran con mayor frecuencia BNMND del grupo aminoesteroide de duración intermedia (vecuronio, rocuronio) en procedimientos ambulatorios cortos.
El mivacurio no deja de tener siempre la incertidumbre ante la posibilidad que el paciente tenga una colinesterasa plasmática inhibida en actividad, disminuida en concentración o genéticamente atípica. Además, el mivacurio también tiene reportes de bloqueo residual 70 . En algunos países incluso se ha dejado de comercializar.
6. Fin de la reversión universal:
La aparición de nuevos agentes, tendrá que definitivamente cambiar el criterio de revertir todos los BNMND con anticolinesterásicos. Se está introduciendo un nuevo concepto de antagonista selectivo. Así, los del grupo aminiesteroide podrán ser revertidos con sugammadex, los del grupo bencilisoquinolínico con anticolinesterásicos, pero dentro de ellos, la colinesterasa humana purificada ha demostrado ser segura y efectiva para antagonizar el bloqueo del mivacurio 71 , 72 , y la cisteína revierte eficientemente el bloqueo del gantacurio 73 , actuando ambos independientemente de la inhibición de la acetilcolinesterasa.
Conclusiones
El sugammadex ha demostrado una buena tolerancia con altas dosis (16 mg·kg-1) y una capacidad para revertir incluso bloqueos profundos, imposibles de antagonizar hasta ahora con aniticolinesterásicos. Su incorporación puede cambiar algunas rutinas de la clínica anestesiológica, por lo que, hay que estar preparados desde el punto de vista teórico cuando ello ocurra.
Puesto que se ha demostrado su eficacia en antagonizar bloqueos que no han podido ser revertidos por los antagonistas convencionales, si la droga es segura pero mantiene sus costos desproporcionados, puede estar disponible en un principio exclusivamente para estos casos o en carros de intubación difícil 74 . La adopción del sugammadex como agente rutinario de reversión de los BNMND es una cuestión de costos; lo reconfortante es que la droga existe y tarde o temprano su precio será más accesible al caso diario.
Debe tenerse siempre cuidado ante la aparición de nuevas drogas. Esta vez los fabricantes han sido extremadamente cautos, ante la prematura incorporación que se hizo al mercado del rapacuronio. Se requieren muchos estudios para demostrar que el sugammadex tiene mínimos efectos secundarios. Igualmente las bencilisoquinolinas seguirán usándose por su gran independencia de los órganos para su eliminación, y también para poder relajar a los pacientes después de haber administrado sugammadex.
¿Un verdadero cambio en la reversión de los relajantes musculares? Sí. Sin embargo, después de más de 60 años de uso en clínica, ni la succinilcolina ni la neostigmina van a ser fácilmente reemplazadas. El sugammadex parece ser una buena droga, y probablemente una de las más sorprendentes aparecidas en el campo de la anestesia en los últimos años, pero siempre hay que tener presente que las buenas drogas nunca reemplazan las buenas prácticas clínicas.
Referencias
- Bom A, Bradley M, Cameron K, et al. A Novel Concept of Reversing Neuromuscular Block: Chemical Encapsulation of Rocuronium Bromide by a Ciclodextrin-Based Synthetic Host. Angew Chem Int 2002; 41: 266-269.
- Adam JM, Bennett DJ, Bom A, et al. Ciclodextrin-Derived Host Molecules as Reversal Agents for the Neuromuscular Blocker Rocuronium Bromide: Synthesis and Structure-Activity Relationships. J Med Chem 2002; 45: 1806-1816.
- Folleto de Información al Profesional de Bridion®, aprobado por el Instituto de Salud Pública el 18 de agosto de 2009.
- Gijsenbergh F, Ramael S, Houwing N, van Iersel T. First human exposure of Org 25969, a novel agent to reverse the action of rocuronium bromide. Anesthesiology 2005; 103: 695-703.
- Sparr HJ, Vermeyen KM, Beaufort AM, et al. Early reversal of profound rocuronium induced neuromuscular blockade by Sugammadex in a randomized multicenter study; efficacy, safety, and pharmacokinetics. Anesthesiology 2007; 106: 935-943.
- Food and Drugs Authority. Anesthetic and Life Support Drugs Advisory Committee core Presentation. En: http: //www.fda.gov/ohrms/dockets/ac/08/slides/2008-4346s1-01-Schering-Plough-corebackup.pdf (Accesado el 20 de abril de 2011).
- Peeters P, Passier P, Smeets J. Sugammadex is cleared rapidly and primarily unchanged via renal excretion. Biopharm Drug Dispos 2011; 32: 159-167.
- Sorgenfrei IF, Norrid K, Larsen PB, et al. Reversal of rocuronium induced neuromuscular block by the selective relaxant binding agent sugammadex: a dose-finding and safety study. Anesthesiology 2006; 104: 667-674.
- Suy K, Morias K, Cammu G, et al. Effective reversal of moderate rocuronium- or vecuronium-induced neuromuscular block with sugammadex, a selective relaxant binding agent. Anesthesiology 2007; 106: 283-288.
- Shields M, Giovanelli M, Mirakhur RK, et al. Org 25969 (sugammadex), a selective relaxant binding agent for antagonism of prolonged rocuronium-induced neuromuscular block. Br J Anaesth 2006; 96: 36-43.
- Pühringer F, Blaszyk M, Cammu G, et al. Sugammadex achieves fast recovery from shallow neuromuscular blockade induced by rocuronium or vecuronium: dose-response studies. Eur J Anaesthesiol 2007; 24 (Supl. 39): 111.
- Plaud B, Meretoja O, Pohl B, et al. Reversal of rocuronium-induced neuromuscular blockade with sugammadex in paediatric and adult patients. Eur J Anaesthesiol 2007; 24: 124.
- Vanacker BF, Vermeyen KM, Struys MM, et al. Reversal of rocuronium-induced neuromuscular block with the novel drug sugammadex is equally effective under maintenance anesthesia with propofol or sevoflurane. Anesth Analg 2007; 104: 563-568.
- Duvaldestin P, Kuizenga K, Saldien V, et al. A randomized, dose-response study of sugammadex given for the reversal of deep rocuronium- or vecuronium-induced neuromuscular blockade under sevoflurane anesthesia. Anesth Analg 2010; 110: 74-82.
- Rex C, Wagner S, Spies C, et al. Reversal of neuromuscular blockade by sugammadex after continuous infusion of rocuronium in patients randomized to sevoflurane or propofol maintenance anesthesia. Anesthesiology 2009; 111: 30-35.
- Eleveld DJ, Kuizenga K, Proost JH, Wierda JMKH. Temporary increase in twitch response during reversal of rocuronium induced muscle relaxant with a small dose of sugammadex. Anesth Analg 2007; 104: 582-584.
- Groudine SB, Soto R, Lien C, et al. A randomized, dose finding, phase II study of the selective relaxant binding drug, Sugammadex, capable of safely reversing profound rocuronium-induced neuromuscular block. Anesth Analg 2007; 104: 55-62.
- Sparr HJ, Vermeyen, Beaufort AM, et al. Early reversal of profound rocuronium-induced neuromuscular blockade by sugammadex in a randomized multi-center study. Anesthesiology 2007; 106: 935-943.
- Duvaldestin P, Kuizenga K, Kjaer CC, et al. Sugammadex achieves fast recovery from profound neuromuscular blockade induced by rocuronium or vecuronium: a dose response study. Eur J Anaesthesiol 2007; 24 (Supl. 39): 123.
- Bustamante R. Resultados presentados en el XXXVII Congreso Chileno de Anestesiología. Coquimbo, Chile. Noviembre de 2009.
- Staals LM, van Egmond J, Driessen JJ. Sugammadex reverses neuromuscular block induced by 3-desacetyl-vecuronium, an active metabolite of vecuronium, in the anaesthetised rhesus monkey. Eur J Anaesthesiol 2011; 28: 265-272.
- Blobner M, Eriksson L, Scholz J, et al. Sugammadex (2 mg/kg) significantly faster reverses shallow rocuronium-induced neuromuscular blockade compared with neostigmine (50 µg/kg). Eur J Anaesthesiol 2007; 24: 125.
- Jones RK, Caldwell JE, Brull SJ, Soto RG. Reversal of profound rocuronium-induced blockade with sugammadex: a randomized comparison with neostigmine. Anesthesiology 2008; 109: 816-824.
- Álvarez Gómez JA, Wattwill M, Vanacker B. Reversal of vecuronium induced shallow neuromuscular blockade is significantly faster with sugammadex compared with neostigmine. Eur J Anaesthesiol 2007; 24 (Supl. 39); 124-125.
- Lemmes HJM, El-Orbany MI, Berry J, Martin G. Sugammadex reverses profound vecuronium blockade more rapidly than neostigmine. Anesthesiology 2007; 107: A1578.
- Decoopman M, Cammu G, Suy K, et al. Reversal of pancuronium-induced block by the selective relaxant binding agent sugammadex: 9AP2-1. Eur J Anaesthesiol 2007; 24: 110.
- de Boer HD, Driessen JJ, Marcus MA, et al. Reversal of rocuronium induced (1.2 mg·kg-1) profound neuromuscular block by sugammadex: a multicenter dose-finding and safety study. Anesthesiology 2007; 107: 239-244.
- Pühringer FK, Rex C, Sielenkämper AW, et al. Reversal of profound, high-dose rocuronium-induced neuromuscular blockade by sugammadex at two different time points: an international multicenter, randomized, dose-finding safety assessor-blinded, phase II trial. Anesthesiology 2008; 109: 188-197.
- Lee C, Jahr J, Candiotti KA, et al. Reversal of Profound Neuromuscular Block by Sugammadex Administered Three Minutes after Rocuronium. Anesthesiology 2009; 110: 1020-1025.
- Simpson J, Munro PT, Graham CA. Rapid sequence intubation in the emergency department: 5 year trends. Emerg Med J 2006; 23: 54-56.
- Dibble C, Maloba M. Rapid sequence induction in the emergency department by emergency medicine personnel. Emerg Med J 2006; 23: 62-64.
- Magorian T, Flannery KB, Miller RD. Comparison of rocuronium, succinylcholine, and vecuronium for rapid-sequence induction of anesthesia in adult patients. Anesthesiology 1993; 79: 913-918.
- Caldwell JE, Miller RD. Clinical implications of sugammadex. Anaesthesia 2009; 54 (Supl. 1); 66-72.
- Howie K, Urquhart C. Sugammadex for rocuronium rapid sequence induction. Anaesthesia 2011; 66: 224-225.
- Hope FG, Bom A. Sugammadex Restores Spontaneous Respiration after Profound Blockade with Rocuronium. Anesthesiology 2008; 109: A356.
- Adam C, Standl T. Case-Report: Reversal of a deep neuromuscular block with sugammadex after rapid sequence induction with high-dose rocuronium bromide. Anasthesiol Intensivmed Notfallmed Schmerzther 2010; 45: 614-616.
- Bisschops MM, Holleman C, Huitink JM. Can sugammadex save a patient in a simulated ‘cannot intubate, cannot ventilate’ situation? Anaesthesia 2010; 65: 936-941.
- Hoshi H, Kadoi Y, Kamiyama J, et al. Use of rocuronium-sugammadex, an alternative to succinylcholine, as a muscle relaxant during electroconvulsive therapy. J Anesth 2011; 25: 286-290.
- Sharp LM, Levy DM. Rapid sequence induction in obstetrics revisited. Curr Opin Anaesthesiol 2009; 22: 357-361.
- Williamson RM, Mallaiah S, Barclay P. Rocuronium and sugammadex for rapid sequence induction of obstetric general anaesthesia. Acta Anaesthesiol Scand 2011 Apr 11. doi: 10.1111/j.1399-6576.2011.02431 (Epub ahead of print).
- Pühringer FK, Kristen P, Rex C. Sugammadex reversal of rocuronium-induced neuromuscular block in Caesarean section patients: a series of seven cases. Br J Anaesth 2010; 105: 657-660.
- Plaud B, Meretoja O, Hofmocker R, et al. Reversal of rocuronium-induced neuromuscular blockade with sugammadex in pediatric and adult surgical patients. Anesthesiology 2009; 110: 284-294.
- Mc Donaugh DL, Benedict PE, Kovac Al, et al. Efficacy, safety, and pharmacokinetics of sugammadex for the reversal of rocuronium-induced neuromuscular blockade in elderly patients. Anesthesiology 2011; 114: 318-329.
- Staals LM, Snoeck MMJ, Driessen JJ, et al. Multicentre, parallel-group, comparative trial evaluating the efficacy and safety of sugammadex in patients with end-stage renal failure or normal renal function. Br J Anaesth 2008; 101: 492-497.
- Staals LM, Snoeck MMJ, Driessen JJ, et al. Reduced clearance of rocuronium and sugammadex in patients with severe end-stage renal failure: a pharmacokinetic study. Br J Anaesth 2010; 104: 31-39.
- Dahl V, Pendeville PE, Hollman, et al. Safety and efficacy of sugammadex for the reversal of rocuronium-induced neuromuscular blockade in cardiac patients undergoing noncardiac surgery. Eur J Anaesthesiol 2009; 26: 874-884.
- Amao R, Zornow MH, Cowan MR, et al. Sugammadex safely reverses rocuronium-induced blockade in patients with pulmonary disease. Anesthesiology 2007; 107: A1582.
- Brunet L, Stamm T, Vargas J. Reversión de bloqueo neuromuscular superficial inducido por rocuronio en obesos mórbidos utilizando sugammadex en dosis calculadas por peso ideal corregido: estudio observacional. Rev Chil Anest 2010; 39: 211.
- Jones, PM, Turkstra TP. Mitigation of rocuronium-induced anaphylaxis by sugammadex: the great unknown. Anaesthesia, 2010; 65: 89-90.
- McDonell NJ, Pavy TJG, Green LK, Platt PR. Case report: Sugammadex in the management of rocuronium-induced anaphylaxis. Br J Anaesth 2011; 106: 199-201.
- Peeters PA, van den Heuvel MW, van Heumen E, et al. Safety, tolerability and pharmacokinetics of sugammadex using single high doses (up to 96 mg/kg) in healthy adult subjects: a randomized, double-blind, crossover, placebo-controlled, single-centre study. Clin Drug Investig 2010; 30: 867-874.
- Flockton EA, Mastronardi P, Hunter JM, et al. Reversal of rocuronium-induced neuromuscular block with sugammadex is faster than reversal of cisatracurium-induced block with neostigmine. Br J Anaesth 2008; 100: 622-630.
- de Kam PJ, van Kuijk J, Prohn M, et al. Effects of sugammadex doses up to 32 mg/kg alone or in combination with rocuronium or vecuronium on QTc prolongation: a thorough QTc study. Clin Drug Investig 2010; 30: 599-611.
- Menéndez L, Ortiz JR, Olaguibel JM, Salvador MJ. Allergy to low dose sugammadex. Anaesthesia 2011; 66: 217-219.
- Zhang MQ. Drug-specific cyclodextrins: the future of rapid neuromuscular block reversal? Drugs Future 2003; 28: 347-354.
- Zwiers A, van den Heuvel M, Smeets J, Rutherford S. Assessment of the potential for displacement interactions with sugammadex: a pharmacokinetic-pharmacodynamic modelling approach. Clin Drug Investig 2011; 31: 101-111.
- Donati F. Sugammadex: an opportunity for more thinking or more cookbook medicine? (Editorial). Can J Anesth 2007; 54: 689-695.
- de Boer H, Driessen JJ, van Egmond J, Booij LHDJ. Non-steroidal neuromuscular blocking agents to re-establish paralysis after reversal of rocuronium-induced neuromuscular block with sugammadex. Can J Anaesth 2008; 55: 124-125.
- de Boer HD, van Egmond J, van de Pol, et al. Sugammadex, a new reversal agent for neuromuscular block induced by rocuronium in anaesthetized Rhesus monkey. Br J Anaesth 2006; 96: 473-479.
- Bom A, Hope F. Neuromuscular block induced by rocuronium and reversed by the encapsulating agent Org 25969 can be re-established using the non-steroidal neuromuscular blockers succinylcholine and cis-atracurium: A-457. Eur J Anaesthesiol 2005; 22: 120.
- Miller RD. Sugammadex: An Opportunity to Change the Practice of Anesthesiology (Editorial). Anesth Analg 2007; 104: 477-478.
- Naguib M. Sugammadex: Another Milestone in Clinical Neuromuscular Pharmacology. Anesth Analg 2007; 104: 575-581.
- Kopman AF. Sugammadex: a revolutionary approach to neuromuscular antagonism (Editorial). Anesthesiology 2006; 104: 631-633.
- Ballantyne JC, Chang Y. The impact of choice of muscle relaxant on postoperative recovery time: a retrospective study. Anesth Analg 1997; 85: 476-482.
- Karcioglu O, Arnold J, Topacoglu H. Succinylcholine or rocuronium? A meta-analysis of the effects on intubation conditions. Int J Clin Pract 2006; 60: 1638-1646.
- Benumof JL, Dagg R, Benumof R. Critical hemoglobin desaturation will occur before return to an unparalyzed state following 1 mg/kg intravenous succinylcholine. Anesthesiology 1997; 87: 979-982.
- Hayes AH, Breslin DS, Mirakhur RK. Frequency of haemoglobin desaturation with the use of succinylcholine during rapid sequence induction of anaesthesia. Acta Anaesthesiol Scand 2001: 45: 746-749.
- Grayling M, Sweeney BP. Recovery from neuromuscular: a survey of practice. Anaesthesia 2007; 62: 806-809.
- Nava AA, Ramírez JC, Moyao D, et al. Preferences of Mexican anesthesiologists for vecuronium, rocuronium and other neuromuscular blocking agents: a survey. BMC Anesthesiology 2002; 2: 2.
- Cammu G, De Witte J, De Veylder J, et al. Postoperative residual paralysis in outpatients versus inpatients. Anest Analg 2006; 102: 426-429.
- Naguib M, el-Gammal M, Daoud W, et al. Human plasma cholinesterase for antagonism of prolonged mivacurium-induced neuromuscular blockade. Anesthesiology 1995; 82: 1288-1292.
- Naguib M, Selim M, Bakhamees HS, et al. Enzymatic versus pharmacologic antagonism of profound mivacurium-induced neuromuscular blockade. Anesthesiology 1996; 84: 1051-1059.
- Belmont MR, Horochiwsky Z, Eliazo RF, Savarese JJ. Reversal of AV430A with cysteine in Rhesus monkeys. Anesthesiology 2004; 101: A1180.
- Ackerman AG, Russ S, Puttick N, Kessell G. Availability and storage of sugammadex for emergency use. Anaesthesia 2011; 66: 139-140.
