Rafael Dalmau 1
Recibido: —
Aceptado: —
©2019 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 48 Núm. 3 pp. 205-207|https://doi.org/10.25237/revchilanestv48n03.02
PDF|ePub|RIS
Distribution and relationship of ventricular preload with blood volume
En su reciente trabajo, Jankelevich y cols.[1], estudian el efecto hemodinámico de la posición de Trendelenburg- una conocida maniobra postural comúnmente empleada en el ámbito perioperatorio, junto con su “prima hermana”, la “sobreelevación pasiva de piernas”. Esta última ha sido objeto de particular interés en la última década como herramienta no invasiva en la predicción de la “respuesta a fluidos”, como es citado en el artículo.
Los autores, sin embargo, analizan el efecto, por así decirlo, “intrínseco” y específico de la maniobra, sin mediar alguna otra intervención: el incremento o variación del gasto cardíaco. Como es explicado, esta respuesta es esperada como consecuencia de la re-distribución central del volumen sanguíneo con la posición cefálico-declive y el reclutamiento de volumen de fin de diástole ventricular (VFD), evaluado mediante ecografía.
Como resultado, se obtiene un incremento no estadísticamente significativo de la precarga y gasto cardíacos, considerándose ésta una respuesta normal y predecible en individuos sanos, normovolémicos y en estado vigil[1]. Finalmente, se hace hincapié en el sistema venoso como el segmento de la vasculatura periférica que determina o “gobierna” la distribución del volumen sanguíneo entre la circulación central y periférica- una renombrada función de “reservorio” que media, o amortigua, los cambios en la volemia y la precarga ventricular[2].
Encuentro este ensayo particularmente interesante desde un punto de vista, a la vez práctico y conceptual. En primer lugar, el hallazgo de los autores concuerda con la línea investigativa de autores como Bundgaard-Nielsen y cols.[3], quienes en una serie de ensayos y revisiones sobre el tema, demostraron que en la posición supina, en reposo, el corazón opera en la “meseta” de la curva de función ventricular de Starling; lo cual explica la imposibilidad de reclutar mayor volumen de fin de diástole.
Por otro lado, este estado “basal” de referencia hace a una definición funcional de aquello que llamamos “normovolemia”[4 ]. Esto es, el volumen sanguíneo “normal” no solo es definido por parámetros prefijados relacionados con esta variable (parámetros antropométricos, y estado fisiológico del individuo) sino que también adopta un aspecto hemodinámico, es decir, relacionado con la circulación del mismo.
Así, la distribución del volumen sanguíneo es el parámetro que define, funcionalmente, la normovolemia; y el punto de referencia de una distribución óptima lo dicta el volumen vascular central al determinar el volumen de llenado cardíaco, y por tanto la posibilidad de aumentar el flujo[2]-[4].
En este sentido, la evaluación de la precarga ventricular, ya sea por métodos “manométricos” o “volumétricos”, debe orientarse no solo a la estimación de las condiciones de carga cardíacas aisladamente, sino en el contexto del “estado volémico” en particular. Por ejemplo, una medición del volumen de fin de diástole anormalmente elevada puede deberse a un estado de hipervolemia, falla cardíaca o estados de bajo flujo, o a una posición de declive cefálico exagerada (vale recordar que el progresivo aumento del volumen cardíaco estará siempre limitado por la membrana pericárdica); mientras que un volumen bajo podría acompañarse de una marcada hipovolemia, posición cefálico-proclive, estados de flujo elevado, restricciones pleuro-pericárdicas, o miocardiopatía restrictiva.
En cualquier caso – sea la distribución flujo-dependiente o hidrostática – el diagnóstico diferencial entre normo- y mal-distribución de la volemia estará guiado por el contexto clínico, o a través de la medición directa del volumen sanguíneo.
Sin embargo, un análisis completo de la precarga cardíaca -esto es, que contemple tanto el volumen con la presión de llenado ventricular* -es necesario para definir el “estado de precarga” actual, que a la vez aportará información sobre el “estado volémico” acompañante. Por ejemplo, no es lo mismo un VFD anormalmente bajo acompañado de una presión de fin de diástole (PFD) también baja (hipovolemia, posición cefálico-proclive, gasto cardíaco elevado) o elevada (taponamiento pericárdico, miocardiopatía restrictiva); cada caso es fundamentalmente diferente, y demanda soluciones diferentes.
Volviendo sobre el trabajo de Jankelevich y cols., la medición simultánea de la PFD hubiera resultado interesante en este sentido -si bien no sería factible para el caso de un ensayo con voluntarios en donde se realicen mediciones y maniobras no invasivas. La PFD hubiera reflejado, para cada caso, el estado de su volemia y/o de su reserva de precarga.
Finalmente, los autores mencionan la importancia relativa de diversos lechos vasculares de diferente compliancia y tamaño en la repercusión sobre la precarga y gasto cardíacos luego de maniobras posturales, y de la activación de reflejos cardiovasculares y liberación de sustancias vasoactivas. No obstante, dada la magnitud de la maniobra es probable que los cambios hemodinámicos registrados simplemente hayan sido consecuencia del efecto pasivo de la gravedad sobre la distribución del volumen sanguíneo. A su vez, si bien los lechos esplácnico y cutáneo tienen mayor tamaño y compliancia, la capacitancia de los segmentos vasculares caudales (pelvis y miembros inferiores) no debe ser subestimada (particularmente durante las maniobras posturales); experimentos clásicos con presión negativa caudal, aún en decúbito supino, han demostrado que el secuestro de volumen sanguíneo en estos segmentos puede ser lo suficientemente significativa como para disminuir el volumen y presión vascular central a valores sub atmosféricos, y por lo tanto, el gasto cardíaco en reposo (Figura 1) [5], un claro ejemplo de distribución hidrostática útil para simular la pérdida del tono vasomotor en prácticas anestésicas cotidianas.
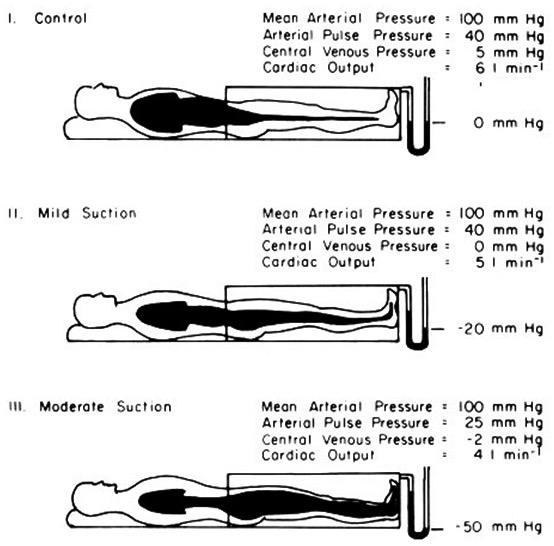
Figura 1. Ilustración esquemática de la distribución del volumen sanguíneo (representada por el área en color negro) en individuos sanos en reposo bajo presión negativa caudal. La volemia se distribuye caudalmente a medida que se incrementa la presión de succión (de 0, a -20, hasta -50 mm Hg), y acorde a ello las presiones de llenado ventricular y el gasto cardíaco caen. Nótese el marcado efecto sobre la presión de llenado en el panel inferior, donde la misma se torna subatmosférica (-2 mm Hg). La presión arterial media se mantiene constante (100 mm Hg) debido a la acción del reflejo baro-receptor. “Control”: control; “Mild Suction”: succión ligera; “Moderate Suction”: succión moderada; “Mean Arterial Pressure”: Presión Arterial Media; “Arterial Pulse Pressure”: Presión de Pulso Arterial; “Central Venous Pressure”: Presión Venosa Central; “Cardiac Output”: Gasto Cardíaco. Extraído de Ref. 5.
En conclusión, existe una relación funcional entre la precarga ventricular y la volemia, y la misma está mediada por la distribución del volumen sanguíneo, la cual puede ser hidrostática o hemodinámica, o ambas.
* La opción entre medidas de la precarga ventricular generalmente recae sobre las mediciones “volumétricas” (esto es, el volumen de fin de diástole, VFD) -preferentemente mediante ultrasonido, que es considerado actualmente el gold standard– sobre la base de que el volumen refleja el grado de estiramiento de la fibra miocárdica, sobre el cual opera el conocido mecanismo de Frank-Starling. No obstante, desde un punto de vista hemodinámico (y para la evaluación de la precarga en sí misma), la presión de fin de diástole (PFD) es igualmente relevante ya que conforma “la otra cara” de la función: la relación presión-volumen de fin de diástole. En otras palabras, la precarga está dada por la relación funcional entre ambas variables, presión y volumen.
Referencias
1. Jankelevich A, Cabrera MC, González C, Castillo F, de la Maza J. La posición de Trendelenburg no cambia el gasto cardíaco en voluntarios sanos. Rev Chil Anest 2019. https://doi.org/10.25237/revchilanestv48n02.09.
2. Dalmau R. Hacia un abordaje funcional del volumen sanguíneo en la hemodinámica clínica. Rev Chil Anest. 2018;47(3):160–5. https://doi.org/10.25237/revchilanestv47n03.02.
3. Rowell LB. The Venous System. Human Circulation. Regulation During Physical Stress. New York: Oxford Univ. Press; 1986. p. 60.
4. Truijen J, Bundgaard-Nielsen M, van Lieshout JJ. A definition of normovolaemia and consequences for cardiovascular control during orthostatic and environmental stress. Eur J Appl Physiol. 2010 May;109(2):141–57. https://doi.org/10.1007/s00421-009-1346-5 PMID:20052592
5. Rowell LB. Adjustments To Upright Posture And Blood Loss. Human Circulation. Regulation During Physical Stress. New York: Oxford Univ. Press; 1986. p. 149.

 ORCID
ORCID
 Creative Commons Attribution
Creative Commons Attribution