Ricardo Bustamante B. 1 , Clara Luxoro V. 1
Rev Chil Anest Vol. 39 Núm. 1 pp. 36-52|doi:
PDF|ePub|RIS
Introducción
La cantidad de terminología en relación al tema ALERGIA es tal, que Nebeker 1 ha tratado de clarificar esto que el mismo ha llamado una Torre de Babel: algunas definiciones y términos han cambiado, algunas categorías han pasado a ser obsoletas, mientras que otras nuevas han emergido. Esto refleja en parte el mejor entendimiento del área de la inmunología clínica.
Lo más aceptable en la actualidad es no hablar de alergia a drogas, sino de reacción adversa a drogas (RAD): “Cualquier efecto lateral nocivo inexplicable y no deseado, secundario a la administración de una droga, que ocurre con dosis utilizadas habitualmente como prevención, diagnóstico y/o tratamiento” 2 . Sería una buena costumbre reemplazar en la hoja de evaluación anestésica el ítem que habitualmente se denomina “reacciones alérgicas” por el término más amplio “reacciones adversas a drogas”.
Durante la anestesia general, y en menor grado durante la anestesia regional, el anestesiólogo administra varios fármacos y sustancias que pueden ocasionar reacciones adversas a drogas, que caen en dos grandes categorías:
-
Reacciones generalmente dosis dependiente y relacionadas con las propiedades farmacológicas de la droga y/o sus metabolitos.
-
Reacciones no relacionadas con las características farmacológicas de la droga y que tienen una menor relación con la dosis.
Estas reacciones incluyen: intolerancia a drogas, reacciones idiosincráticas, alergia inducida por drogas mediada inmunológicamente y alergia inducida por drogas no mediada inmunológicamente 3 .
Los términos anafiláctico y anafilactoídeo fueron usados inconsistentemente en la literatura. El término reacción anafiláctica estaba reservado a las reacciones cuyo mecanismo inmunológico había podido ser demostrado. El término reacción anafilactoídea en cambio, se reserva habitualmente para un cuadro clínico que puede ser similar, con un espectro que va desde signos clínicos menores a una gran severidad, pero en que el mecanismo inmunológico no había podido ser confirmado.
Como se trata de términos usados por especialistas de las distintas ramas de la medicina en todo el mundo, en 2003 el Comité de Revisión de Nomenclatura de la WAO (World Allergy Organization), propuso una actualización de la terminología aceptada hasta entonces por la EAACI (European Academy of Allergy and Inmunology) 4 . Los anestesiólogos no podemos marginarnos de esta nueva terminología. Desde entonces, las reacciones de tipo anafiláctico deben ser reclasificadas en anafilaxias alérgicas y no alérgicas. A su vez, las reacciones anafilácticas alérgicas se subclasifican en mediadas por IgE y no mediadas por IgE.
La anafilaxia o reacción anafiláctica es una reacción de hipersensibilidad severa, generalizada o sistémica que pone en riesgo la vida. Debe usarse el término anafilaxia alérgica cuando la reacción es mediada por un mecanismo inmunológico (mediada generalmente por IgE). Una anafilaxia derivada de cualquier otra causa que no sea inmunológica debe denominarse anafilaxia no alérgica, también llamada pseudoalérgica o anafilactoídea. Ambas son el resultado de la liberación de mediadores preformados y nuevamente sintetizados en mastocitos y basófilos.
Fisiopatología
Entre el 60% y 70% de las anafilaxias alérgicas durante la anestesia son mediadas por IgE, y corresponden a una reacción de hipersensibilidad inmediata de Tipo I según la clasificación de Gell y Coombs. El resto es mediado por IgG y complejos inmunes relacionados con el complemento.
En las anafilaxias no alérgicas, el cuadro clínico es el resultado de la estimulación directa, farmacológica o ‘tóxica’ de mastocitos y basófilos, causando la liberación de mediadores inflamatorios.
-
I-Anafilaxia mediada por IgE
En un contacto inicial de una persona susceptible con un antígeno o una sustancia de estructura química similar, se producen IgE específicas. Las IgE son anticuerpos bivalentes, sintetizados por células plasmáticas, que circulan hasta unirse a receptores específicos de alta afinidad denominados Fce RI, ubicados en la membrana celular de los mastocitos y basófilos, así como a receptores de débil afinidad denominados Fce RII, ubicados en la superficie de las plaquetas y eosinófilos. En un contacto ulterior, el antígeno incriminado es reconocido por estos anticuerpos inmunoespecíficos de tipo IgE y se unen en forma cruzada a dos de sus moléculas. Esto desencadena la degranulación de mastocitos y basófilos y la liberación de una serie de mediadores químicos, responsables de las manifestaciones clínicas de la reacción anafiláctica.
Los mastocitos y basófilos se originan y maduran en la médula ósea y juegan un rol determinante en los mecanismos fisiopatológicos de la alergia. Comparten muchas propiedades, pero también sensibles diferencias que confieren a los mastocitos un rol particular en el compromiso cardíaco de la anafilaxia. Los mastocitos se marginan posteriormente en el tejido conjuntivo, mientras que los basófilos circulan en la sangre pasando a los tejidos como parte de la respuesta inflamatoria. Ambos se caracterizan por tener gránulos citoplasmáticos que contienen histamina preformada. La unión de un antígeno con dos anticuerpos en la membrana de un mastocito genera la activación inmunológica de ésta, induciendo la movilización de sus gránulos citoplasmáticos hacia la membrana celular y liberación de su contenido (Figura 1).
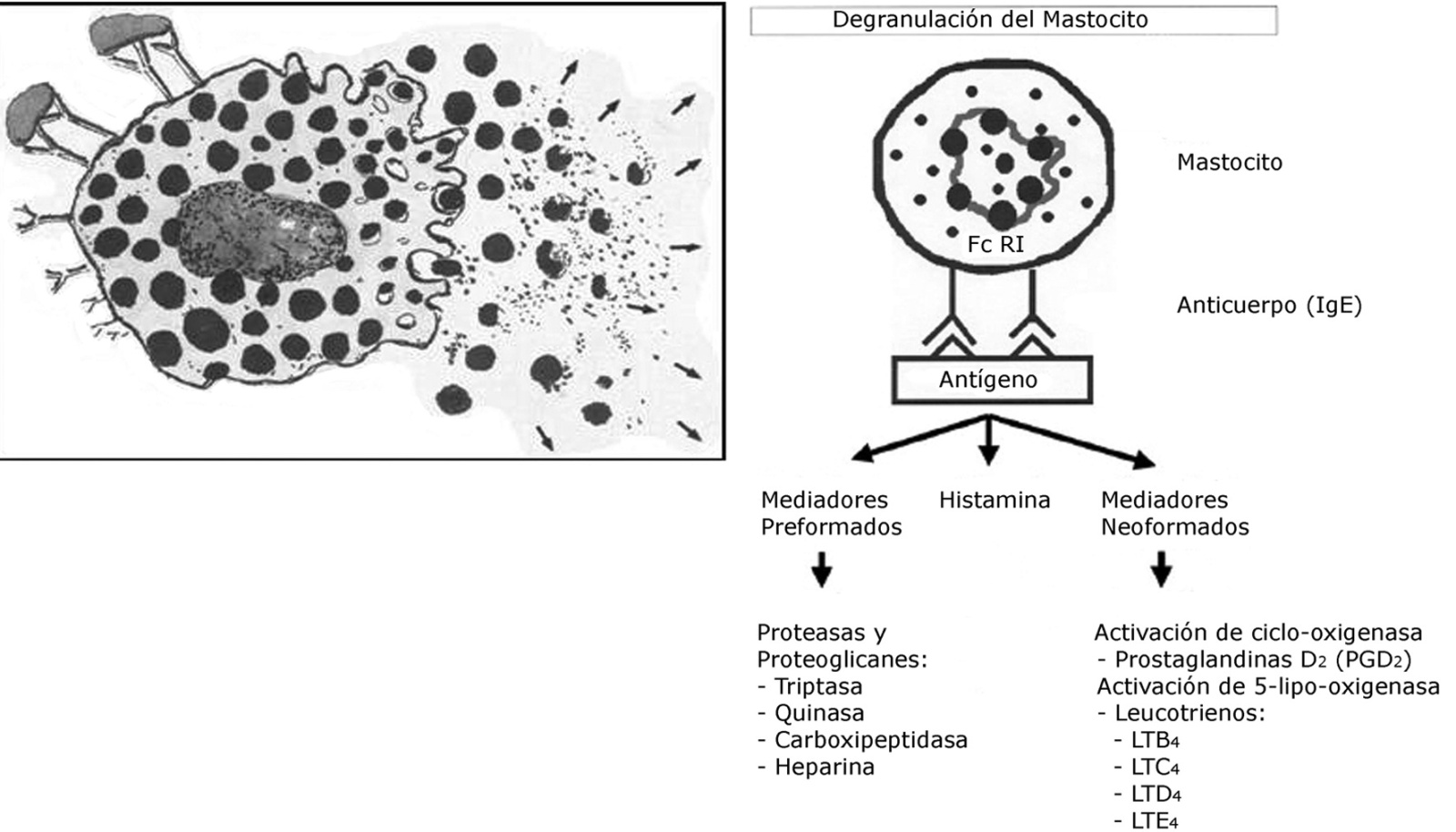
Figura 1 La activación inmunológica de los mastocitos y basófilos induce movimiento de los gránulos citoplasmáticos hacia la membrana celular y liberación de su contenido, compuesto por histamina, mediadores preformados y mediadores neoformados.
La histamina es uno de los principales mediadores liberados en una reacción anafiláctica 5 . La histamina actúa en diferentes tejidos a nivel de la familia de receptores H 1 , H 2 y H 3 , donde su ubicación explica los fenómenos observados. La estimulación de los receptores H 1 y H 2 arteriolares y miocárdicos parece ser responsable de una gran parte de la sintomatología observada: vasodilatación, taquicardia, aumento de la contractilidad miocárdica, exageración del automatismo normal y aparición de un automatismo anormal, enlentecimiento de la conducción AV normal, disminución del umbral de fibrilación ventricular y broncoconstricción.
Sin embargo, no sólo se produce liberación de histamina, sino también la de mediadores preformados almacenados en los gránulos citoplasmáticos y la síntesis de mediadores neoformados, sintetizados y liberados en respuesta a la activación celular.
Entre los mediadores preformados están los de la familia de las proteasas y los proteoglicanos: triptasa, quinasa, carboxipeptidasa y heparina. Entre los mediadores neoformados, se produce fundamentalmente la estimulación de la síntesis de metabolitos lipídicos 6 : la activación de la ciclo-oxigenasa conduce a la producción de prostaglandinas D 2 (PGD 2 ) por los mastocitos y de tromboxano A 2 (TXA 2 ) por las plaquetas; la activación de la 5-lipo-oxigenasa desencadena la producción de leucotrienos LTB 4 , LTC 4 , LTD 4 y LTE 4 . También se ha implicado en la configuración del cuadro clínico de la anafilaxia el factor activador de las plaquetas, la serotonina, la bradikinina, la calcitonina y el óxido nítrico (NO) 7 .
Los efectos de la histamina, asociados a los de los otros mediadores preformados y neoformados pueden llevar al shock anafiláctico, la manifestación clínica más grave de la anafilaxia. La hipótesis de una posible acción miocárdica ha sido ampliamente apoyada por varios estudios experimentales en animales, pero cuyos resultados son generalmente difíciles de extrapolar al ser humano. La ocurrencia de arritmia, angor o infarto del miocardio observada en clínica humana puede ser primaria o resultar de hipoxia, de hipotensión o incluso ser la consecuencia de medicamentos usados como tratamiento del shock. La situación se complica aún más si hay una patología cardíaca subyacente o el paciente está en tratamiento con bloqueadores beta adrenérgicos 8 .
Los datos experimentales sugieren una modificación de la biosíntesis y de la producción de óxido nítrico en el transcurso de un shock anafiláctico. Lamentablemente, la inhibición de la mayor producción de óxido nítrico en animales de experimentación produce resultados contradictorios en diferentes especies 8 .
-
II-Anafilaxia mediada por IgG
La anafilaxia alérgica producida por algunas sustancias como los dextranos, puede ser causada por anticuerpos IgG que producen complejos inmunes con el antígeno (macromoléculas de dextrano), activando de esta manera el sistema de complemento 9 .
-
III-Activación del complemento
El complemento puede ser activado por la vía alternativa a nivel de C3, que conduce a la producción de anafilatoxinas C3a y C5a, responsables de anafilaxias no alérgicas, o por la vía clásica. La vía alternativa, de origen no inmunológico, está relacionada con la génesis de ciertas reacciones anafilácticas no alérgicas relacionadas con los medios de contraste yodados. La activación por la vía clásica, puede ser de origen no inmunológico o inmunológico, como se ha demostrado en productos como los dextranos o la protamina. En general, la activación del complemento no tiene mucha implicancia con los productos usados actualmente en anestesia.
-
III-Anafilaxia no alérgica
Las reacciones anafilácticas no alérgicas no son mediadas inmunológicamente, sino que gatilladas químicamente, independientemente de los anticuerpos IgE. Al no involucrar un mecanismo inmunológico, no es necesario un contacto previo con la sustancia. Derivan de la activación del complemento y/o de la cascada de bradikinina y de la activación directa de los mastocitos y basófilos. Las manifestaciones clínicas de las reacciones anafilácticas no alérgicas pueden ser indistinguibles de las que originan las reacciones anafilácticas alérgicas, pero tienden a ser menos generalizadas.
Muchos fármacos usados durante la anestesia, de diversa estructura molecular, desencadenan la degranulación de mastocitos y la liberación de histamina en forma proporcional a la dosis, con un mecanismo no inmunológico (que no necesita la mediación de anticuerpos ni el contacto previo).
Los medicamentos responsables de liberación inespecífica de histamina son generalmente compuestos básicos cargados positivamente, que inducen liberación de histamina por acción directa a nivel de la membrana de los mastocitos y basófilos 10 . Este fenómeno es facilitado por la presencia de antecedentes atópicos, por la velocidad de inyección y por la hiperosmolaridad del producto.
La sintomatología clínica de la liberación inespecífica de histamina es generalmente menos severa que la de una reacción inmunológica, pues la cantidad de histamina liberada es menor y la liberación de otros mediadores es excepcional. La respuesta clínica no es homogénea, debido a la diversidad de respuesta de los mastocitos según los sitios anatómicos y los productos administrados 11 .
El ejemplo más típico en anestesia son los BNM del grupo de las bencilisoquinolinas, especialmente el atracurio y el mivacurio, pues el cisatracurio no produce liberación de histamina en las dosis usadas en clínica. Otros productos implicados son la protamina, los opiáceos, especialmente la morfina, petidina y codeína, ciertos antibióticos como la vancomicina 12 y algunos agentes de inducción como el tiopental 13 y propofol 14 .
Incidencia
La tasa exacta de la anafilaxia en anestesia es difícil de estimar; la incidencia y los mecanismos son diversos en los diferentes países. En Chile, no hay estadísticas. Las publicaciones más sistemáticas y serias en relación a este tema provienen especialmente de Francia, Australia, Nueva Zelanda, el Reino Unido y los países Escandinavos. La marginación o minimización de los hechos en Estados Unidos, hace sospechar un conflicto de intereses con la industria farmacéutica 15 . Se reporta 1 reacción anafiláctica alérgica y no alérgica por cada 3.500 a 1 por 13.000 anestesias en Francia, 1 por cada 5.000 a 1 por 20.000 anestesias en Australia, 1 por cada 1.250 a 1 por 5.000 en Nueva Zelandia, 1 por cada 3.500 en Inglaterra y 1 por cada 5.000 en Tailandia 16 – 21 .
Si se considera sólo la incidencia de las reacciones anafilácticas mediadas inmunológicamente, que habitualmente corresponden al 60% de todas las reacciones observadas en el período perioperatorio, los reportes son de 1 en 10.000 a 1 en 20.000 en Australia, 1 en 13.000 en Francia, 1 en 10.263 en España, 1 en 5.500 en Tailandia y 1 en 17.000 a 1 en 20.000 en Noruega 22 – 24 .
La incidencia de anafilaxia exclusivamente a los BNM se evalúa entre 1/5.200 24 a 1/6.500 17 anestesias en que se haya usado estos fármacos.
Durante el período perioperatorio la mortalidad del total de reacciones anafilácticas es de un 3% a un 10% de los casos 25 y un grupo adicional de un 2% de pacientes queda con daño neurológico significativo 26 .
Sin embargo, la verdadera incidencia de las reacciones anafilácticas, su morbilidad y su mortalidad asociada están probablemente subvaloradas, debido a la incertidumbre sobre la exactitud de los reportes y a la dificultad de la identificación del mecanismo inmunológico de la reacción.
Cuadro Clínico
La anafilaxia durante la anestesia puede presentarse de muchas maneras y los signos y síntomas difieren de cierta manera de aquellos que no están asociados a la anestesia. Pueden estar enmascarados por hipovolemia, los diferentes niveles de profundidad de la anestesia o la extensión de un bloqueo regional. Los signos cutáneos, que son frecuentes, pueden quedar ocultos por los campos quirúrgicos.
Un estudio realizado en 42 anestesistas con experiencia ayudados por un instructor en Dinamarca, que fueron confrontados en un simulador a una reacción anafiláctica demostró que ninguno de ellos pudo diagnosticar el cuadro en los 10 primeros minutos, y sólo el 25% logró hacerlo después de 15 minutos 27 .
El cuadro clínico puede clasificarse de acuerdo al grado de la lesión en 28 :
Grado I. Signos cutáneomucosos generalizados: eritema, urticaria con o sin edema angioneurótico.
Grado II. Daño multivisceral moderado, con signos cutáneomucosos, hipotensión y taquicardia moderada, hiperactividad bronquial (tos, disnea).
Grado III. Daño multivisceral severo, con riesgo vital, que impone una terapia específica agresiva (colapso cardiovascular, taquicardia o bradicardia, arritmias, broncoespasmo). Los signos cutáneos pueden estar ausentes, o aparecer sólo después de la recuperación de la presión arterial.
Grado IV. Colapso cardiocirculatorio. Paro respiratorio.
Grado V. Muerte por fracaso de la RCP.
El cuadro clínico de una reacción anafiláctica alérgica y no alérgica puede ser indistinguible, por lo que el diagnóstico diferencial no puede hacerse en base a la presentación clínica, sino de laboratorio. Por razones inexplicables, las reacciones a BNM y antibióticos parecen ser más severas que las reacciones al látex. La muerte por reacción anafiláctica al látex sigue siendo un evento muy raro.
Los síntomas tienden a ser más severos en las reacciones anafilácticas alérgicas. Aunque pueden observarse reacciones anafilácticas alérgicas grado I y II, la mayoría de las reacciones anafilácticas alérgicas son grado II (23%) o III (60%), mientras que la mayoría de las reacciones anafilácticas no alérgicas son grado I (55%) o II (30%). De este modo, los signos cutáneos son más frecuentes en las reacciones no alérgicas, mientras que el colapso cardiovascular y el broncoespasmo son más frecuentes en las reacciones alérgicas 29 . Hay reacciones anafilácticas alérgicas grado I, pero no hay reacciones anafilácticas no alérgicas grado IV (Figura 2).
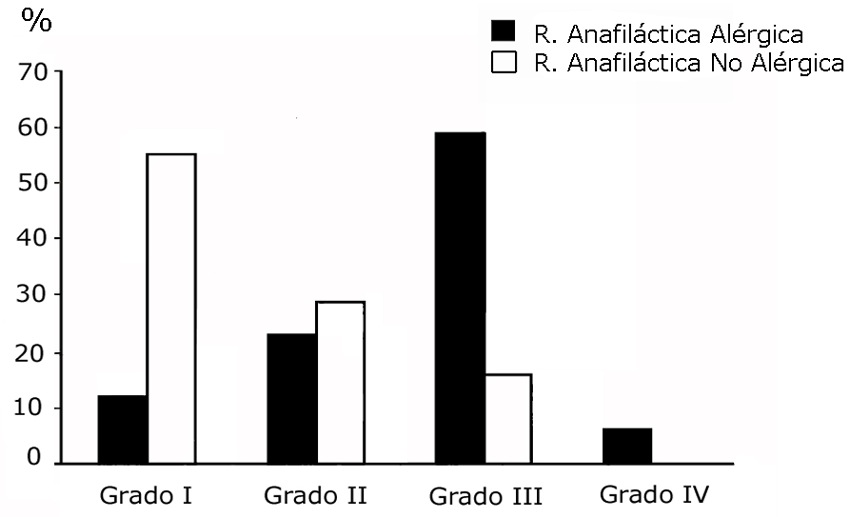
Figura 2 Grados de severidad clínica de las reacciones anafilácticas alérgicas y no alérgicas (anafilactoídeas) durante la anestesia 29.
Las manifestaciones clínicas de una anafilaxia pueden ocurrir en cualquier momento durante la anestesia, pero lo más común es que sea dentro de los primeros minutos de la inducción de la anestesia. El 77,5% sobrevienen en el momento de la inducción, el 16% en el transcurso de la anestesia y el 6,5% al final del procedimiento 28 . De este modo, la mayor parte están relacionadas con los agentes endovenosos usados durante la inducción 30 , 31 . Esto constituye la primera dificultad en la identificación del agente ya que durante la inducción de la anestesia el paciente es expuesto a una serie de agentes en un corto período, incluyendo antígenos visibles como inductores, opioides, antibióticos y BNM, así como preservativos/aditivos de algunos medicamentos (cromofor, metilparabeno). La aparición de las manifestaciones ocurridas después de la administración de un fármaco aislado o un coloide endovenoso durante la mantención de la anestesia hace que sea más fácil relacionar el cuadro clínico con el agente causal.
En otras oportunidades sin embargo, la sintomatología puede ocurrir después de 30 a 60 minutos, y están relacionadas con agentes administrados por otras vías (piel, mucosa, peritoneo o subcutánea) 32 . Es el caso del látex, la clorohexidina y el azul patente. No obstante, estas reacciones también pueden ocurrir precozmente 33 ; en pacientes alérgicos al látex, puede observarse broncoespasmo muy inicialmente en la sala de operaciones en pacientes sensibilizados. La anafilaxia a coloides puede ocurrir inmediatamente o tener un inicio más lento.
En el 91% de los casos se trata de una anestesia general y sólo en el 9% de una anestesia regional. En el 3% de los casos la anestesia fue realizada en condiciones de urgencia 29 .
Los signos clínicos iniciales reportados más frecuentemente son la ausencia de pulso, rush cutáneo, dificultad en la ventilación, desaturación y baja inexplicable de la ETCO 2 34 . . Las manifestaciones más severas pueden comprometer un solo signo: la mayoría de las veces colapso cardiovascular o signos cutáneos.
Un estudio en Francia de los síntomas ocurridos a 477 pacientes entre 1977 y 1998, revela que puede presentarse una variedad de signos y síntomas, y en algunos casos puede presentarse un solo síntoma (Tabla 1) 35 . Una anafilaxia restringida a un solo signo puede hacer pensar en otros diagnósticos, porque muchas otras condiciones patológicas pueden presentar manifestaciones clínicas similares 36 . Se ha reportado la aparición de un súbito paro cardíaco como único signo clínico en 29 de 491 reacciones anafilácticas mediadas por IgE 29 . En casos moderados (broncoespasmo moderado, taquicardia con hipotensión), puede ocurrir una recuperación espontánea sin tratamiento alguno, lo que puede implicar una falta de diagnóstico y una eventual reexposición.
Tabla 1 Variedad de síntomas que puede aparecer en una reacción anafiláctica en un estudio francés realizado en 477 pacientes 35. El colapso cardiovascular y los signos cutáneos ocurren más frecuentemente como único signo clínico
| Signos Clínicos |
N° de Pacientes |
Porcentaje |
(%) N° de Pacientes (Síntoma único) |
| Cardiovasculares: | |||
| – hipotensión |
85 |
17,8 |
10 |
| – colapso |
256 |
53,7 |
40 |
| – bradicardia |
10 |
2,1 |
|
| – paro cardíaco |
19 |
4,0 |
|
| Broncoespasmo: |
211 |
44,2 |
15 |
| Síntomas cutáneos: |
332 |
69,6 |
37 |
| Edema: |
56 |
11,7 |
-
I-Manifestaciones cutáneo-mucosas
Se trata generalmente de los primeros signos clínicos. Tienen mucha prevalencia, aunque pueden faltar, especialmente cuando hay concomitantemente un estado de shock con colapso vascular. Ocurren manifestaciones cutáneas en el 63% de las anafilaxias mediadas por IgE y en el 93% de las anafilaxias no mediadas por IgE 29 . La ausencia de signos cutáneos no excluye el diagnóstico de anafilaxia.
Las primeras manifestaciones comprometen las zonas más ricas en mastocitos (cara, cuello, región anterior del tórax), y luego se generalizan rápidamente 37 . Se trata de un variado tipo de erupciones, a nivel de la superficie de la piel (eritema, erupciones del tipo máculo-pápulas), pero también puede infiltrarse la región profunda (edema de Quincke). El edema de Quincke puede comprometer la laringe y ocasionar obstrucción de la vía aérea en el paciente no intubado o con anestesia regional, pero además de la localización facial clásica, puede comprometer la lengua, las manos e incluso generalizarse.
-
II-Manifestaciones respiratorias
La infiltración edematosa de la mucosa y la contracción de la musculatura lisa bronquial pueden ocasionar una obstrucción respiratoria a diferentes niveles, que se manifiesta clínicamente en el 40% de las anafilaxias documentadas y en el 20% de las anafilaxias no documentadas 29 .
Pueden estar comprometidas la vía aérea superior (rinorrea, obstrucción nasal, tos seca, edema lingual, del paladar blando, de la orofaringe, de la hipofaringe, de la epiglotis o de la laringe) y/o la vía aérea inferior (broncoespasmo, edema pulmonar).
El broncoespasmo es especialmente frecuente en los sujetos asmáticos o que tienen una hiperreactividad bronquial. Si ocurre antes de la inducción, se manifiesta con tos seca, disnea y sibilancias; si ocurre antes de la intubación, puede hacerse difícil o imposible la ventilación con mascarilla y si ocurre en el paciente intubado se traduce en un aumento de la presión de la vía aérea y en una inadaptación completa al respirador que puede incluso dificultar la insuflación manual. Puede ser rebelde al tratamiento clásico, lo que conduce a hipoxemia y/o hipercapnea y eventualmente paro cardíaco anóxico. Los signos son a veces atribuidos a superficialidad anestésica o a intubación esofágica.
Puede ocurrir edema pulmonar como resultado de alteraciones de la permeabilidad capilar, o menos frecuentemente a una disfunción miocárdica.
-
III-Manifestaciones cardiovasculares
El colapso cardiovascular le confiere el nombre al shock anafiláctico. Puede ser el primer y el único signo clínico observado 35 . Las diferentes manifestaciones clínicas (hipotensión, shock, arrritmias y paro cardíaco), ocurren en el 79% de las anafilaxias documentadas y en el 32% de las anafilaxias no documentadas 29 .
El shock anafiláctico representa la manifestación más grave de la anafilaxia y tiene clásicamente 3 fases. Una etapa hiperkinética inicial, asociada a taquicardia y vasodilatación arterial especialmente precapilar (disminución de la postcarga). En una segunda etapa, en ausencia de tratamiento, la vasodilatación se extiende al territorio venoso, produciendo una caída del retorno venoso y de las presiones de llenado de ambos ventrículos; la disminución de la precarga conduce a una disminución del débito cardiaco. Finalmente, si el shock anafiláctico no se trata o se prolonga, se cae en la tercera etapa, en que el cuadro se transforma en un shock hipokinético hipovolémico, secundario a extravasación plasmática transcapilar, con presiones de llenado bajas, débito cardíaco bajo y aumento de las resistencias vasculares sistémicas, que pueden culminar en paro cardíaco. Raramente se observan complicaciones relacionadas con shock prolongado y anoxia, manteniéndose la mortalidad entre un 3% y un 10% 25 .
El shock anafiláctico es clasificado comúnmente como un shock distributivo. El prototipo de shock distributivo es el shock séptico, aunque en cierta medida todos los tipos de shock son distributivos, pues el flujo sanguíneo de algunos órganos (especialmente la musculatura esquelética), disminuye para preservar órganos vitales (corazón y cerebro). Uno de los principales mecanismos de redistribución es la activación del sistema nervioso simpático, que puede contrarrestar la regulación metabólica local del flujo sanguíneo. En un modelo animal, Dewatcher y cols, demostraron que el shock anafiláctico tiene un perfil distributivo caracterizado por un débito cardíaco preservado y una severa vasoconstricción de la musculatura esquelética, así como un gran metabolismo anaerobio secundario a la rápida disminución de la presión tisular de oxígeno (PtiO2 ) 38 .
Se describen trastornos de la excitabilidad y conducción (bradicardia, bloqueo AV, bloqueo de rama, extrasistolía y fibrilación ventricular), así como manifestaciones de isquemia o infarto del miocardio (modificaciones del segmento ST). Puede ocurrir paro cardíaco como producto de una manifestación cardiovascular, sin que exista broncoespasmo o signos cutáneos asociados.
-
IV-Otras manifestaciones
Se trata de manifestaciones digestivas y neurológicas, que pueden pasar desapercibidas en el paciente anestesiado.
Digestivas: hipersialorrea, náuseas, vómitos y dolores abdominales, producto de la contracción de la musculatura lisa del intestino y de la hipersecresión.
Neurológicas: cefalea, compromiso de conciencia, convulsiones, incontinencia de esfínteres y síndrome piramidal bilateral, producto de una anoxia cerebral. Después de terminado el cuadro puede observarse un retardo del despertar o definitivamente un coma anóxico con secuelas graves.
Sustancias Responsables
Todas las drogas y sustancias usadas durante la cirugía y la anestesia, tal vez con la única excepción de los agentes inhalatorios, han sido reportadas como potencialmente causantes de reacciones anafilácticas, incluso aquéllas tan poco probables, como la atropina 39 , o la betametasona 40 . Ninguna premedicación ha sido capaz de reducir la incidencia de reacciones anafilácticas perioperatorias, sin embargo ésta puede disminuirse previniendo las segundas reacciones en pacientes con historia de anafilaxia 41 .
La mayor parte de los agentes usados durante la anestesia se han reportado como responsables de una posible liberación inespecífica de histamina. Dependiendo de la acuciosidad diagnóstica se ha determinado que entre el 8% y el 73% de los pacientes sometidos a anestesia general presentan algún grado de liberación de histamina 42 , 43 .
La identificación del agente es más difícil en las reacciones anafilácticas no alérgicas que en las alérgicas, sin embargo, si se comparan las hojas de anestesia de los pacientes es posible observar ciertas tendencias. El atracurio, clásicamente un liberador de histamina, está más relacionado con reacciones anafilácticas no alérgicas y por el contrario, la succinilcolina y el rocuronio están más relacionados con reacciones anafilácticas alérgicas. Entre los hipnóticos, el propofol está más relacionado con reacciones anafilácticas alérgicas y el pentotal con reacciones anafilácticas no alérgicas. Entre los opiáceos, antibióticos y coloides, no se observan diferencias 29 .
El GERAP (Groupe d’Estudes des Réactions Anafilactoïdes Paranesthésiques), ha realizado 7 estudios documentando la epidemiología de cerca de 5.000 reacciones anafilácticas con riesgo vital en Francia desde 1984. Los grupos de sustancias con mayor incidencia de reacciones anafilácticas perioperatorias, demostradas con exámenes de laboratorio en el último reporte publicado en 2004 por el GERAP, (realizado entre los años 2001-2002) son: los bloqueadores neuromusculares (BNM), el látex y los antibióticos 29 (Figura 3) (Tabla 2).
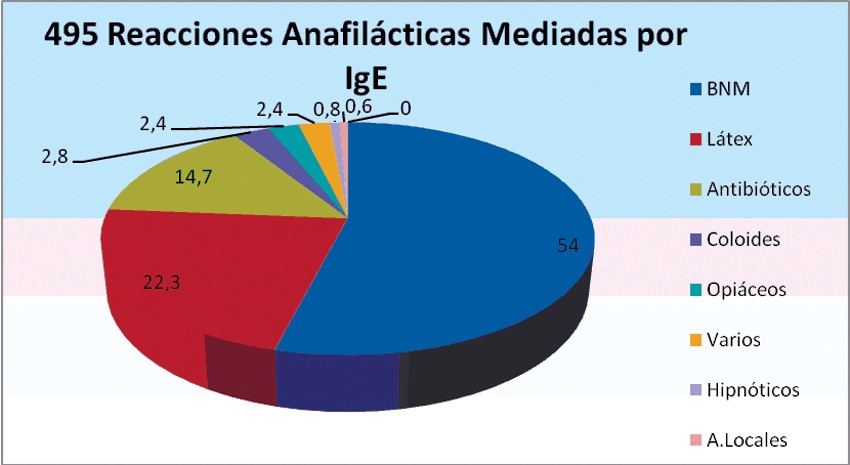
Figura 3 Sustancias implicadas en 495 reacciones anafilácticas, en el último reporte del GERAP durante el bienio 2001-2002 en Francia 29.
Tabla 2 Incidencia relativa de reacciones anafilácticas de las diferentes sustancias implicadas según las 7 encuestas del GERAP. Los agentes más implicados en la última encuesta son los BNM, el látex y los antibióticos 17 ,29,35,37,44 -46
| Substancia |
1984-89 n = 821 (%) |
1990-91 n = 813 (%) |
1992-94 n = 1030 (%) |
1994-96 n = 734 (%) |
1997-98 n = 486 (%) |
1999-00 n = 518 (%) |
2001-02 n = 502 (%) |
| BNM |
81,0 |
70,2 |
59,2 |
61,6 |
69,2 |
58,2 |
54 |
| Látex |
0,5 |
12,5 |
19,0 |
16,6 |
12.1 |
16,7 |
22,3 |
| Hipnóticos |
11,0 |
5,6 |
8,0 |
5,1 |
3,7 |
3,4 |
0,8 |
| Opioides |
3,0 |
1,7 |
3,5 |
2,7 |
1,4 |
1,3 |
2,4 |
| Coloides |
0,5 |
4,6 |
5,0 |
3,1 |
2,7 |
4,0 |
2,8 |
| Antibióticos |
2,0 |
2,6 |
3,1 |
8,3 |
8,0 |
15,1 |
14,7 |
| Otros |
2,0 |
2,8 |
2,2 |
2,6 |
2,9 |
1,3 |
3,0 |
Con el transcurso de los años, la incidencia relativa de los fármacos más reportados como responsables de reacciones anafilácticas intraoperatorias ha ido cambiando en relación a la práctica anestesiológica; el mayor o menor uso de algunas drogas y la aparición u obsolescencia de otras, reflejando su uso en el mercado.
-
I-Bloqueadores neuromusculares
Los BNM pueden inducir dos tipos de reacciones: una de tipo inmunológico, IgE dependiente, con la estructura de amonio cuaternario (NH4+) como principal epítope antigénico 47 , y otra no inmunológica, especialmente relacionada con el grupo de las bencilisoquinolinas, producto de la estimulación no específica de los mastocitos 48 .
La incidencia de reacciones anafilácticas alérgicas a los BNM ha tendido a disminuir en el transcurso del tiempo, probablemente por una indicación más selectiva en el uso de estos fármacos. Esto ha contribuido a aumentar la incidencia de reacciones a otros productos usados durante el acto quirúrgico: el látex (22,3%) y los antibióticos (14,7%).
A pesar de todo, el grupo más implicado sigue siendo el de los BNM: entre el 54% y el 81% según el período observado (Tabla 2). Su incidencia relativa es un reflejo del uso de estos fármacos en el transcurso del tiempo, por lo que en los últimos años se ha producido una desaparición de las reacciones anafilácticas a la galamina, una disminución de las reacciones anafilácticas a la succinilcolina y el vecuronio, y un aumento a drogas más recientemente incorporadas como el rocuronio (Tabla 3 y Figura 4).
Tabla 3 Incidencia relativa de reacciones anafilácticas de los diferentes BNM implicados según las 7 encuestas del GERAP. En la última encuesta, las mayores incidencias son para la succinilcolina, el rocuronio y el atracurio, pero esto debe ser correlacionado con su utilización en clínica 17 , 29 , 35 , 37 , 44 – 46
| BNM |
1984-89 n = 821 (%) |
1990-91 n = 813 (%) |
1992-94 n = 1030 (%) |
1994-96 n = 734 (%) |
1997-98 n = 486 (%) |
1999-00 n = 518 (%) |
2001-02 n = 502 (%) |
| Succinilcolina |
54,3 |
43,0 |
39,3 |
15,3 |
23,2 |
22,6 |
37,6 |
| Vecuronio |
15,3 |
37,0 |
36,0 |
18,8 |
17,6 |
8,5 |
7,0 |
| Pancuronio |
8,7 |
13,0 |
4,8 |
5,9 |
5,9 |
3,3 |
2,6 |
| Atracurio |
0,2 |
6,8 |
14,5 |
15,5 |
21,1 |
19,0 |
23,7 |
| Galamina |
11 |
5,6 |
3,1 |
1,3 |
0 |
0,3 |
0 |
| Alcuronio |
10,5 |
7,6 |
2,3 |
0 |
0 |
0 |
0 |
| Rocuronio |
0 |
0 |
0 |
5,9 |
29,2 |
43,1 |
26,2 |
| Mivacurio |
0 |
0 |
0 |
2,6 |
2,7 |
2,6 |
1,1 |
| Cisatracurio |
0 |
0 |
0 |
0 |
0,3 |
0,6 |
1,8 |
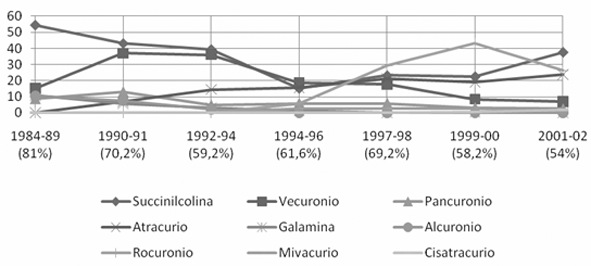
Figura 4 Evolución del porcentaje de incidencia relativa de reacciones anafilácticas a los BNM en Francia en los últimos años. Se señala el período estudiado y el porcentaje que corresponde a BNM entre paréntesis 17 ,29,35,37,44 -46 .
La incidencia debe ser interpretada teniendo en cuenta la utilización de los diferentes BNM en clínica. En Francia, el atracurio es el BNM más utilizado (60%) y contribuye con sólo un 23% de los casos, en tanto que la succinilcolina y el rocuronio que se usa en el 8% y en el 6,5% de los casos tienen una incidencia relativa de un 37% y un 26% respectivamente (Tabla 4) 29 . De este modo, Mertes y Laxenaire clasifican a los BNM en 3 grupos: un grupo de riesgo elevado (succinilcolina y rocuronio), un grupo de riesgo intermedio (vecuronio y pancuronio) y un grupo de bajo riesgo (atracurio, mivacurio y cisatracurio).
Tabla 4 Relación entre el uso de BNM en Francia y la incidencia de reacciones anafilácticas alérgicas
|
Pacientes expuestos (n = 5.721.172) % |
Reacciones anafilácticas (n = 271) % |
|
| Atracurio |
60,3 |
23,7 |
| Cisatracurio |
14,7 |
1,8 |
| Succinilcolina |
8,2 |
37,6 |
| Rocuronio |
6,5 |
26,2 |
| Vecuronio |
4,9 |
7,0 |
| Pancuronio |
1,9 |
2,6 |
| Mivacurio |
3,5 |
1,1 |
| Total |
100% |
100% |
Existe una gran discrepancia en relación a la incidencia de reacciones anafilácticas por rocuronio. Mientras en Estados Unidos 49 ocurre en 1 x 445.000 anestesias, y es donde se usa el 80% de la droga que se produce en el mundo, en Francia es considerado un BNM de riesgo elevado y en Noruega 50 se reporta en 1 x 3.500 anestesias (55 reacciones y 3 muertes en 4 años), lo que llevó incluso a intervenir a la autoridad noruega, recomendando la eliminación del rocuronio de la práctica rutinaria y su uso reservado para las intubaciones de urgencia. Múltiples factores clínicos, metodológicos y estadísticos han contribuido a esta aparente contradicción 51 . Estos factores incluyen una alta incidencia de falsos positivos, el aumento importante del uso de la droga en relación a otros BNM, problemas estadísticos (número pequeño de las muestras por la baja incidencia del evento y sesgos característicos de reporte de efectos secundarios de nuevas drogas) 52 e incluso la posibilidad de diferencias en los genotipos de la población.
Los resultados subevaluados de las reacciones al rocuronio en Estados Unidos se deben probablemente a que los datos se extrajeron de reportes voluntarios de efectos adversos a drogas de la Food and Drug Administration (FDA), en tanto que los reportes sobrevaluados de las reacciones en Noruega pueden deberse a resultados falsos positivos de los métodos diagnósticos utilizados. Hay estudios que sugieren que los prick-tests e intradermorreacciones falsos positivos pueden estar sobreestimando la incidencia del rocuronio en las reacciones anafilácticas, al realizarse con diluciones inadecuadas, lo que pudiera explicar esta discrepancia (prick-test sin dilución (10 mg/ml) e intradermorreacciones con una dilución 1:100 (100 μg/ml). Levy ha demostrado que intradermorreacciones con rocuronio a concentraciones mayores a 1:1.000, producen respuestas claramente positivas en 29 de 30 voluntarios en ausencia de degranulación de mastocitos, por lo que el uso de concentraciones mayores 1:1.000 puede ser la causa de algunos reportes falsos positivos en Europa 53 .
En Australia, usando una dilución de 1:1.000 para las intradermorreacciones, se ha demostrado que el rocuronio tiene un riesgo potencial intermedio de incidencia de anafilaxia y es el resultado del aumento de su uso en clínica 54 .
La incidencia de reacciones a los BNM no mediadas por IgE varía entre un quinto y un tercio de los casos reportados en la mayoría de las series, sin embargo, en un estudio reciente basado en los reportes de efectos adversos del Reino Unido, las reacciones no alérgicas ocurren casi con la misma frecuencia que las alérgicas 55 . El mecanismo preciso de las reacciones no mediadas por IgE es difícil de establecer, pero se presume que son el resultado de una activación directa e inespecífica de mastocitos y basófilos, que produce una liberación de histamina, generalmente menos severa que las reacciones mediadas por IgE. Los BNM que liberan histamina son del grupo de las bencilisoquinolinas: d-tubocurarina, atracurio y mivacurio (el cisatracurio no libera histamina en dosis clínicas). El atracurio tiene una incidencia de efectos secundarios graves por liberación de histamina de un 1% 56 .
-
II-Látex
El látex se ha instalado en los últimos años como la segunda causa de reacciones anafilácticas intraoperatorias: 22,3%. El látex es en forma natural un fluido lechoso que es componente de la mayoría de los guantes usados en el período perioperatorio y de otros productos, como ligaduras venosas, mascarillas faciales, resucitadores y sondas Foley. El cumplimiento de las precauciones impuestas para la prevención del contagio del VIH en los años 80, implicó un aumento del uso de guantes, lo que aumentó su demanda y la fabricación de guantes ricos en proteínas antigénicas, y un secundario aumento de la incidencia de la alergia al látex, que se ha mantenido entre un 15% y un 20% desde los años 90.
Esta cifra sin embargo, parece estar un poco sobreestimada. La incidencia de reacciones al látex es muy dependiente de la población estudiada y del método de diagnóstico utilizado. Un estudio reciente en Noruega indica que representa sólo un 3,6% de los casos de anafilaxia intraoperatoria, donde se ha implementado una estrategia para reducir la exposición al látex 24 .
Estudios hechos en profesionales de la salud, revelan una incidencia de un 10% de niveles de anticuerpos IgE específicos elevados. En anestesiólogos, entre un 12,5% y un 15,8% tienen niveles elevados de IgE, pero sólo un 2,4% tienen sintomatología clínica 57 , 58 .
En Chile, se ha demostrado una incidencia de anticuerpos IgE específicos positivos de un 0,97% en el personal administrativo de la Clínica Dávila, versus un 3,6% en el personal de pabellón 59 .
-
III-Antibióticos
Las penicilinas (PNC) y otros agentes con anillo beta-lactam, como las cefalosporinas, producen reacciones adversas mediadas por mecanismos específicos pero heterogéneos y frecuentemente desconocidos. El mecanismo más común en pacientes con una reacción anafiláctica documentada a PNC es una reacción mediada por IgE, y corresponde a una reacción de hipersensibilidad inmediata de Tipo I.
Aunque la anafilaxia a la PNC sigue siendo excepcional, continúa siendo responsable de alrededor del 75% de las muertes por reacciones anafilácticas en la población general en Estados Unidos 60 . Los pacientes con alergia a la penicilina tienen un riesgo 3 veces mayor de experimentar una reacción anafiláctica a otra droga.
El uso masivo de antibióticos profilácticos y a nivel de la comunidad ha hecho multiplicar por 8 la incidencia de reacciones a este tipo de fármacos desde 1989. La PNC es el antibiótico más frecuentemente responsable de reacciones en Francia y las cefalosporinas en Australia. Consideradas en conjunto, las PNC y cefalosporinas dan cuenta de alrededor del 70% de las reacciones anafilácticas perioperatorias por antibióticos 17 , 29 , 37 .
Existe el concepto generalizado que la PNC es la causa más frecuente de anafilaxia intraoperatoria por antibióticos (1-10%), sin embargo, la gran mayoría de pacientes que dicen ser alérgicos NO LO SON 61 . Un estudio prospectivo demostró que de 1.790 pacientes que dijeron ser alérgicos a la PNC, 57 (3,2%) lo era, y sólo 4 (0,2%) pudieran tener una reacción anafiláctica 62 .
La reacción cruzada entre PNC y cefalosporinas es materia de permanente interés. Se ha reportado un riesgo de reacción cruzada entre las penicilinas y las cefalosporinas, atribuido al anillo beta-lactam que tienen en común, de 8% a 10%, sin embargo, la mayoría de los reportes son sólo eritemas cutáneos de origen no inmunológico y casos antiguos, en que las cefalosporinas estaban contaminadas con pequeñas cantidades de PNC 63 . Un estudio demuestra una incidencia de reacción cruzada de sólo un 1%, recomendando el uso de cefalosporinas en pacientes con antecedentes de alergia a la penicilina, previa administración de una pequeña dosis del antibiótico 64 . La reacción cruzada entre las penicilinas y las cefalosporinas de tercera generación es de 1% a 2% 65 . Secundariamente se mencionan otros antibióticos como la vancomicina y la bacitracina.
La vancomicina se usa cada vez con mayor frecuencia para profilaxis. Aunque se ha reportado reacciones anafilácticas, la gran mayoría de las reacciones adversas observadas por vancomicina, están relacionadas con un fenómeno no inmune asociado a una rápida administración: el síndrome del hombre rojo 66 . La liberación inespecífica de histamina constituye el mecanismo esencial de reacciones a la vancomicina 67 . Su manejo incluye el uso de antihistamínicos, la administración más lenta o la división de la dosis.
-
IV-Otros
La incidencia general de reacciones anafilácticas alérgicas de los expandidores plasmáticos en Francia, es de un 2,8%. Las gelatinas y dextranes están más frecuentemente implicados que la albúmina y los almidones. En los dos últimos estudios realizados en Francia, comprendiendo cuatro años, hay un total de 170 casos reportados: 159 corresponden a gelatinas (94%) y 11 a almidones (6%). No existe reactividad cruzada conocida entre los diferentes coloides 29 . La incidencia de reacciones adversas se ha estimado en 0,275% para los dextranes, 0,099% para la albúmina y 0,058% para el hidroxietilstarch 68 . La liberación inespecífica de histamina también constituye el mecanismo esencial de reacciones que ocurren con las gelatinas con puente de urea (Haemacel) 67 .
La incidencia general de reacciones anafilácticas alérgicas de los opiáceos en Francia es de un 2,4%. Lejos, la mayor incidencia es para la morfina (9 de 12 casos). El resto fue un caso de cada uno de los siguientes opioides: nalbufina, fentanil y sufentanil 29 . La morfina y la meperidina son aminas terciarias que producen liberación inespecífica de histamina dosis dependiente, aunque hay reportes de reacciones mediadas por IgE para estos opioides 69 . El fentanil es una fenilpiperidina que no produce liberación no inmunológica de histamina y muy pocos reportes de reacciones mediadas por IgE. Hay reacciones cruzadas entre los opioides de la misma familia, pero no entre aminas terciarias y fenilpiperidinas. Debido a sus propiedades de liberación directa de histamina, especialmente la morfina, a veces no es fácil diferenciar la anafilaxia alérgica de la no alérgica.
La incidencia general de reacciones anafilácticas alérgicas de los hipnóticos en Francia es de un 0,8% 29 . Entre los hipnóticos, el propofol ocupa actualmente los dos tercios de las causas de reacciones anafilácticas por hipnóticos, probablemente por su mayor uso, seguido muy lejos por el pentotal (16,7%) y el midazolam (16,6%). Las reacciones al etomidato y la ketamina son extremadamente raras. En el caso del resto de las benzodiacepinas, la incidencia es muy baja y las reacciones reportadas han sido más bien al solvente que a la droga misma. Después de los BNM, los agentes más implicados en liberación inespecífica de histamina durante la anestesia son los hipnóticos (tiopental, propofol) 70 , 71 .
Contrariamente a lo que siempre se ha supuesto, el riesgo de anafilaxia a los anestésicos locales es extremadamente bajo, tanto del grupo amida como del grupo ésteres, a pesar del gran número de anestesias locales y regionales que se realizan. La incidencia general de reacciones anafilácticas para los anestésicos locales en Francia es de un 0,6% 29 . Las reacciones anafilácticas reportadas, así como las reacciones cruzadas entre los anestésicos locales de diferente grupo, se deben generalmente al uso de preservativos comunes como el metilparabeno, el parabeno y el metabisulfito de sodio 72 , que con la excepción de este último, que se utiliza en las soluciones adrenalinizadas, han sido eliminados. La mayoría de las reacciones adversas a los anestésicos locales están relacionadas con la inyección intravascular inadvertida o la absorción sistémica de adrenalina, no con alergia. Se estima que menos del 1% de todas las reacciones a anestésicos locales tienen un mecanismo alérgico 73 .
Nunca se ha reportado una reacción a los agentes anestésicos inhalatorios. Sin embargo, se han asociado a daño hepático debido a toxicidad mediada por inmunidad; se ha demostrado anticuerpos IgG inmunoespecíficos desencadenados por un metabolito del halotano (trifluoracetil metabolito). Se ha reportado también daño hepático por enfluorano, isofluorano y desfluorano. El sevofluorano no se metaboliza a trifluoracetil metabolitos y no hay por el momento reportes de daño hepático.
Entre los productos misceláneos que se han demostrado causantes de reacción anafiláctica intraoperatoria están la protamina, el óxido de etileno, medios de contraste yodados, paracetamol, clorhexidina, povidona, metilprednisolona, ranitidina, ondasentron, ketoprofeno, colorantes azules y otros. Los pacientes con reacciones adversas a povidona no tienen reacciones cruzadas con los medios de contraste yodados.
-
V-Reacciones cruzadas
El epítope (región del antígeno que es reconocida por el anticuerpo), ha sido reconocido en varias substancias responsables de reacciones anafilácticas. Su poca especificidad es responsable de reacciones cruzadas entre diferentes medicamentos o entre el látex y algunos vegetales. En el caso de los bloqueadores neuromusculares (BNM), el epítope reconocido por los anticuerpos es el ión amonio cuaternario o terciario. El hecho de que varios BNM tengan 2 o incluso 3 amonios cuaternarios, permite explicar en parte la alta incidencia de reacciones cruzadas 74 .
Se ha responsabilizado a otros radicales en la génesis de sensibilización a otros productos usados en anestesia, como los grupos pentil y etil en posición 5 ubicados en el ciclo pirimidina del tiopental 75 , los dos grupos isopropil del propofol 71 y el radical metilo de la morfina. Los opioides tienen reacciones cruzadas que pueden estar relacionadas con la secuencia del anillo aromático.
En el caso del látex, de entre unas 250 proteínas que posee la Hevea brasiliensis , unas 50 son potencialmente alergizantes 76 . Algunas de ellas pueden tener epítopes comunes con ciertos vegetales y frutas tropicales, que pueden ser responsables de reacciones cruzadas hasta en el 50% de los casos.
La incidencia de reacciones cruzadas entre diferentes BNM es de alrededor de 65% si se determina con test cutáneo y de 80% con radioinmunoensayo. La alta incidencia se debe a la presencia de amonio cuaternario en ambos grupos químicos de los BNM. La reactividad cruzada depende de la configuración del paratope del anticuerpo (sitio de unión del antígeno), que bien puede corresponder completamente con el epítope (amonio cuaternario) o extenderse a una parte adyacente de la molécula de BNM y de la afinidad relativa de los diferentes BNM por sus anticuerpos IgE. La mayor incidencia de reacciones cruzadas ocurre con el vecuronio (87,5%) y el rocuronio (80,6%), mientras que con el atracurio y la succinilcolina se observa sólo en el 76,8% y 54,3% respectivamente.
Se observa reacciones cruzadas preferentemente entre miembros del mismo grupo químico, aminoesteroides o bencilisoquinolinas, o incluso entre succinilcolina y otros BNM 77 . Entre el 17% y el 50%, puede sobrevenir una reacción anafiláctica en una primera administración 35 , 78 , lo que sugiere una sensibilización previa por una sustancia diferente que tenga el epítope común (amonio cuaternario), como algunos cosméticos de uso habitual. Además, la neostigmina y la morfina también contienen iones de amonio cuaternario que pueden tener reacciones cruzadas con los BNM. La reacción cruzada a todos los BNM es muy poco frecuente, pero parece ser más frecuente en el grupo aminoesteroide que en el bencilisoquinolínico 79 .
Diagnóstico
Las reacciones anafilácticas alérgicas involucran la activación de los basófilos y los mastocitos, mientras que las reacciones anafilácticas no alérgicas, activan solamente a los basófilos. La activación de los mastocitos durante una reacción de hipersensibilidad mediada por IgE, libera proteasas como la triptasa, histamina almacenada y mediadores vasoactivos de neoformación.
En un sistema ideal, toda sospecha de anafilaxia perioperatoria debe ser investigada usando una serie de exámenes intra y postoperatorios para confirmar la naturaleza de la reacción, identificar al agente responsable y educar al paciente sobre futuros procedimientos anestésicos. La realidad es muy diferente en nuestro país y muchos pacientes son operados sin ninguna información disponible. Incluso en países que cuentan con la posibilidad de estudio, pueden ocurrir situaciones de emergencia en que aún no se ha aclarado el diagnóstico de una reacción previa. En Chile, no hay centros de alergonestesiología y lo único con que se cuenta finalmente es el listado de los fármacos utilizados durante la anestesia y la posibilidad de test cutáneo y estudio de niveles de IgE anti-látex por radioinmunoensayo. Es altamente recomendable la creación en nuestro país de por lo menos un centro especializado de alergoanestesiología, muy desarrollados en algunos países europeos.
La reacción anafiláctica alérgica, que es IgE dependiente, puede ser detectada por la positividad de exámenes in vitro e in vivo y el aumento de los niveles de triptasa durante la reacción. La reacción anafiláctica no alérgica ocurre por una liberación no inmunológica de mediadores o activación del complemento, es IgE independiente, y generalmente no está asociada a un aumento de la triptasa.
En el caso de la reacción anafiláctica, la identificación del agente responsable se hace identificando los niveles de IgE específicos en el momento de la reacción o a distancia, y con la realización de tests cutáneos (prick test e intradermoreacción). Con este método se puede determinar que dos tercios de las reacciones alérgicas graves que ocurren en el paciente anestesiado son producto de un mecanismo inmunológico y el tercio restante son el resultado de un mecanismo no inmunológico.
Los pacientes que presentan una reacción anafiláctica en el intraoperatorio deben ser estudiados con una batería de exámenes, algunos de los cuales deben ser realizados durante o inmediatamente después de la reacción, y otros secundariamente 4 a 6 semanas posteriormente a la reacción. Desgraciadamente ninguno de estos exámenes ha demostrado una validez absoluta. En Chile, sólo en algunas instituciones se cuenta con el estudio primario, mientras el secundario no hay mucha posibilidad de realizarlo.
-
I- Estudio inmediato
El estudio inmediato comprende la determinación de los niveles de triptasa e histamina sérica para confirmar una reacción anafiláctica, y la búsqueda de IgE específicas, destinadas a identificar el agente.
-
1. Histamina:
Las concentraciones de histamina son máximas casi inmediatamente después de la reacción y disminuyen luego con una vida media de alrededor de 20 minutos. Por esto, la detección de histamina debe hacerse sólo hasta después de 1 hora de iniciada la reacción y en casos leves sólo las determinaciones realizadas inmediatamente pueden estar alteradas 80 . Valores sobre 9 nmol/L. no establecen el mecanismo de la reacción, pero son altamente sugerentes de que la histamina está involucrada. Es muy poco utilizado en la actualidad.
La determinación de niveles de histamina debe evitarse durante el embarazo y en pacientes que están recibiendo tratamiento anticoagulante con heparina, debido a la alta incidencia de falsos negativos, por la rápida degradación de histamina que ocurre en tales circunstancias.
Su determinación se realiza por método radioinmunológico (RIA). La sensibilidad del examen es de un 75%, la especificidad de un 51%, el valor predictivo positivo es de un 75% y el negativo de un 51%.
-
2. Triptasa:
La triptasa es una proteasa liberada predominantemente por los mastocitos, que está compuesta de dos formas principales: alfa y beta-triptasa, que son homólogas en un 90%. La pro-beta-triptasa sirve como medida del número de mastocitos, mientras que la beta-triptasa madura refleja la activación de los mastocitos. Aunque los basófilos también contienen triptasa, su concentración es 300 a 700 veces menor que en los mastocitos de la piel y los pulmones. Los resultados falsos negativos se han atribuido a un mecanismo en que las reacciones involucran basófilos más que mastocitos 81 , mientras que se han reportado resultados falsos positivos, en caso de estrés extremo, como hipoxemia y trauma mayor.
Las concentraciones de triptasa son máximas después de 30 minutos de las primeras manifestaciones clínicas y tienen una vida media de 90 minutos. Pueden detectarse niveles elevados hasta 6 horas después de la reacción. El tiempo óptimo para la toma de la triptasa sérica es de 1-4 horas después de iniciada la reacción, pero pueden estar aumentadas incluso post mortem en caso necesario. Debe tomarse una muestra control al menos 24 horas después de la reacción.
La beta-triptasa, tiene valores normales inferiores a 12 µg/L. Aunque puede estar elevada por otras causas, valores sobre 25 µg/L son muy sugerentes de un mecanismo inmunológico, pero no hace el diagnóstico diferencial entre reacción anafiláctica alérgica y no alérgica, y no contribuye en la identificación del compuesto causante. Sin embargo, en las reacciones no inmunológicas, el aumento de triptasa tiene una menor prevalencia y generalmente es menos pronunciado que en la activación inmunológica de los mastocitos 82 .
La sensibilidad del examen es de un 64%, la especificidad de un 89,3%, el valor predictivo positivo es de un 92,6% y el negativo de un 54,4%. Su determinación se realiza por método inmunoradiométrico.
Los niveles de triptasa están elevados sólo en el 10,7% de las reacciones no inmunológicas, pero en casi dos tercios de las reacciones inmunes, aportando una práctica herramienta para distinguir entre los dos tipos de reacciones. Los niveles normales de triptasa sin embargo, no excluyen una reacción inmunológica: no se encuentran niveles extremadamente altos en cerca de un tercio de las reacciones anafilácticas alérgicas. En todo caso, la congruencia en los valores de triptasa e histamina aumenta la sensibilidad diagnóstica, pero desgraciadamente ninguna de ambas determinaciones está disponible en Chile.
-
3. IgE específicas:
Puede efectuarse la búsqueda de IgE específicas mediante estudios in vitro. La muestra debe ser tomada en el momento de la reacción en el estudio primario, y hasta los 6 meses en el secundario.
Una serie de técnicas mediante radioinmunoensayo puede detectar IgE específicas para BNM usando un compuesto con amonio cuaternario acoplado a sefarosa (QAS-RIA) 83 , o acoplando p-aminofenil fosforil colina (que contiene iones de amonio cuaternario) sobre agarosa (PAPPC-RIA) 84 . Ambos métodos tienen una sensibilidad similar, de alrededor de 88%. Más recientemente se ha efectuado la cuantificación de IgE específicas para rocuronio con el método ImmunoCAP, con la que se obtiene una sensibilidad de más de 85% y una especificidad absoluta 85 .
También se ha detectado IgE específicas mediante técnica de radioinmunoensayo para el pentotal, morfina, fenoperidina y propofol y mediante técnica radioalergoabsorbente (RAST) para el látex. Sin embargo, se ha limitado las indicaciones de determinación de IgE sólo para el diagnóstico de anafilaxia a los BNM, pentotal y látex hasta que exista una mejor validación del método para otros agentes 41 .
-
II- Estudio secundario
El estudio secundario incluye las pruebas cutáneas (prick-tests e intradermorreacciones) y la búsqueda de IgE específicas, ya sea si no se hizo en forma inmediata o si el resultado fue negativo. Hay 2 tipos de pruebas cutáneas: prick skin test (PST) o test de escarificación, e intradermoreaction test (IDT) o test de intradermorreacción. En algunos países se efectúa el estudio de activación de los basófilos y la prueba de liberación de histamina leucocitaria. Sin embargo, las pruebas cutáneas, asociadas a la historia clínica, siguen siendo lo más importante en el diagnóstico de una anafilaxia mediada por IgE.
-
1. Pruebas cutáneas:
Las pruebas cutáneas deben realizarse 4 a 6 semanas después de la reacción, por profesionales con experiencia en interpretar resultados con agentes usados en anestesia 86 . Las pruebas cutáneas a los BNM pueden permanecer positivas por varios años. Deben incluir el conjunto de medicamentos administrados antes de la reacción y el látex 87 .
Aunque las pruebas cutáneas son muy confiables, no son infalibles. La estandarización de los procedimientos y las diluciones para cada agente estudiado son indispensables para evitar resultados falsos positivos. La sensibilidad de las pruebas cutáneas a los BNM es de 94% a 97% 88 . La sensibilidad es mala para barbitúricos, opioides y benzodiacepínicos y mejora para las gelatinas y penicilinas. Existe algún grado de controversia en relación a las ventajas del PST test versus la IDT. Los estudios que comparan ambas técnicas muestran pequeñas diferencias entre ellas 89 , 90 , sin embargo, los PST tienen una pequeña tendencia a producir resultados falsos negativos, mientras que las IDT una pequeña tendencia a producir resultados falsos positivos, especialmente cuando las drogas que se ensayan producen una liberación de histamina directa 91 . Debe preferirse las IDT cuando se investiga reacciones cruzadas a BNM.
Si se ha administrado un BNM, debe realizarse un test para el agente implicado y para cada uno de los otros BNM, debido a la alta incidencia de reacciones cruzadas y a la necesidad de poder recomendar alternativas en futuras intervenciones quirúrgicas 28 , 30 , 41 , 92 . La mayoría de las veces puede recomendarse otro BNM en base a pruebas cutáneas, pero para una mayor seguridad, es recomendable que la concentración del agente sea aumentada, para disminuir la posibilidad de falsos negativos; además, es recomendable la realización de la prueba de liberación de histamina leucocitaria o el estudio de activación de los basófilos. Al administrar un BNM a un paciente sensibilizado a otro BNM, debe tenerse en cuenta el riesgo-beneficio del uso del agente.
La sensibilidad al látex debe ser estudiada con PST usando dos extractos comerciales diferentes 93 . Los colorantes azules (azul patente, azul de metileno, índigo carmín), deben ser estudiados con IDT usando una dilución 1:100 94 .
-
2. IgE específicas:
Las IgE específicas pueden ser estudiadas también en forma secundaria porque hay algunas drogas como los BNM que hacen permanecer sensibilizados a los sujetos hasta 30 años después de una reacción. Otras, como los antibióticos, sensibilizan sólo por un tiempo corto.
-
3. Test de provocación:
Tiene indicaciones limitadas y está restringido a los anestésicos locales, las penicilinas (beta-lactam) y el látex 95 . Consiste en administrar pequeñas cantidades de antígeno por la misma vía por la que se supone ocurrió la reacción (excepto neuroaxial), llegando hasta concentraciones de 1:10. El estudio debe efectuarse en lo posible después de tener los resultados de los test cutáneos y de los anticuerpos IgE. El examen no se realiza en Chile, necesita consentimiento informado y todas las condiciones necesarias para la realización de una resucitación cardiopulmonar. En algunos países es el método de elección para el estudio de la sensibilidad a los anestésicos locales debido a que no se dispone de mediciones validadas de IgE específicas para anestésicos locales.
-
4. Pruebas de liberación de mediadores:
Estas pruebas cuantifican la liberación de mediadores liberados durante la degranulación, especialmente de basófilos, secundaria a la estimulación con un antígeno. Hay dos tipos de pruebas de liberación de mediadores: prueba de liberación de histamina y prueba de liberación de sulfidoleucotrieno. También se ha reportado la cuantificación de liberación de serotonina, proteína eosinofilcatiónica y LTC4, pero estos ensayos no están aún clínicamente validados. En los países escandinavos se realiza el estudio de activación de los basófilos como parte del esquema de evaluación 96 .
En los pacientes con anticuerpos IgE, los basófilos y los mastocitos están sensibilizados y pueden ser gatillados por estimulación con diferentes umbrales alergénicos. La muestra debe tener menos de 24 horas y los pacientes no deben estar en tratamiento con altas dosis de esteroides.
Las pruebas de liberación de histamina leucocitaria y activación de basófilos tienen una baja sensibilidad (71% y 65% respectivamente) y una alta especificidad (100%) en el estudio de la hipersensibilidad a los BNM 97 . A pesar de su buena especificidad, su utilidad diagnóstica es limitada por la difícil reproducción de las condiciones experimentales y la baja sensibilidad, por lo que no son utilizadas en forma rutinaria, sino cuando se estudia reacciones cruzadas entre BNM.
-
5. Análisis flujo citométrico de los basófilos activados in vitro:
La activación de los basófilos no sólo secreta mediadores cuantificables, sino que sobreregula la expresión de diferentes marcadores que pueden ser detectados en forma eficiente por citometría de flujo, usando anticuerpos monoclonales específicos, especialmente anti-CD63 y con menor frecuencia anti-CD203.
Probablemente, una vez que este tipo de análisis haya sido completamente validado, representará una herramienta de diagnóstico interesante aunque solamente en la anafilaxia por BNM y reacciones cruzadas 98 .
Bibliografía
- Nebeker J, Barach P, Samore M. Claryfying Adverses Drug Events: A Clinician’s Guide To Terminology, Documentation, And reporting. Ann Intern Med 2004; 140: 795-801.
- McPherson RD, Willcox C, Chow C, Wang A. Anaesthetit’s responses to patients self-reported drug allergies. Br J Anaesth 2006; 97: 634-639.
- Ebo DG, Fisher MM, Hagendorens MM, et al. Anaphylaxis during anaesthesia: diagnostic approach. Allergy 2007; 62: 471-487.
- Johansson SGO, Blieber T, Dahl R, et al. J Allergy Clin Immunol 203; 113: 832-836.
- Guéant JL, Aimone-Gastin I, Namouf F, et al. Diagnosis and pathogenesis of the anaphylactic and anaphilactoid reactions to anaesthetics. Clin Exp Allergy 1998; 28 (S4): 65-70.
- Weiss ME. Drug allergy. Med Clin North Am 1992; 76: 857-882.
- Mertes PM, Dewachter P, Laxenaire MC. Complications anaphylactiques et anaphylactoïdes de l’anesthésie génerale. Encycl Méd chir, Anesthésie-Réanimation 36-410-A-10, 2003, 15 p.
- Mertes PM, Pinaud M. Prévention du risque allergique en anesthésie: recommandations pour la practique clinique. Mécanisme. Ann Fr Anesth Réanim 2002; 21 (S1): S55-S72.
- Hedin H, Richter W. Pathomechanisms of dextran-induced anaphylactoid/anaphylactic reactions in man. Int Arch Allergy Appl Immunol 1982; 68: 122-126.
- Findlay SR, Dvorak AM, Kagey-Sobotka A, Lichtenstein LM. Hyperosmolar triggering of histamine release from human basophils. J Clin Invest 1981; 67: 1604-1613.
- Marone G, Stellato C, Mastronardi P, Mazzarella B. Mechanism of activation of human mast cells and basophils by general anesthetic drugs. Ann Fr Anesth Réanim 1993; 12: 116-125.
- Renz CL, Laroche D, Thurn JD, et al. Tryptase levels aare not increased during vancomycin-induced anaphylactoid reactions. Anesthesiology 1988; 89: 620-625.
- Lorenz W, Doenicke A. Anaphylactoid reactions and histamine release by barbiturate induction agents: clinical relevance and pathomechanisms. Anesthesiology 1985; 63: 351-352.
- Mc Hale SP, Konieczko K. Anaphylactoid reaction to propofol. Anaesthesia 1992; 47: 864-865.
- Laxenaire MC. Le risque allergique des curares. Can J Anesth 2003; 50: 429-433.
- Murat I. Anaphylactic reactions during paediatric anaesthesia: results of the survey of the French Society of Paediatric Anaesthesia (ADARPEF). Paediatric Anaesth 1993; 3: 339-343.
- Laxenaire MC. Epidemiologie des reactions anaphylactoïdes paranesthésiques. Quatrième enquête multicentrique (juillett 1994-décembre 1996). Ann Fr Anesth Réanim 1999; 18: 796-809.
- Laxenaore MC. What is the real risk of drug hypersensibility in anaesthesia? Incidence. Clinical aspects. Morbidity-mortality. Substances responsible. Ann Fr Anest Réanim 2002; 21 (Sup1): S38-S54.
- Fisher MM, More DG. The epidemiology and clinical features of anaphylactic reactions in anaesthesia. Anaesth Intensive Care 1981; 9: 226-234.
- Watkins J. Adverse anaesthetic reactions: an update from a proposed national reporting and advisory service. Anaesthesia 1985; 40: 797-800.
- Laxenaire MC. Prévention du risque allergique en anesthésie: recommandations pour la practique clinique. Ann Fr Anesth Réanim 2002; 21 (S1): S1-S80.
- Whittington T, Fischer M. Anaphylactic and anaphylactoyd reactions. Bailliere’s Clin Anaesthesiol 1998; 12: 301-323.
- Escolano F, Valero A, Huguet J, et al. Estudio Epidemiológico prospectivo de las reacciones anafilactoíeas perioperatorias ocurridas en Cataluña (1996-7). Rev Esp Anestesiol Reanim 2002; 49: 286-293.
- Harboe T, Guttormsen AB, Irgens A, et al. Anaphylaxis during anesthesia in Norway: a 6-year single center follow-up study. Anesthesiology 2005: 102: 897-903.
- Lienhart A, Auroy Y, Pesquignot F, et al. Survey of anesthesia-related mortality in France. Anesthesiology 2006; 105: 1087-1097.
- Fisher MM, Baldo BA. The incidente and clinical features of anaphylactic reactions during anaesthesia in Australia. Ann Fr Anest Réanim 1993; 12: 97-104.
- Jacobson J, Lindekaer AL, Ostergaard HT, et al. Management of anaphylactic shock evaluated using a full-scale anaesthesia simulator. Acta Anaesthesiol Scand 2001; 45: 315-319.
- Mertes PM, Laxenaire MC. Allergy and anaphylaxis in anaesthesia. Minerva Anestesiol 2004; 70: 285-291.
- Mertes PM, Laxenaire MC. Épidemiologie des reactions anaphylactiques et anaphylactoïdes peranesthésiques en France: Septième enquête multicentrique (Janvier 2001-Décembre 2002). Ann Fr Anesth Réanim 2004; 23: 1133-1143.
- Fisher MM, Baldo BA. Anaphilaxis during anaesthesia: current aspect diagnosis and prevention. Eur J Anaesthesiol 1994; 11: 263-284.
- Moneret-Vautrin DA, Laxenaire MC. Anaphylactic and anaphylactoid reactions. Clinical presentations. Clin Rev Allergy 1991; 9: 249-258.
- Leynadier F, Pecquet C, Dry J. Anaphylaxis to latex during surgery. Anaesthesia 1989; 44: 547-550.
- Practice Parameters of the Joint Task Force on Practice Parameters of Allery and Inmunoligy. The diagnosis and management of anaphylaxis: an updated practice parameter. J Allergy Clin Immunol 2005; 115: S483-S523.
- Mertes PM, Laxenaire MC. Allergic Reactions occurring during anaesthesia. Eur J Anaesthesiol 2002; 19: 240-262.
- Laxenaire MC, Mertes P. Anaphylaxis during anaesthesia. Results of a 2 year survey in France. Br J Anaesth 2001; 87; 549-558.
- Fischer M, Baldo BA. Anaphylaxis during anaesthesia: current aspects of diagnosis and prevention. Eur J Anaesthesiol 1994; 11: 263-284.
- Mertes PM, Laxenaire MC, Alla F. Anaphylactic and Anaphylactoid Reactions Occurring during Anesthesia in France. Anesthesiology 2003; 99: 536-545.
- Dewatcher P, Jouan-Hureaux V, Franck P, et al. Anaphylactic Shock: A Form of Distributive Shock without inhibition of Oxygen Consumption. Anesthesiology 2005; 103: 40-49.
- Coelho D, Fernandes T, Branga P, et al Intraoperative anaphylaxis after intravenous atropine. Eur J Anaesthesiol 2007; 24: 289-290.
- Hama K, Nakahata K, Iranami H, Hatano Y. Immediate Allergic Reaction to Betamethasone During Anesthesia. Anesth Analg 2006; 102: 1913-1914.
- Mertes PM, Laxenaire MC, Lienhart A, et al. Reducing the risk of anafilaxis during anaesthesia: guidelines for clinical practices. J Invest Alergol Clin Inmunol 2005; 15: 1087-1097.
- Duda D, Lorenz W, Menke H, et al. Histamine release during induction of anaesthesia and preparation for operation in patients undergoing general surgery: Incidence and clinically severe cases. Agents Actions 1992; 36: C149-C154.
- Lorenz W, Duda D, Dick W, et al. Incidence and clinical importance of perioperative histamine release: randomized study of volume loading and antihistamines after induction of anaesthesia. Lancet 1994; 343: 933-940.
- Laxenaire MC, Moneret-Vautrin DA, Widmer S, et al. Substances anesthésiques responsables de chocs anaphylactiques. Enquête multicentrique française. Ann Fr Anesth Réanim 1990; 9: 501-506.
- Laxenaire MC. Drugs and other agents involved in anaphylactic shock occurring during anaesthesia. A French multicenter epidemiological inquiry. Ann Fr Anesth Réanim 1993; 12: 91-96.
- Laxenaire MC. Substences responsables des chocs anaphylactiques peranesthésiques. Troisième enquête multicentrique française (1992-1994). Ann Fr Anesth Réanim 1996; 15; 1211-1218.
- Didier A, Cador D, Bongrand P, et al. Role of the quaternary amonium ion determinants in allergy to muscle relaxants. J Allergy Clin Immunol 1987; 79: 578-584.
- Koppert W, Blunk JA, Petersen LJ, et al. Differents patterns of mast cell activation by muscle relaxants in human skin. Anesthesiology 2001; 95: 659-667.
- Bhananker SM, O’Donnell JT, Salemi JM, Bishop MJ. The Risk of Anaphylactic Reactions To Rocuronium in the United States Is Comparable to That of Vecuronium: An Analysis of Food and Drug Administration Reporting of Adverse Events. Anesth Analg 2005; 101: 819-822.
- Gutormsen AB. Allergic reactions during anaesthesia: increased attention to the problem in Denmark and Norway. Acta Anaesthesiol Scand 2001; 45: 1189-1190.
- Hepner DL, Castells MC. Anaphylaxis during the perioperative period. Anesth Analg 2003; 97: 1381-1395.
- Laake JH, Rottingen JA. Rocuronium and anaphylaxis: a statistical challenge. Acta Anaesthesiol Scand 2001; 45: 1196-1203.
- Levy JH, Gottge M, Szlam F, et al. Wheal and flare responses to intradermal rocuronium and cisatracurium in humans. Br J Anaesth 2000; 85: 844-849.
- Rose M, Fisher M. Rocuronium: high risk for anaphylaxis? Br J Anaesth 2001; 86: 678-682.
- Light KP, Lovell AT, Butt H, et al. Adverse effects of neuromuscular blocking agents based on yellow card reporting in the UK: are there differences between males and females? Phaermacoepidemiol Drug Saf 2006; 15: 151-160.
- Wastila WB, Maehr RB, Turner CL, et al. Comparative pharmacology of cisatracurium (51W89), atracurium, and five isomers in cats. Anesthesiology 1996; 85: 169-177.
- Konrad C, Fiebar T, Gerber H. The prevalence of latex sensibity among the anesthesiology staff. Anesth Analg 1997; 84: 629-633.
- Tarlo SM, Sussman GL, Holness DL. Latex sensivity in dental students and staff: a cross-sectional study. J Allergy Clin Immunol 1997; 99: 396-401.
- Rubio ML, Ojeda D, Agurto M, Cisternas P. Sensibilización al látex en el personal de pabellón y administrativo. Congreso Chileno de Anestesiología, Pucón 2008.
- Neugut AI, Ghatak AT, Miller RL. Anaphylaxis in the United States: an investigation into its epidemiology. Arch Internal Med 2001; 161: 15-21.
- Anderson JA. Allergic reactions to drugs and biologic agents. JAMA 1992; 268: 2845-2857.
- Solensky R. Rev Clin Allergy Inmunol 2003; 24: 201-220.
- Anne S, Reisman RE. Risk of administering cephalosporin antibiotics to patients with histories of penicillin allergy. Ann Allergy Asthma Immunol 1995; 74: 167-170.
- Goodman EJ, Morgan MJ, Johnson PA, et al. Cephalosporins can be given to penicillin allergic patients. Anesth Analg 1999; 88 (2S): 3355.
- Reisman AS. Risk of administering cephalosporin antibiotics to patients with histories of penicillin allergy. Ann Allergy Asthma Inmunol 1995; 74: 167-170.
- Renz CL, Thurn JD, Finn HA, et al. Antihistamine prophylaxis permits rapid vancomycin infisión. Cri Care Med 1999; 27: 1732-7.
- Renz C, Lync J, Thurn, Moss J. Histamine release during rapid vancomycin administration. Inflamm Res 1998; 47: S69-S70.
- Laxenaire MC, Charpentier C, Feldman L. Anaphylactoid reactions to colloid plasma substitutes: incidence, risk factors, mechanisms. A french multicenter prospective study. Ann Fr Anest Réanim 1994; 13: 301-310.
- Fisher MM, Harle DG, Baldo BA. Anaphylactoid reactions to narcotic analgesics. Clin Rev Allergy 1991; 9: 309-318.
- Hishman CA, Peters, J, Cartwright-Lee I. Leukocyte histamine release to thiopental. Anesthesiology 1982; 56: 64-67.
- Laxenaire MC, Mata-Bermejo E, Moneret-Vautrin DA, Guéant JL. Life threatening anaphylactoid reactions to propofol (Diprivan). Anesthesiology 1992; 77: 275-280.
- Schwartz HJ, Sher TH. Bisulfite sensitivity manifesting as allergy to local dental anesthesia. J Allergy Clin Immunol 1985; 75: 525-527.
- Fisher MM, Bowey CJ. Alleged allergy to local anaesthetics. Anasth Intensive Care 1997; 25: 611-614.
- Fisher MM. Anaphylaxis to muscle relaxants: cross sensitivity between relaxants. Anesth Intensive care 1980; 8: 211-213.
- Baldo BA, Fisher MM, Harle DG. Allergy to tiopentone. Clin Rev Allergy 1991; 9: 295-308.
- Wagner S, Sowka S, Mayer C, et al. Identification of a Hevea Brasilensis latex manganese superoxide dismutase (Hev b 10) as a cross-reactive allergen. Int Arch Allergy Immunol 2001; 125: 120-127.
- Birnbaum J, Vervloet D. Allergy to muscle relaxants. Clin Rev Allergy 1991; 9: 281-293.
- Fisher MM. Anaphylaxis to muscle relaxants: cross sensivity between relaxants. Anaesth Intensive Care 1980; 8: 211-213.
- Mertes PM, Aimone-Gastin I, Guéant-Rodríguez RM, et al. Hypersensitivity reactions to neuromuscular blocking agents. Curr Pharm Des 2008; 14: 2809-2825.
- Laroche D, Dubois F, Gérard J, et al. Radioimmunoassay for plasma histamine: a study of false positive and false negative values. Br J Anaesth 1995; 74: 430-437.
- Laroche D, Vergnaud MC, Sillard B, et al. Biochemical markers of anaphylactoid reactions to drugs. Comparison of plasma histamine and tryptase. Anesthesiology 1991; 75: 945-949.
- Fisher MM, Baldo BA. Mast cell tryptase in anesthetic anaphylactoid reactions. Br J Anaesth 1998; 80: 26-29.
- Guéant JL, Mata E, Morin B, et al. Evaluation of a new reactive solid phase for radioimmunoassay of serum specific IgE against muscle relaxant drugs. Allergy 1991; 46: 452-458.
- Gigoux L, Ricard-Blum S, Ville G, et al. A new radioimmunoassay using a commercially available solid support for the detection of IgE antibodies against muscle relaxants. J Allergy Clin Immunol 1992; 90: 153-159.
- Ebo DG, Venemalm L, Bridts CH, et al. Immunoglobulin E antibodies to rocuronium: a new diagnostic tool. Anesthesiology 2007; 107: 253-259.
- Soetsens FM. Anaphylaxis during anaesthesia: diagnosis and treatment. Acta Anaesthesiol Belg 2004; 55: 229-237.
- Kroigaard M, Garvey LH, Menne T, et al. Allergic reactions in anesthesia: are suspected causes confirmed on subsequent testing? Br J Anaesth 2005; 95: 468-471.
- Laxenaire MC, Moneret-Vautrin DA. Allergy and anaesthesia. Curr Opin Anaesthesiol 1992; 5: 436-441.
- Leynadier F, Sansarricq M, Didier JM, et al. Prick test in the diagnosis of anaphylaxis of general anesthetic allergy. Br J Anaesth 1987; 59:683-689.
- Fisher MM, Bowey CJ. Intradermal comparing with prick testing in the diagnosis of anaesthetic allergy. Br J Anaesth 1997; 79: 59-63.
- Fisher M, Baldo BA. Anaphylaxis during anaesthesia: current aspects of diagnosis and prevention. Eur J Anaesthesiol 1994; 11: 263-284.
- Mertes PM, Laxenaire MC. Anaphylaxis during general anaesthesia: prevention and management. CNS Drugs 2000; 14: 115-133.
- Turjanmaa K, Palosuo T, Alenius H, et al. Latex allergy diagnosis: in vivo and in vitro standarization of a natural rubber latex extract. Allergy 1997; 52: 41-50.
- Mertes PM, Malinovsky JM, Mouton-Faivre C, et al. Anaphylaxis to dyes during the perioperative period: reports of 14 clinical cases. J Allergy Clin Immunol 2008; 122: 348-352.
- Allombert-Marechal G, Vervloet D, Arnaud A, et al. Provocation tests to local anesthetics. Presse Med 1984; 13: 1903-1904.
- Kroigaard M, Garvey LH, Gilberg L, et al. Scandinavian Clinical practice Guidelines on the diagnosis, management and follow up of anaphylaxis during anaesthesia. Acta Anaesthesiol Scand 2007; 51: 655-670.
- Mata E, Guéant JL, Moneret vautrin DA, et al. Clinical evaluation of in vitro leukocyte histamine release in allergy to muscle relaxant drugs. Allergy 1992; 47: 471-476.
- Mertes PM, Lambert M, Guéant-Rodríguez RM, et al. Perioperative Anaphilaxis. Immunol Allergy Clin N Am 2009; 29: 429-251.


 Creative Commons Attribution
Creative Commons Attribution