Clara Luxoro V. 1 , Ricardo Bustamante B. 1
Rev Chil Anest Vol. 39 Núm. 1 pp. 53-68|doi:
PDF|ePub|RIS
Los anestesiólogos somos quienes con mayor frecuencia nos vemos enfrentados a pacientes con reacciones anafilácticas severas 1 . Sin embargo, el manejo apropiado de la anafilaxia relacionada con anestesia, requiere de un abordaje multidisciplinario 2 , 3 .
Una detección y tratamiento precoz del evento agudo por el equipo anestesiológico responsable, son esenciales para prevenir la mortalidad y las secuelas asociadas a esta complicación 1 , 4 ,5 . La mantención de la perfusión coronaria y cerebral son los objetivos más importantes del tratamiento, lo que a veces es difícil o incluso imposible de conseguir 6 . La vigilancia es esencial y constituye el primer paso hacia el diagnóstico precoz, el manejo exitoso y la futura investigación de una reacción anafiláctica durante la anestesia 1 . Hay estudios que dejan de manifiesto las dificultades existentes en anestesiólogos experimentados para hacer el diagnóstico correcto de estas reacciones oportunamente 7 .
El cuadro clínico y el diagnóstico de anafilaxia son precisados en un artículo anterior. El tratamiento que sigue a continuación, aunque es practicado comúnmente y es ampliamente aceptado, se basa en el consenso más que en la evidencia 8 .
Tratamiento
Hay medidas generales de sentido común, como avisar al cirujano, considerar en conjunto abreviar o cancelar la cirugía, poner al paciente en posición de Trendelemburg, iniciar monitorización invasiva según la intensidad del cuadro clínico y pedir ayuda. Casi todas las publicaciones consideran un tratamiento inicial, de primera línea o primario y un tratamiento secundario o de segunda línea, con un algoritmo fácil de recordar (Figura 1).
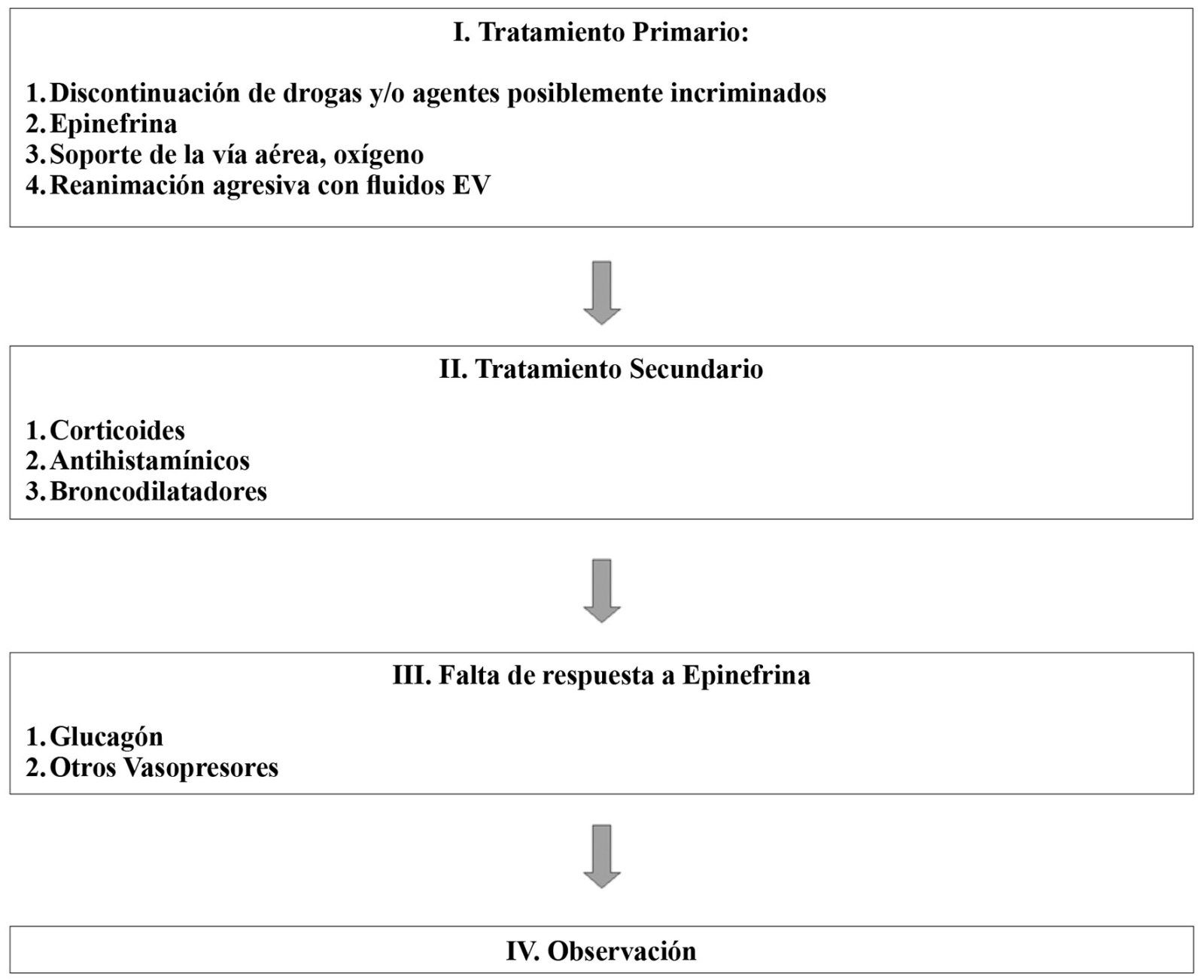
Figura 1 Diagrama de flujo para el tratamiento de la anafilaxia perioperatoria.
-
I- Tratamiento primario
Las piedras angulares son: discontinuación de las drogas o los agentes posiblemente incriminados, uso de epinefrina, soporte de la vía aérea (uso de oxígeno) y reanimación agresiva con fluidos por vía endovenosa (EV).
-
1. Discontinuación de drogas y/o agentes posiblemente incriminados
Aunque no existe evidencia definitiva que avale esta recomendación 9 , la discontinuación de drogas y agentes sospechosos de gatillar la reacción es una práctica médica habitual. Interrumpir el efecto de mediadores liberados, nuevos o preformados, en respuesta a antígenos y prevenir una futura liberación de mediadores, también debe ser motivo de nuestra preocupación 4 , 5 ,10 .
En reacciones tardías en relación a inducción anestésica, o a la administración de antibióticos, sospechar de látex como agente causal. La absorción de alérgenos por vías distintas de la endovenosa es más lenta y retarda la aparición del cuadro clínico. En estos casos se debe retirar todo vestigio de látex del campo operatorio, cambiar guantes de todo el equipo quirúrgico e interrumpir el contacto del paciente con todos los insumos que contengan látex. En la entrada del pabellón y dentro de él debe instalarse letreros que adviertan de “ALERGIA AL LÁTEX”.
-
2. Epinefrina
Todas las publicaciones que se refieren al tratamiento de la anafilaxia ponen énfasis en la administración precoz de epinefrina 1 , 4 ,5 . La epinefrina es la droga de elección en tratamiento de anafilaxia; la OMS la clasifica como una droga esencial 5 , 11 .
Esto se debe a sus propiedades alfa y beta agonistas. Su efecto alfa agonista aumenta el tono vascular y revierte tanto la vasodilatación como el edema provocados por la reacción anafiláctica. Mientras que su efecto beta agonista aumenta la contractilidad miocárdica y el gasto cardíaco, produce broncodilatación y detiene la liberación de mediadores inflamatorios como leucotrienos, bradikinina e histamina desde mastocitos y basófilos 4 , 6 ,10 .
Las catecolaminas que estimulan al receptor beta, determinan su asociación a proteína G, la que activa la adenilciclasa incrementando los niveles intracelulares del segundo mensajero AMPc. A través de este mecanismo, provocan una inhibición de la liberación de mediadores inducida por antígenos. Los beta bloqueadores como el propranolol, previenen la inhibición de liberación de mediadores inmunológicos que ocurre como consecuencia de la administración de epinefrina. Los pacientes en tratamiento crónico con beta bloqueadores que experimentan reacciones anafilácticas, suelen presentar cuadros prolongados, caracterizados por hipotensión severa. El glucagón aumenta los niveles de AMPc por vías que no involucran al receptor beta, razón por la que debe ser considerado particularmente en estos casos.
El margen terapéutico de la epinefrina es estrecho; las concentraciones terapéuticas efectivas y la toxicidad, manifestada por arritmias malignas, son cercanas 11 .
La epinefrina debe ser titulada de acuerdo a la severidad de los síntomas y diluida a concentraciones máximas de 0,1 mg·ml-14,5,10 . Se recomienda utilizar una dosis inicial de 5 a 20 µg por vía endovenosa (0,2 µg·kg-1) en reacciones tipo II y de 100 a 500 µg por vía endovenosa en reacciones tipo III. La dosis debe repetirse cada 1 a 2 minutos de acuerdo a necesidad 1 , 5 ,12 . En reacciones tipo IV, la reanimación debe efectuarse de acuerdo a las recomendaciones vigentes de la American Heart Association (AHA) 13 o European Resuscitation Council (ERC) 14 . Una forma segura y efectiva de usar epinefrina, especialmente en pacientes que requieren de bolos repetidos, es en forma de infusión continua (0,05 a 0,1 µg·kg·min-1); la dosis puede ser titulada a efectos deseados, evitándose la potencial administración accidental de altas concentraciones de la droga 4 ,12,15 .
Las dificultades y demoras en el reconocimiento y tratamiento precoz con epinefrina de las reacciones anafilácticas, podrían determinar reacciones bifásicas, prolongadas o con resultado fatal 1 , 5 ,16 .
-
3. Soporte de la vía aérea: oxígeno
Administrar oxígeno en flujos altos por mascarilla de alto flujo (en caso de anestesia regional) o a través de tubo endotraqueal (pacientes sometidos a anestesia general, con síntomas respiratorios o hipoxemia). También se benefician de oxígenoterapia los pacientes con inestabilidad hemodinámica 2 , 17 ,18 .
En caso de pacientes no intubados que presenten anafilaxia durante el curso de una anestesia regional, se debe evaluar cuidadosamente la necesidad de intubación pues es conveniente evitar administrar nuevas drogas liberadoras de histamina, que podrían necesitarse para instrumentar la vía aérea de personas reactivas. Es perentorio el soporte de la vía aérea con intubación traqueal y ventilación mecánica en reacciones tipo III y más graves, así como en pacientes con edema progresivo de la vía aérea superior 15 . La administración de O2 al 100% aumentará la entrega de O2, compensando el aumento del consumo de O2 5 .
-
4. Reanimación agresiva con fluidos endovenosos
Los pacientes que se mantienen hipotensos a pesar de la administración de las dosis recomendadas de epinefrina deben recibir reanimación agresiva con fluidos por vía endovenosa 5 , 15 ,17 .
Pueden ser necesarios grandes volúmenes de cristaloides (solución fisiológica o solución de Ringer Lactato) en los primeros 5 a 10 minutos después de la reacción. Se aconseja infundirlos utilizando 2 vías venosas de grueso calibre. En reacciones severas con hipotensión, más del 35% del volumen sanguíneo puede extravasarse en los primeros 10 minutos y la vasodilatación puede producir encharcamiento con mayor reducción del volumen sanguíneo efectivo y shock distributivo. El volumen aportado depende de la situación clínica; una hipotensión persistente requiere un enfrentamiento más agresivo con múltiples bolos de fluidos (10 a 20 ml·kg-1 o incluso más, utilizando aceleradores de suero). Inicialmente se utilizan cristaloides, pero si hay una respuesta débil o nula a los cristaloides, se incluyen coloides. En el caso de una reacción con compromiso respiratorio importante o que responde precozmente al tratamiento, el manejo de fluidos debe ser menos agresivo 4 , 5 ,12 .
-
II- Tratamiento secundario
-
1. Corticoides
En estudios controlados por placebo no se ha demostrado la utilidad de los corticoides en el tratamiento de la anafilaxia. Su uso en otras reacciones alérgicas ha llevado a su incorporación en el manejo de este cuadro. Debido a su lento inicio de acción, son considerados parte del tratamiento secundario 4 , 15 ,17 . Se ha sugerido que su uso podría prevenir una reacción prolongada o bifásica, aunque no hay evidencia que lo pruebe 4 , 5 .
Se proponen dosis de 1 a 2 mg·kg-1 por bolo de metilprednisolona EV cada 6 horas. También se ha recomendado hidrocortisona (1-5 mg·kg-1 por dosis) por su rápido inicio de acción 4 , 5 ,15 .
-
2. Antihistamínicos
Los bloqueadores H1 actúan lentamente y principalmente aliviando los síntomas cutáneos, más que los problemas hemodinámicos y respiratorios, que son los que determinan que la anafilaxia se considere una emergencia vital, por lo que se consideran como parte del tratamiento de segunda línea para anafilaxia 4 ,5,15 .
El uso combinado de antagonistas H1 y H2 se ha reportado como más efectivo en el tratamiento de las manifestaciones cutáneas que el uso de antagonistas H1 aislados. No se ha demostrado que algún antagonista H2 sea más eficiente que otro 12 .
Estudios preliminares han demostrado receptores de histamina 3 (H3) involucrados en la anafilaxia. Estos se han identificado en terminaciones presinápticas del sistema nervioso simpático que inerva el corazón y la vasculatura sistémica. En un estudio de anafilaxia en perros, se observó mejoría de la función sistólica del ventrículo izquierdo al comparar casos tratados con antagonistas del receptor H3 con controles 5 .
-
4. Broncodilatadores
Los agonistas beta2 inhalados (albuterol y salbutamol) y el ipatropium pueden ser útiles en el tratamiento sintomático de broncoespasmo refractario a epinefrina 5 , 12 ,17 . No son considerados de primera línea 4 , 17 .
-
III- Falta de respuesta a epinefrina
Un tema importante es cómo proceder en caso de hipotensión persistente a pesar de tratamiento agresivo con epinefrina y con fluidos. La evidencia disponible es a favor de adición empírica de glucagón y de otros vasopresores.
La anafilaxia severa puede asociarse a colapso cardiovascular difícil de manejar. Estas reacciones pueden progresar tan rápidamente que el paciente no ha alcanzado a recibir tratamiento previo cuando se desencadena un paro cardiorrespiratorio. Por tratarse de un cuadro infrecuente, impredecible y amenazante de la vida del paciente, es de mucha dificultad desarrollar en seres humanos estudios prospectivos, aleatorios y controlados, que permitan dilucidar cuál es el mejor tratamiento. Por lo tanto, las alternativas al fracaso del tratamiento con epinefrina, se basan en la teoría (fundamentalmente investigación animal), el consenso, reportes y anécdotas publicadas en la literatura científica más que en evidencias 6 , 16 .
-
1. Glucagón
Existen múltiples reportes que aluden a una mayor severidad de la anafilaxia, de anafilaxia refractaria a tratamiento con epinefrina o de anafilaxia con ausencia de taquicardia en pacientes consumidores de bloqueadores beta adrenérgicos 1 ,8,12 . Teóricamente hay múltiples mecanismos que podrían abortar la respuesta a epinefrina e incluso provocar una reacción paradojal a epinefrina. En estos casos, está indicado intentar con glucagón. Se piensa que el glucagón revierte la hipotensión refractaria y el broncoespasmo a través de la activación de la adenilato ciclasa independiente del receptor beta,aumentando el AMPc.
La dosis recomendada de glucagón es de 1 a 5 mg (20 a 30 µgr·Kg-1) administrada EV en al menos 5 minutos, seguida de una infusión de 5-15 µgr·min-1, titulada según respuesta clínica. La vía aérea debe ser aislada pues el glucagón causa frecuentemente emesis 12 , 15 . Otro efecto colateral frecuente es la hiperglicemia 15 .
-
2. Otros vasopresores
Algunas drogas usadas con éxito son metaraminol, metoxamina, fenilefrina y especialmente norepinefrina y vasopresina 19 . Se recomienda una infusión de norepinefrina, partiendo de 0,05 a 0,1 µg·kg·min-1 6,10,16 .
La vasopresina ha resultado útil en el tratamiento de shock hemorrágico y séptico. Se trata de un péptido sintetizado en el hipotálamo cuyo rol primario es mantener la homeostasis de los fluidos. Entre las indicaciones para su administración se incluyen diabetes insípida, sangramientos debidos a coagulopatías, várices esofágicas y reanimación cardiopulmonar, como alternativa o complemento de epinefrina 10 ,13,14 .
Existen múltiples reportes en la literatura científica de tratamiento exitoso de shock anafiláctico perioperatorio (esto es, rápida estabilización hemodinámica), después de la administración de vasopresina en bolos (2 a 10 UI) o infusión continua (0,01 a 0,04 UI·min-1) en pacientes refractarios a tratamiento con epinefrina sola o asociada a noradrenalina o fenilefrina 6 ,10,15,16 .
La vasopresina eleva la presión arterial en el shock con vasodialtación por más de un mecanismo 10 , 16 .
-
Activación de receptores V1 que median vasoconstricción vía activación de proteína Gq de fosfolipasa C.
-
Inactivación de canales kATP que funcionan bloqueando canales de calcio, permitiendo así que el calcio penetre a las células del músculo liso, se una a los complejos actina-miosina, causando un aumento del tono del músculo liso y constricción de los vasos sanguíneos.
-
Inhibición de la síntesis de óxido nítrico, impidiendo así la vasodilatación provocada por acción de óxido nítrico sobre la fosforilación de la miosina.
-
Elevación de la perfusión de órganos vitales desviando flujo sanguíneo desde músculo, piel, tejido adiposo y sistema gastrointestinal hacia corazón y cerebro.
Estudios recientes en modelos animales (ratas y conejos) de shock anafiláctico revelan que la vasopresina revierte la hipotensión severa y mejora sobrevida 10 .
-
IV- Observación
Después de presentar una reacción anafiláctica, los pacientes deben permanecer en una unidad de paciente crítico para observación, soporte hemodinámico y soporte respiratorio 4 , 5 ,15 . No existe evidencia que sugiera la duración que debe tener esta estadía en Intensivo o Intermedio. Se sugiere que sea proporcional a la severidad de la reacción inicial, con un mínimo de 4 a 6 horas en reacciones que responden rápidamente a tratamiento 11 , 14 .
Este período de observación se fundamenta en que la reacción puede recurrir al momento de suspender la epinefrina y en el riesgo de que se desencadene una reacción bifásica. Según lo establecido en la literatura esta reacción bifásica puede ocurrir entre el 1% y el 20% de las reacciones anafilácticas 12 ,15 y es más frecuente en pacientes que se presentan inicialmente con síntomas más severos. Los intervalos reportados entre el inicio de la reacción y el inicio de la segunda fase van en rango de 1 a 72 horas. Desafortunadamente no se han identificado predictores clínicos capaces de identificar grupos de pacientes con mayor riesgo de presentar reacciones bifásicas, aunque algunos estudios han sugerido que los pacientes que requieren mayores dosis de epinefrina para controlar síntomas iniciales o aquellos en que se ha demorado la administración de epinefrina podrían asociarse a un mayor riesgo de presentar reacciones bifásicas. Generalmente, el mismo órgano está envuelto en la reacción inicial y en la secundaria. En pacientes con reacciones severas o refractarias a tratamiento, el tiempo de observación post reacción debe ser mayor. Debe tenerse especial cuidado en pacientes con vía aérea reactiva, pues estos casos están asociados a una mayor mortalidad.
Una vez estabilizado (si su condición lo permite), el paciente y sus familiares, deben recibir una prolija información sobre lo sucedido, los posibles cursos futuros de su condición y las acciones próximas a seguir, especialmente en relación con la identificación del agente que causó la reacción.
DERIVACIÓN DEL PACIENTE A ESTUDIO ALEGOANESTÉSICO
Se trata de prevenir una nueva exposición a la droga o agente responsable de la crisis inicial, que podría desencadenar un nuevo cuadro agudo con secuelas graves e incluso, costar la vida del paciente 2 , 20 ,21 . Previniendo estas reacciones, llamadas secundarias, será posible disminuir la incidencia de anafilaxia perioperatoria 1 , 5 .
Este estudio debería estar a cargo de un equipo que incluya al menos 2 médicos: uno con experiencia en anestesia y otro en alergias 2 , 3 .
Como no existe premedicación alguna que pueda prevenir efectivamente una reacción anafiláctica, es de responsabilidad del anestesiólogo que presenció y diagnosticó clínicamente el cuadro agudo, que el paciente sea sometido a estudio alergológico. Los objetivos de este estudio son:
-
Identificar posibles reacciones cruzadas del agente/droga responsable con otras moléculas, especialmente en el caso de los bloqueadores neuromusculares (BNM) 1 ,2,21 .
-
Educar al paciente en medidas necesarias para evitar futuras reacciones y proporcionar recomendaciones a considerar en caso de anestesias futuras 2 , 22 ,23 .
Tanto para el paciente como para el futuro personal encargado de una próxima anestesia, es muy tranquilizador saber que ha sido sometido a una investigación competente y estandarizada 4 .
Las reacciones anafilácticas alérgicas 24 , especialmente aquellas mediadas por IgE, son más severas frente a exposiciones subsecuentes de la droga causal, mientras que las no alérgicas 24 tienden a presentarse con severidad similar ante administraciones repetidas 25 .
A diferencia de la anafilaxia no alérgica, la causa de anafilaxia alérgica puede ser dilucidada por test inmunológicos específicos para la droga sospechosa. Éstos pueden ser pruebas cutáneas o determinaciones in vitro de IgE específicas contra drogas estudiadas 2 , 3 ,23 .
Todos los pacientes que sufren reacciones anafilácticas moderadas y severas durante la anestesia (Clase II a IV según la clasificación de manifestaciones clínicas de anafilaxia durante la anestesia 23 ), deben someterse a estudio primario o inmediato con test sanguíneos y a estudio secundario con test de alergias 4 , 21 . Esta misma conducta debe ser seguida por pacientes que reaccionan con urticaria localizada o generalizada luego de exposición a clorhexidina, pues en estos casos reacciones leves han precedido a eventos más severos 4 .
Aunque existen varios exámenes que ayudan a hacer el diagnóstico, ninguno de los disponibles ha demostrado absoluta exactitud1. Idealmente el diagnóstico de anafilaxia durante la anestesia debe hacerse sobre la base de diferentes exámenes confirmatorios, más que sobre sólo uno. En caso de discrepancias entre los diferentes exámenes, el especialista en alergias debe recomendar un medicamento alternativo que haya resultado completamente negativo en todas las pruebas 1 , 21 ,23 . Sin embargo, esta recomendación no garantiza una absoluta prevención de futuras reacciones adversas 2 , 23 .
En el estudio alergológico al que se someterá el paciente que presentó una anafilaxia perioperatoria, los especialistas deben considerar, analizar y valorar elementos clínicos y de laboratorio que se manifiestan en las diversas etapas del proceso quirúrgico. Todos estos antecedentes deben quedar cuidadosamente consignados por el anestesiólogo responsable en los registros anestésicos, para quedar a disposición de quienes realicen este estudio. La Figura 2 resume el diagrama de flujo para el estudio alergoanestésico.
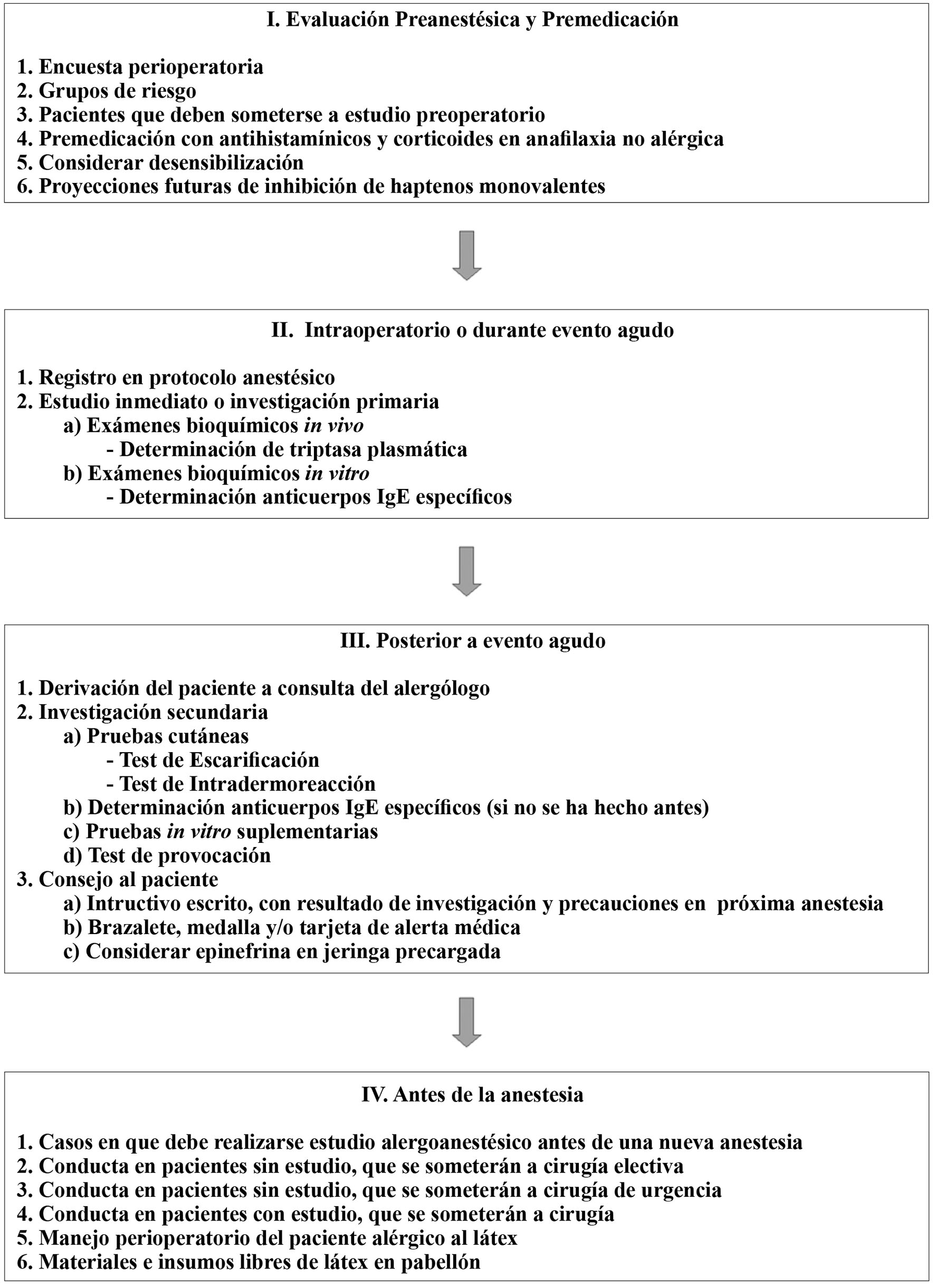
Figura 2 Diagrama de flujo para el estudio alergoanestésico.
-
I- Evaluación preanestésica y premedicación
Al realizar una anamnesis de las reacciones adversas a drogas durante la evaluación preanestésica, dependiendo de las diferentes publicaciones, entre el 25% y el 39% de los pacientes dicen ser “alérgicos” a un medicamento, alimento u otra sustancia. Desgraciadamente la veracidad de estos datos es bastante cuestionable. Algunos dicen ser incluso “alérgicos a la anestesia general” por el solo hecho de haber sufrido náuseas o vómitos en una intervención anterior.
Un estudio de McPherson 26 demuestra que a pesar de un detallado cuestionario y registro, en 101 (15,6%) oportunidades de 644 reacciones reportadas, se administró un medicamento de grupo químico relacionado (generalmente el beta-lactam: cefazolina por penicilina) e incluso en 13 (2%) casos se administró exactamente la droga registrada con antecedentes de alergia (generalmente morfina).
Durante la visita preanestésica debe hacerse una detallada historia remota de reacciones adversas a drogas: deben investigarse las atopias, reacciones alérgicas a drogas, alergia al látex y alimentos (especialmente frutas).
La atopía es una tendencia personal y/o familiar, a ser sensibilizados y producir anticuerpos IgE a varios alérgenos, especialmente proteínas, en respuesta a exposiciones normales. Los alergenos pueden llegar al paciente por vía inhalatoria (polen, polvo de habitación, caspa de animales domésticos) o por el tracto gastrointestinal (alimentos). Las manifestaciones clínicas más comunes de atopía son: asma, rinitis alérgica, conjuntivitis y fiebre de heno en los adultos, y eccema en los niños.
No hay ninguna evidencia para considerar que los antecedentes de atopía hagan necesario un estudio especial a los pacientes que van a ser sometidos a anestesia. Sin embargo, se ha demostrado que los basófilos de los pacientes atópicos liberan histamina con mayor facilidad; la atopía sería de este modo un factor de riesgo para la liberación de histamina de agentes como el tiopental, propofol, gelatinas, mivacurio y atracurio cuando son inyectados rápidamente, pero no para el aumento de incidencia de reacciones anafilácticas.
Fuchs, ha demostrado que los pacientes con asma o rinitis alérgica al polen de pastos y malezas, pueden tener reacción cruzada con el látex. Hay siempre un gran número de pacientes atópicos en las series de pacientes con hipersensibilidad al látex. Esto tampoco justifica por el momento un estudio especial 27 .
Es recomendable el uso de encuestas preoperatorias para la obtención de datos sobre reacciones adversas a drogas. La historia clínica debe ser la base del interrogatorio. La European Network of Drug Allergy, que es el grupo de interés de la European Academy of Allergy and Clinical Immunology (EAACI) 28 , ha desarrollado un cuestionario que puede constituirse en una guía en esta difícil área de la medicina clínica, sin embargo, parece más aplicable a nuestra especialidad y más específico para una evaluación preanestésica el cuestionario recomendado por Buaziz y Laxenaire 21 . Cada encuesta debe estar adaptada a la realidad de cada país y de cada institución (Figura 3).

Figura 3 Proposición de encuesta preoperatoria, según Buaziz y Laxenaire21.
Ningún estudio considera razonable realizar una investigación preoperatoria para pesquisar alergia a anestesia a la población quirúrgica general 1 . Sin embargo, durante la evaluación preanestésica es posible identificar grupos de pacientes cuyo riesgo de presentar anafilaxia intraoperatoria es mayor. La medida permite prevenir anafilaxis perioperatoria 4 , 29 .
Se puede aislar grupos de más riesgo en base a los siguientes factores:
Sexo: Los reportes demuestran consistentemente que los casos de reacciones anafilácticas son más frecuentes en mujeres que en hombres en proporción 2,7-8,1:1, especialmente en lo que concierne a las reacciones a los BNM 18 ,30–32 . Se cree que esta diferencia puede tener relación con la reacción cruzada a productos usados en cosmetología, que contienen amonio cuaternario, pero no ha sido confirmado. Esto no significa tener que tomar una acción especial de premedicación o estudio previo en las pacientes de sexo femenino.
Edad: El máximo de frecuencia se ubica entre los 40 y 60 años en los hombres y entre los 30 y 60 en las mujeres, con una incidencia máxima en la quinta década¿1818?. Un gran grupo de pacientes con reacciones al látex se observa en niños multioperados, especialmente con espina bífida, lo que no ocurre en adultos. En Chile, se ha demostrado que una sola intervención durante el período de recién nacido, tiene una alta posibilidad de sensibilización al látex 33 .
Antecedentes de atopía: Se sospecha en pacientes con eccema, asma o rinitis alérgica. Hay una mayor incidencia de alergia al látex en los pacientes con antecedentes de atopía. En el caso de los BNM, esta asociación no ha podido ser demostrada. Tiene un valor predictivo para las drogas que producen liberación inespecífica de histamina, pero no para las reacciones anafilácticas.
Antecedentes de alergia medicamentosa: Un factor de riesgo mayor es el antecedente de una reacción inexplicada en una anestesia anterior. Si la reacción ocurrió en relación a un BNM, el problema no se soluciona administrando un agente de otro grupo químico o de reciente introducción, sino que se justifica realizar un estudio preoperatorio y evitar estos agentes en la medida que sea posible.
Alergia al látex: Se describen antecedentes de prurito, urticaria o angioedema de contacto. En personas que usan guantes de látex o trabajan en una atmósfera rica en partículas de látex, se describen manifestaciones conjuntivales, rinitis y asma (trabajadores de la industria del látex 34 , profesionales de la salud 35 , 36 ). En un tercio de los pacientes en que se demuestra una reacción anafiláctica al látex, un cuidadoso estudio postoperatorio revela la presencia de síntomas sugerentes de sensibilización previos a la reacción 37 , 38 .
Recientemente se han propuesto recomendaciones para identificar a la población en riesgo de anafilaxia perioperatoria que podría beneficiarse de una evaluación preoperatoria más precisa 39 , para investigar sensibilización a drogas y a agentes de uso perioperatorio, siempre que la oportunidad de la cirugía lo permita 1 ,21,23 . Debe tenerse presente que tanto la obtención de resultados falsos negativos como falsos positivos pueden tener muy malas consecuencias. Los siguientes pacientes, por considerarse de riesgo mayor, deben ser sometidos a estudio preoperatorio:
-
Pacientes que son alérgicos a una de las drogas o productos que probablemente serán administrados durante la anestesia y en quiénes el diagnóstico ha sido previamente establecido con un estudio alergológico.
-
Pacientes que han presentado reacción anafiláctica (diagnosticada o no por investigación alergológica) perioperatoria previa o colapso cardiorespiratorio en cirugía previa 1 , 5 ,40 .
-
Pacientes alérgicos al látex conocidos o con manifestaciones clínicas de alergia frente al contacto con elementos que contienen látex (globos, preservativos, guantes, juguetes).
-
Pacientes con mayor riesgo de presentar alergia al látex 20 , 25 ,41 .
-
Aquellos con exposición significativa: trabajadores de la salud, trabajadores de la industria del látex, pacientes que han requerido de múltiples intervenciones quirúrgicas o procedimientos médicos (contacto periódico con insumos que contienen látex), pacientes portadores de espina bífida, pacientes portadores de anormalidades urogenitales.
-
Aquellos alérgicos a algunas frutas, especialmente palta, plátano y castaña, pero también kiwi, mango, piña, papaya, maní, nueces, avellanas y frutos tropicales en general.
-
Aquellos genéticamente predispuestos (atópicos).
-
Algunos autores consideran como susceptibles de alergia al látex a pacientes con historia de fiebre de heno, rinitis, asma o eccema (atopía) 42 .
-
Pacientes portadores de mastocitosis son propensos a presentar reacciones perioperatorias similares a anafilaxia 20 .
-
Pacientes portadores de deficiencia del inhibidor de la esterasa C1 pueden experimentar una exacerbación de su enfermedad con edema cutáneo, laríngeo y/o gastrointestinal 20 .
Un régimen de pretratamiento con bloqueadores H1 y H2 y con esteroides puede ser efectivo en anafilaxias no alérgicas, como en el caso de reacciones a medios de contraste en que hay una activación del complemento vía alterna, cuyo mecanismo es no inmunológico, pero tiene un valor limitado en anafilaxias alérgicas 1 ,5,17,21,40 . En estos casos, se recomienda destinar estos medicamentos al tratamiento secundario del enfrentamiento agudo.
La profilaxis de una reacción anafiláctica es el componente más importante para disminuir su incidencia 5 . Ninguna premedicación previene efectivamente la anafilaxia alérgica: su única prevención es evitar el contacto con la droga desencadenante 25 .
El paciente que no tiene droga alternativa disponible a aquella que desencadenó la reacción, puede ser desensibilizado siempre que se trate de un mecanismo mediado por IgE. Los pacientes pierden, transitoriamente, la positividad a los test cutáneos luego de ser desensibilizados. Se produce una tolerancia temporal mientras haya niveles sistémicos continuos del alérgeno; el mecanismo por el cual esto ocurre es desconocido 5 , 25 .
Se ha logrado disminuir significativamente, aunque no abolir completamente, las reacciones alérgicas a dextrán mediante la inhibición de haptenos monovalentes 43 . Los haptenos monovalentes ocupan el sitio del anticuerpo, impidiendo que las IgE se unan a células sensibilizadas. Es una forma de prevención interesante de investigar para otros agentes 1 .
Para prevenir futuros episodios de anafilaxia, es esencial un adecuado registro de los hechos durante la anestesia, la referencia del paciente al alergólogo para la identificación de la droga o agente desencadenante y una apropiada conclusión del estudio realizado conjuntamente con el etiquetado o rotulación posterior del paciente como “ALÉRGICO A…” 5 .
-
II- Intraoperatorio o durante evento agudo
-
1. Registro en protocolo anestésico
-
Informe detallado de la reacción: síntomas, severidad y curso temporal. Las reacciones por drogas de administración EV suelen ser inmediatas, versus aquellas por agentes cuya absorción es lenta, los que determinan reacciones más tardías, como látex, desinfectantes y colorantes (azul de metileno, azul patente, índigo carmín) 2 ,20,25,27 .
-
Drogas utilizadas durante la anestesia: hacer distinción entre las utilizadas antes y aquellas usadas después del inicio de la reacción 3 , 4 .
-
Sustancias utilizadas por el cirujano no administradas por vía EV: anestésicos locales, látex, fluidos irritantes, desinfectantes, medios de contraste, colorantes 3 , 4 .
-
Tratamiento recibido 4 .
-
Exámenes de laboratorio solicitados y sus resultados.
-
2. Estudio Inmediato
También llamado investigación primaria. Consiste en obtener una muestra sanguínea suficiente para efectuar estudios in vivo e in vitro, que se realizan preferentemente en el suero 2 , 4 ,23 :
-
Exámenes bioquímicos in vivo: su función esencial es determinar si el mecanismo de la reacción es alérgico o no alérgico.
-
Determinación de HISTAMINA plasmática 23 . Ya no es recomendada por la mayoría de los autores 2 , 4 ,20 . No se mide en forma rutinaria debido a su vida media demasiado corta, de sólo pocos minutos; además es poco sensible y poco específica para determinar el mecanismo inmunológico de reacción anafiláctica 1 .
-
Determinación de TRIPTASA plasmática. Se debe comparar con valores controles (preoperatorios o 24 a 48 horas post reacción). Idealmente, la muestra debe ser tomada entre 1 y 4 horas después de iniciados los síntomas 1 , 2 ,25 . Su sensibilidad para determinar el mecanismo inmunológico es baja y su especificidad alta 1 .
La triptasa sérica no diferencia en absoluto entre activación de mastocitos inmunológicamente y no inmunológicamente mediada. Sin embargo, las elevaciones de la triptasa debido a reacciones no inmunológicas son menos prevalentes y menos pronunciadas que las que son consecuencia de activación de mastocitos inmunológicamente mediada 7 , 18 ,20 . Del mismo modo, una ausencia de elevación de triptasa plasmática no descarta reacción anafiláctica 1 , 5 ,25 . A pesar de su excelente valor predictivo positivo, su relativamente baja sensibilidad no le permite ser utilizada como único elemento para tomar la decisión de someter o no al paciente a un estudio alergológico, o para determinar el mecanismo de la reacción 44 .
-
Exámenes bioquímicos in vitro: su función es determinar el agente causal.
Determinación de anticuerpos IgE específicos contra drogas/agentes incriminados a través de diversos métodos o técnicas 2 , 4 ,20 . Si bien es posible realizarlos para varias drogas y agentes de uso perioperatorio 1 , 24 ,25 , considerando su sensibilidad y especificidad, están indicados en caso de anafilaxia a BNM, tiopental y látex. Deben ser realizados en el momento de la reacción (como parte del estudio inmediato) o hasta antes de cumplidos los 6 meses de ocurrida (como parte del estudio secundario), pues con el tiempo la sensibilización se debilita. Para los BNM, la sensibilización puede permanecer por 30 años 1 , 23 .
-
III- Posterior a evento agudo
-
1. Derivación del paciente a la consulta del alergólogo
Debe portar la siguiente información 4 :
-
Resultados de histamina sérica.
-
Resultados de triptasa sérica.
-
Resultados de exámenes in vitro relevantes (IgE específicas).
-
Una cuidadosa y detallada historia clínica, que constituye la fuente más importante de información cuando se investiga una reacción anafiláctica previa, incluyendo 1 ,3,23 :
-
Listado de drogas y sustancias de exposición previa a reacción.
-
Registro de anestesia y signos vitales.
-
Tratamiento recibido en relación a reacción anafiláctica previa.
-
Historia de alergias conocidas (atopía y alergia a frutas se relaciona con alergia al látex).
-
Listado de medicación habitual.
-
Historia médica previa.
-
Detalles de reacción durante anestesia previa, en caso de existir.
Se enfatiza la importancia de reinterrogar al paciente y/o familiares directos en forma dirigida, luego de una reacción anafiláctica perioperatoria. Con mucha frecuencia se acuerdan de signos de alergia en cirugías previas o en su cotidianidad, que no mencionaron o no fueron investigados durante la evaluación preanestésica 3 , 10 .
-
2. Estudio o investigación secundaria
a) Pruebas cutáneas:
Su función es determinar agente causal. Constituyen el estándar de oro para detectar reacciones mediadas por IgE, exponiendo mastocitos de la piel al alergeno sospechoso. Hay 2 tipos de pruebas cutáneas 1 , 2 ,20 :
-
Prick skin test (PST) o test de escarificación.
-
Intradermoreaction test (IDT) o test de intradermoreacción.
Las pruebas cutáneas a practicar deben incluir el látex y todas las drogas inyectadas antes de la reacción4. No tienen ningún rol como parte de un estudio sistemático preoperatorio en la población general 1 , 2 ,25 .
Deben realizarse 4 a 6 semanas posterior a la reacción para evitar falsos negativos que ocurren como consecuencia de la depleción de mediadores en el interior de los mastocitos 1 , 2 ,5 .
Se recomienda comenzar con el SPT 2 , 4 ,20 . La IDT se reserva en caso de un SPT negativo, dudoso 2 , 20 o para investigación de reacciones cruzadas a BNM 1 . Para el IDT se utilizan diluciones mayores en caso de agentes liberadores de histamina como morfina y BNM. Si el IDT inicial es negativo, se debe utilizar diluciones menores con intervalos de 15 a 20 minutos, sin exceder las concentraciones máximas 1 . Si el PST es positivo, no es necesario realizar IDT o hacerlo con diluciones mayores a las habituales.
Estos criterios son los utilizados por la Sociedad Francesa de Anestesiología y Cuidados Intensivos, también en países escandinavos y son recomendados por otros autores 2 , 20 .
Las diluciones deben ser recién preparadas y bajo condiciones de esterilidad 3 . Deben utilizarse procedimientos y diluciones estandarizadas y precisamente definidas para cada agente testeado con el fin de evitar reacciones falsas positivas, debido a la propiedad que tienen algunas drogas de producir liberación directa de histamina 1 , 23 . En paralelo deben realizarse controles negativos con solución salina y controles positivos con codeína 1 . Las pruebas cutáneas se realizan en el antebrazo o espalda y se leen luego de 15 a 20 minutos 1 , 3 . El SPT se considera positivo cuando el diámetro de la pápula es por lo menos igual a la mitad de la pápula resultante del control positivo y al menos 3 mm mayor que el control negativo 1 . El IDT se considera positivo si el diámetro de la pápula mide el doble o más que la pápula inyectada 1 , 3 .
La sensibilidad estimada para las pruebas cutáneas en el caso de los BNM es de 94% a 97%. La sensibilidad para otras sustancias o agentes es variable, siendo buena para el grupo beta-lactam y gelatinas, y mala en el caso de los barbitúricos, opioides y benzodiacepinas 1 .
Algunas drogas como los antagonistas de receptores H1, vasoconstrictores (efedrina) y neurolépticos, que modifican la reactividad de la piel, deben ser suspendidos al menos 5 días antes del examen. También las diálisis y el consumo exagerado de tabaco, por vasoconstricción, disminuyen la reactividad de la piel. Ésta puede aumentar en presencia de dermografismo o urticaria crónica. El embarazo, no es contraindicación pero aumenta los falsos negativos 2 .
b) Anticuerpos IgE específios
Debe hacerse una determinación de anticuerpos IgE específicos contra drogas/agentes posiblemente implicados, si no se ha efectuado en el momento de la reacción.
c) Pruebas in vitro suplementarias
Se ha propuesto una serie de estudios de liberación de mediadores que permiten determinaciones indirectas de IgE específicas para drogas anestésicas. Entre ellos:
-
Estudio de activación de los basófilos.
-
Prueba de liberación de histamina leucocitaria.
-
Análisis flujo citométrico de los basófilos activados in vitro.
No hay suficiente experiencia con estos exámenes como para recomendarlos como parte de un programa de investigación estándar de alergia anestésica. Necesitan validación. Algunas publicaciones recomiendan realizarlos en caso de resultados inconsistentes entre los exámenes de uso habitual 1 , 4 ,23 .
d) Test de provocación
Consiste en administrar pequeñas cantidades de antígeno en concentraciones crecientes, llegando hasta concentraciones de 1:10, e incluso a full dosis 1 , 2 ,4 .
Se ha realizado con anestésicos locales, analgésicos, látex y antibióticos, probablemente para evitar efectos farmacológicos de anestésicos y BNM. Debe efectuarse según recomendaciones de la Eureopean Network for Drug Allergy y Academy of Allergy and Clinical Immunology. Considerado como un procedimiento de alto riesgo, debe contarse con consentimiento, monitorización, vía venosa permeable y condiciones para reanimación.
El método no es ampliamente recomendado, se realiza en escasos centros europeos. Se sugiere realizarlo en caso de historia clínica muy sugerente, acompañada de pruebas cutáneas y determinaciones de IgE negativas, dudosas o inconsistentes 2 , 4 ,20 . En varios países se considera estándar de oro en el diagnóstico de anafilaxia a los anestésicos locales 2 , 5 ,20,23 .
-
3. Consejo al paciente
Una vez considerada la historia y los antecedentes clínicos, el estudio primario y el estudio secundario, quienes son responsables del estudio alergológico deben emitir una conclusión diagnóstica.
El paciente debe ser advertido del resultado de la investigación y de sus implicancias, aunque resulte negativo 3 , 4 ,23 . En este caso se debe reevaluar historia clínica para pesquisar alergenos no identificados previamente 3 . Idealmente, debe entregarse un documento al paciente con información de la reacción, drogas/sustancias involucradas, resultado de la investigación y precauciones que debe tener en próximas anestesias 1 , 2 ,23 . Esto incluye la entrega de un instructivo escrito, para evitar inconsistencias y confusión. Es muy recomendable la utilización de un brazalete o tarjeta de alerta médica en caso de ser positivo a una droga o substancia 1 , 3 ,10 . Si se identifican alergenos desencadenantes de reacciones anafilácticas a las que sea posible exponerse en ambientes no quirúrgicos o de la vida cotidiana (por ejemplo, alergia a alimentos), se debe proveer al paciente de adrenalina, en lo posible en jeringas precargadas 3 .
-
IV-Antes de la Anestesia
Idealmente, todo paciente que experimenta anafilaxia durante un acto anestésico-quirúrgico, debe ser sometido a una investigación alergoanestésica antes de una siguiente intervención quirúrgica. Desgraciadamente, esto no siempre se cumple. En los lugares en que existe la tecnología, en ocasiones estos pacientes requieren de anestesia para cirugía de emergencia cuando aún no hay información sobre la reacción previa o cuando ésta es insuficiente. En otros lugares no se ha establecido cómo realizar la investigación ni están disponibles los exámenes necesarios para llevarla a cabo 4 .
-
1. Estudio alergoanestésico antes de una nueva anestesia
Debe realizarse en los siguientes casos 21 , 23 :
-
Pacientes con alergia documentada a látex u otra droga usada en anestesia.
-
Pacientes que presentaron una reacción no explicada durante una anestesia previa, caracterizada por hipotensión severa, broncoespasmo y/o edema. Si los registros anestésicos no están disponibles, se deben estudiar los agentes más frecuentemente implicados en estudios epidemiológicos: BNM, látex y antibióticos 18 .
-
Pacientes que afirman ser alérgicos a anestésicos locales y se ha considerado su uso. En ellos deben estudiarse los anestésicos locales de uso más frecuente.
-
Pacientes que pertenecen al grupo de alto riesgo de sensibilización a látex.
Ante un paciente que refiere haber presentado anafilaxia en relación a una intervención quirúrgica/anestesia previa, es necesario responder las siguientes interrogantes 4 :
¿La reacción fue anafiláctica alérgica?
¿La reacción fue anafiláctica no alérgica?
¿La reacción fue investigada?
¿Se requiere información adicional?
Esta evaluación debe realizarse respetando la oportunidad de la cirugía, no debiendo demorar una eventual cirugía de urgencia. Otros riesgos de la anestesia, como estómago lleno y vía aérea difícil, también deben ser considerados al momento de idear una estrategia para abordar al paciente con antecedentes de anafilaxia durante el curso de una anestesia/cirugía previa 4 .
Es de primera importancia conocer si el paciente se sometió a estudio alergoanestésico luego de anafilaxia perioperatoria anterior.
-
2. Conducta en caso de pacientes sin estudio alergoanestésico, que serán sometidos a cirugía electiva
Si el paciente no fue sometido al estudio de una reacción anafiláctica en una cirugía previa y la cirugía actual es electiva, se debe reunir toda la información disponible en relación a la reacción, especialmente aquella que consta en el protocolo anestésico. Si la información reunida sugiere que se trató de una reacción anafiláctica o si no se consigue información sobre la reacción y ésta es altamente sospechosa de anafilaxia por la historia clínica, el paciente debe ser referido a estudio alergoanestésico. La cirugía electiva se programará después de la investigación 4 , 21 .
-
3. Conducta en caso de pacientes sin estudio alergoanestésico, que serán sometidos a cirugía de urgencia/emergencia
Si el paciente no fue sometido al estudio de una de reacción anafiláctica en una cirugía previa y la cirugía es de urgencia/emergencia, se debe reunir toda la información disponible en relación a la reacción, especialmente aquella que consta en el protocolo anestésico, durante un tiempo que no exponga al paciente a amenaza vital. Si la información sugiere que se trató de una reacción anafiláctica, deben evitarse todas las drogas/sustancias usadas previas a la reacción ocurrida en la anestesia previa. Si no existe información rápidamente disponible y hay altas sospechas de anafilaxia o si la información sugiere anafilaxia, entonces 4 , 21 ,40 :
-
Considerar premedicación con antihistamínicos y esteroides.
-
Administrar anestesia y realizar cirugía en ambiente libre de látex (utilizar el pabellón que lleva más tiempo desocupado).
-
Utilizar anestesia local o regional siempre que sea posible (a menos que el agente incriminado sea un anestésico local, lo que es muy infrecuente).
-
Utilizar anestésicos inhalatorios.
-
Usar la menor cantidad de drogas posibles.
-
Evitar el uso de BNM cada vez que sea posible.
-
Evitar el uso de clorhexidina; usar desinfectantes alternativos.
-
Estar preparados para tratar una reacción anafiláctica.
-
4. Conducta en caso de pacientes con estudio alergoanestésico, que serán sometidos a cirugía
Si el paciente se sometió a investigación alergoanestésica y ésta fue positiva evitar droga/agente señalado en documento, tarjeta o brazalete de alerta. En este caso o frente a reacciones consideras negativas, en que se sospecha de anafilaxia no alérgica (liberación inespecífica de histamina), se recomienda 4 :
-
Seguir consejo que entrega investigación alergoanestésica.
-
Considerar premedicación con antihistamínicos y esteroides.
-
Evitar sustancias liberadoras de histamina.
-
Inyectar las drogas lentamente o en forma dividida.
-
Inyectar las drogas en forma separada.
-
Estar preparado para tratar una reacción anafiláctica.
La alta incidencia de reacciones alérgicas cruzadas a BNM implica que no es posible administrarlos en pacientes que ya tuvieron anafilaxia, sin antes asegurarse con pruebas cutáneas negativas 1 , 20 ,21,23 . Esta recomendación no garantiza una prevención absoluta de una futura reacción adversa 23 , siendo el enfrentamiento más seguro, no utilizar BNM cada vez que sea posible 2 , 23 .
-
5. Manejo perioperatorio de pacientes alérgicos al látex
Los pacientes que resulten alérgicos al látex producto de un estudio alergoanestésico, pueden ser intervenidos quirúrgicamente en forma segura en ambiente libre de látex 1 , 25 ,41 .
La disminución de la incidencia de reacciones anafilácticas al látex se ha atribuido a la identificación de los pacientes con mayor riesgo de presentarlas y a una serie de medidas preventivas que se ha implementado en este sentido. Entre ellas 5 , 25 :
-
Identificar pacientes de riesgo, especialmente con una historia cuidadosa.
-
Los pacientes con historia sugerente y confirmación de laboratorio (cuando es posible), deben ser manejados evitando completamente el látex.
-
Coordinar equipos: anestesiólogos, cirujanos, enfermeras de pabellón y técnicos paramédicos.
-
Disponer permanentemente de equipamiento libre de látex, para pabellón libre de látex, almacenado en un sitio determinado y conocido, en centros donde se realiza cirugía de urgencia/emergencia.
-
Programar el paciente de cirugía electiva a primera hora, pues hay una menor cantidad de partículas de látex en suspensión; éstas pueden permanecer suspendidas en aire por más de 5 horas.
-
Disponer letreros “ALERGIA AL LÁTEX” en todas las puertas del pabellón, así como en la cama del paciente durante el período postoperatorio. No debe entrar al pabellón ninguna persona con guantes de látex.
-
Revisar todo el equipamiento que será utilizado y verificar que sea libre de látex.
-
Una carta libre de látex (listado de insumos sin látex) debe acompañar al paciente durante su hospitalización.
-
Instruir al paciente sobre la utilización de algún sistema de identificación (brazalete o medalla), que indique su condición de alérgico al látex.
-
Profilaxis farmacológica: aunque es controversial, se han usado bloqueadores H1, H2 y corticoesteroides. Actualmente no es recomendado en forma mayoritaria.
-
6. Materiales e insumos libres de látex en pabellón
Una de las medidas más importantes de las enumeradas, es disponer permanentemente de equipamiento libre de látex, que debe ser almacenado en un sitio determinado y conocido del recinto quirúrgico, en los centros donde se realiza cirugía de urgencia/emergencia. Al momento de decidir adquisiciones de insumos anestésicos y quirúrgicos siempre debe optarse por aquellos libres de látex. El equipamiento que podría tener látex entre sus componentes y que debe verificarse que sea libre de látex antes de ingresar el paciente alérgico al pabellón es:
a) Equipo General
-
Gorro de pabellón libre de látex.
-
Guantes estériles de polivinilo.
-
Guantes de procedimientos de polivinilo.
-
Tela adhesiva libre de látex.
-
Preservativos libres de látex.
b) Equipo Anestésico
-
Bajadas de soluciones parenterales libres de látex.
-
Bajadas de hemoderivados libres de látex.
-
Ligadura libre de látex (puede utilizarse guante de polivinilo).
-
Jeringas desechables libres de látex.
-
Jeringas de insulina libres de látex.
-
Medicamentos en ampollas de vidrio, sin tapón de goma.
-
Sensor de oxímetro de pulso libre de látex (se puede usar un dedo de guante de polietileno).
-
Manguito de presión arterial y mangueras de insuflación libres de látex.
-
Electrodos libres de látex.
-
Sonda Foley libre de látex (silicona).
-
Sonda de aspiración libre de látex.
-
Sonda naso-gástrica libre de látex.
-
Mascarilla facial de anestesia libre de látex (polivinilo).
-
Circuito respiratorio libre de látex (polivinilo).
-
Bolsa de anestesia libre de látex (neoprene).
-
Fuelle del respirador libre de látex (neoprene o silicona).
-
Cánulas oro y nasofaríngeas libres de látex.
-
Tubos endotraqueales libres de látex (polivinilo).
-
Bolsa del resucitador tipo Ambú libre de látex (silicona).
-
Estetoscopio libre de látex.
-
Verificar anticipadamente las máquinas de anestesia que son libres de látex.
c) Equipo quirúrgico
-
Guantes quirúrgicos libres de látex.
-
Drenajes libres de látex.
-
Evitar clamps cubiertos de látex.
-
Jeringas para irrigación libres de látex.
-
Evitar cintas vasculares de goma.
-
Vendajes autoadhesivos libres de látex.
Conclusión
En consecuencia, considerando las dificultades y complejidades de la investigación alergoanestésica, la necesidad de contar con una política activa para identificar a los pacientes de riesgo y de proveer todo el soporte que los especialistas anestesiólogos y alergólogos requieren para el abordaje de esta complicación perioperatoria, debería estimularse en nuestro país, la formación de al menos 1 centro de alergoanestesia 1 , 23 ,29 . Además de la implementación necesaria para efectuar el diagnóstico de anafilaxia y la identificación del agente implicado, la función de estos centros incluye la producción y distribución de material educativo que contenga información importante respecto de este tema, dirigido a pacientes y a anestesiólogos.
Cada reacción anafiláctica perioperatoria debe reportarse a las autoridades de farmacovigilancia locales o nacionales, de acuerdo al procedimiento vigente 3 , 4 .
Bibliografía
- Mertes PM, Lambert M, Guéant-Rodríguez RM, et al. Perioperative Anaphylaxis. Immunol Allergy Clin N Am 2009; 29: 429-451.
- Dewachter P, Mouton-Faivre C. What investigation after an anaphylactic reaction during anaesthesia? Curr Op Anaesthesiol 2008; 21: 363-368.
- McNeill O, Kerridge RK, Boyle MJ. Review of procedures for investigation of anaesthesia-associated anaphylaxis in Newcastle, Australia. Anaesth Intensive Care 2008; 36: 201-207.
- Kroigaard M, Garvey LH, Gillberg L, et al. Scandinavian Clinical Practice Guidelines on the diagnosis, management and follow up of anaphylaxis during anaesthesia. Acta Anaesthesiol Scand 2007; 51: 655-670.
- Hepner DL, Castells MC. Anaphylaxis during the perioperative period. Anesth Analg 2003; 97: 1381-1395.
- Schummer W, Schummer C, Wippermann J, et al. Anaphylactic shock: Is vasopressin the drug of choice? Anesthesiology 2004; 101: 1025-1027.
- Jacobson J, Lindekaer AL, Ostergaard HT, et al. Management of anaphylactic shock evaluated using a full-scale anaesthesia simulator. Acta Anaesthesiol Scand 2001; 45: 315-319.
- Special Issue Internacional Guidelines 2000 for CPR and EEC A Consensus on Science. Part 8: Advanced Challenges in Resuscitation. Section 3: Special Challenges in EEC. 3D: Anaphylaxis. Resuscitation 2000; 46: 285-288.
- Sprung J, Matesic D, Hebl J. Anaphylaxis Is Not a Dose/Response Effect. In Response Anesth Analg 2005; 100: 597-605.
- Meng L, Lynne Williams E. Case report: Treatment of rocuronium-induced anaphylactic shock with vasopressin. Can J Anesth 2008; 55: 437-440.
- Sampson HA, Muñoz-Furlong A, Bock SA, et al. Symposium on the Definition and Management of Anaphylaxis: Summary report. J Allergy Clin Immunol 2005; 115: 584-591.
- Sampson HA, Muñoz-Furlong A, Campbell RL, et al. Second Symposium on the Definition and Management of Anaphylaxis: Summary report-Second National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network Symposium. Ann Emerg Med 2006; 47: 373-380.
- American Heart Association. Management of cardiac arrest. Circulation 2005; 112: 58-66.
- European Resuscitation Council Guidelines for Resuscitation 2005. Resuscitation 2005; 67S1: S1-S189.
- American Heart Association. Anaphylaxis. Circulation 2005; 112: 143-145.
- Schummer C, Wirsing M, Schummer W. The pivotal role of vasopressin in refractory anaphylactic shock. Anesth Analg 2008; 107: 620-624.
- Levy JH. Anaphylaxis and adverse drug reactions. 57th Annual Refresher Course Lectures and Basic Science Review. ASA 2006.
- Mertes PM, Laxenaire MC. Épidemiologie des reactions anaphylactiques et anaphylactoïdes peranesthésiques en France: Septieme enquête multicentrique (Janvier 2001-Décembre 2002). Ann Fr Anesth Réanim 2004; 23: 1133-1143.
- Breslin DS, McBrien ME. Management of severe anaphylactic reactions should include administration of alfa adrenergic agonists. Anesth Analg 2004; 98: 1499-1505.
- Ebo DG, Fisher MM, Hagendorens MM, et al. Anaphylaxis during anaesthesia: diagnostic approach. Allergy 2007; 62: 471-487.
- Bouaziz H, Laxenaire MC. Anaesthesia for the allergic patient. Curr Op Anaesthesiol 1998; 11: 339-344.
- Lienhart A, Auroy Y. Le choc anaphylact ique existe: nous l’avons rencontré. Ann Fr Anesth Réanim 2004; 23: 1127-1128.
- Mertes PM, Laxenaire MC. Allergy and anaphylaxis in anaesthesia. Minerva Anestesiol 2004; 70: 285-291.
- Johansson SGO, Bieber T, Dahl R. Revised nomenclature for allergy for global use: Report of the nomenclature Review Committee of the World Allergy Organization, October 2003. J Allergy Clin Immunol 2004; 113: 832-836.
- Chacko T, Ledford D. Peri-anesthetic Anaphylaxis. Immunol Allergy Clin N Am 2007; 27: 213-230.
- McPherson RD, Willcox C, Chow C, Wang A. Anaesthetit’s responses to patients self-reported drug allergies. Br J Anaesth 2006; 97: 634-639.
- Fuchs T, Spitzuer S, Vente C, et al. Natural latex, grass pollen, and weed pollen share IgE epitopes. J Allergy Clin Inmmunol 1997; 100: 356-364.
- Demoly P, Kropf R, Bircher A, Pichler WJ. Drug hipersensitivity questionaire. Allergy 1999; 54: 999-1003.
- Mertes PM, Laxenaire MC, Alla F. Anaphylactic and Anaphylactoid Reactions Occurring during Anesthesia in France. Anesthesiology 2003; 99: 536-545.
- Fischer MM, Baldo BA. Incidence and clinical features of anaphylactic reactions during anesthesia in Australia. Ann Fr Anesth Réanim 1993; 12: 97-104.
- Mertes PM, Laxenaire MC. Allergic Reactions occurring during anaesthesia. Eur J Anaesthesiol 2002; 19: 240-262.
- Laxenaire MC, Mertes P. Anaphylaxis during anaesthesia. Results of a 2 year survey in France. Br J Anaesth 2001; 87: 549-558.
- Agurto M, Ojeda D, Rubio ML, et al. Sensibilización al látex: factores de riesgo. Congreso Chileno de Anestesiología, Pucón 2008.
- Tarlo SM, Wong L, Roos J, Booth N. Occupational asthma caused by latex in a surgical glove manufactory plant. J Allergy Clin Immunol 1990; 85: 626-631.
- Konrad C, Fieber T, Gerber H, et al. The prevalence of latex sensitivity among anesthesiology staff. Anesth Analg 1997; 84: 629-633.
- Tarlo, SM, Sussman GL, Holness DL. Latex sensitivity in dental students and staff: a cross-sectional study. J Allergy Clin Immunol 1997; 99: 396-401.
- Prévention du risque allergique peranesthésique. Recommadatio ns pour la practique clinique. Texte Court. Ann Fr Anesth Réanim 2001; 20: 56-69.
- Task Force on Latex sensitivity. Natural rubber latex allergy: considerations for anesthesiologists. Park Ridge: American Society of Anesthesiologists, 1999.
- Mertes PM, Laxen aire MC, Lienhart A, et al. Reducing the risk of anafilaxis during anaesthesia: guidelines for clinical practices. J Invest Alergol Clin Inmunol 2005; 15: 1087-1097.
- Moss J. Allergy to anesthetics. Anesthesiology 2003; 99: 521-523.
- Task Force on Latex sensitivity. Natural rubber latex allergy: considerations for anesthesiologists. American Society of Anesthesiologists, Committee on Occupational Health of Operation Room Personnel, 2005.
- Task Force on Allergic reaction to Latex. American academy of Allergy and immunology committee report. J Allergy Clin Immunol 1993; 92: 16-18.
- Hedin H, Ljungstrom KG. Prevention of dextran anaphylaxis: ten years experience with hapten dextran. Int Arch Allergy Immunol 1997; 113: 358-359.
- Malinovsky JM, Decagny S, Wessel F, et al. Systematic follow-up increases incidence of anaphylaxis during adverse reactions in anesthetized patients. Acta Anaesthesiol Scand 2008; 52: 175-181.


 Creative Commons Attribution
Creative Commons Attribution