Óscar Andrés Escobar Vidarte MD. FACS.1, Javier Orozco Mera MD.2, Juan Felipe Mier-García MD.3,*
Recibido: 01-09-2022
Aceptado: 12-11-2022
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 3 pp. 304-308|https://doi.org/10.25237/revchilanestv5210031046
PDF|ePub|RIS
Spinal cord stimulation for the treatment of complex regional pain syndrome: A case series
Abstract
Objective: To describe the experience of the Neurosurgery Section of the Universidad [Blinded] in the management of complex regional pain syndrome (CRPS) through stimulation of the posterior cords of the spinal cord (ECPME). Materials and Methods: The medical records of patients with CRPS treated with ECPME between 2018 and 2020 were reviewed. A form was applied that evaluated their socio-demographic characte- ristics, triggering event of the condition, time of evolution of the disease and pre-surgery treatment modalities, surgical intervention performed, pre- and post-operative visual analog scale (VAS), follow-up time, and pre- and post-surgical functionality. Results: We obtained results from 3 women and 2 men. Four of them suffered appendiceal fractures or joint sprain, and 1 patient had a complex brachial plexus injury. There had been at least 1 year of symptoms and they had aggressive first, second and third line pharmacological, non-pharmacological and interventional management before being taken to an ECPM performed at the cervical or dorsal level. There was a 60-90% decrease in pain on the VAS in a follow-up between 1-3 years, with improvement in functionality. Conclusions: The CRPS treatment paradigm includes non-invasive and invasive measures, with ECPME playing a leading role in many refractory cases, with acceptable and persistent symptomatic improvement. A 36% decrease in pain has been previously reported in other studies, a figure lower than that of this series of cases, where the results are superior in relation to the decrease in pain according to the VAS.
Resumen
Objetivo: Describir la experiencia de la Sección de Neurocirugía de la Universidad [Anónimo] en el manejo del síndrome doloroso regional complejo (SDRC) mediante la estimulación de cordones posteriores de la médula espinal (ECPME). Materiales y Métodos: Se revisaron historias clínicas de pacientes con SDRC tratados con la ECPME entre 2018 y 2020. Se aplicó un formulario que evaluó sus características socio- demográficas, evento desencadenante del cuadro, tiempo de evolución de la enfermedad y modalidades de tratamiento pre-cirugía, intervención quirúrgica realizada, escala visual análoga (EVA) pre y posoperatorias, tiempo de seguimiento, y funcionalidad pre y posquirúrgica. Resultados: Se obtuvo resultados de 3 mujeres y 2 hombres. Cuatro de ellos sufrieron fracturas apendiculares o esguince articular, y 1 paciente tuvo una lesión compleja de plexo braquial. Hubo al menos 1 año de síntomas y tuvieron un manejo agresivo de primera, segunda y tercera línea, farmacológico, no farmacológico e intervencionista, antes de ser llevados a una ECPME realizada a nivel cervical o dorsal. Hubo una disminución del dolor del 60%-90% en la EVA en un seguimiento entre 1-3 años, con mejoría en la funcionalidad. Conclusiones: El paradigma del tratamiento del SDRC incluye medidas no invasivas e invasivas, teniendo en muchos de los casos refractarios la ECPME un papel protagónico, con mejoría sintomática aceptable y persistente. Se ha reportado previamente en otros trabajos una disminución del dolor del 36%, cifra menor a la de esta serie de casos, donde los resultados son superiores en relación con la disminución del dolor según la EVA.
-
Introducción
El síndrome doloroso regional complejo corresponde a un conjunto de condiciones caracterizadas por dolor continuo regional (i.e, en la distribución o no de un nervio o dermatoma específico), espontáneo o evocado, desproporcionado en términos de tiempo y severidad respecto a lo esperado para cualquier trauma o lesión conocida/desencadenante, con una confluencia variable de factores asociados como anormalidades sensitivas y motoras, cambios vaso y sudomotores, tróficos, y de la densidad ósea, y alteraciones emocionales, y con un patrón de progresión temporal impredecible y variable, significando discapacidad funcional severa, el padecimiento de trastornos afectivos, aislamiento social, y una alta demanda de recursos para los sistemas de salud[1]. Si bien sólo hasta 1993 el término SDRC fue introducido de manera formal a la literatura médica, actualmente se conoce que entidades previa y distintamente descritas, como la “atrofia ósea aguda”, “algodis- trofia”, “atrofia de Sudeck”, “causalgia”, “distrofia simpática refleja”, o la “osteoporosis transitoria”, se agrupan dentro del mismo espectro del SDRC[2], y la International Association for the Study of Pain, IASP, reconoce criterios diagnósticos clínicos establecidos y validados para esta entidad, con una sensibilidad y una especificidad del 82% y 68%, respectivamente (Tabla 1) [3].
Actualmente, el paradigma clásico del tratamiento del SDRC habla de un abordaje multidisciplinario y multimodal centrado en el paciente, según respuesta y resolución sintomática, y que incluye medidas no invasivas e invasivas como lo son la atención psicológica, rehabilitación física, y el uso alternativas farmacológicas, e intervencionistas en muchos de los casos refractarios (eg, neuromodulación). En las últimas tres décadas, dentro de la neuromodulación, la estimulación de los cordones posterio
res de la médula espinal ha tenido un papel protagónico en el manejo de casos refractarios a otras estrategias de manejo farmacológico y no farmacológico; contribuyendo clásicamente a la inducción de parestesias, ha significado una mejoría sintomática aceptable y mantenida en el tiempo en los pacientes, dentro de los diferentes trabajos publicados[4].
Teniendo profundas repercusiones personales, laborales y económicas, es necesario un conocimiento actualizado del SDRC en términos de su fisiopatología, diagnóstico, tratamiento y pronóstico. En este contexto, se presenta aquí una serie de casos de pacientes con diagnóstico de SDRC refractario a distintas modalidades terapéuticas, con sintomatología y discapacidad severa, y en quien la ECPM contribuyó a un satisfactorio control de su enfermedad.
Tabla 1. Criterios diagnósticos de Budapest de la IASP para el SDRC

-
Materiales y Métodos
Se incluyó retrospectivamente en el estudio a los pacientes tratados en los meses de enero de 2016 a junio de 2018 en la institución [anónimo]. Se obtuvo consentimiento informado de los pacientes incluidos para estudio y la aprobación del comité de ética institucional para la revisión de historias clínicas de los pacientes.
El seguimiento de los pacientes se realizó por un equipo multidisciplinar de la clínica del dolor hospitalaria. Se diagnosticó a los pacientes con SDRC según los criterios definidos por la IASP y se dio manejo de primera, segunda y tercera línea, farmacológico e intervencionista, según las guías de manejo propias de la enfermedad, siendo la cirugía la alternativa de manejo tras refractariedad, utilizando electrodos de 1×8 contactos Vectris SureScanTM y generadores de pulso IntellisTM (Medtronic, Minneapolis, MN, EEUU) para estimulación medular espinal.
Tabla 2. Características demográficas de los pacientes intervenidos
| Paciente | Sexo | Edad (años) | Tiempo de | Tipo de SDRC | Segmento | EVA pre | EVA post |
| evolución | medular | ||||||
| (años, meses) | implantado | ||||||
| 1 | F | 47 | 1,6 | I | Cervical | 10 | 2 |
| 2 | F | 18 | 1,0 | I | Dorsal | 10 | 1 |
| 3 | F | 52 | 2,0 | I | Dorsal | 10 | 3 |
| 4 | H | 24 | 1,0 | I | Cervical | 10 | 2 |
| 5 | H | 43 | 2,0 | II | Cervical | 9 | 4 |
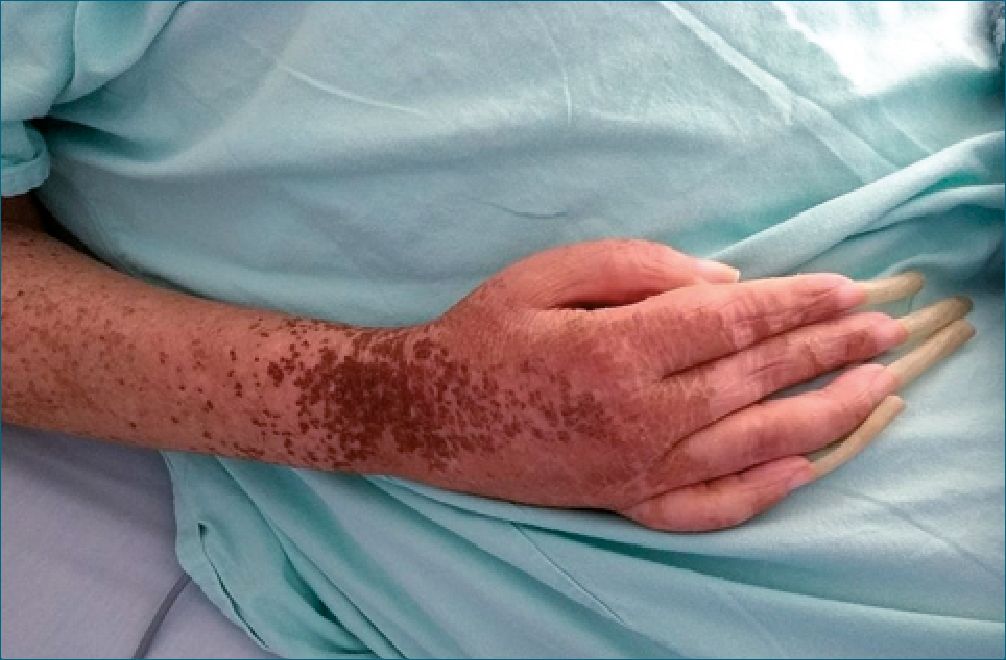
Figura 1. Imagen preoperatoria de una paciente intervenida. Se evidencia la gravedad sintomática de la enfermedad.
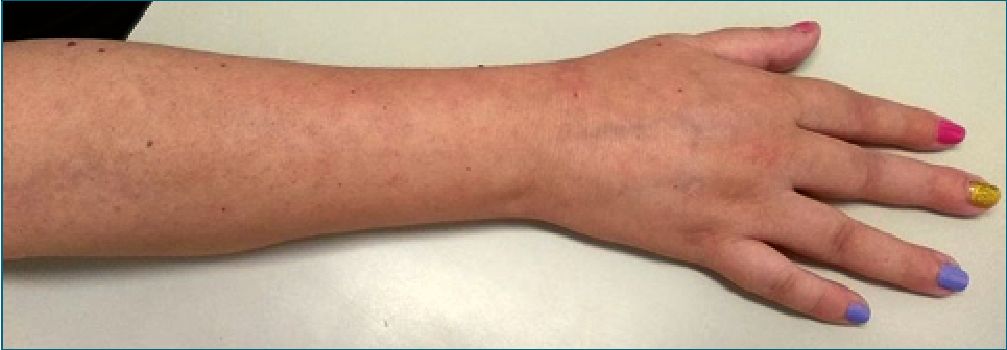
Figura 2. Imagen posoperatoria de una de las pacientes después de un año de seguimiento tras el tratamiento con ECPME.
Se realizó una caracterización sociodemográfica de los pacientes, del tiempo de evolución de su enfermedad, tipo de SDRC, el segmento medular implantado, la severidad del dolor pre y posoperatorio según la escala visual análoga (EVA) del dolor además de una descripción subjetiva sobre funcionalidad y calidad de vida, y el tiempo de seguimiento.
-
Resultados
Se presenta una serie de cinco pacientes (Tabla 2), tres mujeres y dos hombres; cuatro con antecedentes de fracturas apendiculares en extremidades o esguince articular, y uno paciente con una lesión compleja de plexo braquial, todos con al menos 1 año de síntomas como dolor de características neu- ropáticas con alodinia, edema, cambios tróficos en la piel y las faneras (Figura 1), limitación funcional crítica de la extremidad, síntomas depresivos, y refractariedad al manejo agresivo en diferentes regímenes de primera, segunda y tercera línea, farmacológico (ie, acetaminofén, antiinflamatorios no esteroideos, imipramina, gabapentina, pregabalina, duloxetina, tramadol, morfina, oxicodona) no farmacológico (ie, terapia física, ocupa- cional, psicológica, alternativas y cognitiva-conductual) e intervencionista (ie, bloqueos percutáneosde ganglios simpáticos).
La ECPME fue realizada a nivel cervical o dorsal, inicialmente con pruebas terapéuticas, las cuales, de ser satisfactorias, significando un alivio del dolor superior al 50%, eran decisivas para llevar a cabo la tunelización de electrodos y la implantación de generadores de pulso definitivos. Se observó una disminución del dolor entre el 60%-90% en la EVA del dolor, lo cual fue estable en el seguimiento llevado a cabo entre uno y tres años, con mejoría en la funcionalidad pre y posoperatoria.
En el seguimiento a corto plazo, en los meses posteriores a la implantación del estimulador, con la coadministración de fármacos, los pacientes refirieron mejoría sintomática significativa respecto a su estado basal en términos de control del dolor y resolución de cambios de las áreas del cuerpo afectadas (Figura 2).
-
Discusión
La presente serie de casos ilustra el impacto del padecimiento del SDRC en la vida de un paciente, la variabilidad en términos de respuesta a sus alternativas terapéuticas, y la gran utilidad de la ECPME en términos de resolución y remisión de síntomas.
La IASP otorgó al SDRC la definición de síndrome, permitiendo englobar una serie de síntomas y signos clínicos, que no teniendo una causa o etiología común, podrían agruparse, y reconoce dos tipos[4]:
• El I, que corresponde a pacientes que cumplen criterios diagnósticos sin evidencia de daño en el tronco de un nervio periférico o una de sus ramas principales, y que agrupa gran parte del total de casos; en esta serie, el 80% de pacientes.
• El II, que se refiere a aquel cuadro que cumple criterios diagnósticos para la enfermedad y en donde se confirma el daño a un nervio; en esta serie, el 20% de pacientes.
Se han descrito factores desencadenantes de síntomas en
el SDRC como las fracturas, lesiones tipo aplastamiento, luxaciones, estados posquirúrgicos, síndrome del túnel del carpo y traumas cortantes, los cuales son consistentes con los antecedentes de los pacientes aquí presentados; no obstante, hasta 10% de casos pueden ser idiopáticos[5].
El dolor corresponde al síntoma más prominente y discapacitante en el SDRC, y al protagonista en la serie presentada. Este se describe como quemante, tipo punzada o desgarrante, en la profundidad o superficie del área afectada, continuo y fluctuante en severidad o paroxístico, y exacerbado con el movimiento, el mantenimiento de posiciones determinadas, el contacto, cambios en la temperatura ambiental y situaciones estresantes. La hiperalgesia, la alodinia y la hiperestesia son hallazgos comunes al examen físico en el paciente con SDRC, y puede existir limitación funcional de la extremidad en relación con dolor, edema o contracturas. Pueden de igual manera observarse cambios en la temperatura y el color de la piel, aumento de la sudoración, edema, aumento o disminución del crecimiento de las faneras, fibrosis y contractura de las articulaciones y estructuras fasciales, atrofia cutánea y pérdida de la densidad ósea locales[4],[5]. Todo lo anterior, salvo la disminución en la densidad ósea, se observó y documentó en los pacientes de la serie presentada.
El intervencionismo como manejo del SDRC recurre a la infiltración de glucocorticoides en puntos gatillo, los bloqueos simpáticos, la infusión continua de fármacos en el espacio epi- dural y la ECPME, esta última útil en casos refractarios, con tasas de mejoría dramáticas consistentemente satisfactorias tanto en la literatura, como en esta serie[2].
Parte de los fenómenos patológicos tras el SDRC, como se explicó, se asocian a una disrregulación autonómica en los tejidos afectados, con respuestas exageradas a las catecola- minas, con lo cual los bloqueos simpáticos tanto a nivel del ganglio estrellado como en la cadena simpática lumbar para el tratamiento de síntomas en miembros superiores e inferiores, respectivamente, han sido de particular utilidad en el control sintomático inmediato y mediato, con evidencia actual que no permite ni refutar o avalar su uso o beneficio en pacientes con SDRC, pero que según experiencia propia previamente publicada son de gran ayuda y constituyen una herramienta valiosa en el armamentario para el manejo de esta patología[3].
La ECPME corresponde a una terapia reversible usada en el tratamiento de síndromes de dolor neuropático, con técnicas que incluyen generadores de pulso implantados con distintos puertos de salida y una gran variabilidad de electrodos, los cuales pueden ser colocados de manera percutánea o a través de laminotomías, con la gran ventaja de que su prueba terapéutica puede emular el procedimiento de implante definitivo, pudien- do el paciente definir si este tendría algún impacto anticipadamente, ahorrándose costos de la implantación de un dispositivo que no resultaría efectivo en la resolución de síntomas[1].
La ECPME es de gran utilidad en el SDRC cuando otras modalidades terapéuticas han fallado[1]-[3], existiendo recomendaciones vigentes que sugieren su uso en el manejo del dolor refractario a manejo médico[6].
Existe evidencia sobre el impacto de la ECPME en términos de mejoría en la percepción del dolor y calidad de vida, con reportes de satisfacción subjetiva en el seguimiento a 5 años del 95%, siendo superior respecto a modalidades de tratamiento no farmacológico, con evidencia de disminuciones importantes y significativas en la severidad del dolor según seguimientos con el uso de una escala visual análoga en comparación con terapia física, capacidad funcional, y una satisfacción global mantenida en el seguimiento a 5 años[7].
En una revisión sistemática llevada a cabo por Visnjevac et al.[2] recientemente, se evaluó y demostró la eficacia del uso de la ECPME en el SDRC respecto a alivio del dolor, resolución de manifestaciones clínicas y satisfacción en global; teniéndose en cuenta 19 estudios, incluyendo ensayos clínicos aleatorizados, estudios observacionales prospectivos, estudios de cohortes y reportes de casos, desde 1989 hasta el 2015; y si bien resultó inconclusa respecto a los efectos en funcionalidad e impacto psicológico, estos son aspectos en los que se observa un impacto positivo en experiencias individuales y series de casos como la publicada en este y otros trabajos, en donde la disminución del dolor, sumada a mejoría en aspectos como el buen ánimo y la disminución de la fatiga, la tristeza y la rabia han sido evidentes; siendo la experiencia aquí presentada concordante con la literatura publicada respecto a mejoría del dolor y funcionali- dad[8],[9].
Algunos autores han postulado según su experiencia que retrasos en el establecimiento de una terapia definitiva en aquellos no respondedores a medidas no intervencionistas están asociados con desenlaces clínicos desfavorables, haciendo visible e incluso abogando por la necesidad de la aplicación temprana de medidas invasivas para limitar la progresión de la enfermedad y sus secuelas. El pronóstico en el SDRC es incierto y altamente variable respecto a desenlaces clínicos en lo reportado en la literatura, no obstante, es claro que los pacientes sufren de discapacidad de manera prolongada según se evidencia refractariedad a la terapéutica[1],[3],[10].
-
Conclusiones
En la serie de casos presentada es evidente el grado de severidad de la enfermedad, la refractariedad al escalonamien- to progresivo en su abordaje terapéutico, y lo significativo del efecto en términos de remisión de síntomas y recuperación de la funcionalidad con el uso de la ECPME.
Agradecimientos: A Lina María Villegas Trujillo, Profesora de Investigación de la Sección de Neurocirugía.
Fuentes de financiamiento del estudio: Ninguna.
Conflicto de interés: Ninguno.
-
Referencias
1. Hoydonckx Y, Costanzi M, Bhatia A. A scoping review of novel spinal cord stimulation modes for complex regional pain syndrome. Can J Pain. 2019 Mar;3(1):33–48. https://doi.org/10.1080/24740527.2019.1574536 PMID:35005392
2. Visnjevac O, Costandi S, Patel BA, Azer G, Agarwal P, Bolash R, et al. A comprehensive outcome-specific review of the use of spinal cord stimulation for complex regional pain syndrome. Pain Pract. 2017 Apr;17(4):533–45. https://doi.org/10.1111/papr.12513 PMID:27739179
3. Shim H, Rose J, Halle S, Shekane P. Complex regional pain syndrome: a narrative review for the practising clinician. Br J Anaesth. 2019 Aug;123(2):e424–33. https://doi.org/10.1016/j.bja.2019.03.030 PMID:31056241
4. Bussa M, Guttilla D, Lucia M, Mascaro A, Rinaldi S. Complex regional pain syndrome type I: a comprehensive review. Acta Anaesthesiol Scand. 2015 Jul;59(6):685–97. https://doi.org/10.1111/aas.12489 PMID:25903457
5. Ott S, Maihöfner C. Signs and symptoms in 1,043 patients with complex regional pain syndrome. J Pain. 2018 Jun;19(6):599–611. https://doi.org/10.1016/j.jpain.2018.01.004 PMID:29409933
6. Isagulyan E, Slavin K, Konovalov N, Dorochov E, Tomsky A, Dekopov A, et al. Spinal cord stimulation in chronic pain: technical advances. Korean J Pain. 2020 Apr;33(2):99–107. https://doi.org/10.3344/kjp.2020.33.2.99 PMID:32235010
7. Deer TR, Grider JS, Lamer TJ, Pope JE, Falowski S, Hunter CW, et al. A systematic literature review of spine neurostimulation therapies for the treatment of pain. Pain Med. 2020 Nov;21(7):1421–32. https://doi.org/10.1093/pm/pnz353 PMID:32034422
8. Bakr SM, Knight J, Johnson SK, Williams AE, Tolley JA, Raskin JS. Spinal cord stimulation improves functional outcomes in children with complex regional pain syndrome: case presentation and review of the literature. Pain Pract. 2020 Jul;20(6):647–55. https://doi.org/10.1111/papr.12882 PMID:32190956
9. Schwarm FP, Stein M, Uhl E, Maxeiner H, Kolodziej MA. Spinal cord stimulation for the treatment of complex regional pain syndrome leads to improvement of quality of life, reduction of pain and psychological distress: a retrospective case series with 24 months follow up. Scand J Pain. 2020 Apr;20(2):253–9. https://doi.org/10.1515/sjpain-2019-0081 PMID:31743107
10. Kriek N, Schreurs MW, Groeneweg JG, Dik WA, Tjiang GC, Gültuna I, et al. Spinal cord stimulation in patients with complex regional pain syndrome: a possible target for immunomodulation? Neuromodulation. 2018 Jan;21(1):77–86. https://doi.org/10.1111/ner.12704 PMID:29064599

 ORCID
ORCID