J. Antonio Aldrete 1 , Mª Del Socorro Romero F. 2 , Gabriel Guizar S. 3 , Nora Godinez C. 4 y Alfredo Ramírez B. 4
Rev Chil Anest Vol. 40 Núm. 1 pp. 13-23|doi:
PDF|ePub|RIS
INTRODUCCIÓN
Realizar intervenciones intraespinales para obtener anestesia quirúrgica requiere destreza y conocimiento de la técnica para completarlas con éxito. Sin embargo, tal definición no termina allí, ya que nuestra responsabilidad exige que tales maniobras no resulten en déficits neurológicos temporales o permanentes que usualmente producen, además de lesiones importantes, discapacidad, dolor severo intratable, depresión y otros efectos indeseables que afectan la calidad de vida.
Ocasionalmente ocurre que después de una anestesia peridural, raquídea o combinada, algunos pacientes presentan déficits neurológicos como paraplejia, síndrome de cola de caballo, “pie caído”, adormecimiento, alodinia, hiperalgesia y/o aracnoiditis. En la mayoría de los casos publicados, se ha observado eventos inesperados como parestesias, punciones múltiples (Figura 1), debilidad muscular de una extremidad o cefalea súbita continua, de duración de dos a tres horas o más, seguidos generalmente por alguno de los déficits neurológicos (DN) mencionados.
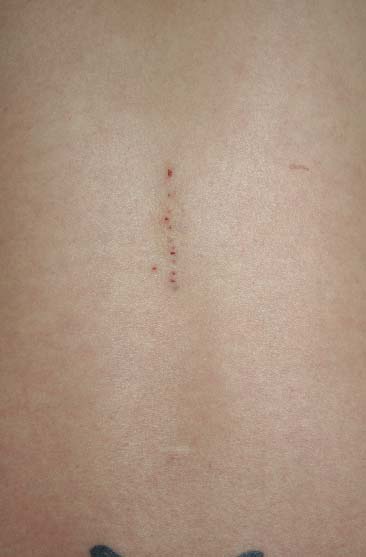
Figura 1 Evidencia de 12 sitios de punciones intentadas para realizar una anestesia peridural lumbar. El paciente tuvo varias parestesias y desarrolló posteriormente aracnoiditis.
La aracnoiditis (ARC) es un síndrome caracterizado por dolor severo con características neurológicas, originado por una reacción inflamatoria inespecífica de la membrana aracnoides, que evoluciona eventualmente a una fase crónica con degeneración de los elementos nerviosos adyacentes, acompañado de síntomas locales y sistémicos y que hasta recientemente, se consideraba incurable. Por más de un siglo y medio, la existencia de esta enfermedad ha sido controvertida, sin embargo, en las últimas décadas se han establecido no sólo las causas, sino que se ha podido identificar la localización de diferentes lesiones típicas mediante exámenes de imagenología 1 , 2 pudiendo así determinarse la localización precisa de las mismas y trazando su evidente origen. Usando modelos experimentales 3 , 4 no sólo se ha identificado la fisiopatología 5 -permitiendo establecer recomendaciones específicas para su prevención y empezar a realizar tratamientos específicos 6 – sino que además, de acuerdo con el origen y la localización de la lesión inicial y teniendo en cuenta el tiempo transcurrido y la evolución de los síntomas, se definen las pautas que guiarán, eventualmente, las medidas terapéuticas a seguir.
ETIOLOGÍA
A manera de aclaración, se señala las causas más frecuentes de los DN mencionados y de la ARC, ambos ya definidos 7 y descritos, eliminando así el escepticismo preexistente para aceptarlos como evidente complicación de intervenciones invasivas del raquis. De este modo, ahora se procede a enumerar los factores predisponentes al desarrollo de las entidades neuropatológicas involucradas, después de un acto anestésico complicado llevado a cabo en el neuroeje.
ANESTESIA NEUROAXIAL
Por razones obvias, se considera por separado las técnicas peridural, subaracnoídea y su combinación, ya que son diferentes, aunque con ciertas similitudes. Con abordajes y agujas de diferente calibre pero diseño semejante, las dosis de medicamentos varían considerablemente fuera y dentro del saco dural, al igual que los medicamentos aditivos (preservantes, vasoconstrictores) y la posibilidad de implantar catéteres para infusiones prolongadas. Es reconocido que ciertas substancias administradas por vía peridural, pueden ser neurotóxicas si se administran intratecalmente.
-
Anestesia peridural
El abordaje peridural, aunque aparentemente inocuo, puede producir traumatismos causados por agujas y/o por catéteres (parestesias, cefaleas, etc.), que pueden ocurrir en el proceso de introducirlos en el espacio alrededor del saco dural. Este espacio está localizado entre 5 a 10 cm de la piel en adultos y mide sólo 0,5 a 1,2 cm del ligamentum flavum a la dura (Tabla 1). Sabemos que no hay raíces nerviosas en el espacio peridural posterior, de tal forma, que si ocurren parestesias, implican que la punta de la aguja ha tocado o penetrado una de las raíces nerviosas localizada dentro del saco dural. Se puede entonces deducir que, incidentalmente, se ha perforado la duramadre y que, probablemente, se haya penetrado o lesionado el perineuro de la raíz afectada 8 . Si se inyecta anestésicos locales, éstos -que generalmente son inocuos cuando la capa de mielina está intacta- pueden iniciar, aún a concentraciones bajas, una reacción inflamatoria en la aracnoides y lesionar los axones contenidos dentro del endoneuro 9 . Anteriormente, se consideraban las parestesias como eventos inocuos, sin embargo, en la práctica actual de la anestesia neuroaxial se ha confirmado que la parestesia es una señal de advertencia predictiva 10 , por lo que, en la medida de lo posible, debe evitarse en todos los procedimientos. Si ocurre, se sugiere decidir si se evita el riesgo de dañar los elementos nerviosos (axones) que quedan desprovistos de su capa protectora. Las alternativas son: abandonar el procedimiento, postergando la cirugía u optar por anestesia general, si es posible. Sin embargo, tal decisión se deja al anestesiólogo involucrado, quién tiene que tomar en consideración todos los factores involucrados en cada caso.
Tabla 1 Distancia promedio de la piel a la duramadre en adultos
|
Distancia |
L3-L4 |
L4-L5 |
L5-S1 |
| Piel a espacio peridural |
5,48 |
6,31 |
6,20 |
| Piel a saco dural |
6,28 |
7,22 |
6,66 |
| Diámetro del Saco Dural |
1,61 |
1,47 |
1,21 |
| Los valores representan la media expresada en centímetros. Tomada en parte de Aldrete et al: Skin to lumbar epidural space, as determined by Magnetic Resonance Imaging. The Pain Clinic 1997: 10: 101-107. | |||
Como información, se reconoce que parestesias percibidas por el paciente en la pierna izquierda o derecha sugieren punción de una raíz nerviosa del lado ipsilateral. Si sienten parestesia en el perineo, probablemente indique que el cono medular fue tocado o puncionado, mientras que parestesias percibidas en el “cerebro” generalmente indican que la médula espinal se penetró o se tocó (Figura 2).
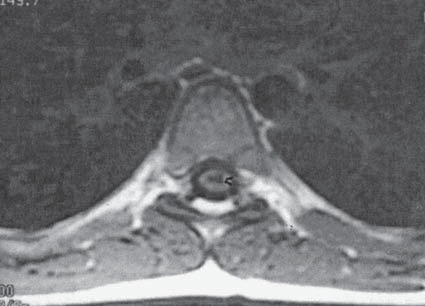
Figura 2 Punción de la médula espinal en paciente de 7 años, causada por una aguja de Tuohy 18G insertada a nivel T7-T8, resultando en síndrome de cauda equina permanente. (Tomada de Aldrete JA, Ferrari, HA: Myelopathy with Syringomyelia following thoracic epidural anestesia. Anaesth Intensive Care 2004: 32: 100-3).
Por otra parte, cuando los catéteres destinados al espacio peridural se introducen incidentalmente en el compartimiento subdural (Figura 3), se produce una latencia larga del efecto anestésico 11 . Si no se reconoce esta localización específica, existe el riesgo de pensar que se trata de una anestesia “lenta” y se decida aumentar la dosis, lo que eventualmente puede resultar en una sobredosis y ocasionalmente en una anestesia raquídea alta 12 . Para evitar estas complicaciones, se insiste en la aspiración del catéter antes de inyectar cada dosis y se sugiere que la administración del anestésico local se haga en bolos no mayores de 5 ml, esperando por lo menos 5 minutos antes de suplementarlas.
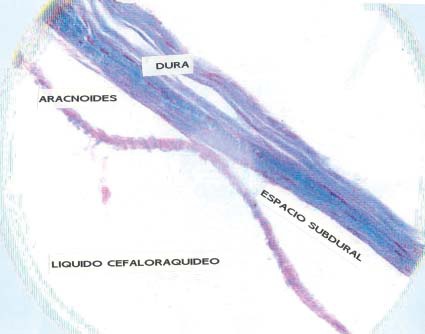
Figura 3 Espécimen histológico de meninges de rata indicando la duramadre, el compartimiento intratecal donde está el líquido cefaloraquídeo, con el espacio subdural en medio.
La punción incidental de la duramadre con agujas de calibre 16G a 18G continúa siendo una complicación que no debe ser considerada de ninguna manera leve (Figura 4). Desde luego, el orificio creado en la duramadre es más grande que los producidos con agujas empleadas en anestesia raquídea, y la fuga de líquido cefalorraquídeo (LCR) puede ser abundante (Figura 5). Además, la aparición súbita de cefalea severa y constante, frecuentemente indica que el aire contenido en la jeringa usada para llevar a cabo el método de “la pérdida de la resistencia”, entró al espacio intratecal (Figura 6) y eventualmente ascendió al cerebro. Esta desagradable molestia dura de 90 a 120 minutos y habitualmente desaparece cuando el aire es reabsorbido gradualmente por la circulación venosa.
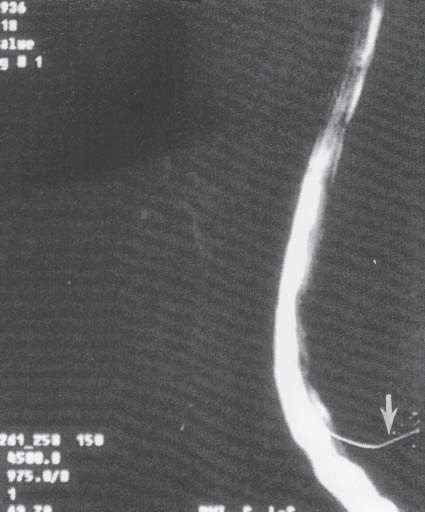
Figura 4 Localización (no invasiva) de fuga de LCR mediante cintigrafía dos semanas después de la punción.
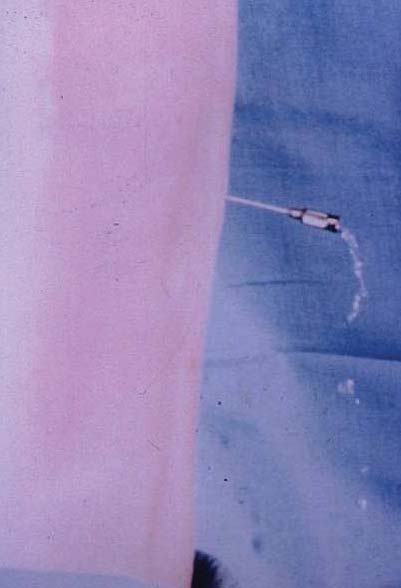
Figura 5 LCR saliendo por una aguja de Tuohy 17G. Por cortesía del Dr. A. Torrieri.
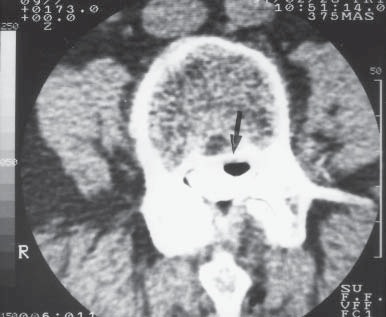
Figura 6 Burbuja de aire en el LCR después de intentar un bloqueo peridural, con jeringa conteniendo aire y solución salina, usando el método de “pérdida de la resistencia”.
Las parestesias son serias porque implican que una aguja de calibre considerable tocó o penetró una de las raíces dentro de la duramadre, con los posibles daños anatómicos a la misma, permitiendo así la probable toxicidad farmacológica ocasionada por el anestésico local sobre los axones desprotegidos por el endoneuro. Además, una vez perforada la duramadre, los anestésicos depositados en el espacio intratecal suelen resultar en niveles de anestesia más altos que los planeados 12 . Para evitar la punción incidental de la duramadre, es útil recordar las dimensiones anatómicas de las distancias promedio de los diferentes planos a penetrar, que se obtuvieron calculando la media procurada por medición en placas radiográficas de resonancias magnéticas de 100 pacientes adultos (Tabla 1), incluyendo también el diámetro antero-posterior del saco dural.
-
Anestesia raquídea
Se ha comprobado que aún una punción subaracnoídea no complicada, produce pleocitosis, hiperproteinemia e hipoglucemia en el LCR, por lo menos durante dos días 13 . De esto se deduce que la inyección subaracnoídea de medicamentos potencialmente neurotóxicos puede ser más perjudicial, especialmente si se acepta la premisa que “todos los anestésicos locales son potencialmente neurotóxicos” 14 . Se debe aclarar que esto es dependiente de su concentración, la que a su vez es influenciada por la dosis total, lo cual se confirmó con la lidocaína al 5% en el espacio subaracnoídeo, que eventualmente se demostró que producía aracnoiditis en un número importante de casos 15 , 16 . Peculiarmente, la lidocaína al 5% se usó por vía intratecal por más de tres décadas en millones de casos. Analizando las circunstancias de esta controversia, se reconoció a posteriori al causante, el cual fue probablemente un aumento progresivo en la dosis inyectada.
Si estamos dispuestos a aceptar que las inyecciones intratecales de anestésicos locales pueden, en algunos casos, producir un cierto porcentaje de déficits neurológicos, es nuestra obligación eliminarlos o mantenerlos al mínimo (Tabla 2). En la mayoría de estos casos, resultó que las dosis empleadas fueron casi el doble de lo que se administraba cuando se introdujo este medicamento a la práctica anestésica. En los 50’s se inició su uso por vía intratecal en dosis de sólo 60 mg, dosis que luego fueron aumentando gradualmente hasta que, tres décadas más tarde, se usaban más de 140 mg.
Tabla 2 Número de pacientes confirmados* con aracnoiditis secundaria a anestesia neuroaxial 2004 a 2008
| Raquideas |
48 |
|
| Peridurales | ||
| Cervicales |
1 |
|
| Toracicos |
2 |
|
| Lumbares |
64 (54%) |
|
| Caudales |
1 |
|
| Ttotal |
116 |
|
|
* Pacientes vistos personalmente en consulta, por el Dr. Jorge Antonio Aldrete, realizando revisión de expediente, examen físico y neurológico, así como revisión de las imágenes radiológicas disponibles. |
||
Intentando aclarar otra controversia, en relación a la nominación del sitio donde se depositan los anestésicos locales para realizar una anestesia espinal o raquídea, se considera necesario recalcar que el uso de la terminología “anestesia subdural” para referirse a este tipo de anestesia es incorrecta, porque en realidad se refiere al depósito del anestésico dentro del saco dural, específicamente en el LCR y no en el espacio subdural. El espacio subdural no es el mismo que el espacio subaracnoídeo, ya que el espacio subdural generalmente no tiene LCR pues se encuentra entre la duramadre y la aracnoides (Figuras 3 y 7). El objetivo en anestesia raquídea, es en realidad administrar el anestésico en el espacio subaracnoídeo, una vez atravesada la dura y la aracnoides, en donde se obtiene un flujo libre, continuo y fácil de aspirar de LCR en los cuatro cuadrantes de la aguja. Es así como se confirma no sólo estar dentro del saco dural, sino también dentro del compartimiento subaracnoídeo. Si por otra parte, se deposita el anestésico en el espacio “subdural”, eventualmente el medicamento se filtra a través de la aracnoides en 8 a 12 minutos llegando al compartimiento intratecal en forma retardada.
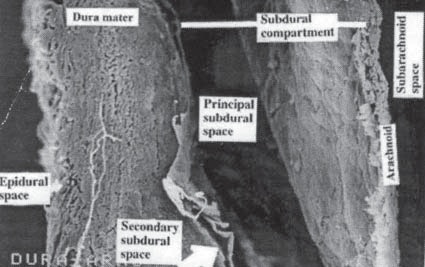
Figura 7 Espacio subdural claramente identificado entre la dura y la aracnoides. Espécimen obtenido de cadáver, x 180. Por cortesía del Dr. Miguel Angel Reyna.
El uso de catéteres intratecales, aunque factible, fue casi completamente abandonado pues las dosis administradas en forma repetida aparentemente se acumulan, resultando ser excesivas, más aún si se acompañan de dextrosa al 5 o al 7,5% para hacerlas hiperbáricas en relación al LCR 17 , 18 . De este modo, los anestésicos locales se depositan por períodos prolongados en los manguitos de la duramadre que acompañan usualmente a las raíces durante su trayecto foraminal, produciendo lesiones neurológicas prolongadas de localización radicular, resultando en aracnoiditis.
Cabe mencionar que dentro del saco dural, todos los elementos (raíces, vasos, duramadre, piamadre y ligamentos dentados) están rodeados o envueltos por la aracnoides (Figura 8) precisamente llamada “el policía del espacio intratecal”, ya que inicia un proceso de inflamación en cuanto entra una substancia irritante o es invadido por agujas, catéteres o instrumentos extraños. Como toda reacción inflamatoria, puede desvanecerse si hay tratamiento adecuado o el sistema neuro-vegetativo-endotelial procede a desarrollar un proceso inflamatorio completo con el subsiguiente edema, fibrosis y tejido cicatricial.
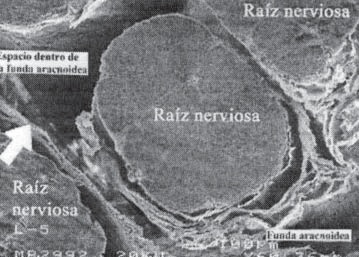
Figura 8 Espécimen obtenido de cadáver (2 días) demostrando la aracnoides rodeando vasos, raíces nerviosas y ligamentos dentados (x 20). Por cortesía del Dr. Miguel Ángel Reyna.
Gradualmente, la mayoría de los medicamentos que se han empleado en el espacio subaracnoídeo, debido a su probable toxicidad, aceptable en un tiempo pero intolerable en la actualidad, se han ido eliminando para esta indicación (i.e. procaína, pontocaína, lidocaína al 5%, etc.). Considerando estos antecedentes y algunos casos publicados, nos atrevemos a predecir que el uso progresivo de dosis mayores de 12 mg de bupivacaína hiperbárica, probablemente resulten en un número preocupante de déficits neurológicos, mencionando sólo algunos de los bastantes ya reportados 19 , 20 , 21 , 22 , 23 . Además, reconociendo lo tenue que es el flujo sanguíneo a la cauda equina y a las raíces nerviosas (sólo el 50% del oxígeno y de los nutrientes proviene de la sangre arterial y el resto del LCR), el uso de vasoconstrictores (epinefrina, efedrina y neosinefrina, aún en mínimas dosis), mezclados con anestésicos locales, pueden resultar en isquemia, sobre todo en presencia de arteriosclerosis, en que el riesgo de isquemia aumentaría significativamente 24 , 25 .
Igualmente, la presencia de estenosis vertebral en el área de la región lumbar alta o torácica baja, puede producir un estancamiento de la rotación normal del LCR que circula del cerebro al extremo distal del saco dural cada 2,5 a 4 h (Figuras 9 y 10). En estos casos la cauda equina podría estar expuesta a los agentes anestésicos por tiempos prolongados, pudiendo resultar en toxicidad retardada, anestesias extensamente prolongadas y algunas veces en DN permanentes 26 .
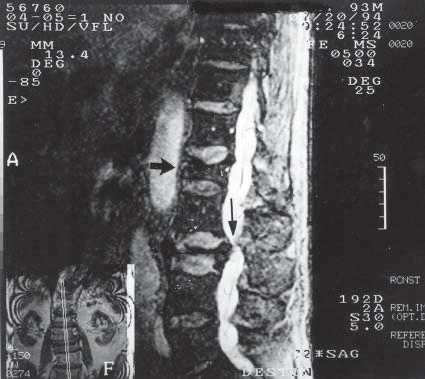
Figura 9 Vista sagital de resonancia magnética de la columna lumbar demostrando estenosis del canal vertebral en un paciente con fracturas compresivas de L2 y L3 (flecha vertical) proyectando fragmentos posteriormente que retardan el ascenso del LCR. Si el anestésico local es depositado en la zona más caudal, su acción sería más prolongada.
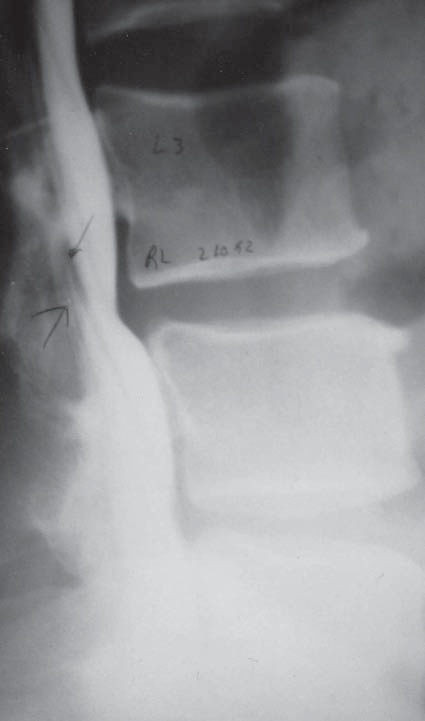
Figura 10 Mielografía de columna lumbar con estenosis del saco dural por una hernia del disco intervertebral, con prolongación hacia arriba, impidiendo el ascenso del líquido cefalorraquídeo.
Al mencionar la posibilidad que algunos medicamentos que pueden causar daño neurológico permanente se utilicen de rutina, se recomienda remontarnos a la sabiduría de Paracelso, quien hace más de cinco siglos advirtió: “No hay drogas seguras, solamente dosis seguras”. Esta máxima se debe aplicar indudablemente a los anestésicos locales depositados en el LCR y en el espacio peridural.
Preocupante es la reaparición de infecciones por microorganismos resistentes a antibióticos comunes, que se originan en el quirófano, las salas de terapia intensiva y últimamente en los pabellones de obstetricia, donde tratando de proveer un ambiente familiar, se ha relajado la costumbre de mantener un ambiente aséptico, lo que ha producido un aumento de infecciones difícil de abolir por su resistencia a antibióticos comunes, sobre todo cuando se insertan catéteres. Es de notar que el ambiente “familiar” en algunas clínicas gíneco-obstétricas 27 , 28 , en las cuales se han eliminado algunas medidas de asepsia que prevenían contaminación, a favor de un ambiente no formal y han promovido la eliminación de medidas antisépticas en las prácticas de anestesia y obstetricia resultando en una anestesia practicada en ámbitos no estériles, puede ser uno de los factores causales del resurgimiento de infecciones 28 , 29 , 30 . Por otra parte, también suelen ocurrir infecciones cuando se dejan catéteres intratecales 29 por más de 14 horas o epidurales por varios días 30 , 31 (Figura 11), con excepción de pacientes con dolor crónico 30 .
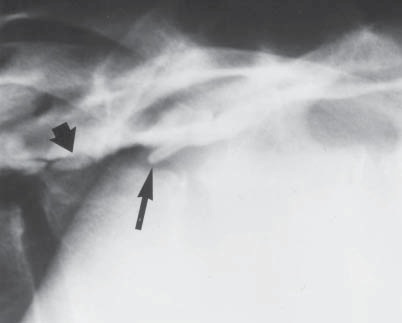
Figura 11 Epidurografía demostrando la punta de un catéter rodeada de un proceso infeccioso en el espacio extradural.
Nos vemos entonces forzados a aceptar la paradoja ética de admitir cierta morbilidad, ya que si empleamos estos procedimientos con alguna frecuencia, hay probabilidad de que medicamentos usualmente nobles y reversibles, podrían ocasionar déficits neurológicos desastrosos 19 – 32 , terminando en paraplejia y/o dolor neuropático severo, espasmos musculares y disestesias; así, como disfunción sexual, vesical y rectal 6 , 33 , 34 .
De este modo, en las dos últimas décadas se ha llevado a cabo un escrutinio respecto a tal porcentaje de complicaciones neurológicas reportadas 2 , 10 , 11 , 12 , 19 , 21 , 35 , considerándose que es inaceptable por pequeño que sea, ya que si se hace un examen acucioso de cada caso, la mayoría se pudo haber evitado. A propósito, se sugiere implementar normas en la técnica a seguir 37 .
-
Anestesia combinada (peridural + raquídea)
Implica el uso de ambas técnicas favoreciendo conjuntamente las ventajas derivadas de ambos abordajes. La técnica fue sugerida inicialmente por Soresi 37 y puesta en práctica por Torrieri y Aldrete 38 , usando una aguja peridural modificada (Figura 12). La aguja gradualmente ha evolucionado a varios modelos, en los cuales primero se localiza el espacio epidural y luego, a través de la misma aguja con la curvatura en la punta diseñada por Tuhoy 39 , se inserta una aguja más larga de raquídea (12 cm), siguiendo la curvatura típica hacia arriba o a través de una perforación distal, precisamente en la curvatura mencionada, lo que permite fácilmente el acceso de la aguja raquídea al mismo nivel. En el abordaje inicial, se ha notado que la aguja raquídea entra al espacio subaracnoídeo generalmente a un nivel más alto de lo planeado, lo cual puede resultar en una punción del cono medular, como describió Reynolds 40 , debido a una combinación de errores, como es el estimar equivocadamente el nivel intervertebral en el cual se realizaba la punción en la piel y la desviación de la aguja raquídea hacia arriba (casi siempre un espacio intervertebral más alto). Aparentemente este error no es raro, como lo comprobaron Broadbent y sus colaboradores 41 , cuando preguntaron a anestesiólogos con más de 10 años de experiencia que determinaran y marcaran el espacio L3-L4 por palpación, más del 60% lo hicieron equivocadamente.
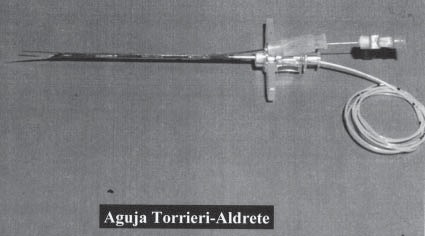
Figura 12 Aguja de Torrieri y Aldrete para anestesia combinada (peridural y raquídea). Acta Anaesth Belg 39: 65-66, 1988.
No obstante su aplicación por más de dos décadas, aún no se ha definido en su totalidad una secuencia específica: si se inyecta primeramente intratecal y luego epidural o viceversa. Hay además variantes; por ejemplo, si se inyecta primero intratecal un anestésico local, se puede elevar el nivel de anestesia inyectando en el espacio peridural solamente solución salina, la cual “empujaría” el anestésico en el LCR en dirección cefálica; por otra parte, si se reinvierte el orden de las inyecciones, primero la solución salina, en el espacio peridural, cuando se inyecte el anestésico intratecal no ascendería lo esperado, produciendo una anestesia “más sólida” distalmente, pero a un nivel más bajo.
Han ocurrido parestesias después de la inserción de ambas agujas, resultando a veces en niveles de anestesia impredecibles por anestesiólogos no acostumbrados al uso rutinario de esta técnica, resultando en complicaciones semejantes a las ya mencionadas 42 , 43 , 44 .
PARCHE HEMÁTICO EPIDURAL
En la actualidad, la modalidad terapéutica más frecuentemente usada para tratar la cefalea post-punción dural (CPPD) persistente accidental es el parche hemático epidural, que puede en algunas ocasiones producir déficits neurológicos, si la sangre es inyectada incidentalmente en el espacio subaracnoídeo (Figura 13).
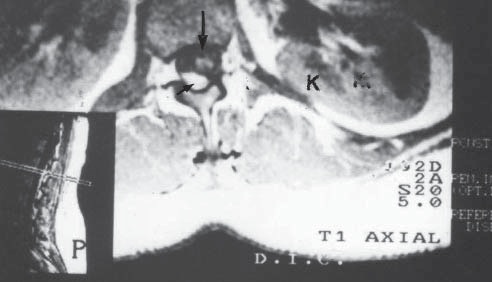
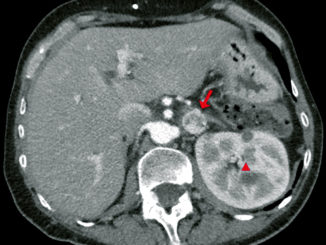
Figura 13 Resonancia magnética de la columna vertebral, a nivel de L1 (ver cuadro). El LCR está indicado por la flecha horizontal, la sangre contenida en el saco dural está en la zona oscura, indicada por la flecha vertical e incluye la médula espinal. Los riñones están hacia el lado (K).
El parche hemático epidural fue inicialmente propuesto por Gormley 45 en 1960, quien trató siete pacientes con cefalea post-punción dural inyectando 3 ml de sangre autóloga y reportó un 100% de éxito. Ocurren problemas cuando el volumen se inyecta intradural, produciendo un hematoma subaracnoídeo; puesto que la sangre es un líquido irritante para el tejido nervioso, estos volúmenes son suficientes para iniciar un proceso inflamatorio en la aracnoides. Por otra parte, volúmenes mayores de 15 ml, aún en el espacio peridural, actúan como un hematoma extradural, revirtiendo la diferencia de presión, lo que resulta en que el espacio peridural, en lugar de tener presión negativa, adquiere una presión positiva mayor que la del espacio subaracnoídeo manifestándose como presión radicular, favoreciendo así el paso de la sangre a través del orificio inicial creado por la aguja hacia el espacio subaracnoídeo y determinando su distribución intradural. Después de todo, ese es el mecanismo propuesto para explicar la forma en que los parches hemáticos depositados fuera del saco dural interrumpen la fuga continua del LCR, formando eventualmente un tapón en el orificio comunicante 46 .
Los casos publicados de complicaciones serias secundarias a este procedimiento exceden más de 100 47 y probablemente los no publicados son aún mucho más numerosos. Una alternativa terapéutica es la administración IM de hormona ACTH inicialmente propuesta por Weed y Cushing 48 .
Reconociendo las posibles complicaciones con el parche epidural de sangre se han considerado otras alternativas; entre ellas está el uso de 18 ml de Dextrán 40 49 – 50 o de almidón 51 en el mismo espacio peridural, que evitan los efectos indeseables del parche hemático, lo que fue demostrado en cabras por Launder y Korbon 52 , al notar que sangre en el espacio peridural produce una inflamación considerable que dura de 7 a 10 días, lo que no ocurre con el almidón. Recientemente Romo Salas y colaboradores 53 , han obtenido prometedores resultados al tratar cefaleas posturales producidas por punción dural, administrando volúmenes pequeños de agua destilada por vía endovenosa, lo que puede repetirse varias veces, sin posibilidad de ocasionar otra lesión intra-raquídea.
DIAGNÓSTICO
Después de haber concluido el procedimiento, los pacientes que recibieron anestesia neuroaxial deben ser examinados por deficiencias neurológicas: dolor, adormecimiento, debilidad muscular, cefalea o cualquier síntoma que pudiese indicar deficiencia neurológica. Si así fuera, deberán ser mantenidos bajo observación por 24 horas, procediendo a hacer un examen neurológico, sobre todo de las extremidades y determinar si hay cambios en el nivel de anestesia residual. El diagnóstico se puede definir solicitando una resonancia nuclear magnética, teniendo en cuenta que las lesiones evidentes que se pueden reconocer en síndromes de pie caído, de cola de caballo o de ARC son diferentes en los primeros tres meses después del evento precipitante 2 , 54 . Es importante también descubrir lesiones neurológicas ocultas debido a otras enfermedades, así como déficits neurológicos resultantes de compresión del útero resultante de embarazos de gran tamaño, tracción por separadores o presión de nervios periféricos al elevar los miembros inferiores sin una adecuada protección. Los síntomas a definir ya sea por otros déficits neurológicos o por aracnoiditis se enlistan en la Tabla 3.
Tabla 3 Síntomas que sugieren déficit neurológico o aracnoiditis en el posoperatorio inmediato (una semana)
| Dolor ardiente o punzante |
| Adormecimiento persistente en áreas de las extremidades o del abdomen bajo |
| Disestesia, hiperalgesia, hormigueo, sensación de quemadura o alodinia |
| Adormecimiento distal, en parche, a diferencia de radiculopatía |
| Espasmos musculares |
| Debilidad muscular |
| Incontinencia u otra disfunción de la vejiga |
| Disfunción rectal (diarrea o constipación) |
| Disfunción sexual |
| Alteraciones de la propiocepción, mareos, tinnitus, tropezones, caídas frecuentes |
| Alteración de la función visual y/o del oído |
| Hiperhidrosis, sensación de calor o de frío exagerado |
PREVENCIÓN
Ya que no hay tratamiento definitivo para la aracnoiditis en la fase crónica, debemos evitar las situaciones que pueden llevar a su inicio. Esto es fácil de decir, pero difícil de implementar. Por ejemplo, si al intentar una punción peridural se perfora incidentalmente la duramadre, la dosis de anestésico local debe ser reducida, ya que la presencia de un orificio en la dura, va a permitir su entrada al espacio intratecal. Esta complicación es más seria cuando ocurre en el proceso de la administración de esteroides para el tratamiento de lumbalgia, ya que estos últimos contienen conservadores con acción neurotóxica y/o neurolítica 7 , por lo que, es preferible no inyectarlos y repetir el tratamiento una semana después. En realidad, es tiempo de considerar que si el objetivo es una simple dosis de anestésicos locales o esteroides, administrada en el espacio extradural, sobretodo en situaciones de cirugía ambulatoria, quizás es mejor utilizar una aguja de menor calibre (25 G) y de una longitud menor (7,5 cm), que alcanza en el 90% de los pacientes el compartimiento peridural 55 .
Además de estas especificaciones, para reducir aún más el riesgo de una punción dural incidental, la superficie del centímetro distal del trócar se hace rugosa para poder percibir mejor la resistencia al avance cuando se atraviesan los diferentes planos de tejidos. Si se penetra la dura accidentalmente, siendo la aguja calibre 25, produciría un orificio más pequeño con menores posibilidades de causar CPPD (Figura 14).

Figura 14 Aguja calibre 25 G, con marcas cada cm, alas para manejar a dos manos, de 7,5 cm de longitud. La superficie del centímetro distal es rugosa para percibir cuando se atraviesa el ligamento supraespinoso.
TRATAMIENTO
En cirugía espinal, la punción de duramadre debe considerarse como una complicación seria y repararse de inmediato, para prevenir el ingreso de sangre al espacio intratecal. Si se anticipa cierto sangrado en el espacio extradural al final de las operaciones del raquis, se aconseja insertar una sonda de drenaje por 24 horas, para evitar que se acumule en la incisión. Si se nota un déficit neurológico, o si el dolor en el postoperatorio inmediato es extremo y de tipo neuropático, se sugieren las siguientes medidas:
-
Hacer un examen neurológico completo: si se encuentran anormalidades no existentes en el preoperatorio, solicitar una interconsulta al Servicio de Neurología.
-
Realizar una resonancia nuclear magnética de la columna vertebral lumbar, con medio de contraste (gadolinium) de emergencia. En la etapa inflamatoria de la aracnoiditis, las raíces se edematizan y aparecen engrosadas y con un aspecto estelar (“enhancement”). Las imágenes típicas de las raíces nerviosas agrupadas en racimos (“clumping”), distribuidas asimétricamente dentro del saco dural, aparecen en la fase tardía (proliferativa) de esta enfermedad.
En estas circunstancias se sugiere iniciar un tratamiento multimodal 56 , por ejemplo:
-
Antiinflamatorios (metamizol, indometacina, ketoprofeno, etc.) dos veces al día, por 15 días, protegiendo la integridad de la mucosa gástrica que puede ser afectada por estos medicamentos.
-
Gabapentina, aumentando la dosis gradualmente hasta llegar a una dosis óptima en que no se produzcan efectos secundarios y se obtenga mejoría de los síntomas. En caso de que no se tolere, puede substituirse por fenitoína, topiramato o pregabalina.
-
Si los síntomas persisten, se puede iniciar la administración de esteroides por tres días. En casos renuentes, se sugieren dosis mayores por un período más largo.
Estas medidas deberán instituirse tan pronto cuando se confirme el diagnóstico, ya que la ventana de oportunidad para tratar o reducir el proceso aracnoidítico inflamatorio estará disponible sólo por tres meses después del evento adverso que inició este cuadro clínico. Subsecuentemente las lesiones son permanentes y los síntomas de por vida.
REFERENCIAS
- Ross JB, Masaryk TJ, Modic LT, et al. MRI images of lumbar Arachnoiditis. AJNR 1987; 8: 1025-1032.
- Aldrete JA, Ghaly RF, Brown TL, Vascello LA, et al. Correlación de hallazgos radiológicos con los eventos adversos que posiblemente hayan causado aracnoiditis. Rev Soc Esp Dolor 2005; 12: 269-276.
- Romero Figueroa S, Aldrete JA, Martínez-Cruz A, et al. Nerve root degeneration and regeneration by intrathecal phenol in rats, a morphological approach. J of Peripheral Nervous System 2006; 11: 1-8.
- Guizar-Sahagun G, Martínez-Cruz A, Aldrete JA, Madrazo I. Nerve root and spinal cord demyelination by intrathecally administered methylene blue. En preparación.
- Curran DR, Walsh MT, Costello RW, et al. Interactions between inflammatory cells and nerves. Curr Opinion Pharmacol 2002; 2: 243-248.
- Aldrete JA. Arachnoiditis: the evidence revealed. Editorial Alfil, Mexico. 2010; 3-723.
- Nelson DA, Landau WM. Intraspinal steroids: history, efficacy, accidentally and controversy with review of the USA FDA reports. Neurosurg Quaterly 2001; 11: 433-443.
- Selander D, Duhner CG, Lundburg D. Peripheral nerve injury due to injection needles used for regional anaesthesia. Acta Anaesthesiol Scand 1977; 21: 182-188.
- Gentili F, Johnson AR, Hunter D, et al. Nerve injection injury with local anesthetics agents: a light and electromicroscopic, fluorescence microscopic and horseradish peroxidase study. Neurosurgery 1980; 6: 263-272.
- Ramírez Bermejo A, Aldrete JA, Godinez Cubillos NC, et al. Déficits neurológicos y aracnoiditis secundarios a anestesia neuroaxial: rol de parestesias, punciones durales, anestésicos locales y género. Protocolo para su tratamiento. Rev Soc Esp Dolor 2009; 16: 330-343.
- Douglas J, Choi D. Inmediate complications of regional blockade in obstetrics. In Regional Analgesia in Obstetrics. F. Reynolds (ed). Springer, London 2001: pp. 285-305.
- DeSeze MP, Sztark F, Janvier G, et al. Severe and long lasting complications of the nerve root after central neuroaxial blockade. Anesth Analg 2007: 104: 975-979.
- Iason AH, Lederer M, Steiner M. Changes in spinal fluid following injection of spinal anesthesia. Surg Gynec Obstet 1930: 51: 76-77.
- Selander D. Neurotoxicity of Local Anesthetics. Animal Data. Reg Anesth 1993: 18: 461-468.
- Schneider MC, Ettlin T, Kaufmann M, et al. Transient neurologic toxicity after hyperbaric subarachnoid anesthesia with 5% lidocaine. Anest Analg 1993: 75: 1154-1157.
- Snyder R, Hui G, Flugstad P, et al. More cases of possible neurologic toxicity associated with single subarachnoid injection of 5% hyperbaric lidocaine. Anesth Analg 1994: 7: 411.
- Lambert DH, Hurley RJ. Cauda equine syndrome and continuous spinal anesthesia. Anest Analg 1991: 817-819.
- Rigler ML, Drasner K, Krejcie TC, et al. Cauda equine syndrome after continuous spinal anesthesia. Anesth Analg 1991: 72: 275-281.
- Paech MJ. Unexplained neurological deficit after uneventful combined spinal-epidural anesthesia for cesarean delivery. Reg Anesth 1997: 22: 479-482.
- Meherberg R, Porter BE. Cauda equine syndrome after spinal anesthesia with bupivacaine: a case report. Arch Phys Med Rehab 2003: 84: 35-36.
- Chabbouh T, Lentchener C, Zuber M, et al. Persistent cauda equine syndrome with no identifiable facilitating condition after uneventful single spinal administration of 0.5% hyperbaric bupivacaine. Anesth Analg 2005: 101: 1847-1848.
- Aldrete JA, Reza-Medina M, Daud O, et al. Exacerbation of preexisting neurological deficits by neuraxial anesthesia: report of 7 cases. Clin Anesth 2005: 17: 304-313.
- Rohm KD, Boldt J. Persistent neurologic symptoms after uncomplicated intrathecal bupivacaine. Anesth Analg 2006: 103: 1047.
- Alahuhta S, Raasanen P, Jouppila R, et al. Ephedrine and phenylephrine for avoiding maternal hypotension due to spinal anaesthesia for caesarean section. Effects on ureteroplacental and fetal hemodynamics. Int J Obstet Anaes 1992: 1: 129-132.
- Usubiaga JE. Complicaciones anestésicas en la anesthesia epidural. Clínica Anestesiológica. Barcelona: Salvat Editores, SA 1977: pp. 1-110.
- Bessac B, Levy R, Chauvin M. Paraplegia after spinal anesthesia in a patient with cancer. Ann Fr Anaesth Reanim 1992: 11: 218-220.
- Wang LP, Hauerberg J, Schmidt JF. Long-term outcome after neurosurgically treated spinal-epidural abscess following epidural anesthesia. Acta Anaesthesiol Scand 2001: 45: 233-239.
- Hughes SC. Neuraxial blockade in obstetrics and complications related to infections: can we lower the risk? ASA Newsletter 2007: 71: 6-8.
- Bohuhemad B, Dounas M, Mercier FJ, et al. Bacterial meningitis following combined spinal-epidural analgesia for labor. Anaesthesia 1998: 53: 292-295.
- Aldrete JA, Williams SK. Infections from extended epidural catheterization in ambulatory catheterization in ambulatory patients. Reg Anes Pain Med 1998: 23: 491-495.
- Reynolds F. Neurologic complications of pregnancy and regional anesthesia. In Chestnut DH (ed). Obstetric Anesthesia: Principles and Practice. Philadelphia, Elsevier Mosby. 2004: pp. 579-601.
- Reynolds F. Neurological infections after Neuraxial Anesthesia. Anesthesiology Clinics 2008: 26: 230-252.
- Suback LL, QuesenberryCP, Posner SF, et al. The effect of behavioral therapy on urinary incontinence: a randomized control trial. Obstet Gynecol 2002: 100: 72-78.
- Mardirosoff C, Dumont L. Bowel and bladder dysfunction after spinal bupivacaine. Anesthesiology 2001; 95: 1306.
- Casatti A, Fanelli G, Aldegheri G, et al. A transient neurologic deficit following intrathecal injection of 1% bupivacaine hyperbaric for unilateral spinal anaesthesia. Europ J Anaesth 1998: 15: 112-113.
- Torrieri A, Aldrete JA. Indice de dificultad de la puncion en la anesthesia intradural. Tratamiento de la fase aguda de la arachnoiditis y los deficits neurologicos que ocurren ocasionalmente. Rev Arg Anes 2009; 67: 36.
- Soresi AL. Episubdural anesthesia. Anesth Analg 1937; 16: 306-310.
- Torrieri A, Aldrete JA. Spinal-epidural needle for combined anaesthesia. Acta Anaesth Belg 1988: 65-66.
- Tuohy EB. Continuous spinal anesthesia: its usefulness and technique involved. Anesthesiology 1944: 5: 142-148.
- Aldrete JA, Ghaly RF. Need for precise diagnosis prior to epidural steroids. Anesthesiology 2000; 93: 565-566.
- Reynolds F. Damage to the conus medullaris following spinal anaesthesia. Anaesthesia 2001: 56: 235-247.
- Broadbent CR, Maxwell WB, Ferrier SA, et al. Ability of Anaesthetists to identify a marked lumbar interspace. Anaesthesia 2000: 65: 1122-1126.
- Tsui BHC, Asmstron K. Can direct spinal cord injury occur without paresthesia? A report of spinal cord injury after epidural placement in an awake patient. Anesth Analg 2005: 101: 1212-1214.
- Norris MC, Leighton BL, De Simone CA. Needle bevel direction and headache after inadvertent dural puncture. Anesthesiology 1989; 79: 729-731.
- Gormley JB. Treatment of postspinal headache. Anesthesiology 1960; 21: 565-566.
- Harrington BE. Postdural puncture headache and the development of the epidural blood patch. Reg Anesth & Pain Med 2004; 29: 2: 136-163.
- Holder D, Aldrete JA. Dural punctures and epidural blood patches. In Arachnoiditis: The Evidence Revealed. Ed. J. Antonio Aldrete. Editorial Alfil – Mexico City, Mexico, 2010.
- Weed LH, Cushing. Studies on the CSF: effects of pituitary extract on its secretion. Am J Physiol 1915; 36: 77-79.
- Barrios-Alarcón J, Aldrete JA, Tapia D. Relief of postdural puncture headache with epidural Dextran 40. A preliminary report. Reg Anesth 1989: 14: 78-80.
- Aldrete JA, Daly J. Treatment of persistent post-dural puncture headache with epidural Dextran. Am J Pain Manage 1992; 2: 93-94.
- Jáuregui ML, Guevara López U. Aplicación de almidón en el espacio epidural como tratamiento de cefalea postpunción dural. Rev Mex Anest 2004; 456: 138-142.
- Launder CJ, Korbon GA. Histopathological consequences of epidurally administered dextran, Anesthesiology 1988; 69: A 420 (Suppl).
- Romo Salas F, Aldrete JA. Treatment of cefalea postpuncion dural con agua destilada por vía endovenosa. En preparación.
- Aldrete JA, Reza-Medina M, Daud O, et al. Exacerbation of preexisting neurological deficits by neuraxial anestesia: report of 7 cases. J Clin Anesth 2005; 17: 304-313.
- Aldrete JA, Harms JE. Experience with a new 25 gauge epidural needle. Pain Digest 1998; 8: 260-263.
- Aldrete JA, Ghaly RF. Early “Combo” therapy can reverse Arachnoiditis. Anesthesiology News 2009; 31: 22.