Sebastián Monsalves R 1 ., Samuel Mora M 2 ., Vanessa Tapia G 3 ., Nicolas Olivares S 1 ., Florencia Oliden F 1 ., David Barra O. 4
Recibido: 21 de diciembre de 2017
Aceptado: 10 de enero de 2018
©2018 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Rev Chil Anest Vol. 47 Núm. 1 pp. 40-45|https://doi.org/10.25237/revchilanestv47n01.08
PDF|ePub|RIS
Case report of two cases: Acute renal failure adter scolisosis surgery
Abstract
Corrective surgery is a therapeutic alternative for patients with scoliosis Cobb angle > 40-45ª. This surgery offers a solution to aesthetic deformities, prevents progression and in some cases can resolve the cardiopulmonary consequences. It also improves the ambulation biomechanics and allows the reintegration to total functionality. Posterior artrodesis with bars and pedicular screws is the technic of choice. It has a high risk of hemorrhagic complications and neurological damage. Presently, anaesthetic and surgical approaches, along with neurological somatosensitive monitoring, have decrease these complications. However, other complications, including acute renal failure are still present in high-risk cases such as patient with neuromuscular scoliosis. We present a case report including 2 patients with neuromuscular scoliosis that underwent posterior artrodesis in our hospital (Hospital Clinico San Borja Arriaran) during 2015. Both develop and acute renal failure in the early postoperative period.
Resumen
La cirugía correctiva de escoliosis es la alternativa terapéutica para los pacientes portadores de escoliosis severa con ángulos de Cobb > 40- 45º. La corrección ofrece solución a la deformidad estética, evita la progresión y/o corrige según sea el caso, el compromiso cardiopulmonar. Mejora además biomecánica de marcha y permite reintegración funcional de los pacientes. La artrodesis posterior con barras y tornillos es la técnica de elección, tiene un alto riesgo de hemorragia y de daño neurológico postoperatorio. En la actualidad, las estrategias de manejo anestésico – quirúrgico y la incorporación de neuromonitoreo continuo han disminuido la incidencia y el impacto clínico de estas complicaciones. Sin embargo, otras complicaciones como la falla renal aguda aún están presentes en pacientes de alto riesgo como portadores de patología neuromuscular. A continuación, se presenta un reporte y análisis de 2 casos clínicos de falla renal aguda en el postoperatorio inmediato en cirugía correctiva de escoliosis con artrodesis posterior, en pacientes portadores de escoliosis neuromuscular severa ocurridos durante el año 2015 en el hospital clínico San Borja Arriarán.
Introducción
Se define escoliosis como la deformidad de la columna vertebral con desviación lateral mayor a 10° del ángulo de Cobb asociado a rotación variable de los cuerpos vertebrales[1] en la radiografía de columna total de pie. Se divide en 3 grupos según etiopatología; neuromuscular, congénita e idiopática.
La etiología se correlaciona con la progresión y severidad de la deformidad en el tiempo, así como con la incidencia de complicaciones médico-quirúrgicas. La escoliosis idiopática es la más frecuente y menos severa, alcanzado hasta el 85% de los casos[2],[5]. Las escoliosis neuromuculares son infrecuentes, de inicio precoz y de rapida evolución a deformidades severas[4]. Presentan una morbimortalidad perioperatoria que alcanza hasta un 35%[3],[4],[5].
En esta cirugía se identifican múltiples factores de riesgo para el desarrollo de daño renal agudo (AKI = Acute kidney injury), no obstante, esta complicación ha sido escasamente descrita en contexto de pacientes con escoliosis neuromuscular. A continuación describimos dos casos AKI en el postoperatorio inmediato en cirugía correctiva de escoliosis neuromuscular ocurridas en el hospital San Borja Arriarán en el año 2015.
Caso clínico 1
N.S. Mujer de 20 años, 30 kg y 1,27 m de estatura. Portadora de cifoescoliosis neuromuscular severa de doble curva (T4 a T11 con 64° y curva secundaria de T11-S1 con 100° Cobb). Parálisis cerebral espástica, epilepsia secundaria y retraso mental severo. Evaluación cardiopulmonar: gasometría normal, espirometría no concluyente porque no logra realizar examen. Ecocardiograma Transtorácico normal. En lo neurológico tono espástico en cuatro extremidades e hiperreflexia, electroencefalograma con actividad epileptiforme. Exámenes preoperatorios basales en Tabla 1.
Anestesia
Inducción y mantención con anestesia total endovenosa remifentanyl y propofol titulados a TCI (target controled infusion), relajo neuromuscular con atracurio. Monitoreo standard y presión arterial invasiva (PAI), sonda foley y control continuo de temperatura esofágica. Dos accesos venosos. Aporte de volumen con cristaloides Ringer – lactato y NaCL 0,9%. Técnica de ahorro de sangre: ácido tranexánico e hipotensión controlada para presión arterial media (PAM) con meta 55 – 60 mmHg. Analgesia multimodal con ketorolaco, dipirona, paracetamol endovenoso y metadona 0,1 mg/kg pre instrumentación.
Neuromonitoreo
Se realizan potenciales evocados sensitivos con estimulación en tibial posterior bilateral. Potenciales evocados motores con estimulación cerebral y registro muscular en hallux, tibial anterior y bíceps braquial bilaterales.
Evolución perioperatoria
Artrodesis posterior con tornillos pediculares e iliacos desde T4 a pelvis y dos barras premoldeadas. Se usó aloinjerto óseo con 1 g de vancomicina en el sitio quirúgico.
El sangrado estimado fue de 3.000 ml. La reposición de volumen fue con 800 ml de plasma fresco congelado (4 Unidades), 779 ml de glóbulos rojos (GR) autólogos al 50% obtenidos con el recuperador celular, más 2.500 ml de cristaloides administrados en forma liberal. Al finalizar la cirugía se logra un hematocrito de 23,7% y una hemoglobina de 8,6 g/dL. Hemodinamia se reportó estable dentro de las metas de PAM. Neuromonitoreo sin incidentes. La diuresis intraoperatoria total fue de 60 ml, equivalentes a 0,44 ml/kg/h.
Precozmente a su ingreso a la unidad de cuidados intensivos (UCI) se evidencia creatinkinasa (CK) de 3.200 U/L, creatinina de 1,22 mg/dL, sedimento de orina con cilindros granulosos gruesos y finos además de hematuria y mioglobinuria. Destaca alza persistente de CK con cenit a las 24 h (11.022 U/L) y reagudización de la anemia a las 48 h, llegando a Hb de 6,6 g/dL. Se maneja con tranfusión de 1 U de GR. En la Tabla 2 se muestra la evolución temporal de valores de laboratorio.
| Tabla 2 Evolución temporal de hematocrito/hemoglobina, función renal y CK total desde preoperatorio (basal) hasta el día 5. Casos 1 y 2 |
.jpeg) |
En el manejo destaca alcalinización de orina precoz con 400 ml de bicarbonato 2/3 molar. Hemodinamia se sostuvo sólo con aporte liberal de cristaloides no se usaron drogas vasoactivas.
Caso clínico 2
G.A. varón de 16 años, 81 Kg y estatura 1,79 m. Con cifoescoliosis severa, portador de la enfermedad de Scheuermann y miopatía congénita. Historia de apnea obstructiva del sueño y trastorno de déficit atencional.
-
Estudio preoperatorio
Cardiopulmonar normal. Neurológico: debilidad de músculos faciales extraoculares y de extremidades superiores. Exámenes preoperatorios en Tabla 1. Igual técnica anestésica y neuromonitoreo que caso 1.
-
Evolución perioperatoria
Se realizó artrodesis posterior de T4 a L4. Instrumentación con tornillos bilaterales y dos barras. Se usó injerto de osteotomía e injerto sintético más 2 g de vancomicina. El sangrado estimado fue de 1.200 ml. Se recuperaron 815 ml de GR autólogos al 54%. Neuromonitoreo intraoperatorio normal. No se describen alteraciones hemodinámicas.
Al primer día postoperatorio presentó anuria, alza de creatinina, mioglobinuria y hematuria. CK alcanza un cenit de 13.551 U/L. Se dializa entre las 48 h y el 11vo día del postoperatorio logrando recuperación de la función renal. Evolución temporal de valores de laboratorio se muestran en Tabla 2.
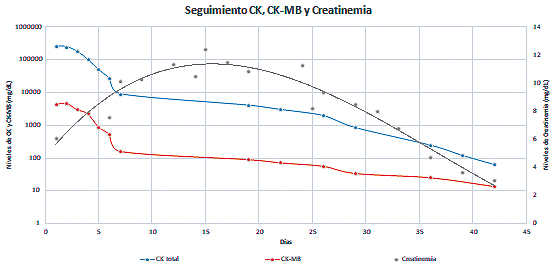 |
| Figura 1 Seguimiento de valores de Creatin-quinasa, Creatin-quinasa-MB y Creatinemia. |
Discusión
En ambos casos la creatinina plasmática presento un alza mayor a 0,3 mg/dl antes de las 48 h y alcanzo un cenit mayor a 6 veces el basal, al 5to día del postoperatorio. El debito urinario fue precozmente bajo desde la salida de pabellón con cifras menores a los 0,5 mg/kg/h y se mantuvo bajo por más de 6 horas. Esta evolución clasifica para AKI según los criterios de Kidney Disease Improving Global Outcomes Foundation (KDIGO)[7]. La aparición de AKI fue claramente previsible pues coexistieron múltiples factores de riesgo:
a) Anemia, hipovolemia e hipoperfusión renal: la artrodesis posterior es muy sangradora[5],[6]. En el primer caso la perdida fue mayor a una volemia (referencia formula de Nader). Las técnicas de ahorro de sangre usadas fueron ácido tranexánico en infusión, rescate sanguíneo intraoperatorio e hipotensión controlada. Esta última ha sido cuestionada por la creciente evidencia de hipoperfusion tisular[8] que probablemente se instaló en el intraoperatorio.
b) Uso de nefrotóxicos: ambos pacientes fueron expuestos a conocidos nefrotoxicos como los AINES y la vancomicina. Además de estos, hay que considerar el uso de metadona pues ha sido reportada como un potencial nefrotóxico y gatillante de rabdomiolisis[9]. Un mecanismo propuesto fue el aumento del consumo muscular de oxigeno favoreciendo la isquemia muscular especialmente si hay hipoperfusión.
c) Daño muscular quirúrgico: en ambos casos la incisión quirúrgica fue extensa afectando la musculatura de más de 12 niveles toracolumbares. En ambos casos hubo evidencia de este daño en las pruebas de laboratorio; alza brusca de CK en pacientes con niveles basales normales, además de la aparición precoz de mioglobinuria y hematuria en el sedimiento de orina. La literatura sugiere que este daño muscular es más intenso en pacientes portadores de miopatia de aquellos que no la poseen[10].
d) Transfusiones de hemoderivados alogénicos: son un conocido factor de riesgo independiente[11] de AKI.
Podemos especular que la AKI postoperatoria fue multifactorial y que la patología neuromuscular pudo condicionar el desarrollo de rabdomiolisis aguda[4],[10].
En escenarios quirúrgicos se identifican variados mecanismos de rabdomiolisis: trauma quirúrgico extenso,isquemia tisular por uso de torniquetes y clampeos vasculares, gatillada por gases halogenados o succinilcolina (hipertermia maligna en susceptibles), daño mitocondrial en síndrome de infusión prolongada por propofol, inducida por fármacos (ej: estatinas), infecciones y miopatias congénitas[12],[13]. Estas últimas son especialmente sensibles a cualquier injuriante muscular, pues pueden desencadenar lisis muscular severa, aún con actividad física de baja intensidad[4],[10].
Para el diagnostico de rabdomiolisis se requiere un cuadro clínico compatible y elevación de parametros sugerentes de daño muscular: alza de la CK mayor a 100 veces el valor normal[13], mioglobina plasmática elevada y mioglobinuria[12],[13],[14]. El daño renal agudo se ha documentado puede desarrollarse con niveles de CK mayores de 5.000 UI/L[ 13 ]. A las 48 h ambos casos presentan los criterios diagnósticos.
Podemos sugerir algunas conductas para prevenir el desarrollo de AKI en cirugía correctiva de escoliosis miopática:
1. Prevención de anoxia: aumentar la masa globular previo intervención[11] y suspensión de la hipotensión controlada como técnica de ahorro de sangre[8]. Esta ha sido cuestionada pues no ha demostrado disminuir las pérdidas sanguíneas, si aumentar el riesgo de daño neurológico postinstrumentación y agravar el daño renal como sugieren estos casos.
2. Detección precoz de rabdomiolisis: control de CK basal prequirúrgico, intraoperatorio y seriado al menos por 5 días postoperatorio. Buscar dirigidamente mioglobinuria en pabellón.
3. Limitar o eliminar el uso de AINES para la analgesia: las técnicas analgésicas actuales nos permiten eliminar el uso de AINES sin necesariamente aumentar el dolor postoperatorio. Uso de morfina intratecal[15] o dexmedetomidina[16] en el intraoperatorio son alternativas a explorar.
4. Limitar el uso de metadona. Si bien la evidencia es escasa y se basa sólo en reportes de casos puede evitarse y reemplazarse por otros opioides.
5. Reposición de volumen guiada por metas hemodinámicas a circulante efectivo como delta presión de pulso o por variación del gasto cardiaco. El uso de monitores asociado a línea arterial son factibles (ej: Liddco), la ecocardiografía transesofágica sería un gran aporte, pero su uso está limitado por el decúbito prono.
6. Monitoreo deuda global de oxigeno: curva de lactato, gradiente arterio-venosa de CO2, SavO2 son fácil de realizar con acceso arterial y venoso central[14] y permitiria identificar el gatillo transfusional óptimo[17].
7. Si bien no hay evidencia que demuestre eficacia en la prevención de rabdmiolisis, frente a la presencia de mioglobinuria en intraoperatorio podría explorarse la estrategias de alcalinización de orina.
Podemos concluir que el daño renal agudo en la cirugía de escoliosis es una complicación altamente probable y precoz en pacientes susceptibles al daño muscular. Conocer la especificidadaes de la tecnica quirúrgica y anestesica permite preveer e instalar medidas básicas de nefroprotección desde el intraoperatorio. El control de CK intraoperatorio parece ser de utilidad en el enfoque preventivo.
Referencias
1.Cobb JR. Outline for the study of scoliosis. American Academy of Orthopaedic Surgeons Instructional Course Lectures. 1948;5:261–5.
2. Rogala EJ, Drummond DS, Gurr J. Scoliosis: incidence and natural history. A prospective epidemiological study. J Bone Joint Surg Am. 1978 Mar;60(2):173–6. https://doi.org/10.2106/00004623-197860020-00005 PMID:641080
3. Weiss HR, Goodall D. (2008). Rate of complications in scoliosis surgery-a systematic review of the Pub Med literature. Scoliosis, 3(1), 9. doi: 9. https://doi.org/10.1186/1748-7161-3-9.
4. Pesenti S, Blondel B, Peltier E, Launay F, Fuentes S, Bollini G et al. Experience in Perioperative Management of Patients Undergoing Posterior Spine Fusion for Neuromuscular Scoliosis. BioMed Res Int. 2016;2016:3053056. https://doi.org/10.1155/2016/3053056 PMID:28058256
5. Murphy RF, Mooney JF 3rd. Complications following spine fusion for adolescent idiopathic scoliosis. Curr Rev Musculoskelet Med. 2016 Dec;9(4):462–9. https://doi.org/10.1007/s12178-016-9372-5 PMID:27639726
6. Buchlak QD, Yanamadala V, Leveque JC, Sethi R. Complication avoidance with pre-operative screening: insights from the Seattle spine team. Curr Rev Musculoskelet Med. 2016 Sep;9(3):316–26. https://doi.org/10.1007/s12178-016-9351-x PMID:27260267
7. Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group: KDIGO clinical practice guideline for acute kidney injury. Kidney Int Suppl. 2012;2:1–138.
8. Soghomonyan S, Stoicea N, Sandhu GS, Pasternak JJ, Bergese SD. The Role of Permissive and Induced Hypotension in Current Neuroanesthesia Practice. Front Surg. 2017 Jan;4:1. https://doi.org/10.3389/fsurg.2017.00001 PMID:28194399
9. Alinejad S, Ghaemi K, Abdollahi M, Mehrpour O. Nephrotoxicity of methadone: a systematic review. Springerplus. 2016 Dec;5(1):2087. https://doi.org/10.1186/s40064-016-3757-1 PMID:28018795
10. Halawi MJ, Lark RK, Fitch RD. Neuromuscular Scoliosis: current Concepts. Orthopedics. 2015 Jun;38(6):e452–6. https://doi.org/10.3928/01477447-20150603-50 PMID:26091215
11. Freeland K, Hamidian Jahromi A, Duvall LM, Mancini MC. Postoperative blood transfusion is an independent predictor of acute kidney injury in cardiac surgery patients. J Nephropathol. 2015 Oct;4(4):121–6. https://doi.org/10.12860/jnp.2015.23 PMID:26457259
12. Stone Genevra L, Flávio E. Nácul, John M O’Donnell. “Rhabdomyolysis.” Surgical Intensive Care Medicine. Springer International Publishing; 2016. pp. 645–51.
13. Madrazo Delgado M, Uña Orejón R, Redondo Calvo FJ, Criado Jiménez A. Rabdomiolisis isquémica y fracaso renal agudo. Rev Esp Anestesiol Reanim. 2007 Aug-Sep;54(7):425–35. PMID:17953337
14. Isbister JP. The three-pillar matrix of patient blood management—an overview. Best Pract Res Clin Anaesthesiol. 2013 Mar;27(1):69–84. https://doi.org/10.1016/j.bpa.2013.02.002 PMID:23590917
15. Son-Hing JP, Poe-Kochert C, Thompson GH, Potzman J, Tripi PA. Intrathecal morphine analgesia in idiopathic scoliosis surgery: does sex or racial group affect optimal dosing? J Pediatr Orthop. 2011 Jul-Aug;31(5):489–95. https://doi.org/10.1097/BPO.0b013e3182203988 PMID:21654454
16. Jones JS, Cotugno RE, Singhal NR, Soares N, Semenova J, Nebar S et al. Evaluation of dexmedetomidine and postoperative pain management in patients with adolescent idiopathic scoliosis: conclusions based on a retrospective study at a tertiary pediatric hospital. Pediatr Crit Care Med. 2014 Jul;15(6):e247–52. https://doi.org/10.1097/PCC.0000000000000119 PMID:24743445
17. Vallet B, Adamczyk S, Barreau O, Lebuffe G. Physiologic transfusion triggers. Best Pract Res Clin Anaesthesiol. 2007 Jun;21(2):173–81. https://doi.org/10.1016/j.bpa.2007.02.003 PMID:17650770
Fecha de recepción: 21 de diciembre de 2017
Feccha de aceptación: 10 de enero de 2018
ORCID
https://orcid.org/0000-0002-6739-7386
Case report of two cases: Acute renal failure adter scolisosis surgeryCase report of two cases: Acute renal failure adter scolisosis surgery

 ORCID
ORCID