Mikel Batllori Gastón PhD 1a , Nicolás Zaballos Barcala MD 1a , Paloma Liberal Sarnago MD 1a , Héctor Bordas Larreta 1b , Cecilia Yoldi Mateo 1b , María Elena García Tinoco 1c
Recibido: 11-01-2019
Aceptado: 23-03-2019
©2019 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 48 Núm. 5 pp. 470-474|https://doi.org/10.25237/revchilanestv48n05.13
PDF|ePub|RIS
Noncardiogenic acute pulmonary edema in the immediate postoperative period
Abstract
Acute non-cardiogenic pulmonary edema is a rare clinical entity which sometimes complicates the perioperative period. Even though one of the main causes is the acute obstruction of the airway, which may occur during a laryngospasm event, its etiology is varied and must be known for an adequate clinical management. We report the case of an 18 year old patient who developed postoperative acute non-cardiogenic pulmonary edema, probably of mixed etiology.
Resumen
El edema agudo de pulmón (EAP) no cardiogénico es una entidad poco habitual que complica en ocasiones el período perioperatorio. Aunque una de las principales causas es la obstrucción aguda de la vía aérea que puede ocurrir durante un episodio de laringoespasmo, su etiología es variada y debe ser conocida para un adecuado manejo clínico. Presentamos el caso de un paciente de 18 años que desarrolló un EAP no cardiogénico postoperatorio, de etiología probablemente mixta.
-
Introducción
La aparición de un cuadro de edema pulmonar agudo (EAP) en el período perioperatorio puede deberse a causas tanto cardiacas como no cardiacas. El EAP no cardiogénico puede deberse a una serie de eventos desencadenantes, entre los que se encuentran la obstrucción de la vía aérea, las lesiones pulmonares, las lesiones traumáticas del sistema nervioso central, la anafilaxia y la sobrecarga-maldistribución de fluidos[1].
El conocimiento de los mecanismos fisiopatológicos asociados a la génesis del EAP no cardiogénico es esencial para mantener un grado de sospecha adecuado, así como para administrar un tratamiento precoz efectivo. Presentamos a continuación un caso de EAP no cardiogénico diagnosticado en el postoperatorio inmediato, que ilustra la posibilidad de que varias causas concomitantes contribuyan al desarrollo del cuadro clínico.
-
Caso clínico
Paciente de 18 años, sin antecedentes de interés. Acudió a Urgencias por cuadro de dolor abdominal de 48 horas de evolución, compatible con apendicitis aguda. Durante las últimas 12 horas había presentado valores de presión arterial sistólica de entre 60 y 80 mmHg, en probable relación con sepsis de origen abdominal (procalcitonina preoperatoria 35,65 ng/ml). Se decidió realizar una apendicectomía laparoscópica urgente. La intervención se llevó a cabo bajo anestesia general con intubación orotraqueal e inducción de secuencia rápida durante la que se administraron 20 mg de etomidato, 150 mcg de fentanilo y 100 mg de succinilcolina. Tras la inducción se constató hipotensión leve sostenida (75/55 mmHg), refractaria a la infusión intermitente de bolos de fenilefrina. Se realizaron canulaciones arterial y venosa central y se inició soporte con noradrenalina a 0,2 mcg/kg/min, incrementándose la presión arterial a 120/70 mmHg.
La duración de la cirugía fue de 110 minutos. Como mantenimiento anestésico se emplearon sevoflurano (2,5-3% en gas espirado) y 100 mg de rocuronio. Se administraron también 8 mg de dexametasona, 40 mg de omeprazol y 30 mg de ketorolaco. Se inició tratamiento antibiótico con 4 g/0,5 g de piperacilina/tazobactam. Se administraron 3.000 ml de cristaloide (Plasmalyte) hasta poder estabilizar la perfusión de noradrenalina en 0,35 mcg/kg/min. La diuresis fue sostenida y adecuada durante la cirugía (600 ml).
Al finalizar la cirugía se administraron 7 mg de cloruro mórfico, 1 g de paracetamol y 400 mg de sugammadex. El paciente fue extubado en quirófano, constatándose entonces una muy marcada agitación postoperatoria que precisó administración de un bolo de 100 mg de propofol. Tras administrarlo, se produjo una obstrucción parcial de la vía aérea resuelta con tracción mandibular, colocación de 2 cánulas nasofaríngeas y aplicación de presión positiva mediante mascarilla facial. A continuación se decidió traslado a la unidad de recuperación postanestésica, y justo entonces se observó expulsión brusca y masiva de esputo espumoso y rosáceo a través de las cánulas nasofaríngeas, coincidente con desaturación brusca por debajo de 80%. Se decidió reintubación urgente e instauración de ventilación mecánica, consiguiéndose una SpO2 de 99%. En este momento comenzó a producirse una salida masiva de esputo espumoso a través del tubo orotraqueal, con auscultación de crepitantes diseminados en ambos campos pulmonares. Ante la sospecha de EAP no cardiogénico se decidió administrar 100 mg de hidrocortisona y 80 mg de furosemida 80 y trasladar al paciente a la Unidad de Cuidados Intensivos (UCI). Una radiografía de tórax mostró infiltrados perihiliares bilaterales de predominio derecho (Figura 1), la relación PaO2/FiO2 fue de 200 y el valor de procalcitonina de 59,33 ng/ml. Una exploración ecocardiográfica transtorácica no reveló alteraciones en las funciones ventricular ni valvular, y ante la ausencia de otra clínica se estableció el diagnóstico de sospecha de EAP por presión negativa en el contexto de shock séptico de origen abdominal. Se inició tratamiento diurético, y tras 20 horas de ventilación mecánica el paciente fue extubado sin incidencias. 48 horas después fue dado de alta de la UCI, tras haberse controlado el cuadro séptico y dejar de precisar soporte vasopresor.
-
Discusión
La clínica del EAP perioperatorio es similar, independientemente de la causa que lo desencadene. Consiste en un cuadro de insuficiencia respiratoria aguda, con taquipnea, taquicardia, secreciones respiratorias espumosas rosáceas y crepitantes en la auscultación. El diagnóstico diferencial debe incluir causas cardiacas y no cardiacas (Figura 2). El EAP cardiogénico habitualmente viene precedido por una disfunción ventricular izquierda de nueva aparición, cuya causa puede ser variable (isquemia o disfunción valvular agudas, infarto, arritmias graves), y su diagnóstico se confirma generalmente mediante ecocardiografía. A veces, el EAP perioperatorio puede deberse a una combinación de mecanismos cardiacos y no cardiacos, como una insuficiencia cardiaca crónica que se vea descompensada por una sobrecarga de fluido intravascular.
El EAP postobstructivo, o “por presión negativa”, aparece como consecuencia de un episodio agudo de obstrucción de la vía aérea durante el que el paciente genera una gran presión negativa intratorácica. Es la causa más frecuente de EAP no cardiogénico en el perioperatorio, y suele aparecer tras episodios de laringoespasmo, en los que se realizan inspiraciones forzadas contra una glotis cerrada. La gran presión negativa intratorácica que se genera en esta situación incrementa el retorno venoso, aumenta la presión capilar pulmonar hidrostática y favorece el paso de fluido desde la microcirculación al intersticio pulmonar. Cuando una cantidad crítica de edema se acumula en el intersticio, el líquido sobrante comienza a pasar hacia los alveolos. La consecuencia es una hipoxemia arterial que habitualmente se manifiesta durante los primeros 90 minutos tras el inicio del cuadro y se acompaña de infiltrados pulmonares bilaterales en la radiografía de tórax. Se trata de un diagnóstico de exclusión, basado en la sospecha clínica, y suele presentarse en pacientes jóvenes de categorías ASA I y II[1].
El EAP secundario a daño pulmonar puede aparecer como consecuencia de una variedad de patologías que produzcan activación y daño sobre el endotelio vascular pulmonar. Muchas de estas patologías pueden producir también un síndrome de distrés respiratorio del adulto (SDRA). Algunas de sus causas más frecuentes son: sepsis, aspiración de contenido gastrointestinal, daño pulmonar por inhalación, transfusiones sanguíneas y traumatismos[2].
El EAP neurogénico ocurre en el contexto de patologías cerebrales recientes, tales como hemorragia subaracnoidea, ictus o traumatismos craneoencefálicos. Este tipo de EAP se origina como consecuencia de una descarga simpática masiva que genera hipertensión pulmonar, la cual a su vez induce un incremento de la permeabilidad capilar pulmonar. La anafilaxia puede desencadenar también EAP en el contexto de la exposición a alérgenos en el perioperatorio. Puede acompañarse de rash cutáneo, urticaria, edema, broncoespasmo y colapso hemodinámico.
En el caso que presentamos, se postuló una causa mixta como causa del desarrollo del EAP. En primer lugar, podría considerarse como causa una obstrucción parcial de la vía aérea. Se han descrito dos tipos de obstrucción por cierre laríngeo: la obturación glótica y el cierre en “válvula de bola”[3]. En el primer tipo, causado por una disminución en el tono de los músculos abductores de las cuerdas vocales, la aplicación de presión positiva puede resolver la obstrucción. En el segundo tipo, causado por una aducción de las cuerdas vocales verdaderas y falsas, la presión positiva puede empeorar el cierre mientras que la maniobra de tracción mandibular puede resolverlo. Si bien en nuestro caso se aplicaron ambas maniobras (presión positiva y tracción mandibular), y se obtuvo en todo momento una adecuada curva de capnografía, no podemos descartar que existiera una obstrucción parcial que contribuyera a la generación de presiones negativas intratorácicas mayores de las habituales y contribuyera a la génesis del EAP. En segundo lugar, podría considerarse la sepsis grave que presentaba nuestro paciente como causa contribuyente al desarrollo del EAP. La sepsis produce una alteración de la permeabilidad capilar pulmonar que puede favorecer el desarrollo de edema pulmonar, y que explica los casos de SDRA en el contexto de cuadros sépticos.
No se hallaron evidencias de patología cardiológica ni neurológica, ni tampoco se observaron signos o síntomas compatibles con anafilaxia. La imagen radiológica de infiltrados pulmonares bilaterales no era consistente con la que suele observarse en los cuadros de neumonitis por aspiración, en los que es más típico un infiltrado localizado. La administración de un volumen significativo de cristaloides en el contexto de una fluidoterapia de resucitación en un cuadro de shock séptico, aunque indicada, pudo contribuir al desarrollo del EAP.
El manejo clínico del EAP no cardiogénico perioperatorio debe centrarse en resolver la causa que lo originó, si es que ésta aún persiste. En nuestro caso se instauraron medidas para el control de la sepsis (eliminación quirúrgica del foco séptico y tratamiento antibiótico). El tratamiento del EAP en sí mismo se basa en medidas de soporte ventilatorio y administración de diuréticos. Si bien algunos casos leves pueden recuperarse con tratamiento conservador, otros pacientes requerirán ventilación mecánica con presión positiva telespiratoria[4].
Ante la aparición de un cuadro de EAP perioperatorio es importante considerar el diagnóstico diferencial, teniendo en cuenta las causas cardiacas y no cardiacas. La utilización de un algoritmo basado en la experiencia clínica como el que exponemos (Figura 2), aunque no esté validado, puede facilitar la actitud diagnóstica y terapéutica.
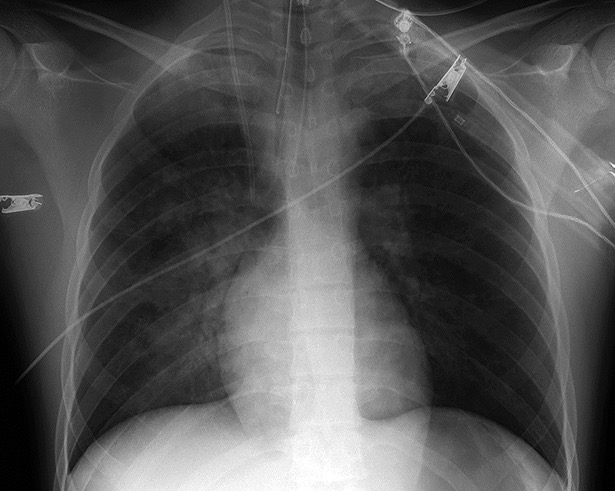
Figura 1. Radiografía de tórax obtenida en el postoperatorio inmediato, en la que se observan infiltrados pulmonares perihiliares bilaterales de predominio derecho.
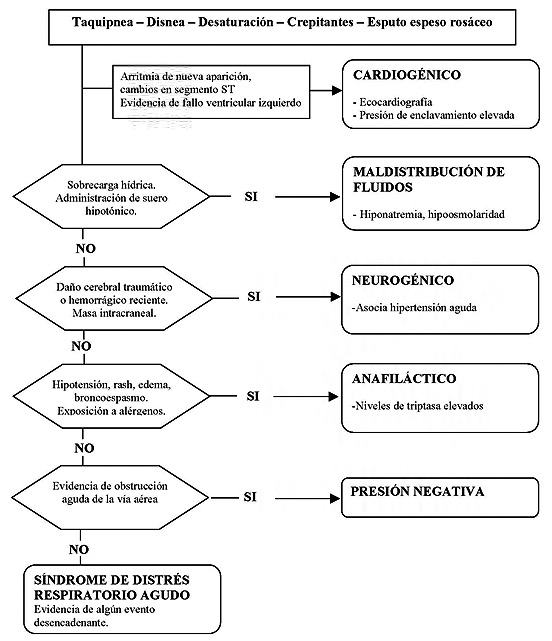
Figura 2. Algoritmo para el diagnóstico diferencial etiológico del edema agudo de pulmón postoperatorio[2].
-
Referencias
1. Krodel DJ, Bittner EA, Abdulnour R, Brown R, Eikermann M. Case scenario: acute postoperative negative pressure pulmonary edema. Anesthesiology. 2010 Jul;113(1):200–7. https://doi.org/10.1097/ALN.0b013e3181e32e68 PMID:20526178
2. Angus DC. The acute respiratory distress syndrome: what’s in a name? JAMA. 2012 Jun;307(23):2542–4. https://doi.org/10.1001/jama.2012.6761 PMID:22797455
3. Salem MR, Ovassapian A. Difficult mask ventilation: what needs improvement? Anesth Analg. 2009 Dec;109(6):1720–2. https://doi.org/10.1213/ANE.0b013e3181be0541 PMID:19923495
4. Herrick IA, Mahendran B, Penny FJ. Postobstructive pulmonary edema following anesthesia. J Clin Anesth. 1990 Mar-Apr;2(2):116–20. https://doi.org/10.1016/0952-8180(90)90064-A PMID:2189449

 ORCID
ORCID



 Creative Commons Attribution
Creative Commons Attribution