Nicolás Valls J. 1 , Constanza Alzola. 1 , Luis Toro 2 , Fernando Marchant 3 , Afaf Rumie 4 , Pascuala Ebner 4 , Rodrigo Alzamora 4 , Antonello Penna 1,2
Recibido: 02-07-2019
Aceptado: 05-08-2019
©2020 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 49 Núm. 2 pp. 255-261|https://doi.org/10.25237/revchilanestv49n02.10
PDF|ePub|RIS
Perioperative acute kidney injury. A study protocol todetermine the role of Fibroblast Growth Factor 23 as abiomarker for early diagnosis
Abstract
Acute kidney injury (AKI) corresponds to a sudden reduction in renal function, and its diagnosis is based on an increase in serum creatinine or a decrease in diuresis. Both diagnostic criteria show slow kinetics and do not allow early intervention to modify the course of the pathology. Hence, it is essential to identify more early AKI biomarkers. In this protocol, a new biomarker, the fibroblast growth factor 23 (FGF23), will be studied for the detection of AKI caused by renal hypoperfusion due to transient and controlled ischemia during partial nephrectomy. Therefore, the objective of this protocol will be to evaluate the role of FGF23 in predicting the development of ischemic AKI. An observational and prospective study of a group of patients undergoing partial nephrectomies will be carried out. The control group will include patients undergoing abdominal surgeries. All patients will be measured creatinine and FGF23 before surgery and after 1, 24, and 72 hours of ischemia. Additionally, the duration of ischemia, episodes of hypotension, and estimated bleeding will be recorded. Preliminarily, 10 patients undergoing partial nephrectomies have been studied. Three developed AKI, but in all 10 patients, FGF23 increased in the first hour after ischemia. Although these results are promising, they should still be confirmed once the experimental protocol is concluded.
Resumen
La injuria renal aguda (IRA) corresponde a una reducción súbita de la función renal y su diagnóstico se basa en un aumento de la creatinina sérica y/o una disminusión de la diuresis. Ambos criterios diagnósticos presentan una cinética lenta y no permiten actuar precozmente para modificar el curso de la patología. Por ello, es imprescindible identificar biomarcadores de IRA más precoces. En este protocolo se estudiará un nuevo biomarcador, el factor de crecimiento fibroblástico 23 (FGF23), para la detección de IRA causada por una hipoperfusión renal debido a una isquemia transitoria y controlada durante una nefrectomía parcial. Entonces, el objetivo de este protocolo será evaluar el rol de FGF23 para predecir el desarrollo de IRA de causa isquémica. Se realizará un estudio observacional y prospectivo, de un grupo de pacientes sometidos a nefrectomias parciales. Como grupo control se incluirá a pacientes sometidos a cirugías abdominales. A todos los pacientes, se les medirá creatinina y FGF23 previo a la cirugía y tras 1, 24 y 72 horas de la isquemia. Adicionalmente, se registrará la duración de la isquemia, los episodios de hipotensión y el sangrado estimado. Preliminarmente, se han estudiado 10 pacientes sometidos a nefrectomías parciales. Tres desarrollaron IRA, pero en los 10 pacientes el FGF23 se elevó en la primera hora posterior a la isquemia. A pesar de que estos resultados son promisorios, aún deben ser confirmados una vez que se concluya el protocolo experimental.
-
Introducción
La injuria renal aguda (IRA) se define como una reducción súbita de la función renal, lo cual clínicamente se manifiesta con un aumento absoluto de la creatinina plasmática y/o una disminución de la diuresis[1 ]. Se ha descrito que un 20% de los adultos hospitalizados presentan un daño agudo a nivel renal[2 ] y, además, se ha demostrado que la IRA es un factor de riesgo independiente de morbimortalidad a corto y largo plazo. Es así como, los pacientes que cursan con IRA tienen una mortalidad aumentada con un odds ratio (OR) de 2,2-8,8 en relación a los pacientes sin IRA, lo cual aumenta en forma proporcional a la severidad[3 ]. Adicionalmente, en el primer año de evolución, un 25,8% de los pacientes que sobreviven al cuadro agudo renal evolucionan hacia una enfermedad renal crónica y 8,6% requerirán algún tipo de terapia de reemplazo renal[4 ].
Fisiopatológicamente la IRA consiste en una caída rápida y potencialmente reversible de la velocidad de filtración glomerular (VFG)[5 ]. Clasificándose según la relación anatómica respecto al túbulo renal como: prerrenal (proximal al túbulo, glomerular y/o vascular), renal (a nivel del túbulo) y postrrenal (distal al túbulo, ej. Obstrucción de uréteres). El diagnóstico de la IRA y su clasificación actual se basan en la determinación del aumento de los niveles plasmáticos de creatinina y la disminución de la diuresis, según los criterios definidos actualmente por las guías de la “Kidney Disease: Improving Global Outcomes” o “KDIGO”. Sin embargo, los cambios de la creatininemia presentan una cinética lenta, manifestándose el alza de ésta con un importante retardo temporal con relación al deterioro agudo de la VFG, por lo que no se ajusta adecuadamente a la evolución de la enfermedad[6],[7]. Por otro lado, la disminución de la diuresis, el segundo indicador de IRA, se observa solamente en el 10% de los pacientes, lo que limita su utilidad[8 ]. Ambas determinaciones generan que el diagnóstico de IRA en el ámbito clínico sea tardío para la eventual toma de decisiones que puedan prevenir el daño. Es debido a esto que existe un gran interés en encontrar biomarcadores de daño renal que permitan predecir y diagnosticar precozmente el desarrollo de IRA.
-
Biomarcador propuesto
La National Institutes of Health estableció la definición de biomarcador como un parámetro biológico, medible y cuantificable, capaz de identificar procesos fisiológicos o patológicos, o bien una respuesta a una intervención. En relación a la IRA, correspondería a una molécula plasmática cuyos niveles se modifiquen concordantemente junto al desarrollo agudo del daño renal, permitiendo su variación realizar un diagnóstico precoz. Este biomarcador debe, además, poseer una alta sensibilidad y especificidad para el diagnóstico y ser capaz de reflejar la magnitud del daño glomerular y tubular. Además, idealmente debería poder predecir la severidad y recuperación, anticipar potenciales desenlaces clínicos y no ser modificado por condiciones distintas del proceso fisiopatológico de la IRA.
El biomarcador propuesto en nuestro estudio corresponde al factor de crecimiento fibroblástico 23 (FGF23), el cual es una proteína de 251 aminoácidos (28 kDa), sintetizada principalmente en el hueso, en osteocitos y osteoblastos[9 ]. Esta molécula pertenece a la familia de los “Fibroblast Growth Factors”, teniendo acciones paracrinas/autocrinas en el tejido óseo, disminuyendo el crecimiento longitudinal y la mineralización[10],[11]. Su acción endocrina es la inhibición de la reabsorción de fosfato en el túbulo proximal renal, causando fosfaturia e hipofosfatemia[12 ]. Además, en el tejido renal disminuye la síntesis de vitamina D, por supresión de la expresión de la enzima 1 -hidroxilasa. Otro de sus tejidos blanco corresponde a la glándula paratiroides, donde inhibe la expresión y secreción de paratohormona[13 ]. En estudios clínicos, se ha demostrado que el FGF23 tiene un alza precoz y acorde a la severidad en pacientes con enfermedad renal crónica (ERC). Además, en modelos experimentales en los que se induce una ERC se ha demostrado que la concentración plasmática de FGF23 aumenta precozmente y la magnitud de aumento se correlaciona directamente con el deterioro crónico de la VFG[14 ].
El alza precoz de FGF23 en pacientes con ERC permitió cuestionarse si en la IRA este biomarcador también se eleva. De hecho, en un estudio clínico transversal realizado por Zhang M y cols.[15 ], el año 2011, se demostró que FGF23 aumenta en pacientes con IRA (n = 12) respecto a pacientes sin IRA (n = 8), sin encontrar una asociación con la severidad del daño renal. En un siguiente estudio caso-control realizado por Leaf DE y cols.[16], el año 2012, en pacientes hospitalizados en sala común y en una Unidad de Cuidados Intensivos (UCI), se encontraron niveles significativamente elevados de FGF23 a las 24 horas en los pacientes que desarrollaron una IRA, además, se observó que una elevación mayor de FGF23 se asoció a una mayor necesidad de terapia de reemplazo renal y una mayor mortalidad durante la hospitalización, demostrando que el alza de FGF23 se asoció a severidad y peor pronóstico.
La IRA es frecuente en los primeros días tras una cirugía, ya que los pacientes se ven expuestos a diversos factores que empeoran la perfusión renal en el acto quirúrgico, tales como: a) depleción de volumen intravascular (hemorragia, pérdidas elevadas de volumen), b) hipotensión con volumen conservado y/o vasoplejia (farmacológicas, shock cardiogénico, shock séptico), c) obstrucción de vasos arteriales (ej. pinzamiento de grandes vasos arteriales) y/o d) alteración de la autorregulación renal miogénica. Por ello, en este contexto es crítico predecir y diagnosticar precozmente la IRA. Sin embargo, el diagnóstico en el perioperatorio se realiza tardíamente, fundamentalmente en base a la elevación de la creatinina plasmática. El rol de FGF23 en el postoperatorio como biomarcador de IRA sólo se ha evaluado en el contexto de cirugía cardíaca, encontrándose que los niveles plasmáticos de FGF23 se elevaron significativamente en pacientes con necesidad de terapia de reemplazo renal y muerte intrahospitalaria[17 ]. No obstante, en las cirugías cardiacas existen múltiples injurias, tales como isquémicas, inflamatorias y secundarias al uso de múltiples fármacos, por lo que estos resultados no se pueden generalizar al resto de las cirugías, en las que el daño renal ocurre fundamentalmente por un déficit en la perfusión. Por ello, es necesario evaluar el rol de FGF23 tras cirugías en las cuales el daño renal sea generado fundamentalmente por una isquemia. Tal es el caso de las nefrectomías parciales, en las cuales ocurre una injuria renal isquémica controlada (hipoperfusión extrema) con tasas conocidas de desarrollo de IRA (39%). Por este motivo, este tipo de cirugías se transforma en un modelo clínico efectivo para determinar el rol de FGF23 como biomarcador del desarrollo de IRA en el postoperatorio.
El presente protocolo de estudio tiene como objetivo establecer el rol de FGF23 en el contexto de IRA en el postoperatorio inmediato. Se espera que una isquemia renal transitoria incremente los niveles plasmáticos de FGF23 proporcionalmente al daño renal, determinando así su papel en el diagnóstico y evaluación de severidad en pacientes postoperados de nefrectomías parciales.
-
Metodología
Para el objetivo específico en pacientes sometidos a nefrectomías parciales durante una isquemia renal transitoria y la determinación del rol de FGF23 como biomarcador de IRA en el postoperatorio, se realizará un estudio clínico observacional prospectivo, el cual ha sido aprobado por el Comité Ético-Científico del Hospital Clínico de la Universidad de Chile. En este estudio se incluirán pacientes adultos sin comorbilidades mayores (ASA 1 y 2), quienes serán sometidos a una cirugía de nefrectomía parcial habiendo previamente aceptado el consentimiento informado (Grupo Estudio). Además, se estudiará un grupo de pacientes con similares características, quienes serán sometidos a cirugías electivas realizadas bajo anestesia general, las cuales se realizan sin isquemia renal (Grupo Control). Se excluirán los pacientes con antecedentes de enfermedad renal crónica, definida como una alteración de la función renal de más de tres meses de evolución caracterizada por una velocidad de filtración glomerular estimada (eVFG) menor a 60 ml/min. La eVFG será calculada a través de la ecuación CKD-EPI[18 ]. Se excluirán, además, pacientes menores de 18 años, embarazadas, usuarios de fármacos nefrotóxicos, de metformina, pacientes en los cuales su procedimiento corresponda a una reintervención quirúrgica, pacientes anémicos (hemoglobina < 13 g/dl hombres y < 12 g/dl mujeres), pacientes ferropénicos y pacientes con alteraciones en paratohormona y/o vitamina D.
A los pacientes del Grupo Estudio se les realizará en distintas temporalidades la medición de niveles plasmáticos de FGF23, creatinina, diuresis, velocidad de filtración glomerular estimada a través del clearence de creatinina. Previo a la cirugía, se obtendrán los datos demográficos, clínicos y el uso de fármacos para control de comorbilidades crónicas. Luego, al ingreso a pabellón se tomarán muestras de sangre venosa para determinación de creatinina y FGF23, las cuales se repetirán: 1 h, 24 h y 72 h posterior al inicio de la isquemia renal. Además, a las 24 h postoperatorias se realizará la medición de clearence de creatinina acotado a 8 h[19 ]. Adicionalmente, se registrarán en el intraoperatorio fármacos utilizados durante la cirugía, estimación de sangrado en el intraoperatorio, periodos de hipotensión (definida como presión arterial media menor de 65 mmHg, mantenida por más de tres minutos) y aporte de volumen endovenoso (cristaloides y/o coloides). Finalmente, se registrarán datos clínicos de la evolución del paciente durante toda su hospitalización.
Por otro lado, a los pacientes del Grupo Control se les medirá creatinina, FGF23, en una muestra basal, tras transcurrido una hora desde el inicio de la intervención, luego a las 24 y 72 horas posteriores a la cirugía.
-
Análisis estadístico
La muestra de pacientes del Grupo Estudio será conseguida en el Hospital Clínico de la Universidad de Chile. El tipo de muestreo a utilizar será aleatorio simple. Para el cálculo del tamaño de la muestra a estudiar, se considerará como desenlace primario los niveles plasmáticos de FGF23 en pacientes que desarrollen y no desarrollen IRA postoperatorio. De esta forma, es importante tener en consideración los siguientes aspectos de acuerdo a lo reportado por la literatura y a los resultados de estudios previos:
• En un contexto de sepsis en paciente crítico, se determinó que los niveles plasmáticos de FGF23 de los pacientes con y sin IRA fueron de 28 y 8 pg/ml con una desviación estándar de 10 pg/ml[20 ].
• Existe una incidencia de IRA tras una nefrectomía parcial de un 39% según publicaciones epidemiológicas previas.
• Se considerará un 80% potencia, 5% de error, y un test de dos colas.
De acuerdo a la fórmula de tamaño muestral para diferencia de dos medias, se calculó un tamaño muestral de 20 individuos para diferenciar en base a FGF23 a los pacientes que desarrollan IRA y los que no desarrollan tras una nefrectomía parcial.
Por otro lado, la muestra de pacientes del Grupo Control será un 50% (10 pacientes) de la muestra calculada para el Grupo Estudio, para obtener un valor promedio de FGF23 con una dispersión similar al otro grupo.
-
Estadística descriptiva
Se realizará el test de Shapiro Wilk para evaluar la distribución normal de las variables continuas. Las estadísticas descriptivas se realizarán con porcentaje en caso de las variables categóricas y en el caso de las continuas con media ± desviación estándar o mediana (p25-p75) según corresponda de acuerdo a su distribución de normalidad.
El desarrollo de IRA postoperatorio, será representado en un gráfico de cajas con bigotes, uno para el grupo que desarrolle IRA, otro el que no lo haga y otro para el Grupo Control. El análisis estadístico se realizará usando el software Prism 6.
En base al desarrollo y no desarrollo de AKI postoperatorio se subdividirá la población del Grupo Estudio en dos grupos y se realizarán comparaciones adicionales. Para realizar las inferencias de hipótesis entre los dos; En el caso de las variables continuas se utilizará t-student o U de Mann-Withney según corresponda a la distribución de las variables. En el caso de las variables categóricas, se compararán mediante la prueba exacta de Fisher. Todas las pruebas estadísticas se realizarán considerando significativo un p – valor < 0,05.
Para evaluar si existe correlación entre los niveles de FGF23 y la gravedad de la IRA (etapificación según guía de KDIGO), determinado por la creatinina y clearence de creatinina, se realizarán pruebas de correlación de Pearson o Spearman, se utilizarán dependiendo de la distribución de las variables.
-
Ejecución del protocolo y resultados preliminares
En nuestro protocolo elegimos estudiar un grupo de pacientes específicos, los que representan un desafío fisiopatológico conocido y común al intraoperatorio. A pesar de que la etiología de la disfunción renal suele ser multifactorial y con factores de riesgo variados, la causa predominante de IRA durante la cirugía es la hipoperfusión renal. Por ello y con el fin de exponer la ejecución inicial del protocolo de investigación se muestran a continuación la información obtenida a partir de los 10 primeros pacientes incluidos en el Grupo de Estudio, correspondiente solo a pacientes sometidos a nefrectomías parciales con isquemia renal controlada a través del pinzamiento de la arteria renal.
Dentro de los 10 primeros participantes se encuentran 5 pacientes de sexo femenino y 5 masculinos. Teniendo una edad promedio de 48 años con un rango entre los de 31 a 65 años, con un valor de creatinina basal de referencia de 0,70 ± 0,2 mg/dl y una eVFG según CKD-EPI de 106 ± 16 ml/min /1,73 m2.
Con respecto al procedimiento quirúrgico, todas las intervenciones se realizaron sin incidentes, logrando en el 100% la correcta realización de la nefrectomía parcial. El tiempo de isquemia controlada fue de 21 ± 9 minutos. Adicionalmente, el tiempo de hipotensión registrado en el intraoparatorio fue de 13 ± 6 minutos y el sangrado intraoperatorio estimado fue en promedio 360 ± 40 ml. Por otro lado, el aporte de volumen fue realizado en el 100% de los casos con cristaloides (1.120 ± 538 ml).
Con respecto al desarrollo de IRA, tres pacientes (30%) cumplieron con criterios para el diagnóstico de IRA según las guías actuales de la KDIGO; 2 en base a un alza desde su creatinina basal ≥ 0,3 mg/dl (Figura 1) y un paciente debido a oliguria < 0,5 ml/kg/h mantenida por 12 horas. En todos los casos los criterios diagnósticos de IRA se cumplieron entre las 24 y 72 horas posteriores a la cirugía. Adicionalmente, el clearence de creatinina realizado durante el primer día postoperatorio resultó en promedio 142 ± 34 ml/min/173 m2, no siendo un aporte para la ayuda diagnóstica en ninguno de los casos estudiados hasta el momento. Es importante destacar que ningún paciente requirió diálisis después de la operación y no hubo complicaciones ni muertes asociadas a la intervención quirúrgica. Por otro lado, en relación al biomarcador propuesto en el estudio, FGF23, hasta el momento se ha elevado precozmente en todos los pacientes, observándose un alza promedio de 82%. Además, esta elevación ocurrió en 100% de los casos en la primera hora posterior a la isquemia renal (Figura 2).
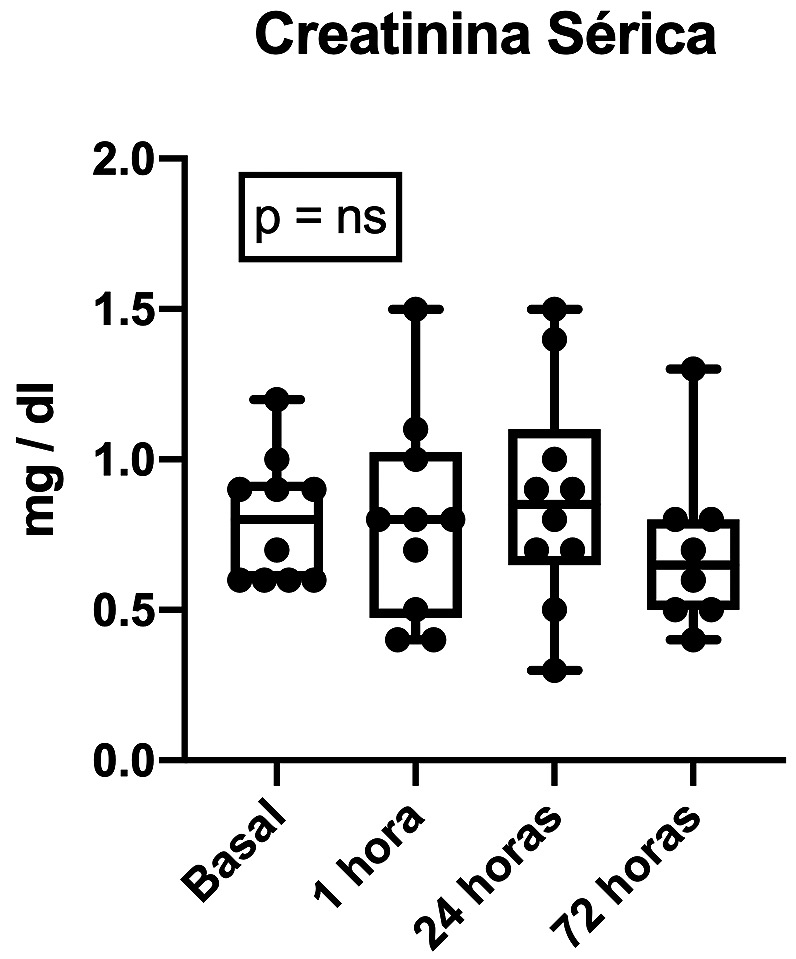
Figura 1. Curso temporal de creatinina sérica de los 10 pacientes sometidos a nefrectomía parciales. Cuatro muestras de sangre obtenidas en los distintos tiempos: Basal, y luego 1, 24 y 72 horas posteriores a la isquemia renal. No existen diferencias al comparar los valores basales con ninguna de las mediciones posteriores.
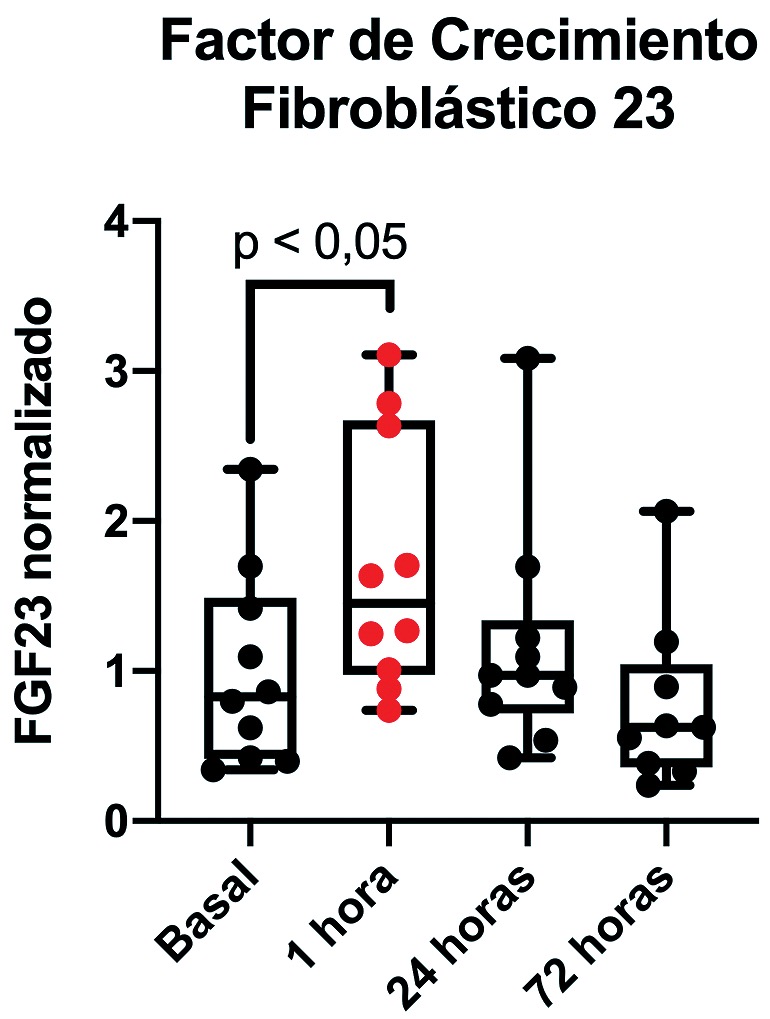
Figura 2. Curso temporal del factor de crecimiento fibroblástico 23 en 10 pacientes sometidos a nefrectomías parciales. Se muestran en el gráfico los valores normalizados, correspondiendo estos a la concentración (pg/ml) de cada muestra en relación al promedio de la concentración (pg/ml) de muestras basales. Existe una diferencia significativa (p < 0,05) al comparar los valores basales con la medición realizada tras una hora desde la isquemia renal.
-
Discusión
El riñón es un órgano bastante resistente que puede tolerar la exposición a varios insultos sin sufrir un cambio estructural o funcional significativo. Por esta razón, cualquier cambio agudo en la función renal a menudo indica un trastorno sistémico relevante y potencialmente predice un mal pronóstico. A pesar de esto, actualmente la VFG es ampliamente aceptada como pilar diagnóstico y como el mejor índice general de la función renal en condiciones fisiológicas y patológicas. Sin embargo, la VFG es difícil de medir y comúnmente se estima a partir del nivel sérico de marcadores de filtración endógenos, como la creatinina. Por esta razón, la creatinina y la diuresis son los subrogantes de los cambios reales que ocurren en el ámbito de la función renal.
Dado que el desarrollo de una IRA se asocia con una mayor morbilidad y mortalidad, el reconocimiento y manejo temprano de ésta es fundamental debido a que su manejo precoz puede producir mejores resultados que el tratamiento de la IRA ya establecida. Es debido a esto la importancia en la detección de IRA en sus etapas tempranas. Sin embargo, para lograr esto, se necesitan biomarcadores más sensibles y específicos que los cambios en la creatinina sérica o en la producción de orina, los cuales forman la base de todos los criterios de diagnóstico actuales.
En el protocolo de investigación presentado se observan exactamente las mismas características que se critican actualmente a las recomendaciones diagnósticas actuales. Observamos que, de los diez pacientes presentados, tres (30%) manifestaron una IRA con los criterios KDIGO. Sin embargo, los 10 pacientes fueron sometidos a una hipoperfusión renal extrema, dada por el pinzamiento de la arteria renal. Esta hipoperfusión renal, transitoria y controlada, en la mayoría de los pacientes (70%) no se manifestó con cambios en la función renal, ya sea como una alteración de la creatinina sérica, oliguria o disminución del clearence de creatinina medido. Es aquí donde se demuestra la fortaleza potencial de FGF23. Se observa en los 10 pacientes una elevación significativa del biomarcador dentro de la primera hora posterior a la isquemia. Estos resultados son promisorios, pero deben ser confirmados una vez que se concluya el protocolo experimental.
Finalmente, en la literatura existen diversos ensayos clínicos que han probado variadas intervenciones farmacológicas dirigidas a la prevención de la IRA mediante la protección del riñón. Estas intervenciones farmacológicas incluyen infusiones de antioxidantes, administración de estatinas, N-acetilcisteína, hidratación con cristaloides intravenosos, alcalinización urinaria con bicarbonato de sodio, entre otros. Lamentablemente, a la fecha, la evidencia que respalda el uso rutinario de estas intervenciones para prevenir la IRA en el contexto perioperatorio sigue siendo limitada, y es claro que se necesitan más estudios. Basándonos en esto, creemos que futuros resultados podrían permitir a FGF23 predecir eficazmente el desarrollo de IRA en el postoperatorio, sobre la base de una medición realizada en una muestra sanguínea de fácil acceso, lo que permitiría, en condiciones clínicas reales, tomar medidas terapéuticas que hagan que el desenlace de daño sobre la función renal pueda ser aminorado.
En conclusión, este es un protocolo novedoso, cuyos resultados nos pueden dar nuevas luces acerca de la fisiopatología de la IRA perioperatoria y orientarnos de mejor manera para estudiar posibles medidas preventivas.
Fuentes de Financiamiento
Fondo de apoyo a la investigación, Comité Científico, Sociedad Chilena de Anestesiología 2016.
Concurso Proyectos de Investigación SAVAL 2016.
Referencias
1. Mehta RL, Kellum JA, Shah SV, Molitoris BA, Ronco C, Warnock DG, et al.; Acute Kidney Injury Network. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury. Crit Care. 2007;11(2):R31. https://doi.org/10.1186/cc5713 PMID:17331245
2. Susantitaphong P, Cruz DN, Cerda J, et al. Acute Kidney Injury Advisory Group of the American Society of Nephrology. World incidence of AKI: a metaanalysis. Clin J Am Soc Nephrol. 2013;8(9):1482–93. https://doi.org/10.2215/CJN.00710113 PMID:23744003
3. Srisawat N, Kellum JA. Acute kidney injury: definition, epidemiology, and outcome. Curr Opin Crit Care. 2011 Dec;17(6):548–55. https://doi.org/10.1097/MCC.0b013e32834cd349 PMID:22027404
4. Coca SG, Singanamala S, Parikh CR. Chronic kidney disease after acute kidney injury: a systematic review and meta-analysis. Kidney Int. 2012 Mar;81(5):442–8. https://doi.org/10.1038/ki.2011.379 PMID:22113526
5. Abuelo JG. Normotensive ischemic acute renal failure. N Engl J Med. 2007 Aug;357(8):797–805. https://doi.org/10.1056/NEJMra064398 PMID:17715412
6. Myers BD, Moran SM. Hemodynamically mediated acute renal failure. N Engl J Med. 1986 Jan;314(2):97–105. https://doi.org/10.1056/NEJM198601093140207 PMID:3510383
7. Star RA. Treatment of acute renal failure. Kidney Int. 1998 Dec;54(6):1817–31. https://doi.org/10.1046/j.1523-1755.1998.00210.x PMID:9853246
8. Prowle JR, Liu YL, Licari E, Bagshaw SM, Egi M, Haase M, et al. Oliguria as predictive biomarker of acute kidney injury in critically ill patients. Crit Care. 2011 Jul;15(4):R172. https://doi.org/10.1186/cc10318 PMID:21771324
9. Wang H, Yoshiko Y, Yamamoto R, Minamizaki T, Kozai K, Tanne K, et al. Overexpression of fibroblast growth factor 23 suppresses osteoblast differentiation and matrix mineralization in vitro. J Bone Miner Res. 2008 Jun;23(6):939–48. https://doi.org/10.1359/jbmr.080220 PMID:18282132
10. Hu MC, Shiizaki K, Kuro-o M, Moe OW. Fibroblast growth factor 23 and Klotho: physiology and pathophysiology of an endocrine network of mineral metabolism. Annu Rev Physiol. 2013;75(1):503–33. https://doi.org/10.1146/annurev-physiol-030212-183727 PMID:23398153
11. Neyra JA, Moe OW, Hu MC. Fibroblast growth factor 23 and acute kidney injury. Pediatr Nephrol. 2015 Nov;30(11):1909–18. https://doi.org/10.1007/s00467-014-3006-1 PMID:25480729
12. Gattineni J, Bates C, Twombley K, Dwarakanath V, Robinson ML, Goetz R, et al. FGF23 decreases renal NaPi-2a and NaPi-2c expression and induces hypophosphatemia in vivo predominantly via FGF receptor 1. Am J Physiol Renal Physiol. 2009 Aug;297(2):F282–91. https://doi.org/10.1152/ajprenal.90742.2008 PMID:19515808
13. Kuro-o M. Klotho. Pflugers Arch. 2010 Jan;459(2):333–43. https://doi.org/10.1007/s00424-009-0722-7 PMID:19730882
14. Ix JH, Shlipak MG, Wassel CL, Whooley MA. Fibroblast growth factor-23 and early decrements in kidney function: the Heart and Soul Study. Nephrol Dial Transplant. 2010 Mar;25(3):993–7. https://doi.org/10.1093/ndt/gfp699 PMID:20037168
15. Zhang M, Hsu R, Hsu CY, Kordesch K, Nicasio E, Cortez A, et al. FGF-23 and PTH levels in patients with acute kidney injury: A cross-sectional case series study. Ann Intensive Care. 2011 Jun;1(1):21. https://doi.org/10.1186/2110-5820-1-21 PMID:21906363
16. Leaf DE, Wolf M, Waikar SS, Chase H, Christov M, Cremers S, et al. FGF-23 levels in patients with AKI and risk of adverse outcomes. Clin J Am Soc Nephrol. 2012 Aug;7(8):1217–23. https://doi.org/10.2215/CJN.00550112 PMID:22700885
17. Leaf DE, Christov M, Jüppner H, Siew E, Ikizler TA, Bian A, et al. Fibroblast growth factor 23 levels are elevated and associated with severe acute kidney injury and death following cardiac surgery. Kidney Int. 2016 Apr;89(4):939–48. https://doi.org/10.1016/j.kint.2015.12.035 PMID:26924052
18. Levey AS, Stevens LA, Schmid CH, Zhang YL, Castro AF 3rd, Feldman HI, et al.; CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). A new equation to estimate glomerular filtration rate. Ann Intern Med. 2009 May;150(9):604–12. https://doi.org/10.7326/0003-4819-150-9-200905050-00006 PMID:19414839
19. O’Connell MB, Wong MO, Bannick-Mohrland SD, Dwinell AM. Accuracy of 2- and 8-hour urine collections for measuring creatinine clearance in the hospitalized elderly. Pharmacotherapy. 1993 Mar-Apr;13(2):135–42. PMID:8469620
20. Toro L, Barrientos V, León P, Rojas M, Gonzalez M, González-Ibáñez A, et al. Erythropoietin induces bone marrow and plasma fibroblast growth factor 23 during acute kidney injury. Kidney Int. 2018 May;93(5):1131–41. https://doi.org/10.1016/j.kint.2017.11.018 PMID:29395333

 ORCID
ORCID