Ramos Matías 1 , Fratebianchi Franco 1 , Verlangieri Stella 1
Recibido: —
Aceptado: —
©2021 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 50 Núm. en avance pp. -|https://doi.org/10.25237/revchilanestv50-03-03
PDF|HTML-EN|ePub|RIS
Vasoplegic shock after pheocromocytoma resection: the role of methylene blue
Abstract
We present a case of a patient with hypotension refractory to the administration of norepinephrine after laparoscopic pheochromocytoma resection in the left adrenal gland. We describe the use of methylene blue as an alternative drug therapy to the adrenergic system, as well as associated doses, contraindications and complications.
Resumen
Presentamos el caso de un paciente con hipotensión refractaria a la administración de noradrenalina luego de la resección laparoscópica de un feocromocitoma en la glándula suprarrenal izquierda. Describimos el uso de azul de metileno como terapia farmacológica alternativa al sistema adrenérgico, así como también dosis, contraindicaciones y complicaciones asociadas.
-
Introducción
El manejo perioperatorio de los feocromocitomas es un desafío para el equipo médico perioperatorio. Desde la optimización preoperatoria hasta el manejo de las crisis adrenérgicas en quirófano, el rol del anestesiólogo es crucial para obtener buenos resultados. En particular, la hipotensión luego del aislamiento quirúrgico del tumor, puede ser un problema dada su refractariedad a los vasoactivos comúnmente utilizados. Describiremos el uso de azul de metileno ante un caso de shock vasopléjico refractario a noradrenalina.
-
Presentación del caso
Paciente masculino de 56 años, ASA III, portador de tumor adrenal identificado como feocromocitoma, programado para adrenalectomía laparoscópica. En la visita preanestésica reveló un historial de insuficiencia cardíaca, fibrilación auricular, hipertensión arterial, diabetes mellitus, hipotiroidismo, infarto de miocardio que requirió colocación de stent metálico en coronaria derecha y neurofibromatosis tipo I. Su medicación habitual incluía: valsartán, ivabradina, metformina, digoxina, rosuvastatina, clopidogrel, nebivolol, levotiroxina, ácido acetilsalicílico, doxazosina y acenocumarol. El acenocumarol y el clopidogrel fueron suspendidos cinco días antes de la cirugía, de acuerdo a las recomendaciones actuales[1]. Entre los estudios preoperatorios se destaca un ecocardiograma que revela hipoquinesia global, hipertrofia ventricular excéntrica, fracción de eyección de 38%, función ventricular derecha disminuida (TAPSE 14 mm) e insuficiencia mitral leve. La cinecoronariografía muestra la arteria descendente anterior libre de lesiones, la arteria circunfleja con una lesión grave que compromete su luz en 70% y la arteria coronaria derecha con reestenosis grave del stent que disminuye su luz 95%.
La presión arterial al ingreso a quirófano era de 132/76 mmHg y la frecuencia cardíaca de 86 latidos por minuto. Se premedicó con midazolam y 75 mcg de fentanilo endovenoso, se colocaron monitores básicos, se cateterizó la arteria radial y luego de la inducción con fentanilo, propofol y rocuronio, se colocó catéter venoso central ecoguiado en yugular derecha. Para el mantenimiento de la anestesia se utilizó remifentanilo y sevoflurano.
Durante la cirugía, la presión arterial media (PAM) fue mantenida entre 70 y 90 mmHg con una infusión de noradrenalina. Debido a la manipulación quirúrgica, el tumor liberaba catecolaminas provocando crisis hipertensivas que requerían la administración de nitroprusiato sódico en infusión titulado entre 1 a 2,5 mcg/kg/min más bolos de fentolamina de 2 mg. Existió un episodio de taquicardia sinusal de 145 latidos por minuto asociado a 270/130 mmHg de presión arterial que requirió la administración de 0,5 mg/kg de esmolol.
Minutos luego del clampeo de la vena efluente se precipitó una crisis hipotensiva. Todos los vasodilatadores fueron suspendidos y se reinició la infusión de noradrenalina a 0,15 mcg/kg/min que, dada la falta de respuesta, fue titulándose hasta dosis de 0,7 mcg/kg/min. La PAM continuaba en 40 mmHg a pesar de la fluidoterapia con Ringer lactato y no había respuesta a bolos de 50 mcg de noradrenalina. Dada la secuencia de eventos y ante la ausencia de un desencadenante de falla cardíaca claro, el cuadro de hipotensión y taquicardia fue interpretado como shock vasopléjico. Ante la falta de vasopresina en nuestra institución y dada la evidente ineficiencia de los agonistas adrenérgicos para el control de la presión arterial, se decide administrar azul de metileno, 10 mg en bolo y luego 60 mg más en infusión durante 10 minutos. Una vez finalizada la administración, la presión arterial comenzó a recuperarse paulatinamente durante el cierre quirúrgico y fue necesario disminuir la dosis de noradrenalina. Finalizada la cirugía, el paciente fue extubado en quirófano y los vasoactivos suspendidos. Fue trasladado a Unidad Coronaria lúcido y hemodinámicamente estable, los signos vitales a su ingreso fueron: FC 107 lpm, TA 120/70 (89) mmHg, SpO2 95% al aire ambiente y 18 respiraciones por minuto. El paciente fue dado de alta de la unidad cerrada tres días después.
-
Discusión
Este caso muestra el efecto que tiene el corte abrupto en el suministro de catecolaminas por parte del feocromocitoma luego de su aislamiento quirúrgico. La caída brusca de la concentración de catecolaminas, sumado a la disminución de receptores adrenérgicos en la superficie celular, la acción residual de bloqueadores y la hemorragia (descartada en este caso) provocan una crisis hipotensiva que requiere la rápida intervención del médico anestesiólogo. La mayoría de las veces, el organismo responde a la suspensión de drogas vasodilatadoras, a fluidoterapia adecuada y a la infusión de catecolaminas exógenas. En este caso, el uso agresivo de terapia farmacológica adrenérgica con noradrenalina era completamente inefectivo, lo que llevó al diagnóstico de shock vasopléjico[2] refractario a catecolaminas. Inmediatamente se pensaron alternativas farmacológicas, y la vasopresina se mostró como una gran candidata[3], pero dado su falta de disponibilidad en nuestra institución fue descartada. Sabemos que el estrés quirúrgico y los fenómenos inflamatorios promueven la activación de la óxido nítrico sintasa inducible (iNOS) en el endotelio vascular, resultando en un incremento de óxido nítrico el cual estimula la guanilato ciclasa (GC)[4] y entonces, subsecuentemente, se incrementa el GMPc, mediador que dispara la relajación del músculo liso vascular (Figura 1). El producto final de esta vía es la vasodilatación y su consecuente pérdida de poscarga, que aún con gasto cardíaco normal o incluso aumentado, el organismo pierde la capacidad de generar presión arterial adecuada para su perfusión. El azul de metileno no depende de la disponibilidad de receptores adrenérgicos para la recuperación del tono muscular ya que cruza las membranas celulares y actúa inhibiendo a la iNOS y a la GC en el músculo liso vascular[5]. Este colorante, fuera del contexto perioperatorio, se ha utilizado para el tratamiento de la metahemoglobinemia, el priapismo y la malaria, mostrando un perfil de seguridad adecuado para su uso. En el ámbito de los cuidados críticos y anestesia, el azul de metileno ha demostrado ser útil en la vasoplejía de la cirugía cardíaca[6], en la reperfusión del trasplante hepático, en el shock anafilático y en pacientes quemados[7].
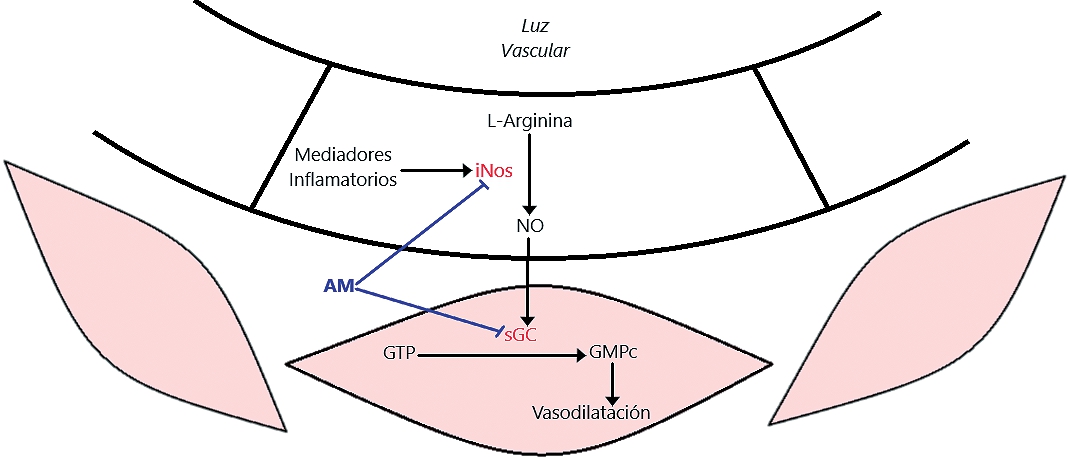
Figura 1.
La dosis de azul de metileno usualmente utilizada según trabajos en shock séptico, cirugía cardíaca o anafilaxia es de 1 a 2 mg/kg[8]. Manifestaciones tóxicas se han reportado con dosis de 7 mg/kg. Luego de descartarse contraindicaciones, como el uso de inhibidores de monoaminooxidasa o deficiencia de glucosa 6 fosfatasa, se decidió administrar 1 mg/kg de azul de metileno. Esto produjo una mejora sustancial en el perfil hemodinámico, traducido como la necesidad de descender la dosis de noradrenalina a medida que la presión arterial se recuperaba hacia valores normales. El resultado fue similar al obtenido en un reporte anterior, pero en un caso pediátrico[9].
Ya que el azul de metileno, al igual que la desoxihemoglobina, absorbe la luz de 660 nm emitida por el saturómetro, puede ser interpretado por el dispositivo como desaturación arterial[10]. En nuestro caso, este fenómeno no fue observado.
-
Conclusión
Este reporte muestra una clara mejoría hemodinámica luego del uso de azul de metileno para el control de un shock vasopléjico refractario a catecolaminas secundario a la resección de un feocromocitoma. Creemos que la mejora no fue solo una correlación coincidente, pero trabajos de superior calidad científica deberían realizarse para proporcionar mejor evidencia. Estamos seguros de que el anestesiólogo debe tener un umbral bajo para comenzar la terapéutica con alternativas farmacológicas al sistema adrenérgico con el objetivo de lograr la estabilidad hemodinámica una vez que la hipovolemia es corregida. De todos modos, como la evidencia científica que respalda el uso del azul de metileno no es de alta calidad, creemos que este agente no debería utilizarse en primera línea.
Esperemos que el reporte de este caso, junto con otros, sean las bases para que en un futuro se desarrollen ensayos de mayor complejidad y calidad científica.
Consentimiento: Los autores declaran que se ha obtenido el consentimiento informado del paciente para la publicación del presente trabajo.
Soporte financiero: Nulo.
Conflicto de interés: No hay conflicto de intereses.
Referencias
1. Kozek-Langenecker, S., Ahmed, A., Afshari, A., Albaladejo, P., Aldecoa, C., & Barauskas, G. et al. (2017). Management of severe perioperative bleeding. Eu-ropean Journal Of Anaesthesiology, 34(6), 332-395. https://doi.org/10.1097/EJA.0000000000000630
2. Landry DW, Oliver JA. The pathogenesis of vasodilatory shock.N Engl J Med 2001;345:588-95. https://doi.org/10.1056/NEJMra002709
3. Augoustides J, Abrams M, Berkowitz D. Vasopressin for hemodynamic rescue in catecholamine-resistant vasoplegic shock after resection of massive pheochromocytoma. Anesthesiology 2004; 101: 1022-1024. https://doi.org/10.1097/00000542-200410000-00031
4. Mayer B, Brunner F, Schmidt K. Inhibition of nitric oxide synthesis by methylene blue. Biochem Pharmacol. 1993;45: 367-374. https://doi.org/10.1016/0006-2952(93)90072-5
5. Faber P, Ronald A, Millar BW. Methylthioninium chloride: pharmacology and clinical applications with special emphasis on nitric oxide mediated vasodilatory shock during cardiopulmonary bypass. Anaesthesia 2005; 60: 575-587 https://doi.org/10.1111/j.1365-2044.2005.04185.x
6. Leyh RG, Kofidis T, Strüber M, Fischer S, Knobloch K, Wachsmann B, Hagl C, Simon AR, Haverich A. Methylene blue: the drug of choice for catecholami-ne-refractory vasoplegia after cardiopulmonary bypass? J Thorac Cardiovasc Surg 2003;125:1426-31) https://doi.org/10.1016/S0022-5223(02)73284-4
7. Hosseinian, L., Weiner, M., Levin, M. A., & Fischer, G. W. (2016). Methylene Blue. Anesthesia & Analgesia, 122(1), 194-201. https://doi.org/10.1213/ANE.0000000000001045
8. McCartney, S. L., Duce, L., & Ghadimi, K. (2018). Intraoperative vasoplegia: methylene blue to the rescue! Current Opinion in Anaesthesiology, 31(1), 43-49. https://doi.org/10.1097/ACO.0000000000000548
9. Amin Nasr, A., Fatani, J., Kashkari, I., Al Shammary, M., & Amin, T. (2009). Use of methylene blue in pheochromocytoma resection: case report. Pediatric Anesthesia, 19(4), 396-401. https://doi.org/10.1111/j.1460-9592.2009.02956.x
10. Kessler MR. Spurious pulse oximeter desaturation with methylene blue injection. Anesthesiology 1996;65:435-6. https://doi.org/10.1097/00000542-198610000-00017

 ORCID
ORCID