Javiera Flores C. 3 , M. Francisca Elgueta L. MD. 1 ,2 , Antonia Cárdenas C. MD. 1
Recibido: 06-08-2020
Aceptado: 30-10-2020
©2021 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 50 Núm. 4 pp. 568-575|https://doi.org/10.25237/revchilanestv50-04-05
PDF|ePub|RIS
Systemic lupus erythematosus: implications for anesthesia
Abstract
Introduction: Sistemyc lupus erythematosus (SLE) is an autoinmune disease associated to severe organ damage and mortality. SLE patients have a higher surgical risk. The objective of this article is to review the systemic manifestations of SLE and how they can challenge the anesthetic management, so a safer and more tailored anesthesia can be provided. Methods: A search was made on Pubmed, ProQuest, and EMBASE databases obtaining a total of 2,028 articles. The titles of articles found were reviewed, of which 88 merited greater review. The complete text of each article of this group was reviewed, references that were of greater interest were also reviewed. Finally, a total of 29 works to be included in this review were selected. Results: Musculoskeletal, cardiac, renal and laringeal involvement are the most frequent and important complications to anesthetic management. It´s clinical manifestations must be assess in the preoperative evaluation as well as potential pharmacological interactions with regular medications that the patient might be taking. The need of antibiotic profilaxis and steroidal supplementation has to be addressed. The post operative management should be focused on assessment of frecuent complications as cardiovascular or thrombotic events. Conclusion: SLE is a complex disease that represent a challenge in surgical context. Its complications can affect the airway, ventilatory or hemodinamic management as well as renal function. That is why the multidisciplinary management of these patients and a complete preoperative evaluation are essentials so a risk estratification can be made and anesthesiologists can prepare correctly to handle potential complications.
Resumen
Introducción: El lupus eritematoso sistémico es una enfermedad autoinmune, asociada a complicaciones severas y mayor mortalidad. Por las complicaciones de la enfermedad estos pacientes son de alto riesgo quirúrgico. El objetivo de este trabajo es revisar las manifestaciones sistémicas y complicaciones del LES y como éstas pueden afectar el manejo anestésico, de manera de proporcionar una anestesia más segura y acorde a las necesidades de cada paciente. Materiales y Métodos: Se realizó una búsqueda en Pubmed, Embase y ProQuest, encontrándose un total de 2.028 trabajos. Se revisaron los títulos, encontrando 88 de interés para mayor revisión. Se revisaron los textos completos, incluyendo además referencias y sugerencias que parecieron pertinentes. Se seleccionaron, finalmente, 29 trabajos para ser incluidos en esta revisión. Resultados: El compromiso musculoesquelético, cardiaco, renal y laríngeo son los más frecuentes e importantes en el manejo anestésico. Deben buscarse de manera dirigida en la evaluación preoperatoria, además de evaluar posibles interacciones farmacológicas entre anestésicos y medicamentos de uso habitual. Por el uso de corticoides e inmunosupresores, considerar el uso de profilaxis antibiótica y reemplazo esteroidal. El manejo posoperatorio debe enfocarse en la búsqueda de complicaciones más frecuentes como eventos cardiovasculares o trombóticos. Discusión: El LES es una enfermedad compleja con desafíos en el contexto quirúrgico. Sus complicaciones afectan el manejo de vía aérea, terapia ventilatoria, manejo hemodinámico y mantención de la función renal. Es por ello que el manejo multidisciplinario y una buena evaluación preoperatoria son fundamentales, de manera de estratificar el riesgo y prepararse oportunamente.
-
Introducción
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune sistémica, asociada a complicaciones severas y mayor mortalidad[1]. Se estima una prevalencia de 40 a 200 casos por 100.000 habitantes[2], afectando principalmente a mujeres en edad fértil[1],[3].
Su fisiopatología incluye una asociación de factores ambientales, hormonales y genéticos con alteraciones en la regulación de la respuesta inmune y mecanismos de apoptosis[1],[3].
Las manifestaciones clínicas son heterogéneas lo cual dificulta el diagnóstico[1]. Los síntomas más frecuentes son artralgias o artritis de pequeñas articulaciones, fotosensibilidad, rash malar y síntomas constitucionales que están presentes en el 80%-90% de los casos[1],[3],[4]. El compromiso sistémico involucra alteraciones hematológicas, cardiovasculares, pulmonares, óseas, neurológicas y renales, las cuales generan un deterioro importante en la calidad de vida[1],[3],[4]. El compromiso laríngeo, si bien es menos frecuente, ha tomado relevancia en el contexto anestésico, ya que puede manifestarse como una vía aérea difícil o generar obstrucción crítica de la vía aérea superior[4].
Por otro lado, el LES se asocia a una prevalencia alta de anticuerpos antifosfolípidos y síndrome antifosfolípidos (SAAF), que se asocian a mayor riesgo trombótico dificultando el manejo perioperatorio de estos pacientes. Considerando la alta prevalencia de LES en mujeres en edad fértil las complicaciones obstétricas asociadas a este cuadro son relevantes, con mayor riesgo de aborto espontáneo, preeclampsia y trombosis materna[3].
Además, del compromiso sistémico el LES se asocia a múltiples comorbilidades. El riesgo de sufrir eventos cardiovasculares es 2-3 veces mayor. Las infecciones también son más frecuentes, principalmente secundarias al tratamiento inmunosupresor y a las alteraciones en la inmunidad innata y adaptativa. La prevalencia de osteoporosis y fracturas también aumenta con respecto a la población general, probablemente en contexto de inflamación crónica o uso prolongado de corticoides[1].
La mortalidad es causada principalmente por enfermedades cardiovasculares, infecciones y complicaciones de la insuficiencia renal terminal. En Chile, las tasas de supervivencia son de 92% a los 5 años y 66% a los 15 años, las cuales son menores a las reportadas en otros países como, por ejemplo, Canadá donde las tasas de sobrevida son de 79% a los 15 años[2].
Gracias a la disponibilidad de tratamientos efectivos la sobrevida de estos pacientes ha aumentado en las últimas décadas, debiendo enfrentar pacientes más complejos, con un daño sistémico secundario a la evolución de la enfermedad importante y con mayor necesidad de intervención quirúrgica. Por las complicaciones sistémicas propias de la enfermedad y aquellas derivadas del tratamiento, los pacientes que padecen LES son de alto riesgo quirúrgico. En particular, las manifestaciones cardiacas, pulmonares, renales, hepáticas y laríngeas toman relevancia para el anestesiólogo por las implicancias que pueden tener en el manejo perioperatorio. Sin embargo, este es un tema poco estudiado por lo cual no hay protocolos de manejo establecidos. El objetivo de este trabajo es revisar las manifestaciones sistémicas y complicaciones del LES y cómo éstas pueden afectar el manejo anestésico, de manera de proporcionar una anestesia más segura y acorde a las necesidades de cada paciente.
-
Materiales y Métodos
Se realizó una búsqueda en las bases de datos Pubmed, Embase y ProQuest, utilizando los términos “systemic lupus erythematosus”, “anesthesia”, “anesthetic agents”, “anesthetic risk”, “surgical risk”, “perioperative care”, “laringeal involvement”, “azathioprine”, “cyclophosphamide”, “immunosuppressant agents”, “anesthetic drugs interaction” y sus respectivas combinaciones, encontrándose un total de 2.028 trabajos. Se revisaron los títulos de éstos, de los cuales 88 fueron encontrados de interés para mayor revisión. Se revisaron los resúmenes y textos completos, además se incluyeron para revisión algunas referencias y sugerencias que parecieron pertinentes para este trabajo. Se incluyeron solo artículos en idioma inglés y español, eligiendo aquellos con mejor calidad de evidencia como revisiones sistemáticas, ensayos randomizados o estudios de cohorte con un n significativo. Sin embargo, en algunos temas no se encontró evidencia de este tipo por lo que se incluyeron estudios de menor calidad. Se seleccionaron finalmente 29 trabajos para ser incluidos en esta revisión (Figura 1).
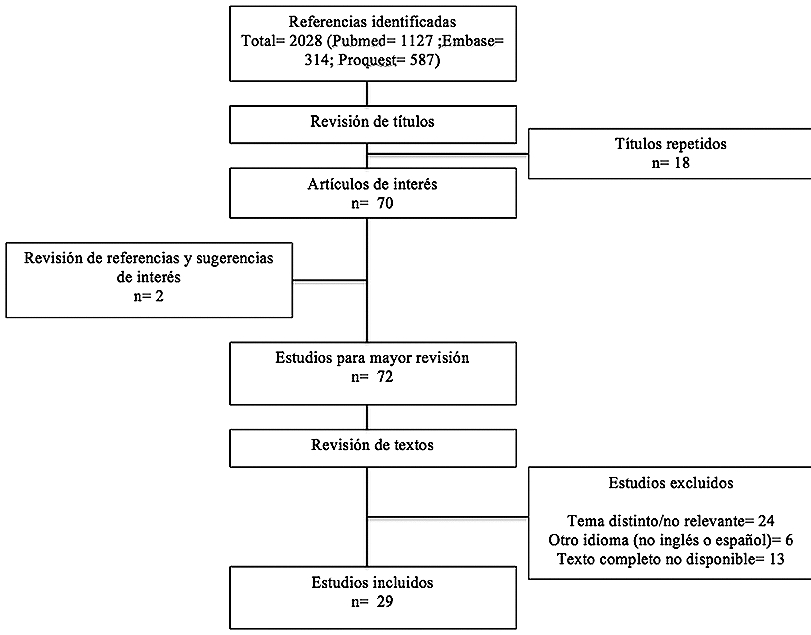
Figura 1. Estrategia de búsqueda.

Figura 1. Estrategia de búsqueda.
-
Resultados
-
Compromiso sistémico en LES
1. Musculoesquelético
El daño musculoesquelético es la complicación más frecuente con una prevalencia estimada entre 24%-55%[5]. Sobre un 90% de los pacientes manifiestan artralgias o artritis no erosiva[5]. Es frecuente también la osteoporosis, con una prevalencia de 23%, artrosis, necrosis avascular de la cabeza femoral y fracturas vertebrales por aplastamiento[5]. Probablemente están relacionadas a la inflamación crónica y a la falta de vitamina D, puesto que por la fotosensibilidad los pacientes evitan la exposición a la luz solar[4],[5]. Con respecto al uso crónico de corticoides, clásicamente se ha descrito como factor de riesgo de fracturas, pero hay estudios que no han encontrado asociación entre su uso y una menor densidad mineral ósea. Más bien, éste pudiese ser incluso benéfico al disminuir la actividad de la enfermedad, y por ende, la pérdida de masa ósea relacionada a la misma[4],[5]. Las tasas de necrosis avascular alcanzan 30% en algunos estudios y el riesgo de fracturas es 5 veces mayor a la población general[4]. Esto conlleva a altas tasas de artroplastías, especialmente de cadera y rodilla. El riesgo de inestabilidad de columna cervical no ha sido estudiado en estos pacientes[4].
2. Cardiovascular
Una de las complicaciones más reconocidas es la pericarditis, presente hasta en 25% de los pacientes de forma sintomática y en hasta 50% asintomáticamente[4]. El taponamiento cardiaco puede verse en 2% de los casos[4] y las manifestaciones clínicas dependen del tiempo de evolución y volumen de líquido acumulado. En derrames agudos o de alto volumen los mecanismos compensatorios no alcanzan a desarrollarse, por lo que la presión intrapericárdica aumenta, disminuyendo la compliance diastólica y el llenado ventricular. Si esto progresa las presiones pericárdicas y cardíacas terminan ecualizándose lo que resulta en un cese del llenado y eyección ventricular, con colapso hemodinámico secundario[6)]. Por otro lado, los pacientes con taponamiento cardiaco disminuyen su volumen sistólico en inspiración, cuando normalmente en esta fase se produce un aumento del llenado ventricular. El ventrículo izquierdo, al no poder expandirse contra el pericardio, desplaza el septum interventricular limitando el llenado del ventrículo derecho[6]. La clínica consiste en disnea, ortopnea, dolor torácico, ingurgitación yugular, hipotensión o disminución de tonos cardíacos. En el electrocardiograma se puede ver taquicardia, elevación difusa del segmento ST, disminución en la amplitud de los complejos QRS o alternancia eléctrica[6]. El gold standard para el diagnóstico es la ecografía, que permite clasificar la severidad del derrame y discriminar entre derrames pericárdicos y taponamiento, mediante la visualización de colapso de cámaras durante el ciclo cardiaco[6]. En ocasiones requieren pericardiocentesis, la cual puede ser percutánea o quirúrgica[4],[6]. Dado el potencial compromiso hemodinámico es importante el reconocimiento del cuadro y las posibles consecuencias durante el manejo perioperatorio.
La miocarditis es también frecuente, afectando a 5%-10% de los pacientes. De ellos, 80% tiene una fracción de eyección disminuida. Puede progresar a arritmias, miocardiopatía dilatada e insuficiencia cardiaca crónica, sobre todo en presencia de hipertensión, valvulopatías, enfermedad aterosclerótica, falla renal o tratamiento con ciclofosfamida e hidroxicloroquina[4].
Por otro lado, el LES es un factor de riesgo cardiovascular independiente, aumentando el riesgo de infarto agudo al miocardio y la mortalidad asociada en forma significativa, especialmente en mujeres[7]. Se ha descrito una incidencia de eventos cardiovasculares de 25,4% en 8 años de seguimiento, siendo los más frecuentes el infarto agudo al miocardio (IAM) y accidentes cerebrovasculares (ACV)[8]. La causa del desarrollo de enfermedad cardiovascular temprana se cree está relacionada con la fisiopatología inflamatoria y autoinmune, la cual es compartida con la enfermedad aterosclerótica que se vería acelerada en estos pacientes[4]. Por otro lado, los pacientes con lupus desarrollan un fenotipo dislipidémico clásico de enfermedad cardiovascular[4].
Las alteraciones valvulares también son frecuentes, particularmente la endocarditis de Libman-Sacks, encontrada en hasta 10% de los pacientes, sobre todo aquellos con largo tiempo de evolución de enfermedad, actividad alta y anticuerpos antifosfolípidos. La válvula mitral es la más frecuentemente afectada, seguida por la aórtica y genera clásicamente cuadros de insuficiencia valvular, aumentando el riesgo de eventos isquémicos cerebrales. La disfunción valvular clínica ocurre en 3%-4% de los pacientes, de ellos la mitad requiere cirugía[4].
Por último, se pueden ver alteraciones del ritmo cardiaco como taquicardia sinusal, fibrilación auricular y bloqueos auriculoventriculares. Contribuyen al desarrollo de éstas la enfermedad cardiovascular prematura y algunas drogas que prolongan el intervalo QT, por ejemplo, hidroxicloroquina[4].
3. Pulmonar
Presente hasta en 18% de los pacientes. El compromiso pleural es el más frecuente, manifestándose como derrame pleural. El compromiso parenquimatoso incluye la enfermedad intersticial difusa o hemorragia alveolar. Esta última ocurre en 1%-5% de los casos y tiene una mortalidad de hasta un 50%. Otra complicación documentada menos frecuente es la hipertensión pulmonar, con una prevalencia que varía entre 0,5%-14%[4],[9]. La presencia de disnea, alteración en pruebas de capacidad de difusión pulmonar y elevación de péptidos natriuréticos deben hacer sospechar esta patología[9].
4. Compromiso laríngeo
El compromiso laríngeo es una complicación poco frecuente, pero potencialmente mortal[10]. La incidencia varía entre los estudios, desde 0,3%-0,5% hasta 30%[4],[11]. Las manifestaciones son variadas desde úlceras o edema laríngeo leve (las más comunes) hasta necrosis, parálisis de cuerdas vocales, estenosis subglótica o edema laríngeo con obstrucción completa de la vía aérea superior[4],[10],[11],[12],[13]. En la mayoría de los casos se presenta con disnea, ronquera o estridor que resuelve con la administración de corticoides, a menos que exista compromiso infeccioso[6],[11],[13]. La fisiopatología no es bien comprendida. En los casos de compromiso de partes blandas se cree que existe depósito de inmunocomplejos y activación del complemento que desencadenan inflamación. Por otro lado, las parálisis de cuerdas vocales pueden ser secundarias a neuropatía del nervio laríngeo recurrente por vasculitis que afectan la vasa vasorum, neuritis o compresión por parte de la arteria pulmonar dilatada en pacientes con hipertensión pulmonar[6],[11],[12],[13]. También se ha reportado obstrucción de vía aérea superior secundaria a artropatía cricoaritenoidea[6],[11]. Hay cierta evidencia que el LES activo podría predisponer a estenosis subglótica posintubación, incluso después de periodos breves[4]. Por último, puede haber cuadros de angioedema, secundario a interacciones medicamentosas, déficit de esterasas o hipocomplementemia. Los antiinflamatorios no esteroidales (AINES) e inhibidores de enzima convertidora de angiotensina (iECA) son la causa más frecuente. En algunos casos se requiere asegurar la vía aérea, lo cual debe hacerse en etapas precoces ya que la progresión del edema puede dificultar la visualización de la laringoscopía haciendo imposible la intubación orotraqueal[11].
5. Renal
La nefritis lúpica se encuentra hasta en 60% de los pacientes luego de 3 años del diagnóstico y conlleva una alta morbimortalidad. Se manifiesta inicialmente con proteinuria y menos frecuentemente hematuria. Entre 5%-20% de los pacientes progresa a enfermedad renal crónica terminal con necesidad de diálisis. No se ha visto correlación entre los niveles de creatinina o proteinuria y el grado de compromiso histológico, por lo que, incluso en pacientes con función renal normal hay que tomar precauciones, evitando o minimizando el uso de fármacos nefrotóxicos o con eliminación renal[4].
6. Neurológico
Se ve en 37%-95% de los pacientes, pudiendo comprometer el sistema nervioso central, periférico o autonómico. Se manifiesta como cefalea, ansiedad, trastornos depresivos, mono o polineuropatías, psicosis, convulsiones o disautonomías. Además, asociado a la presencia de anticuerpos antifosfolípidos, existe una mayor incidencia de ACV[4].
7. Hematológico
Puede comprometer todas las series hematológicas. La mitad de los pacientes tiene anemia secundaria a enfermedades crónicas, hemólisis, deficiencia de hierro o toxicidad medular por fármacos. La mayoría son moderadas, pero hay un porcentaje que pueden ser severas requiriendo incluso transfusión[4]. La trombocitopenia puede ocurrir de forma aislada o en conjunto con otros déficits, con una prevalencia de 10%-26%[4],[14]. En general responde a inmunosupresión, pero 20% de los casos puede fallar requiriendo esplenectomía[4],[14].
8. Síndrome antifosfolípido
Se asocia frecuentemente a LES, manifestándose por episodios de trombosis o abortos recurrentes, con anticuerpos positivos presentes en 12%-34% de los pacientes con LES (vs 2% en población general)[4],[15].
Aunque es un síndrome protrombótico, prolonga el tiempo de tromboplastina parcial activada (TTPA)[4].
La trombosis venosa es lo más frecuente, pero también puede ocurrir en territorios arteriales, especialmente cerebral y coronario. La suspensión de terapia anticoagulante, infecciones o cirugías pueden gatillar una trombosis sistémica catastrófica, con una mortalidad de 50%[4],[15]. Luego de un episodio trombótico, la anticoagulación se mantiene en forma indefinida. En pacientes sin eventos trombóticos se recomienda profilaxis con aspirina (AAS) o heparina en caso de embarazo[4]. Es por esto que un porcentaje importante de los pacientes con LES sometidos a cirugías están anticoagulados o antiagregados, lo cual debe ser considerado al definir el manejo perioperatorio.
9. Infecciones
Por efecto de la misma enfermedad o del tratamiento inmunosupresor existe mayor riesgo de infecciones principalmente bacterianas. Dentro de las infecciones virales las más frecuentes son parvovirus B19 y citomegalovirus. Se asocian a mayor estadía hospitalaria y mayor mortalidad[4].
-
Farmacoterapia, efectos adversos e interacciones farmacológicas[4]
El tratamiento consiste en el manejo sintomático con AINES, hidroxicloroquina o AAS combinado con agentes inmunosupresores para alcanzar la remisión de la enfermedad. Los más usados son corticoides, ciclofosfamida, azatioprina, metotrexato o micofenolato, muchos de ellos con un perfil de efectos adversos importantes con implicancias en el
manejo perioperatorio (Tabla 1)[4],[16].
|
Tabla 1. Efectos adversos de farmacoterapia en LES |
|
|
Fármaco |
Efectos adversos |
|
Ciclofosfamida |
Cardiotoxicidad (dosis altas): insuficiencia cardiaca aguda Mielosupresión Infecciones |
|
Hidroxicloroquina |
Cardiomiopatía, prolongación QT Broncoespasmo Miopatías Mielosupresión Alteración pruebas hepáticas |
|
Azatioprina |
Alteración pruebas hepáticas Leucopenia, trombocitopenia Infecciones |
|
Metotrexato |
Alteración de pruebas hepáticas, cirrosis Trombosis arterial y venosa Hipotensión Hemorragia digestiva Falla renal Mielosupresión Daño pulmonar |
|
Micofenolato |
Taquicardia, hipertensión, hipotensión Hiperglicemia, hipo/hiperkalemia, acidosis, hipocalcemia Mielosupresión Hemorragia digestiva Alteración de pruebas hepáticas |
|
Corticoides |
Hipertensión arterial Hiperglicemia Osteoporosis Infecciones *Suspensión aguda: insuficiencia suprarrenal aguda |
|
AINES |
Hemorragia digestiva, úlceras gastroduodenales Falla renal Alteración de pruebas hepáticas Edema Hipertensión, síncope, taquicardia |
|
AAS |
Arritmias, hipotensión Hemorragias, úlceras gastroduodenales Anemia, trombocitopenia Broncoespasmo, edema laríngeo |
|
*Autoría propia, fuentes de información Ben-Menachem, 2010 y accessmedicine drugs; AINES: antiinflamatorios no esteroidales; AAS: aspirina. |
|
Con respecto a interacciones farmacológicas, azatioprina puede interactuar con los relajantes musculares disminuyendo su efecto, por interacción con fosfodiesterasas y aumento de la liberación de acetilcolina presináptica. Se ha visto, en contexto de trasplante renal, necesidad de incrementar las dosis de inducción de relajantes musculares con el uso concomitante de azatioprina endovenosa y una disminución en el efecto durante el período de mantención, sin relevancia clínica demostrada[4],[10]. Sin embargo, esto no ha sido estudiado en pacientes con LES usuarios crónicos de azatioprina vía oral.
La ciclofosfamida puede actuar como inhibidor de colinesterasas implicando un riesgo de efecto prolongado posterior al uso de succinilcolina[4].
La administración conjunta de metotrexato y AINES puede precipitar una falla renal aguda y pancitopenia, además si se administra con óxido nitroso puede precipitar los efectos adversos de metotrexato[4].
Recientemente, se ha reportado un caso de exacerbación de LES gatillada por propofol. Se ha visto que éste puede aumentar la actividad de linfocitos T helper y la diferenciación de linfocitos B, aumentando la producción de anticuerpos, especialmente en pacientes con anticuerpos anti-DNA y antinucleares positivos, aunque faltan estudios para demostrar la significancia clínica de esto[17].
-
Consideraciones anestésicas
Podemos ver que el LES es una enfermedad compleja en la cual los pacientes, debido a una mayor sobrevida que permite el desarrollo de las complicaciones a largo plazo, se enfrentan cada vez más a escenarios quirúrgicos. En este contexto múltiples estudios han demostrado un riesgo aumentado, asociándose a mayor mortalidad intrahospitalaria[18],[19],[20] y complicaciones posoperatorias como infecciones, sepsis, falla renal aguda, enfermedad tromboembólica, eventos cardiovasculares, caídas o necesidad de transfusión, especialmente en pacientes inmunosuprimidos, anémicos, usuarios crónicos de corticoides o AAS, con compromiso renal o antecedente de hospitalización reciente por crisis lúpica[5],[18],[19],[20],[21],[22]. En pacientes sometidos a cirugía cardíaca la presencia de infecciones posoperatorias se asoció a mayor estadía hospitalaria, mayor estadía en UCI, mayor duración de ventilación mecánica e hipertensión pulmonar sistólica[23].
Dado la epidemiología de la enfermedad es frecuente enfrentarse a mujeres embarazadas con LES. Se ha demostrado que la mortalidad materna puede ser hasta 20 veces mayor con respecto a mujeres sanas. El riesgo de trombosis, infección, trombocitopenia y necesidad de transfusión aumentan entre 3-7 veces[24],[25]. La mortalidad materna ocurre principalmente secundarias a sepsis y falla renal[26],[27].
Aunque no ha sido demostrado que el nivel de actividad de la enfermedad se asocie a mayor mortalidad suena razonable posponer las cirugías no urgentes en caso de crisis activa[4].
En la evaluación preoperatoria se debe establecer el compromiso sistémico del LES, buscando principalmente síntomas y signos sugerentes de compromiso cardiaco, pulmonar y renal. En caso de soplos se debe solicitar un ecocardiograma, idealmente transesofágico, en busca de valvulopatías o endocarditis. Se debe solicitar un electrocardiograma en todos los pacientes, dado la asociación con enfermedad cardiovascular y evaluar la presencia de anticuerpos antifosfolípidos dado el mayor riesgo de trombosis.
Cuando se sospeche compromiso laríngeo una evaluación otorrinolaringológica es adecuada, la cual puede complementarse con el uso de electromiografía de los músculos tiroaritenoideo y cricotiroideo[12]. El tratamiento consiste en la administración de corticoides en dosis altas con lo cual la mayoría responde, sin embargo, existe el riesgo de falla con necesidad de intubación de urgencia[13].
Con respecto al compromiso hematológico se debe solicitar un hemograma para pesquisar anemia que requiera transfusión o trombocitopenia. El conteo de plaquetas aumenta con la terapia inmunosupresora, existiendo reportes de manejo exitoso con el uso perioperatorio de inmunoglobulinas[4],[14].
Considerar también la necesidad de reemplazo esteroidal, que cubra los requerimientos generados por el estrés quirúrgico[4]. El corte es variable y dependiente de protocolos locales, pero en general en usuarios de más de 10 mg diarios de prednisona en forma crónica debiera suplementarse. La droga más usada es la hidrocortisona en dosis de 50-100 mg, dependiendo del estrés generado por la intervención. En el período posoperatorio hay que estar atentos a síntomas y signos de insuficiencia suprarrenal, la cual es una urgencia por lo que se debe tener un alto índice de sospecha en pacientes de riesgo[28].
Con respecto al manejo de pacientes anticoagulados, dado el alto riesgo trombótico se recomienda suspender los anticoagulantes por el menor tiempo posible. Esto se logra traslapando con heparinas de bajo peso molecular en el caso de cirugías con riesgo intermedio-alto de sangrado y manteniendo la anticoagulación en cirugías o procedimientos de bajo riesgo como cirugía oftálmica, dental, endoscopías, etc.[29].
La técnica anestésica debe considerar las interacciones farmacológicas entre los agentes anestésicos y los medicamentos de uso habitual. Considerar la posibilidad de una vía aérea difícil por el compromiso laríngeo y contar con los elementos necesarios para su manejo. Las técnicas neuroaxiales tienen beneficios con respecto a las complicaciones de vía aérea y manejo del dolor, sin embargo, no están exentas de riesgo y están contraindicadas en pacientes anticoagulados. La incidencia de infecciones varía entre 1:500 a 1:10.000 procedimientos dependiendo del tipo de infección, que pueden ser tan graves como una meningitis. Se ha visto que los pacientes inmunosuprimidos, diabéticos, alcohólicos, usuarios crónicos de corticoides, entre otros, tienen un riesgo aumentado de infecciones[30]. Esto se hace relevante en los pacientes con LES, ya que la mayoría de ellos está cursando algún tratamiento inmunosupresor o son usuarios crónicos de corticoides, sin embargo, no hay evidencia que contraindique este tipo de procedimientos en pacientes inmunosuprimidos si se hace con una técnica aséptica adecuada y en caso de dejar un catéter que sea por el menor tiempo posible[30]. Los pacientes inmunosuprimidos, además, tienen peor cicatrización y mayor riesgo de infección de herida operatoria, por lo que se debe administrar una profilaxis antibiótica adecuada[4],[30].
El cuidado en la posición del paciente es importante para prevenir fracturas en hueso osteoporótico y neuropatías por compresión de nervio periférico[4].
Se deben evitar nefrotóxicos, incluso con función renal normal, dado que la falla renal aguda es una de las complicaciones más frecuentes, incluso en pacientes sin antecedentes de compromiso renal[4],[18].
La frecuencia de eventos adversos cardiovasculares mayores (IAM, ACV o muerte) ha demostrado ser significativamente mayor en los pacientes con LES. Además, se asoció a mayor mortalidad e incidencia de infartos en pacientes más jóvenes que lo habitual[31]. Por esto la monitorización intraoperatoria debería contar con un ECG de 5 derivaciones para pesquisar isquemia y considerar la instalación de una línea arterial en cirugías de riesgo moderado-alto[4].
El manejo posoperatorio inmediato debe estar enfocado en la pesquisa de las complicaciones más frecuentes ya mencionadas. Con respecto al manejo del dolor no se encontraron trabajos en pacientes con LES, sin embargo, se debe considerar la importancia de su evaluación y manejo, ya que muchos pacientes experimentan dolor como parte de la enfermedad, por lo que frecuentemente son usuarios crónicos de analgésicos[1],[4]. Se debe indagar en estos tratamientos, continuándolos mientras no haya contraindicación y tener presente que puede haber fenómenos de sensibilización central que disminuyan el umbral del dolor, dificultando el manejo.
Algunas situaciones particulares de mayor riesgo son pacientes sometidos a cirugía cardiaca. Los procedimientos más frecuentes son el reemplazo valvular, la ventana pericárdica y la cirugía de revascularización coronaria, requiriendo frecuentemente el uso de circulación extracorpórea[15],[23]. Particularmente en los pacientes con anticuerpos antifosfolípidos el manejo es complejo, dado que el cuadro se asocia tanto a un mayor riesgo trombótico como a defectos en la formación de defectos en la formación de coágulos. El período libre de anticoagulación debe ser el mínimo. Las heparinas de bajo peso molecular son la elección en el período intraoperatorio, sin embargo, los anticuerpos antifosfolípidos pueden afectar la detección del tiempo de formación del coágulo y generalmente se usan cortes más altos. El uso de tromboelastograma, aunque no está validado, es útil para la toma de decisiones. Las drogas antifibrinolíticas no se recomiendan dado la alta mortalidad de los eventos trombóticos posoperatorios, aunque hay algunos reportes de que podrían ser seguros. La anticoagulación debería ser retomada con heparina o warfarina lo antes posible con un objetivo de INR 2-3[15].
En los pacientes con pericarditis que necesiten intervención quirúrgica se debe constatar la severidad de los síntomas y el compromiso hemodinámico. Con respecto a la elección de la técnica anestésica, para pacientes que irán a drenaje percutáneo puede bastar con el uso de anestesia local y sedación suplementaria. Si el paciente requiere intubación hay que tener precaución en mantener el retorno venoso. Se recomienda la monitorización continua de la presión arterial. Previo a la inducción se debe contar con una cantidad adecuada de fluidos de resucitación, drogas vasoactivas e inótropos. La presión positiva debe ser la mínima, ya que su efecto en la precarga, sumado al efecto depresor de los anestésicos puede generar un deterioro hemodinámico significativo. La elección de tubo endotraqueal depende de la técnica quirúrgica requiriendo en algunas ocasiones la exclusión de un pulmón[6].
El manejo obstétrico debe ser multidisciplinario, teniendo en cuenta el compromiso de órganos asociados y las alteraciones hematológicas, con especial cuidado en las pacientes con SAAF usuarias de anticoagulación, en quienes la anestesia neuroaxial está contraindicada. Con respecto a usuarias de AAS, si bien se ha descrito sangrado posterior a procedimientos neuroaxiales, no hay una contraindicación absoluta por lo que debe evaluarse riesgo-beneficio en cada caso[32].
-
Discusión
El LES es una enfermedad autoinmune sistémica muy compleja, que presenta grandes desafíos en el contexto quirúrgico. En el ámbito anestésico siempre deben considerarse de mayor riesgo. Dada la heterogeneidad de sus manifestaciones es difícil establecer protocolos únicos de manejo, por lo cual el plan anestésico debe ser adecuado caso a caso. Los anestesistas deben conocer la fisiopatología y potencial daño orgánico, de manera de buscar en forma dirigida estas complicaciones, las cuales pueden ser asintomáticas. Éstas frecuentemente afectan el manejo de vía aérea, terapia ventilatoria, manejo hemodinámico y mantención de la función renal. Es por ello que el manejo multidisciplinario y una buena evaluación preoperatoria son fundamentales, de manera de estratificar el riesgo quirúrgico y prepararse de forma oportuna para evitar o tratar de manera precoz complicaciones mayores como sangrado, eventos trombóticos, cardiovasculares u otros. En situaciones especiales de mayor riesgo como es el caso de cirugía cardiaca u obstétrica, la presencia de anestesiólogos especialistas debiera ser de regla siempre que exista el recurso. Dado la alta incidencia de compromiso renal, la protección de la función renal debe ser prioritaria durante toda la hospitalización, evitando nefrotóxicos y manteniendo una perfusión renal adecuada. Considerando esto y el frecuente compromiso hepático, asociado a los múltiples tratamientos farmacológicos es importante conocer los principales efectos adversos de los fármacos de uso habitual y posibles interacciones con las drogas anestésicas. La búsqueda de complicaciones posoperatorias debe estar siempre presente en quienes estén a cargo de unidades de recuperación, teniendo un alto índice de sospecha dado el conocido aumento del riesgo de éstas en los pacientes con LES.
Finalmente, este tema sigue siendo poco estudiado en la actualidad por lo que hay un desafío importante de desarrollar estudios de calidad que permitan comprender mejor las implicancias anestésicas del LES y crear protocolos que faciliten el manejo de estos pacientes, de manera de entregar una anestesia segura y disminuir la tasa de complicaciones y mortalidad asociada.
1. Fava A, Petri M. Systemic lupus erythematosus: diagnosis and clinical management. J Autoimmun. 2019 Jan;96:1–13. https://doi.org/10.1016/j.jaut.2018.11.001 PMID:30448290 2. Minsal. Guía clínica LES 2013, Ministerio de Salud. Gobierno de Chile. [Consultado el 11 julio 2020]. Disponible en: http://www.bibliotecaminsal.cl/wp/wp-content/uploads/2016/04/Lupus.pdf 3. Justiz Vaillant AA, Goyal A, Bansal P, Varacallo M. Systemic Lupus Erythematosus (SLE). StatPearls. Treasure Island (FL): StatPearls Publishing Copyright. StatPearls Publishing. 2020;LLC:2020. 4. Ben-Menachem E. Review article: systemic lupus erythematosus: a review for anesthesiologists. Anesth Analg. 2010 Sep;111(3):665–76. https://doi.org/10.1213/ANE.0b013e3181e8138e PMID:20601448 5. Kasturi S, Goodman S. Current Perspectives on Arthroplasty in Systemic Lupus Erythematosus: Rates, Outcomes, and Adverse Events. Curr Rheumatol Rep. 2016 Sep;18(9):59. https://doi.org/10.1007/s11926-016-0608-6 PMID:27443850 6. Grocott HP, Gulati H, Srinathan S, Mackensen GB. Anesthesia and the patient with pericardial disease. Can J Anaesth. 2011 Oct;58(10):952–66. https://doi.org/10.1007/s12630-011-9557-8 PMID:21789738 7. Lin CY, Shih CC, Yeh CC, Chou WH, Chen TL, Liao CC. Increased risk of acute myocardial infarction and mortality in patients with systemic lupus erythematosus: two nationwide retrospective cohort studies. Int J Cardiol. 2014 Oct;176(3):847–51. https://doi.org/10.1016/j.ijcard.2014.08.006 PMID:25156834 8. Ballocca F, D’Ascenzo F, Moretti C, Omedè P, Cerrato E, Barbero U, et al. Predictors of cardiovascular events in patients with systemic lupus erythematosus (SLE): a systematic review and meta-analysis. Eur J Prev Cardiol. 2015 Nov;22(11):1435–41. https://doi.org/10.1177/2047487314546826 PMID:25139772 9. Pérez-Peñate GM, Rúa-Figueroa I, Juliá-Serdá G, León-Marrero F, García-Quintana A, Ortega-Trujillo JR, et al. Pulmonary Arterial Hypertension in Systemic Lupus Erythematosus: prevalence and Predictors. J Rheumatol. 2016 Feb;43(2):323–9. https://doi.org/10.3899/jrheum.150451 PMID:26669915 10. Jayachandran NV, Agrawal S, Rajasekhar L, Narsimulu G. Bilateral vocal cord palsy as a manifestation of systemic lupus erythematosus. Lupus. 19. England2010. p. 109-10. 11. Bandi V, Munnur U, Braman SS. Airway problems in patients with rheumatologic disorders. Crit Care Clin. 2002 Oct;18(4):749–65. https://doi.org/10.1016/S0749-0704(02)00030-1 PMID:12418439 12. Lee JH, Sung IY, Park JH, Roh JL. Recurrent laryngeal neuropathy in a systemic lupus erythematosus (SLE) patient. Am J Phys Med Rehabil. 2008 Jan;87(1):68–70. https://doi.org/10.1097/PHM.0b013e31815b669e PMID:17993990 13. Teitel AD, MacKenzie CR, Stern R, Paget SA. Laryngeal involvement in systemic lupus erythematosus. Semin Arthritis Rheum. 1992 Dec;22(3):203–14. https://doi.org/10.1016/0049-0172(92)90020-E PMID:1295093 14. Hogan WJ, McBane RD, Santrach PJ, Plumhoff EA, Oliver WC Jr, Schaff HV, et al. Antiphospholipid syndrome and perioperative hemostatic management of cardiac valvular surgery. Mayo Clin Proc. 2000 Sep;75(9):971–6. https://doi.org/10.4065/75.9.971 PMID:10994834 15. Sharma VK, Chaturvedi R, Manoj Luthra V. Antiphospholipid syndrome, cardiac surgery and cardiopulmonary bypass. Ann Card Anaesth. 2011 May-Aug;14(2):146–9. https://doi.org/10.4103/0971-9784.81571 PMID:21636937 16. Accessmedicine [Internet]. McGraw-Hill Education. Accessmedicine drugs. [Consultado el 31 julio 2020]. Disponible en: https://accessmedicine-mhmedical-com.pucdechile.idm.oclc.org/drugs.aspx?GbosID=422633#letter=A&groupId=320&resourceIndexType=0&tab=tab0 17. Yu Y, Gui H, Xiong K, Fang X, He J. Progression of systemic lupus erythematosus associated with propofol administration: a case report. Eur J Hosp Pharm Sci Pract. 2018 Jul;25(4):225–7. https://doi.org/10.1136/ejhpharm-2017-001255 PMID:31157026 18. Babazade R, Yilmaz HO, Leung SM, Zimmerman NM, Turan A. Systemic Lupus Erythematosus Is Associated With Increased Adverse Postoperative Renal Outcomes and Mortality: A Historical Cohort Study Using Administrative Health Data. Anesth Analg. 2017 Apr;124(4):1118–26. https://doi.org/10.1213/ANE.0000000000001911 PMID:28319545 19. Quintanilla-González L, Torres-Villalobos G, Hinojosa-Azaola A. Risk factors for development of early infectious and noninfectious complications in systemic lupus erythematosus patients undergoing major surgery. Lupus. 2018 Oct;27(12):1960–72. https://doi.org/10.1177/0961203318799188 PMID:30185095 20. Lin JA, Liao CC, Lee YJ, Wu CH, Huang WQ, Chen TL. Adverse outcomes after major surgery in patients with systemic lupus erythematosus: a nationwide population-based study. Ann Rheum Dis. 2014 Sep;73(9):1646–51. https://doi.org/10.1136/annrheumdis-2012-202758 PMID:23740232 21. Fein AW, Figgie CA, Dodds TR, Wright-Chisem J, Parks ML, Mandl LA, et al. Systemic Lupus Erythematosus Does Not Increase Risk of Adverse Events in the First 6 Months After Total Knee Arthroplasty. J Clin Rheumatol. 2016 Oct;22(7):355–9. https://doi.org/10.1097/RHU.0000000000000435 PMID:27660932 22. Yazdanyar A, Wasko MC, Scalzi LV, Kraemer KL, Ward MM. Short-term perioperative all-cause mortality and cardiovascular events in women with systemic lupus erythematosus. Arthritis Care Res (Hoboken). 2013 Jun;65(6):986–91. https://doi.org/10.1002/acr.21915 PMID:23213026 23. Tejeda-Maldonado J, Quintanilla-González L, Galindo-Uribe J, Hinojosa-Azaola A. Cardiac surgery in systemic lupus erythematosus patients: clinical characteristics and outcomes. Reumatol Clin (Engl Ed). 2018 Sep – Oct;14(5):269–77. https://doi.org/10.1016/j.reumae.2017.01.016 PMID:28291723 24. Wang HC, Tsai PS, Li KY, Fan YC, Huang CJ. Perioperative risk factors for postpartum pulmonary embolism in Taiwanese Cesarean section women. Asian J Anesthesiol. 2017 Jun;55(2):35–40. https://doi.org/10.1016/j.aja.2017.05.002 PMID:28971803 25. Clowse ME, Jamison M, Myers E, James AH. A national study of the complications of lupus in pregnancy. Am J Obstet Gynecol. 2008 Aug;199(2):127.e1–6. https://doi.org/10.1016/j.ajog.2008.03.012 PMID:18456233 26. Moroni G, Ponticelli C. Pregnancy in women with systemic lupus erythematosus (SLE). Eur J Intern Med. 2016 Jul;32:7–12. https://doi.org/10.1016/j.ejim.2016.04.005 PMID:27142327 27. Bauer ME, Bateman BT, Bauer ST, Shanks AM, Mhyre JM. Maternal sepsis mortality and morbidity during hospitalization for delivery: temporal trends and independent associations for severe sepsis. Anesth Analg. 2013 Oct;117(4):944–50. https://doi.org/10.1213/ANE.0b013e3182a009c3 PMID:24023020 28. Neil JA. Perioperative care of the immunocompromised patient. AORN J. 2007 Mar;85(3):544–60. https://doi.org/10.1016/S0001-2092(07)60126-4 PMID:17352893 29. Jafri SM. Periprocedural thromboprophylaxis in patients receiving chronic anticoagulation therapy. Am Heart J. 2004 Jan;147(1):3–15. https://doi.org/10.1016/j.ahj.2003.06.001 PMID:14691412 30. Gronwald C, Vowinkel T, Hahnenkamp K. Regional anesthetic procedures in immunosuppressed patients: risk of infection. Curr Opin Anaesthesiol. 2011 Dec;24(6):698–704. https://doi.org/10.1097/ACO.0b013e32834cd2f0 PMID:21986352 31. Smilowitz NR, Katz G, Buyon JP, Clancy RM, Berger JS. Systemic lupus erythematosus and the risk of perioperative major adverse cardiovascular events. J Thromb Thrombolysis. 2018 Jan;45(1):13–7. https://doi.org/10.1007/s11239-017-1591-0 PMID:29230625 32. Davies SR. Systemic lupus erythematosus and the obstetrical patient—implications for the anaesthetist. Can J Anaesth. 1991 Sep;38(6):790–5. https://doi.org/10.1007/BF03008462 PMID:1914067 Referencias

 ORCID
ORCID



 Creative Commons Attribution
Creative Commons Attribution