Ángela Ruiz García 1 ,, Clara Serrano Ferrer 1 , Rocío Molina Montero 1 , Laura María Alcázar Sánchez-Elvira 1
Recibido: 16-06-2020
Aceptado: 10-07-2020
©2021 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 50 Núm. en avance pp. -|https://doi.org/10.25237/revchilanestv50-04-14
PDF|ePub|RIS
Malignant hyperthermia during laparoscopic apendicectomy: Case report
Abstract
Malignant hyperthermia is a hypermetabolic syndrome in which the intracellular calcium receptors are altered. In general patients who present compatible symptoms with this syndrome are genetically predisposed. Many of the cases have been described in the surgical area, due to the use of anesthesic drugs and neuromuscular blockers. However there are some cases with an unknown trigger. The prevalence of the syndrome is very difficult to estimate. The diagnosis and early treatment are pronostic factors predicting the evolution of the syndrome.
Resumen
La hipertermia maligna es conocida como un síndrome de estimulación masiva del metabolismo debido a la alteración en la liberación de calcio intracelular. Muchos pacientes que presentan clínica compatible con este síndrome están genéticamente predispuestos. La mayoría de los casos se describen en el ámbito quirúrgico, con el empleo de fármacos anestésicos y determinados relajantes neuromusculares, aunque también existen casos en los que no se halla desencadenante. De prevalencia difícil de estimar, la sospecha diagnóstica y el tratamiento precoz marcan el pronóstico evolutivo de estos pacientes.
-
Caso clínico
Se describe el caso de una mujer de 54 años, natural de Colombia, con antecedentes médicos personales de espondiloartrosis y enfermedad de Suddeck. No presenta factores de riesgo cardiovascular ni hábitos tóxicos. No alergias medicamentosas.
Intervenida quirúrgicamente de síndrome de túnel del carpo bilateral y una cesárea realizada en su país.
En tratamiento con sertralina, arcoxia, tramadol/paracetamol, gabapentina, trazodona y omeprazol.
La paciente acude al Servicio de Urgencias por un cuadro de dolor abdominal en fosa ilíaca derecha de 12 h de evolución, de intensidad moderada, fiebre de hasta 38º C junto con náuseas y vómitos, sin deposiciones diarreicas.
No refiere cuadro compatible con infección de origen respiratorio, sin clínica relacionada con infección por COVID 19 y sin contactos epidemiológicos de riesgo.
A la exploración, la paciente presenta buen estado general, normocoloreada y bien perfundida. Saturación basal 96%, tensión arterial 124/72 mmHg; frecuencia cardíaca 100 lpm, temperatura axilar 36º C. Abdomen, blando aunque doloroso a la palpación en fosa ilíaca derecha, Murphy negativo, Blumberg dudoso, sin palpación de masas ni megalias.
En pruebas analíticas, leucocitosis de 14.500/ucl sin neutrofilia, con cifras de hemoglobina y plaquetas sin alteraciones. Parámetros de coagulación normales. PCR en ascenso de 55. 5 mg/l, sin alteración de la función renal o del ionograma. PCR de exudado nasofaríngeo y serologías de COVID 19 negativas.
Ante estos hallazgos, es valorada por Sº Cirugía General, que recomiendan realizar ecografía abdominal. En ella, identifica en fosa ilíaca derecha una estructura tubular, aperistáltica, compatible con el apéndice cecal con un calibre máximo de 12 mm; trabeculación de la grasa locorregional, y mínima lengüeta de líquido libre perilesional. Blumberg ecográfico positivo. Hallazgos compatibles con apendicitis aguda, decidiéndose intervención quirúrgica.
Se explican los riesgos de la intervención a la paciente, quien comprende y firma consentimiento informado.
Se procede a inducción anestésica con 200 mg de propofol, 20 mcg de fentanilo y 60 mg de rocuronio, realizando intubación orotraqueal sin incidencias.
Inicio de anestesia de mantenimiento con desflorano como gas halogenado, objetivando discreto aumento de la frecuencia cardíaca. En los siguientes minutos presenta elevación progresiva de EtCO2 hasta 60, mantenida a pesar de ventilación con volúmenes minuto elevados. Taquicardia sinusal en torno a 140 lpm, con tendencia a la hipertensión. Temperatura axilar 37,8º C. No rigidez mandibular ni a ningún otro nivel.
Se solicita valoración por Servicio de Cardiología para descartar cardiopatía congénita/shunt derecha-izquierda ante la ausencia de elevación de temperatura corporal. En ecocardiografía portátil, se observa ventrículo izquierdo de grosor y funcionalidad normal, con FEVI 60%, sin alteraciones de la contractilidad. Ventrículo derecho normofuncionante y aurículas de tamaño normal. No se observan valvulopatías, sin dilatación de la raíz aórtica.
Ante la persistencia de taquicardia sinusal, se decide colocación de sonda esofágica, objetivando temperatura central de 40,3º C. En gasometría arterial, acidosis metabólica con un pH 7,24 y HCO3 18,3, con pCO2 43,9.
Ante los hallazgos clínicos y descartados otros posibles diagnósticos, se sospecha un síndrome de hipertermia maligna secundaria a anestesia con desflorano.
Se decide suspender intervención quirúrgica, retirar gas anestésico y rotar pauta anestésica, iniciando perfusión continua de propofol y remifentanilo. Se canaliza vía venosa central y arteria radial para monitorización invasiva. Se inician medidas físicas para enfriamiento.
Se inicia dantroleno intravenoso a dosis de 2,5 mg/Kg, de administración única, durante 15 minutos, observándose disminución de la frecuencia cardíaca progresiva y descenso de la temperatura central hasta 37,5º C.
Ingresa en la Unidad de Cuidados Intensivos, sedoanalgesiada con RASS -4,-5, adecuadamente adaptada al respirador, manteniendo volúmenes minuto elevados y FiO2 100%, para fomentar la hiperventilación.
Mejoría evolutiva con recuperación de frecuencia cardíaca, con ritmo sinusal a 85 latidos por minuto y tensión arterial sistólica en torno a 90 mmHg, por lo que se decide iniciar soporte vasoactivo con noradrenalina a dosis de 0,1 mcg/kg/min.
Dado el cuadro de apendicitis aguda no intervenida y consensuado con el equipo de cirugía se decide iniciar cobertura antibiótica con amoxicilina- clavulánico.
En la analítica de ingreso, no se observa leucocitosis ni neutrofilia, plaquetas en rango y hemoglobina de 10,6 g/dl. No se observan alteraciones de la coagulación.
Función renal conservada con hipopotasemia de 3,1 mmol/l. CK 30 U/l sin elevación de LDH. Reactantes de fase aguda en discreto aumento con PCT 1,42 ng/ml y PCR 72,3 mg/l. En gasometría, acidosis mixta con HCO3 18,7 y pCO2 30, con lactato elevado de 3,7 mmol/l. Se ajustan parámetros del respirador.
En el día +1 de ingreso, se realiza ventana de sedación para evaluar estado neurológico de la paciente, observándose adecuada respuesta a estímulos y órdenes, con movilización de las cuatro extremidades.
Elevación de cifras leucocitarias con neutrofilia, sin coagulopatía ni plaquetopenia. Llamativo aumento de PCT a 36,96 ng/ml y PCR 141,8 mg/l, manteniendo acidosis mixta con lactato en descenso de 2,5 mmol/l.
A la exploración, el abdomen blando, impresiona de doloroso a la palpación en fosa ilíaca derecha.
Se comenta caso de manera interdisciplinar con los Servicios de Anestesia y Cirugía General, decidiendo intervención quirúrgica mientras permanezca en condiciones de sedoanalgesia e intubación orotraqueal.
Comentado con familiares de la paciente, se explican las ventajas e inconvenientes, decidiendo finalmente autorizar intervención, firmando consentimiento informado.
Se realiza apendicectomía por laparoscopia sin complicaciones y regresa de nuevo a la UCI. Se rota antibioterapia a Piperacilina- tazobactam dado el aumento de reactantes de fase aguda (láctico 1 mmol/l y PCR de 188,4 mg/l) y el hallazgo intraoperatorio de líquido periapendicular turbio.
Muy buena evolución posterior, la paciente se mantiene afebril y hemodinámicamente estable, pudiendo ser extubada el día +2 de ingreso en UCI con retirada de soporte vasoactivo.
Disminución progresiva de leucocitos y reactantes de fase aguda, sin fallo de órganos acompañantes. Inicio de tolerancia oral sin complicaciones.
Ante la mejoría evolutiva, se decide alta a planta de Cirugía para continuar tratamiento.
El síndrome de hipertermia maligna se define como un estado hipermetabólico desencadenado en la mayoría de los casos tras una exposición farmacológica en pacientes que son genéticamente susceptibles. También se han descrito casos desarrollados de manera espontánea, sin exposición o causa conocida[1].
Algunos de esos fármacos incluidos son los relajantes neuromusculares despolarizantes como succinilcolina o los gases halogenados como el sevofluorano. Los antagonistas de los canales de calcio también han sido descritos como posibles desencadenantes de hipertermia maligna[2].
En los casos con mediación genética se han identificado numerosas mutaciones que afectan en su mayoría a genes del receptor del músculo esquelético. Estas alteraciones producen un acúmulo excesivo de calcio intracelular, alterando la contracción muscular.
Muchas de estas mutaciones son de herencia autosómica dominante, con penetrancia incompleta y expresividad variable. El resto, son mutaciones de novo.
Por ello, el modo de presentación y la clínica suelen ser muy heterogéneas, dificultando la estimación de la prevalencia en la población general, variable según las series[3].
El síndrome de hipertermia maligna presenta signos clínicos indeterminados como taquicardia, hipertensión arterial o diaforesis y otros carácter más específico como son la hipertermia, CO2 espirado final elevada y rigidez generalizada, sobre todo a nivel masetero.
Nuestra paciente presentaba antecedentes anestésico-quirúrgicos inmediatos y signos clínicos compatibles con el síndrome descrito, en ausencia de rigidez musculoesquelética, con EtCO2 persistentemente elevado a pesar de no observarse hipercapnia en gasometría de control.
La sospecha diagnóstica y el inicio soporte terapéutico de manera precoz, junto con la suspensión del agente causal y el inicio de Dantroleno son los pilares fundamentales en el tratamiento de hipertermia maligna. Así mismo, es importante establecer un diagnóstico diferencial de otras posibles causas de aumento de temperatura y taquicardia con EtCO2 elevado en ambiente intraoperatorio.
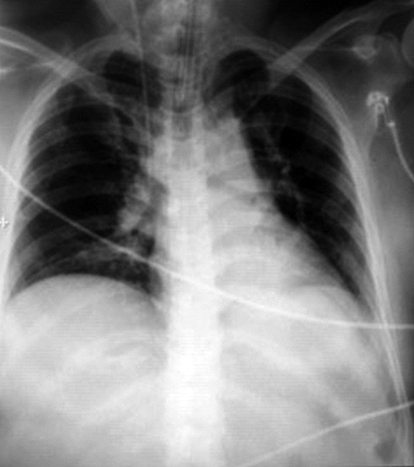
Figura 1. Radiografía de tórax al ingreso en UCI.
|
Tabla 1. Resumen epidemiológico y etiológico del síndrome de hipertermia maligna |
|
|
Prevalencia |
1:2.000-1:3.000 |
|
Predisposición genética |
Autosómica dominante De novo |
|
Mutación |
Genes de control de calcio del retículo sarcoplásmico ( RYR1, DHP, STA…) |
|
Causas |
Exposición farmacológica:
– Bloqueantes neuromusculares despolarizantes: succinilcolina – Anestésicos halogenados: Sevofluorano – Antagonistas del calcio No desencadenante Idiopático |
Referencias
1. Gupta PK, Hopkins PM. Diagnosis and management of malignant hyperthermia. BJA Educ. 2017;17(7):249–54. https://doi.org/10.1093/bjaed/mkw079.
2. Kollmann-Camaiora A, Alsina E, Domínguez A, Del Blanco B, Yepes MJ, Guerrero JL, et al. Protocolo clínico asistencial de manejo de la hipertermia maligna. Rev Esp Anestesiol Reanim. 2017 Jan;64(1):32–40. https://doi.org/10.1016/j.redar.2016.06.004 PMID:27633384
3. Marino PL. Trastornos de la temperatura corporal. El libro de la UCI. 4th. New York: Wolters Kluwer; 2015. pp. 761–75.

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution