Eder I. Zamarrón López MD. 1 , Alvaro E. Ramírez Gutiérrez MD. 2 , Orlando R. Pérez Nieto MD. 3 , Paola Villa Cortés MD. 4 , Manuel A. Guerrero Guitiérrez MD. 5 ,*, Silvia Uribe Moya MD. 6
Recibido: 02-06-2021
Aceptado: 10-07-2021
©2021 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 50 Núm. 6 pp. 799-805|https://doi.org/10.25237/revchilanestv5001101033
PDF|ePub|RIS
Contemporary approach of cardiogenic shock
Abstract
Background: Cardiogenic shock (CSh) is a state of low cardiac output that results in hypoperfusion and hypoxia in end organs. The most common cause is myocardial infarction (AMI) with left ventricular dysfunction. Before the routine use of early revascularization, CSh associated with AMI had an in-hospital mortality that exceeded 80%, however, since the start of therapy, this figure has decreased, however it remains a high percentage of mortality (27-51%). Objective: To review new concepts on cardiogenic shock, etiologies and current management to be reproduced in medical practice. Conclusión: The early recogni- tion of the different hemodynamic patterns that occur according to the etiology of the CSh, are highly related to the specific treatment of this, considering the different mechanisms of vasoactive drugs that would improve not only the prognosis of the patients, but also survival. Not without leaving behind invasive mechanical assist devices such as heart transplantation.
Resumen
Antecedentes: El choque cardiogénico (ChC) es un estado de bajo gasto cardiaco que da como resultado hipoperfusión e hipoxia en órganos diana. La causa más frecuente es el infarto del miocardio (IAM) con disfunción ventricular izquierda. Antes del uso rutinario de revascularización temprana, el ChC asociado a IAM, tenía una mortalidad intrahospitalaria que excedía el 80%, sin embargo, desde el inicio de la terapia de revascularización esta cifra ha disminuido, no obstante, sigue siendo un alto porcentaje de mortalidad (27%-51%). Objetivo: Revisar nuevos conceptos sobre choque cardiogénico, etiologías y manejos actuales para reproducir en la práctica médica. Conclusión: El reconocimiento temprano de los distintos patrones hemodinámicos que se presentan según la etiología del ChC, están sumamente relacionados con el tratamiento específico de éste, contemplando los diferentes mecanismos de los fármacos vasoactivos que mejoraría, no solo el pronóstico de los pacientes, sino también la sobrevida. No sin dejar atrás los dispositivos invasivos de asistencia mecánica como el trasplante cardiaco.
-
Introducción
El choque cardiogénico es una condición clínica de hipo- perfusión tisular debido a una disfunción cardíaca que desencadena inestabilidad hemodinámica, provocando alteraciones funcionales del miocardio, válvulas, sistema de conducción y/o pericardio[1],[2]. Se define de manera práctica como un gasto cardiaco inefectivo causado por un problema cardiaco primario. La definición operacional del ChC varía de acuerdo con los estudios en los que se han propuesto diferentes puntos de corte (Tabla 1).
-
Fisiopatología
En el ChC existe disminución de la contractilidad cardiaca dando como resultado una disminución del gasto cardiaco (GC), hipotensión arterial e isquemia miocárdica. De forma compensatoria existe vasoconstricción sistémica, dando como resultado daño cardiaco agudo y gasto sistólico inefectivo, generando vasoconstricción periférica puede mejorar la perfusión coronaria y periférica, incrementando la poscarga. La inflamación sistémica provocada por el daño cardiaco agudo puede inducir vasodilatación refleja, que es otra forma de presentación con resistencias vasculares periféricas (RVS) disminuidas (Figura 1). Participan la sintasa de óxido nítrico inducible y endotelial, las cuales juegan un papel fundamental en la producción de niveles altos de óxido nítrico, que en conjunto con el peroxinitrito tienen un efecto inotrópico negativo y cardiotóxico[8].
Debido a esto, el ChC se divide en estadios: Estadio A o en Riesgo: pacientes que no presentan signos o síntomas de choque cardiogénico, pero están en riesgos de desarrollarlo, como en pacientes con infarto agudo del miocardio o insuficiencia cardiaca. Estado B o pre-choque, con evidencia de hipotensión relativa o taquicardia sin hipoperfusión. Estado C o Choque cardiogénico clásico, que presenta hipoperfusión que requiere inotrópico, vasopresor o soporte mecánico a pesar de la reanimación hídrica. Estado D o deterioro, que no responde a las intervenciones iniciales. Estado E o extremo, con colapso circulatorio, paro cardiaco refractario con reanimación cardiopulmonar en curso o apoyado con múltiples intervenciones. La identificación del estadio del paciente es clave para brindar el mejor manejo[9].
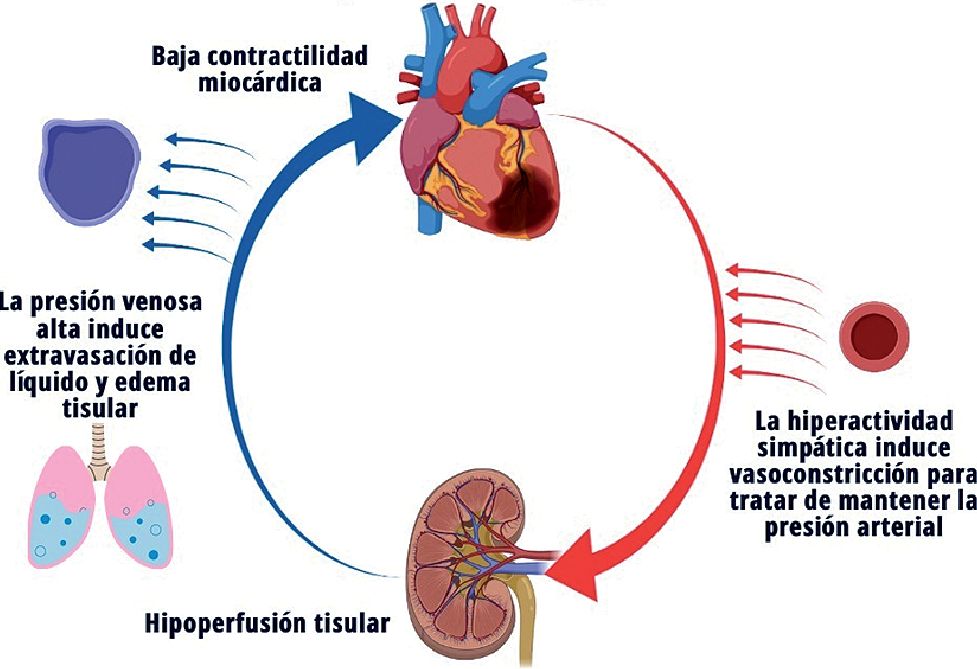
Figura 1. Fisiopatología del Choque Cardiogénico (Esquema por Karla Hernández Múñiz).
La característica fisiológica común en todos los fenotipos es el índice cardiaco (IC) bajo, pero la precarga ventricular (Presión Capilar Pulmonar (PCP) o Presión Venosa Central (PVC)), volumen y RVS pueden variar. A pesar de esto, debemos tomar en cuenta que el punto de corte del IC < 1,8 a 2,2 L/min/m2 para definir ChC, a veces es impráctico, dado que la hipoperfusión orgánica se puede observar con IC más altos. El fenotipo más frecuente se presenta como el paciente “frío y húmedo” y se caracteriza por un IC bajo, RVS elevadas y PCP alta[10].
En el fenotipo clínico “húmedo y caliente”, existe la asociación de la cascada de citocinas y la expresión de oxido nítrico sintasa inducible con la ruptura de la placa coronaria en el IAM, produciéndose una respuesta inflamatoria sistémica y vasodilatación posterior por disminución de las resistencias vasculares sistémicas, éste tiene alta mortalidad[11] (Tabla 2).
Tabla 1. Diferentes definiciones diagnósticas de choque cardiogénico
SHOCK3
TRIUMPH4
IABP-SHOCK II5
CULPRIT-SHOCK6
Criterios clínicos
TAS < 90 mmHg más de 30 minutos
Soporte para mantener TAS > 90 mmHg
Hipoperfusión (extremidades frías o gasto urinario < 30 mL/h)
Criterios hemodinámicos
IC < 2,2 L/min/m2 y
PCP >15 mmH2O
IAM confirmado
TAS < 100 mmHg a pesar de vasopresor (dopamina >7 mcg/kg/min o norepinefrina > 0,15 mcg/kg/min Hipoperfusión orgánica Criterios clínicos o hemodinámicos de D2VI elevada FEVI < 40%
TAS < 90 mmHg por > 30 minutos o TAS > 90 mmHg con catecolaminas Congestión pulmonar Alteración de perfusión (estado mental alterado, piel y extremidades frías, uresis < 30 ml/h, lactato > 2 mmol/L)
Enfermedad arterial coronaria multivaso > 70% de estenosis en al menos 2 vasos mayores (> 2 mm) TAS < 90 mmHg por > 30 minutos o TAS > 90 mmHg con catecolaminas Congestión pulmonar Hipoperfusión (estado mental alterado, piel y extremidades frías
Oligouria o uresis < 30 ml/h o lactato > 2 mmol/L)
Guías europeas de falla cardiaca7
TAS < 90 mmHg con
Hipoperfusión clínica (extremidades frías, oliguria, confusión mental, presión de pulso estrecha) O
Hipoperfusión por laboratorio (acidosis metabólica, lactato elevado, elevación de creatinina)
Abreviaturas: TAS: Tensión Arterial Sistólica; IC: Índice Cardiaco; PCP: Presión Capilar Pulmonar; IAM: Infarto Agudo del Miocardio; ACTP: angioplastia coronaria transluminal percutánea; D2VI: presión telediastólica del ventrículo izquierdo; FEVI: Fracción de eyección del ventrículo izquierdo.
Tabla 2. Fenotipos hemodinámicos del Choque cardiogénico[10]
| Estado de volumen | |||
| Húmedo | Seco | ||
| Frío | Choque cardiogénico clásico | Choque cardiogénico euvolémico | |
| Circulación periférica | (IC.; tRVS; tPCP) | (IC.; tRVS; ^PCP) | |
| Caliente | Choque cardiogénico vasodilatado | Choque vasodilatado | |
| o | (no cardiogénico) | ||
| Choque mixto
(IC.;. ^R.S- tPCP) |
(ICt;. RVS; .pcp ) | ||
Tabla 3. Etiologías de choque cardiogénico[3]
Infarto agudo del miocardio
Fallo de la bomba
• Infarto que generalmente afecta > 40% del ventrículo izquierdo
• Infarto más pequeño con disfunción ventricular izquierda preexistente o un infarto previo
• Reinfarto
Complicaciones mecánicas
• Insuficiencia mitral aguda causada por la rotura de un músculo papilar o cuerdas tendinosas o disfunción grave del músculo papilar
• Ruptura del tabique interventricular
• Ruptura de la pared libre del ventrículo izquierdo
• Taponamiento cardiaco por rotura de la pared libre del ventrículo izquierdo
Infarto de ventrículo derecho
Otras condiciones
Miocardiopatía en etapa terminal
Miocarditis
Choque séptico con depresión miocárdica grave
Obstrucción del tracto de salida del ventrículo izquierdo (Estenosis aórtica, Miocardiopatía hipertrófica obstructiva)
Obstrucción del llenado del ventrículo izquierdo (Estenosis mitral, Mixoma auricular izquierdo)
Toxicidad farmacológica (p. Ej., Betabloqueador, bloqueador de los canales de calcio o sobredosis de clonidina)
Arritmias (Taquiarritmias, Bradiarritmias)
Insuficiencia mitral aguda (ruptura de cuerdas)
Sx. Aorticos agudos
Contusión miocárdica
Bypass cardiopulmonar prolongado
Existen además ChC normotensivo y ChC ventricular derecho. En el ensayo shock[11] el 5,2% de pacientes con hipoperfusión periférica estaban normotensos (TAS > 90 mmHg), este grupo tenía IC, PCP y fracción de expulsión del ventrículo izquierdo (FEVI) parecidas, pero mayores resistencias vasculares sistémicas en comparación con pacientes con ChC hipotensos. La prevalencia reportada del ChC por VD es del 5,3%, en ChC por IAM; se caracteriza por PVC y FEVI relativamente elevadas, presión sistólica de la arteria pulmonar (PSAP) menor, sin diferencia en IC o PCP. Sólo el 71% de los pacientes con IAM del VD en el registro shock cumplieron los criterios clásicos hemo- dinámicos (PVC: PCP > 0,8), sin embargo, otros estudios han mostrado que los retos con líquido incrementan la prevalencia de la definición hemodinámica[11].
-
Etiología
El ChC relacionado con el síndrome coronario agudo (SICA) representa aproximadamente el 60 al 80% de los casos, mientras que el 40% restante abarca una amplia gama de etiologías variadas (Tabla 3). Aproximadamente, el 70% de los pacientes que desarrollan ChC por SICA presentan elevación del segmento ST, por lo que en el abordaje diagnóstico inicial debe contar con electrocardiograma en los primeros 10 minutos de ingreso. En pacientes que han presentado recientemente un infarto se debe tener en cuenta las complicaciones mecánicas para lo que se deberá realizar un ecocardiograma transtorácico[12]. La insuficiencia cardiaca crónica (ICC) descompensada es culpable del 30% de los casos del ChC[13].
-
Abordaje diagnóstico del choque cardiogénico
La elevación y disminución de troponinas en un contexto electrocardiográfico y clínico adecuado apoya el diagnóstico de la etiología. El péptido natriurético cerebral (BNP, siglas en ingles) además, de contextualizar la falla cardiaca, su nivel asocia mortalidad, un bajo BNP puede sugerir no ser ChC, sin embargo, un BNP elevado no confirma el diagnóstico[10].
La elevación de lactato arterial o venoso es un marcador temprano de disfunción mitocondrial e hipoperfusión tisular, su elevación se asocia con mortalidad. En la patogénesis de la producción de lactato contribuyen la alteración de la entrega de oxígeno, hiperlactatemia inducida por estrés y alteración de la depuración de lactato[14],[15].
El estado ácido-base puede destacar acidosis que disminuye la contractilidad miocárdica y la respuesta a vasopresores, siendo el bicarbonato un predictor de mortalidad a 30 días[10].
La radiografía de tórax, electrocardiograma de 12 derivaciones, ecocardiograma transtorácico son indispensables, éste último determina la función ventricular y valvular, identifica la falla predominante, es decir si existe mayor involucro de ventrículo derecho, izquierdo o biventricular; y guiar terapia inotrópica y vasopresora, así como apoyar en la toma de decisiones en relación a dispositivos de asistencia ventricular[3].
-
Manejo del choque cardiogénico
Un metaanálisis de 15 estudios de intervencionismo corona- río percutáneo (ICP) y 7 de cirugía de revascularización (CRVC), que reunieron más de 1 millón de pacientes de más de 2.000 hospitales, encontró menor mortalidad en centros con más de 600 casos de ICP y CRVC, a los que se denominan de alto volumen[16], la mortalidad se relaciona directamente con el volumen de atención de estos casos en los hospitales[17]. Siendo el IAM la causa más común del ChC, se considera como principal opción de tratamiento ICP temprana, en caso de no contar con esa opción se debe valorar realizar estrategia fármaco invasiva seguido del traslado seguro del paciente a un sitio con la capacidad de atención de acuerdo a las guías[11]. La mortalidad en pacientes en los que la ICP fue exitosa es del 35% comparado con 80% sin intervencionsimo coronario.
Monitorización en la unidad de cuidados intensivos o unidad coronaria
Se requiere ingresar a Unidad de Cuidados intensivos o unidad coronaria con uso de telemetría continua, un índice enfermera-paciente 1:1 y monitorización de la presión arterial con manguito braquial o línea arterial[11]. El uso de un catéter venoso central se requiere para el paso de medicamentos vasoactivos. Se debe monitorear balance hídrico y cuantificación estricta de gasto urinario[18].
La monitorización del gasto cardiaco con catéter pulmonar (Swan-Ganz) mide directamente las presiones de enclavamiento capilar pulmonar (PCP), gasto cardíaco, calcular índice cardiaco y RVS; no se recomienda de forma rutinaria, se debe considerar cuando no existe respuesta al tratamiento inicial, con la finalidad de asegurar las presiones de llenado y guiar cambios en el tratamiento, destete de aminasvasoactivas e inotrópicos o valorar la indicación de soporte mecánico[3],[11].
Se indica vasopresor de primera línea en pacientes con choque, incluido el ChC. La dopamina se asoció a mayor frecuencia de arritmias y mayor riesgo de mortalidad en el subgrupo de ChC, sin embargo, las recomendaciones son en realidad pragmáticas y no necesariamente basadas en evidencia[19]. Para la toma de decisión del vasopresor y/o el inotrópico, conviene tener en cuenta el fenotipo del ChC, el momento, así como la forma de actuar de cada uno de los fármacos, Jentzer y colaboradores proponen un cuadro que ilustra el efecto de los vasopresores y los inotrópicos de acuerdo a la combinación de acciones, es decir de acuerdo a si son puramente vasoconstrictores, inotrópicos con efecto vasoconstrictor o inotrópicos con efecto vasodilatador[20],[21] (Tabla 4).
Estudios comparativos de norepinefrina y epinefrina mostraron menor mortalidad con norepinefrina y menor incremento de lactato y frecuencia cardiaca. Por ello, la norepinefrina es el vasopresor de elección cuando hay hipotensión. No hay evidencia de un beneficio con uso de segundo vasopresor como vasopresina[19]. El uso de inotrópicos como dubutamina incrementa el GC mejorando el consumo de oxigeno, con el propósito de mejorar la contractilidad miocárdica puede suministrarse junto a norepinefrina[22],[23].
Hasta 88% de pacientes con ChC requieren ventilación mecánica invasiva. A pesar de que la ventilación mecánica no invasiva mejora la disnea y la hipoxemia, no disminuye la mortalidad. No existe suficiente evidencia para recomendar alguna modalidad específica. Dentro de las medidas a tomar en cuento es el PEEP en un nivel adecuado, además de mejorar la hipoxemia, contrabalancea las fuerzas hidrostáticas que llevan al edema pulmonar, moviendo el líquido desde el alveolo al especio intersticial y de ahí a la circulación; en pacientes con reducción de la función del VI, también reduce la poscarga al disminuir las presiones pulmonares transtorácicas, disminuye la precarga y optimiza la entrega de oxígeno. En pacientes con reducción de la función del VD, el PEEP reduce las resistencias vasculares pulmonares e incrementa el IC, por atenuación de la vasoconstricción pulmonar y reducción del edema pulmonar. Sin embargo, presiones altas comprometen la precarga del VD e incrementan la poscarga en parte por compresión de los vasos intraalveolares[24],[25].
| Tabla 4. Soporte hemodinámico acorde al fenotipo de Choque cardiogénico | ||
| SI «Efecto inotrópico directo « NO | ||
| Efecto vascular directo | (Subconjunto I) Inoconstrictores Norepinefrina Epinefrina Dopamina | (Subconjunto II)
Vasoconstrictores Fenilefrina Vasopresina En choque ventricular derecho Estenosis aórtica Obstrucción dinámica del TSVI |
| (Subconjunto III) Inodilatadores Dobutamina Milrinona Levosimendan | (Subconjunto IV) Vasodilatadores Nitroglicerina Nitroprusiato Nesiritide | |
Subconjunto I: choque frío y seco, frío y húmedo, caliente y húmedo y normotensivo; Subconjunto II: choque ventricular derecho, estenosis aórtica, obstrucción dinámica del tracto de salida del ventrículo izquierdo; Subconjunto III: choque normotensivo, insuficiencia aórtica y/o mitral.
Tabla 5
| SAVE score[29] | ENCOURAGE score[30] | CARD-SHOCK risk score[31] | IABP-SHOCK II score[27] |
| Etiología por SICA | Edad > 60 años | Edad > 75 años | Edad >73 años |
| Edad > 63 años | Sexo femenino | IAM previo o cirugía de revascularización | Nivel de glucosa plasmática |
| Peso | IMC > 25 kg/m2 | Etiología SICA | Creatinina |
| Falla orgánica (renal, hepática) HCO3 < 15 mmol/L | ECG < 6, creat >150 mmol/L | FEVI < 40% | Choque cardiogénico previo |
| Ventilación mecánica invasiva pre ECMO
Presión pico < 20 cmH2O |
Lactato | Lactato | TIMI < 3 post-ICP |
| PAD pre ECMO > 40 mmHg Presión de pulso pre ECMO < 20 mmHg | Actividad de protrombina < 50% | TFG estimada | Nivel de lactato |
SICA: síndrome coronario agudo; PAD: presión arterial diastólica; HCO3: bicarbonato; IMC: índice de masa corporal; ECG: escala de coma de Glasgow; IAM: infarto agudo al miocardio; RC: revascularización coronaria; FEVI: fracción de eyección del ventrículo izquierdo; TFG: tasa de filtración glomerular, TIMI: trombólisis en infarto al miocardio; ICP: intervención coronaria percutánea.
Terapia de reemplazo renal contínua
La falla renal aguda en ChC se presenta hasta en el 28% de pacientes y más del 20% requieren terapia de reemplazo, cuando esto sucede la sobrevida disminuye, e incluso se considera un predictor independiente de mortalidad en ChC. El cambio repentino de volumen causa inestabilidad en estos pacientes por lo que no toleran adecuadamente la diálisis intermitente, así que se debe considerar la terapia de reemplazo continua cuando existe indicación.
Dispositivos de asistencia mecánica y trasplante cardiaco
Los dispositivos de asistencia mecánica se pueden utilizar como puente a la recuperación, cuando la función cardiovascular es recuperable. Se indica también como puente a puente, se coloca un dispositivo provisional con la finalidad de dejar uno durable después de la estabilización clínica. Por último, también puede ser usado como puente a decisión en los casos en que la necesidad del
Se sugiere el uso de dispositivos temporales como primera línea antes de considerar los durables, para estabilizar a los pacientes. Los dispositivos temporales son: balón intraaórtico de contra pulso (BIAC), estudiado en el IABP-SHOCK II, el cual incluyó pacientes con ChC asociado a IAM y no mostró diferencias en la mortalidad a los 30 días; se recomienda el BIAC en caso de complicaciones post IAM como insuficiencia mitral, comunicación interventricular o en el caso de que otros dispositivos no se encuentren disponibles[27]. Actualmente, se encuentran disponibles algunos dispositivos percutáneos como el TandemHeart y el Impella micro axial. Para el soporte de ventrículo derecho se puede utilizar por punción venosa el Impella RP. En cuanto al uso de la membrana de oxigenación extracorpórea (ECMO), también se puede considerar en el ChC. Tiene varias contraindicaciones como una expectativa de vida menor de 1 año, edad mayor de 75 años, enfermedad vascular periférica severa, enfermedad hepática avanzada, contraindicaciones para anticoagulación sistémica o daño neurológico. El ECMO se prefiere cuando existe pobre oxigenación que no mejora con otros dispositivos temporales o durante reanimación cardiopulmonar[28].
En cuanto a los dispositivos de asistencia ventricular durables se encuentran el HeartMate II, el cual usa una bomba de flujo axial, mientras que el HeartWare HVAD usa una bomba levitada hidrodinámicamente con flujo centrífugo. Otros en investigación son el HeartMate 3, el Jarvik 2000 y el ReliantHeartAssist 5. Estos dispositivos durables se recomiendan como puente a recuperación o como puente a puente, en quienes no tienen infección sistémica, no tienen disfunción orgánica[26].
En cuanto al trasplante cardiaco se sugiere que a los pacientes que se han considerado candidatos a dispositivos de asistencia ventricular, se les considere y evalúe concomitantemente para trasplante cardiaco[26].
Se han formulado puntuaciones pronósticas más completas para ayudar a la estratificación del riesgo de los pacientes con ChC con el fin de asignar mejor los recursos disponibles e identificar rápidamente a aquellos pacientes que se beneficiarían de estrategias terapéuticas más invasivas en términos de supervivencia y el momento óptimo para proceder con soporte mecánico circulatorio (Tabla 5).
Los pacientes pueden agruparse en 3 categorías de riesgo: riesgo bajo (puntuaciones 0-3), intermedio (puntuaciones 4-5) y alto (puntuaciones 6-9) con una tasa de mortalidad de 8,7, 36 y 77%, respectivamente. De acuerdo con esta estratificación de riesgo, se recomendaría un soporte mecánico circulatorio como ECMO en pacientes de alto riesgo (riesgo de mortalidad > 50%). La puntuación de riesgo IABP-SHOCK clasifica a los
pacientes en tres grupos de riesgo: bajo (puntuaciones 0-2), intermedio (puntuaciones 3-4) y de alto riesgo (puntuaciones 5-9), con una tasa de mortalidad a 30 días del 23,8%, 49,2% y 76,6%, respectivamente[27],[31]. De acuerdo con esta puntuación, los pacientes con ChC con una clase de alto riesgo podrían considerarse candidatos a ECMO. Ambas puntuaciones de riesgo se caracterizaron por un buen valor predictivo cuando se aplicaron a una gran cohorte de pacientes del mundo real, incluidos sujetos con SICA y sin SICA, aunque su rendimiento global fue superior en el grupo de SICA[24],[27].
-
Conclusión
El choque cardiogénico es una entidad de suma importancia de la salud pública, el infarto al miocardio con disfunción ventricular izquierda sigue siendo la causa más frecuente y elevada mortalidad. Es fundamental reconocer en los pacientes con choque cardiogénico los distintos fenotipos hemodinámicos que existen dentro de esta patología, además, conocer la etiología del mismo para dirigir el manejo temprano y definitivo que impactara en el pronóstico. Existen distintos metaanálisis donde difieren las clasificaciones del ChC, sin embargo, todas coinciden finalmente que el manejo es multidisciplinario.
Conflicto de interés: Sin conflicto de interés.
Referencias
1. Thiele H, Zeymer U, Neumann FJ, Ferenc M, Olbrich HG, Hausleiter J, et al. IABPSHOCK II Trial Investigators. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med. 2012; 367:1287-1296. https://doi.org/10.1056/NEJMoa1208410
2. Reynolds HR, Hochman JS. Cardiogenic shock: current concepts and improving outcomes. Circulation. 2008; 117:686-697. https://doi.org/10.1161/CIRCULATIONAHA.106.613596
3. Hochman JS, Sleeper LA, Webb JG, Sanborn TA, White HD, Talley JD, et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock: SHOCK Investigators: Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N Engl J Med. 1999; 341:625-634. https://doi.org/10.1056/NEJM199908263410901
4. Alexander JH, Reynolds HR, Stebbins AL, Dzavik V, Harrington RA, Van de Werf F. Effect of tilarginine acetate in patients with acute myocardial infarction and cardiogenic shock: the TRIUMPH randomized controlled trial. JAMA. 2007; 18;297(15):1657-66. https://doi.org/10.1001/jama.297.15.joc70035
5. Thiele H, Zeymer U, Neumann F-J, Ferenc M, Olbrich H-G, Hausleiter J, et al. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med. 2012; 367:1287-1296. https://doi.org/10.1056/NEJMoa1208410
6. Thiele H, Akin I, Sandri M, Fuernau G, de Waha S, Meyer-Saraei R, et al. CULPRIT-SHOCK Investigators.PCI Strategies in Patients with Acute MyocardialInfarction and Cardiogenic Shock. N Engl J Med. 2017; 21;377(25):2419-2432. https://doi.org/10.1056/NEJMoa1710261
7. Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS, et al. 2016 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure: the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016; 37:2129-2200. https://doi.org/10.1093/eurheartj/ehw128
8. Hollenberg SM, Kavinsky CJ, Parrillo JE. Cardiogenic shock. Ann Intern Med. 1999; 131:47-59. https://doi.org/10.7326/0003-4819-131-1-199907060-00010
9. Hochman JS. Cardiogenic shock complicating acute myocardial infarction: expanding the paradigm. Circulation. 2003; 107:2998 3002. https://doi.org/10.1161/01.CIR.0000075927.67673.F2
10. Baran D, Grines C, Bailey S, Burkhoff D, Hall S, Henry T, et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock: This document was endorsed by the American College of Cardiology (ACC), the American Heart Association (AHA), the Society of Critical Care Medicine (SCCM), and the Societ. Catheter Cardiovasc Interv ofiicial. J Soc Card Angiogr Interv. 2019;94(1):29-37. https://doi.org/10.1002/ccd.28329
11. Fincke R, Hochman JS, Lowe AM, Menon V, Slater JN, Webb JG, LeJemtel TH, Cotter G; SHOCK Investigators. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: a report from the SHOCK trial registry. J Am Coll Cardiol. 2004; 44:340-348. https://doi.org/10.1016/j.jacc.2004.03.060
12. Kohsaka S, Menon V, Lowe AM, Lange M, Dzavik V, Sleeper LA, Hochman JS; SHOCK Investigators. Systemic inflammatory response syndrome after acute myocardial infarction complicated by cardiogenic shock. Arch Intern Med. 2005; 165:1643-1650. https://doi.org/10.1001/archinte.165.14.1643
13. Menon V, Slater JN, White HD, Sleeper LA, Cocke T, Hochman JS. Acute myocardial infarction complicated by systemic hypoperfusion without hypotension: report of the SHOCK trial registry. Am J Med. 2000; 108:374-380. https://doi.org/10.1016/S0002-9343(00)00310-7
14. Jacobs AK, Leopold JA, Bates E, Mendes LA, Sleeper LA, White H, et al. Cardiogenic shock caused by right ventricular infarction: a report from the SHOCK registry. J Am Coll Cardiol. 2003; 41:1273-1279. https://doi.org/10.1016/S0735-1097(03)00120-7
15. Harjola VP, Lassus J, Sionis A, Kober L, Tarvasmaki T, Spinar J, et al; CardShock Study Investigators; GREAT Network. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. Eur J Heart Fail. 2015; 17:501-509. https://doi.org/10.1002/ejhf.260
16. Milo-Cotter O, Cotter-Davison B, Lombardi C, Sun H, Bettari L, Bugatti S, et al. Neurohormonal activation in acute heart failure: results from VERITAS. Cardiology. 2011; 119:96-105. https://doi.org/10.1159/000330409
17. Lazzeri C, Valente S, Chiostri M, Gensini GF. Clinical significance of lactate in acute cardiac patients. World J Cardiol. 2015; 7:483-489. https://doi.org/10.4330/wjc.v7.i8.483
18. Post PN, Kuijpers M, Ebels T, Zijlstra F. The relation between volume and outcome of coronary interventions: a systematic review and meta-analysis. Eur Heart J. 2010; 31:1985-1992. https://doi.org/10.1093/eurheartj/ehq151
19. Thiele H, Ohman EM, Waha-Thiele S, Zeymer U, Desch S. Management of cardiogenic shock complicating myocardial infarction: an update 2019. European Heart Journal. 2019; 0:1-5. https://doi.org/10.1093/eurheartj/ehz363
20. Srinivas VS, Hailpern SM, Koss E, Monrad ES, Alderman MH. Effect of physician volume on the relationship between hospital volume and mortality during primary angioplasty. J Am Coll Cardiol. 2009; 53:574-579. https://doi.org/10.1016/j.jacc.2008.09.056
21. van Diepen S, Reynolds HR, Stebbins A, Lopes RD, Džavik V, Ruzyllo W, et al. Incidence and outcomes associated with early heart failure pharmacotherapy in patients with ongoing cardiogenic shock. Crit Care Med. 2014; 42:281-288. https://doi.org/10.1097/CCM.0b013e31829f6242
22. Sim DS, Jeong MH, Cho KH, Ahn Y, Kim YJ, Chae SC, et al. Korea Acute Myocardial Infarction Registry (KAMIR) Investigators. Effect of early statin treatment in patients with cardiogenic shock complicating acute myocardial infarction. Korean Circ J. 2013; 43:100-109. https://doi.org/10.4070/kcj.2013.43.2.100
23. Jentzer JC, Coons JC, Link CB, Schmidhofer M. Pharmacotherapy update on the use of vasopressors and inotropes in the intensive care unit. J Cardiovasc Pharmacol Ther. 2015;20(3):249-60. https://doi.org/10.1177/1074248414559838
24. Sciaccaluga C, Mandoli GE, Ghionzoli N. Anselmi F, Sorini C, Righini F, et al. Risk stratification in cardiogenic shock: a focus on the available evidence. Heart Failure Reviews. 2021. https://doi.org/10.1007/s10741-021-10140-7
25. Luecke T, Pelosi P. Clinical review: positive end-expiratory pressure and cardiac output. Crit Care. 2005; 9:607-621. https://doi.org/10.1186/cc3877
26. Van Diepen S, Katz JN, Albert NM, Henry TD, Jacobs AK, Kapur NK, et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement from the American Heart Association.; American Heart Association Council on Clinical Cardiology; Council on Cardiovascular and Stroke Nursing; Council on Quality of Care and Outcomes Research; and Mission: Lifeline. Circulation. 2017; 17;136(16): e232-e268. https://doi.org/10.1161/CIR.0000000000000525
27. Thiele H, Zeymer U, Neumann FJ, Ferenc M, Olbrich HG, Hausleiter J, et al. Intraaortic Balloon Pump in Cardiogenic Shock II (IABP-SHOCK II) Trial Investigators. Intra-aortic balloon counterpulsation in acute myocardial infarction complicated by cardiogenic shock (IABP-SHOCK II): final 12-month results of a randomised, open-label trial. Lancet. 2013; 382:1638-1645. https://doi.org/10.1016/S0140-6736(13)61783-3
28. Elsharkawy HA, Li L, Esa WA, Sessler DI, Bashour CA. Outcome in patients who require venoarterial extracorporeal membrane oxygenation support after cardiac surgery. J Cardiothorac Vasc Anesth. 2010; 24(6):946-51. https://doi.org/10.1053/j.jvca.2010.03.020
29. Amin F, Lombardi J, Alhussein M, Posada JD, Suszko A, Koo M, et al. Predicting Survival After VA-ECMO for Refractory Cardiogenic Shock: Validating the SAVE Score. CJC Open. 2020; 16;3(1):71-81. https://doi.org/10.1016/j.cjco.2020.09.011
30. Muller H, Flecher E, Lebreton G, Luyt CE, Trouillet JL, Bréchot N, et al. The ENCOURAGE mortality risk score and analysis of long-term outcomes after VA-ECMO for acute myocardial infarction with cardiogenic shock. Intensive Care Med. 2016;42(3):370-378. https://doi.org/10.1007/s00134-016-4223-9
31. Hongisto M, Lassus J, Tarvasmäki T, Sionis A, Sans-Rosello, Tolppanen H, et al. Mortalily risk prediction in elderly patients with cardiogenic shock: results from the CardShock study. Esc Heart Failure. 2021; 8:1398-1407. https://doi.org/10.1002/ehf2.13224

 ORCID
ORCID