Edgardo Banille 1 ,*, Ricardo Ledesma 2 , Camila Rosso 3 , Mario Espósito 3 , Cecilia Traferi 3 , Carolina Fernández 3 , Alejandro Peirone 4 , Alejandro Contreras 4
Recibido: 05-07-2021
Aceptado: 18-07-2021
©2021 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 50 Núm. 6 pp. 890-893|https://doi.org/10.25237/revchilanestv5007101025
PDF|ePub|RIS
Doppler ultrasound of abdominal vessels. New monitoring paradigm in hemodynamic instability
Abstract
We present a premature patient with a large patent ductus arteriosus who was admitted to our unit in cardiogenic shock and severe renal failure of 24 hours of evolution. Doppler ultrasound of the heart and abdominal and brain vessels is performed. The protocol shows hemodynamic repercussions of the congestion in the different organs prior to surgical ligation of the ductus, and changes after it.
Resumen
Presentamos una paciente prematura, con ductus arterioso permeable grande que ingresa a nuestra unidad en shock cardiogénico y falla renal severa de 24 h de evolución. Se realiza ecografía Doppler cardíaca y de vasos abdominales y cerebrales. El protocolo muestra repercusiones hemodinámicas de la congestión en los diferentes órganos previamente a la ligadura quirúrgica del ductus, y cambios posteriores a la misma.
-
Introducción
La ecografía realizada en tiempo real es denominada PO- CUS por sus siglas en inglés (point of care ultrasonography) y básicamente es el uso de la ecografía para el diagnóstico y solución de problemas en el ámbito clínico de urgencia.
El aprendizaje y la aplicación del enfoque POCUS por médicos intensivistas adultos, pediátricos y neonatólogos ha ganado popularidad estos últimos años ya que permite una rápida evaluación del estado hemodinámico respondiendo rápidamente a las preguntas denominadas las 5 “E”[1].
Esta modalidad permite integrar los hallazgos ecográficos en el contexto clínico del paciente siendo de utilidad en la toma de decisiones, permite un seguimiento ante cambios clínicos en el monitoreo convencional y además es posible usarlo en diversas especialidades. Debido a su disponibilidad e inocuidad para el paciente y el operador, es considerado en la actualidad el quinto pilar del examen físico[2].
El score VExUS ha demostrado utilidad para evaluar la sobrecarga hídrica de diferente etiología en pacientes adultos[3]-[6].
Un score VExUS ampliado que incluye la evaluación vasos arteriales (aorta abdominal, arteria mesentérica y cerebral media), podría ser usado en niños debido a que las ventanas son más favorables y permite un análisis integral de las repercusiones hemodinámicas[7].
El objetivo del caso es presentar la utilidad del flujo Doppler en vasos abdominales y cerebrales en el monitoreo hemodinámico en un neonato con insuficiencia cardíaca.
Presentamos un paciente femenino de 15 días de vida, recién nacido pretérmino con edad gestacional de 25 semanas y 720 gramos de peso (RNPT/AEG). Score de Apgar 4/7. Madre primigesta, quien recibe tratamiento para maduración pulmonar 3 días previos al nacimiento.
La niña se coloca en asistencia respiratoria mecánica durante 4 días y luego cánula nasal. Recibe tratamiento con surfactante y alimentación parenteral.
Se diagnostica ductus permeable grande a los 5 días de vida y se intenta cierre farmacológico con paracetamol (15 mg/kg/ día) durante 5 días, luego indometacina (0,2 mg/kg/dosis) por 4 dosis. Cursa sepsis por Klebsiella neumoniae y es tratada ampicilina más gentamicina por 7 días.
A los 13 días presenta dificultad respiratoria e inestabilidad
hemodinámica: presión arterial 36/15/22. Se realiza restricción hídrica y se coloca dopamina 8 mcg/kg/min. El laboratorio muestra PCR: (-), Hb: 13,8 g%, urea: 146 mg/dL, creatinina: 3,41 mg/dL, calcio: 8,4 mg/dL, sodio: 146 meq/L, potasio: 6,9 mEq/L. Gases venosos: Ph; 7,11, EB: -16, lactatos 6 mmoles/L.
Es derivada a nuestra institución. Al ingreso presenta palidez generalizada, taquicardia (180 lpm), R1 normal, R2 único intenso, soplo continuo 3/6, pulsos saltones, palidez, mal perfusión periférica y hepatomegalia.
El ecocardiograma Doppler color muestra dilatación de cavidades izquierdas con disfunción sistólica (fracción de acortamiento 27% recibiendo dopamina). Aurícula izquierda de 5 mm, aorta de 3,2 mm, relación AI/Ao > 1. Ductus de 2,4 mm, tronco de arteria pulmonar de 6 mm. Relación Doppler color ductal/ tronco pulmonar 36%.
Desde vista subcostal exploramos la aorta abdominal (3 mm), vena cava inferior (4,5 mm) con flujo a predominio diastólico. Flujo diastólico reverso en aorta abdominal. Se encontró también alteración de los flujos de venas suprahepáticas (flujo diastólico mayor que sistólico y mayor onda A reversa.) y flujo pulsátil en vena porta.
En el análisis de los flujos arteriales (cerebral media, mesentérica y renal) evidenciaron un incremento del índice de resistencia (Figura 1). La ecografía pulmonar de campos anteriores muestra líneas B difusas.
El abordaje POCUS y VExUS modificado permitió determinar que la paciente tenía un síndrome de bajo gasto e incremento de presiones de llenado del VI y edema pulmonar.
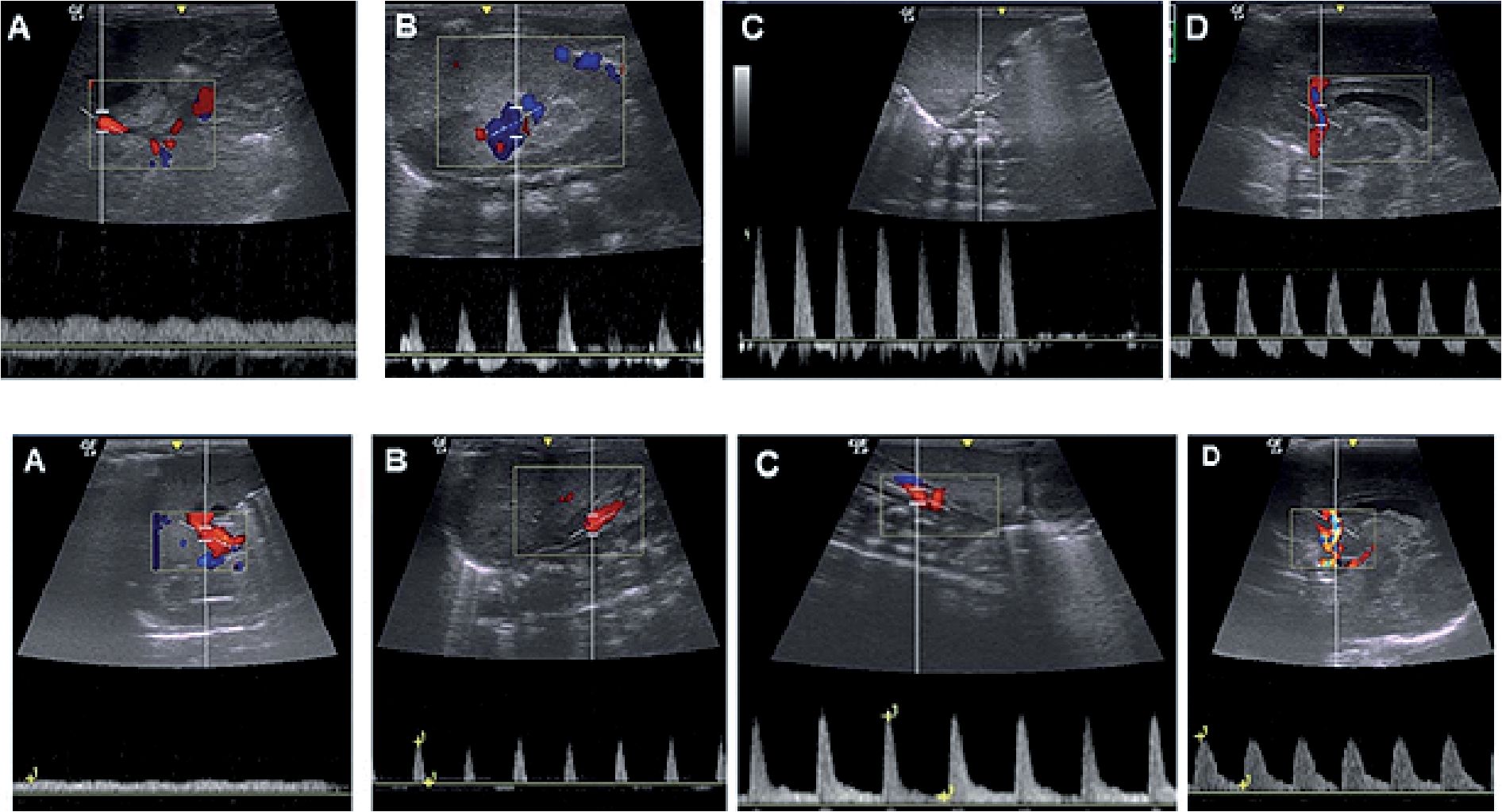
Figura 1. Ecografía al ingreso. Flujo de vena porta: onda pulsátil (A superior). (VN: diámetro 3 mm, velocidad 7 a 22 cm/segundos). Flujo de venas renales e índice de resistencia arterial renal. Vena con inversión diastólica. Arteria con IR > 1. (VN: 0,79). > ecogenicidad de la corteza renal; (B superior). Flujo de arteria mesentérica: aumento del IR (VN: 0,6-0,7); (C superior). Flujo de arteria cerebral anterior. Inversión de la diástole con hemorragia subependimaria a nivel del surco caudotalámico (grado I de Papile); (D superior). Ecografía 24 h posquirúrgicas. Flujo de vena porta: con onda monofásica predominante sin colapso (A inferior). Flujo de venas renales e índice de resistencia renal. Vena con ausencia de onda diastólica. Arteria con IR: 1. Persiste ecogenicidad de la corteza renal; (B inferior). Flujo de arteria mesentérica: con presencia de diástole IR: 0.91; (C inferior). Flujo de arteria cerebral anterior: con presencia de diástole IR: 0.87; (D inferior).
Luego de la ligadura quirúrgica la evolución es favorable con mejoría clínica, de la función renal, y de los flujos Doppler pulsado de los vasos arteriales y venosos evaluados.
Nuestra paciente presenta un shock cardiogénico secundario a sobrecarga volumétrica provocada por la persistencia de un ductus arterioso grande. En pacientes prematuros la descompensación hemodinámica es más precoz debido a la inmadurez miocárdica y de la vasculatura pulmonar que no toleran la sobrecarga volumétrica ocasionada por el cortocircuito de izquierda a derecha a nivel ductal. Más importante aún es la insuficiencia retrógrada que incrementa la presión pulmonar y produce sobrecarga del ventrículo y aurícula derecha, con transmisión de la misma a los vasos abdominales (venas supra- hepáticas, porta y renales).
Numerosas publicaciones en pacientes adultos en el período posoperatorio cardiovascular, avalan la utilización de la ecografía Doppler de vasos abdominales para evidenciar la repercusión hemodinámica en otros sistemas y como parámetro de perfusión orgánica[3]-[5].
La sobrecarga de fluidos de distinta etiología repercute en los pulmones con presencia de edema intersticio alveolar y en los órganos abdominales se evidencia edema a nivel esplácnico y renal, que son particularmente sensibles al incremento de la presión intraabdominal y a la hipertensión venosa secundaria al aumento de la presión en aurícula derecha y en la presión venosa central (PVC) que se trasmite en forma retrógrada a los vasos abdominales[1],[3]-[5].
En ecografía crítica el tamaño y colapsabilidad de la vena cava inferior es considerada como subrogante a la presión de aurícula derecha y la alteración de su flujo es mucho más precoz que la aparición de signos clínicos de sobrecarga hídrica como estertores crepitantes o edemas periféricos[1].
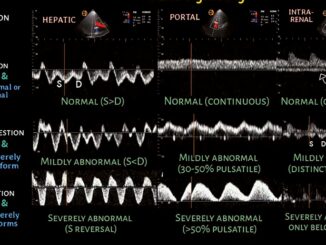
Desde vista subcostal se explora la vena cava inferior que presenta normalmente un flujo bifásico (inspiratorio/espiratorio). El flujo de venas suprahepáticas es de morfología trifásica: 1- onda sistólica (S) anterógrada (en dirección al corazón, debajo de la línea de base), que refleja el descenso de la presión en aurícula derecha ocasionada por el descenso del anillo tricuspídeo hacía el ápex durante la sístole ventricular (corresponde a la onda V de la curva de PVC); 2- onda diastólica (D) también muestra una dirección anterógrada., de menor amplitud que la onda S y refleja el descenso de la presión en aurícula derecha ocasionada por la apertura de la válvula tricúspide y el llenado diastólico ventricular temprano (corresponde al colapso Y de la onda de PVC) y 3- onda (A) que se corresponde a la contracción auricular (onda A de la PVC), que excede la presión de la vena cava inferior mostrando una dirección retrógrada hacia las venas hepáticas (arriba de la línea de base)[1],[4].
El flujo normal en vena porta es monofásico con leve ondulación y un índice de pulsatilidad < 30%, y el flujo en venas renales normal es contínuo monofásico.
Cuando se incrementa el volumen estresado o la presión en aurícula derecha, se produce insuficiencia tricuspídea, la transmisión retrógrada del flujo sistólico que proviene desde el ventrículo derecho, modifica los patrones de flujo Doppler como ocurrió en nuestra paciente que presentó inversión del flujo en venas suprahepáticas (predominio diastólico y exageración de la onda A, aparición de pulsatilidad en venas porta y aparición de onda diastólica en venas renales.
En lo refiere a los flujos arteriales cerebral, arteria mesentérica superior y arterias renales, se evidencia un incremento del índice de resistencia (IR).
A las 24 h de la ligadura quirúrgica la paciente entra en fase poliúrica y se visualiza como se normalizan los flujos Doppler pulsado en venas suprahepáticas y vena porta, y desaparición de la onda diastólica en venas renales.
Los riñones son particularmente vulnerables a la congestión venosa, al ser un órgano encapsulado, el incremento de la presión de vena cava inferior dificulta el vaciado de las venas renales generando mecanismos con efecto de cascada, el aumento de la presión intersticial renal, disminuye la presión de perfusión con retención de agua y sodio activados por mecanismos proinflamatorios y neurohormonales agravados por la prematurez[6],[7].
El flujo cerebral se encuentra protegido en las etapas de shock inicial debido a los mecanismos compensadores (disminución del flujo esplácnico, cutáneo y renal), pero al persistir el estado de shock muestran un incremento del índice de resistencia arterial, este concepto se puede correlacionar con los valores de NIRS abdominal, renal y cerebral con los cuales podemos deducir la distribución del flujo sanguíneo[8].
El ductus permeable produce bajas resistencias periféricas (robo diastólico), evidenciada por (tensión arterial diastólica baja y presión del pulso amplia) en el período postoperatorio se produce una inversión de las resistencias (cifras de presión arterial diastólica elevadas y presión del pulso estrecha) y se evidencia con persistencia de los índices de resistencia (IR) elevados en los territorios arteriales cerebrales, mesentéricos y renales[9].
En el biomonitoreo se registró acidosis metabólica, y elevación de los niveles de lactato sérico. Los marcadores de función renal mejoraron luego de una fase poliúrica.
Es de destacar que los hallazgos patológicos en el Doppler de vasos abdominales, reflejan la precocidad del compromiso hemodinámico, son un factor predictivo de insuficiencia renal y también un marcador de evolución, como se pudo ver en nuestra paciente con la mejoría hemodinámica[9],[10].
El monitoreo ecográfico a pie de cama, se recomienda como un complemento al examen clínico y al biomonitoreo en la evaluación hemodinámica de un paciente crítico. El presente caso refleja la utilidad de la ecografía POCUS como herramienta en el diagnóstico y seguimiento de pacientes críticos.
El score VExUS utilizado en adultos para evaluar la sobrecarga de fluidos, es un método emergente en pediatría y neonatología para monitoreo hemodinámico.
Los autores no contaron con fuentes de financiamiento.
Los autores declaran no tener conflicto de interés.
Referencias
1. Koratala A, Kazory A. Point of Care Ultrasonography for Objetive Assesment of Heart Failure: Integration of Cardiac, Vascular, and Extravascular Determinants of Volume Status- Cardiorenal Med 2021;11:5-17. https://doi.org/10.1159/000510732
2. Narula J, Chandrashelchar Y, Braunwald E. Time to Add a Fifth Pillar to Bedside Physical Examination. Inspection, Palpation, Percussion, Auscultation. JAMA Cardiol 2018; 3:346-350. https://doi.org/10.1001/jamacardio.2018.0001
3. Denault A, Canti D, Azzam M, Beaubien-Souligny W, Amir A. Whole-body ultrasoud in the intensive care unit. ICU Management & Practice 2018;18 (4):
4. Beaubien- Souligny W, Bouchard J, Desjardins G, et al. Extracardiac Signs of Fluid Overload in Critically ill Cardiac Patient: A Focused Evaluation Using Bedside Ultrasound. Canadian J Cardiology 2017;33:83-100 https://doi.org/10.1016/j.cjca.2016.08.012
5. Beubien-Soulign W, Rola P, Haycock K, et al. Quantifyng systemic congestion with Point-Of-Care Ultrasound: development of the venous excess ultrasound grading system. The Ultrasound Journal 2020;(1) 12-16 https://doi.org/10.1186/s13089-020-00163-w
6. Haycok K, Spiegel R, Rola P. Bedside Ultrasound: a primer for clinical integration. Special Skills: Venous Congestion. Chapter 6. 2019; 100-107.
7. Banille E. Ecografía más allá del corazón. En Banille E. (Ed). Monitoreo Cardiopulmonar Pediátrico. De la teoría a la práctica. Capítulo 4. Editorial RECFOT. Año 2019.
8. Banille E. Monitoreo hemodinámico deductivo. “Del corazón a la microcirculación”. En Banille E. (Ed) Monitoreo Cardiopulmonar Pediátrico. De la teoría a la práctica. Capítulo 7.Editorial RECFOT. 2019
9. Banille E. Neuromonitoreo en Cirugía Cardiovascular Pediátrica. En Banille E. (Ed) Monitoreo Cardiopulmonar Pediátrico. De la teoría a la práctica. Capítulo 9. Editorial RECFOT0F -632.0 122019
10. Corradi F, Via G, Tavazzi G. What New in Ultrasound-based assessment of organ perfusion in the critically in: expanding the bedside clinical monitoring window for hypoperfusion in shock. Intensive Care Med 2020; 46(4):775-779. https://doi.org/10.1007/s00134-019-05791-y

 ORCID
ORCID