Sebastián Amaya 1 ,*, Dario Andrade Fierro 2 , Adriana C. Orozco 3 , Byron Rosero-Britton 4 , David M. Orozco 5
Recibido: 26-06-2021
Aceptado: 14-07-2021
©2021 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 50 Núm. 6 pp. 898-901|https://doi.org/10.25237/revchilanestv5007101213
PDF|ePub|RIS
Quadricuspid aortic valve: Intraoperative echocardiographic approach
Abstract
The quadricuspid aortic valve is considered a rare cardiac malformation, as well as an exotic aetiology of aortic regurgitation. The detection of this cardiac anomaly can be done via transthoracic and/or transesophageal echocardiography, thus highlighting the importance of these imaging modalities, as well as its utility in perioperative clinical decision making. We present the case of a 70-year-old patient with severe aortic regurgitation, who was referred to our institution for aortic valve replacement, in whom a quadricuspid aortic valve was documented intraoperatively. Therefore, we believe it is valuable to share this case, present intraoperative echocardiographic images, and review the pertinent literature on this subject.
Resumen
La válvula aórtica cuadricúspide se considera una malformación cardíaca rara, así como una etiología exótica de insuficiencia aórtica. La detección de esta anomalía cardíaca se puede realizar mediante ecocardiografía transtorácica y/o transesofágica, destacando así la importancia de estas modalidades de imagen, así como su utilidad en la toma de decisiones clínicas perioperatorias. Presentamos el caso de un paciente de 70 años con insuficiencia aórtica severa, que fue remitido a nuestra institución para reemplazo valvular aórtico, en el que se documentó intraoperatoriamente una válvula aórtica cuadricúspide. Por ello creemos valioso compartir este caso, presentar imágenes ecocardiográficas intraoperatorias y revisar la literatura pertinente sobre este tema.
-
Introducción
La insuficiencia aórtica (IA) es una indicación frecuente de intervención sobre dicha válvula, sin embargo, el hallazgo de anatomía cuadricúspide es exótico, con alrededor de 200 casos reportados en la literatura a la fecha. Presentamos en este artículo un caso de la misma, discutimos la literatura al respecto y destacamos el papel preponderante del ecocardiograma intraoperatorio en la toma de decisiones en este escenario.
-
Caso clínico
Un paciente de 70 años fue remitido a nuestra institución por un cuadro de insuficiencia cardíaca congestiva de etiología valvular por IA de varios años de evolución, la cual había requerido varias hospitalizaciones en el último año.
Al examen físico se encontró un paciente caquéctico, con soplo diastólico en foco aórtico con velamiento del primer ruido cardíaco, pulsos saltones e impulso cardíaco en cúpula. Se practicó ecocardiograma transtorácico en el cual se confirmó la IA, además se documentó depresión de la función ventricular izquierda con fracción de eyección de 20%. El paciente fue monitorizado con presión arterial invasiva, catéter de arteria pulmonar, y ecocardiografía transesofágica. En dicho examen (Figura 1) se documenta la anatomía cuadricúspide con apertura en X, con cuatro valvas de igual tamaño (Tipo I); e insuficiencia central severa por insuficiencia en la coaptación sin dilatación de la raíz aórtica (Mecanismo Ic) (vena contracta 6 mm, reversión holodiastólica del flujo en aorta descendente, tiempo de hemipresión 178 ms), asociado a dilatación severa del ventrículo izquierdo con función sistólica profundamente deprimida.
Se realizó cambio valvular aórtico por una prótesis biológica número 23 en 66 minutos de circulación extracorpórea y durante la disección se confirma la anatomía. Se logra la separación de la circulación extracorpórea con soporte inotrópico en forma rutinaria. Fue extubado en el segundo día postoperatorio, y se dio de alta a su domicilio al 9 día después de un curso clínico normal.
-
Discusión
La válvula aórtica cuadricúspide (VAC) es una anomalía congénita infrecuente de dicha válvula, con una incidencia de 0,00028-0,00033% en autopsias, 0,0059-0,0065% en series ecocardiográficas, y 0,05%-1% en pacientes con indicación quirúrgica de cambio valvular por IA[1]. Debido a la rareza de la lesión, el manejo óptimo de la misma es empírico en gran parte, debido a que la historia natural, mecanismo de la insuficiencia, estrategia y momento quirúrgico no están bien establecidos.
Existen dos sistemas de clasificación; el de Hurwitz, el cual tiene siete subtipos, y el simplificado de Nakamura, al cual nos vamos a referir. Este se enfoca en la posición de la valva supernumeraria con respecto a las otras; Tipo I: localizada entre la valva coronariana derecha y la izquierda, Tipo II: entre la derecha y la no coronariana, Tipo III: entre la derecha y la izquierda, Tipo IV: valva supernumeraria no identificada entre dos cúspides de igual tamaño[1],[2],[3] (Figura 2).
Existen dos teorías generalmente aceptadas de la génesis de VAC: anomalías en la septación aortopulmonar o proliferación anormal de tejido mesenquimatoso en el tronco común[1],[2]. Debido a que la válvula aórtica se forma a continuación de la formación de las arterias coronarias lo cual hace que anomalías en estas últimas puedan concurrir.
La VAC suele presentarse como una lesión aislada, sin embargo, puede asociarse a otros defectos, siendo los más frecuentes anomalías en el origen y distribución de las arterias coronarias en 30%, así como comunicación interventricular, ductus arterioso persistente, estenosis pulmonar, membrana subaórtica, o insuficiencia mitral[4]. La dilatación aórtica es un componente frecuente de la VAC que merece atención especial, Idrees reporta una incidencia de 42% (13/31) en una serie de 10 años, sin embargo, no hay recomendaciones en el umbral de tratamiento o en el riesgo de desarrollo de complicaciones de la misma (ruptura o disección)[5].
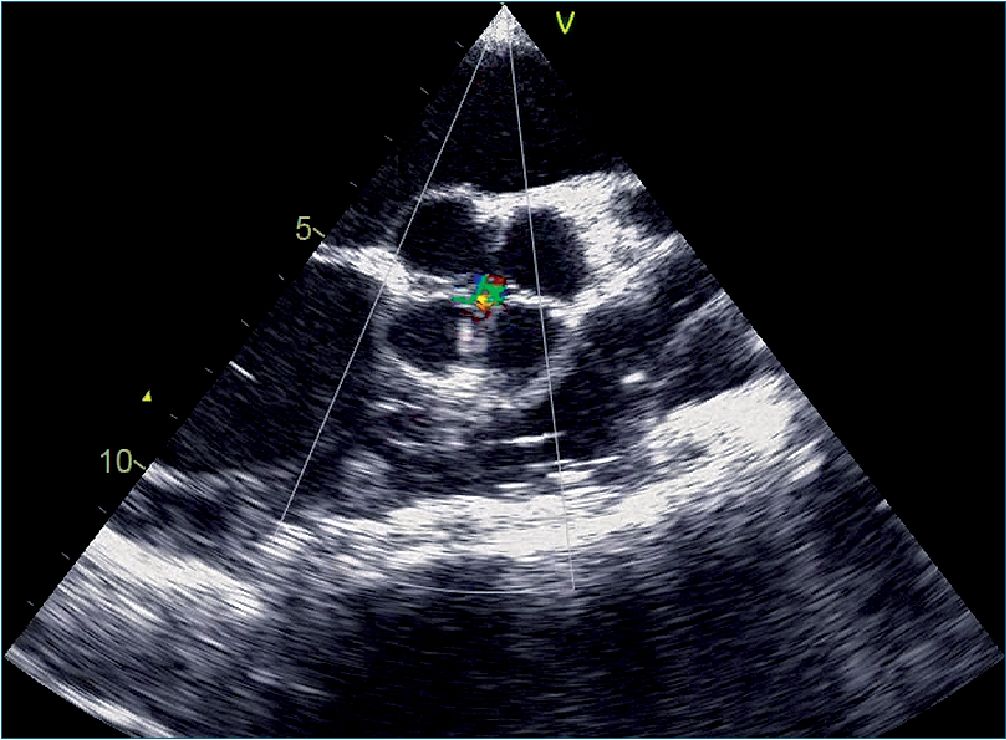
Figura 1. Eje corto de la válvula aórtica en diástole, en el cual se puede apreciar la anatomía cuadricúspide y un chorro de regurgitación central.
Se acepta generalmente que la VAC es insuficiente per se, sin embargo, esto ha sido rebatido. En la serie de Tutarel y Westhoff-Bleck se reportó que el porcentaje de IA fue 74,7%, doble lesión 8,4%, estenosis 0,7%, y función normal en el 16,2%[6]. Cuando la población se compone de pacientes con indicación quirúrgica, Yotsumoto y cols. reportaron que de 616 programados para cambio valvular aórtico, 9 (1,46%) individuos tenían VAC, de los cuales solamente uno tenía doble lesión[7].
El examen ecocardiográfico intraoperatorio no difiere del análisis de una regurgitación de cualquier etiología; en el examen previo a la circulación extracorpórea hay 4 objetivos:
1. Cuantificación de la severidad.
2. Definición del mecanismo de la insuficiencia.
3. Repercusión de la lesión en las cámaras.
4. Búsqueda de lesiones asociadas.
El análisis de la severidad se debe establecer idealmente en preoperatorio; puesto que en la mayoría de estudios se documenta disminución de la severidad por la alteración de las condiciones de carga en el corazón asociadas con la anestesia general y la institución de ventilación controlada; sin embargo si se hiciere necesaria la cuantificación de la misma se recomienda el uso de vasopresores para el restablecimiento de las presión arterial hasta los valores basales y en ese momento hacer las mediciones. En la última actualización de las recomendaciones de la evaluación de no invasiva de la regurgitación valvular nativa de la Sociedad Americana de Ecocardiografía se establecen una evaluación algorítmica de la de la insuficiencia, en el cual establecen signos específicos de severidad en IA: Eversión valvar, vena contracta mayor de 6 mm, jet central que ocupe más del 65% del tracto de salida del ventrículo izquierdo, tiempo de hemipresión menor a 200 ms, reversión holodiastólica prominente en aorta descendente, y ventrículo izquierdo dilatado con función normal. La presencia de 4 criterios clasifica la insuficiencia como definitivamente severa[8].
El análisis del mecanismo de la regurgitación aórtica, se hace con respecto a un análisis sistemático de la misma, en el cual se tiene en cuenta los 2 anillos de la misma; el de la unión ventrículo arterial y en la unión sinotubular, de tal forma que se integra la arquitectura de la raíz aórtica en el análisis de la regurgitación; sucintamente vamos a revisar los tipos de mecanismo, para después puntualizar en la válvula cuadricúspide; Tipo I movilidad normal de las valvas, asociado o no a dilatación de la raíz aórtica, tipo II movilidad incrementada, y Tipo III movilidad restringida[9]

Figura 2. Clasificación de Nakamura, Tipo I: Valva supernumeraria localizada entre la valva coronariana derecha y la izquierda, Tipo II entre la derecha y la no coronariana, Tipo III entre la derecha y la izquierda, Tipo IV valva supernumeraria no identificada entre dos cúspides de igual tamaño.
Con respecto a la válvula aórtica cuadricúspide se hace también en una forma funcional enumerando el mecanismo para evitar términos confusos. Se cree que la distribución anormal del estrés por las cuatro valvas condiciona fatiga estructural temprana, fibrosis, retracción lo cual conduce a fracaso en la coaptación; este se cree que es el principal mecanismo (Tipo I); aunque la distorsión de la arquitectura de raíz aórtica es también frecuente; prolapsos (tipo II), o restricción de la movilidad por degeneración también han sido descritos (Tipo III)[2]-[7].
La regurgitación aórtica le afecta principalmente al ventrículo izquierdo; por lo cual el análisis de la geometría ventricular, los volúmenes ventriculares, y la función sistodiastólica van a permitir establecer pronóstico, planear estrategias hemodinámicas y sustentar el diagnóstico: un ventrículo izquierdo dilatado con buena función sistólica soporta la sospecha en caso en el cual que los parámetros Doppler no sean conclusivos[8].
El examen ecocardiográfico intraoperatorio debe ser exhaustivo para detectar posibles lesiones que requieran corrección en el mismo tiempo quirúrgico. En el caso específico de la válvula aórtica, la medición de los diámetros y arquitectura aórtica hacen parte fundamental de la evaluación. Empero no hay recomendaciones específicas en cuanto a cuál es el diámetro que indica el reemplazo de la misma en el escenario de VAC por lo cual se siguen las mismas recomendaciones que en la válvula trivalva[10]. Teniendo presentes las anomalías más frecuentemente asociadas es recomendable revisar detenidamente la relación del nacimiento de las arterias coronarias con las valvas, revisar el espectro de color de la arteria pulmonar (para descartar ductus), la morfología del espectro Doppler y la anatomía del tracto de salida del ventrículo izquierdo y derecho (membranas o estenosis pulmonar).
El examen posterior a la circulación extracorpórea está enfocado en revisar la calidad del reparo: en un cambio valvular aórtico esto consiste en descartar/cuantificar regurgitación ya sea intra o paraprotésica; así mismo como la medición de los gradientes para descartar desajuste o malfuncionamiento de la prótesis, así mismo se titulan líquidos, inotrópicos y vasopresores.
El manejo perioperatorio de dichos pacientes sigue los mismos objetivos que cualquier paciente con insuficiencia aórtica; enfatizando en búsqueda de las anomalías asociadas que requieran corrección en el mismo tiempo quirúrgico.
1. Yuan SM. Quadricuspid Aortic Valve: A Comprehensive Review. Braz J Cardiovasc Surg. 2016;31(6):454‐460. https://doi.org/10.5935/1678-9741.20160090 2. Timperley J, Milner R, Marshall AJ, Gilbert TJ. Quadricuspid aortic valves.Clin Cardiol. 2002;25(12):548‐552. https://doi.org/10.1002/clc.4950251203 3. Malviya A, Kumar Jha P, Ashwin, Mishra J, Srivastava P, Mishra A,Quadricuspid aortic valve – A case report and literature review.The Egyptian Heart Journal,volume 68, Issue 4,2016,Pages 271-275,ISSN 1110-2608, https://doi.org/10.1016/j.ehj.2015.09.003 4. Plaunova A, Gulkarov I, Tortolani AJ, Worku B. Surgery for a quadricuspid aortic valve: case report and comprehensive review of the literature. J Heart Valve Dis. 2015;24(2):260‐262. 5. Idrees JJ, Roselli EE, Arafat A, et al. Outcomes after repair or replacement of dysfunctional quadricuspid aortic valve. J Thorac Cardiovasc Surg. 2015;150(1):79‐82. https://doi.org/10.1016/j.jtcvs.2015.03.019 6. Tutarel O. The quadricuspid aortic valve: a comprehensive review. J Heart Valve Dis. 2004;13(4):534‐537. 7. Yotsumoto G, Iguro Y, Kinjo T, Matsumoto H, Masuda H, Sakata R. Congenital quadricuspid aortic valve: report of nine surgical cases. Ann Thorac Cardiovasc Surg. 2003;9(2):134-7. 8. Zoghbi WA, Adams D, Bonow RO, et al. Recommendations for Noninvasive Evaluation of Native Valvular Regurgitation: A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Magnetic Resonance. J Am Soc Echocardiogr. 2017;30(4):303‐371. 9. Boodhwani M, de Kerchove L, Glineur D, et al. Repair-oriented classification of aortic insufficiency: impact on surgical techniques and clinical outcomes. J Thorac Cardiovasc Surg. 2009;137(2):286‐294. https://doi.org/10.1016/j.jtcvs.2008.08.054 10. Hayakawa M, Asai T, Kinoshita T, Suzuki T. Quadricuspid aortic valve: a report on a 10-year case series and literature review.Ann Thorac Cardiovasc Surg. 2014;20 Suppl:941‐944. https://doi.org/10.5761/atcs.cr.13-00125 Referencias

 ORCID
ORCID