Víctor Guerrero Legro1, Alberto Fernández Delgado2,*, Sofía Castrillón Acosta3.
Recibido: 21-10-2021
Aceptado: 12-12-2021
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 6 pp. 769-762|https://doi.org/10.25237/revchilanestv5106101520
PDF|ePub|RIS
Cardiac myxoma during pregnancy: Report of one case
Abstract
Myxomas are cardiac tumors originating in the mesenchymal cells of the heart, which represent between 30%-50% of primary cardiac tumors in the adult population. Despite the predominance in females, the presentation and diagnosis of cardiac myxomas during pregnancy are extre- mely rare, with surgical excision under extracorporeal circulation and cesarean delivery being the most recommended therapeutic strategies. We present the case of a 16-year-old patient who visits the emergency department due to the onset of labor, furters presents a pansystolic murmur on physical examination and a large intracavitary cardiac mass on transthoracic echocardiography, requiring cesarean section and cardiac surgery under extracorporeal circulation.
Resumen
Los mixomas son tumores cardíacos originados en las células mesenquimales del corazón, los cuales representan entre el 30%-50% de los tumores cardíacos primarios de la población adulta. A pesar del predominio en el sexo femenino, la presentación y diagnóstico de los mixomas cardíacos durante la gestación son extremadamente raros, siendo la escisión quirúrgica bajo circulación extracorpórea y el parto por cesárea las estrategias terapéuticas más recomendadas. Presentamos el caso de una paciente de 16 años quien consulta al servicio de urgencias por inicio de trabajo de parto, quien presenta soplo pansistólico al examen físico y gran masa cardíaca intracavitaria en el ecocardiograma transtorácico, requiriendo cesárea y cirugía cardíaca bajo circulación extracorpórea.
-
Introducción
Los mixomas son tumores cardíacos originados en las células mesenquimales del corazón, los cuales representan entre el 30%-50% de los tumores cardíacos primarios de la población adulta. El 92% de estos se presentan en las aurículas, mientras que solo el 8% ocurre en alguno de los ventrículos, y a pesar de su predominio en el sexo femenino, su presentación y diagnóstico en mujeres en embarazo son extremadamente raros, con solo algunos casos reportados en la literatura actual[1],[2].
Los síntomas de esta entidad varían según la localización, la movilidad y las características morfológicas de la masa, al igual que de las comorbilidades de cada paciente. Algunos de los hallazgos más comúnmente reportados en la literatura de pacientes grávidas con diagnóstico de fibromixoma son disnea, palpitaciones, sensación de mareo, cefalea y soplos cardíacos. Con menor frecuencia se han reportado casos con presentaciones más graves, como infarto agudo de miocardio, disfunción valvular aguda, accidente cerebrovascular y embolia pulmonar[3].
La ecocardiografía es el método diagnóstico no invasivo estándar tanto en pacientes gestantes como no gestantes[2]. En general, la escisión quirúrgica bajo circulación extracorpórea y el parto por cesárea son las estrategias terapéuticas más recomendadas, sin embargo, es necesario el manejo multidisciplinario y el análisis de cada caso para tomar la mejor decisión en cuanto al momento ideal para la intervención, esto teniendo en cuenta la alta mortalidad fetal (14,3%-38,5%) y materna (2,9%-13,3%) entre pacientes embarazadas con requerimiento de cirugía cardíaca, en especial durante la gestación tem- prana[1)]. Entre las variables con probable implicación en los resultados maternos y feto-neonatales se encuentran la edad gestacional, el deseo de continuar el embarazo, el riesgo individual de sangrado y trombosis, el grado de obstrucción y el compromiso hemodinámico de la gestante[3].
-
Presentación del caso clínico
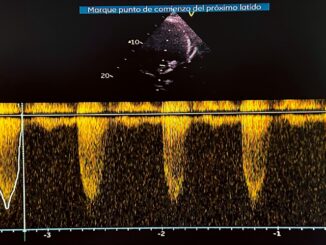
Paciente femenina de 16 años primigestante con embarazo único de 36,1 semanas de gestación por ecografía del primer trimestre, quien consulta al servicio de gineco-obstetricia por inicio de contracciones uterinas y expulsión de tapón mucoso. Durante la anamnesis refirió asistir a 7 controles prenatales y haber recibido manejo para sífilis gestacional, negando antecedentes personales previos de importancia; refirió presentar disnea durante la realización de actividad física de moderada intensidad sin haber realizado consulta médica por este motivo. Durante el examen físico se ausculta soplo pansistólico cardíaco grado IV, por lo cual se ordena realización de ecocardiografía transtorácica, en la cual se evidencia gran masa intracavitaria alargada, homogénea y de contornos bien definidos que mide 9,0 cm x 2,8 cm, ubicada en el ventrículo izquierdo, con ocupación del 90% del tracto de salida del ventrículo izquierdo cau sando obstrucción severa al flujo sanguíneo y prolapso leve de la válvula aortica, generando disfunción ventricular moderada – severa con fracción de eyección del 27%. La lesión no formaba cuerpo con el miocardio ventricular (Figuras 1 y 2) presentando leve adherencia en el ápex, por lo cual se realizó impresión diagnostica de masa tumoral con diagnostico diferencial de trombo intracavitario. Por lo anterior, se solicita valoración por cirugía cardiovascular, quien en consenso con el servicio de gineco-obstetricia, deciden realizar cesárea emergente y resección de lesión cardíaca.
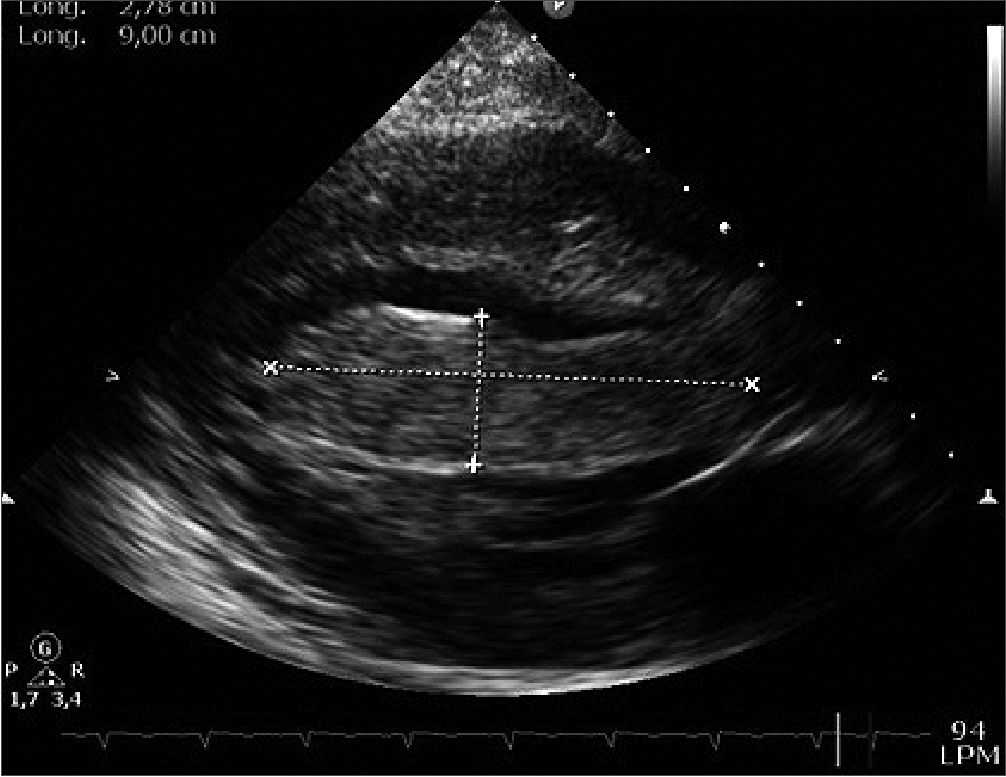
Figura 1. Gran masa intracavitaria ventricular izquierda, ubicada desde el ápex hasta el tracto de salida ventricular izquierdo, prolapsando levemente la válvula aórtica. Ocupa el 90% del tracto de salida ventricular izquierdo con obstrucción severa al flujo sanguíneo a este nivel.
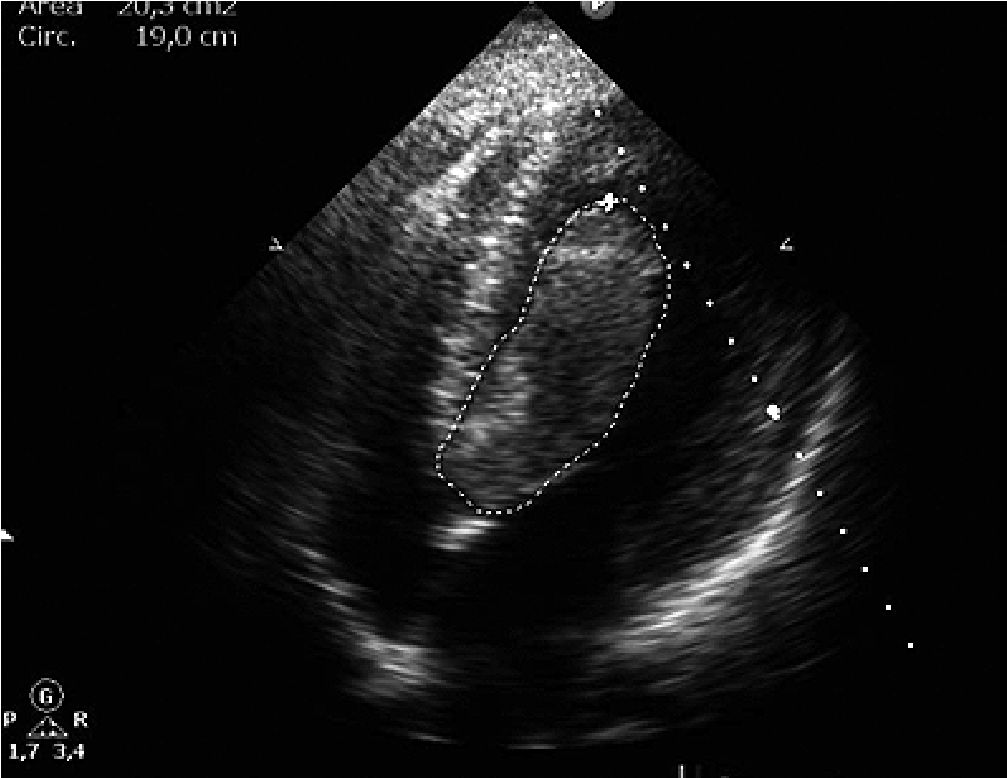
Figura 2. Masa homogénea de contornos bien definidos, la cual no forma cuerpo con el miocardio ventricular, presentando leve adherencia al ápex ventricular.
Al ingreso a quirófano se realiza monitoria anestésica básica, registrando TA: 105/72 mmHg, FC: 95 lpm FR: 16 rpm y SaO2: 99% al aire ambiente. Teniendo en cuenta el alto riesgo cardiovascular de la paciente, se decide realizar colocación de catéter arterial radial izquierdo y catéter venoso central yugular derecho de alto flujo (9 Fr) bajo guía ecográfica previo al inicio de la inducción anestésica. Una vez realizada la asepsia y antisepsia de la región abdominal inferior, colocación de campos estériles y la preparación del equipo quirúrgico, se procede a iniciar la inducción anestésica con preoxigenación con FiO2 al 100% durante 5 minutos, posteriormente administrándose lidocaína 60 mg, fentanilo 250 mcg, propofol 140 mg y cisa- tracurio 10 mg vía endovenosa. Posteriormente, se realiza laringoscopia directa con hoja curva tipo MAC 3, evidenciándose un Cormack-Lehane grado 1 y la apertura glótica adecuada sin anomalías. Se realiza intubación con tubo endotraqueal (TET) número 7.5 y fijación de este a 20 cm de la comisura oral derecha, sin presencia de complicaciones durante el procedimiento. La auscultación demostró una ventilación simétrica en ambos campos pulmonares, en ausencia de ruidos agregados. Se inicio ventilación mecánica en modo controlado por volumen, con un volumen corriente a razón de 6 ml/kg, frecuencia respiratoria de 12, FiO2 al 60% y presión positiva al final de la espiración de 5 cm de H2O. La onda de capnografía estuvo presente y fue regular durante el inicio de la ventilación mecánica. El mantenimiento anestésico se realizó mediante la administración de sevoflurano a una concentración alveolar mínima (MAC) de 0,5.
Se da inicio al procedimiento quirúrgico con incisión tipo Pfannenstiel y posterior extracción de feto único vivo; se realiza alumbramiento activo, extracción de placenta, rafia uterina y cierre de la pared abdominal sin complicaciones con una pérdida sanguínea aproximada de 400 ml durante la cesárea. Durante el procedimiento se mantuvo estabilidad hemodinámica con tensión arterial media (TAM) mayor a 70 mmHg. Posteriormente, se realiza esternotomía y pinzamiento aórtico para dar inicio a circulación extracorpórea (CEC); mediante la máquina de perfusión se administra cardioplejía Del Nido, continuando con la extracción de la masa intraventricular, la cual se realiza sin complicaciones, por lo que en conjunto con equipo quirúrgico y perfusionista se decide realizar despinzamiento aórtico escalonado (25% – 50% – 75% y 100%) hasta salida de CEC, titulando el soporte vasopresor con noradrenalina según TAM y apertura aortica. Mediante guía ecocardiografíca transesofágica se evidencia disfunción ventricular inicial por aturdimiento miocárdico, presentando mejora paulatina y se guía la aspiración de aire intracavitario. Se inicia la administración de protamina para revertir el efecto anticoagulante con adecuada tolerancia hemodinámica y se continúa con la administración de gluconato de calcio, desmopresina y hemoderivados para reposición de perdida sanguínea, lográndose la decanulación aortica y posterior cierre de esternón.
Finaliza el procedimiento quirúrgico y se realiza extubación sin complicaciones, realizando el traslado de la paciente a unidad de cuidados intensivos (UCI) hemodinámicamente estable y bajo ventilación espontánea con Venturi con FiO2 al 50%. Los paraclínicos de ingreso a UCI demostraron hemoglobina: 8,5 g/dL, hematocrito: 24%, leucocitos: 10.500, ácido láctico: 1,6, fibrinogeno: 355 mg/dL, BUN:14 mg/dL, Cr 0,5 mg/dL; gasometría arterial con pH: 7,39, PaO2: 157,6 mmHg, PaCO2: 41,5 mmHg, HCO3: 24,7 mEq/l, BE: -0,3 mmol/L, FiO2: 50%, PaFi: 315,2. En UCI se suministró oxígeno suplementario con titulación progresiva y adecuado patrón respiratorio, además, logrando óptimo control del dolor y estabilidad hemodinámi- ca. La gasometría arterial al segundo día de estancia en UCI demostró pH: 7,40, PaO2: 90,1 mmHg, PaCO2: 39,1 mmHg, HCO3: 24,1 mEq/l, BE: -0,6 mmol/L, FiO2: 24%, PaFi: 375,4, con saturación arterial de oxígeno en 98% recibiendo oxigenoterapia con cánula nasal a razón de 1 lt/min. Al tercer día posoperatorio se traslada a sala general previo retiro de sondas mediastinales sin complicaciones.
El estudio histopatológico e inmunohistoquímico de la lesión demostró un tumor cardíaco tipo fibromixoma. La paciente fue dada de alta al quinto día posoperatorio sin secuelas.
-
Discusión
La enfermedad cardiovascular grave durante la gestación es relativamente rara y se estima que complica aproximadamente entre el 2% y el 4% de los embarazos. Puede ser secundaria a patologías “de novo”, las cuales pueden presentarse de forma aguda o estar relacionada a la exacerbación de una patología previa silente, desenmascarada por los cambios hemodinámi- cos propios del embarazo[2]. A pesar de ser una entidad poco frecuente, puede cargar consigo una carga de morbimortalidad importante, especialmente cuando las condiciones clínicas de la paciente hacen imposible posponer el manejo quirúrgico definitivo hasta después del período de gestación[4].
En el pasado, los procedimientos cardiovasculares mayores durante el embarazo se relacionaron con un alto porcentaje de desenlaces adversos tanto para la madre como para el feto[1]. Sin embargo, en la actualidad, la literatura sugiere una carga actual de desenlaces para la madre similar a los de la población femenina no gestante[5]. Un metaanálisis que incluyó 10 estudios y 154 gestantes las cuales requirieron intervención cardíaca bajo circulación extracorpórea (CEC) de forma urgente o emergente, concluyó una mortalidad global materna de 11,2% (95% IC, 6,8% a 17,8%) y una tasa de complicaciones maternas generales del 8,8% (95% IC, 2,8% a 24,2%)[1].
Por otro lado, la mortalidad y complicaciones generales para el producto de la gestación continúan teniendo una carga importante. Algunas fuentes aseguran incluso una tasa mayor de complicaciones maternofetales que las reportadas en la literatura previa[1]. El metaanálisis mencionado previamente reporta una tasa de muerte fetal del 33,1% (95% IC, 25,1% a 41,2%) y un riesgo de complicaciones en los neonatos del 10,8% (95% IC, 4,2% a 25,2%). Además, se ha reportado que el 28% de los casos presentaron parto pretérmino y el 33,8% de los casos requirió parto por cesárea (IC 95%, 15,6% a 45%; IC 95%, 19,1% a 52,4%). Otras bibliografías estiman que el porcentaje de muertes fetales puede acercarse incluso del 16% al 33%[1]. Algunos de los desenlaces adversos fetales y neonatales secundarios al uso de CEC durante la gestación reportados en diferentes estudios son retardo del crecimiento intrauterino (5%), retraso del desarrollo fetal (14%), síndrome de dificultad respiratoria neonatal (33%) y lesión neurológica (2,6%)[2].
En cuanto a las muertes fetales, se ha reportado que los momentos quirúrgicos con mayor riesgo son las fases de enfriamiento y recalentamiento durante la CEC. Además, en las cirugías cardíacas en las cuales la conducta ha sido continuar con la gestación, reportan un mejor rendimiento de la perfusión pulsátil durante el bypass cardiopulmonar frente a la perfusión no pulsátil, lo cual optimiza la perfusión uteroplacentaria evitando la hipoxia y el sufrimiento fetal[1]. Otros mecanismos mediante los cuales el bypass cardiopulmonar puede afectar al feto incluyen: alteraciones de la cascada de la coagulación y componentes sanguíneos, liberación de sustancias vasoactivas por parte de los leucocitos, activación del complemento, embolismos aéreos, hipotermia e hipotensión; dichos mecanismos son capaces de generar los tres mecanismos fisiopatológicos principales asociados a desenlaces adversos fetales: Contracción uterina, hipoperfusión placentaria e hipoxia fetal[7].
Con el fin de brindar una adecuada perfusión útero placen- taria y garantizar protección fetal, las recomendaciones actuales sugieren: Presión de perfusión alta (> 70 mmHg), alto flujo (2,5 L/min/m2), flujo pulsátil, normotermia durante la CEC. Se ha recomendado además un valor de hematocrito materno > 28% para optimizar la transferencia de oxígeno, así como el manejo de gases en sangre según la estrategia alfa stat con el fin de evitar hipocapnia fetal y vasoconstricción uteroplacentaria[1],[6].
En cuanto al riesgo materno fetal según el trimestre gestacional, se ha reportado que la morbimortalidad materna es menor cuando el procedimiento quirúrgico se realiza durante las semanas 13 a 28, esto debido a que las intervenciones en el primer trimestre gestacional están asociadas a mayor mortalidad fetal y riesgo de malformaciones. Por el contrario, la Cirugía cardíaca en el embarazo tardío conlleva mayor riesgo materno pero mejores resultados en términos obstétricos y neonatales[5]. Por lo tanto, la cesárea emergente previa a la cirugía cardíaca debería ser considerada en pacientes con más de 28 semanas de gestación[6].
-
Conclusión
La enfermedad cardiovascular grave durante la gestación representa un riesgo potencial con alta probabilidad de comprometer los desenlaces maternos y fetales. A pesar de ser una entidad poco frecuente, existe la posibilidad de enfrentarse a esta durante la práctica anestésica. El papel del anestesiólogo en la disminución de la morbimortalidad materno fetal durante la cirugía cardiovascular es crucial, siendo capaz de apoyar en las medidas que preserven la salud materna y optimicen la perfusión útero placentaria, garantizando de esta manera la protección fetal.
No declaramos fuentes de financiación ni conflictos de interés en relación a este manuscrito.
Referencias
1. Alexis A, Origer P, Hacquebard JP, De Cannière D, Germay O, Vandenbossche JL, et al. Anesthetic Management of a Voluminous Left Atrial Myxoma Resection in a 19 Weeks Pregnant with Atypical Clinical Presentation. Case Rep Anesthesiol. 2019 Dec;2019:4181502. https://doi.org/10.1155/2019/4181502 PMID:31934456
2. John AS, Connolly HM, Schaff HV, Klarich K. Management of cardiac myxoma during pregnancy: a case series and review of the literature. Int J Cardiol. 2012 Mar;155(2):177–80. https://doi.org/10.1016/j.ijcard.2011.05.069 PMID:21715030
3. Traisrisilp K, Kanjanavanit R, Taksaudom N, Lorsomradee S. Huge cardiac myxoma in pregnancy. BMJ Case Rep. 2017 Jul;2017:bcr2017219624. https://doi.org/10.1136/bcr-2017-219624 PMID:28765487
4. Yuan SM. Cardiac myxoma in pregnancy: a comprehensive review. Rev Bras Cir Cardiovasc. 2015 Jul-Sep;30(3):386–94. https://doi.org/10.5935/1678-9741.20150012 PMID:26313731
5. Patel C, Akhtar H, Gupta S, Harky A. Pregnancy and cardiac interventions: what are the optimal management options? J Card Surg. 2020 Jul;35(7):1589–96. https://doi.org/10.1111/jocs.14637 PMID:32484993
6. Kapoor MC. Cardiopulmonary bypass in pregnancy. Ann Card Anaesth. 2014 Jan-Mar;17(1):33–9. https://doi.org/10.4103/0971-9784.124133 PMID:24401299
7. Liu Y, Han F, Zhuang J, Liu X, Chen J, Huang H, et al. Cardiac operation under cardiopulmonary bypass during pregnancy. J Cardiothorac Surg. 2020 May;15(1):92. https://doi.org/10.1186/s13019-020-01136-9 PMID:32404125

 ORCID
ORCID