Mario Concha Pinto1, Marcos Rattalino1
Recibido: 26-05-2022
Aceptado: 28-05-2022
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 4 pp. 484-491|https://doi.org/10.25237/revchilanestv5114061209
PDF|ePub|RIS
Perioperative fluid therapy in pediatric patients
Abstract
Fluid therapy in pediatric patients plays a fundamental role in perioperative anesthetic management. Planning of all surgical procedures must take into account the fluid therapy necessary to maintain both the basal metabolic needs and the losses de- rived from surgery. Generally, maintenance fluid therapy is performed with balanced hydro electrolytic solutions plus glucose (although the latter may not be necessary in most pediatric surgeries), and replacement fluid therapy with glucose-free solutions, with crystalloids being the most frequently used. Surgeries that present significant losses require a replacement fluid plan that allows maintaining an adequate intravascular volume, allowing an appropriate return and ventricular filling, as well as adequate tissue transport of oxygen. When necessary, transfusion of blood products should be aimed at reestablishing the necessary con- ditions to maintain homeostasis during the perioperative period.
Resumen
La terapia de aporte de fluidos en pediatría es una parte fundamental del manejo anestésico perioperatorio. La planificación de todo procedimiento quirúrgico debe considerar el aporte necesario para mantener tanto las necesidades metabólicas basales como las pérdidas derivadas de la cirugía. En general, la terapia de mantención se efectúa con soluciones hidroelectrolíticas balanceadas más glucosa (aunque en la mayoría de las cirugías pediátricas pudiese no ser necesario esto último), y la terapia de reposición con soluciones libres de glucosa, siendo los cristaloides los más frecuentemente utilizados. Cirugías que presentan pérdidas importantes requieren tener un plan de aporte que permita mantener un espacio intravascular adecuado y permita a su vez un adecuado retorno y llenado ventricular, así como un adecuado transporte de oxígeno tisular. Cuando sea necesario, la transfusión de hemoderivados debe estar dirigida a reestablecer las condiciones necesarias para mantener dicho balance y homeostasis durante todo el período perioperatorio.
-
Introducción
La mantención del correcto funcionamiento de los distintos parénquimas requiere de la adecuada mantención de la cantidad y composición de los fluidos corporales. A esto se opone el hecho de que todo procedimiento quirúrgico interferirá en distinto grado con este objetivo. Por este motivo, la planificación de todo procedimiento quirúrgico debe considerer el aportar los fluidos necesarios para satisfacer las necesidades metabólicas basales, así como también reponer las pérdidas que se van produciendo por efecto de la cirugía.
La reposición de volumen es un punto relevante de todo procedimiento anestésico. Tanto un déficit como un exceso de aporte han sido relacionados con el origen de morbilidad[1]-[4]. Resulta, por lo tanto, de gran importancia la adecuada planificación de la cantidad y tipos de fluidos a aportar.
-
Definición y reconocimiento del problema
Numerosos factores dificultan dicha planificación:
– La mayor parte de la información disponible proviene de estudios realizados en pacientes adultos y cuyos resultados se extrapolan a los pacientes pediátricos con todos los problemas que esto puede llevar.
– Existen diferencias determinadas por el sitio quirúrgico: no es lo mismo una laparotomía que una toracotomía o una craneotomía.
– Con frecuencia se confunde reposición con reanimación. Estos términos no son equivalentes, requiriendo criterios distintos; además, con frecuencia estas acciones pudieran estar realizándose simultáneamente. Para fines de esta revisión entenderemos como reposición la administración de fluidos para reemplazar las pérdidas que se producen habitualmente durante una cirugía. Entenderemos como reanimación la administración de fluidos que busca restablecer un adecuado aporte de oxígeno a los tejidos.
– Los métodos de verificación de la efectividad de la reposición y del estado del espacio intravascular son todos inespecíficos e imprecisos.
– Una serie de situaciones que sobrestimaban las pérdidas pueden llevar a la administración de cantidades de volumen muy importantes. Considerando que tanto el déficit como el exceso de aporte han demostrado asociarse a morbilidad, debemos tener un claro conocimiento de dónde se originan las necesidades y pérdidas durante un procedimiento quirúrgico.
Teniendo en mente estas consideraciones y problemas discutiremos brevemente algunos puntos que nos permiten realizar una planificación razonable del aporte de fluidos en el perioperatorio. Una excelente revisión al respecto se puede leer en una edición anterior de esta revista, por lo que la finalidad de este artículo es complementar dicha información[27].
-
Consideraciones preoperatorias
Clásicamente el ayuno ha tenido como finalidad reducir el riesgo de aspiración por regurgitación de contenido gástrico. Numerosas guías al respecto han sido publicadas, entregando recomendaciones relativamente estándar entre ellas. La tendencia actual es a reducir lo más posible (dentro de un intervalo de seguridad apropiado) las horas de ayuno del paciente pediátrico (Tabla1). Como recomendación general, el ayuno debe limitarse a lo sugerido en las guías, no debe despertarse a los niños para que coman a mitad de la noche ni tampoco debe ponerse una vía venosa previo a la cirugía. Solamente en aquellos pacientes en los cuales se estime que existe una pérdida anormal de volumen, éstas deben tratar de ser repuestas.
-
Consideraciones intraoperatorias
Los objetivos de la administración de volumen durante el intraoperatorio son:
• Administrar los fluidos necesarios para satisfacer los requerimientos metabólicos.
• Reponer las pérdidas que se producen durante el intraope- ratorio.
Existen numerosas fórmulas para determinar los requerimientos basales, siendo todas susceptibles de ser discutidas y revisadas. Por su facilidad de aplicación y por funcionar razonablemente bien para la mayor parte de los pacientes, la fórmula de Holliday y Segar (1957) sigue siendo probablemente la más utilizada (Tabla 2).
Tablal. Recomendaciones de ayuno en pacientes pediátricos
| País / Sociedad | Recomendación |
| ASA, 2017 | 2 h líquidos claros
4 h leche materna 6 h fórmula, comida liviana 8 h comida rica en grasas, carne y frituras |
| Sociedad Europea de Anestesia y Cuidado Intensivos, 2022 | 1 h líquidos claros
3 h leche materna 4 h fórmula, desayuno liviano 6 h cualquier otra comida sólida |
| Asociación Británica e Irlandesa de Anestesia Pediátrica, 2021 | 1 h líquidos claros pacientes hasta 16 años
4 h leche materna 6 h comida sólida, fórmula materna y otras leches |
| Sociedad Canadiense de Anestesia Pediátrica, 2019 – 2020 | 1 h líquidos claros
4 h leche materna 6 h comida liviana, fórmula materna y otras leches |
| Sociedad Alemana de Anestesiología y Cuidados Intensivos, 2004 | 2 h líquidos claros
4 h leche materna y fórmula 6 h alimentos sólidos |
| Sociedad Australiana y Neozelandesa de Anestesia, 2021 | 1 h líquidos claros (máximo 3 ml/kg/h)
3 h leche materna en < 6 meses 4 h fórmula en < 6 meses 6 h alimentos sólidos |
| Tabla 2. Requerimientos de mantención de fluidos (Holliday y Segar, 1957) | |
| Peso (kg) < 10 | Hora Día
4 ml/kg 100 ml/kg |
| 10 – 20 | 40 ml + 2 ml/kg por cada kg sobre los 10 kg 1000 ml + 50 ml/kg por cada kg sobre los 10 kg |
| > 20 | 60 ml + 1 ml/kg por cada kg sobre los 20 kg 1500 ml + 20 ml/kg por cada kg sobre los 20 kg |
Tabla 3. Soluciones frecuentemente utilizadas para la administración de volumen
| LEC | NaCI | Ringer | R. Lactato | SB + G1% | |
| Cationes (mmol/lt) | |||||
| Na+ | 142 | 154 | 147 | 130 | 140 |
| K+ | 4,5 | – | 4 | 5 | 4 |
| Ca2+ | 2,5 | – | 2,3 | 1 | 2 |
| Mg2+ | 1,25 | – | – | 1 | 2 |
| Aniones (mmol/lt) | |||||
| Cl- | 103 | 154 | 156 | 112 | 118 |
| HCO3- | 24 | – | – | – | – |
| Acetato | – | – | – | – | 30 |
| Lactato | 1,5 | – | – | 27 | – |
| Glucosa (mg/dl) | 50 – 90 | – | – | – | 1.000 |
| Osmolaridad teórica | |||||
| (mmol/lt) | 291 | 308 | 309 | 276 | 296 |
(Adaptado de Perioperative intravenous fluid therapy in children: guidelines from the Association of the Scientific Medical Societies in Germany. Robert Sumpelmann, Karin Becke et al. Pediatric Anesthesia 27 (2017) 10-18.) SB + G1%: Solución balanceada + glucosa al 1%.
Bajo la premisa que la utilización del agua es paralela al metabolismo energético, el metabolismo energético sigue al área de superficie y el área de superficie sigue al peso, estimaron el requerimiento de agua (de una manera no lineal) solo a partir del peso. Luego, los autores procedieron bajo una serie de suposiciones para extrapolar datos a una “relación entre el peso y el gasto de energía que podría recordarse fácilmente”.
Asumiendo que los requerimientos de energía de los “pacientes hospitalizados” están “aproximadamente a medio camino entre los niveles basales y normales”, se construyó una curva de requerimiento calórico versus peso. Tal curva podría verse como compuesta de tres secciones lineales: 0-10 kg, 1020 kg y > 20 kg[28].
Otra alternativa ampliamente difundida, principalmente por lo fácil de seguir en su recomendación, es la de la Sociedad Alemana de Anestesiología y Cuidados Intensivos. En ella se recomienda usar soluciones balanceadas con glucosa entre el 1% y 2,5% a una infusión de 10 ml/kg/h e ir ajustando según requerimientos[29].
Sin embargo, si nos regimos por las recomendaciones actuales de ayuno, en pacientes sanos y procedimientos de corta duración (menores a 1 hora), esto puede omitirse de la planificación de reposición. Para procedimientos prolongados puede programarse una infusión para satisfacer estos requerimientos, aún cuando muy probablemente estos requerimientos serán cubiertos al reponer las pérdidas.
-
¿Qué solución utilizar?
-
Requerimientos basales
Para los requerimientos basales, generalmente se han utilizado soluciones balanceadas sin glucosa (Tabla 3). Aún cuando el aporte de aporte de glucosa no es necesario en la mayor parte de los pacientes, existen condiciones específicas en las cuales existe riesgo de desarrollo de hipoglicemia, en la cual ésta debe ser administrada:
• Recién nacidos.
• Prematuros.
• P.E.G.
• Hijo de madre diabética.
• Cuadros hipercatabólicos.
• Uso de nutrición parenteral.
• Falla hepática.
De la misma manera, en situaciones de cirugías prolongadas, el uso de soluciones como ringer lactato con glucosa al 1%-2,5% ayuda a evitar la hipoglicemia (infusión de glucosa 120-300 mg/kg/h es suficiente para mantener euglicemia)[5].
En pacientes con riesgo de presentar hipoglicemia (como los recién nacidos), es recomendable medir glicemia regularmente y ajustar los requerimientos para una normoglicemia, ya que estos pacientes presentan riesgo de lipólisis y desarrollo de cetoacidosis. No se recomienda administrar soluciones con concentraciones altas de glucosa libre de electrolitos, ya que se puede desencadenar coma hiperosmolar hiperglicémico, entre otras complicaciones.
-
Reposición de pérdidas
La reposición de las pérdidas debe considerar:
a) No hemáticas.
b) Hemáticas.
a) No hemáticas. Son las más importantes en la gran mayoría de las cirugías, e incluyen la evaporación, diuresis, y la más importante, el paso de agua desde el intravascular al intersticio. El tipo de cirugía determinará la cantidad de agua que pasa desde el intravascular al intersticio, lo cual no es medible en la práctica clínica. Como ya se mencionó, en cirugía simple y superficial y con mínimas pérdidas como es la mayor parte de la cirugía pediátrica, este paso es escaso, en cuyo caso, si respetamos las recomendaciones de ayuno vigentes, podríamos no administrar volumen durante el intraoperatorio, y la vía venosa ser solo un elemento de seguridad para la administración de drogas frente a alguna situación inesperada. En cirugía intracavitaria, las consideraciones para realizar la planificación del aporte dependen de las pérdidas que se producen y de las características del sitio quirúrgico en relación a su capacidad para reintegrar al intravascular el líquido que pasa al intersticio. En este sentido no es lo mismo el abdomen, el pulmón o el cerebro. No hay manera de determinar las pérdidas por esta situación. Nos podemos aproximar a la cantidad de volumen a administrar (volumen a administrar, no pérdidas), utilizando los valores encontrados en estudios que evalúan morbilidad y aporte[2],[4], o volumen necesario para mantener llenado o débito cardíaco[6]. A partir de estos volúmenes a administrar se debe evaluar y ajustar frecuentemente los efectos de la reposición.
Existen otras consideraciones que se deben hacer al momento de la planificación de la administración de volumen que apuntan principalmente a evitar la sobrehidratación:
– Evaporación. Esta fue con mucha frecuencia muy sobreestimada, sabiéndose hoy que una laparotomía grande pierde por evaporación máximo 1 ml/kg/h[7].
– Ayuno. Este no debe ser repuesto. Los pacientes que hasta el día previo mantuvieron una ingesta normal, no presentan déficit del intravascular después de una noche sin tomar agua[8]. Como ya se ha mencionado, si se siguen las actuales recomendaciones, en las que el paciente puede recibir líquidos claro hasta muy cercano el momento de la cirugía, y aún cuando el ayuno se prolongue, no se requiere de aportes adicionales de fluidos.
– Tercer espacio. Este es un concepto generalmente mal entendido, utilizado frecuentemente para situar el volumen que no se encontraba en el intravascular, y que sabemos hoy está en el intersticio. A diferencia de lo que sucede con el tercer espacio, cuya existencia incluso es cuestionada, el intersticio es funcional, por lo tanto, el agua que se acumula allí también está disponible para retornar al intravascular. El no considerar esto llevará a sobrehidratar a los pacientes.
– Diuresis. Ha sido utilizada como un indicador de perfusión tisular. Desafortunadamente, el no considerar que la antidiuresis es la respuesta fisiológica frente al trauma quirúrgico puede llevar a aportar volumen innecesariamente buscando una respuesta diurética. Cuando durante la cirugía se producen situaciones que determinan la necesidad de aporte importante de volumen, la interpretación de diuresis se dificulta siendo difícil precisar si una oliguria corresponde a hipoperfusión o a la respuesta fisiológica normal.
A modo de ejemplo, en un paciente de 5 kg, se puede proponer el siguiente esquema (Tabla 4).
Las pérdidas deben ser reemplazadas con soluciones balanceadas, sin glucosa. No hay evidencias de la superioridad de usar cristaloides o coloides[10], y en la práctica generalmente se combinan ambos sin existir criterios establecidos para esto. La álbumina, frecuentemente, y sin evidencias suficientes ha sido considerada como la solución ideal de reposición, particularmente en los más pequeños. En estudios en adultos ha pasado desde asociarse a mayor mortalidad, a tener un resultado similar al suero fisiológico[11]-[16].
Los almidones pueden ser utilizados en pacientes pediátri- cos[17]. Su uso en pacientes adultos sépticos ha sido cuestionado por un mayor riesgo de falla renal y coagulopatía, sin embargo, en el contexto de pacientes en el perioperatorio existen evidencias que muestran la seguridad de su utilización[18]-[20].
Debe insistirse en la necesidad de reevaluación y ajuste frecuente de la respuesta al aporte, y que en caso de requerir restablecer condiciones hemodinámicas en forma rápida, el uso de bolos 10-20 ml/kg parecen adecuados.
b) Hemáticas. Son las más evidentes, pero no necesariamente las más importantes, debiendo ser consideradas en todo plan de reposición de volumen. Esto no significa que debe siempre aportarse glóbulos rojos (GR), sino que algún tipo de solución para normalizar el intravascular. De igual manera se debe estimar el volumen de sangrado o hematocrito (Hcto) que se aceptará antes de iniciar el aporte de GR, ajustado por la volemia del paciente y su condición (Tabla 5).
-
¿Cómo se estiman estos límites?
Existen fórmulas que permiten estimar el sangrado máximo permitido antes de iniciar el aporte de GR. Una manera fácil es calcular el 20% de volemia estimada si el Hcto es normal o menos si éste está disminuido. Ambas alternativas, si bien tienen importantes limitaciones, permiten orientarse. Actualmente, disponer de control de Hcto es un requisito mínimo para procedimientos en que se estiman pérdidas hemáticas importantes. El Hcto mínimo tolerable depende de factores como la edad y presencia de patología cardiopulmonar:
• RN: 35% – 40%.
• Lactante con patología cardiopulmonar: 32% – 35%.
• Niño sano: 25% – 20%.
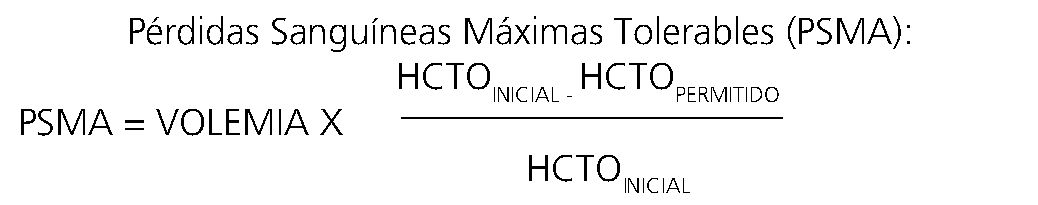
En caso de sangrado rápido de difícil control no se debe esperar estos valores para iniciar el aporte de glóbulos rojos.
Tabla 4. Paciente sano de 5 kg. Laparotomía
| ml/kg/h | ml/h | |
| Requerimientos basales | 4 | 20 |
| Paso al intersticio++ | 4-6 | 20-30 |
| Evaporación | 1* | 5 |
| Diuresis | 1 | 5 |
| Sangrado | ** | ** |
| Total | 9-10 | 45 – 50 |
* Menos aún en toracotomía o craneotomía.
** Requiere plan de reposición específico.
++ El valor asignado corresponde a la cantidad necesaria para mantener llenado ventricular o débito cardíaco.
-
¿Qué soluciones utilizar en caso de sangrado?
No existen evidencias que permitan decir si algún tipo de solución es mejor que la otra para reponer un sangrado[21]. En condiciones de normovolemia, los coloides permanecen por mayor tiempo en el intravascular, sin embargo, en las condiciones clínicas que hacen necesario aportar GR, existen numerosas condiciones que pueden alterar el glicocálix y modificar la permeabilidad y el comportamiento de las soluciones que se utilicen. Por esta razón, en la práctica clínica habitualmente se combinan ambas soluciones. En caso de requerir transfundir hemocomponentes, éstos deben ser ajustados por edad e indicación precisa (Tabla 6).
La administración de fluidos y de hemocomponentes, particularmente en situaciones de alto reemplazo o que presentan riesgo de llegar a una transfusión masiva, deben considerar:
a) Mantención de temperatura. Se deben tomar las mediada para prevenir la aparición de hipotermia:
• Control de la temperatura del pabellón.
• Calentar fluidos.
• Calentar y humidificar gases ventilatorios.
• Uso de frazada de aire caliente.
• Cubrir las zonas expuestas (cabeza).
b) Mantención o corrección de alteraciones metabólicas que puedan aparecer durante la cirugía (hipoglicemia, hipercal- cemia, hiperkalemia, acidosis). Estas pueden aparecer como resultado del procedimiento quirúrgico mismo, del recambio de volumen secundario al uso de transfusiones o por hipo- perfusión. Deben ser sospechadas y buscadas dirigidamente.
c) Prevención de coagulopatía. Esta se produce por dilución, consumo de factores de coagulación e hiperfibrinolisis, todo lo cual llevan a la aparición de una coagulopatía. Esto debe ser prevenido con la administración precoz de los factores que primero disminuyen, como son las plaquetas (0,10,3 unidades/kg) y fibrinógeno[22],[23]. Por no disponer de concentrados de fibrinógeno se utiliza crioprecipitado 0,1-0,3 unidades/kg. Debe tenerse presente que en estas condiciones por efecto del citrato presente en las unidades de glóbulos rojos, se puede producir hipocalcemia, que también afectará la coagulación y que debe ser corregida.
En situaciones en las cuales se producen pérdidas sanguí
Tabla 5. Volumen sanguíneo estimado por rango etario
| Intervalo de edad | Volemia |
| RN pretérmino | 90 – 95 ml/kg |
| RN término – 3 meses | 80 – 90 ml/kg |
| 3 meses – 2 años | 70 – 80 ml/kg |
| > 2 años | 70 ml/kg |
Tabla 6. Hemocomponentes y sus dosis
| Hemocomponente | Dosis |
| Globulos rojos | 10 – 20 ml/kg |
| Plasma fresco congelado | 10 – 20 ml/kg (en transfusión masiva) |
| Plaquetas | 1U cada 10 kg (aumenta 5.000/uL) |
| Crioprecipitado | 1U cada 10 kg o 5 ml/kg |
neas rápidas e importantes del intravascular, se debe iniciar reposición de volumen inmediatamente y en forma agresiva buscando restablecer parámetros hemodinámicos “aceptables” a la brevedad. La importancia de una rápida y efectiva reposición ha sido evidenciada hace ya tiempo[24],[25] y sigue siendo un concepto absolutamente válido. La mantención de condiciones de hipoperfusión determina daño tisular y mortalidad, por lo cual se deben restablecer condiciones adecuada entrega de oxígeno a la brevedad, siendo el primer paso de esto el asegurar un volumen intravascular que permita un adecuado llenado ventricular y débito cardíaco[24]-[26]. De no ser así se debe avanzar en el grado de monitorización y agregar otras medidas de soporte basadas en el análisis de la condición hemodinámi- ca del paciente[26]. La falta de respuesta al aporte de 60 ml/ kg en una hora, o menos si aparece algún tipo de signología congestiva, debe hacer considerar el agregar un inótropo y/o un vasoactivo.
A modo de ejemplo, es útil tener diseñado un plan de acción en caso de necesidad de reanimación, ajustado por las características del paciente y el tipo de cirugía. Aquí, en un paciente de 9 kg. que se someterá a una reparación de craneosinostosis: (ver recuadro).
-
Consideraciones posoperatorias
Como concepto general, en cirugías de corta duración y no complejas, se debe promover la ingesta oral tan pronto como sea posible y el paciente o sus cuidadores así lo expresen. Cuando ello no es posible, se debe considerar mantener una infusión basal sumado a las posibles pérdidas que puedan seguir presentándose en el posoperatorio. Esto último diferirá considerablemente dependiendo de la cirugía realizada y del transcurso de esta, así como de la necesidad de reposición específica sumado al control seriado de exámenes según necesidad.
-
Conclusiones
La reposición de fluidos en el paciente pediátrico es un acto que debe estar orientado a mantener la homeostasis de éste durante todo el perioperatorio. Para ello es fundamental planificar de manera individualizada, considerando el tipo de paciente al que nos enfrentamos, el tipo de cirugía, su duración y la eventual presencia de complicaciones. Es muy útil tener un esquema de manejo previamente diseñado. Como concepto general, la terapia de mantención se efectúa con soluciones hidroelectrolíticas balanceadas más glucosa (aunque en la mayoría de las cirugías pediátricas pudiese no ser necesario esto último), y la terapia de reposición con soluciones libres de glucosa, siendo los cristaloides los más frecuentemente utilizados. Cirugías que presentan pérdidas importantes requieren tener un plan de aporte que permita mantener un espacio intravascu- lar adecuado y permita a su vez un adecuado retorno y llenado ventricular, así como un adecuado transporte de oxígeno tisu- lar. La transfusión de hemoderivados, llegado el caso, debe ser orientada a reestablecer dicho balance, considerando riesgos y beneficios asociados, junto con una indicación precisa y fundamentada de la transfusión de cada hemocomponente. Es importante tener presenta que el objetivo principal siempre será indicar una adecuada y segura fluidoterapia en estos pacientes.
| Nombre | ||||
| Cirugía | Craneosinostosis | |||
| Edad (años) | 1 | |||
| Peso (Kg) | 9 | |||
| Hto inicial % | 36 | (aprox) | ||
| Tubo endotraqueal c/cuff (> 2 años) | 3,5 | Distancia tubo (cm) | 10,5 | |
| Volemia estimada (ml) | 630 | |||
| Sangrado permitido Hto 25% | 193 | **Sangrado activo | ||
| Sangrado permitido Hto 20% | 280 | **Sin sangrado activo | ||
| Hemoderivados | Rangos de dosis | Observaciones | ||
| Globulos rojos (ml) | 90 | 180 | ||
| Plaquetas (ml) | 45 | 90 | Mantener > 50.000 o 100.000 | |
| Plasma fresco congelado (ml) | 90 | 135 | 100-200 mg de fibrinogeno en 200 cc | |
| Crioprecipitado (U) y (ml) | 0,9 | 45 | *izq en U y der ml | 100-200 mg de fibrinogeno en 20 cc |
| Ac tranexanico bolo (mg) / infusión | 90 | 45 | Mantener inf 24 h | |
| (mg/k/h) | ||||
| PCR | ||||
| Epinefrina (ug) EV | 90 | |||
| Epinefrina (mg) ET | 0,9 | |||
| Atropina (ug) | 90 | 180 | ||
| Adenonsina (mg) | 0,9 | 1,8 | Max 6 a 12 mg | |
| Amiodarona (mg) | 45 | 135 | Max 300 mg | |
| Sulfato Mg (mg) | 225 | 450 | En 10 a 20 min | |
| Bicarbonato (g) | 0,75 | kg x 0,3 x BE | ||
| Bicarbonato (mEq) | 9 | (kg x 0.3 x BE) / 12 | ||
| Cardioversión (Joules) | 18 | 36 | ||
| Calcio (Cloruro) 10% (mg)/(ml)* | 180 | 1,8 | *Primera columna mg y segunda ml | |
| Calcio (Gluconato) 10% (mg)/(ml)* | 900 | 9 | *Primera columna mg y segunda ml | |
| DVA | ||||
| Fenilefrina (ug) | 4,5 | 9 | ||
| Efedrina (mg) | 0,9 | |||
| Norepinefrina (ug/k/min) | 0,45 | 4,5 | ||
| Epinefrina (ug/k/min) | 0,45 | 9 | ||
| Dopamina (ug/k/min) | 45 | 90 | ||
| Hipoglicemia | ||||
| Glucosa a reponer en hipoglicemia | 1.800 | |||
| (mg) | ||||
| Glucosa 30% (cc) (rapido) | 6,3 | 1 cc de Glu 30% = 300 mg | ||
| Glucosa 10% (cc) (rapido) | 18 | 1 cc de Glu 10% = 100 mg | ||
| Mantencion (mg/min) 4-6 mg/kg/min | 36 | 54 |
Fuente de financiamiento: Ninguna.
Conflicto de interés: Ninguno
Referencias
1. Mythen MG, Webb AR. Intra-operative gut mucosal hypoperfusion is associated with increased post-operative complications and cost. Intensive Care Med. 1994;20(2):99–104. https://doi.org/10.1007/BF01707662 PMID:8201106
2. Brandstrup B, Tønnesen H, Beier-Holgersen R, Hjortsø E, Ørding H, Lindorff-Larsen K, et al.; Danish Study Group on Perioperative Fluid Therapy. Effects of intravenous fluid restriction on postoperative complications: comparison of two perioperative fluid regimens: a randomized assessor-blinded multicenter trial. Ann Surg. 2003 Nov;238(5):641–8. https://doi.org/10.1097/01.sla.0000094387.50865.23 PMID:14578723
3. Lobo DN, Bostock KA, Neal KR, Perkins AC, Rowlands BJ, Allison SP. Effect of salt and water balance on recovery of gastrointestinal function after elective colonic resection: a randomised controlled trial. Lancet. 2002 May;359(9320):1812–8. https://doi.org/10.1016/S0140-6736(02)08711-1 PMID:12044376
4. Nisanevich V, Felsenstein I, Almogy G, Weissman C, Einav S, Matot I. Effect of intraoperative fluid management on outcome after intraabdominal surgery. Anesthesiology. 2005 Jul;103(1):25–32. https://doi.org/10.1097/00000542-200507000-00008 PMID:15983453
5. Dubois MC, Gouyet L, Murat I, Saint-Maurice C. L, Murat, I. Lactated Ringer with 1%dextrose: an apprropiatesolution for peri-operativefluid therapy in children. Paediatr Anaesth. 1992;2(2):99–104. https://doi.org/10.1111/j.1460-9592.1992.tb00183.x.
6. Concha MR, Mertz VF, Cortínez LI, González KA, Butte JM, López F, et al. The volume of lactated Ringer’s solution required to maintain preload and cardiac index during open and laparoscopic surgery. Anesth Analg. 2009 Feb;108(2):616–22. https://doi.org/10.1213/ane.0b013e3181923a38 PMID:19151298
7. Lamke LO, Nilsson GE, Reithner HL. Water loss by evaporation from the abdominal cavity during surgery. Acta Chir Scand. 1977;143(5):279–84. PMID:596094
8. Jacob M, Chappell D, Conzen P, Finsterer U, Rehm M. Blood volume is normal after pre-operative overnight fasting. Acta Anaesthesiol Scand. 2008 Apr;52(4):522–9. https://doi.org/10.1111/j.1399-6576.2008.01587.x PMID:18339157
9. Jacob M, Chappell D, Rehm M. The ‘third space’—fact or fiction? Baillieres Best Pract Res Clin Anaesthesiol. 2009 Jun;23(2):145–57. https://doi.org/10.1016/j.bpa.2009.05.001 PMID:19653435
10. Sümpelmann R, Becke K, Brenner S, Breschan C, Eich C, Höhne C, et al. Perioperative intravenous fluid therapy in children: guidelines from the Association of the Scientific Medical Societies in Germany. Paediatr Anaesth. 2017 Jan;27(1):10–8. https://doi.org/10.1111/pan.13007 PMID:27747968
11. Alderson P, Bunn F, Lefebvre C, Li WP, Li L, Roberts I, et al. Human albumin solution for resuscitation and volume expansion in critically ill patients. Cochrane Database Syst Rev. 2002;(1):CD001208. PMID:11869596
12. Alderson P, Schierhout G, Roberts I, Bunn F. Colloids versus crystalloids for fluid resuscitation in critically ill patients. Cochrane Database Syst Rev. 2000;(2):CD000567. PMID:10796729
13. Bunn F, Lefebvre C, Li Wan Po A, Li L, Roberts I, Schierhout G. Human albumin solution for resuscitation and volume expansion in critically ill patients. The Albumin Reviewers. Cochrane Database Syst Rev. 2000;(2):CD001208. PMID:10796756
14. Alderson P, Bunn F, Lefebvre C, Li WP, Li L, Roberts I, et al.; Albumin Reviewers. Human albumin solution for resuscitation and volume expansion in critically ill patients. Cochrane Database Syst Rev. 2004 Oct;(4):CD001208. PMID:15495011
15. Finfer S, Bellomo R, Boyce N, French J, Myburgh J, Norton R; SAFE Study Investigators. A comparison of albumin and saline for fluid resuscitation in the intensive care unit. N Engl J Med. 2004 May;350(22):2247–56. https://doi.org/10.1056/NEJMoa040232 PMID:15163774
16. Myburgh J, Cooper DJ, Finfer S, Bellomo R, Norton R, Bishop N, et al.; George Institute for International Health. Saline or albumin for fluid resuscitation in patients with traumatic brain injury. N Engl J Med. 2007 Aug;357(9):874–84. https://doi.org/10.1056/NEJMoa067514 PMID:17761591
17. Bailey AG, McNaull PP, Jooste E, Tuchman JB. Perioperative crystalloid and colloid fluid management in children: where are we and how did we get here? Anesth Analg. 2010 Feb;110(2):375–90. https://doi.org/10.1213/ANE.0b013e3181b6b3b5 PMID:19955503
18. Van Der Linden P, James M, Mythen M, Weiskopf RB. Safety of modern starches used during surgery. Anesth Analg. 2013 Jan;116(1):35–48. https://doi.org/10.1213/ANE.0b013e31827175da PMID:23115254
19. Bagshaw SM, Chawla LS. Hydroxyethyl starch for fluid resuscitation in critically ill patients. Can J Anaesth. 2013 Jul;60(7):709–13. https://doi.org/10.1007/s12630-013-9936-4 PMID:23604905
20. Zhou ZB, Shao XX, Yang XY, Zhang T, Xian DF, Huang CY, et al. Influence of Hydroxyethyl Starch on Renal Function After Orthotopic Liver Transplantation. Transplant Proc. 2015 Jul-Aug;47(6):1616–9. https://doi.org/10.1016/j.transproceed.2015.04.095 PMID:26293023
21. Chappell D, Jacob M. Role of the glycocalyx in fluid management: small things matter. Best Pract Res Clin Anaesthesiol. 2014 Sep;28(3):227–34. https://doi.org/10.1016/j.bpa.2014.06.003 PMID:25208958
22. Karam O, Tucci M. Massive Transfusion in Children. Transfus Med Rev. 2016 Oct;30(4):213–6. https://doi.org/10.1016/j.tmrv.2016.05.010 PMID:27287298
23. Maw G, Furyk C. Pediatric Massive Transfusion: A Systematic Review. Pediatr Emerg Care. 2018 Aug;34(8):594–8. https://doi.org/10.1097/PEC.0000000000001570 PMID:30080793
24. Carcillo JA, Davis AL, Zaritsky A. Role of early fluid resuscitation in pediatric septic shock. JAMA. 1991 Sep;266(9):1242–5. https://doi.org/10.1001/jama.1991.03470090076035 PMID:1870250
25. Han YY, Carcillo JA, Dragotta MA, Bills DM, Watson RS, Westerman ME, et al. Early reversal of pediatric-neonatal septic shock by community physicians is associated with improved outcome. Pediatrics. 2003 Oct;112(4):793–9. https://doi.org/10.1542/peds.112.4.793 PMID:14523168
26. Davis AL, Carcillo JA, Aneja RK, Deymann AJ, Lin JC, Nguyen TC, et al. American College of Critical Care Medicine Clinical Practice Parameters for Hemodynamic Support of Pediatric and Neonatal Septic Shock. Crit Care Med. 2017 Jun;45(6):1061–93. https://doi.org/10.1097/CCM.0000000000002425 PMID:28509730
27. Priscilla Ulloa V., Valeria Epulef. Fluidoterapia perioperatoria en el paciente pediátrico. Revista Chilena de Anestesia Vol. 51 Núm. 2 pp. 168-174|https://doi.org/10.25237/revchilanestv5104021443..
28. Holliday MA, Segar WE. The maintenance need for water in parenteral fluid therapy. Pediatrics. 1957 May;19(5):823–32. https://doi.org/10.1542/peds.19.5.823 PMID:13431307
29. Perioperative intravenous fluid therapy in children: guidelines from the Association of the Scientific Medical Societies in Germany. Robert Sumpelmann, Karin Becke et al. Pediatric Anesthesia 27 (2017) 10–18.

 ORCID
ORCID